《仪器分析实验》讲义

实验一酸度计主要性能的检验及溶液pH的电位测定
一、实验目的
1、掌握溶液pH值电位测定法的原理和实验方法;
2、学会使用酸度计和主要性能的检验。
二、方法原理
溶液的p H值是溶液中H+离子浓度或酸碱性的一种表示方法。
pH值电位测定的电池组成:指示电极| 试液|| 参比电极
指示电极:pH玻璃电极
参比电极:饱和甘汞电极(SCE)
电池电动势:E=K + 0.059V p H(25℃)
式中K在一定条件下为常数(与参比电极电位、不对称电位等有关)。因此,只要难确测定E电池的电位,即可测得溶液的p H值。
因为常数项K值难于准确知道,所以只能利用已知准确pH值的标准缓冲溶液,对仪器进行定位,校准校正曲线的截距。然后可以在电表的度盘上直接读出pH的数值来。
酸度计适用于工矿企业、农业医药、环保等单位取样测定水溶液的酸度(pH值)和测量电极电位(mV值)。如配上适当的离子选择电极、则可以作为电位滴定分析的终点显示器。所以评价和检验其质量的高低,熟练掌握其使用方法显得尤为重要。
本实验从外观和示值准确性和示值重现性的主要性能对其进行检验并对未知溶液进行pH的直接电位法测定。
示值准确性以基本误差表示,仪器用标准缓冲溶液校准后,在测量与标准溶液的pHs相差约3pH单位的另一标准缓冲溶液,所得示值与同一温度下的标准值(pHs)之差,称为基本误差。
仪器示值重现性的检定,先用标准缓冲溶液校准仪器,再测量另一种标准缓冲溶液。如此重复五次。五次测量间的最大差值,为重复性误差。
三、仪器与试剂
1、仪器:pHS-3C 酸度计、pH玻璃电极、饱和甘汞电极(SCE)、温度计
2、试剂:缓冲溶液的配制方法:
(1)酸性缓冲溶液甲:0.05 mol.L-1邻苯二甲酸氢钾
将KHC8H4O4(A.R)晶体在115±5℃下烘干2-3小时,取出放在干燥器内冷却45分钟左右。称取1.021g,溶于去离子水中,在容量瓶中稀释至100mL。
(2) 中性缓冲溶液乙(0.025 mol.L-1磷酸二氢钾,0.025 mol.L-1磷酸氢二钠):
将分析纯试剂在115±5℃下烘干2-3小时,(温度不能太高,避免生成缩合磷酸盐),取
出放在干燥器内冷却45分钟左右。称取KH2PO4 0.340g、Na2HPO4.10H2O 0.895g,溶于(除去CO2)重蒸馏水中,在容量瓶稀释至100mL。
(3) 碱性缓冲溶液丙(0.01 mol.L-1硼砂),
称取0.381克分析纯Na2B4O5 (OH)48H2O溶于(除去CO2)重蒸馏水中,在容量瓶中稀释至100mL(注意:硼砂不能烘干,称量前,试剂应放在以蔗糖和NaCI饱和溶液为干燥剂的保干器中平衡数天,使其组成恒定)。
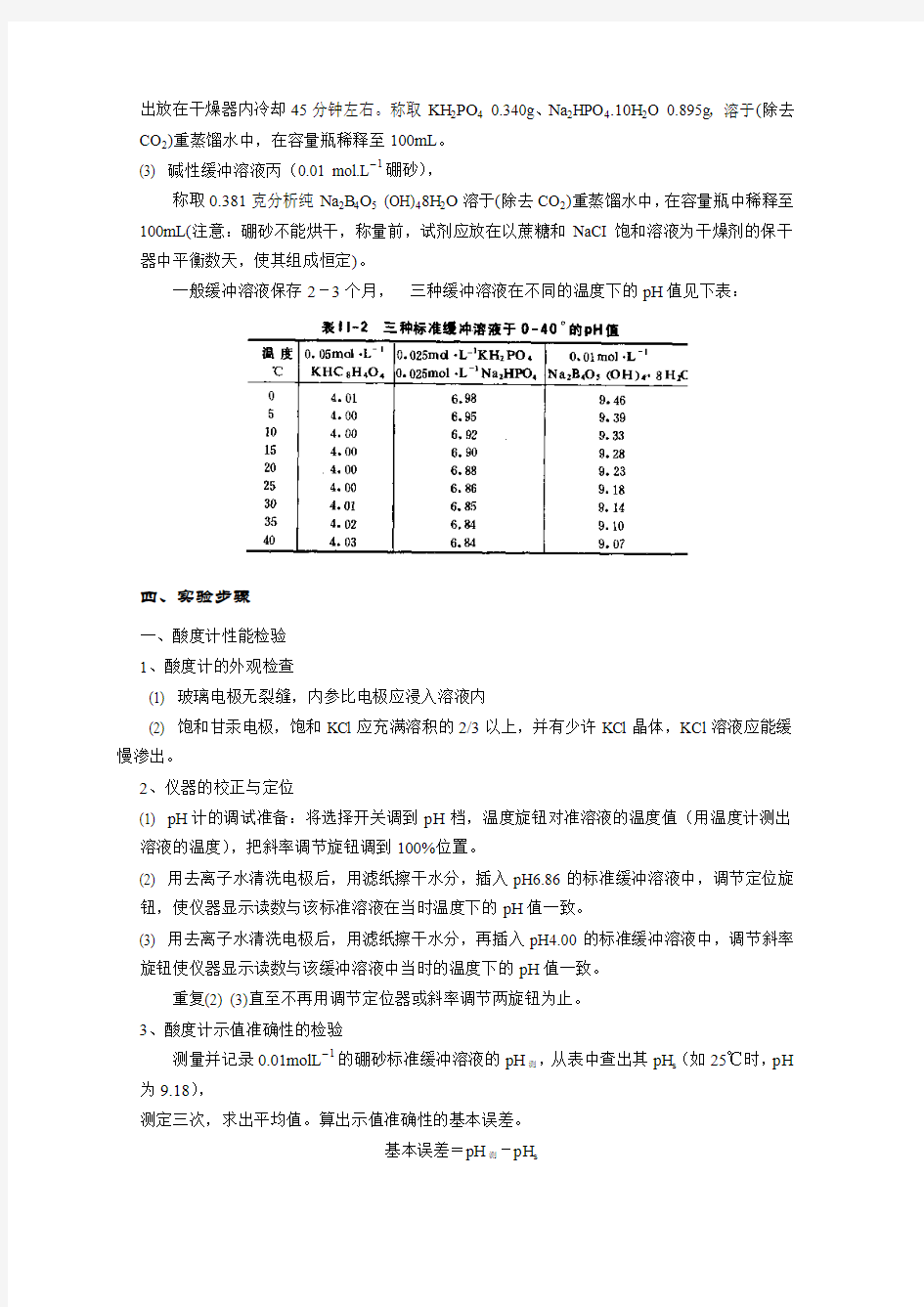
一般缓冲溶液保存2-3个月,三种缓冲溶液在不同的温度下的pH值见下表:
四、实验步骤
一、酸度计性能检验
1、酸度计的外观检查
(1) 玻璃电极无裂缝,内参比电极应浸入溶液内
(2) 饱和甘汞电极,饱和KCl应充满溶积的2/3以上,并有少许KCl晶体,KCl溶液应能缓慢渗出。
2、仪器的校正与定位
(1) pH计的调试准备:将选择开关调到pH档,温度旋钮对准溶液的温度值(用温度计测出
溶液的温度),把斜率调节旋钮调到100%位置。
(2) 用去离子水清洗电极后,用滤纸擦干水分,插入pH6.86的标准缓冲溶液中,调节定位旋
钮,使仪器显示读数与该标准溶液在当时温度下的pH值一致。
(3) 用去离子水清洗电极后,用滤纸擦干水分,再插入pH4.00的标准缓冲溶液中,调节斜率
旋钮使仪器显示读数与该缓冲溶液中当时的温度下的pH值一致。
重复(2) (3)直至不再用调节定位器或斜率调节两旋钮为止。
3、酸度计示值准确性的检验
,从表中查出其pH s(如25℃时,pH 测量并记录0.01molL-1的硼砂标准缓冲溶液的pH
测
为9.18),
测定三次,求出平均值。算出示值准确性的基本误差。
基本误差=pH
-pH s
测
4、仪器示值重现性的检定
(1) 用pH4.00的标准缓冲溶液校准仪器后,测量并记录pH6.86的标准缓冲溶液,如此重复五次
(2) 五次测量值间的最大差值,为重复性误差。
3、酸度计表示值准确性的检定
二、未知溶液pH值测的量:
用pH试纸初测出试液的pH,选用适当的pH标准缓冲溶液定位,测出未知溶液的pH。
五、数据处理
1、基本误差=pH测-pH s。
2、重复性误差
3、未知溶液的pH
要求用表格的形式列出原始数据和计算结果(自己设计表格)
注:请查阅复合电极的使用方法。
实验二 饮用水中氟含量的测定(氟离子选择性电极)
一、实验目的
1、巩固离子选择性电极的理论,了解氟选择性电极的构造及测定氟浓度的原理和基本方法;
2、学会电池的安装,使用pH 计测量电动势的方法;
3、了解氟选择性电极测定氟浓度的条件。
二、方法原理
氟是人体必须的微量元素,摄入适量的氟有利于牙齿的健康,但摄入过量的氟对人体有害,轻则造成斑釉牙,重者会引起氟中毒,造成氟胃症。在饮用水中比较适宜的含量范围为0.5~1mg.L -1。饮用水中痕量氟的测定可采用蒸馏比色法和氟离子选择性电极法,前者费时,后者简便快速。
氟离子选择性电极是目前最成熟的一种离子选择性电极,是一种典型的单晶膜电极,其敏感膜由掺入微量氟化铕(增加导电性)的LaF 3单晶片制成,构造见下图,将膜封在塑料电极管的一端,管内装0.1 mol.L -1的NaCl 和0.1 mol.L -1NaF 溶液作内参比溶液,其中插入Ag -AgCl 丝作内参比电极,膜中传递电荷的离子是F -,所以响应的离子是F -。
测定水样时,以氟离子选择性电极为指示电极,以饱和甘汞电极为参比电极,组成的测量电池为:氟离子选择性电极│试液‖SCE φF =φ
Ag -AgC +K -
F a F
RT
lg 303.2 电池电动势E 电池=φSCE
-φAg -AgC -K +
F a F
RT
lg 303.2 令K ’= φ
SCE
-φAg -AgC -K
E 电池=K ’+
F a F
RT
lg 303.2 25℃时,E 电池=K ’+0.0592 lg a F (或E 电池=K ’-0.0592 p F )
即在一定的条件下,电池电动势E 电池与溶液中的F -
活度的对数呈直线关系,这就是应用氟离子选择性电极直接电位法定量分析F -的理论依据,其线性范围一般在5×10-7~1×10-1 mol.L -1。
氟离子选择性电极具有较好的选择性,常见阴离子NO 3-
、SO 42-、PO 43-
、AC -、X -
、HCO 3-
等不干扰,主要的干扰离子是OH -
,干扰的原因是在膜表面发生如下反应:
LaF 3+3OH -=La(OH)3+3F -
测定时,适宜的pH 范围是5~6,pH 低时,F -生成HF 而产生负误差;pH 高时,由于上述
反应而产生正误差。
氟离子选择性电极响应的是溶液中离子的活度,因此必须控制试液和标准溶液的离子强度相同,实验中加入总离子强度调节缓冲剂(Total ion strength adjustment buffer, TISAB),其目的就在于控制溶液的pH、消除阳离子干扰和控制离子强度使γi恒定,从而可用c i 代替a i。
三、仪器与试剂
1、仪器:离子计或pH计,氟离子选择性电极,饱和甘汞电极、电磁搅拌器(具聚乙烯或聚四氟乙烯包裹的搅拌子),容量瓶(比色管)50mL,聚乙烯塑料烧杯100mL。
2、试剂:用去离子水配制下列试剂,且都使用聚乙烯塑料瓶装。
(1) F-标准储备溶液(100μg/mL):称取分析纯NaF(120℃烘干1h)0.2210 g溶于适量去离子水中,转入1000mL容量瓶中,稀释至标线,摇匀,立即转入干燥洁净的聚乙烯塑料瓶中。(由教师配好)。
(2) F-标准溶液(10μg/mL):取F-标准储备溶液10mL于100mL容量瓶中,稀释至标线,摇匀。
(2)总离子强度调节缓冲剂(TISAB)
0.2mol/L柠檬酸钠-1mol/L硝酸钠:
称取58.8g分析纯的二水合柠檬酸钠和85g硝酸钠,加水溶解,用HCl调节pH=5~6,转入1000mL容量瓶中,稀释至标线,摇匀。存放于冰箱内可保存两个月。(由教师配好)
(3)2mol/LHCl溶液
(4) 乙酸钠溶液:称取15g乙酸钠溶于水,并稀释到100mL。
四、实验步骤
1、标准曲线法:
(1)标准曲线的制作:分别移取1.0、3.0、5.0、10.0、20.0mL F-标准溶液(10μg/mL),置于50mL比色管或容量瓶中,加入10mL TISAB溶液,用水稀释至标线,摇匀。分别移入100mL聚乙烯塑料烧杯中,各放入一支塑料搅拌子,以浓度由低到高的顺序分别依次插入电极,连续搅拌溶液约8mins,待电位稳定后,在继续搅拌下读取电位值(E)。(注:在每次测量之后,都要用水将电极冲洗干净,并用滤纸吸去水份。)
(2) 测定:用移液体管移取自来水样25.0 mL置于50mL比色管或容量瓶中,用乙酸钠或2mol/LHCl溶液调节近中性,加入10mL TISAB溶液,用水稀释至标线,摇匀。按上述方法测定电位值。
(3) 空白实验:
用去离子水代替水样,按照方法测定E
2、一次标准加入法:
当样品组成复杂或成份不明时,可采用一次标准加入法,以减少基体的影响。
方法:a、先测体积为V x待测液的电动势
b、于试液中加入待测离子标准溶液,体积为V s(约 1%V x )、浓度为Cs ( 约100c x )
/
两式处理后得到
△E=E s+x-E x S为电极的响应斜率。
五、数据处理
1、数据记录
2、分析结果报告:自来水试样中F-浓度为、测定次数、相对偏差。
3、注意事项
(1)标准工作曲线有时斜率会发生变化,所以在分析样品的同时制作标准工作曲线。(2)必须依次按氟含量由稀到浓的顺序测定mV值,每次测量后应用滤纸吸干电极。(3)测定前,氟电极必须先用去离子水浸泡2-2.5小时以上,实验完毕后将电极洗干净,在去离子水中搅拌浸泡10min,用滤纸吸干水分后干燥保存。
六、问题讨论
用氟离子选择性电极法测定自来水中氟的含量,加入TISAB的作用是什么?
实验三分光光度法测定络合物的络合比
一、实验目的:
1、掌握分光光度法测定配合物配合比的原理及方法。
2、进一步熟练分光光度计的使用。
二、实验原理:
在一定条件下,假设金属离子M和络合剂L发生显色反应:
M+n L=M L n(略去离子电荷)
可应用光度法测定络合比n,常用方法的方法有摩尔比法和等摩尔连续变化法。本实验主要应用摩尔比法测定。该方法是固定金属离子的浓度c M,改变络合剂的浓度c L,配制一系列c L/c M不同的显色溶液。在络合物的λmax处,采用相同的比色皿测量各溶液的吸光度,并以A-c L/c M作图,由曲线的转折点可以求出络合物的络合比n。(具体原理参见分析化学理论教材p296页)。
A
n c L/c M
此方法适用于解离度小,络合比高的络合物组成的测定。
三、仪器与试剂
1、仪器:72型(或721型)分光光度计,
50mL容量瓶(或比色管),移液管1mL2支、吸量管5mL2支,250mL烧杯2、试剂:
(1) HCl 6 mol.L-1,100 mL
(2) 铁标准溶液10-3mol.L-1(0.5 mol.L-1HCl):
准确称取0.4822g NH4Fe(SO4).12H2O于250mL烧杯中,加入80 mL6 mol.L-1 HCl和少量的水,溶解后定量转移到1L容量瓶中,稀释到刻度,摇匀。
(3) 邻二氮菲(Mr=180.2,熔点93℃),10-3mol.L-1水溶液:准确称取0.1802g,溶于1L
水。
(4) 盐酸羟胺:10%水溶液(新鲜配制)
(5) NaAc 1 mol.L-1(200 mL)
[注]也可用Fe3+与SSA(磺基水杨酸)在pH<2.4条件下生成紫色配合物,在最大波长500nm处测定。所用试剂:高氯酸(10-2 mol.L-1); 铁标准溶液10-2mol.L-1:用2mL高氯酸溶解。SSA:磺基水杨酸0.2542g于100mL水中定容。
四、实验步骤
1、摩尔比法测定络合比的溶液配制
按下表,由上至下加入试剂,在50mL容量瓶中(或比色管)配制显色溶液。
2、用1cm的比色皿,以各自相应的空白溶液(不加铁溶液)为参比溶液,在波长510nm处测定各溶液的吸光度。
五、数据处理
1、数据记录
2、以吸光度A为纵坐标,c L/c M为横坐标作图,根据曲线确定络合物的络合比n。
六、问题讨论:
1、为了使仪器测量引起的误差最小,应使吸光度值在0.15~0.80范围。如果不在该范围,可采取什么措施使吸光度值在0.15~0.80范围?
实验四 实验课题 分光光度法测定酸碱指示剂的pK a
一、实验目的
1、掌握分光光度法在测定指示剂离解常数的应用和实验方法;
2、掌握不同pH 值的缓冲溶液的配制方法。
3、进一步熟悉和掌握分光光度计的构造和操作方法。 二、方法原理
酸碱指示剂是最适宜用分光光度法来进行研究的对象,由于很多指示剂在水中的溶解度很小,用电位法测定离解常数有困难,而它在紫外-可见区常常有很好的吸收光谱,所以用光度法研究是很方便的。
酸碱指示剂HIn 本身是弱酸,它的平衡式如下:HIn =H ++In -,其p K a 与p H 的关系为:
]
[]
[lg
In HIn pH pK a +=,参看分析化学理论教材p298 公式(10-12) A
A A A pH pK HIn In
a --=lg
+
即为分光光度法测定指示剂离解常数的关系式。式中,A HIn 为强酸介质中的吸光度,A In 为强碱介质中的吸光度,pH >p K a +2,A 为中间pH (可由酸度计测得)值介质中的吸光度。它们均可由实验测得。由上式求p K a 的方法:
1、计算法:从以上公式可求得一系列不同pH 的p K a ,取平均值即可得到指示剂的p K a
2、作图法:(1)A -pH 曲线
A HIn
2
In
HIn A A +
A In
p K a pH 图2 A -pH 曲线
由公式A
A A A pH pK HIn In a
--=lg +可知,当A A A A HIn In --lg =0时,p K a =pH ,在此情况下,
A
A A A HIn In
--=1即
2
In
HIn A A A +=
,据此以溶液的pH 为横坐标,相应的吸光度为纵坐标得到A -pH 曲线,在曲线上与
2
In
HIn A A +对应的pH 即为p K a 值如图所示。 (2)]
[]
[lg
In HIn -pH 曲线 以溶液的pH 为横坐标,以相应的A A A A HIn In --lg 为纵坐标得一直线,在A A A A HIn In --lg =0处,pH
=p K a 。
待测样品可选用:甲基橙(理论p K a =3.4)
溴百里酚蓝(理论p K a =7.3)等。
三、仪器与试剂
1、仪器:紫外-可见分光光度计(721G 型分光光度或其它)
50mL 容量瓶; 1.00mL 、2.00mL 、5mL 、10mL 移液管或吸量管。 2、试剂: (1) 1×10-4mol.L -1的甲基橙溶液:称取32.7m g 甲基橙溶解稀释至1L 。 (2) 2.5 mol.L -1的KCl 溶液 (3) 缓冲溶液: 配制方法一:
a 、氯乙酸-氯乙酸钠(氯乙酸p K a =2.86):总浓度0.5 mol.L -1,pH 分别为2.1、2.4、2.7、3.0、3.5
b 、醋酸-醋酸钠(醋酸pKa =4.74):总浓度0.5 mol.L -1,pH 分别为4.0、4.5、6.0。 可用0.5 mol.L -1醋酸和0.5 mol.L -1醋酸钠按不同的比例配制。 配制方法二:磷酸氢二钠-柠檬酸缓冲溶液
方法:A 、0.1 mol.L -1磷酸氢二钠:35.6g Na 2HPO 4.2H 2O /升
B 、0.1 mol.L -1柠檬酸:21.0g
C 6H 8O 7.H 2O /升
四、实验步骤
1、取50mL比色管8个,分别按下表加入各试剂,用水稀释到刻度,摇匀,用pH计或精密pH试纸求出各份溶液的pH。
2、以水为参比,1cm玻璃比色皿,选用最大和最小pH的溶液在400nm~620nm(每隔10nm 测一次)绘制吸收曲线求出最大吸收波长λIn、λHIn。
3、在510 nm (λHIn) 处测定各份溶液的A。(或在λIn、λHin处可测得两个吸光度,求出两个p K a取平均值即可
五、数据处理
1、数据记录形式:按上表格式记录。
2、绘制A-pH曲线,或采用计算方法求出p K a,与标准值比较。
问题讨论:
1、如何配制总浓度为一定值的各种不同pH缓冲溶液?
2、为了使仪器测量引起的误差最小,应使吸光度值在0.15~0.80范围。如果不在该范围,可采取什么措施使吸光度值在0.15~0.80范围?
注:请查阅722或722—S看见分光光度计的使用说明。
仪器分析课程教学大纲
《仪器分析》课程教学大纲 课程编号:190142110 课程类型:必修课 英文名称:Instrumental Analysis 课程类型:基础方向课 学时:64学时讲课学时:60学时 学分:4学分 适用对象:环境科学专业、化学专业 先修课程:无机化学、分析化学、有机化学、高等数学、计算机 执笔人:刁春鹏审定人:张金萍 一、课程的性质、目的与任务以及对先开课要求 仪器分析是化学学科的一个重要分支,它是以物质的物理和物理化学性质为基础建立起来的一种分析方法。利用较特殊的仪器,对物质进行定性分析,定量分析,形态分析及结构分析。它具有测定快速、灵敏、准确和自动化程度高等特点,它是分析化学的发展方向。 仪器分析是化学专业必修的基础课程之一。仪器分析的主要任务是介绍常用的主要仪器分析方法,介绍这些分析方法的基本原理、基本概念和典型仪器的结构与性质,利用这些仪器完成定性、定量、定结构的分析任务,为今后开展科学研究和更好的指导工农业生产打下牢固的基础。 仪器分析是建立在无机化学、分析化学、有机化学、高等数学、物理学及计算机基础上的后续课程,它为后续课和今后的科研工作打下扎实的理论基础和操作技能。它是许多学科进行科学研究不可缺少的重要测试手段,并在提高人才素质和实现现代化的进程中,发挥着越来越重要的作用。 二、教学重点与难点 本课程重点介绍光谱、电化学和色谱三大块和质谱法的内容。 掌握常用仪器分析方法的基本原理、基本知识和基本技能。如:紫外-可见吸收光谱法,红外吸收光谱法,分子发光分析法,原子发射光谱法原子吸收光谱法,电位分析法,极谱分析法,色谱分析法,核磁共振波谱法和质谱分析法等。 了解仪器的结构及常用仪器的主要组成部分,学会使用一些仪器。 要求学生初步具有根据分析的目的、要求和各种仪器分析方法的特点、应用范围,选择适宜的分析方法以解决分析化学问题的能力。了解一些仪器分析方法和技能在实际中的应用,为后续课的学习及今后科学研究打下一定的基础。 三、与其他课程关系 仪器分析是建立在无机化学、分析化学、有机化学、高等数学、物理学及计算机基础上的后续课程,用到先修课的一些基础知识。 四、教学内容、学时分配及基本要求 第1章绪论 学时:2
仪器分析实验试题及答案1
一、填空题 1、液相色谱中常使用甲醇、乙腈和四氢呋喃作为流动相,这三种溶剂在反相液相色谱中的洗脱能力大小顺序为甲醇<乙腈<四氢呋喃。 2、库仑分析法的基本依据是法拉第电解定律。 3、气相色谱实验中,当柱温增大时,溶质的保留时间将减小;当载气的流速增大时,溶质的保留时间将减小。 二、选择题、 1、、色谱法分离混合物的可能性决定于试样混合物在固定相中___D___的差别。 A. 沸点差 B. 温度差 C. 吸光度 D. 分配系数。 2、气相色谱选择固定液时,一般根据___C__原则。 A. 沸点高低 B. 熔点高低 C. 相似相溶 D. 化学稳定性。 3、在气相色谱法中,若使用非极性固定相SE-30分离乙烷、环己烷和甲苯混合物时,它们的流出顺序为(C ) A. 环己烷、乙烷、甲苯; B. 甲苯、环己烷、乙烷; C. 乙烷、环己烷、甲苯; D. 乙烷、甲苯、环己烷 4、使用反相高效液相色谱法分离葛根素、对羟基苯甲醛和联苯的混合物时,它们的流出顺序为(A ) A. 葛根素、对羟基苯甲醛、联苯; B. 葛根素、联苯、对羟基苯甲醛; C. 对羟基苯甲醛、葛根素、联苯; D. 联苯、葛根素、对羟基苯甲醛 5、库仑滴定法滴定终点的判断方式为(B ) A. 指示剂变色法; B. 电位法; C. 电流法 D. 都可以 三、判断题 1、液相色谱的流动相又称为淋洗液,改变淋洗液的组成、极性可显著改变组分的分离效果。(√) 2、电位滴定测定食醋含量实验中电位突越点与使用酸碱滴定法指示剂的变色点不一致(×) 四、简答题 1、气相色谱有哪几种定量分析方法? 答:气相色谱一般有如下定量分析方法:内标法、外标法、归一法、标准曲线法、标准加入法。 2、归一化法在什么情况下才能应用?
偏振光实验报告
实 验 报 告 学生姓名: 学 号: 指导教师: 实验地点: 实验时间: 一、实验室名称:偏振光实验室 二、实验项目名称:偏振光实验 三、实验学时: 四、实验原理: 光波的振动方向与光波的传播方向垂直。自然光的振动在垂直与其传播方向的平面内,取所有可能的方向;某一方向振动占优势的光叫部分偏振光;只在某一个固定方向振动的光线叫线偏振光或平面偏振光。将非偏振光(如自然光)变成线偏振光的方法称为起偏,用以起偏的装置或元件叫起偏器。 (一)线偏振光的产生 1.非金属表面的反射和折射 光线斜射向非金属的光滑平面(如水、木头、玻璃等)时,反射光和折射光都会产生偏振现象,偏振的程度取决于光的入射角及反射物质的性质。当入射角是某一数值而反射光为线偏振光时,该入射角叫起偏角。起偏角的数值α与反射物质的折射率n 的关系是: n =αtan (1) 称为布如斯特定律,如图1所示。根据此式,可以简单地利用玻璃起偏,也可以用于测定物质的折射率。从空气入射到介质,一般起偏角在53度到58度之间。 非金属表面发射的线偏振光的振动方向总是垂直于入射面的;透射光是部分偏振光;使用多层玻璃组合成的玻璃堆,能得到很好的透射线偏振光,振动方向平行于入射面的。 图 1 图 2 2.偏振片 分子型号的偏振片是利用聚乙烯醇塑胶膜制成,它具有梳状长链形结构的分子,这些分子平行地排列在同一方向上。这种胶膜只允许垂直于分子排列方向的光振动通过,因而产生
线偏振光,如图2所示。分子型偏振片的有效起偏范围几乎可达到180度,用它可得到较宽的偏振光束,是常用的起偏元件。 图 3 鉴别光的偏振状态叫检偏,用作检偏的仪器叫或元件叫检偏器。偏振片也可作检偏器使用。自然光、部分偏振光和线偏振光通过偏振片时,在垂直光线传播方向的平面内旋转偏振片时,可观察到不同的现象,如图3所示,图中(α)表示旋转P ,光强不变,为自然光;(b )表示旋转P ,无全暗位置,但光强变化,为部分偏振光;(c )表示旋转P ,可找到全暗位置,为线偏振光。 (二)圆偏振光和椭圆偏振光的产生 线偏振光垂直入射晶片,如果光轴平行于晶片的表面,会产生比较特殊的双折射现象。这时,非常光e 和寻常光o 的传播方向是一致的,但速度不同,因而从晶片出射时会产生相位差 d n n e )(200 -= λπ δ (2) 式中0λ表示单色光在真空中的波长,o n 和e n 分别为晶体中o 光和e 光的折射率,d 为晶片厚度。 1.如果晶片的厚度使产生的相位差1 (21)2 k δπ=+,k =0,1,2,…,这样的晶片称为1/4波片,其最小厚度为0 min 4() o e d n n λ= -。线偏振光通过1/4波片后,透射光一般是椭 圆偏振光;当α=π/4时,则为圆偏振光;当0=α或π/2时,椭圆偏振光退化为线偏振光。由此可知,1/4波片可将线偏振光变成椭圆偏振光或圆偏振光;反之,它也可将椭圆偏振光或圆偏振光变成线偏振光。 2.如果晶片的厚度使产生的相差πδ)12(+=k ,k =0,1,2,…,这样的晶片称为半波片,其最小厚度为0 min 2() o e d n n λ= -。如果入射线偏振光的振动面与半波片光轴的交角为 α,则通过半波片后的光仍为线偏振光,但其振动面相对于入射光的振动面转过α2角。 3. 如果晶片的厚度使产生的相差2k δπ=,k =1,2,3,…,这样的晶片称为全波片, 其最小厚度为0 min o e d n n λ= -。从该波片透射的光为线偏振光。
SGP-I型偏振光实验系统说明书
1规格与主要技术指标 1.1 规格 计算机与操作软件1套 格兰棱镜2块 1/2波片(632.8nm) 1片 1/4波片(632.8nm) 1片 三维调节架2套 二维调节架2套 底座9套 由步进电机控制的调节架3套 光电接收系统2套 分束器1片 氦氖激光器(包括电源)1套 1.2 主要技术指标 所有调节架光学中心高度200mm 步进电机控制的调节架任意旋转角度,精度0.05° 氦氖激光器和电源波长632.8nm 、功率≥1.5 mW 2工作原理 2.1 实验用光源 光源采用氦氖激光光源,这种光源具有很好的单色性,波长为632.8nm。 2.2 偏振器 偏振器从工作原理上可分为三大类:(1)利用反射和折射产生线偏振光的原理制成的各种偏振分光镜;(2)由双折射晶体制成的各种偏振棱镜;(3)由二向色性透光材料制成的偏振片。当偏振器用来将自然光转换成线偏振光时通常被称之为起偏器,而偏振器被用来检验偏振光时又被称之为检偏器。本实验采用格兰棱镜做偏振器。 波片波片是相位延迟器的一种,是由双折射材料制成的一种光学元件,本实验采用石英晶体材料制作的偏振片,其性能稳定。 2.3 原理 光的偏振现象比光的干涉和衍射更为抽象,若不借助于专门的器件和方法,人的眼睛和光学接收器无法鉴别光的偏振特性,为适应大学基础实验要求,我公司特设计了一套用于偏振光实验的实验系统,该系统的测量内容包括两部分:一是对用做起偏和相位延迟器件本身的工作参数进行标定测量,二是利用偏光器件对光的偏振性质进行测量和鉴别。 偏振光实验,将光电接收的电信号经A/D变换进入计算机进行处理,实验中通过测量光强分布来确定偏振光的偏振态。 用光电器件探测偏振光时,应注意的一个问题是:几乎所有的光电器件都具有偏
仪器分析实验思考题答案合集汇编
一、离子选择性电极法测定水中微量氟 1、总离子强度调节剂(TISAB)是由那些组分组成,各组分的作用是什么? 答:氯化钠,柠檬酸钠,冰醋酸,氢氧化钠,氯化钠是提高离子强度,柠檬酸钠是掩蔽一些干扰离子,冰醋和氢氧化钠形成缓冲溶液,维持体系PH值稳定!2、测量氟离子标准系列溶液的电动势时,为什么测定顺序要从低含量到高含量? 答:测什么一般都是从低到高,每测一个你都冲洗电极吗,不冲洗的话,从低到高,比从高到低,影响小。还有就是防止测到高浓度的溶液使电极超出使用范围。 3、测定F-浓度时为什么要控制在测定F-离子时,为什么要控制酸度,pH值过高或过低有何影响? 答:因为在酸性溶液中,H+离子与部分F-离子形成HF或HF2-,会降低F-离子的浓度;在碱性溶液中,LaF3 薄膜与OH-离子发生反应而使溶液中F-离子浓度增加。因此溶液的酸度对测定有影响。氟电极的适用酸度范围为pH=5~6,测定浓度在10^0~10^-6 mol/L范围内,△φM与lgC F-呈线性响应,电极的检测下限在10-7 mol/L左右。 二、醇系物的气相色谱分析 1、如何进行纯物质色谱的定性分析? 色谱无法对未知纯物质定性分析(这里所谓未知就是你对它的分子组成、结构一无所知),除非你已经知道它可能是某种物质或某几种物质之一,那么你可以用这几种物质的标准品和待分析的纯物质样品在相同色谱条件下对照,保留时间相同,则证明是同种物质。 为色谱峰面积; A i 为相对重量校正因子,f(甲醇)=1.62、f(乙醇)=1.65、f(正丙醇)=1.05、f(正f i 丁醇)=0.87 三、邻二氮菲分光光度法测定铁 1、 2、制作标准曲线和进行其他条件试验时,加入还原剂、缓冲溶液、显色剂等试 剂的顺序能否任意改变?为什么?
偏振光实验报告
实验1. 验证马吕斯定律 实验原理:某些双折射晶体对于光振动垂直于光轴的线偏振 光有强烈吸收,而对于光振动平行于光轴的线偏振光吸收很少(吸 收o 光,通过e 光),这种对线偏振光的强烈的选择吸收性质,叫 做二向色性。具有二向色性的晶体叫做偏振片。 偏振片可作为起偏器。自然光通过偏振片后,变为振动面平行 于偏振片光轴(透振方向),强度为自然光一半的线偏振光。如图1、图2所示: 图1中靠近光源的偏振片1P 为起偏器,设经过1P 后线偏振光 振幅为0A (图2所示),光强为I 0。2P 与1P 夹角为θ,因此经2P 后 的线偏振光振幅为θcos 0A A =,光强为θθ20220cos cos I A I ==, 此式为马吕斯定律。 实验数据及图形: P 1 P 2 线偏光 单色自然光 线偏光 图1 P 1 P 2 A 0 A 0cos θ θ 图2
从图形中可以看出符合余弦定理,数据正确。 实验2.半波片,1/4波片作用 实验原理:偏振光垂直通过波片以后,按其振动方向(或振 动面)分解为寻常光(o 光)和非常光(e 光)。它们具有相同的 振动频率和固定的相位差(同波晶片的厚度成正比),若将它们投 影到同一方向,就能满足相干条件,实现偏振光的干涉。 分振动面的干涉装置如图3所示,M 和N 是两个偏振片,C 是 波片,单色自然光通过M 变成线偏振光,线偏振光在波片C 中分 解为o 光和e 光,最后投影在N 上,形成干涉。 考虑特殊情况,当M ⊥N 时,即两个偏振片的透振方向垂直时,出射光强为:)cos 1)(2(sin 420δθ-= ⊥I I ;当M ∥N 时,即两个偏振片的透振方向平行时,出射光强为:M N 图3 分振动面干涉装置 I 0 波片 偏振片 偏振片 单色自然光
仪器分析课程教学设计
仪器分析 专业名称;工业分析与检验专业 课程学分:5 总学时:90 课程类型专业核心课程 一、课程定位 为工业分析与检验专业的专业核心课程,根据检验专业的人才培养目标,对应检验工的岗位需求,整合教学内容,“教-学-做”一体化、项目导向、任务驱动教学,体现职业道德培养和职业素质养成的需要。通过本课程的学习,使学生掌握常用仪器分析的方法,熟练使用分析仪器,更重要的是学会正确选择分析方法,解决相应问题,具备从事轻化产品检验的能力,为学生将来从事轻工产品和化工产品的检验和管理工作打下良好的技术基础。它以无机化学,分析化学、有机化学及物理学等课程的学习为基础,是下一步进行顶岗实习的基础。 二、课程教学设计理念和思路 以职业能力培养为重点,与行业企业合作,根据行业企业发展需要和完成检验工工作任务所需要的知识、能力、素质要求。本课程倡导项目教学法,以工作任务为中心组织课程内容,并让学生在完成具体项目的过程中学会完成相应工作任务,并构建相关理论知识,发展职业能力。其总体设计思路是,课程内容突出对学生职业能力的训练,理论知识的选取紧紧围绕工作任务完成的需要来进行,同时又充分考虑了高等职业教育对理论知识学习的需要,并融合了相关职业资格证书对知识、技能和态度的要求。项目设计以具体实训项目为线索来进行,项目如下:纯碱中微量铁测定、废液中Co2+和Cr3+检测、水中苯酚含量分析、自来水中钙含量测定、水中铜含量分析、洗发水pH值的测定、牙膏中氟含量检验、废液中I-和Cl-的分析、白酒中杂醇油的测定、乙醇中微量水分析、西瓜中多糖的测定以及茶叶中咖啡因的分析等。这些项目包含了仪器分析类型:可见光光度法、紫外光分光光度法、原子吸收分光光度法、电位分析法、气相色谱法和高效液相色谱法。应用了标准曲线法、标准加入法、比较法、归一化法、内标法及外标法
仪器分析实验试题与答案
二、填空题(共15题33分) 1.当一定频率的红外光照射分子时,应满足的条件是红外辐射应具有刚好满足分子跃迁时所需的能量和分子的振动方式能产生偶 极矩的变化才能产生分子的红外吸收峰。 3.拉曼位移是_______________________________________,它与 ______________无关,而仅与_______________________________________。4.拉曼光谱是______________光谱,红外光谱是______________光谱;前者是由于________________________产生的,后者是由于________________________ 产生的;二者都是研究______________,两种光谱方法具有______________。5.带光谱是由_分子中电子能级、振动和转动能级的跃迁;产生的,线光谱是由__原子或离子的外层或内层电子能级的跃迁产生的。 6.在分子荧光光谱法中,增加入射光的强度,测量灵敏度增加 原因是荧光强度与入射光强度呈正比 7.在分子(CH 3) 2 NCH=CH 2 中,它的发色团是-N-C=C<
在分子中预计发生的跃迁类型为_σ→σ*n→π*n→σ*π→π* 8.在原子吸收法中,由于吸收线半宽度很窄,因此测量_______积分吸收________有困难,所以用测量__峰值吸收系数 _______________来代替. 9.用原子发射光谱进行定性分析时,铁谱可用作_谱线波长标尺来判断待测元素的分析线. 10.当浓度增加时,苯酚中的OH基伸缩振动吸收峰将向__低波数方向位移. 11.光谱是由于物质的原子或分子在特定能级间的跃迁所产生的,故根据其特征光谱的()进行定性或结构分析;而光谱的()与物质的含量有关,故可进行定量分析。 12.物质的紫外吸收光谱基本上是其分子中()及()的特性,而不是它的整个分子的特性。 13.一般而言,在色谱柱的固定液选定后,载体颗粒越细则()越高,理论塔板数反映了组分在柱中()的次数。
偏振光实验数据处理分析
偏振光实验数据处理分析 ——关于验证马吕斯定律的数据处理方法 一、 马吕斯定律: 1.一束光强度为的线偏振光,透过检偏器以后,透射光的光强度为α20cos I I = (1) 其中是线偏振光的光振动方向与检偏器透振方向间的夹角,该式称为马吕斯定律。 2.在光路中放入偏振片 作为起偏器,获得振动方向与 透振方向一致的线偏振光,线偏 振光的强度为入射自然光强度的 。 马吕斯定律光路图 3.在光路中放入偏振片,作为检偏器,其透振方向 与的夹角为,透过的光振 幅为 αcos A A 2 20 2 = (2) 式中为透过的线偏振光的振幅。因为 ,所以,光强度为α20cos I I = 这就是马吕斯定律,马吕斯定律说明了入射到偏振片上的线偏振光,其透射光强度的变化规律。 二、 简单实验过程 以He-Ne 激光作光源,用偏振片起偏和检偏,光电池接收,用电检流计量度光强的大小。实验从两偏振片方向(或称光轴)平行或垂直开始,记录光电流。测量时每转15记录一个数据,转180,取12个位置读数。 2 P 1 P
三、 数据处理 以角度为横坐标,光电流为纵坐标画图,并与余弦函数的平方值随着角度的变化关系比较 表1 将表1中角度θ和电流i 的数据输入,并通过工作表计算出2cosθ的值。打开Origin 数据处理软件,将含有原始数据的excel 工作表在Origin 数据处理软件中打开。 当图形窗口为当前窗口时,可以采用从菜单进行电流i 和cos 2θ的直线拟合,其拟合的函数为 Y=A+BX i 采用最小二乘法估计方程参数: B X -Y A = ∑ ∑ = N i 2 i N i i i X -X Y -Y X -X B )() )(( 对马吕斯定律的验证一般采用的方法是由实验得到的角度θ和电流i 的数据,进而用作图法得出cos 2θ和I 成正比的线性关系,如果cos 2θ与电流i 的线性关系良好,则说明马吕斯定律得以验证。然而学生用作图法验证马吕斯实验时,是用目测测试点分布而画出cos 2θ和电流i 之间的直线图,目测时测试点呈直线与否的界限难以确定,手工作图过程中也必然引入误差,以至于使实验中真正导致误差较大的原因容易被掩盖。同时,这种处理方法也使实验中产生的有规律性的误差被忽略,其结果往往达不到定量验证的目的。用Origin 数据分析软件依据最小二乘法原理进行实验数据处理,可由相关系数R 定量表示测试点的线性程度,达到定量验证物理规律的目的。由回归标准差SD 可得到实验误差。
《仪器分析》期末考试试卷答案
武汉大学2006-2007学年度第一学期《仪器分析》期末考试试 卷答案(B) 学号姓名院 (系)分数 一、填空(每空1分,共9分,答在试卷上) 1.在测定AsO33-浓度的库仑滴定中, 滴定剂是_I2_。实验中, 将阴极在套管中保护起来, 其原因是防止阴极产物干扰, 在套管中应加足Na2SO4_溶液, 其作用是_导电。 2.液相色谱分析法常使用的化学键合反相色谱填充柱是十八烷基键合硅胶填充柱或 ODS(C18) ,分离原理是疏水作用,常使用极性溶剂(如水- 甲醇)流动相,分析分离难挥发弱极性类化合物。 二、选择题(每小题2分,共20分,答在试卷上) 1. 空心阴极灯的构造 是: ( 4 ) (1) 待测元素作阴极,铂棒作阳极,内充氮气; (2) 待测元素作阳极,铂棒作阴极,内充氩气; (3) 待测元素作阴极,钨棒作阳极,灯内抽真空; (4) 待测元素作阴极,钨棒作阳极,内充惰性气体。 2 关于直流电弧,下列说法正确的 是:( 1) (1) 直流电弧是一种自吸性很强、不稳定的光源; (2) 直流电弧的检出限比交流电弧差; (3) 直流电弧的电极头温度比交流电弧低;
(4) 直流电弧只能进行定性、半定量分析,不能进行准确的定量分析。 3. 等离子体是一种电离的气体,它的组成 是:(4 ) (1) 正离子和负离子; (2) 离子和电子; (3) 离子和中性原子; (4) 离子,电子和中性原子。 4. 极谱分析中,氧波的干扰可通过向试液中__(1)___而得到消除。 (1). 通入氮气; (2). 通入氧气; (3). 加入硫酸钠固体;(4). 加入动物胶。 5. 在化合物 R-CO-H(Ⅰ),R-CO-Cl(Ⅱ),R-CO-F(Ⅲ)和R-CO-NH2(Ⅳ)中,羧 基伸缩振动频率大小顺序 为: ( 3 ) (1) Ⅳ>Ⅲ>Ⅱ> Ⅰ; (2) Ⅲ>Ⅱ>Ⅳ>Ⅰ; (3) Ⅲ>Ⅱ>Ⅰ> Ⅳ; (4) Ⅰ>Ⅱ>Ⅲ>Ⅳ. 6.. 在色谱流出曲线上, 两峰间距离决定于相应两组分在两相间的 ( 2 ) (1)保留值; (2)分配系数; (3)扩散速度; (4)传质速率。
偏振光的研究实验报告doc
偏振光的研究实验报告 篇一:偏振光的观测与研究~~实验报告 偏振光的观测与研究 光的干涉和衍射实验证明了光的波动性质。本实验将进一步说明光是横波而不是纵波,即其E和H 的振动方向是垂直于光的传播方向的。光的偏振性证明了光是横波,人们通过对光的偏振性质的研究,更深刻地认识了光的传播规律和光与物质的相互作用规律。目前偏振光的应用已遍及于工农业、医学、国防等部门。利用偏振光装置的各种精密仪器,已为科研、工程设计、生产技术的检验等,提供了极有价值的方法。 【实验目的】 1.观察光的偏振现象,加深偏振的基本概念。 2.了解偏振光的产生和检验方法。 3.观测布儒斯特角及测定玻璃折射率。 4.观测椭圆偏振光和圆偏振光。 【实验仪器】 光具座、激光器、偏振片、1/4波片、1/2波片、光电转换装置、光点检流计、观测布儒斯特角装置 图1 实验仪器实物图 【实验原理】 1.偏振光的基本概念 按照光的电磁理论,光波就是电磁波,它的电矢量E和
磁矢量H相互垂直。两者均垂直于光的传播方向。从视觉和感光材料的特性上看,引起视觉和化学反应的是光的电矢量,通常用电矢量E代表光的振动方向,并将电矢量E和光的传播方向所构成的平面称为光振动面。在传播过程中,光的振动方向始终在某一确定方位的光称为平面偏振光或线偏振光,如图2(a)。光源发射的光是由大量原子或分子辐射构成的。由于热运动和辐射的随机性,大量原 - 子或分子发射的光的振动面出现在各个方向的几率是相同的。一般说,在106s内各个方向电矢量的时间平均值相等,故出现如图2(b)所示的所谓自然光。有些光的振动面在某个特定方向出现的几率大于其他方向,即在较长时间内电矢量在某一方向较强,这就是如图2(c)所示的所谓部分偏振光。还有一些光,其振动面的取向和电矢量的大小随时间作有规则的变化,其电矢量末端在垂直于传播方向的平面上的移动轨迹呈椭圆(或圆形),这样的光称为椭圆偏振光(或圆偏振光),如图2(c)所示。 图2 光波按偏振的分类 2.获得偏振光的常用方法 (1)非金属镜面的反射。 通常自然光在两种媒质的界面上反射和折射时,反射光和折射光都将成为部分偏振光。并且当入射角增大到某一特定值时,镜面反射光成为完全偏振光,其振动面垂直于入
仪器分析教案
1.1 仪器分析和化学分析两者的区别在于:①检测能力②样品的需求量③分析效率④使用的广泛性⑤精确度 1.2 仪器分析方法的分类 根据测量原理和信号特点,仪器分析方法大致分为四大类 ⒈ 学分析法 以电磁辐射为测量信号的分析方法,包括光谱法和非光谱法 ? ???? ?的变化折射、衍射等基本性质物质之后,引起反射、非光谱法:电磁波作用拉曼散射 磁辐射的吸收、发射或光谱法:依据物质对电 ⒉电化学分析法 依据物质在溶液中的电化学性质而建立的分析方法 ⒊色谱法 以物质在两相间(流动相和固定相)中分配比的差异而进行分离和分析。 ⒋其它仪器分析方法包括质谱法、热分析法、放射分析等 。 第二章 紫外-可见吸收光谱法 紫外-可见吸收光谱法历史较久远,应用十分广泛,与其它各种仪器分析方法相比,紫外-可见吸收光谱法所用的仪器简单、价廉,分析操作也比较简单,而且分析速率较快。 在有机化合物的定性、定量分析方面,例如化合物的鉴定、结构分析和纯度检查以及在药物、天然产物化学中应用较多。 本章内容: 本章主要讨论了紫外-可见吸收光谱的产生、紫外-可见分光光度计仪器原理和结构以及紫外-可见吸收光谱法在有机定性及结构分析中的应用。 讲解思路: 让学生首先了解:不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,因而具有不同的吸收光谱。而各种化合物,无机化合物或有机化合物吸收光谱的产生在本质上是相同的,都是外层电子跃迁的结果,但二者在电子跃迁类型上有一定区别。电子跃迁类型是本章的难点。最后了解利用紫外-可见分光光度计可使物质产生吸收光谱并对其进行检测。鉴定的方法是本章的重点。 2.1.光分析法概论 内容提要:电磁辐射的波动性和粒子性 电磁波谱原 重点难点:电磁波谱区 一、电磁辐射的性质 电磁辐射具有波动性和粒子性。 ⒈波动性 电磁辐射是在空间传播着的交变电磁场,可以用频率(υ)、波长(λ)和波数(δ)等波参数表征。掌握频、波长、波数的定义及之间的关系。 ⒉微粒性 普朗克方程 E λ ?=υ=c h h (2-3) 该方程将电磁辐射的波动性和微粒性联系起来, 二、电磁波谱 按照波长的大小顺序排列可得到电磁波谱,不同的波长属不同的波谱区,对应有不同的光子能量和不同的能级跃迁。能用于光学分析的是中能辐射区,包括紫外、可见光区和红外区。 2.2.紫外-可见吸收光谱 内容提要:介绍紫外-可见吸收光谱法的基本概念。紫外-可见吸收光谱法是根据溶液中物质的分子对紫外和可见光谱区辐射能的吸收来研究物质的组成和结构的方法。也称作紫外和可见吸收光度法,它包括比色分析和紫外-可见分光光度法。 不同物质具有不同的分子结构,对不同波长的光会产生选择性吸收,因而具有不同的吸收光谱。无机化合物和有机化合物吸收光谱的产生本质上是相同的,都是外层电子跃迁的结果,但二者在电子跃迁类型上有一定区别。 有机化合物吸收可见光或紫外光,σ、π和n 电子就跃迁到高能态,可能产生的跃迁有σ→σ*、n →σ*、π→π*和n →π*。各种跃迁所需要的能量或吸收波长与有机化合物的基团、结构有密切关系,根据此原理进行有机化合物的定性和结构分析。 无机络合物吸收带主要是由电荷转移跃迁和配位场跃迁而产生的。电荷转移跃迁的摩尔吸收系数很大,根据朗伯-比尔定律,可以建立这些络合物的定量分析方法。 重、难点:分子的电子能级和跃迁 生色团的共轭作用 d-d 配位场跃迁 金属离子影响下的配位体π-π*跃迁。 2.3.朗伯比耳定律
清华大学偏振光学实验完整实验报告
偏振光学实验完整实验报告 工物53 李哲 2015011783 16号 1.实验目的: (1)理解偏振光的基本概念,在概念以及原理上了解线偏振光,圆偏振光以及椭圆偏振光,并了解偏振光的起偏与检偏方法。以及线偏振光具有的一些性质。 (2)学习偏振片与玻片的工作原理。 2.实验原理: (1)光波偏振态的描述: · 单色偏振光可以分解成两个偏振方向垂直的线偏振光的叠加: t a E X ωcos 1=与()δω+=t a E Y cos 1(其中δ是两个偏振方向分量的相位延迟,21,a a 为两个光的振幅),由其中的δ,,21a a 就可以确定这个线偏振光的性质。 πδ=或0=δ就为线偏振光,2 ,21π δ==a a 为圆偏振光(就是光矢量的顶点绕 其中点做圆周运动,依然是偏振光),而一般情况下是椭圆偏振光。 · 上述式子通常描述的是椭圆偏振光,而本实验通过测量椭圆的长轴方位角ψ以及椭圆的短半轴与长半轴的比值对于椭圆偏振光进行描述。其计算式是: ()δβcos 2tan arctan 2 1 ?=ψ () 12sin sin 112222-?-+=βδa b 而对于实验中的椭圆偏振光而言,其光强在短轴对应的方向最小,在长轴的对应方向最大,所以可以通过使这个椭圆偏振光通过一个偏振片,并调整偏振片的透射轴方位,测量其最大最小值,就可以知道其长轴短轴的比值。又由于光强与振幅的平方成正比,所以测得的光强的比值是长轴短轴之比的平方。 (2)偏振片: · 理想偏振片:只有电矢量振动方向与透射轴平行方向的光波分量才能通过偏振片。 · 实验中的偏振片不是理想化的,并不能达到上述的效果,当入射光波的振动方向与透射轴平行时,其透射率不能达到1,当垂直于透射轴时,其透射率不是0。所以对于偏振片有主透射率以及消光比两个量进行描述。 · 主透射率21T T ,指沿透射轴或消光轴方向振动光的光强透射率。两者的比值
《仪器分析》教学大纲
《仪器分析》教学大纲一、课程及教师基本信息 2:平时考核应占总成绩的40-70%。
二、任课教师简介 曾凡刚,教授,对仪器分析教学已有20多年的教学经验,能跟上现代各种仪器发展的步伐。 三、课程简介 课程梗概: 仪器分析课程适合于我校环境学院环境科学和环境工程专业的学生,是在学生具备了一定的无机化学、化学分析理论知识基础上开设的一门专业技术核心课。其任务是依据物质的物理及物理化学性质,采用精密仪器设备得到分析数据,鉴定物质体系的化学组成、测 定其中有关成分的含量和确定体系中物质的结构和形态,即要解决物质定性和定量问题。 教学目标: 1.掌握各类仪器分析方法的基本原理以及仪器的各重要组成部分。 2.了解各仪器分析方法的应用对象及分析的基本过程。 3.初步了解当今世界各类分析仪器、分析方法及发展趋势,为今后的工作及更深一步地学习作必要的铺垫。 课程特点: 仪器分析需要一定的大学分析化学,大学物理等课程的基础。 四、学习要求与建议 包括预习、复习、课堂讨论(或实验(实践)操作)、课外交流、作业和文献阅读等自主学习、课堂(或实验(实践)教学环节)纪律、课程考核等方面的要求与建议。 五、教学进度、内容和要求 教学进度及基本内容
1.掌握各类仪器分析方法的基本原理以及仪器的各重要组成部分。 2.了解各仪器分析方法的应用对象及分析的基本过程。 3.初步了解当今世界各类分析仪器、分析方法及发展趋势,为今后的工作及更深一步地学习作必要的铺垫。 【课外学习内容与要求】 第一章仪器分析概论 必读文献:《仪器分析》,北京大学仪器分析编写组,北京大学出版社《环境仪器分析》,环境科学出版社 参考文献:《仪器分析》,朱明华编,高等教育出版社,第四版; 《仪器分析》,方慧群等编,科学出版社 第二章光学分析法导论 必读文献:《仪器分析》,北京大学仪器分析编写组,北京大学出版社《环境仪器分析》,环境科学出版社 参考文献:《仪器分析》,朱明华编,高等教育出版社,第四版; 《仪器分析》,方慧群等编,科学出版社 第三章紫外-可见吸收光谱法 必读文献:《仪器分析》,北京大学仪器分析编写组,北京大学出版社《环境仪器分析》,环境科学出版社 参考文献:《仪器分析》,朱明华编,高等教育出版社,第四版; 《仪器分析》,方慧群等编,科学出版社 第四章红外吸收光谱法 必读文献:《仪器分析》,北京大学仪器分析编写组,北京大学出版社《环境仪器分析》,环境科学出版社 参考文献:《仪器分析》,朱明华编,高等教育出版社,第四版; 《仪器分析》,方慧群等编,科学出版社 第五章分子发光分析法
实验报告偏振光学实验
实验报告 女姓名. *****班级:*****■学号. *****实验成绩: 同组姓名:*****实验日期:*****指导教师:批阅日期: 偏振光学实验 【实验目的】 1 ?观察光的偏振现象,验证马吕斯定律; 2.了解1 / 2波片、1 / 4波片的作用; 3 ?掌握椭圆偏振光、圆偏振光的产生与检测。 【实验原理】 1 .光的偏振性 光是一种电磁波,由于电磁波对物质的作用主要是电场,故在光学中把电场强度E称为光矢量。在垂直于光波传播方向的平面内,光矢量可能有不同的振动方向,通常把光矢量保持一定振动方向上的状态称为偏振态。如果光在传播过程中,若光矢量保持在固定平面上振动,这种振动状态称为平面振动态,此平面就称为振动面(见图1)。此时光矢量在垂直与传播方向平面上的投影为一条直线,故又称为线偏振态。若光矢量绕着传播方向旋转,其端点描绘的轨道为一个圆,这种偏振态称为圆偏振态。如光矢量端点旋转的轨迹为一椭圆,就成为椭圆偏振态(见图2)。 2.偏振片 虽然普通光源发出自然光,但在自然界中存在着各种偏振光,目前广泛使用的偏振光的器件是人造偏振片,它利用二向色性获得偏振光(有些各向同性介质,在某种作用下会呈现各向异性,能强烈吸收入射光矢量在某方向上的分量,而通过其垂直分量,从而使入射的自然光变为偏振光,介质的这种性质称为二向色性。)。 偏振器件即可以用来使自然光变为平面偏振光一一起偏,也可以用来鉴别线偏振光、自然光和部分偏振光一一检偏。用作起偏的偏振片叫做起偏器,用作检偏的偏振器件叫做检偏器。实际上,起偏器和检偏器是通用的。 3?马吕斯定律 设两偏振片的透振方向之间的夹角为a,透过起偏器的线偏振光振幅为A0,则 透过检偏器 的线偏振光的强度为I
《仪器分析》教案
《仪器分析》教案 绪 论 本章是《仪器分析》课程的介绍。主要是让学生了解《化学分析》与《仪器分析》的联 系与区别,仪器分析方法的分类和它的发展情况,介绍仪器定量分析方法的评价指标。重点在于对分析方法进行评价的几项指标。学时计划为1学时。 内容提要:仪器分析与化学分析的区别与联系、仪器分析方法的分类及发展趋势。 重点难点:仪器分析方法的分类 授课方式:讲授 一、仪器分析和化学分析 ⒈化学分析定义 ⒉仪器分析定义 ⒊两者的区别在于: ①检测能力 ②样品的需求量 ③分析效率 ④使用的广泛性 ⑤精确度 二、仪器分析方法的分类 根据测量原理和信号特点,仪器分析方法大致分为四大类 ⒈光学分析法 以电磁辐射为测量信号的分析方法,包括光谱法和非光谱法 ? ?????的变化折射、衍射等基本性质物质之后,引起反射、非光谱法:电磁波作用拉曼散射 磁辐射的吸收、发射或光谱法:依据物质对电 ⒉电化学分析法 依据物质在溶液中的电化学性质而建立的分析方法 ⒊色谱法 以物质在两相间(流动相和固定相)中分配比的差异而进行分离和分析。 ⒋其它仪器分析方法 包括质谱法、热分析法、放射分析等 。 三、仪器分析的发展概述 发展趋势 ⒈计算机技术在仪器分析中的广泛应用,实现了仪器操作和数据处理自动化。 ⒉不同方法联用提高仪器分析的功能。
⒊各学科的互相渗透 第一章 光学分析法基础 本章是学习光学分析法之前应具备的基础知识。主要介绍光的波粒二象性,原子光谱和分子光谱基础知识。在介绍电磁辐射基础上重点讲解能级跃迁图。本章计划学时为1学时。 第一节 电磁辐射的性质 一、电磁辐射的性质 电磁辐射具有波动性和粒子性。 ⒈波动性 电磁辐射是在空间传播着的交变电磁场,可以用频率(υ)、波长(λ)和波数(δ)等波参 数表征。掌握频、波长、波数的定义及之间的关系。 ⒉微粒性 普朗克方程 Eλ?=υ=c h h (1-1) 该方程将电磁辐射的波动性和微粒性联系起来, 二、电磁波谱 按照波长的大小顺序排列可得到电磁波谱,不同的波长属不同的波谱区,对应有不同的 光子能量和不同的能级跃迁。 能用于光学分析的是中能辐射区,包括紫外、可见光区和红外区。 第四节 原子光谱和分子光谱 内容提要: 原子光谱项、原子光谱能收图及原子光谱选择定则,分子光谱能收分子吸 收光谱和分子发光光谱 重点、难点:原子光谱项、分子光谱能及跃迁图 授课方式: 讲授 一、原子光谱 原子光谱产生于原子外层电子能级的跃迁 ⒈核外电子的运动状态 原子接到电子的运动状态可以用主量数n 、角量子数l2、磁量子数m和自旋量子数s 来描述。 ⒉光谱项 原子的能量状态需要用n.L.S .J 四个量子数为参数的光谱项来表征。
仪器分析教学大纲
《仪器分析》课程教学大纲 Instrumental Analytical Chemistry 一、课程说明 课程编码:02200110 课程总学时:48 周学时: 4 学分:3 开课学期:4 1.课程性质: 课程性质:专业必修 2.适用专业与学时分配: 适用于化学、应用化学专业 教学内容与学时分配 3.课程教学目的与要求: 本课程是化学相关专业的专业必修课,目的是使学生熟悉各种科学分析仪器的基本原理,掌握实验技能,加强学生分析问题和解决问题的能力。熟悉色谱分析法,液相色谱分析法,电位分析法,伏安分析法,库仑分析法,原子光谱法(原子发射,原子吸收),分子光谱法(紫外可见分光光谱法,
红外光谱法,荧光光谱法),核磁共振波谱法和质谱的基本原理及各种仪器的结构,工作原理及基本操作。 掌握各种分析方法的定性或定量的全过程,并且每一方法掌握1、2个实际测试实验。 教师在使用本大纲时,在必须完成规定的基本内容基础上,对讲授次序、课时分配和教学方式等方面可根据教学计划灵活掌握。 4.本门课程与其它课程关系: 先修课程为无机化学原理、元素无机化学、有机化学、分析化学、物理化学等,是高等分析化学课程的基础。 5.推荐教材及参考书: 推荐教材:《仪器分析》,高等教育出版社,朱明华编,2008年,第四版。 参考书: (1)《仪器分析》,科学出版社,方惠群等编,2002年,第一版。 (2)《仪器分析习题精解》,科学出版社,胡胜等编,2006年,第二版。 (3)《仪器分析学习指导》,科学出版社,方惠群等编,2004年,第一版。 6.课程教学方法与手段: 所有内容采用多媒体教学 7.课程考试方法与要求: 考核方式:闭卷考试 评分标准:考试方式总成绩=平时成绩(出勤+作业)×10% +期末考试×90% 二、教学内容纲要 第一章引言(2学时) 1.教学目的与要求 主要讲明仪器分析的任务,内容,范围,让学生了解仪器分析发展的概况。 2.主要内容 仪器分析方法的分类、仪器分析的特点、仪器分析的发展以及仪器分析的应用。 第二章气相色谱分析(6学时) 1.教学目的与要求 (1)介绍色谱法有关的名词术语,色谱流出曲线。 (2)介绍塔板理论和速率理论。提出评价柱效能的三项指标,即柱效率(n),相对保留值(r)
7讲义(偏振光)
偏振光的特性研究 一、实验目的 1、观察光的偏振现象,加深对光偏振基本规律的认识。 2、熟悉常用的起偏振和检偏振的方法。 3、了解各种波片的作用原理、 二、实验仪器 三、实验原理 1、偏振光的基本概念 光是电磁波,它的电矢量E 和磁矢量H 相互垂直,且均垂直于光的传播方向C ,通常用电矢量E 代表光的振动方向,并将电矢量E 和传播方向C 构成的平面称为振动面。在传播过程中,电矢量振动方向始终在某一确定的振动面的光称为平面偏振光或线偏振光。光源发出的光是有大量的原子或分子辐射构成的。由于大量原子或分子的热运动和辐射的随机性,它们所发射的光的振动面,出现在各个方向的几率是相同的。故这种光源发射的光对外不显示偏振的性质,称为自然光。在发光过程中,有些光振动面在某个特定的方向上出现的几率大于其它方向,即在较长的时间内电矢量在某个方向是较强,这种光称为部分偏振光,还有一些光其振动面取向和电矢量的大小随时间作有规律的变化,而电矢量末端在垂直于传播方向的平面上轨迹呈椭圆或圆。这种光称为椭圆偏振光或圆偏振光。 2、获得偏振光的常用方法 将非偏振光变成偏振光的过程成为起偏,起偏装置成为起偏器。常用的起偏装置主要有: (1)反射起偏(或透射起偏器) 当自然光在两种媒质的界面反射时,反射光和折射光都将成为部分偏振光。当入射角达到某一特定值 b ?时,反射光成为完全偏振光,其振动面垂直于入射 面(见图1)而角b ?就是布儒斯特角,也称起偏角,由布儒斯特定律得2 1 tan b n n ?= 图2 He —Ne 激光器 (波长632.8nm ) 偏振片 (起偏器) 偏振片 (检偏器) 白屏 波片 (4/λ、2/λ) 图1
仪器分析实验习题及参考答案
色谱分析习题及参考答案 一、填空题 1、调整保留时间是减去的保留时间。 2、气相色谱仪由五个部分组成,它们是 3、在气相色谱中,常以和来评价色谱 柱效能,有时也用 表示柱效能。 4、色谱检测器按响应时间分类可分为型和型两种,前者的色谱图为 曲线,后者的色谱图为曲线。 5、高效液相色谱是以为流动相,一般叫做, 流动相的选择对分离影响 很大。 6、通过色谱柱的和之比叫阻滞因子, 用符号表示。 7、层析色谱中常用比移值表示。由于比移值Rf重现性较差,通常 用做对照。他表示与移行距离之比。 8、高效液相色谱固定相设计的原则是、以达到 减少谱带变宽的目的。 二、选择题 1、色谱法分离混合物的可能性决定于试样混合物在固定相中______的差别。 A. 沸点差, B. 温度差, C. 吸光度, D. 分配系数。 2、选择固定液时,一般根据_____原则。 A. 沸点高低, B. 熔点高低, C. 相似相溶, D. 化学稳定性。 3、相对保留值是指某组分2与某组分1的_______。 A. 调整保留值之比, B. 死时间之比, C. 保留时间之比, D. 保留体积之比。 4、气相色谱定量分析时______要求进样量特别准确。 A.内标法; B.外标法; C.面积归一法。 5、理论塔板数反映了 ______。
A.分离度; B. 分配系数; C.保留值; D.柱的效能。 6、下列气相色谱仪的检测器中,属于质量型检测器的是 A.热导池和氢焰离子化检测器; B.火焰光度和氢焰离子化检测器; C.热导池和电子捕获检测器; D.火焰光度和电子捕获检测器。 7、在气-液色谱中,为了改变色谱柱的选择性,主要可进行如下哪种(些)操作?() A. 改变固定相的种类 B. 改变载气的种类和流速 C. 改变色谱柱的柱温 D. (A)和(C) 8、进行色谱分析时,进样时间过长会导致半峰宽______。 A. 没有变化, B. 变宽, C. 变窄, D. 不成线性 9、在气液色谱中,色谱柱的使用上限温度取决于 _____ A.样品中沸点最高组分的沸点, B.样品中各组分沸点的平均值。 C.固定液的沸点。 D.固定液的最高使用温度 10 、分配系数与下列哪些因素有关_____ A.与温度有关; B.与柱压有关; C.与气、液相体积有关; D.与组分、固定液的热力学性质有关。 11、对柱效能n,下列哪些说法正确_ ____ A. 柱长愈长,柱效能大; B.塔板高度增大,柱效能减小; C.指定色谱柱对所有物质柱效能相同; D.组分能否分离取决于n值的大小。 12、在气相色谱中,当两组分不能完全分离时,是由于() A 色谱柱的理论塔板数少 B 色谱柱的选择性差 C 色谱柱的分辨率底 D 色谱柱的分配比小 E 色谱柱的理论塔板高度大 13.用硅胶G的薄层层析法分离混合物中的偶氮苯时,以环己烷—乙酸乙酯(9;1)为展开剂,经2h展开后,测的偶氮苯斑点中心离原点的距离为9.5cm,其溶剂前沿距离为24.5cm。偶氮苯在此体系中的比移值R为()f A 0.56 B 0.49 C 0.45 D 0.25 E 0.39 14、气相色谱分析下列那个因素对理论塔板高度没有影响()。 A 填料的粒度 B 载气得流速 C 填料粒度的均匀程度 D 组分在流动相中的扩散系数 E 色谱柱长 三、计算题 1、用一根2m长色谱柱将组分A、B分离,实验结果如下: 空气保留时间30s ;A峰保留时间230s;B峰保留时间250s;B峰底宽 25s。求:色谱柱的理论塔板数n;A、B各自的分配比;相对保留值r;两峰的分离度R;若2,1将两峰完全分离,柱长应该是多少? 2、组分A和B在一1.8m长色谱柱上的调整保留时间t'=3min18s,t'=3min2s,两组BA分峰的半宽分别为W=1.5mm和W=2.0mm,记录仪走纸速度为600mm/h,试
