物理化学考前复习:基础知识+重点(考前必备)

物理化学考前复习:基础知识+重点(考前必备)第一章热力学第一定律
1、热力学三大系统:
(1)敞开系统:有物质和能量交换;
(2)密闭系统:无物质交换,有能量交换;
(3)隔绝系统(孤立系统):无物质和能量交换。
2、状态性质(状态函数):
(1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
(2)强度性质:如压力,温度,粘度,密度。
数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
3、热力学四大平衡:
(1)热平衡:没有热隔壁,系统各部分没有温度差。
(2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同
(3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。
(4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。
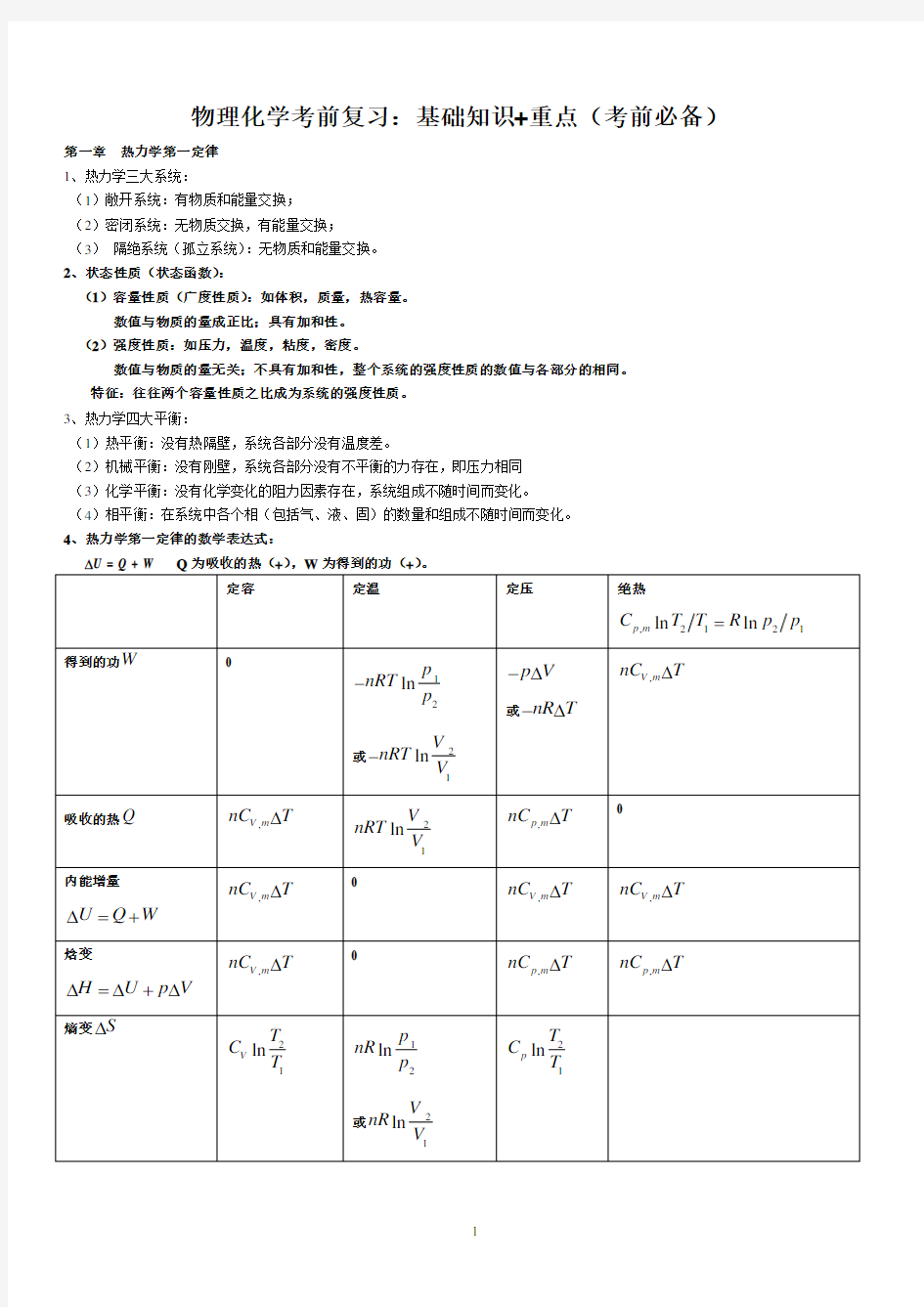
4、热力学第一定律的数学表达式:
?U = Q + W Q为吸收的热(+),W为得到的功(+)。
12、在通常温度下,对理想气体来说,定容摩尔热容为:
单原子分子系统
,V m C =32
R
双原子分子(或线型分子)系统 ,V m C =52R
多原子分子(非线型)系统 ,V m C 6
32
R R ==
定压摩尔热容:
单原子分子系统 ,52
p m C R =
双原子分子(或线型分子)系统 ,,p m V m C C R -=,72
p m C R =
多原子分子(非线型)系统 ,4p m C R =
可以看出:
,,p m V m C C R -=
13、,p m C 的两种经验公式:,2p m C a bT cT =++ (T 是热力学温度,a,b,c,c ’ 是经
,2'
p m c C a bT T
=++ 验常数,与物质和温度范围有关)
14、在发生一绝热过程时,由于0Q δ=,于是dU
W δ=
理想气体的绝热可逆过程,有:,V m nC dT pdV =- ? 22
,11
ln
ln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ?= ,,p m
V m
C pV C γγ=常数 =>1. 15、-焦耳汤姆逊系数:J T T
=(
)H p
μ??- J T μ->0 经节流膨胀后,气体温度降低;
J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。
16、气体的节流膨胀为一定焓过程,即0H
?=。
17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温度相同而在反应过程中只做体积功不做其他功时,化学反应所
吸收或放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度:()()()
n B n B B ξ
ν-=
末初
(对于产物v 取正值,反应物取负值)
1ξ=时,r r m U
U ξ
??=
,r r m H
H ξ
??=
19、(1)标准摩尔生成焓(0
r m H ?):在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热,为该物质的
标准摩尔生成焓。
(2)标准摩尔燃烧焓(0
c m H ?):在标准压力和指定温度下,单位物质的量的某种物质被氧完全氧化时的反应焓,为该物质的标
准摩尔燃烧焓。
任意一反应的反应焓0
r m H ?等于反应物燃烧焓之和减去产物燃烧焓之和。
20、反应焓与温度的关系-------基尔霍夫方程
()()r B A p p p p p p H H H C B C A C T T T ????
??????=-=-=? ? ? ?
?????????
()()()()210,021p p p C H T H H C T T ?=???>?-?=?- 0,Cp ?<即产物热容小于反应物热容,则 ()0p H T ???<,即温度升高时反应焓减小。 0,Cp ?>即产物热容大于反应物热容,则 ()0p H T ???>,即温度升高时反应焓增大。
0,p C ?=或很小时,反应焓将不随温度而改变。
21、基尔霍夫方程的应用:
()()()2121p H H C T T ?-?=?-
适用条件:温度变化范围不大时,将 p C ?近似看作常数,与温度无关。
第二章 热力学第二定律
1、热力学第二定律的经典表述:人们不可能设计成这样一种机器,这种机器能不断循环工作,它仅仅从单一热源吸热变为功而没有任何
其他变化。
2、卡诺循环:
过程1 保持T 2定温可逆膨胀。故2
2
121
ln
V Q W RT V =-= 过程2 绝热可逆膨胀。由于系统不吸热,0Q =,故 212()V W U C T T =?=-
过程3 保持T 1定温可逆压缩。故 4
1313
ln
V Q W RT V =-= 过程4 绝热可逆压缩。故
421()V W U C T T =?=-
卡诺热机的效率:
2122W T T Q T η--=
= 制冷效率:121
T T T β=- 3、卡诺定理:
(1)在两个不同温度的热源之间工作的任意热机,以卡渃热机的效率为最大。否则将违
反热力学第二定律。
(2)卡诺热机的效率只与两个热源的温度有关,而与工作物质无关。否则也将违反热力学第二定律。 4、热力学第二定律人数学表达式--------克劳修斯不等式
Q
dS T
δ≥
dS 是系统的熵变,Q δ是实际过程中传递的热,T 是热源温度,
Q
T
δ是实际过程中的热温商。该式的等号适用于可逆过程;大于
号适用于不可逆过程。它的含义是:
(1) 假如某一过程的发生将使系统的熵变大于热温商,则该过程是一个不违反热力学第二定律的、有可能进行的不可逆过程。 (2) 假如某一过程发生时,系统的熵变为热温商相等地,则该过程是一个可逆过程。 (3)
Q
dS T
δ<
的过程不可能发生。
(4) 克劳修斯不等式用于孤立系统时,0dS ≥,即孤立系统中所发生的任意过程总是向着熵增大的方向进行。
5、熵变的计算:
(1)定温过程中的熵变:2
21112
ln
ln ln r
V nRT Q V p V S
nR nR T
T V p ?====?
(2)定压过程的熵变:2
2
11
2
1
ln T T r
p T T Q C dT T S
Cp T T T δ?===?
?
(3)定容过程的熵变:2211
2
1
ln T T r V V T T Q C dT T S C T T T δ?===??
(4)相变化的熵变:H n H
S T T
???==
(定温定压,两相平衡,可逆) 6、熵是系统混乱度的度量: ln S k =Ω Ω是热力学概率,k 是玻耳兹曼常数。
7、热力学第二定律的本质:一切自发过程,总的结果都是向混乱度增加的方向进行。 8、热力学第三定律:在0K 时,任何纯物质的完美晶体其熵值为零。 9、有反应:
a A
b B g G h
H +→+ 熵变计算:()()()()o
o o o o
r m
m m m m S gS G hS H aS A bS B ?????=+-+????
10、定温定容的系统--------亥姆霍兹函数A (1)定义A U TS =-
(2)
(),'T V A W ?≤ 等式表示可逆,不等式表示不可逆。 在定温定容条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。 (3)
(),0T V A ?< ,表示能够发生的不可逆过程。
(),0T V A ?= ,表示可逆过程(或平衡) (),0T V A ?> ,表示不可能发生的过程
11、定温定压系统-----------吉布斯函数G (1)定义: G H TS U pV TS A p V
=-=+-=+
(2)(),'T p G W ?≤ 等式表示可逆,不等式表示不可逆。
在定温定压条件下,系统亥姆霍兹函数的减少等系统所能做的最大有效功(绝对值)。 (3)(),0T p G ?< ,表示能够发生的不可逆过程。
(),0T p G ?= ,表示可逆过程(或平衡)
(),0T p G ?> ,表示不可能发生的过程
12、热力学的基本公式:
当系统只做体积功不做其他功时
dU TdS pdV
dH TdS Vdp dA SdT pdV dG SdT Vdp
=-=+=--=-+
13、麦克斯韦关系式:
V S T p V S ??????
=- ? ???????
S p T V p S ??????
= ? ???????
V T S p V T ??????
= ? ?
?????? p T S V p T ??????-= ? ???????
14、计算G ?: (1)定温:221
1
2
1
ln p p p p nRT p G
Vdp dp nRT p p ?===??
(2)发生相变:始态和终态的两个相平衡,且温度和压力相同,则0G ?=
始态和终态不平衡,则设计可逆过程来计算。 (3)化学反应:G H
T S ?=?-?
(4)G ?温度的变化--------吉布斯--亥姆霍兹公式
定温:()p G S T ????=-??
???? ()p G T G H T ?????=?-??????? ()2
p G T H
T T ?????=-?????
应用式:
2211
22111()T T T T G G H dT H T T T T T ???????
??-=-=?- ? ? ???????
?
附第二章 化学势
1、 (1)偏摩尔量的定义:多组分系统的任一种容量性质X (X 可分别代表V ,U ,H ,S ,A ,G 等),可以看成是温度T 、压力p 及各
物质的量,B C n n ,…的函数:
(),,,,,B C D X f T p n n n =
C A ,(B)A ,(B),,(C A)d d d d p n T n T p n X X X X T p n T p n ≠?????????
=++ ? ? ?
?????????
C B B ,,(C B)
d T p n X n n ≠??
?++ ?
??? 定义:
()B
B ,
,C B
d e f C T p n X X n ≠??
? ????则A A B B d d d X
X n X n =++ B B B
d X n =∑
B X 称为B 的“偏摩尔量”。
(2)偏摩尔量的集合公式:
A A C C X n X n X =++……
2、(1)化学势定义:B
B B ,,(
C B)
C T P n G G n μ≠??
?= ?
??? (2)物理意义:决定物质传递方向和限度的强度因素。 (3)定温定压下:
'B B r dG dn W μδ==∑ ,也就是说B B dn μ∑是定温度定压条件下一多组分均相系统在发生状态变化时所
能做出的最大有效功。
(4)在不做其他功的条件下,
(),0T p dG <是能够进行的过程;(),0T p dG =,过程即达平衡。
3、理想气体化学势表达式:ln
p RT p θθ
μμ=+
4、对于理想气体混合物来说,其中某种气体的行为与该气体单独占有混合气体总体积时的
行为相同。即ln
B B
B p RT p θθ
μμ=+
5、实际气体的化学势:ln
p
RT p
θθ
γμμ=
+()ln RT f p θθμ=+
定义逸度
f p γ= 校正因子γ
称为逸度系数或逸度因子。
6、拉乌尔定律:一定温度时,溶液中溶剂的蒸气压A p 与溶剂在溶液中的物质的量分数A x 成正比,其比例是纯溶剂在该温度时的蒸气
压
*A p (上标“*”表示纯物质)
。即: ***A A A A A A B p p x p p p x =?-=
(溶液蒸气压的降低与溶质在溶液中的摩尔分数成正比)
7、(1)理想液态混合物:在一定的温度和压力下液态混合物中任意一种物质在任意浓度下均遵守拉乌耳定律的液态混合物。 (2)理想液态混合物中物质的化学势:液态混合物与蒸气相达成平衡时,有:
(ln)()()ln
B
B B B p s g g RT p
μμμ??==+*()ln B B l RT x μ=+, 其中*
*
()()ln B B
B
p l g RT p
μμ?
?
=+
8、亨利定律:一定温度时,稀溶液中挥发性溶质的平衡分压与溶质在溶液中的摩尔分数成正比:
B x B p k x = ,
B p 是与溶液平衡的溶质蒸气的分压,B x 是溶质在溶液中的摩尔分数,x k 是比例常数,
称为亨利系数。其数值在一定温度下不仅与溶质性质有关,还有溶剂性质有关,可以大于 或小于纯溶质的饱和蒸汽压
*B p 。
9、理想稀溶液的定义:一定的温度和压力下,在一定的浓度范围内,溶剂遵守拉乌尔定律、溶质遵守亨利定律的溶液称为理想稀溶液。 10、不挥发性溶质理想稀溶液的依数性: (1)凝固点降低:*2()f f
B fus m R T T x H ?
?=
? (fus m H ??与温度无关) =f B K m ,其中B m 是溶液中溶质的质量摩尔浓度。
f K 是凝固点降低常数*2()f A f
fus m R T M K H ?
=
?(A M 是溶剂的摩尔质量,单位1
kg mol
- )
(2)沸点升高:*11
ln ()vap m A b b H x R T T ??=
- 沸点升高常数*2()b A
b vap m
R T M K H ?=
? 则b
b B T K m ?=
(3)半透膜两边平衡时,纯溶剂的压力为*p 、溶液的压力为p ,则
*p p -=∏ ,压力差∏称为渗透压,
渗透压c R T ∏=B B
W R T
M V
?=
∏
(4)求算活度:*11ln ()fus m A
f f H a R
T T ?
?=
-*11
()vap m b b H R T T ??=-*,m A V RT
∏=-
第三章 化学平衡
1、理想气体的化学反应:()()()()aA g bB g gG g hH g +===+
标准平衡常数()()()()g h
G H a b
A B p p p p K p p p p ???
??=
活度商(')(')(')(')g h
G H a a b
A B p p p p Q p p p p ????=
标准吉布斯函数变化ln r m G RT K ?
??=- ln r m r m a G G RT Q ??=?+
当a Q K ?<时,0r m G ?<,反应能够正向进行。 当a Q K ?>时,0r m G ?>,反应能够逆向进行。 当a
Q K ?=时,0r m G ?=,反应达到平衡。。
2、平衡常数的表示法:
(1)气相反应:()()()()()()B g h G H B
a b
A B p p p p K p p p p p p νν
???
?-???==∏ (g h a b ν?=+--)
()()B B B p B B B x K p px x p K p ννννν??=∏=∏=∏=
B x B p K x K p νν-?=∏=(与温度、压力有关)=
(()B
B B x B B B n K x n n n n K n ν
νννν-?-?=∏=∏=∏=总总总) n x K K n ν?=总
总结:()()()p x n K K p K p p K p p n ννν
?
?-?????===总
(2)液相反应:
理想液态混合物:B B K x ν?
=∏ 理想稀溶液:()B B K c c ν??=∏ 非理想稀溶液:B B K a ν?=∏
(3)复相反应:
3、(1)温度对平衡常数的影响:12
(2)11
ln ()(1)r m H K K R T T ???
?=- (2)压力、惰性气体的影响:()n K K p p n ν?
??=总
第四章 多相平衡
1、相:系统中,物理及化学性质完全均一的部分。
气体:一个系统中,无论有多少气体,都只能形成一个气相。
液体:由于不同液体的相互溶解的程度不同,一个系统中可以有一个或两个液相,但不会超过三个。
固体:如果系统中的不同固体达到分子程度的均匀混合,形成固溶体,一种固溶
体是一个固相;否则,不论固体有多碎,系统中有多少固体,就有多少个 固相。
2、 物种数S :系统中所含的化学物质。
3、 组分数K :足以表示系统中各相组成所需要的最少独立物种数。
4、 独立化学平衡数R ,独立溶度关系数R ’
5、
'K S R R =--
6、 自由度:在不引起旧相消失和新相形成的前提下,可以在一定范围内独立变动的强度性质。
7、 相律:
2f K φ=-+(只考虑温度和压力)φ为相数
普遍式:
f K n φ=-+
第五章 电化学
1、(1)原电池:正极是阴极(还原极);负极是阳极(氧化极)。 (2)电解池:正极是阳极(氧化极);负极是阴极(还原极)。
2、法拉第定律:当电流通过电解质溶液时,通过电极的电荷量与发生电极反应的物质的
量成正比:Q
nF =,其中1196485F C mol -=
,n 的数值就等于该离子的价态变化数。 3、(1)溶液电阻()R
l A ρ= ,l 为两电极间的距离,A 为浸入溶液的电极面积,ρ为电阻率。
(2)电导率1
l G A κρ??
=
= ??? ()1S m - ,G 是倒数电导。 (3)摩尔电导率()21m c S m mol κ-?=
强电解质的摩尔电导率与物质的量溶度c
:(1m m ∞?=?-
弱电解质的摩尔电导率(以HAc 为例): ()()()m m m HAc H Ac λλ∞∞+∞-?=+
()()()m m m HCl NaAc NaCl ∞∞∞=?+?-?
4、电导测定应用:
(1)求弱电解质的电离度α和电离平衡常数:m m α
∞
=ΛΛ
22
1()
m c m m m c c K αα∞∞Λ==-ΛΛ-Λ
(2)求微溶盐的溶解度和溶度积: 饱和溶液的溶度:2()(((m m H O c κκκ∞∞
-=
=ΛΛ盐)
盐)盐), 溶解度:s Mc = 溶度积(
m n A B ):()()()()n m
n m n m sp K c A c B mc nc +
-????==??????
5、溶液中的离子的活度和活度系数:
z z v v M A v M v A +-+-+-→+
(1)电解质的化学势可用各个离子的化学势之和表示:
v v μμμ++--=+
(ln )(ln )
ln ln v v v RT a v RT a v v RT a a RT a
μμμμμ+-??+++---??++--+-?+=+++=++=+
(2)离子平均活度a ±,与离子平均质量摩尔溶度m ±和离子平均活度系数γ±的关系: a m m γ?±±±=
(3)对强电解质v v M A +-来说,令v v v +-=+,定义离子平均活度v v v a a a +-±+-= ,
离子平均活度系数v
v v γγγ+-±
+-= ,离子平均质量摩尔溶度v v v m m m +-±+-= 。
(4) 在稀溶液情况下,影响强电解质离子平均活度系数γ±的主要因素是浓度和离子价数,而且离子价数比浓度的影响更加显
著。溶液离子强度定义:
21
2B B B
I m z =
∑ (m 是离子的质量摩尔浓度,z 是离子价数,B 是某种离子)
ln A γ±=-(温度和溶剂指定,'A 为常数)
6、可将化学能转化为电能的装置叫电池,若此转化是以热力学可逆方式进行的,则称为“可逆电池”。在可逆电池中,系统吉布斯函数的降低'()r m T p G ?,等于系统对外所做 的最大功'r W 此时电池两极间的电势差可达最大值,称为该电池的电动势
E ,
即:
'()'r m T p r G W nFE ?==-
7、热力学意义上的可逆电池具备的两个条件:
(1)可逆电池放电时的反应与充电时的反应必须互为逆反应。 (2)可逆电池所通过的电流必须为无限小。 8、能斯特方程:
反应温度为T 时,电池反应:aA bB gG hH +→+
方程:ln g h
G H a b A B
a a RT E E nF a a ?
=- (n 是电极反应中得失电子数,B a 是反应物质B 的活度)
9、求算电池标准电动势:r m E G nF ?
?=-?
10、电动势E 及其温度系数
()p E
T ??与电池反应热力学量的关系:
r m p p
G E nF T T ???????=- ? ?
???????r m p E S nF T ????= ???? 定温条件,反应的可逆热效应:r
r m p E Q T S n F T T ???=?= ???? r m r m r m p
E H G T S nFE nFT T ???
?=?+?=-+ ????
11、在任何温度下,H +
的标准摩尔生成吉布斯函数f m G ?
? 、标准摩尔生成焓f m H ??及
标准摩尔熵m S ?
均为零。
电极电势的表示:ln
(RT a
nF a ???=-
(还原态)氧化态)
12、电极电势及其电池电动势的应用:
(1)判断反应趋势:电势越低,越易失去电子;电势越高,越易得到电子。
两个电极进行比较时,在??
值相差较大,或活度相近的情况下,可以用数据直接判断反应趋势,否则,均必须比较?值方可
判断。
(2)求化学反应的平衡常数:ln r m
G nFE RT K ?
?
?
?=-=- ,则ln K ?
=
nFE RT
?
(3)求微溶盐活度积:微溶盐活度积sp K 实质就是微溶盐溶解过程的平衡常数。 (4)求离子平均活度系数:测定一电池的电动势E ,再由?
?
求得E ?
后,依据能斯特方程求算电池电解质溶液的离子平均活度a ±
及离子平均活度系数γ±。
13、(1)当有电流通过电极时,发生的必然是不可逆的电极反应,此时的电极电势i ?与可逆电极电势r ?不同。
(2)电极在有电流通过时所表现的电极电势i ?与可逆电极电势r ?产生偏差的现象称为“电极的极化”;偏差的大小(绝对值)
称为“过电势”i r
η
??=-
(3)电极极化,阳极电势升高,阴极电势降低:
()i r ??η=+阳极 ; ()i r ??η=-阴极
第六章 化学动力学基本原理
1、反应速率的表示法:d J
dt
ξ=
对于任意化学反应:aA bB gG hH +→+ ,
其反应速率:1111G A B H
dn dn dn dn J a dt b dt g dt h dt =-
=-==
8、 有许多的速率公式:[][]
r
k A B α
β
=…
定义反应级数:n α
β=++…
3、对于基元反应:aA bB gG hH +→+ ,
其速率公式:[][]
a b
r k A B =
4、 速率常数k
311/()n mol dm s --- ,n 是反应级数。
5、几种简单级数反应的速率公式:(
是反应物的起始浓度,x 为t 时刻反应物已反应掉的浓度)
5、 阿累尼乌斯经验公式:
2a dT RT
= Ea RT k Ae -?= (a E 称为实验活化能,一般被看做与温度无关的常数,单位:1
1J mol mol --
或kJ )
6、有效碰撞数q 的计算:c
E RT
q
e -=
第七、八章 表面现象和分散系统
1、在一定的温度与压力下,对一定的液体来说,扩展表面所做的表面功'W δ应与表面积dA 成正比,以σ表示比例系数:
'W dA δσ=
若扩展过程可逆:,(
)T p G A
σ
?=? σ可称为:表面吉布斯函数,表面能(2*J m -)
;表面张力(1
*N m -)。 2、弯曲液面下的附加压力:2p r
σ
?=
(方向指向曲面球心,即无论凹凸液面,球内压力总是大于球外压力)。
曲率对蒸汽压的影响: 开尔文公式:'2ln
'r p M
p RTr σρ
=
'r p 为饱和蒸汽压,'p 为平面液体蒸汽压
3、毛细管现象:2cos h
gR
σθρ=
(R 为毛细管半径),完全润湿时:θ=0.。
4、气体在固体表面的吸附: (1)吸附等量式:2ln ads m H p T RT -????
=
?
???等量
(ads m H ?是吸附热,为负;p 为吸附质平衡分压)
(2)朗格缪尔等温式:1kbp
a k bp
θ==
+(a 为吸附量,)
5、物理吸附与化学吸附:
第六章
1、设每种分布的微观状态数为j t ,那么系统的总微观状态数就等于各种分布的微观状态
数之和:j
t
Ω=
∑
2、波尔兹曼定理:ln S
k =Ω(231.3810k R L -==?)
3、斯特林近似:ln !ln N N N N ≈-
4、分子配分函数:
最概然分布方式:i i i i kT i n g e N g e ξξ--=∑i j kT
i i kT
j j n g e n g e ξξ--?=(i ξ为i 级能量值,g 为简并度)
厨师必须知道的烹饪小技巧与烹饪基础知识
厨师必须知道的烹饪小技巧与烹饪基础知识 很多厨师向我们反映。说他们制作出来的一些菜肴这里那里出了问题。依我看。问题不是出在你这里。而是因为你缺乏经验所致。对于一个厨师来说、经验就是他的最宝贵的财产。任何东西都换不来经验。下面就给大家介绍一些烹饪中的经验之谈。都是非常实用。并且是一些厨师们日基月累。而累积的经验。下面就给大家详细的介绍这些厨艺中最宝贵的经验 1.“炖”的方法和窍门 炖有两种方法: 一、不隔水的炖:不隔水炖法是将原料在开水烫去血污和腥膻气味,再放人制的器皿,加葱、、酒等调味品和水(加水量一般可掌握比原料的稍多一些,如一斤原料可加一斤半到二斤水),加盖,直接放在火上烹制。烹制时,先用旺火煮沸,撇去泡沫,再移微火上炖至酥烂。炖煮的时间,可根据原料的性质而定,一般约二、三小时左右。 二、隔水炖法:隔水炖法是将原料在沸水烫去腥污后,放入瓷制、制的钵,加葱、、酒等调味品与汤汁,用纸封口,将钵放人水锅(锅的水需低于钵口,以滚沸水不浸人为度),盖紧锅盖,不使漏气。以旺火烧。使锅的永不断滚沸,大约三小时左右即可炖好。这种炖法可使原料的鲜香味不易散失,制成的菜肴香鲜味足,汤汁清澄。也有的把装好的原料的密封钵放在沸滚的蒸笼上蒸炖的,其效果与不隔水炖基本相同,但因蒸炖的温度校高,必须掌握好蒸的时间。蒸的时间不足,会使原料不熟和少香鲜味道;蒸的时间过长,也会使原料过于熟烂和散失香鲜滋味。 2.炒菜保持鲜绿的心得 蔬菜在烹制时往往变成黄色,怎样让它保持鲜绿色呢? 1) 盖锅要适时,如果一开始把锅盖得严严的,就会褪色发黄,据说这是因为蔬菜的叶绿素中含有镁,这种物质在做菜时会被蔬菜的另一种物质——有机酸(含氢离子)替代出来,生成一种黄绿色的物质。如果先炒或煮一下,让这种物质受热先发挥出来,再盖好锅盖,就不会使叶绿素受酸的作用而变黄了。 2)若为了美观,可在烹调时稍加些小打或碱面,能使蔬菜的颜色更加鲜艳透明,切不影响菜的营养价值。 3."炒"的学问:生炒、熟炒、软炒、干炒的方法及要点 “炒”是最广泛使用的一种烹调方法。适用于炒的原料,多系经刀工处理的小型丁、丝、条、球等。炒用小油锅,油量多少视原料而定。操作时,切记一定要先将锅烧热,再下油。一般用旺火热油,但火力的大小和油温的高低要根据原料而定。操作时,依次下料,用手勺和铲翻拌,动作要敏捷,关键的原则是断生即好。它的特点是脆、嫩、滑。具体方法可分生炒、
四川大学物理化学期末考试题及答案(B卷)
四川大学期末考试试题 (2010—2011学年第一学期) 课程代码:(Ⅰ)—1 课程名称:物理化学任课教师:李泽荣、何玉萼适用专业:化学、应化、材化专业印数:200份班级:学号:姓名:成绩 注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第1页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印
注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第2页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印 2200 2400 2300 t/℃ a
注:1、试题字迹务必清晰,书写工整。本卷3页,本页为第3页 2、题间不留空,一般应题卷分开教务处试题编号: 3、务必用16K纸打印 2010级物理化学(Ⅰ)-1期末考试题B卷答案
一、选择题(12分,每题2分) 1、B 2、A 3、B 4、C 5、C 6、D 二、填空题(20分,每空2分) 1、> ;> ;> ;= 2、 3、 ; 4、1 ;2 5、y A >0,B x >x A ;纯A ;纯B 6、- 三、(16分) 解:33.3kJ R P vap m Q Q H n H ==?=?= 4分 kJ 2.32.383324.81)(=??==≈?=nRT pV V p W g R 2分 kJ 1.302.33.33=-=+=?W Q U 2分 1-3vap K J 9.862 .383103.33?=?=?==?b m R T H T Q S 体 2分 -186.9J K R Q Q S T T ?==-=-?环环 2分 0R R G H T S Q Q ?=?-?=-= 2分 kJ 2.3-=-=-?=?-?=?R R W Q U S T U F 2分 四、(12分) 解: ∵ A A B B P x P x P ** +=总 ∴ 13 78.844 A B P P **+= 6分 1182.722 A B P P **+= 联立求解得 kPa P A 5.90=* 6分 kPa P B 9.74=* 五、(20分) 解:1.(7分) 2.
物理化学期末考试试题(1)
物理化学期末考试试题(1)
《物理化学》上册期末试卷本卷共 8 页第1页 《物理化学》上册期末试卷本卷共 8 页第2页 化学专业《物理化学》上册期末考试试卷(1)(时间120分钟) 一、单 项选择题(每小题2分,共30分) 1、对于内能是体系状态的单值函数概念,错误理解是( ) A 体系处于一定的状态,具有一定的内能 B 对应于某一状态,内能只能有一数值不能有两个以上的数值 C 状态发生变化,内能也一定跟着变化 D 对应于一个内能值,可以有多个状态 2、在一个绝热刚瓶中,发生一个放热的分子数增加的化学反应,那么( ) A Q > 0,W > 0,?U > 0 B Q = 0,W = 0,?U < 0 C Q = 0,W = 0,?U = 0 D Q < 0,W > 0,?U < 0 3、一种实际气体,其状态方程为PVm=RT+αP (α<0),该气体经节流膨胀后,温度将( ) A 、升高 B 、下降 C 、不变 D 、不能确定 4、在隔离体系中发生一个自发过程,则ΔG 应为( ) A. ΔG < 0 B. ΔG > 0 C. ΔG =0 D. 不能确定 5、理想气体在绝热条件下,在恒外压下被压缩到终态,则体系与环境的熵变( ) A 、ΔS 体>0 ΔS 环>0 B 、ΔS 体<0 ΔS 环<0 C 、ΔS 体>0 ΔS 环<0 D 、ΔS 体>0 ΔS 环=0 6、下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否 无关( ) (A ). S 、G 、F 、C V (B) U 、H 、P 、C V (C) G 、F 、H 、U (D) S 、U 、H 、G 7、在N 个独立可别粒子组成体系中,最可几分布的微观状态数t m 与配分函数q 之间的关系为 ( ) (A) t m = 1/N ! ·q N (B) t m = 1/N ! ·q N ·e U /kT (C) t m = q N ·e U /kT (D) t m = N ! q N ·e U /kT 8、挥发性溶质溶于溶剂形成的稀溶液,溶液的沸点会( ) A 、降低 B 、升高 C 、不变 D 、可能升高或降低 9、盐碱地的农作物长势不良,甚至枯萎,其主要原因是( ) A 、天气太热 B 、很少下雨 C 、水分倒流 D 、肥料不足 10、在恒温密封容器中有A 、B 两杯稀盐水溶液,盐的浓度分别为c A 和c B (c A > c B ),放置足够长的时间后( ) (A) A 杯盐的浓度降低,B 杯盐的浓度增加 ; (B) A 杯液体量减少,B 杯液体量增加 ; (C) A 杯盐的浓度增加,B 杯盐的浓度降低 ; (D) A 、B 两杯中盐的浓度会同时增大 。 11、298K 、101.325kPa 下,将50ml 与100ml 浓度均为1mol·dm -3 萘的苯溶液混合,混合液的化学势μ为:( ) (A) μ = μ1 + μ2 ; (B) μ = μ1 + 2μ2 ; (C) μ = μ1 = μ2 ; (D) μ = ?μ1 + ?μ2 。 12、硫酸与水可组成三种化合物:H 2SO 4·H 2O (s )、H 2SO 4·2H 2O (s )、H 2SO 4·4H 2O (s ),在P θ 下,能与硫酸水溶液共存的化合物最多有几种( ) A 、1种 B 、2种 C 、3种 D 、4种 13、A 与B 可以构成2种稳定化合物与1种不稳定化合物,那么A 与B 的体系 可以形成几种低共熔混合物( ) A 、5种 B 、4种 C 、3种 D 、2种 14、对反应CO(g)+H 2O(g)=H 2(g)+CO 2(g) ( ) (A) K p $=1 (B) K p $=K c (C) K p $>K c (D) K p $ <K c 15、 一定温度下,一定量的 PCl 5(g)在某种条件下的解离度为α,改变下列条件, 何者可使α增大?( ) 题号 一 二 三 四 五 六 七 八 得 分 得分 得分 评卷人 复核人 学院: 年级/班级: 姓名: 学号: 装 订 线 内 不 要 答 题
物理化学期末考试大题及答案
三、计算 1、测得300C时某蔗糖水溶液的渗透压为252KPa。求 (1)该溶液中蔗糖的质量摩尔浓度; (2)该溶液的凝固点降低值; (3)在大气压力下,该溶液的沸点升高值已知Kf =1.86K mol–1Kg–1 , Kb =0.513K mol–1Kg–1 ,△vapH0m=40662J mol–1 2、有理想气体反应2H2(g)+O2(g)=H2O(g),在2000K时,已知K0=1.55×107
1、计算H2 和O2分压各为1.00×10 4 Pa, 水蒸气分压为1.00×105 Pa的混合气体中,进行上述反应的△rGm,并判断反应自发进 行的方向。 2、当H2和O2分压仍然分别为1.00×10 4 Pa 时。欲使反应不能正向自发进行,水蒸气分 压最少需多大? △rGm=-1.6﹡105Jmol–1;正向自发;P (H2O)=1.24﹡107Pa。 装 订 线
在真空的容器中放入固态的NH4HS,于250C 下分解为NH3(g)与H2S(g), 平衡时容器内的压力为66.6kPa 。 (1)当放入NH4HS时容器中已有39.99kPa 的 H2S(g),求平衡时容器内的压力;(2)容器中已有6.666kPa的NH3(g),问需加多大压力的H2S(g),才能形成NH4HS 固体。 1)77.7kPa 2)P(H2S)大于166kPa。
4、已知250C时φ0(Fe3+/ Fe) =-0.036V,φ0(Fe3+/ Fe2+) =-0.770V 求250C时电极Fe2+|Fe的标准电极电势φ0(Fe2+/ Fe)。 答案: φ0(Fe2+/ Fe)= -0.439V 5、0.01mol dm-3醋酸水溶液在250C时的摩尔电导率为1.62×10-3S m2 mol–1,无限稀释时的摩尔电导率为39.07×10-3S m2 mol–1 计算(1)醋酸水溶液在250C,0.01mol dm-3
物理化学(重点)超强总结
第一章热力学第一定律 1、热力学三大系统: (1)敞开系统:有物质和能量交换; (2)密闭系统:无物质交换,有能量交换; (3)隔绝系统(孤立系统):无物质和能量交换。 2、状态性质(状态函数): (1)容量性质(广度性质):如体积,质量,热容量。 数值与物质的量成正比;具有加和性。 (2)强度性质:如压力,温度,粘度,密度。 数值与物质的量无关;不具有加和性,整个系统的强度性质的数值与各部分的相同。 特征:往往两个容量性质之比成为系统的强度性质。 3、热力学四大平衡: (1)热平衡:没有热隔壁,系统各部分没有温度差。 (2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力相同 (3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而变化。 (4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随时间而变化。 4、热力学第一定律的数学表达式: ?U = Q + W Q为吸收的热(+),W为得到的功(+)。
12、在通常温度下,对理想气体来说,定容摩尔热容为: 单原子分子系统 ,V m C =32 R 双原子分子(或线型分子)系统 ,V m C =52R 多原子分子(非线型)系统 ,V m C 6 32 R R == 定压摩尔热容: 单原子分子系统 ,52 p m C R = 双原子分子(或线型分子)系统 ,,p m V m C C R -=,72 p m C R = 多原子分子(非线型)系统 ,4p m C R = 可以看出: ,,p m V m C C R -= 13、,p m C 的两种经验公式:,2p m C a bT cT =++ (T 是热力学温度,a,b,c,c ’ 是经 ,2' p m c C a bT T =++ 验常数,与物质和温度范围有关) 14、在发生一绝热过程时,由于0Q δ=,于是dU W δ= 理想气体的绝热可逆过程,有:,V m nC dT pdV =- ? 22 ,11 ln ln V m T V C R T V =- 21,12ln ,ln V m p V C Cp m p V ?= ,,p m V m C pV C γγ=常数 =>1. 15、-焦耳汤姆逊系数:J T T =( )H p μ??- J T μ->0 经节流膨胀后,气体温度降低; J T μ-<0 经节流膨胀后,气体温度升高; J T μ-=0 经节流膨胀后,气体温度不变。 16、气体的节流膨胀为一定焓过程,即0H ?=。 17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温度相同而在反应过程中只做体积功不做其他功时,化学反应所 吸收或放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度:()()() n B n B B ξ ν-= 末初 (对于产物v 取正值,反应物取负值) 1ξ=时,r r m U U ξ ??= ,r r m H H ξ ??= 19、(1)标准摩尔生成焓(0 r m H ?):在标准压力和指定温度下,由最稳定的单质生成单位物质的量某物质的定压反应热,为该物质的
2016下期物理化学(上册)期末试题
化学化工学院《物理化学》(上)试题(A 卷) 2016~2017学年第一学期15级化学、应化、制药、化工专业 时量:120min,总分100分,考试形式:闭卷 一、选择题 (15×2=30分): 1、在绝热刚性反应器中发生一个放热反应,该过程: A 、ΔU = 0 B 、ΔH = 0 C 、ΔS = 0 D 、ΔG = 0 2、1 mol 单原子分子理想气体,从始态p 1= 202.650kPa ,T 1= 273 K 沿着p /V =常数的途径可逆变化到终态为p 2=405.300k Pa 则ΔH 等于: A 、-17.02 kJ B 、17.02 kJ C 、-10.21 kJ D 、10.21 kJ 3、下列函数中为强度性质的是: A 、S B 、(?U /?V )S C 、(?G /?p )T D 、C V 4、含有非挥发性溶质B 的水溶液,在 101.325k Pa 、270.15 K 时开始析出冰,已知水的 K f =1.86 K ?kg ?mol -1,K b =0.52 K ?kg ?mol -1,该溶液的正常沸点是: A 、370.84 K B 、372.31 K C 、376.99 K D 、373.99 K 5、在一定温度和压力下,对于一个化学反应,能用以判断其反应方向的是: A 、Δr G m B 、K p C 、Δr H m D 、Δr G m 6、将CaCO 3(s)、CaO(s)和CO 2(g)以任意比例混合,放入一密闭容器中,一定温度下建立 化学平衡,则系统的组分数C 、相数P 、条件自由度数F 分别为: A 、3,3,1 B 、3,2,2 C 、2,3,0 D 、2,2,1 7、已知反应2221()2 H O H O l + →的()r m H T ?,下列说法不正确的是: A 、()r m H T ?为2()H O l 的生成焓 B 、()r m H T ?为2H 的燃烧焓 C. r m H ?与r m U ?数值不等 D. r m H ?与r m H θ?数值相等 8、热力学第一定律以dU Q pdV δ=-形式表达时,其使用的条件为: A 、理想气体可逆过程 B 、封闭系统只做膨胀功的过程 C. 理想气体等压过程 D. 封闭系统的恒压过程 9、在绝热钢瓶中发生一个放热的分子数增加的化学反应: A 、Q ﹥0, W ﹥0, U ?﹥0 B 、Q =0, W =0, U ?﹥0 C 、Q =0, W =0, U ?=0 D 、Q ﹤0, W ﹥0, U ?﹤0 10、在268K,101.325KPa 下1mol 过冷液体水结冰过程( ) A.sys S ?<0 amb S ?<0 total S ?<0 B. sys S ?>0 amb S ?>0 total S ?>0 C. sys S ?<0 amb S ?>0 total S ?<0 D. sys S ?<0 amb S ?>0 total S ?>0 11、对于双原子理想气体()s T V ??为( )
★物理化学(上)期末试题及参考答案
一、填空题(每小题2分,共20分) 1、热力学第零定律是指: 。 2、熵与热力学概率之间的函数关系式是。 3、补全热力学函数关系式:C P= (?S/?T)P 4、一定量的单原子理想气体定压下从T1变化到T2的熵变与定容下从T1变化到T2的熵变之比为: 5、化学势的表示式中,是偏摩尔量。 6、稀溶液的依数性包括、、和。 7、反应NH4HS(s)=NH3(g)+H2S(g),在298K时测得分解压为66.66Pa,则该温度下该反应的K pΘ= ;K p= 。 8、1atm压力下水和乙醇系统的最低恒沸混合物含乙醇质量分数为0.9557,现将含乙醇50%的乙醇水溶液进行分馏,最终得到的物质为。 9、水在101.3kPa时沸点为373K,汽化热为40.67 kJ/mol(设汽化热不随温度变化);毕节学院的大气压约为85.5 kPa,则在毕节学院水的沸点为K。 10、反应NH4HS(s)=NH3(g)+H2S(g)已达平衡;保持总压不变,往系统中充入一定量的惰性气体,平衡移动方向为。 二、选择题(每小题2分,共30分) 1、下列属于化学热力学范畴的是() (A)物质结构与性能的关系(B)化学反应速率 (C)化学变化的方向和限度(D)反应机理 2、下列关于热力学方法叙述正确的是() (A)热力学研究所得的结论不适用于分子的个体行为 (B)热力学可以解决某条件下怎样把一个变化的可能性变为现实性的问题 (C)经典热力学详细讨论了物质的微观结构 (D)经典热力学常需计算一个变化所需要的时间 3、下列函数中为强度性质的是:() (A) S (B) (?G/?p)T(C) (?U/?V)T(D) C V 4、一定量的纯理想气体,下列哪组量确定后,其他状态函数方有定值。() (A)T (B)V (C)T、U (D)T、p
烹饪基础知识大全 烹饪烘焙原料常识
烹饪基础知识大全烹饪烘焙原料常识 为了让大家更好地熟悉烹饪及烘焙,我特收藏这些基础贴——介绍各种材料、常识、小窍门等等:有一定的中英法文对照,有一些实例~~~常常看到有些朋友因为对原料不熟悉,而无从下手。 一、淀粉类 1、玉米淀粉Corn Starch Maizena 又叫玉米粉、粟米淀粉、粟粉、生粉, 还有的地方管它叫豆粉(这个的确少见),是从玉米粒中提炼出的淀粉。包括玉米淀粉在内的淀粉类(很多其他类谷物也可以提炼出淀粉)在烹饪中是作为稠化剂使用的,用来帮助材料质地软滑以及汤汁勾芡之用。而在糕点制作过程中,在调制糕点面糊时,有时需要在面粉中掺入一定量的玉米淀粉。玉米淀粉所具有的凝胶作用,在做派馅时也会用到,如克林姆酱。另外,玉米淀粉按比例与中筋粉相混合是蛋糕面粉的最佳替代品,用以降低面粉筋度,增加蛋糕松软口感
2、太白粉Potato Starch Fecule (de pomme de terre) 即生的马铃薯淀粉,加水遇热会凝结成透明的粘稠状,在中式烹调(尤其是台菜)上经常将太白粉加冷水调匀后加入煮好的菜肴中做勾茨,使汤汁看起来浓稠,同时使食物外表看起来有光泽。港菜茨汁一般则惯用玉米粉。但是,太白粉勾芡的汤汁在放凉后会变得较稀,而玉米淀粉勾芡的汤汁在放凉后不会有变化。太白粉不能直接加热水调匀或放入热食中,它会立即凝结成块而无法煮散。 3、番薯粉Sweet Potato Starch 番薯有红薯、红苕、山芋、地瓜、白薯等,它和马铃薯、木薯并称为世界三大薯类。 番薯粉也叫地瓜粉,它是由蕃薯淀粉等所制成的粉末,一般地瓜粉呈颗粒状,有粗粒和细粒两种,通常家中购买以粗粒地瓜粉为佳。地瓜粉与太白粉一样,融于水中后加热会呈现粘稠状,而地瓜粉的粘度较太白粉更高,因此,在中菜勾芡时较少使用地瓜粉,因为粘度较粘而难以控制。地瓜粉应用于中式点心制作较多。地瓜粉同样也可以用于油炸,在腌好的排骨上沾上粗粒地瓜粉油炸后,地瓜粉可呈现酥脆的口感,同时颗粒状的表皮也可以带来视觉上的效果。
物理化学期末考试题库(上下册)
一 化学热力学基础 1-1 判断题 1、可逆的化学反应就是可逆过程。(×) 2、Q 和W 不是体系的性质,与过程有关,所以Q+W 也由过程决定。(×) 3、焓的定义式H=U+pV 是在定压条件下推导出来的,所以只有定压过程才有焓变。(×) 4、焓的增加量ΔH 等于该过程中体系从环境吸收的热量。(×) 5、一个绝热过程Q=0,但体系的ΔT 不一定为零。(√) 6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。(√) 7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q 、W 、ΔU 及ΔH 是相等的。(×) 8、任何物质的熵值是不可能为负值或零的。(×) 9、功可以全部转化为热,但热不能全部转化为功。(×) 10、不可逆过程的熵变是不可求的。(×) 11、任意过程中的热效应与温度相除,可以得到该过程的熵变。(×) 12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。(√) 13、绝热过程Q=0,而T Q dS δ= ,所以dS=0。(×) 14、可以用一过程的熵变与热温商的大小关系判断其自发性。(√)
15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。(×) 16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。(×) 17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体系),该过程W>0,ΔU>0。(×) 18、体系经过一不可逆循环过程,其体S ?>0。(×) 19、对于气态物质,C p -C V =nR 。(×) 20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔板,空气向真空膨胀,此时Q=0,所以ΔS=0。(×) 21、高温物体所含的热量比低温物体的多,因此热从高温物体自动流向低温物体。(×) 22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物质的温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。(×) 23、在标准压力下加热某物质,温度由T 1上升到T 2,则该物质吸收的 热量为?=21 T T p dT C Q ,在此条件下应存在ΔH=Q 的关系。 (√) 24、带有绝热活塞(无摩擦、无质量)的一个绝热气缸装有理想气体,内壁有电炉丝,将电阻丝通电后,气体慢慢膨胀。因为是一个恒压过程Q p =ΔH ,又因为是绝热体系Q p =0,所以ΔH=0。(×) 25、体系从状态I 变化到状态Ⅱ,若ΔT=0,则Q=0,无热量交换。(×) 26、公式Vdp SdT dG +-=只适用于可逆过程。 ( × ) 27、某一体系达到平衡时,熵最大,自由能最小。
物理化学期末考试试卷及答案10
期末试卷 课程名称: 物理化学A 考试时间: 120 分钟 考试方式: 闭卷 (开卷/闭卷) (卷面总分100分,占总成绩的 60 %) 题号 一 二 三 四 五 六 七 八 总分 题分 10 20 8 10 10 10 20 12 核分人 得分 复查人 一、填空题(每小题2分,共10分) 1、实际气体的0???? ????=-H T J P T μ,经节流膨胀后该气体的温度将 。 2、从熵的物理意义上看,它是量度系统 的函数。 3、稀溶液中溶剂A 的化学势 。 4、在ξ-G 曲线的最低点处m r G ? ,此点即为系统的平衡点。 5、一定温度下,蔗糖水溶液与纯水达到渗透平衡时的自由度数等于 。 二、单项选择题(每小题2分,共20分) 1、在标准状态下,反应 C 2H 5OH (l )+ 3O 2(g) →2CO 2(g) + 3H 2O(g)的反应焓为 Δr H m Θ , ΔC p >0。下列说法中正确的是( ) (A)Δr H m Θ 是C 2H 5OH (l )的标准摩尔燃烧焓 (B)Δr H m Θ 〈0 (C)Δr H m Θ=Δr Um 0 (D)Δr H m Θ 不随温度变化而变化 2、当理想气体其温度由298K 升高到348K ,经(1)绝热过程和(2)等压过程,则两过 程的( ) (A)△H 1>△H 2 W 1 0 ΔA>0 (B)ΔS>0 ΔA<0 (C)W<0 ΔG<0 (D)ΔH>0 ΔS<0 (E)ΔU>0 ΔG =0 得分 评卷人 得分 评卷人 得分 评卷人 得分 评卷人 准考证号和姓名必 须由考生本人填写 △△△△△△△ △△△△△△△ 该考场是 课混 考场。 混编考场代号: 考 座准 考 证 号 姓 名 ○ ○ ○ ○ ○ (装 订 线 内 不 要 答 题 ) ○ ○ ○ ○ ○ ○ △△△△△△△ △△△△△△△ 准考证号、 姓名、 学 院和专业必须由考生 本人填写 △△△△△△△ △ △△△△△△ 场 代 号: △△△△△△△△△△△△△△ 座位序号由考生本人填写 位 序 号 △△△△△△△ △△△△△△△ 姓 名 学 号 ○ ○ ○ ○ ○ (装 订 线 内 不 要 答 题 ) ○ ○ ○ ○ ○ ○ 学院 专业 ,考试作弊将带来严重后果! 华南理工大学期末考试 《 物理化学 》(48、56、64学时)试卷(B) 1. 考前请将密封线内填写清楚; 所有答案请直接答在试卷上; .考试形式:闭卷; 本试卷共 四 大题,满分100分, 考试时间120分钟。 选择题.(每题2分, 10题共20分) 1. 已知反应CO(g)+1/2O 2(g) → CO 2(g) 的焓变为△H ,下列说法中何 △H 是CO 2(g) 的生成焓 B. △H 是CO(g)的燃烧焓 △H 是负值 D. △H 与反应△U 的数值不等 2. 室温下,10 p O 的理想气体绝热节流膨胀至 5p O 的过程有: (1) W < 0 ; (2) T 1> T 2; (3) Q = 0 ; (4) △S > 0 A. (3)、(4) B. (2)、(3) C. (1)、(3) D. 、(2) 3. 反应N 2(g) + 3H 2(g) = 2NH 3(g) 可视为理想气体间反应,在反应 达平衡后,若维持系统温度与压力不变,而于系统中加入惰性气体,则 A. K p不变,平衡时N2和H2的量将增加,而NH3的量减少 B. K p不变,且N2, H2, NH3的量均不变 C. K p不变,平衡时N2和H2的量将减少,而NH3的量增加 D. K p增加,平衡时N2和H2的量将减少,NH3的量增加 4. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A 和k B,且知k A>k B,则当A和B压力相同时,在该溶剂中所溶解的量是( ) A. A的量大于B的量 B. A的量小于B的量 C. A的量等于B的量 C. A的量与B的量无法比较 5. NH 4HS(s) 和任意量的 NH 3 (g) 及 H 2 S(g) 达平衡时有( ) A. C = 2,P = 2,F = 2; B. C = 1,P = 2,F = 1; C. C = 2,P = 3,F = 2; D. C = 3,P = 2,F = 3; 6. 下列纯物质两相平衡有关的描述,不正确的是( ) A.沸点将随压力增加而升高 B. 熔点将随压力增加而升高 C.蒸气压将随温度升高而加大 D. 升华温度将随压力增大而升高 7. 同一温度、压力下,一定量某纯物质的熵值______________ 。 A. S(气)>S(液)>S(固) B. S(固)>S(液)>S(气) C. S(气)=S(液)=S(固) D. S(液)>S(气)>S(固) 8. 101325Pa, 下,水蒸发为水气,这过程系统哪一种热力学函数变化为 零。______________ 。 A. ΔU B ΔH C ΔS D ΔG 第二章 热力学第一定律 内容摘要 ?热力学第一定律表述 ?热力学第一定律在简单变化中的应用 ?热力学第一定律在相变化中的应用 ?热力学第一定律在化学变化中的应用 一、热力学第一定律表述 U Q W ?=+ d U Q W δδ=+ 适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+? 2、U 是状态函数,是广度量 W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 2、基础公式 热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ 理想气体 ? 状态方程 pV=nRT ? 过程方程 恒温:1122p V p V = ? 恒压: 1122//V T V T = ? 恒容: 1122/ / p T p T = ? 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--= 1111 22 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ 相变 H m W = -p ΔV 无气体存在: W = 0 有气体相,只需考虑气体,且视为理想气体 ΔU = n Δ 相变 H m - p ΔV 2、相变焓基础数据及相互关系 Δ 冷凝H m (T) = -Δ蒸发H m (T) Δ凝固H m (T) = -Δ熔化H m (T) Δ 凝华 H m (T) = -Δ 升华 H m (T) (有关手册提供的通常为可逆相变焓) 3、不可逆相变化 Δ 相变 H m (T 2) = Δ 相变 H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆; 2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤; 3.除可逆相变化,其余步骤均为简单变化计算. 4.逐步计算后加和。 四、热力学第一定律在化学变化中的应用 1、基础数据 标准摩尔生成焓 Δf H θm,B (T) (附录九) 标准摩尔燃烧焓 Δc H θ m.B (T)(附录十) 2、基本公式 ?反应进度 ξ=△ξ= △n B /νB = (n B -n B.0) /νB ?由标准摩尔生成焓计算标准摩尔反应焓 Δr H θm.B (T)= ΣνB Δf H θ m.B (T) ?由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θ m.B (T)=-Σ νB Δc H θ m.B (T) (摩尔焓---- ξ=1时的相应焓值) ?恒容反应热与恒压反应热的关系 Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) ?Kirchhoff 公式 微分式 d Δr H θ m (T) / dT=Δr C p.m 积分式 Δr H θm (T 2) = Δr H θ m (T 1)+∫Σ(νB C p.m )dT 本章课后作业: 教材p.91-96(3、4、10、11、16、17、38、20、23、24、28、30、33、34) 刀工基本知识 刀工基本知识 练好刀工技巧,是一名厨师的必备功课。高超的刀工技巧,对菜肴成品的呈现起着锦上添花的作用。 一、刀工的重要性、基本要求与要领 1.刀工的重要性 刀工,是厨师根据烹调的需要,把各种不同的原料加工成一定形状的成品的技巧。刀工的好坏,直接关系到菜肴的质量、美观、制菜速度,因此刀工是烹调技术中必不可少的一个重要环节。 随着人们生活水平的提高,对刀工的要求也越来越高,已经不再局限于对改变原料的形状,还要求对原料达到美化的效果,使烹调出的菜肴变得绚丽多彩,带给人以赏心悦目的感觉。 中式菜肴讲究色、香、味、形、器的美感性,而菜肴的形色与刀工有着十分紧密的关系,因此中式菜肴的烹调就非常重视刀工。几千年以来,在劳动人民的不断实践下,创造出精美绝伦的刀工技术,也丰富了刀工经验,使我国的刀工达到了较高的艺术水平。 2.刀工的基本要求 (1)刀工要与烹饪相结合 刀工是为菜肴的烹调制作做好准备,在制作的过程中,应该根据不同的烹饪方法与菜肴品种对原料施以细致加工,才能满足烹饪的需求。比如,炖、焖烹饪法,在操作的过程中所用的火力较小,所用的时间较长,菜品要酥烂,这就要求原料的形状较厚大,如是过于薄小,就易碎烂,或是成糊状。氽、爆烹饪法,在操作的过程中所用的火力较大,所用的时间较短,这就要求菜肴成品脆嫩鲜美。如果原料的形状过分厚大,就不容易熟透,因此切制的菜品应以薄小为最佳。总之,刀工只有满足了菜肴的烹调要求,才有能烹调出色、香、味、形俱佳的菜品。 (2)原料改刀后要整齐、均匀 每一种原料在经过刀工的处理后,不管是块、条、丁、片、丝、粒,或是其他任何形状,都必须呈现整齐、均匀的质感。换句话说,原料的改刀既要长短相等,粗细合理、厚薄均匀,也要块与块、条与条、片与片之间,能够利落地分开。若出现粗细不均,厚薄不匀,大小不一,长短不齐,或是前面切断了、后面还连着,上面切断了、下面还连着的现象,既会影响菜肴的美观,又会因原料有厚有薄、有粗有细,造成烹饪的过程中薄的、细的先入味,粗的、厚的后入味;薄的、细的熟透了,粗的、厚的却还没有熟,等到粗的、厚的入味,或是熟透的时候,薄的、细的就过了火候。从这一点上可以看出,原料形状的整齐度、均匀度,是烹调好菜肴的前提。 东北林业大学 200x-200x学年第二学期考试试题 一、选择题(在每个小题四个备选答案中选出一个正确答案,填在题 末的括号中)(本大题共10小题,每小题1.5分,总计15分) 1. 正离子的迁移数与负离子的迁移数之和等于( ) A. >1 B. =1 C. <1 D. =0 2. 柯尔劳施离子独立运动定律适合于:( ) A. 任意浓度的强电解质溶液 B. 任意浓度的弱电解质溶液 C. 无限稀释的强或弱电解质溶液 D. 理想稀溶液 3. 醌-氢醌[C6H4O2, C6H4(OH)2] 电极属于:( ) A. 第一类电极 B. 第二类电极 C. 氧化-还原电极 D. 离子选择性电极 4. 若反应速率常数k的单位为浓度·时间-1,则该反应为:( ) A. 三级反应 B. 二级反应 C. 一级反应; D. 零级反应 5. 确定速率方程的关键是确定:( ) A. 速率常数 B. 平衡常数 C. 反应级数 D. 反应分子数 6. 催化剂能极大地改变反应速率,原因是催化剂改变了:( ) A. 反应焓变 B. 平衡常数 C. 反应熵变 D. 反应活化能 7. 一般情况下,界面张力与温度的关系是:( ) A. 温度升高界面张力降低 B. 温度升高界面张力增加 C. 温度对界面张力没有影响 D. 不能确定 8. 微小液滴的饱和蒸气压同温度下平面液体的饱和蒸气压。( ) A. 大于 B. 等于 C. 小于 D. 不一定 9. 下列属于溶胶光学性质的是( ) A. 唐南(Donnan)平衡 B. 丁铎尔(Tyndall)效应 C. 电泳 D. 扩散 10. 溶胶和高分子溶液:( ) A. 都是单相多组分系统 B. 都是多相多组分系统 C. 高分子溶液是单相多组分系统,溶胶是多相多组分系统 D. 高分子溶液是多相多组分系统,溶胶是单相多组分系统 4. 酶催化反应的主要特征是:反应条件温和,具有高的_______性和___________性。 5. 溶于水中能显著降低水的表面张力的物质通常称为?????????????????物质。 6. 铺展润湿的必要条件是????????????????????????????????????????。 7. 化学吸附的吸附力是????????????????,吸附层数是?????????层。 8. 在公式?r G m= -zFE中,E称为????????????????????,E的实验值测定要求在电流I 1 第一章热力学第一定律 选择题 1.关于焓的性质, 下列说法中正确的是() (A) 焓是系统内含的热能, 所以常称它为热焓(B) 焓是能量, 它遵守热力学第一定律 (C) 系统的焓值等于内能加体积功(D) 焓的增量只与系统的始末态有关 答案:D 。因焓是状态函数。 2.涉及焓的下列说法中正确的是() (A) 单质的焓值均等于零(B) 在等温过程中焓变为零(C) 在绝热可逆过程中焓变为零 (D) 化学反应中系统的焓变不一定大于内能变化 答案:D 。因为焓变ΔH=ΔU+Δ(pV),可以看出若Δ(pV)<0则ΔH<ΔU。 3.与物质的生成热有关的下列表述中不正确的是() (A) 标准状态下单质的生成热都规定为零(B) 化合物的生成热一定不为零(C) 很多物质的生成热都不能用实验直接测量 (D) 通常所使用的物质的标准生成热数据实际上都是相对值 答案:A 。按规定,标准态下最稳定单质的生成热为零。 4.下面的说法符合热力学第一定律的是() (A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时,其内能一定变化 (B) 在无功过程中, 内能变化等于过程热, 这表明内能增量不一定与热力学过程无关 (C)封闭系统在指定的两个平衡态之间经历绝热变化时, 系统所做的功与途径无关 (D) 气体在绝热膨胀或绝热压缩过程中, 其内能的变化值与过程完成的方式无关 答案:C 。因绝热时ΔU=Q +W =W 。(A )中无热交换、无体积功故ΔU=Q +W =0。(B )在无功过程中ΔU=Q ,说明始末态相同热有定值,并不说明内能的变化与过程有关。(D )中若气体绝热可逆膨胀与绝热不可逆膨胀所做的功显然是不同的,故ΔU亦是不同的。这与内能为状态函数的性质并不矛盾,因从同一始态出发,经绝热可逆膨胀与绝热不可逆膨胀不可能到达同一终态。 5.关于节流膨胀, 下列说法正确的是 (A)节流膨胀是绝热可逆过程(B)节流膨胀中系统的内能变化(C)节流膨胀中系统的焓值改变(D)节流过程中多孔 塞两边的压力不断变化 答案:B 6.在实际气体的节流膨胀过程中,哪一组描述是正确的: (A )Q H =p < 0 (B )Q =H p >0 (C )Q =H =p <0 (D )Q H =p <0 答案:C 。节流膨胀过程恒焓绝热且压力降低。 7.系统经一个循环后,ΔH、ΔU、Q 、W 是否皆等于零? 答:否。其中H 和U 为状态函数,系统恢复至原态后其值复原,即ΔH=0、ΔU=0。而热与功是与途径有关的函数,一般不会正好抵消而复原,除非在特定条件下,例如可逆绝热膨胀后又可逆绝热压缩回至原态,或可逆恒 温膨胀后又可逆恒温压缩回至原态等。 1. 在温度T 、容积V 都恒定的容器中,含有A 和B 两种理想气体,它们的物质的量、分压和分体积分别为nA ,pA ,VA 和nB ,pB ,VB ,设容器中的总压为p 。试判断下列公式中哪个是正确的()。 (A )A A p V n RT (B )B A B ()pV n n RT (C )A A A p V n RT (D )B B B p V n RT 答:(A )只有(A )符合Dalton 分压定律。 4. 真实气体液化的必要条件是()。 (A )压力大于C p (B )温度低于C T (C )体积等于m,C V (D )同时升高温度和压力 答:(B )C T 是能使气体液化的最高温度,温度再高无论加多大压力都无法使气体液化。 一化学热力学基础 1-1 判断题 1、可逆的化学反应就是可逆过程。(×) 2、Q和W不是体系的性质,与过程有关,所以Q+W也由过程决定。(×) 3、焓的定义式H=U+pV是在定压条件下推导出来的,所以只有定压过程才有焓变。(×) 4、焓的增加量ΔH等于该过程中体系从环境吸收的热量。(×) 5、一个绝热过程Q=0,但体系的ΔT不一定为零。(√) 6、对于一个定量的理想气体,温度一定,热力学能和焓也随之确定。(√) 7、某理想气体从始态经定温和定容两个过程达终态,这两个过程Q、W、ΔU及ΔH是相等的。(×) 8、任何物质的熵值是不可能为负值或零的。(×) 9、功可以全部转化为热,但热不能全部转化为功。(×) 10、不可逆过程的熵变是不可求的。(×) 11、任意过程中的热效应与温度相除,可以得到该过程的熵变。(×) 12、在孤立体系中,一自发过程由A B,但体系永远回不到原来状态。(√) 13、绝热过程Q=0,而T Q dS δ=,所以dS=0。(×) 14、可以用一过程的熵变与热温商的大小关系判断其自发性。 (√) 15、绝热过程Q=0,而ΔH=Q ,因此ΔH=0。(×) 16、按克劳修斯不等式,热是不可能从低温热源传给高温热源的。 (×) 17、在一绝热体系中,水向真空蒸发为水蒸气(以水和水蒸气为体 系),该过程W>0,ΔU>0。(×) 18、体系经过一不可逆循环过程,其体S ?>0。(×) 19、对于气态物质,C p -C V =nR 。(×) 20、在一绝热体系中有一隔板,两边分别是空气和真空,抽去隔 板,空气向真空膨胀,此时Q=0,所以ΔS=0。(×) 21、高温物体所含的热量比低温物体的多,因此热从高温物体自动 流向低温物体。(×) 22、处于两相平衡的1molH 2O (l )和1molH 2O (g ),由于两相物 质的温度和压力相等,因此在相变过程中ΔU=0,ΔH=0。(×) 23、在标准压力下加热某物质,温度由T 1上升到T 2,则该物质吸收 的热量为?=2 1 T T p dT C Q ,在此条件下应存在ΔH=Q 的关系。(√) 24、带有绝热活塞(无摩擦、无质量)的一个绝热气缸装有理想气 体,内壁有电炉丝,将电阻丝通电后,气体慢慢膨胀。因为是一个 恒压过程Q p =ΔH ,又因为是绝热体系Q p =0,所以ΔH=0。(×) 25、体系从状态I 变化到状态Ⅱ,若ΔT=0,则Q=0,无热量交换。各大高校物理化学期末考试试题及答案考试必备突击必取
物理化学知识点(全)
1.4.3.2中式烹饪基础知识-刀工基本知识
物理化学期末试题
物理化学期末考试试题库2017(附答案与解析)汇总
物理化学期末考试题库(上(下册))
