《中国药典》XXXX年版三部未收载历版《中国药典》三部和《中
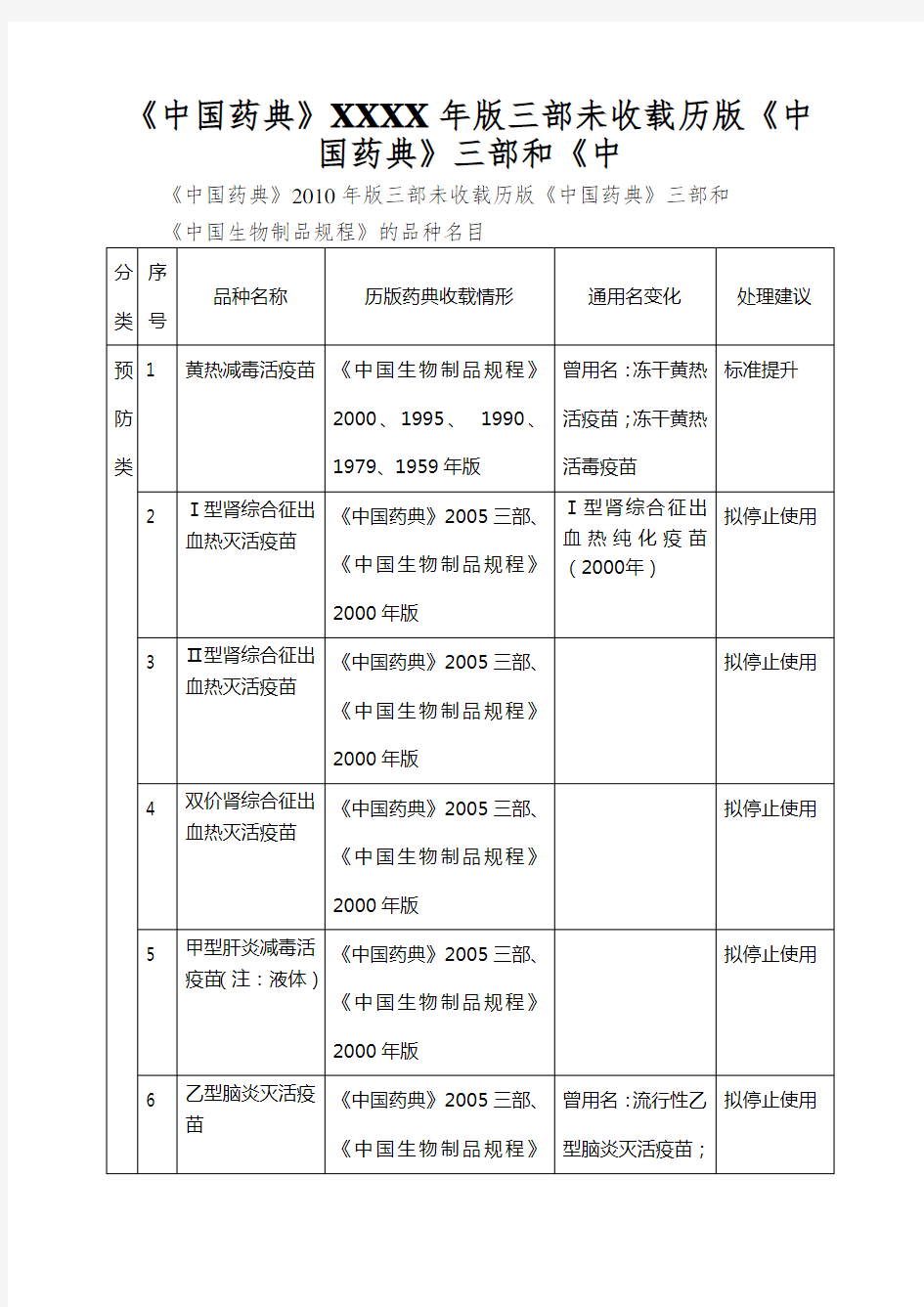
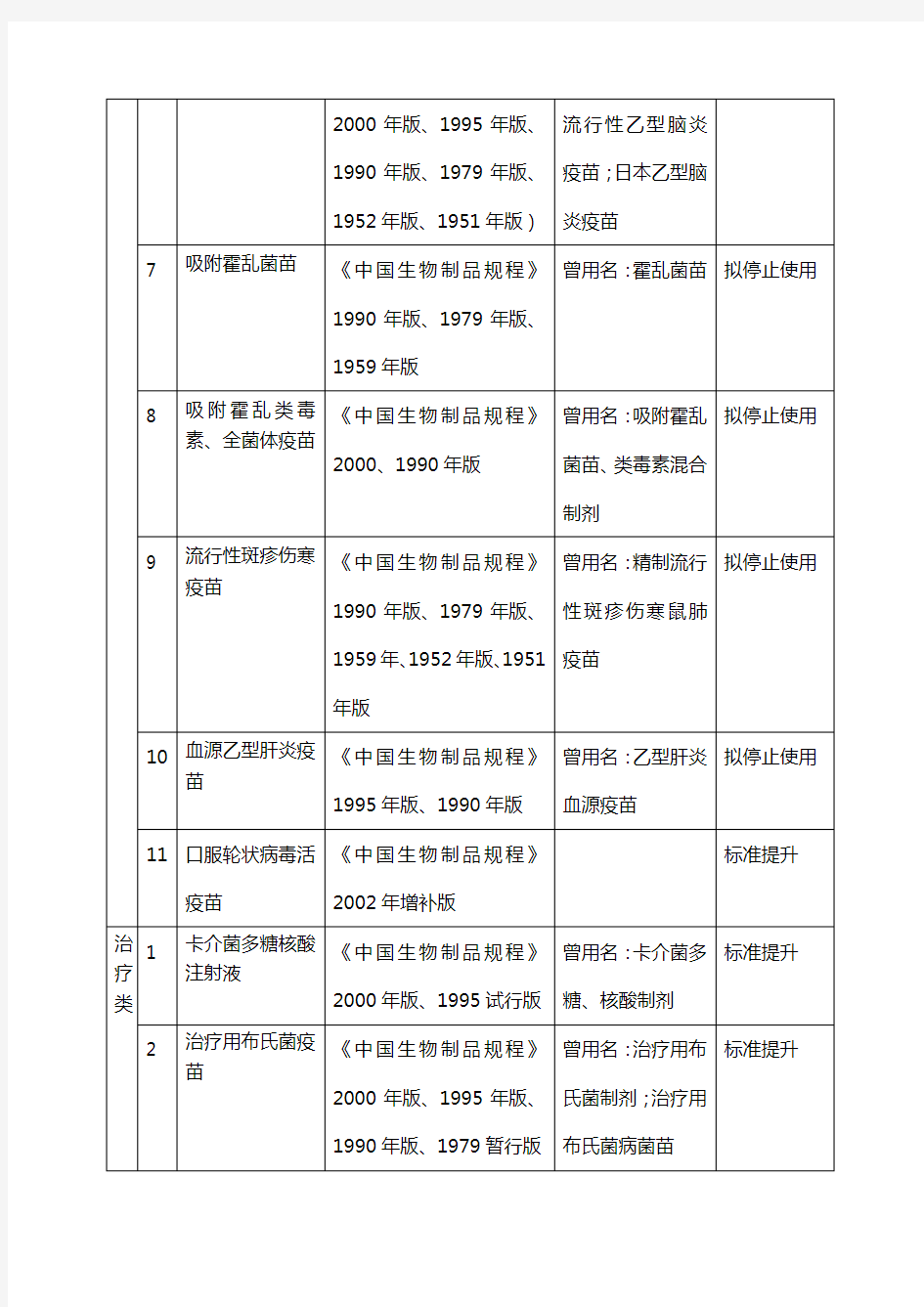
《中国药典》XXXX年版三部未收载历版《中
国药典》三部和《中
《中国药典》2010年版三部未收载历版《中国药典》三部和
《中国生物制品规程》的品种名目
2015年版药典查阅与使用
姓名:黄金菊学号:201351147 专业班级:2013级制药一班任课教师:柴宝丽序号: 序号查阅项目 药典中位置 查阅结果几 部 哪部分页数 例1:氢化可的松的鉴别二正文品种第一部 分 765 四项: 1.化学鉴别:显黄色 2.化学鉴别:显黄色至红色、绿色荧光、少量絮状沉淀 3.色谱鉴别:HPLC法,供试品主峰应与对照品主峰保留时间一致。 4.光谱鉴别:红外光谱法,与光谱集283图一致。 2 乳糖的性状四正文品种八画524 1.本品为白色的结晶性颗粒或粉末;无臭,味微甜。 2.本品在水中易溶,在乙醇、三氣甲烷或乙醚中不溶。 3.比旋度取本品,在80°C干燥2小时后,精密称定,加水溶解并定量 稀释制成每lm l中约含本品0. lg 与氨试液0. 02ml的溶液,依法测定 (通则0621),比旋度为十52.0°至+ 52.6°。 3 硫酸盐检查四通则目次第八部分99 1.除另有规定外,取各品种项下规定量的供试品,加水溶解使成约40ml(溶 液如显碱性,可滴加盐酸使成中性);溶液如不澄清,应滤过;置50ml 纳氏比色管中,加稀盐酸 2 m l,摇匀,即得供试品溶液。另取该品种项下 规定量的标准硫酸钾溶液置50ml纳氏比色管中,加水使成约40ml,加稀 盐酸2ml,摇匀,即得对照溶液。于供试品溶液与对照溶液中,分别加人 25%氣化钡溶液5ml,用水稀释至50ml,充分摇匀,放置10分钟,同置 黑色背景上,从比色管上方向下观察、比较,即得。 2.供试品溶液如带颜色,除另有规定外,可取供试品溶液两份,分别置 50ml纳氏比色管中,一份中加25%氯化钡溶液5ml,摇匀,放置10分钟, 如显浑浊,可反复滤过,至滤液完全澄淸,再加规定量的标准硫酸钾溶液 与水适量使成50ml摇匀,放置10分钟,作为对照溶液;另一份中加25% 氯化钡溶液5ml与水适量使成50ml,摇匀,放置10分钟,按上述方法与
中国药典2015版4部 可见异物检查法
0904 可见异物检查法 可见异物系指存在于注射剂、眼用液体制剂和无菌原料药中,在规定条件下目视可以观测到的不溶性物质,其粒径或长度通常大于50μm。 注射剂、眼用液体制剂应在符合药品生产质量管理规范(GMP)的条件下生产,产品在出厂前应采用适宜的方法逐一检查并同时剔除不合格产品。临用前,需在自然光下目视检查(避免阳光直射),如有可见异物,不得使用。 可见异物检查法有灯检法和光散射法。一般常用灯检法,也可采用光散射法。灯检法不适用的品种,如用深色透明容器包装或液体色泽较深(一般深于各标准比色液7号)的品种可选用光散射法;混悬型、乳状液型注射液和滴眼液不能使用光散射法。 实验室检测时应避免引人可见异物。当制备注射用无菌粉末和无菌原料药供试品溶液时,或供试品的容器不适于检查(如透明度不够、不规则形状容器等),需转移至适宜容器中时,均应在B级的洁净环境(如层流净化台)中进行。 用于本试验的供试品,必须按规定随机抽样。 第一法(灯检法) 灯检法应在暗室中进行。
A B C D 检查装置如下图所示。 图灯检法示意 A.带有遮光板的日光灯光源(光照度可在1000~4000lx范围内调节); B.不反光的黑色背景; C.不反光的白色背景和底部(供检査有色异物); D.反光的白色背景(指遮光板内侧)。 检查人员条件远距离和近距离视力测验,均应为4.9及以上(矫正后视力应为5.0 及以上);应无色盲。 检査法 按以下各类供试品的要求,取规定量供试品,除去容器标签,擦净容器外壁,必要时将药液转移至洁净透明的适宜容器内,将供试品置遮光板边缘处,在明视距离(指供试品至人眼的清晰观测距离,通常为25cm),手持容器颈部,轻轻旋转和翻转容器(但应避免产生气泡),使药液中可能存在的可见异物悬浮,分别在黑色和白色背景下目视检查,重复观察,总检查时限为20秒。供试品装量每支(瓶)在10ml及10ml以下的,每次检查可手持2支(瓶)。50ml或50ml以上大容量注射液按直、横、倒三步法旋转检视。供试品溶液中有大
中国药典2015版4部可见异物检查法
0904可见异物检查法 可见异物系指存在于注射剂、 眼用液体制剂和无菌原料药中, 在规定条件下目视可以观 测到的不溶性物质,其粒径或长度通常大于 50 口。 注射剂、眼用液体制剂应在符合药品生产质量管理规范( GMP )的条件下生产,产品 在出厂前应采用适宜的方法逐一检查并同时剔除不合格产品。 临用前,需在自然光下目视检 查(避免阳光直射),如有可见异物,不得使用。 可见异物检查法有灯检法和光散射法。 一般常用灯检法,也可采用光散射法。 灯检法不 适用的品种,如用深色透明容器包装或液体色泽较深 (一般深于各标准比色液 7号)的品种 可选用光散射法;混悬型、乳状液型注射液和滴眼液不能使用光散射法。 实验室检测时应避免引人可见异物。当制备注射用无菌粉末和无菌原料药供试品溶液 时,或供试品的容器不适于检查(如透明度不够、不规则形状容器等) 中时,均应在B 级的洁净环境(如层流净化台)中进行。 用于本试验的供试品,必须按规定随机抽样。 第一法(灯检法) 灯检法应在暗室中进行。 检查装置如下图所示。 A. 带有遮光板的日光灯光源(光照度可在 1000?4000IX 范围内调节); B. 不反光的黑色背景; C. 不反光的白色背景和底部(供检査有色异物) ; D. 反光的白色背景(指遮光板内侧) 。 检查人员条件 远距离和近距离视力测验,均应为 4.9及以上(矫正后视力应为 5.0 及以上);应无色盲。 检査法 按以下各类供试品的要求,取规定量供试品, 除去容器标签,擦净容器外壁,必要时将 药液转移至洁净透明的适宜容器内, 将供试品置遮光板边缘处, 在明视距离(指供试品至人 ,需转移至适宜容器
中国药典(2010版)
4附录XIX C 原料药与药物制剂稳定性试验指导原则 稳定性试验的目的是考察原料药或药物制剂在温度、湿度、光线的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期。 稳定性试验的基本要求是:(1)稳定性试验包括影响因素试验、加速试验与长期试验。影响因素试验用1批原料药或1批制剂进行。加速试验与长期试验要求用3批供试品进行。(2)原料药供试品应是一定规模生产的,供试品量相当于制剂稳定性试验所要求的批量,原料合成工艺路线、方法、步骤应与大生产一致。药物制剂供试品应是放大试验的产品,其处方与工艺应与大生产一致。药物制剂如片剂、胶囊剂,每批放大试验的规模,片剂至少应为10000片,胶囊剂至少应为10000粒。大体积包装的制剂如静脉输液等,每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据情况另定。(3)供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质量标准一致。(4)加速试验与长期试验所用供试品的包装应与上市产品一致。(5)研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性试验结果的可靠性。在稳定性试验中,应重视降解产物的检查。(6)由于放大试验比规模生产的数量要小,故申报者应承诺在获得批准后,从放大试验转入规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速试验与长期稳定性试验。 本指导原则分两部分,第一部分为原料药,第二部分为药物制剂。 4.1一、原料药 原料药要进行以下试验。 4.1.1(一)影响因素试验 此项试验是在比加速试验更激烈的条件下进行。其目的是探讨药物的固有稳定性、了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装、贮存条件和建立降解产物分析方法提供科学依据。供试品可以用1批原料药进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤1 0mm厚的薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在的危害性,必要时应对降解产物进行定性或定量分析。
中国药典临床用药须知2010版中国药典
《中华人民共和国药典临床用药须知》2010年版中国医药科技出版社 2011年最新出版 原价:1980元优惠价:1380元 如需2010版药典可同时购买
详细分册: 《临床用药须知——化学药和生物制品卷》750.00 《临床用药须知——中药成方制剂卷》650.00 《临床用药须知——中药材与饮片卷》580.00 《中华人民共和国药典临床用药须知》2010年版 内容简介 由国家药典委员会组织编写的《中华人民共和国药典临床用药须知》(以下简称《临床用药须知》)2010年版编纂工作已经完成,经国家食品药品监督管理局批准、国家药典委员会授权,将由中国医药科技出版社于2011年1月独家出版发行。 本版《临床用药须知》由国家药典委员会组织国内200多位一流的临床各科专家及相关药学专家编写,分三卷出版: ①中药材与饮片卷,约1300页,共介绍了656种药物,其中包括正药547种,附药109种。正品药物按中文名称、汉语拼音名、药材来源、炮制、性味归经、功能主治、效用分析、配伍应用、鉴别应用、方剂举隅、成药例证、用法用量、不良反应、使用注意、化学成分、药理毒理、本草摘要、参考文献等分别撰写; ②中药成方制剂卷,约1200页,收载品种约2855个。针对每类药物的方解、临床应用、药理毒理、不良反应、注意事项、用法用量、参考文献等方面进行系统介绍。为了便于临床使用,附录中还介绍了病证索引;
③化学药和生物制品卷,约1800页,收载品种1800余种。本版的最大特点是对儿童用药剂量进行了全面的审查和修订。同时,对每种药物的出处均作了标注,即是否是《中国药典》收录的药品,是否是国家基本药物,是否是医保药物,等等。 《临床用药须知》2010年版在继承前版的基础上,做了大量发展和创新性的工作,具有以下鲜明特色:①首次将“中药材与饮片”独立成卷,为中药材、饮片的规范使用提供了标准和依据。②中药成方制剂卷、中药材与饮片卷对收载品种的药理毒理进行了独立介绍。③化学药和生物制品卷在书末收录了“儿童用药剂量表”,由北京儿童医院等权威机构的儿科专家审定,便于临床医生查阅。④化学药和生物制品卷首次将“美国食品药品管理局(FDA)妊娠期药物安全性分级”收入附录,为妊娠期用药提供了强有力的科学依据。⑤对同一药物的不同功效在各相关章节中分别详细介绍,采用“相互参阅”的原则,便于临床医师准确、全面地了解药物的治疗效果。 《临床用药须知》是《中国药典>的配套用书,对临床用药和编写药品说明书具有权威指导意义。临床各科医师、图书馆、药品生产企业、药品经营企业等单位和个人都应配备、使用。望各《临床床用药须知》使用单位从保障公众用药安全的高度,落实好《临床用药须知》2010年版的配备和使用工 2010年12月1日
中国药典的化学对照品
中国药典的化学对照品 摘要:药品检验是验证药品质量的一个重要手段,是国家药品监督保证体系的重要组成部分,在保障药品安全有效方面有着重要的不可替代的作用。在药品检验工作中我们常会用到一种用来检查药品质量的特殊参照物——药品标准物质(标准品或对照品),以它作为确定药品真伪优劣的对照标准。药品标准物质在药品检验中具有十分重要的地位。随着仪器分析的广泛使用,必将越来越多地使用药品标准物质。笔者就化学对照品的类别、制备、标化、发放、保存和使用等作一简介。 关键词:中国药典化学对照品药品检验药品标准物质 l 标准品与对照品 1.1 标准品 标准品系指用于生物检定、抗生素或生化药品中含量或效价测定的标准物质,按效价单位(或g)计,以国际标准品进行标定。例如卡那霉素标准品、胰岛素标准品、凝血酶标准品等。 1.2 对照品 对照品系指用于化学合成药物及中药有效成分测定的标准物质,包括杂质对照品,但不包括色谱法中的内标物质。例如水杨酸对照品、地高辛对照品、环丙沙星对照品等。 2 对照品的分类 根据用途,对照品可以分为以下5类: (1)鉴别用对照品。用于药品鉴别项下的红外、薄层色谱等的鉴别。(2)检查用对照品。用于药品检查项下有关物质、溶出度及含量均匀度的检查。一般情况下,鉴别检查用对照品的纯度应不低于99.0%。(3)含量测定用对照品。用于含量测定,纯度要求较高。一般情况下,含量测定用对照品的纯度应不低于99.5%。(4)熔点标准品。为一系列具有不同熔点的标准物质,用于熔点温度计的校正。例如偶氮苯(熔点69℃)、磺胺(熔点166℃)、双氰胺(熔点210.5℃)、糖精(熔点229℃)、酚酞(熔点263℃)等。(5)溶出度校正片。为特殊制备的某种药片,通常为水杨酸校正片,用于溶出度仪的校正及实验操作技术的校正。 3 对照品的来源与制备 对照品通常来源于原料药的精制品,其中: (1)国内对照品:由国内生产厂家提供精制原料,再经中检所精制、标化和分发。(2)国际对照品:包括EP、BP和USP对照品,分别由欧洲、英国和美国药典委员会提供,可以不经标化使用。(3)进口药对照品:由国外厂家或外商提供,经中检所重新标化后分发。各口岸药检所只有使用由中检所提供的进口药对照品、进口药品的检验报告书才有效。 4 新药和地标升国标的对照品
中国药典2010版
《中华人民共和国药典临床用药须知2010年版》 中国医药科技出版社于2011年1月独家出版发行, 三部总定价1980元 优惠价:1100元 各相关单位: 由国家药典委员会组织编写的《中华人
民共和国药典临床用药须知》(以下简称《临床用药须知》)2010年版编纂工作已经完成,经国家食品药品监督管理局批准、国家药典委员会授权,将由中国医药科技出版社于2011年1月独家出版发行。 本版《临床用药须知》由国家药典委员会组织国内200多位一流的临床各科专家及相关药学 专家编写,分三卷出版: ①中药材与饮片卷,约1300页,共介绍了656种药物,其中包括正药547种,附药109种。正品药物按中文名称、汉语拼音名、药材来源、炮制、性味归经、功能主治、效用分析、配伍应用、鉴别应用、方剂举隅、成药例证、用法用量、不良反应、使用注意、化学成分、药理毒理、本草摘要、参考文献等分别撰写; ②中药成方制剂卷,约1200页,收载品种约2855个。针对每类药物的方解、临床应用、药理毒理、不良反应、注意事项、用法用量、参考文献等方面进行系统介绍。为了便于临床使用,附录中还介绍了病证索引;
③化学药和生物制品卷,约1800页,收载品种1800余种。本版的最大特点是对儿童用药剂量进行了全面的审查和修订。同时,对每种药物的出处均作了标注,即是否是《中国药典》收录的药品,是否是国家基本药物,是否是医保药物,等等。 《临床用药须知》2010年版在继承前版的基础上,做了大量发展和创新性的工作,具有以下鲜明特色: ①首次将“中药材与饮片”独立成卷,为中药材、饮片的规范使用提供了标准和依据。 ②中药成方制剂卷、中药材与饮片卷对收载品种的药理毒理进行了独立介绍。 ③化学药和生物制品卷在书末收录了“儿童用药剂量表”,由北京儿童医院等权威机构的儿科专家审定,便于临床医生查阅。
微生物限度检查操作规程(中国药典2015版四部通则).
霉菌和酵母菌总数、控制菌的检查。 二、引用标准:《中国药典》2015年版(通则1105-1106) 三、目录1.微生物限度标准 2.设备、仪器及用具 3.消毒液、稀释剂、试液及培养基 4.检查总则(通则1105:非无菌产品微生物限度检查:微生物计数法,通则1106 非无菌产品微生物限度检查:控制菌检查法) 5.微生物计数法检查 6.控制菌检查法 7.实验技术 8. 附件 1.微生物限度标准 非无菌药用原料及辅料的微生物限度标准 (2).目测霉变者以不合格论。 (3).“无”为标准依据或无相应规定。
准依据或无相应规定。 2.设施、仪器及用具 2.1、设施: 2.1.1.微生物限度检查室及相关设施:微生物计数试验环境应符合微生物限度检查的要求。检验全过程必须严格遵守无菌操作,防止再污染,防止污染的措施不得影响供试品中微生物的检出。单向流空气区域、工作台面及环境应定期进行监测。 2.1.2.其他设备:高压蒸汽灭菌器;细菌培养箱(30~35℃);霉菌培养箱(25~28℃);电炉(或其他适宜的加热装置);恒温水浴;电热干燥箱(250~300℃);电冰箱。生化试剂储存箱。 2.2仪器及器皿 2.2.1.菌落计数器;显微镜(1500X);电子天平或药物天平(感量0.1g);pH系列比色计。 2.2.2.玻璃器皿:锥形瓶(250~300ml,内装玻璃珠若干)、研钵(玻璃或陶瓷制,∮10~12cm)、培养皿(∮9 cm)、量筒(100 ml)、试管(18×180mm)及塞、吸管(1ml 分度0.01,10 ml分度0.1)、载玻片、盖玻片、玻璃消毒缸(带盖)。 2.2.3新购的玻璃器皿的清洁:先用流水冲洗,浸泡于1%~2%盐酸(工业用)液中约2~6小时,除去游离碱质,再用流水冲洗。用于化学分析的玻璃仪器,需用重铬酸钾清洁液浸泡数分钟后,再用流水冲洗,最后以纯化水涮洗2~3次,晾干备用。 2.3用过的玻璃器皿: 2.3.1未被病原微生物污染的器皿:可随时洗涤。用清水冲洗(或浸泡),除容量仪器外,可用毛刷和肥皂粉,内外刷洗,再用清水涮洗干净,晾干备用。容量仪器宜用清洁液浸泡或涮洗,再用流水冲洗,最后以纯化水涮洗2~3次。
世界各国药典大汇总
世界各国药典大汇总 为了大家方便下载,本帖把中国,美国,英国,日本等主要国家的药典做一个汇总,欢迎大家跟帖补充。 A、中国药典(CHP):不介绍了…… 国家药典委网 址https://www.360docs.net/doc/df17593133.html,/cms/home/ B、美国药典/国家处方集(简称USP/NF)U.S. Pharmacopeia / National Formulary:https://www.360docs.net/doc/df17593133.html,/uspnf/login 由美国政府所属的美国药典委员会(The United States Pharmacopeial Convention)编辑出版。USP于1820年出第一版,1950年以后每5年出一次修订版,到2005年已出至第28版。NF1883年第一版,1980年15版起并入USP,但仍分两部分,前面为USP,后面为NF。 美国药典是美国政府对药品质量标准和检定方法作出的技术规定,也是药品生产、使用、管理、检验的法律依据。NF收载了美国药典(USP)尚未收入的新药和新制剂。 美国药典正文药品名录分别按法定药名字母顺序排列,各药品条目大都列有药名、结构式、分子式、CAS登记号、成分和含量说明、包装和贮藏规格、鉴定方法、干燥失重、炽灼残渣、检测方法等常规项目,正文之后还有对各种药品进行测试的方法和要求的通用章节及对各种药物的一般要求的通则。可根据书后所附的USP 和NF的联合索引查阅本书。 C、英国药典(BP):https://www.360docs.net/doc/df17593133.html,/ 《英国药典》是英国药品委员会(British Pharmacopoeia Commission)的正式出版物,是英国制药标准的重要来源。英国药典不仅为读者提供了药用和成药配方标准以及公式配药标准,而且也向读者展示了许多明确分类并可参照的欧洲药典专著。英国药典出版周期不定。BP2004该药典由三卷本组成。其中两卷为英国药典、一卷为英国兽药典(兽医药品部分)。各条目均以药品名称字母顺序排列,内容包括药品性质、制法、血产品、免疫产品、电磁药品制法及外科材料等部分。英国药典书后附有全部内容关键词索引。 D、欧洲药典(EP):https://www.360docs.net/doc/df17593133.html,/ 欧洲药典委员会1964年成立。1977年出版第一版《欧洲药典》。从1980年到1996年期间,每年将增修订的项目与新增品种出一本活页本,汇集为第二版《欧洲药典》各分册,未经修订的仍按照第一版执行。1997年出版第三版《欧洲药典》合订本,并在随后的每一年出版一部增补本,由于欧洲一体化及国际间药品标准协调工作不断发展,增修订的内容显著增多,时隔五年,第四版《欧洲药典》于2002年1月生效。 E、日本药典(JP):http://jpdb.nihs.go.jp/jp14e/index.html 日本药局方:(The Japanese Pharmacopoeia)由日本药局方编集委员会
2010版中国药典—中华人民共和国药典用药须知
《2010 中华人民共和国药典临床用药须知》 作者:国家药典委员会编 出版社:中国医药科技出版社 出版时间:2011-7-1 开本:16开精装 3卷 2010 中华人民共和国药典临床用药须知-中药饮片卷原价:¥592.00 2010 药典临床用药须知-化学药和生物制品卷原价:¥798.00 2010 药典临床用药须知-中药成方制剂卷原价:¥590.00 三部总定价:1980元优惠价:1380元 药典和临床用药须知两部一起买更便宜
本版《临床用药须知》由国家药典委员会组织国内200多位一流的临床各科专家及相关药学专家编写,分三卷出版:①中药饮片卷,正文1268页,共介绍了656种药物,其中包括正品药物547种,附药109种。正品药物按中文名称、汉语拼音名、药材来源、炮制、性味归经、功能主治、效用分析、配伍应用、鉴别应用、方剂举隅、成药例证、用法与用量、不良反应、使用注意、化学成分、药理毒理、本草摘要、参考文献等分别撰写;②中药成方制剂卷,正文1068页,收载品种约1565个。针对每类药物的方解、临床应用、药理毒理、不良反应、注意事项、用法与用量、参考文献等方面进行系统介绍。为了便于临床使用,附录中还介绍了病证索引; ③化学药和生物制品卷,正文1577页,收载品种1440余种。本版的最大特点是对儿童用药剂量进行了全面的审查和修订。同时,对每种药物的出处均作了标注,即是否是《中国药典》收录的药品,是否是国家基本药物,是否是医保药物,等等。
《临床用药须知》2010年版在继承前版的基础上,做了大量发展和创新性的工作,具有以下鲜明特色:①首次将“中药饮片”独立成卷,为中药材、饮片的规范使用提供了标准和依据。②中药成方制剂卷、中药材与饮片卷对收载品种的药理毒理进行了独立介绍。 ③化学药和生物制品卷在书末收载了“儿童常用药物剂量表”,由北京儿童医院等权威机构的儿科专家审定,便于临床医生查阅。④化学药和生物制品卷首次将“美国食品药品管理局(FDA)妊娠期药物安全性分级”收入附录,为妊娠期用药提供了强有力的科学依据。⑤对同一药物的不同功效在各相关章节中分别详细介绍,采用“相互参阅”的原则,便于临床医师准确、全面地了解药物的治疗效果。 《临床用药须知》是《中国药典》的配套用书,对临床用药和编写药品说明书具有权威指导意义。临床各科医师、图书馆、药品生产企业、药品经营企业等单位和个人都应配备、使用。望各《临床用药须知》使用单位从保障公众用药安全的高度,落实好《临床用药须知》2010年版的配备和使用工作 配套《2010版中国药典》
