原电池实验报告

探究原电池的工作原理及原电池的设计
【实验目的】
理解原电池原理,掌握原电池的构成条件,会进行简单的原电池设计。
【实验原理】
原电池是将化学能直接转化为电能的装置,自发的氧化还原反应可设计成原电池【实验用品】铅笔芯、Cu片、铁钉、Zn片、电流计、导线、
稀H2SO4、酒精、CuS04溶液、西红柿2个、
【实验过程】
实验操作实验现象解释或方程式
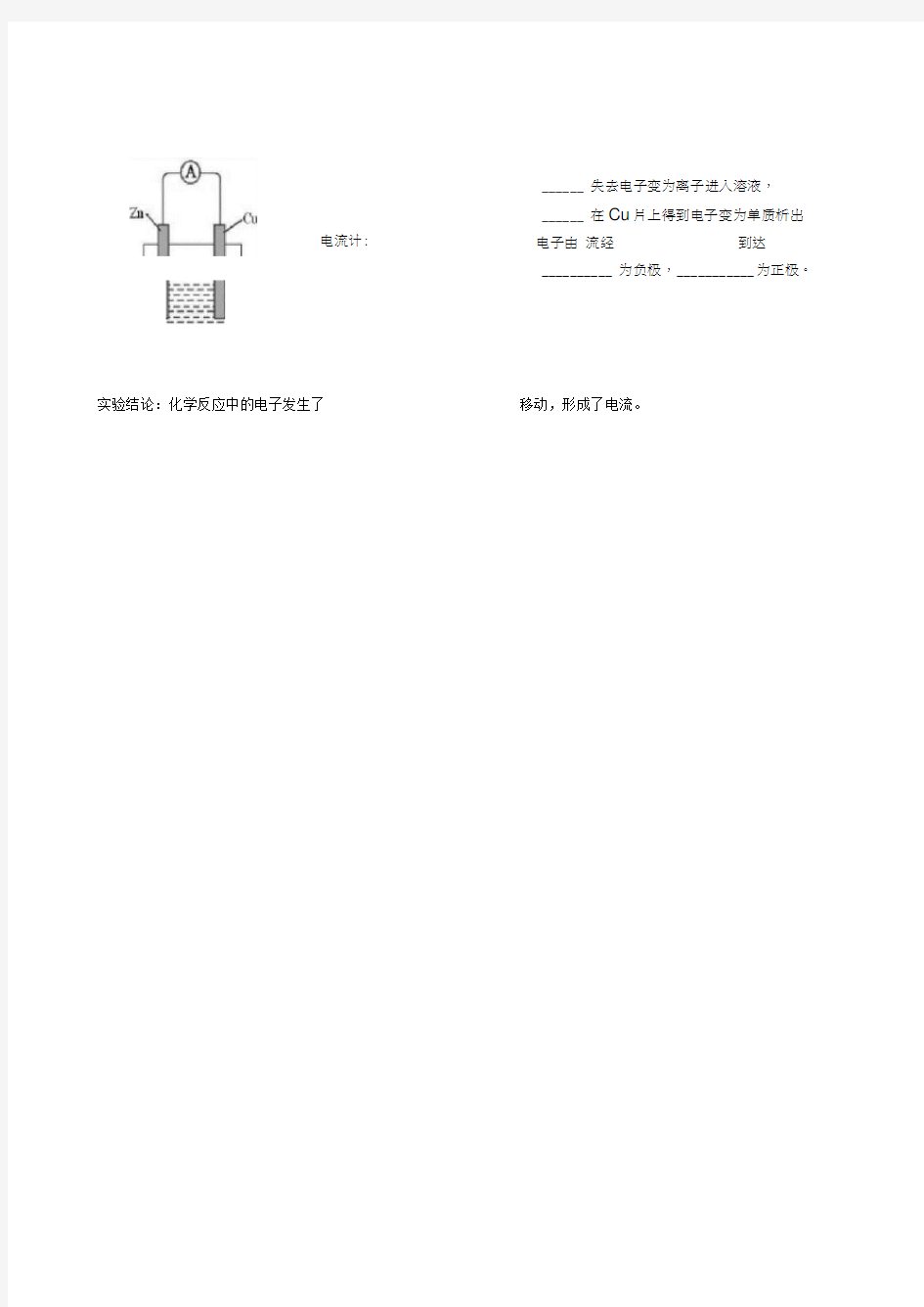
Zn片:
Cu片:
Cu片:
」、探究原电池的工作原理
?II2SO4
电流计:
______ 失去电子变为离子进入溶液, ______ 在Cu 片上得到电子变为单质析出 电子由 流经 到达 __________ 为负极, ___________ 为正极。
实验结论:化学反应中的电子发生了
移动,形成了电流。
原电池电动势的测定与应用物化实验报告
原电池电动势的测定及热力学函数的测定 一、实验目的 1) 掌握电位差计的测量原理和测量电池电动势的方法; 2) 掌握电动势法测定化学反应热力学函数变化值的有关原理和方法; 3) 加深对可逆电池,可逆电极、盐桥等概念的理解; 4) 了解可逆电池电动势测定的应用; 5) 根据可逆热力学体系的要求设计可逆电池,测定其在不同温度下的电动势值,计算电池 反应的热力学函数△G 、△S 、△H 。 二、实验原理 1.用对消法测定原电池电动势: 原电池电动势不能能用伏特计直接测量,因为电池与伏特计连接后有电流通过,就会在电极上发生生极化,结果使电极偏离平衡状态。另外,电池本身有阻,所以伏特计测得的只是不可逆电池的端电压。而测量可逆电池的电动势,只能在无电流通过电池的情况下进行,因此,采用对消法。对消法是在待测电池上并联一个大小相等、方向相反的外加电源,这样待测电池中没有电流通过,外加电源的大小即等于待测电池的电动势。 2.电池电动势测定原理: Hg | Hg 2Cl 2(s) | KCl( 饱和 ) | | AgNO 3 (0.02 mol/L) | Ag 根据电极电位的能斯特公式,正极银电极的电极电位: 其中)25(00097.0799.0Ag /Ag --=+ t ?;而+ ++-=Ag Ag /Ag Ag /Ag 1 ln a F RT ?? 负极饱和甘汞电极电位因其氯离子浓度在一定温度下是个定值,故其电极电位只与温度有关,其关系式: φ饱和甘汞 = 0.2415 - 0.00065(t – 25) 而电池电动势 饱和甘汞理论—??+=Ag /Ag E ;可以算出该电池电动势的理论值。与测定值 比较即可。 3.电动势法测定化学反应的△G 、△H 和△S : 如果原电池进行的化学反应是可逆的,且电池在可逆条件下工作,则此电池反应在定温定压
电功率经典练习题(附标准答案)
电功率经典练习题 1.一台电动机正常工作时线圈两端电压为380V ,线圈电阻为2Ω,线圈中电流为10A ,这台电动机正常工作1s 消耗的电能为W 和产生的热量为Q 分别为A A.3800J 、200J . B.3800J 、3800J C.72200J 、200J D.72200J 、3800J 2.一个标有“6V 3W”的灯泡,欲接到9V 的电源上能正常发光,应给它C A.串联一个3Ω的电阻 B.并联一个3Ω的电阻 C.串联一个6Ω的电阻 D.并联一个6Ω的电阻 3.一只标有“6V 1.5W”的灯泡L 1和另一只“6V 3W”的灯泡L 2串联后接在电源上,通电后有一只灯泡正常发光,另一只灯泡较暗,其中能正常发光的是灯泡 L1 ,此时电路中的电流是 0.25 A ,电源电压是 9 V 。 4. 图所示电路,电源中电源两端的电压保持不变,R 0为定值电阻,R 为滑动变 阻器.闭合开关S 后,在滑动变阻器滑片P 向右滑动的过程中,下列说法正确 的是 C A .电流表A 1的示数变小 B .电流表A 2的示数变大 C .电压表V 的示数不变 D .小灯泡L 的亮度变暗 5.如图所示电路,电源电压保持不变,L 是标有“6V 3W ”的小灯泡,R 是滑 动变阻器。闭合开关S 3,断开开关S 1、S 2,滑片P 位于中点时,灯泡L 恰好正常发光,电压表V 的示数为U 1;当S 1、S 2都闭合,滑片P 滑至b 端时,电流表 示数为1.5A ,电压表V 的示数为U 2;U 1:U 2=1:2,下列选项正确的是B A .滑动变阻器的变化范围是0~12Ω B .滑动变阻器的变化范围是0~24Ω C .当S 1、S 2 、S 3都闭合,滑片P 位于a 端时,灯泡L 仍能正常工作 6.小敏同学在做电学实验时按照如图7所示的电路将电学器材连接,她使用的 电流表量程为0~0.6A ,电压表的量程为0~3V ,电源两端的电压为6V 且保持不变,电阻R 的阻值为10Ω,允许消耗的最大电功率为0.9W 。滑动变阻器R 0的最大阻值为20Ω,允许通过的最大电流为0.5A 。将开关S 闭合后,要保证电路中各个元件正常工作,以 下说法正确的是 B A .通过电阻R 的电流最大值为0.4A B .滑动变阻器接入电路的最小值为5Ω C .电压表示数最大的变化量为1V D .滑动变阻器R 0消耗的最大功率为1.2W 7.图所示电路中电源两端电压不变。当①和②均为电压表时,开关S 闭合后,电压表V 1、V 2的示数之比为7∶12,电阻R 1消耗的电功率为P 1。当①和②均为电流表 时,开关S 闭合后,电流表A 1、A 2的示数之比为16∶21,此时电阻R 2消耗 的电功率为P 2'。则P 1∶P 2'等于D A .1∶12 B.1∶16 C .3∶64 D.9∶16 8.如图所示电路中,电压U 保持不变,电流表的示数为1A 。如果R 1与R 2的等效电阻为R ,并且R 1:R=5:3,电阻R 2消耗的电功率为2.4W ,则电阻R 1=___12.8__Ω。 9.如图所示电路,R 是定值电阻,灯泡L 1L 2分别标有“8V 8W ”和“12V 24W ”,电路两 R 0
原电池电动势的测定实验报告
实验九 原电池电动势的测定及应用 一、实验目的 1.测定Cu -Zn 电池的电动势和Cu 、Zn 电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC -Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=- (9-1) 式中G ?是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -?);E 为电池的电动势。所以测出该电池的电动势E 后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22() ()2Zn Zn s Zn a e ++-+ 正极起还原反应: 22()2()Cu Cu a e Cu s ++-+ 电池总反应为: 2222()()()()Cu Zn Zn s Cu a Zn a Cu s ++++++ 电池反应的吉布斯自由能变化值为: 22ln Cu Zn Zn Cu a a G G RT a a ++?=?- (9-2) 上述式中G ?为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221Cu Zn a a ++==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn Cu a RT E E nF a + + =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1 ln 2Cu Cu Cu RT F a ??+ + += - (9-6) 22,1 ln 2Zn Zn Zn RT F a ??+ + -= - (9-7) 式中2,Cu Cu ? +和2,Zn Zn ?+是当221Cu Zn a a ++==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
电功率经典计算题(含答案)
电功率经典计算题 1.如图45所示,灯炮L正常发光时,求:(1)通过灯泡的电流强度是多少? (2)安培表示数是多少? 2.如图46所示,电源电压为10伏,电灯L的电压为9伏特,它的电阻为12欧姆.安培表示数I=1.2安培,求: (1)电阻R1是多少欧姆? (2)若将R1换成36欧姆的电阻R2,然后调节变阻器使安培表示数变为I'=0.8安培,这 时电灯上的电流强度是多少? 3.在图47所示的电路中,AB是滑动变阻器,P是滑片,小灯泡L上标有“2.5V 1W”字样,电源电压为4.5伏特,电路中串接一只量程为0~0.6安培的电流表。 (1)当K1、K2都打开时,滑片P应在滑动变阻器的哪一端?(2)当闭合K1,调节滑动变阻 器,使电流表中的读数多大时,小灯泡才能正常发光?这时滑动变阻器的阻值是多少 (3)若此时将开关K2闭合,问通过电流表的电流会不会超过量程? 4.现有两个小灯泡A和B。A灯标有“6V 1.2w”的字样,B灯标有“12V 6W”字样,试求:(1)两个小灯泡的额定电流;(2)如果把它们串联起来,为了使其中一个灯泡能够持续地正常发光,加在串联灯泡两端的总电压不得超过多少伏特?(设灯丝的电阻不随温度变化) 5.如图48所示,L为标为“3V 0.15W”的一只灯泡,R的阻值为120欧姆。 (1)当开关K2闭合,K1断开时,L恰好正常发光,此时安培表和伏特表的示数各是多少?(2)当开关K1闭合,K2断开时,安培表和伏特表的示数各是多少? 6.图49中的A是标有“24V 60W”的用电器,E是电压为32伏特电源,K是电键,B是滑动变阻器,若确保用电器正常工作,请在图中把电路连接起来,并求出滑动变阻器B中通过电流的那段电阻值和它消耗的电功率。
原电池电动势的测定实验报告
实验九原电池电动势的测定及应用 一、实验目的 1.测定Cu-Zn电池的电动势和Cu、Zn电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC-Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=-(9-1) 式中G ?是电池反应的吉布斯自由能增量;n为电极反应中得失电子的数目;F为法拉第常数(其数值为965001 ?);E为电池的电动势。所以测出该电池的电动势E后,进而 C mol- 又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计 测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就
可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s |||| 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”代表连通两个液相的“盐桥”;1m 和2m 分别为4ZnSO 和4CuSO 的质量摩尔浓度。 当电池放电时, 负极起氧化反应: { }22()()2Zn Zn s Zn a e ++ - + 正极起还原反应: 22()2()C u C u a e C u s + +- + 电池总反应为: 2222()()()()C u Zn Zn s C u a Zn a C u s ++++ ++ 电池反应的吉布斯自由能变化值为: 22ln C u Zn Zn C u a a G G RT a a ++?=?- (9-2) 上述式中G ? 为标准态时自由能的变化值;a 为物质的活度,纯固体物质的活度等于1,即1Cu Zn a a ==。而在标态时,221C u Zn a a + +==,则有: G G nFE ?=?=- (9-3) 式中E 为电池的标准电动势。由(9-1)至(9-1)式可得: 22ln Zn C u a R T E E nF a ++ =- (9-4) 对于任一电池,其电动势等于两个电极电势之差值,其计算式为: E ??+-=- (9-5) 对铜-锌电池而言 22,1ln 2C u C u C u RT F a ??+ ++=- (9-6) 22,1ln 2Zn Zn Zn RT F a ??+ + -=- (9-7) 式中2,Cu Cu ?+ 和2,Zn Zn ?+ 是当221C u Zn a a + +==时,铜电极和锌电极的标准电极电势。 对于单个离子,其活度是无法测定的,但强电解质的活度与物质的平均质量摩尔浓度和
《电功、电功率》经典练习题+答案
-- 《电功、电功率》经典练习题 一、基础题(直接应用公式) 1.有一种用于220V 电路中的节能灯,额定功率仅为1W,则通过它的电流为____A 0.0045A 2.1度电可供两盏100W 电灯正常工作_______h. 5h 3.一个“220V 800W ”的电炉,正常工作时电阻丝的电阻是______Ω。 60.5Ω 4.一个灯泡上印着“PZ 220 25”,它正常工作时的电阻是______Ω,如果把它接入一个110V 电压的电路中,它实际消耗的电功率是________,与接在220V电路上相比,这时他发光的亮度___________ (1936Ω,6.25W , 暗些。) 5.某次雷电的电流约2?410A,电压约8 110?V,放电时间约0.001s 。这次雷电的电功率约________千瓦,释放_________J 的能量。(2×109 KW , 2×109 J ) 6.某工厂共有电灯1000盏,都用60W 的普通照明灯泡,平均每天用电12h 。如果都改用40W 的日光灯,不但可以省电,而且比原来更亮了。该厂一年(365天)可节约多少千瓦时的电?(87600KW ·h) 7. 某导体的电阻是2Ω,通过2 A 的电流时,1min 产生多少焦耳的热量?480J 8. 一只额定功率是450W的电饭锅,在220V 的额定电压下使用,每分钟产生________J 的热量.27000J 9. 一只电烙铁的额定电压是220V ,在额定电压下工作时的电阻是1210Ω,它的额定功率是________W,在额定电压下通电10min 产生___________J的热量。40W,24000J 10. 某校师生自制了一台电烘箱。电烘箱的电阻丝通过5A的电流时,每分钟可产生 46.610?J 的热量。求这台电烘箱的电功率和电阻丝工作时的电阻。1.1×103W ,4 4Ω 18. 某型号电冰箱主要技术参数如表所示,此电冰箱连续使用一个月(按30天计)消耗的电能为 。20.7kW ·h 19.一个灯泡的灯丝烧断了,把断了的灯丝搭在一起,灯泡会更亮。怎么解释这个现象? 答:灯丝烧断后再搭在一起,由于灯丝的长度变短而使其电阻变小,在灯泡两端电压 不变的情况下,通过灯丝的电流会变大,根据P=U I可知,灯泡的实际功率会变大,所以灯泡会变亮。 二、电功率练习 1.将标有“12V,3W ”的甲灯和“6V ,3W ”的乙灯串联在15V 的电源上,那么能正常发光的是( )A A .甲灯 B .乙灯 C.甲、乙两灯均能正常发光 D.无法判断 2.有两个额定功率相同的甲、乙灯炮,当它们并联接入某一电路时,甲灯比乙灯亮,则它们的额定电压( )B A.U 甲>U 乙 B. U 甲<U 乙 C. U 甲=U 乙 D.无法判断 3.将“12V 8W ”和“6V 3W”的灯泡并联接在电压是6V的电路上,则它们消耗的实际功率之比是 ( )B A 、2:1 B 、2:3 C 、3:8 D、8:3 4. 两个用电器电阻之比R1:R 2=3:1,分别接在两个电路上, 通过它们的电流之比I 1:I2=2:3,则在相等的时间内电流对它们所做功之比W 1:W 2= . 4:3 5.如图1所示,电源电压保持不变。当开关S 1 合、S 2断开时,电流表的示数为0.2A ;当开关S 1、S 2都闭合时,电流表的示数为0.8A 。则电阻R1与R2的比值为( )A A 、1∶3 B 、 3∶l C 、 2∶3 D 、 3∶2 6.如图8所示,电源电压恒定,定值电阻的阻值R =1 0Ω,滑动变阻器R ′的规格为“20Ω 1A ”。闭合开关S,当滑动变阻器接入电路的阻 值在0~10Ω范围内变化时,电流表的示数在0.3A ~0.6A 的范围内变化,则电源电压为 V。从当滑动 图2 R a b A R ′ S
高一化学原电池练习题及答案
高一化学原电池练习题及答案 班级姓名学号 1.下列关于原电池的叙述中,正确的是 A. 原电池中,正极就是阳极,负极就是阴极 B. 形成原电池时,在负极上发生氧化反应 C. 原电池工作时,溶液中的阳离子向负极移动 D. 电子从负极流向正极 2.下列关于原电池的叙述正确的是 A. 构成原电池的正极和负极必须是两种不同的金属 D. Mg片上有气泡产生 6.下列事实能说明Al的金属活动性比Cu强的是 A、常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中 B、常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中 C、与氯气反应时,铝失去3个电子,而铜失去2个电子 D、常温下,铝在浓硝酸中钝化而铜不发生钝化 7.有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B 与E构成原电池时,电极反应式为:E2-+2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为 A、A﹥B﹥E﹥D B、A﹥B﹥D﹥E C、D﹥E﹥A﹥B D、D﹥A ﹥B﹥E.原电池的正负极的判断: ①由组成原电池的两极材料判断。一般是的金属为负极,活泼性的金属或能的非金属为正极。
②根据电流方向或电子流动方向判断。电流是由流向;电子流动方向是由极流向极。 ③根据原电池里电解质溶液内离子的定向流动方向。在原电池的电解质溶液内,阳离子移向的极是极,阴离子移向的极为极。 是 9.______极,发生1011 34.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是 A.稀硝酸 B.硝酸铜 C.稀盐酸 D.氢氧化钠 35.下列物质的组合,不属于铝热剂的是 A.FeO+Al B.Mg+Al2O C.Al+V2O D.Al+Cr2O3 36.下列金属冶炼的反应原理,错误的是 高一化学《原电池》专项练习 1. 下列烧杯中盛放的都是稀硫酸,在铜电极上能产生氢气 2. 如下图,下列装置属于原电池的是 3. 关于原电池的叙述中正确的是 A.构成原电池的电极是两种不同的金属B.原电池是将化学能转化为电能的装置 C.原电池负极发生的电极反应是还原反应 D.原电池的正极是还原剂,总是溶液中的阳离子在此
原电池电动势的测定实验报告
实验九 原电池电动势的测定及应用 一、实验目的 1.测定Cu -Zn 电池的电动势和Cu 、Zn 电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握数字电位差计的测量原理和正确的使用方法。 二、实验原理 电池由正、负两极组成.电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=- (9-1) 式中G ?是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -?);E 为电池的电动势。所以测出该电池的电动势E 后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小. 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量.原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 4142()()()()Zn s ZnSO m CuSO m Cu s ||||
(完整)初中物理电功率经典计算题100个
初中物理电功率经典计算题100个 1、一根阻值为20Ω的电炉丝做成电热器,接上10V电源能正常工作;用这个电热器与一个小灯泡串联接人该电源时,电热器消耗的功率是其额定功率的0.64倍。求: (1)电热器正常工作的电流和额定功率; (2)小灯泡的电阻值。 2、用R1=121Ω、R2=60.5Ω的两根电阻丝,两个开关(S1、S2)设计有低、中、高三档不同的电功率的取暖器,简化如图求: (1)取暖器工作于低档时,S1、S2的断开或闭合情况是怎样的?此时电路的电流和电功率各多大? (2)电取暖器工作于高档时,S1、S2的断开或闭合情况是怎样的?此时电路的干路电流和电功率多大? 3、小灯泡L标有“6V 6W”字样,R2=3Ω,当S1、S2都闭合时,电流表示数为1.2A,这时小灯泡L正常发光,求: (1)电源电压U ; (2)电阻R1的阻值 ; (3)当S1、S2都断开时,小灯泡L消耗的功率. 4、电源电压U=7.5v , R 为保护电阻,L 为标有“6 V 3w”的小灯泡,电流表量程为0~0.6A ,电压表量程为0~3v 。闭合开关S 后,要求灯L两端的电压不超过额定电压,且两电表的示数均不超过各自的量程,则滑动变阻器允许接入电路的最大阻值为
5、L是标有“6V 3W“的电灯,电压是8伏特的电源求:电阻R和滑动变阻器RW的阻值各是多大时,才能使滑动变阻器的滑片P无论在什么位置上,加在电灯两端的电压都不超过3~6伏特的范围。 6、有两个阻值分别为20Ω、30Ω的电阻在电路中,请你任意补充一个条件,提出问题,然后解答。(至少选择两种解。法,但要求每次补充不同条件,提出不同的问题) 7、闭合开关后,用电器R1、R2均能正常工作。已知R1的额定功率为1.5 W,电流表A1的示数为0.5 A,电流表A2的示数为1.5 A。求(1)R1的电阻大小。(2)R2的额定电功率 8、“220 V 500 W”的小电炉子接在家庭电路中使用,求: (1)半个小时内它能放出多少焦耳的热量? (2)你还能算出该电炉子的哪些物理量?请任意选择两个计算出来。 9、接在家庭电路上的一盏灯,在10 min内消耗的电能是2.4×104 J.求这盏灯的电功率和通过灯丝的电流. 10、一个额定电压为2.5 V的小灯泡,正常发光时通过灯丝的电流为0.2 A,求 (1)小灯泡的额定功率; (2)小灯泡发光时的灯丝电阻; (3)通电1 min小灯泡消耗多少电能?
原电池原理及其应用
第四节 原电池原理及其应用 教学目的: 1、 使学生理解原电池原理; 2、 常识性介绍日常生活中常用的化学电源和新型化学电池; 3、 使学生了解金属的电化腐蚀 教学重点:原电池的原理 教学难点:金属的电化腐蚀 教学方法:实验探究法 教学用品:铁丝、铜丝、锌片、铜片、稀硫酸、导线、烧杯、电流计 教学过程: 第一课时 [引言] 前几节我们学习了有关金属的知识,了解了铁和铜的性质。铁是比较活泼的金属,能溶于稀硫酸,铜是不活泼的金属,不溶于稀硫酸。如果我们同时将铁和铜连在一起,同时放到稀硫酸中,会发生什么现象呢?下面我们做这个实验。 [提问] 大家看到了什么现象? [讲述] 把铁线和铜丝的上端连在一起,放入稀硫酸中,在金属丝中有电子流动,构成了一个小电池,我们叫它原电池。下面我们就来研究原电池的原理及其应用。 [板书] 第四节 原电池原理及其应用 一、原电池 [讲述] 实验结果表明,导线中有电流通过,电流是如何产生的呢? [学生讨论] [板书] 锌片 Zn —2e -==Zn 2+ (氧化反应) 铜片 2H ++2e -==H 2 (还原反应) 电子由锌片经导线流向铜片 [讲述] 我们知道,物质发生反应时,常伴有化学能与热能、光能等的相互转化。例如,镁条在空气中燃烧的化学反应,伴有放热、发光等现象。这说明化学能转变为热能和光能。那么,我们做的这个实验是化学能转变为哪种能呢? [学生回答] [教师总结] 这种化学能转变为电能的装置叫原电池。 [板书] 原电池的定义:化学能转变为电能的装置。 [讲述] 这一现象早在1799年被意大利的物理学家伏打扑捉到并加以研究,发明了世界上第一个原电池---------伏打电池,即原电池。 [引导思考] 原电池的两极材料如何选择呢? [ 讲述] 下面我们再做几个实验共同探讨一下原电池的组成条件和原理 Z n C Z u F C 稀硫酸 C u SO 4溶液 稀硫酸 A B C D
原电池实验报告.doc
word 文档可编辑 探究原电池的工作原理及原电池的设计 【实验目的】 理解原电池原理,掌握原电池的构成条件,会进行简单的原电池设计。 【实验原理】 原电池是将化学能直接转化为电能的装置, 自发的氧化还原反应可设计成原电池 【实验用品】铅笔芯、Cu 片、铁钉、Zn 片、电流计、导线、 稀H 2SO 4、酒精、CuS04溶液、西红柿2个、 【实验过程】 」、探究原电池的工作原理 _______ 失去电子变为离子进入溶液, _______ 在Cu 片上得到电子变为单质析出 电子由 流经 到达 __________ 为负极, _________ 为正极。 实验结论:化学反应中的电子发生了 移动,形成了电流。 实验操作 实验现象 解释或方程式 I P 稀 Zn 片: Cu 片: Cu 片: 电流计:
实验现象 解释或电极反应式 word 文档可编辑 二、探究原电池的构成条件 对比实验1: 实验装置 tag 二 J_J"匚二 J -B T"!_IC^i . ? Il/o* 实验结论:形成原电池,必须发生 _________________________ 反应 对比实验2: 电流计指针 _____________ 实验装置 r~?^\ 实验现象 解释或电极反应式 OiSDi 弱 jft 电流计指针 ____________ 电流计指针 ____________ 电流计指针 _____________
实验装置 实验现象 解释及电极反应式 word 文档可编辑 对比实验 3: 电流计指针 _____________ 电流计指针 _____________ 实验结论:形成原电池,必须有两个 的电极
初三物理电功电功率典型例题解析(免费)
电功电功率典例精析 电功和电功率基础知识 1. 电功(W):电流对用电器做的功(电能转化成其他形式能的多少)叫电功。 ①电功的国际单位:焦耳(J)。常用:度(千瓦时)KW.h,1度=1千瓦时=3.6×106焦耳。 ②测量电功的工具:电能表(电度表) ③电功公式:W=Pt=UIt(式中单位W→焦(J);U→伏(V);I→安(A);t→秒)。 ④利用W=UIt计算时注意:①式中的W、U、I、t必须对于同一导体(同一段电路)的同一过程,才能代入公式计算,即要满足“同一性”;②计算时单位要统一;③已知任意的三个量都可以求出第四个量; ⑤其他计算公式:W=I2Rt(多用于串联电路),W=U2t/R(多用于并联电路) 2. 电功率(P):表示电流做功的快慢。国际单位:瓦特(W)。常用单位:千瓦(KW) ①计算公式:P=W/t=UI(式中单位P→瓦(w);W→焦(J);t→秒(s);U→伏(V);I→安(A)) ②利用公式计算时单位要统一: a.如果W用焦(J),t用秒(s),则P的单位是瓦(w); b.如果W用千瓦时(KW.h),t用小时(h),则P的单位是千瓦(KW)。 c.公式中各物理量必须满足“同一性”才能代入公式计算。 ③其他计算公式:P=I2R (多用于串联电路),P=U2/R(多用于并联电路) ④额定电压(U额):用电器正常工作的电压。另有:额定电流 ⑤额定功率(P额):用电器在额定电压下的功率。 ⑥实际电压(U实):实际加在用电器两端的电压。另有:实际电流 ⑦实际功率(P实):用电器在实际电压下的功率。 ⑧用电器消耗的实际功率随加在它两端的实际电压而改变。实际电压升高,实际功率增大;反之则减小。 a.当U 实> U额时,则P 实> P额;(灯很亮,将缩短灯泡寿命,且易烧坏)。 b.当U实< U额时,则P实< P额;(灯很暗)。 c.当U实= U额时,则P实= P额;(正常发光)。 ⑨同一个电阻,接在不同的电压下使用,则有,如:当实际电压是额定电压的一半时,则实际功率就是额定功率的1/4。(即同一用电器消耗的实际功率跟它两端的实际电压的平方成正比,P1/P2=U12/U22)
原电池原理及其应用
【基础知识精讲】 装詈特点:化学能转化趟能 严两个活泼性不同的电极 形成条件彳②电解质涪液 〔0)形成闭合回路 先色沿寻绞悔必育电矗产韭 加 Se-Zn^T I SW.反网」匝 K 析氢 腐、蚀 L 吸氧腐蚀 「斑变金属的內部组织结构 ②在金属裹面霍盖保护层 I ③电化学保护法 以铜锌原电池为例,理解原电池的工作原理:负极发生氧化反应,正极发生还原反应 紧抓这个基本原理去解决各种类型的原电池问题 ^ 【重点难点解析】 重点:①原电池原理; ②金属的腐蚀原理与防护? 难点:金属的电化学腐蚀与防护? 1. 正确判定原电池 2. 原电池正极和负极的确定 (1) 由两极的相对活泼性确定? (2) 由电极现象确定.通常情况下,在原电池中某一电极若不断溶解或质量不断减少, 该 电极发生氧化反应, 此为原电池的负极; 若原电池中某一电极上有气体生成, 电极的质量不 断增加或不变,该电极发生还原反应,此为原电池的正极 3. 原电池工作原理:以 Cu-Zn 原电池为例. 学科:化学 教学内容:原电池原理及其应用 r 金属腐蚀 L 化学腐蚀 电化腐蚀 匕钢铁腐蚀 '主曼应用〈 I 防护方法T 厂沪2e-Hj A 千 ti rJ i
负极(锌板):Zn-2e=Zn 2+ 被氧化,锌板不断溶解; 正极(铜板):2H+2e=Hf 被还原,表面置出气泡. 电子流动方向:负极(Zn )经导线正极(Cu ). Cu-Zn 原电池发生的总反应跟锌和酸的反应是一致的,但电子却经外接导线发生迁移, 形成持续 的电流,使化学能转化为电能 ? 构成原电池的反应必须能自发地进行氧化还原反应 ?从理论上讲,任何一个氧化还原反 应都可设计成原电池, 只不过要求氧化反应和还原反应必须在两极上分别进行, 使与两极连 接的导线里,产生持续电流 ? 【难题巧解点拨】 例1 :把a,b,c,d4 块金属片浸入稀硫酸中,用导线两两相连组成原电池 .若a,b 相连时, a 为负极;c,d 相连时,d 上产生大量气泡;a ,c 相连时,电流由c 经导线流向a ; b 、d 相 连时,电子由d 经导线流向b ,则此4种金属的活动性由强到弱的顺序为 () A.a > b > c >d B.a > c > d > b C.c >a > b > d D.b > d > c > a 分析:根据原电池原理,较活泼的金属为负极,被氧化溶解; 相对不活泼的金属为 正极,冒气泡或析出金属?电子由负极经外电路流向正极,电流方向与电子方向相反等进行 分析:根据构成原电池的条件必须同时满足: (1)要有活泼性不同的两个电极 .(2)要 有 电解质溶液.(3)要有导线,能形成闭合回路? 用此条件进行判断:在 A 中两个电极的金属相同,不符合条件,在 (D )中没有电解质溶 液,乙醇是非电解质.故只有B C 符合条件 答案:BC 例3:银锌电池是广泛用作各种电子仪器的电源,它的充电和放电过程可表示为: 2Ag+Z n( 0H)2 三 Ag 2O+Zn+2HO 此电池放电时, 负极上发生反应的物质是 () A.Ag B.Z n(0H)2 C.Ag 2O D.Z n 分析:根据原电池工作原理,负极上发生氧化反应 .元素化合价会升高,所以在放电过 程中被氧化的是 Zn,即Zn 为负极. 答案:为D 【命题趋势分析】 常考知识点: 1. 原电池的概念、工作原理 2. 电极反应和电池反应 乙醉 E A 山嵐礙液 C
实验一原电池电动势测定
实验一 原电池电动势的测定及应用 一、实验目的 1.测定Cu -Zn 电池的电动势和Cu 、Zn 电极的电极电势。 2.学会几种电极的制备和处理方法。 3.掌握SDC -Ⅲ数字电位差计的测量原理和正确的使用方法。 二、实验原理 原电池由正、负两极和电解质组成。电池在放电过程中,正极起还原反应,负极起氧化反应,电池内部还可以发生其它反应,电池反应是电池中所有反应的总和。 电池除可用来提供电能外,还可用它来研究构成此电池的化学反应的热力学性质。从化学热力学知道,在恒温、恒压、可逆条件下,电池反应有以下关系: G nFE ?=- (9-1) 式中G ?是电池反应的吉布斯自由能增量;n 为电极反应中得失电子的数目;F 为法拉第常数(其数值为965001C mol -?);E 为电池的电动势。所以测出该电池的电动势E 后,进而又可求出其它热力学函数。但必须注意,测定电池电动势时,首先要求电池反应本身是可逆的,可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆; (2)电池中不允许存在任何不可逆的液接界; (3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,亦即允许通过电池的电流为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,常用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位。 在进行电池电动势测量时,为了使电池反应在接近热力学可逆条件下进行,采用电位计测量。原电池电动势主要是两个电极的电极电势的代数和,如能测定出两个电极的电势,就可计算得到由它们组成的电池的电动势。由(9-1)式可推导出电池的电动势以及电极电势的表达式。下面以铜-锌电池为例进行分析。电池表示式为: 符号“|”代表固相(Zn 或Cu )和液相(4ZnSO 或4CuSO )两相界面;“‖”
初三电功率专题训练经典题目
“电功率及电功”专题复习 电功率概念辨析 1、 标有“PZ220-40”字样的灯泡正常工作10h ,消耗的电能是_________kW·h ,合_________J 。 2、 现有两个灯泡L1、L2,分别标有“10V 10W”和“9V 5.4W”的字样.当将它们串联使用时,电路两端 允许加的最大电压是______V ;当将他们并联使用时,干路允许通过的最大电流是______A ,电路消耗的最大功率是_______W . 3、 如图5—3所示,当S 闭合,甲、乙两表为电压表时,两表示数比为U 甲︰U 乙=5︰3;当S 断开,甲、 乙两表为电流表时,两表示数比为I 甲︰I 乙=______,此时R 1和R 2消耗的功率之比P 甲︰P 乙=________。 4、 下列说法中,正确的是 ( ) A . 电功率是表示电流做功多少的物理量 B .电功率是表示电流做功快慢的物理量 C .用电器的电功率越大,做功越多 D .相同时间,消耗功率大的用电器耗电一定多 5、下列电器正常工作时,每秒做功为几十焦耳的是 ( ) A .电饭锅 B .教室里的一只日光灯 C .家用手电筒里的灯泡 D .空调器 6、额定电压相同的甲、乙两只白炽灯串联接入电路,发现甲灯比乙灯亮,则下列说法中正确的是 ( ) A.甲灯额定功率和实际功率都比乙灯大 B.甲灯额定功率大,但实际功率小 C.甲灯额定功率和实际功率都比乙灯小 D.甲灯额定功率小,但实际功率大 7、生活中下列用电的做法,正确的是( ) A .用粗铜线代替保险丝 B .开关串联在零线上 C .使用测电笔时手指不接触笔尖金属部位 D .使用洗衣机不接地 8、如图2所示,电源电压保持不变,R 1=2R 2,开关S断开时,电流表的示数为I1,R 1消耗的功率为P 1;开关S 闭合时,电流表示数为电流表的示数为I2,R1消耗的功率为P2,则( ) A .I1∶I2=1∶1,P 1∶P 2=3∶1 B .I1∶I2=1∶3,P 1∶P 2=1∶1 C .I1∶I2=3∶1,P 1∶P 2=1∶1 D .I1∶I2=1∶1,P 1∶P 2=1∶3 9、右图所示的电路中,电源电压为30V ,定值电阻为30Ω,滑动变阻器标有"60Ω,1.5A"字样,在该电路正常使用的情况下,则( ) A .电路消耗的最大功率为75W B.电流表的最大示数为1.5 A C .滑动变阻器消耗的最小功率为45W D.电路总电阻的变化围为0Ω~20Ω 10、如图所示,电源电压不变.闭合开关S 后,当滑动变阻器的 滑片P 向右移动时,下列判断正确的是 ( ) A.电流表示数变小,电压表示数变小,R 1功率变小 B.电流表示数变小,电压表示数变大,R 1功率变大 C.电流表示数变大,电压表示数不变,R 1功率变大 D.电流表示数变小,电压表示数不变,R 1功率变小 11、如图所示电路中,设电源电压不变,灯电阻不变.闭合开关S,在滑动变阻器滑片移动的过程中,电流表的最小示数是0.2A,电压表的最大示数是4V ,灯L 的 最大功率与最小功率之比为9:4,则 ( ) A.电源电压是6V B.灯的电阻是40Ω C.电源电压是4V D.电路消耗的最大功率是2.4W 第9题图 第10题图 A R 1 R 2 P S V V A 11题图 P L S R
2021届高考化学一轮复习专项测试:专题十二 考点一 原电池原理及其应用 (3)
2021届高考化学一轮复习专项测试专题十二 考点一原电池原理及其应用(3) 1、将反应2Al+6H+=2Al3++3H2↑的化学能转化为电能,能达到目的的是( ) 2、人工光合系统装置(如图)可实现以CO2和H2O合成CH4。下列说法不正确的是( ) A.该装置为原电池,且铜为正极 B.电池工作时,H+向Cu电极移动 C.GaN电极表面的电极反应式为:2H2O-4e-=O2+4H+ D.反应CO2+2H2O 光照CH4+2O2中每消耗1mol CO2转移4mol e- 3、某同学按下图所示的装置进行实验。A、B为两种常见金属,它们的硫酸盐可溶于水,当 SO从右向左通过交换膜移向A极。下列分析正确的是( ) K闭合时,2- 4
A. 溶液中c (2A +)减小 B. B 极的电极反应:2B 2e =B -+- C. Y 电极上有2H 产生,发生还原反应 D. 反应初期,X 电极周围出现白色胶状沉淀 4、由W 、X 、Y 、Z 四种金属按下列装置进行实验。下列说法不正确的是( ) 装置 现象 金属W 不断溶解 Y 的质量增加 W 上有气体产生 A.装置甲中W 作原电池负极 B.装置乙中Y 电极上的反应式为2+-Cu +2e =Cu C.装置丙中电流由Z 流向W D.四种金属的活动性强弱顺序为Z>W>X>Y 5、流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu +PbO 2+2H 2SO 4=CuSO 4+PbSO 4+2H 2O 。下列说法不正确的是( )
【实验报告】原电池电动势的测定实验报告
原电池电动势的测定实验报告 实验目的 1.掌握可逆电池电动势的测量原理和电位差计的操作技术 2.学会几种电极和盐桥的制备方法 3.学会测定原电池电动势并计算相关的电极电势 实验原理 凡是能使化学能转变为电能的装置都称之为电池(或原电池)。 可逆电池应满足如下条件: (1)电池反应可逆,亦即电池电极反应可逆;(2)电池中不允许存在任何不可逆的液接界;(3)电池必须在可逆的情况下工作,即充放电过程必须在平衡态下进行,即测量时通过电池的电流应为无限小。 因此在制备可逆电池、测定可逆电池的电动势时应符合上述条件,在精确度不高的测量中,用正负离子迁移数比较接近的盐类构成“盐桥”来消除液接电位;用电位差计测量电动势可满足通过电池电流为无限小的条件。电位差计测定电动势的原理称为对消法,可使测定时流过电池的电流接近无限小,从而可以准确地测定电池的电动势。 可逆电池的电动势可看作正、负两个电极的电势之差。设正极电势为φ+,负极电势为φ-,则电池电动势E = φ+ - φ- 。 电极电势的绝对值无法测定,手册上所列的电极电势均为相对电极电势,即以标准氢电极作为标准,规定其电极电势为零。将标准氢电极与待测电极组成电池,所测电池电动势就是待测电极的电极电势。由于氢电极使用不便,常
用另外一些易制备、电极电势稳定的电极作为参比电极。常用的参比电极有甘汞电极、银-氯化银电极等。这些电极与标准氢电极比较而得的电势已精确测出,具体的电极电位可参考相关文献资料。 以饱和甘汞电极与铜/硫酸铜电极或锌/硫酸锌电极组成电池,测定电池的电动势,根据甘汞电极的电极电势,可推得这两个电极的电极电势。 仪器和试剂 SDC-II型数字式电子电位差计,铜电极,锌电极,饱和甘汞电极,0.1 mol?L-1 CuSO4 溶液,0.1 mol?L-1 ZnSO4 溶液,饱和KCl 溶液。 实验步骤 1. 记录室温,打开SDC-II型数字式电子电位差计预热5 分钟。将测定旋钮旋到“内标”档,用1.00000 V电压进行“采零”。 2. 电极制备:先把锌片和铜片用抛光砂纸轻轻擦亮,去掉氧化层,然后用水、蒸馏水洗净,制成极片。 3. 半电池的制作:向两个50 mL 烧杯中分别加入1/2 杯深0.1000 mol?L-1 CuSO4 溶液和0.1000 mol?L-1 ZnSO4 溶液,再电极插入电极管,打开夹在乳胶管上的弹簧夹,将电极管的尖嘴插入溶液中,用洗耳球从乳胶管处吸气,使溶液从弯管流出电极管,待电极一半浸没于溶液中时,用弹簧夹将胶管夹住,提起电极管,保证液体不会漏出电极管,如有滴漏,检查电极是否插紧。 4. 原电池的制作:向一个50 mL 烧杯中加入约1/2 杯饱和氯化钾溶液,将制备好的两个电极管的弯管挂在杯壁上,要保证电极管尖端上没有气泡,以免电池断路。
