常见酸和碱知识点汇总
常见的酸和碱
一、酸碱指示剂
1指示剂的概念
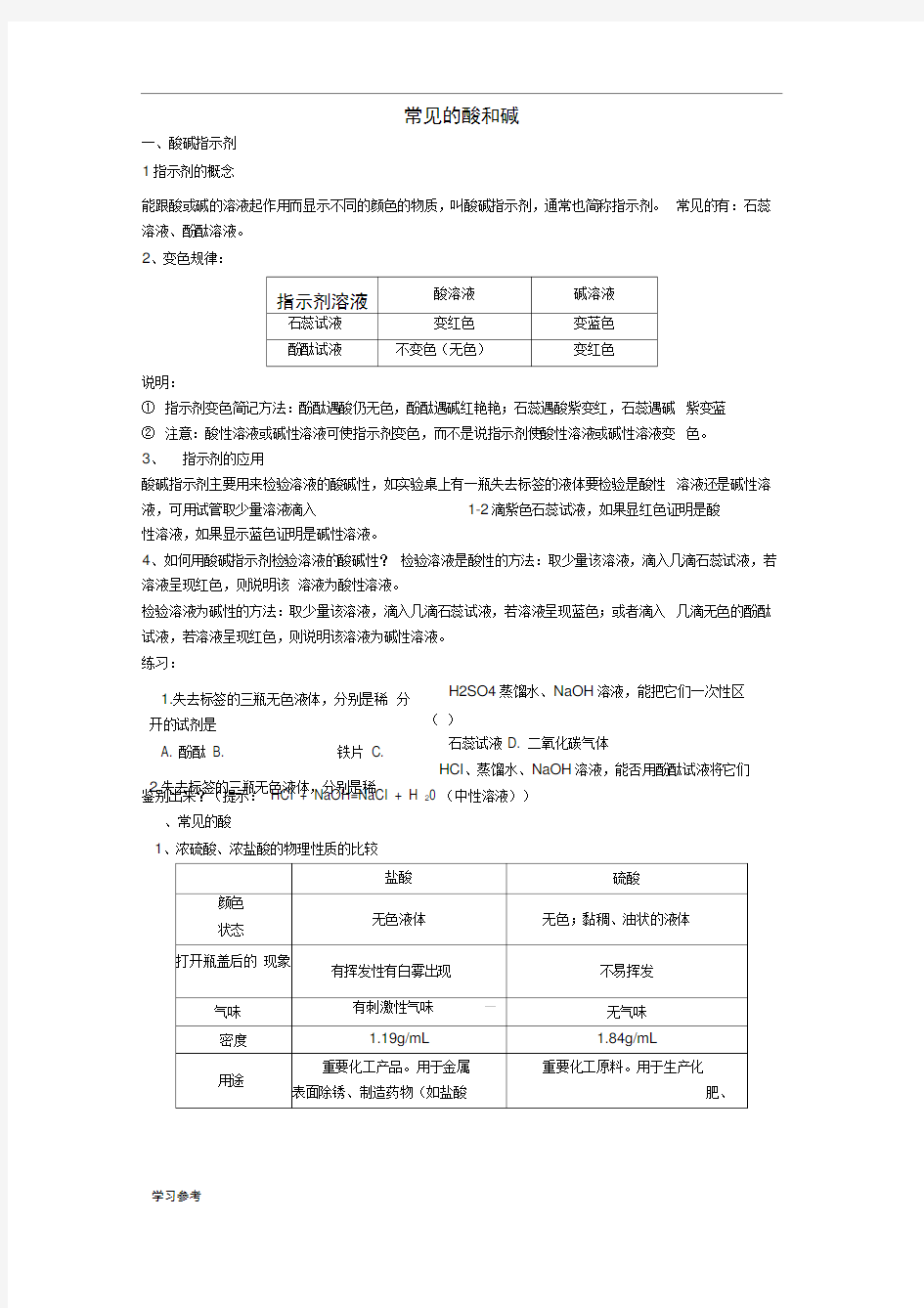
能跟酸或碱的溶液起作用而显示不同的颜色的物质,叫酸碱指示剂,通常也简称指示剂。 常见的有:石蕊溶液、酚酞溶液。
2、变色规律:
说明:
① 指示剂变色简记方法:酚酞遇酸仍无色,酚酞遇碱红艳艳;石蕊遇酸紫变红,石蕊遇碱 紫变蓝 ② 注意:酸性溶液或碱性溶液可使指示剂变色,而不是说指示剂使酸性溶液或碱性溶液变 色。
3、 指示剂的应用
酸碱指示剂主要用来检验溶液的酸碱性,如实验桌上有一瓶失去标签的液体要检验是酸性 溶液还是碱性溶液,可用试管取少量溶液滴入
1-2滴紫色石蕊试液,如果显红色证明是酸
性溶液,如果显示蓝色证明是碱性溶液。
4、 如何用酸碱指示剂检验溶液的酸碱性? 检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,若
溶液呈现红色,则说明该 溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;或者滴入 几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。 练习:
H2SO4蒸馏水、NaOH 溶液,能把它们一次性区
( )
石蕊试液 D. 二氧化碳气体
HCI 、蒸馏水、NaOH 溶液,能否用酚酞试液将它们
鉴别出来?(提示: HCI + NaOH=NaCI + H 20 (中性溶液))
、常见的酸
1、浓硫酸、浓盐酸的物理性质的比较
1.失去标签的三瓶无色液体,分别是稀 分
开的试剂是
A. 酚酞
B. 铁片
C.
2.失去标签的三瓶无色液体,分别是稀
2
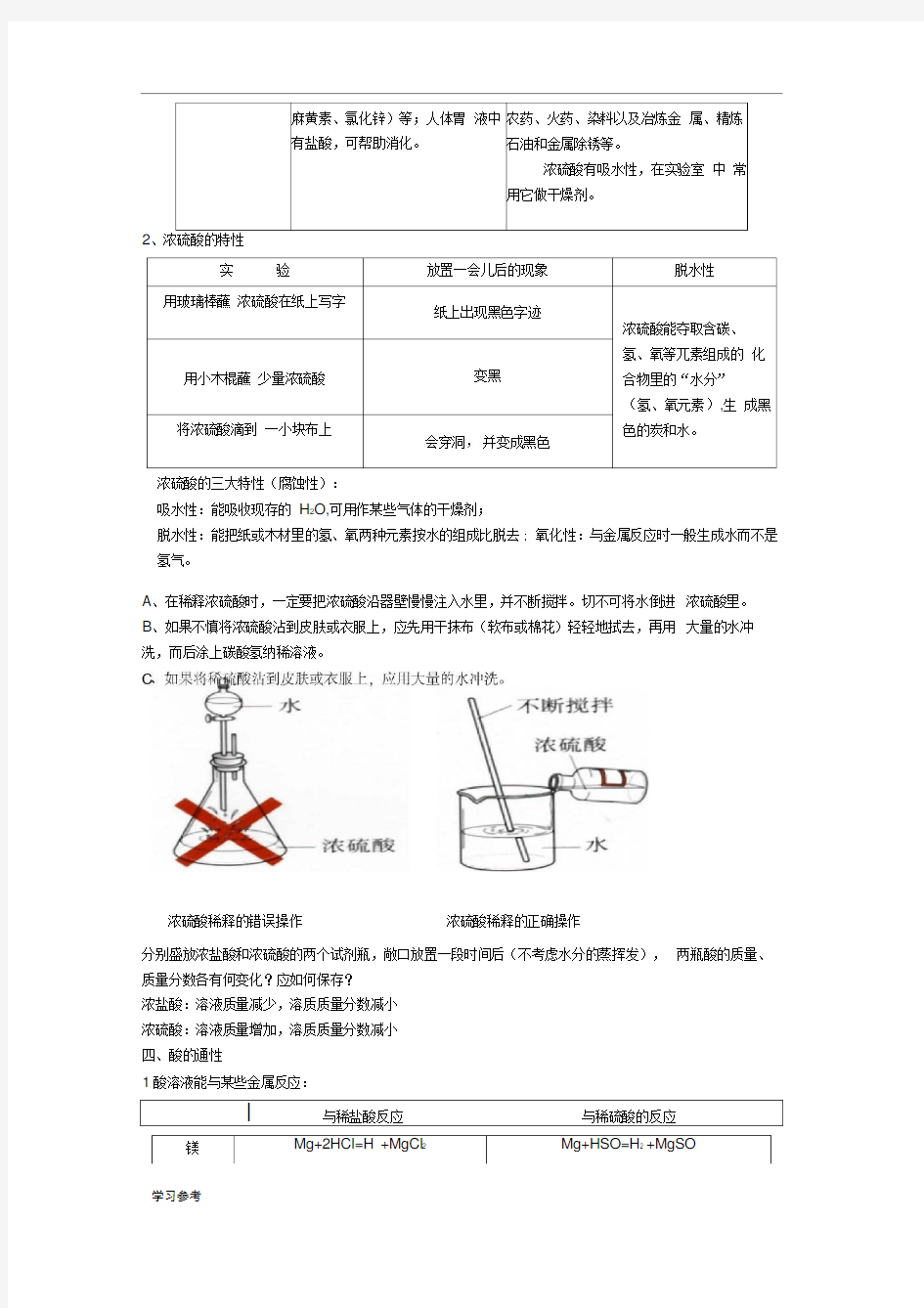
浓硫酸的三大特性(腐蚀性):
吸水性:能吸收现存的H2O,可用作某些气体的干燥剂;
脱水性:能把纸或木材里的氢、氧两种元素按水的组成比脱去; 氧化性:与金属反应时一般生成水而不是氢气。
A、在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水里,并不断搅拌。切不可将水倒进浓硫酸里。
B、如果不慎将浓硫酸沾到皮肤或衣服上,应先用干抹布(软布或棉花)轻轻地拭去,再用大量的水冲洗,而后涂上碳酸氢纳稀溶液。
浓硫酸稀释的错误操作浓硫酸稀释的正确操作
分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸挥发),两瓶酸的质量、质量分数各有何变化?应如何保存?
浓盐酸:溶液质量减少,溶质质量分数减小
浓硫酸:溶液质量增加,溶质质量分数减小
四、酸的通性
1酸溶液能与某些金属反应:
A. 在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B. 排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg 反应有明显放热现象;
C. 强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D .该类反应属于置换反应
2、酸与金属氧化物反应
3、酸与碱反应
H2SQ + Cu(OH) 2 = CuSO 4 + 2H 2O
HCl + NaOH =NaCI + H 2O
酸能与碱反应生成盐和水
4、酸与某些盐反应生成新酸和新盐
HCI + AgNO 3 ==AgCI +严0 3
HCI + CaCI 2 ==CaCl2 + CO 彳 + H 2。
五、酸的分类和命名
「含氧酸:多数按中心元素命名为某酸,如硫酸(HSQ)按是否含氧Y 无氧酸:命名为氢某酸,如盐酸(HCI)又叫氢氯酸
{
L 一元酸:HCI、HNO等
(醋酸CH3COO为一元酸)
二元酸:HSQ等
三元酸:H3PC4等
练一练:
1能使紫色石蕊溶液变蓝的溶液,它能使无色酚酞溶液()
A.变红色B .变蓝色C .呈无色D .变紫色
2. 下列物质的水溶液能使紫色石蕊溶液变红色的是()
A. NaCI B . NH3 C . HCI D . NaOH
3. 下列物质不能由金属和稀盐酸直接制取的是()
A. MgCI2 B . FeCI2 C . CuCI2 D . FeCI3
4?某同学不慎将浓硫酸沾到皮肤上,正确的做法是( )
A.先用较多的水冲洗 B ?先用氢氧化钠溶液冲洗
C. 后涂上3%~5喲碳酸氢钠溶液 D .不作任何处理
六、常见的碱
①物理性质:
氢氧化钠是白色固体,易溶于水,并放出大量热。
氢氧化钠在空气中易潮解(固体物质曝露在空气中吸收空气中的水分表面潮湿并逐渐溶解, 这种现象叫做潮解)一一可作某些气体的干燥剂。
思考:潮解是物理变化还是化学变化?
②腐蚀性:
氢氧化钠有强烈的腐蚀性,所以,它的俗名叫做苛性钠、火碱或烧碱。如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼
镜。
③用途:
氢氧化钠是一种重要的化工原料,广泛应用于肥皂、石油、造纸、纺织和印染等工业。氢氧化钠能与油脂反应,在生活中可以用来去除油污,如炉具清洁剂中就含有氢氧化钠。
2、氢氧化钙[Ca(OH)2]
氢氧化钙俗称熟石灰或消石灰,它可由生石灰(CaO)与水反应得到:
CaO + H2O === Ca(OH)2 (反应中放出大量热)
氢氧化钙对皮肤、衣服等也有腐蚀作用。
氢氧化钠、氢氧化钙都属于碱。除这两种碱外,常用的碱还有氢氧化钾(KOH)、氨水(NH3 ? H20等。
复习巩固:
1. 下列关于氢氧化钠的描述中错误的是()
A .易溶于水,溶解时放出大量的热
B .对皮肤有强烈的腐蚀作用
C .水溶液能使石蕊溶液变红
D .能除去油污,可做厨房的清洁剂
2. ____________________________________________如果不慎将碱液沾到皮肤上,要用较多的______________________________________________________ 冲洗,再涂上___________ 溶液。
3. ___________________________________________________ 氢氧化钠有强烈的腐蚀性,所以,它的俗名叫做_______________________________________________ 、 ____________ 、 _________
它曝露在空气中时容易____________________ ,表面潮湿并逐渐_____________ ,这种现象叫做
______________ ;因此,氢氧化钠可以作某些气体的________________________ 。
4. _______________________________________ 澄清石灰水能使紫色石蕊溶液变成,使无色酚酞溶液变成____________________________________ 。澄清石
灰水中的溶质是___________ ,俗称 __________ 或__________ 。写出检验二氧化碳的化学方程式
5?下列各组物质,属于同种物质的是 A 、生石灰、熟石灰、消石灰 B 6 .下列物质中,长期放在敞口瓶里会变质的是
()
A 、大理石
B 、浓硫酸
C
、熟石灰
D 、石墨
7 .下列哪些物质溶于水或和水反应时能放出大量的热 (
) 七、碱的通性
1碱与某些非金属氧化物反应生成盐和水
① 回忆:二氧化碳使澄清石灰水变浑浊
Ca(OH) 2+CO==CaCOj +H 2O
氢氧化钙能与空气中的二氧化碳反应,生成坚硬的碳酸钙。将氢氧化钙粘土和沙子混凝, 用来做建筑材料,就是利用氢氧化钙的这一性质。
② 氢氧化钠在空气中不仅吸收水分而潮解,还会与空气中的二氧化碳发生反应而变质:
2NaOH+CO=N@CO+H 2O
所以,氢氧化钠必须密封保存。
讨论:上面两个反应有什么共同之处?三氧化硫与碱的反应与上面的两个反应类似,试写 出三氧化硫与氢氧化钠反应的化学方程式:
2NaOH+SO=Na 2SQ+H 2O
③ 常见反应
2NaOH+CONe 2CO+H2O Ca(OH )2+CO=CaCOj +H 2O 2NaOH + SO=Na z SO + H 2O 2NaOH + SO=Na 2SO + H 2O
Ca(OH )2+SO=CaSOj +"O Ca(OH )2+SO=CaSO+H2O
2、碱与酸反应生成盐和水
Ca(OH) 2 + H 2SQ = CaSO 4 + 2H 2。 NaOH+ HCl =NaCl + H 2O
3、碱与盐反应生成新碱和新盐(两种反应物都可溶,生成物中有沉淀或气体反应才能进行) NaOH Ca(OH )2、KOH Ba(OH )2都是典型的碱,表现了碱的通性(其他碱一般难溶) 2NaOH + CuSO== Cu(OH) 2 J + NaSC 4 2NaOH + MgCb == Mg(OH) 2 J + 2NaCl 3NaOH + FeCI 3 == Fe(OH) 3 J + 3NaCl Ba(OH )2 + Na 2SQ ==BaSQ J + 2 NaOH Ca(OH) 2 + Na 2CO ==CaCO J + 2NaOH
5、碱的分类、命名、特性
①碱的分类(根据碱的溶解性)
可溶性碱:NaOH Ca(OH)2、KOH Ba(OH )2、NH? H 2O 等 难溶性碱:C U (OH )2、Fe(OH )3、Mg(OH> 等
变价金属元素形成的碱:
i
、金刚石、石灰石、大理石
C 沼气、天然气、煤气
D 、烧碱、火碱、苛性钠
A 、氢氧化钠固体
B 、浓盐酸
C 、氧化钙
D 、氢氧化钙固体
高价金属的碱一一氢氧化某,如Fe(OH)3――氢氧化铁
低价金属的碱一一氢氧化亚某,如Fe(OH)2――氢氧化亚铁
③几种常见碱的溶解性和颜色
八、碱性氧化物和酸性氧化物
1凡是能跟酸起反应,生成盐和水的氧化物,叫做碱性氧化物,金属氧化物大多数是碱性氧化物。金属活动性强的碱性氧化物(如NaaO KO CaO等)可直接与水化合生成碱。
如:NaaO + H2O == 2NaOH
所以当把Na2O放入水中形成溶液时,溶质是NaOH而不是Na^Q其水溶液显碱性,PH> 7,
滴入无色酚酞试液变红色。
2、凡是能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物,非金属氧化物大多数是酸性
氧化物,但CO NC不是酸性氧化物,酸性氧化物多数能溶于水,跟水化合生成酸。SiO2不能溶于水,也不能与水反应,但它是酸性氧化物。
女口:SO + H 2O ==H2SQ , CO 2 + H 2O ==HzCQ
所以把SO通入水时,形成溶液中溶质是"SQ而不是SO。其中水溶液显酸性,PH< 7,滴
入紫色石蕊试液变红。
