高中化学必修化学方程式总结

高一化学上学期化学方程式总结
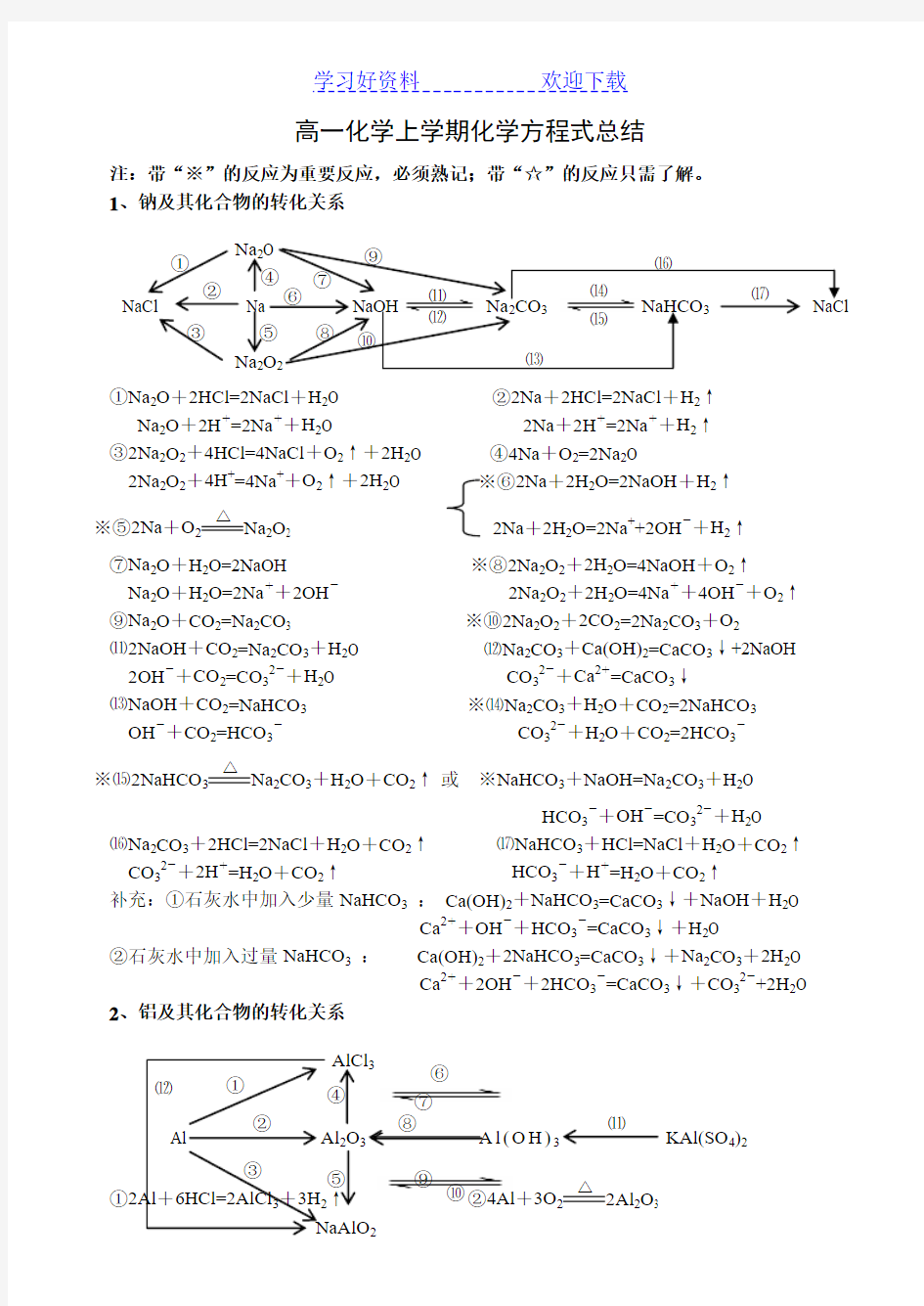
注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。 1、钠及其化合物的转化关系
①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑
Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na +
+H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O
2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2
△
2O 2 2Na +2H 2O=2Na ++2OH -
+H 2↑
⑦Na 2O +H 2O=2NaOH
※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑
Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -
+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2
⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH
2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+
=CaCO 3↓
⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3
OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-
※⒂2NaHCO 3
△
2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O
HCO 3-
+OH -
=CO 32-
+H 2O
⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑
CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +
=H 2O +CO 2↑
补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O
Ca 2++OH -+HCO 3-
=CaCO 3↓+H 2O
②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O
Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-
+2H 2O 2、铝及其化合物的转化关系
①↑ ②4Al +3O 2 △
2O 3
NaCl Na NaOH NaHCO Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂
④2O 3 A l (O H )3 KAl(SO 4)2
2
AlCl 3 ④ ⑤ ⑥
⑦
⑧ ⑨ ⑩ ⑾
2Al +6H +
=2Al 3+
+3H 2↑
※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O
2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3+
+3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl
Al 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+
⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3
△
Al 2O 3+3H 2O
Al(OH)3+3H +
=Al 3+
+3H 2O
☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3
AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-
※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +
Al(OH)3+OH -= AlO 2-
+2H 2O 明矾净水
⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-
+2H 2O 3、铁及其化合物的转化关系
①Fe 3O 4+4CO
△
+4CO 2 ※② 3Fe +4H 2O(g)
高温
Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2
点燃
Fe 3O 4
Fe +2H +=Fe 2+
+H 2↑ ④2Fe +3Cl 2
点燃
2FeCl 3
※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 2
2Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+
⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2O
Fe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2+
+2H 2O
※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl
白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -
= Fe(OH)3↓
⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +
(净水) Fe(OH)3+3H +
= Fe 3+
+3H 2O ⑿2Fe(OH)3
△
Fe 2O 3+3H 2O
⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KCl
Fe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -
= Fe(SCN)3 4、硅及其化合物的转化关系
①Si +O 2
△
SiO 2
SiF 4 Si
SiO 2 CaSiO 3
① ②
③
④ ⑤ ⑨
Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 O 3 ①
② ③ ④
⑤ ⑥ ⑦ ⑧ ⑨
⑩ ⑾
⒁
②SiO 2+2C
高温
Si +2CO ↑
※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃) ④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO
高温
CaSiO 3
※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3
高温
CaSiO 3+CO 2↑
SiO 2+2OH -
= SiO 32-
+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3
高温
Na 2SiO 3+CO 2↑ SiO 32-
+2H +
= H 2SiO 3↓
※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3
SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-
⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △
H 2O +SiO 2
H 2SiO 3+2OH -
= SiO 32-
+2H 2O 5、氯及其化合物的转化关系
①2Fe +3Cl 2 点燃
2FeCl 3 ②Cu +Cl 2 点燃
CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 2
2Fe 3++Cu = 2Fe 2++Cu 2+
④H 2+Cl 2 2HCl
※⑤MnO 2+4HCl(浓) △
MnCl 2+Cl 2↑+2H 2O
MnO 2+4H ++2Cl - △ Mn 2+
+Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑
Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -
+O 2↑
※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O
Cl 2+2OH -= Cl -+ClO -
+H 2O 工业制漂白粉
※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClO
Ca 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H +
= HClO 漂白粉的漂白原理
向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClO
ClO -+H 2O +CO 2 = HCO 3-
+HClO
CuCl 2 HClO HCl Cl 2 FeCl 3
NaClO Ca(ClO)2
① ② ③ ④
⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃
或光照 光照
光照
6、硫及其化合物的转化关系
①S+O2点燃SO2
②2H2S+SO2=3S+2H2O
※③SO2+O2
催化剂
加热
2SO3
④SO3+H2O = H2SO4
⑤SO2+CaO
△
CaSO3或SO2+Ca(OH)2 = CaSO3↓+H2O
⑥SO3+CaO = CaSO4SO2+Ca2++2OH-=CaSO3↓+H2O
SO3+Ca(OH)2 = CaSO4+H2O ⑦2CaSO3+O2
△
2CaSO4
※⑧SO2+Cl2+2H2O = H2SO4+2HCl ※⑨Cu+2H2SO4(浓)
△
CuSO4+SO2↑+2H2O SO2+Cl2+2H2O = 4H++SO42-+2Cl-Cu+2H2SO4(浓)
△
Cu2++SO42-+SO2↑+2H2O ※⑩C+2H2SO4(浓)
△
2
↑+2SO2↑+2H2O
7、氮及其化合物的转化关系
※①N2+O22NO
※②2NO+O2 = 2NO2
※③3NO2+H2O = 2HNO3+NO
3NO2+H2O =2H++2NO3-+NO
以上三个反应为“雷雨发庄稼”原理
扩展反应有:4NO2+O2+2H2O = 4HNO3
4NO+3O2+2H2O = 4HNO3
※④Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O上面两个反应主要用于气体溶于水时的计算Cu+4H++2NO3-=Cu2++2NO2↑+2H2O 或4HNO3 4NO2↑+ O2↑+ 2H2O C+4HNO3(浓)
△
CO2↑+2NO2↑+2H2O 浓硝酸见光易变黄的原因
※⑤3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O ⑥N2+3H2
催化剂
高温高压
2NH3 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 合成氨反应是人工固氮的主要途径
⑦NH3+HCl = NH4Cl ⑧NH4Cl
△
NH3↑+HCl↑NH3+H+= NH4+(水溶液中)补充:NH4HCO3△NH3↑+H2O+CO2↑
氨气与酸均能反应生成铵盐,且与挥发性酸铵盐受热都易分解,但并不是所有的铵盐
(如浓HCl、浓HNO3)相遇时空气中有白烟都分解出氨气,如NH4NO3、(NH4)2SO4
※⑧NH4Cl+NaOH
△
+NH3↑+H2O NH4++OH-
△
NH3↑+H2O 所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
※⑧⑶2NH4Cl+2Ca(OH)2
△
CaCl2+2NH3↑+2H2O
实验室制氨气,此反应为固体反应,不能写成离子方程式。
☆⑨4NH3+5O2催化剂
△
4NO+6H2O 氨的催化氧化反应,工业制硝酸的第一步。
注:带“※”的反应为重要反应,必须熟记;带“☆”的反应只需了解。
①
S 4
②
①⑨
⑧
⑦
⑥
N2NH3NH4Cl
NO NO HNO3
②③
高温或放电
光照
高中化学方程式总结整理
1 高中化学方程式 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过 量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3 Cl2+PCl3PCl5 Cl 2+2Na2NaCl 3Cl2+2Fe2FeCl3 Cl2+CuCuCl2 Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl?) Cl2+2NaBr===2NaCl+Br2Cl2+2Br?=2Cl?+Br2
Cl2+2KI===2KCl+I2Cl2+2I?=2Cl?+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3FeFe3O4 O2+K===KO2 S+H 2H2S 2S+CCS2S+ZnZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2CuCu 2S (只能由单质制取,不能由离子制取) 3S+2AlAl2S3 (只能由单质制取,不能由离子制取) N 2+3H2催化剂 高温高压2NH3 N2+3MgMg3N2 N2+3CaCa3N2 2 N 2+3BaBa3N2 N2+6Na2Na3N N2+6K2K3N N 2+6Rb2Rb3N N2+2Al2AlN P 4+6H24PH3P+3NaNa3P 2P+3ZnZn3P2 H 2+2Li2LiH 2、还原性
人教版高中化学必修一必修二化学方程式汇总
必修一、必修二化学方程式汇总 必修一 1、硫酸根离子的检验: B a C l2 + N a2S O4 ==== B a S O4↓+ 2N a C l 2、碳酸根离子的检验:C a C l2+N a2C O3=====C a C O3↓ +2N a C l 3、碳酸钠与盐酸反应:N a2C O3+2H C l=====2N a C l+H2O +C O2↑ 4、木炭还原氧化铜:2C u O+C 高温 2C u+C O2↑ 5、铁片与硫酸铜溶液反应:F e+C u S O4=====F e S O4+C u 6、氯化钙与碳酸钠溶液反应:C a C l2+N a2C O3=====C a C O3↓+ 2N a C l 7、钠在空气中燃烧:2N a+O2 N a2O2 钠与氧气反应:4N a+O2====2N a2O 8、过氧化钠与水反应:2N a2O2+2H2O====4N a O H+O2↑ 9、过氧化钠与二氧化碳反应:2N a2O2+2C O2====2N a2C O3+O2 10、钠与水反应:2N a+2H2O====2N a O H+H2↑ 11、铁与水蒸气反应:3F e+4H2O(g)====F e3O4+4H2↑ 12、铝与氢氧化钠溶液反应:2A l+2N a O H+2H2O====2N a A l O2 +3H2↑ 13、氧化钙与水反应:C a O+H2O====C a(O H)2 14、氧化铁与盐酸反应:F e2O3+6H C l=====2F e C l3+3H2O
15、氧化铝与盐酸反应:A l2O3+6H C l=====2A l C l3+3H2O 16、氧化铝与氢氧化钠溶液反应:A l2O3 + 2N a O H ===== 2N a A l O2 +H2O 17、氯化铁与氢氧化钠溶液反应:F e C l3 + 3N a O H ===== F e(O H)3↓+3N a C l 18、硫酸亚铁与氢氧化钠溶液反应:F e S O4 + 2N a O H ==== F e(O H)2↓+N a2S O4 19、氢氧化亚铁被氧化成氢氧化铁:4F e(O H)2+2H2O+O2==== 4F e(O H)3 20、氢氧化铁加热分解:2F e(O H)3 F e2O3+3H2O↑ 21、实验室制取氢氧化铝:A l2(S O4)3+6N H3·H2O==== 2A l(O H)3↓ +3(N H3)2S O4 22、氢氧化铝与盐酸反应:A l(O H)3 + 3H C l ==== A l C l3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:A l(O H)3 + N a O H ==== N a A l O2 +2H2O 24、氢氧化铝加热分解:2A l(O H)3 A l2O3+3H2O 25、三氯化铁溶液与铁粉反应:2F e C l3+F e====3F e C l2 26、氯化亚铁中通入氯气:2F e C l2+C l2=====2F e C l3 27、二氧化硅与氢氟酸反应:S i O2+4H F====S i F4+2H2O 硅单质与氢氟酸反应:S i+4H F====S i F4+2H2↑
高一必修一化学方程式及离子方程式总结
必修一化学方程式及离子方程式小结 1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓ 2、碳酸根离子的检验:CaCl2 + N a2CO3 = CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓ 3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+== CO2↑+ H2O 4、木炭还原氧化铜:2CuO + C 2Cu + CO2↑ 5、钠与非金属单质反应: 4Na+O2=2Na2O 2Na+O2 Na2O2 Cl2 +2Na 2NaCl 6、钠与水反应:2Na+2H2O=2NaOH+H2↑ 2Na + 2H2O == 2Na+ + 2OH-+ H2↑ 7、氧化钠的主要化学性质:2Na2O+O2 2Na2O2 Na2O+H2O=2NaOH Na2O+SO3=Na2SO4 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O 8、过氧化钠的主要反应:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2
9、氯气的主要化学性质: Cl2 +H2 2HCl (或光照) 3Cl2 +2P 2PCl3 Cl2 +PCl3 PCl5 3Cl2 +2Fe 2FeCl3 Cl2 +2Na 2NaCl Cl2+Cu CuCl2 Cl2 +2FeCl2 =2FeCl3 Cl2 + 2Fe2+ == 2Fe3+ + 2Cl- 2Cl2+2NaBr=2NaCl+Br2 Cl2 + 2KI =2KCl + I2 Cl2 + 2I- == 2Cl - + I2 Cl2+H2O=HCl +HClO Cl2 + H2O == Cl- + H+ + HClO Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 + SO2 + 2H2O == 2Cl- + SO42- + 4H+ Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2 + 2OH- == Cl- + ClO- + H2O 10、铁及其化合物的主要化学性质:2Fe + 3Cl2 2FeCl3 3Fe + 2O2 Fe3O4 Fe + S FeS 3Fe+4H2O(g) Fe3O4+4H2 Fe+2HCl=FeCl2+H2↑ Fe+2H+ = Fe2+ + H2↑ Fe + CuSO4 = FeSO4 + Cu Fe + Cu2+ = Fe2+ + Cu 4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O 2FeCl2 + Cl2=2FeCl3 2FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2 FeCl3 + 3KSCN == Fe(SCN)3 + 3KCl
高一化学《必修一》方程式总结
高一化学《必修一》方程式总结第一、二章: 1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 3、银离子的检验:Cl -+ Ag += AgCl ↓ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6. 镁在二氧化碳中燃烧: 2Mg +CO2点燃 2MgO +C 第三章: 一、钠 1、钠在空气中燃烧(黄色的火焰):2Na +O2Na2O2 2、钠块在空气中变暗:4Na+O2=2Na2O 3、Na2O在空气中加热(变黄):2Na2O+O2△2O2 4、金属锂在空气中燃烧:4Li +O2△2Li2O 5、钠与水反应(浮、熔、游、响、红) 2Na +2H2O =2NaOH+H2↑ 2Na +2H2O =2Na++2OH -+H2 ↑ Na2O 、Na2O2的相关反应: 6、碱性氧化物Na2O与水的反应:Na2O+H2O=2NaOH 7、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,可用于漂白) 2Na2O2+2H2O =4NaOH +O2↑ 2Na2O2+2H2O =4Na++4OH -+O2↑ 8、碱性氧化物Na2O与CO2的反应Na2O +CO2=Na2CO3 9、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na2O2+2CO2=2Na2CO3+O2 10、Na2O +SO2=Na2SO3Na2O2+SO3=Na2SO4
11、Na2O +2HCl =2NaCl +H2O 12、2Na2O2+4 HCl =4 NaCl +2 H2O +O2↑ 14、小苏打受热分解:2NaHCO3△ Na2CO3+H2O +CO2 ↑ 15、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO3+NaOH △ Na2CO3+H2O 16、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式: NaHCO3+NaOH =Na2CO3+H2O HCO3-+OH -=H2O +CO32- 17、向NaOH溶液中通入少量CO2 :2NaOH + CO2 = Na2CO3 + H2O 18、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3 总反应方程式:NaOH + CO2 = NaHCO3 19、苏打(纯碱)与盐酸反应: ①盐酸中滴加纯碱溶液 Na2CO3+2HCl =2NaCl +H2O +CO2↑CO32-+2H+=H2O +CO2↑②纯碱溶液中滴加盐酸,至过量 Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3- NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O +CO2↑ 20、(1)Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应: Na2CO3 +Ca(OH)2 =CaCO3↓+2 NaOH NaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O 2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O 21、Na2CO3溶液、NaHCO3溶液与CaCl2反应: Na2CO3 +CaCl2 =CaCO3↓+2 Na Cl NaHCO3溶液与CaCl2 不反应; 二、经典Al三角:
高中化学方程式总结
最新高中化学方程式汇编﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡无机化学反应方程式﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡§1◆碱金属元素 4Na+O2===2Na2O 2Na2O+ O2Na2O2 4Na+2O22Na2O22Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2↑Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑ (此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.) Na2O+CO2===Na2CO32Na2O2+2CO2===2Na2CO3+O2 Na2CO3+HCl===NaHCO3+NaCl NaHCO3+HCl===NaCl+H2O+CO2↑ Na2CO3+2HCl===2NaCl+ H2O+ CO2↑ 2NaHCO3Na2CO3+ H2O+ CO2↑ 4Li+ O2 2 Li2O 2K+2H2O===2KOH+H2↑ NaHCO3 + NaOH== Na2CO3 + H2O Na2CO3+ H2O+ CO2 = 2NaHCO3 2NaOH+ CO2 (少量)== Na2CO3 + H2O NaOH+ CO2(多量)== NaHCO3 Na2CO3+ Ca(OH)2=Ca CO3↓+2 NaOH2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO3NaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O NaOH+HCl===NaCl+H2O CO2+Ca(OH)2(过量)===CaCO3↓+H2O 2CO2(过量)+Ca(OH)2===Ca(HCO3)2 Na2O+2HCl===2NaCl+H2O Na2O+SO3===Na2SO4 CaCO3CaO+CO2↑MgCO3MgO+CO2↑ 2Fe(OH)3Fe 2O3 + 3H2O Mg(OH)2Mg O+ H2O Cu(OH)2Cu O+ H2O 2Al(OH)3Al 2O3 + 3H2O CaCO3+H2O +CO2=Ca(HCO3)2 2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4 3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl §2卤族元素 Cl2+Cu Cu Cl23Cl2+2Fe2FeCl3 Cl2+2 Na 2Na Cl Cl2 + H22HCl 3Cl2 +2 P 2PCl3 Cl2 + PCl3PCl5 Cl2+H2O==HCl+HClO Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O Cl2+2FeCl2===2FeCl3 Ca(ClO)2+H2O+ CO2(少量)== Ca CO3↓+2 HClO
人教版高中化学必修一化学方程式汇总
高中化学(人教版)必修一化学方程式汇总 1、硫酸根离子的检验: BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温 2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 ===== FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 Na2O2 钠与氧气反应:4Na + O2 ==== 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) ==== Fe3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O
高一化学必修一方程式总结
高一化学方程式总结(一) 1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2△Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 △Fe2O3 + 3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3?H2O = 2Al(OH)3↓ + 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 △Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3 33、氯气与金属铜反应:Cu + Cl2 点燃CuCl2 34、氯气与金属钠反应:2Na + Cl2 点燃2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO 36、次氯酸光照分解:2HClO 光照2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O 39、盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3
所有重要的高中化学方程式汇总
所有重要的高中化学方 程式汇总 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
高中化学专题之二-----高中化学方程式 一、非金属单质(F2,C l2,O2,S,N2,P,C,S i,H) 1、氧化性: F2+H2===2HF(阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2(水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF(ClF属于类卤素:ClF+H2O==HF+HClO) 3F2(过量)+Cl2===2ClF3(ClF3+3H2O==3HF+HClO3) Cl2+H22HCl(将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓
化学必修二化学方程式总结
必修二化学方程式 第一章物质结构元素周期律 1、Li与O2反应(点燃): 4Li + O2 2Li2 O Na与O2反应(点燃):2Na+O2Na2O2 Na与H2O反应: 2Na+2H2O===2NaOH+H2↑ K与H2O反应: 2K+2H2O===2KOH+H2↑ 2、卤素单质F2、Cl2、Br2、I2与氢气反应: F2 + H2 === 2HF Cl2 + H2错误!未找到引用源。= 2HCl Br2+ H2错误!未找到引用源。= 2Br I2+ H2错误!未找到引用源。= 2HI 3、卤素单质间的置换反应: (1)氯水与饱和溴化钠、氯水与饱和碘化钠溶液反应: ① Cl2+2NaBr===Br2+2NaCl ② Cl2+2NaI===I2+2NaCl (2)溴水与碘化钠溶液反应:Br2+2NaI===I2+2NaBr 4、Mg与H2O反应:Mg+2H2O 错误!未找到引用源。= Mg(OH)2+H2↑ Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑
Mg与HCl反应: Mg+2 HCl 错误!未找到引用源。= MgCl2+ H2↑ 5、Na与Cl2反应(点燃): 6、用电子式表示氯 化氢的形成过程: 第二章化学反应与能量 1、Ba(OH)2?8H2O与NH4Cl的反应 : Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O 2、原电池原理 典型的原电池(Zn-Cu原电池) 负极(锌):Zn-2e-===Zn2+(氧化反应) 正极(铜):2H++2e-===H2↑(还原反应) 电子流动方向:由锌经过外电路流向铜。
人教版必修一化学方程式归纳齐全
人教版《化学必修1》化学方程式归纳 、钠及其化合物 1. 钠与氧气:常温:4Na+O= 2Na2O 点燃:2Na + O2 - Na zQ 2. 钠与水反应:_2Na + 2H 2O = 2NaOH + H2 f _离子方程式:2Na + 2H2O = 2Na* + 20H + H 2 f 3. 钠与硫酸反应:2Na +H2SQ = Na2SQ+Hd 4. 氧化钠与水反应:NaaO+HO= 2NaOH 5. 过氧化钠与二氧化碳反应:2Na2Q + 2CO 2 = 2Na 2CO +O2 f 6. 过氧化钠与水反应:2N3Q+2H2O =4NaOH+O f 离子方程式:2Na2Q+2HO=4N扌+ 4OH+Q f 7. NaOH溶液中通入少量CO: 2NaOH+CO Na z CO+HO 离子方程式:2OH+CO= CQ2「+HO NaOH溶液中通入过量CO: NaOH+CO NaHCO 离子方程式:_ OH +CO= HCQ「_ 8. ①向碳酸钠溶液滴入少量稀盐酸:Na 2CO + HCI = NaHCO 3 + NaCI _______________ 向稀盐酸滴入少量碳酸钠溶液:Na 2CO + 2HCI = 2NaCI + H 2O + CO2 f ______________________ ②除去碳酸氢钠溶液中混有的碳酸钠:Na 2CO + H2O +CO =2NaHCO_________________ ③碳酸钠与氢氧化钙: ____ Na 2CO + Ca(OH) 2 = CaCOj + 2NaOH _______________ ④碳酸氢钠与盐酸:NaHCO 3+HCI= NaCI+HO+CO ____________________ ⑤少量碳酸氢钠溶液滴入氢氧化钙溶液中:NaHCQ+ Ca(OH)2 = CaCOj + NaOH+ H2O 少量氢氧化钙溶液滴入碳酸氢钠溶液中:2NaHCQ+ Ca(OH)2 = CaCOj + Na 2CO + 2H 2O ⑥除去碳酸钠溶液中的碳酸氢钠:NaHCO 3+ NaOH 二 W2CO + H 2O ⑦除去碳酸钠固体中的碳酸氢钠:2NaHCQ Na z CO + H 2O +CQ f _________________ ⑧鉴别碳酸钠和碳酸氢钠溶液:Na 2CO + CaCI 2 = CaCOj + 2NaCI ______________ 、铝及其化合物 1. 铝与氧气的反应:4AI + 3O 22AI 2Q 高温 2. 铝与氧化铁反应(铝热反应):2AI + Fe 2Q 2Fe + Al 2Q 3. 铝和稀盐酸:2AI + 6HCI = 2AICI 3 + 3H 2 f 离子方程式:2AI + 6H + = 2AI 3+ + 3H 2 f 4. 铝和NaOH溶液:2AI+2NaOH+2HO=2NaAIO+3H f 离子方程式: 2AI+2OH +2H2O=2AIQ_+3H f 5. 氧化铝和稀硫酸:Al 2Q+3HSQ= Al 2(SO4)3+3HO 离子方程式: Al 2Q+6』=2AI 3*+3H2O 6. 氧化铝和NaOH溶液:AI2Q + 2NaOH错误!未找到引用源。2NaAIO2 +H2O离子方程式:Al 2O3 + 2 QH !未找到引用源。2 AIO 2-+HO -错误 7. 氢氧化铝和盐酸:AI(OH) 3+3HCI = AICI 3+3HO离子方程式: AI(OH) 3+3』=Al 3++3HO 8. 氢氧化铝和NaOH溶液:AI(OH) 3+NaOH错误!未找到引用源。NaAIO2+2H2O离子方程式:AI(OH) 3 +OH -错误!未找到引用源。AIO 2 +2HO 9. 氢氧化铝受热分解:2AI(OH) 3 Al 2Q_+3H2Q__ 10. 硫酸铝与氨水反应:Al2(SO4)3+6NH ? HO=2AI(OH)3j +3(NH4)2SQ 3亠亠 离子方程式:_ Al +3NH? H2O=AI(OH)3j +3NH ________ 11. AICI 3溶液中加入少量NaOH溶液:AICI 3+3NaO= Al ( OH) 3 J +3NaCI AICI 3 溶液中加入过量NaOH溶液:AICI 3 + 4NaOH = NaAIQ + 3NaCI+2H2O
专题-高一化学必修一化学方程式总结
高一化学必修一化学方程式总结 1、钠及其化合物的转化关系 ①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑ Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O 2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2 △ Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑ ⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2 ⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH 2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓ ⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3- ※⒂2NaHCO 3 △ Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O HCO 3-+OH -=CO 32-+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑ 补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O Ca 2++OH -+HCO 3-=CaCO 3↓+H 2O ②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系 ①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2 △ 2Al 2O 3 2Al +6H +=2Al 3++3H 2↑ ※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ ⒃ ⒄ ④ Al Al 2O 3 A l (O H)3 KAl(SO 4)2 NaAlO 2 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
高中化学方程式总结(超全)
高考总复习之高中化学方程式总结 化学 第一册 第一章 卤素 第一节 氯气 1、NaCl 2Cl Na 22??→?+点燃 2、22CuCl Cl Cu ?? →?+点燃 3、32FeCl 2Cl 3Fe 2??→?+点燃 4、HCl 2Cl H 22?? ??→?+点燃(光照) 5、32PCl 2Cl 3P 2??→?+点燃 6、523PCl Cl PCl →+ 7、HClO HCl O H Cl 22+→+ 8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++?→? +? 2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+?? →?见光 第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+?→? +? HCl SO Na NaCl NaHSO 424 16、↑+?→?+? HCl 2SO Na SO H NaCl 2424 2(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+
18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应 21、O H Cu H CuO 22+?→? +? 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++?→?+? )((极稀) 24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++?→?+? )((极稀) 27、O H 31SO K SO Fe 9SO Cr SO H 31O Fe 6O Cr K 2423423424243722+++→++)()( 28、↑+↑+→++2223CO 3N S K S C 3KNO 2 第四节 卤族元素 29、HF 2F H 22→+ 30、HBr 2Br H 22→+ 31、HI 2I H 22→+ 32、22Br NaCl 2Cl NaBr 2+→+ 33、22I KCl 2Cl KI 2+→+ 34、22I KBr 2Br KI 2+→+ 35、33NaNO AgBr AgNO NaBr +↓→+ 36、33KNO AgI AgNO KI +↓→+ 37、2Br Ag 2AgBr 2+?? →?光照 第二章 摩尔 反应热 第一节 摩尔
高中化学必修一化学方程式汇总 结
高中化学必修1化学方程式总结 1、钠及其化合物的转化关系 ①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O ※⑤2Na +O 2 △ Na 2O 2 ※⑥2Na +2H 2O=2NaOH +H 2↑ ⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2 ⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH ⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 ※⒂2NaHCO 3 △ Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ 补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2O Ca 2++OH -+HCO 3- =CaCO 3↓+H 2O ②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2O Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32- +2H 2O ③钠与硫酸铜溶液的反应: 2Na + CuSO 4 + 2H 2O = Cu(OH)2↓+ Na 2SO 4 + H 2↑ ④氢氧化钠的制取: 电解食盐水法:2NaCl + 2H 2O 电解 2NaOH + H 2↑ + Cl 2↑ 石灰纯碱法:Na 2CO 3 + Ca(OH)2 = CaCO 3↓+ 2NaOH 2、铝及其化合物的转化关系 ①2Al +6HCl=2AlCl 3+3H 2 ②4Al +3O 2 △ 2Al 2O 3 2Al +6H +=2Al 3+ +3H 2↑ 或2Al + 3Fe 2O 3 高温 Al 2O 3 + 2Fe ※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O 2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3+ +3H 2O NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂ ⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 NaAlO 2 AlCl 3 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿
人教版高中化学必修一方程式总结
经典方程式再书写 1.将Na 2O 2加入到Na 2SO 3溶液中(写化学方程式) Na 2O 2+Na 2SO 3+H 2O===2NaOH +Na 2SO 4 2.将Na 加入到FeCl 3溶液中(写化学方程式) 6Na +6H 2O +2FeCl 3===6NaCl +2Fe(OH)3↓+3H 2↑ 3.将Na 2O 2加入到FeCl 3溶液中(写化学方程式) 6Na 2O 2+6H 2O +4FeCl 3===4Fe(OH)3↓+12NaCl +3O 2↑ 4.将Na 2O 2加入到含等物质的量的FeCl 2溶液中(写离子方程式) 4Na 2O 2+6H 2O +4Fe 2+===4Fe(OH)3↓+O 2↑+8Na + 5.实验室利用KClO 3和浓HCl 反应制Cl 2(写离子方程式) ClO -3+6H ++5Cl -===3Cl 2↑+3H 2O 6.工业上利用Cl 2和石灰乳制漂白粉(写化学方程式) 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 7.将SO 2通入到碘水中(写离子方程式) SO 2+I 2+2H 2O===4H ++SO 2-4+2I - 8.漂白粉在空气中的漂白原理(写离子方程式) Ca 2++2ClO -+CO 2+H 2O===CaCO 3↓+2HClO 9.Cu 和浓H 2SO 4反应(写化学方程式) Cu +2H 2SO 4(浓)=====△ CuSO 4+SO 2↑+2H 2O 10.C 和浓H 2SO 4反应(写化学方程式) C +2H 2SO 4(浓)=====△ CO 2↑+2SO 2↑+2H 2O 11.将H 2S 气体通入到FeCl 3溶液中(写离子方程式) 2Fe 3++H 2S===S ↓+2Fe 2++2H + 12.将SO 2气体通入到H 2O 2中(写离子方程式) SO 2+H 2O 2===2H ++SO 2-4 13.工业上制粗硅 SiO 2+2C=====△ Si +2CO ↑ 14.强碱缓慢腐蚀玻璃(写离子方程式) SiO 2+2OH -===SiO 2-3+H 2O 15.将过量CO 2气体通入到Na 2SiO 3溶液中(写离子方程式) SiO 2-3+2CO 2+2H 2O===H 2SiO 3↓+2HCO -3 16.制水煤气 C +H 2O(g)=====高温 CO +H 2 17.实验室制NH 3
必修一、必修二化学方程式汇总
高中化学(人教版)必修一、必修二相关化学方程式汇总 必修一 1、硫酸根离子的检验:先加HCl酸化--- BaCl2 + Na2SO4 ==== BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 ===== CaCO3↓+ 2NaCl 碳酸钠与盐酸反应: Na2CO3 + 2HCl ===== 2NaCl + H2O + CO2↑ 3、2Na + O2Na2O2钠与氧气反应:4Na + O2 ==== 2Na2O 7、过氧化钠与水反应:2Na2O2 + 2H2O ==== 4NaOH + O2↑ 8、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 ==== 2Na2CO3 + O2 9、钠与水反应:2Na + 2H2O ==== 2NaOH + H2↑ 10、铁与水蒸气反应:3Fe + 4H2O(g) ==== F3O4 + 4H2↑ 11、Mg与HCl反应: Mg+2 HCl === MgCl2+ H2↑ 12、Al与HCl反应: 2Al+6HCl===2AlCl3+3H2↑铝与氢氧化钠溶液反应: 2Al + 2NaOH + 2H2O ==== 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O ==== Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl ===== 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl ===== 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH ===== 2NaAlO2 + H2O 17、氯化铝与氢氧化钠溶液反应:AlCl3 + 3NaOH ===== Al(OH)3↓+ 3NaCl
高一化学必修一化学方程式和离子方程式总结
高一化学必修一化学方程式和离子方程式总结 1、硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 △ Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 20、氢氧化铁加热分解:2Fe(OH)3 △ Fe2O3 + 3H2O↑ 21、实验室制取氢氧化铝:Al2(SO4)3 + 6NH3?H2O = 2Al(OH)3↓+ 3(NH3)2SO4 22、氢氧化铝与盐酸反应:Al(OH)3 + 3HCl = AlCl3 + 3H2O 23、氢氧化铝与氢氧化钠溶液反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O 24、氢氧化铝加热分解:2Al(OH)3 △ Al2O3 + 3H2O 25、三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 26、氯化亚铁中通入氯气:2FeCl2 + Cl2 = 2FeCl3 27、二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O 硅单质与氢氟酸反应:Si + 4HF = SiF4 + 2H2↑ 28、二氧化硅与氧化钙高温反应:SiO2 + CaO 高温CaSiO3 29、二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O 30、往硅酸钠溶液中通入二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ 31、硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ 32、氯气与金属铁反应:2Fe + 3Cl2 点燃2FeCl3 33、氯气与金属铜反应:Cu + Cl2 点燃CuCl2 34、氯气与金属钠反应:2Na + Cl2 点燃2NaCl 35、氯气与水反应:Cl2 + H2O = HCl + HClO 36、次氯酸光照分解:2HClO 光照2HCl + O2↑ 37、氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O 38、氯气与消石灰反应:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
