NA培养基
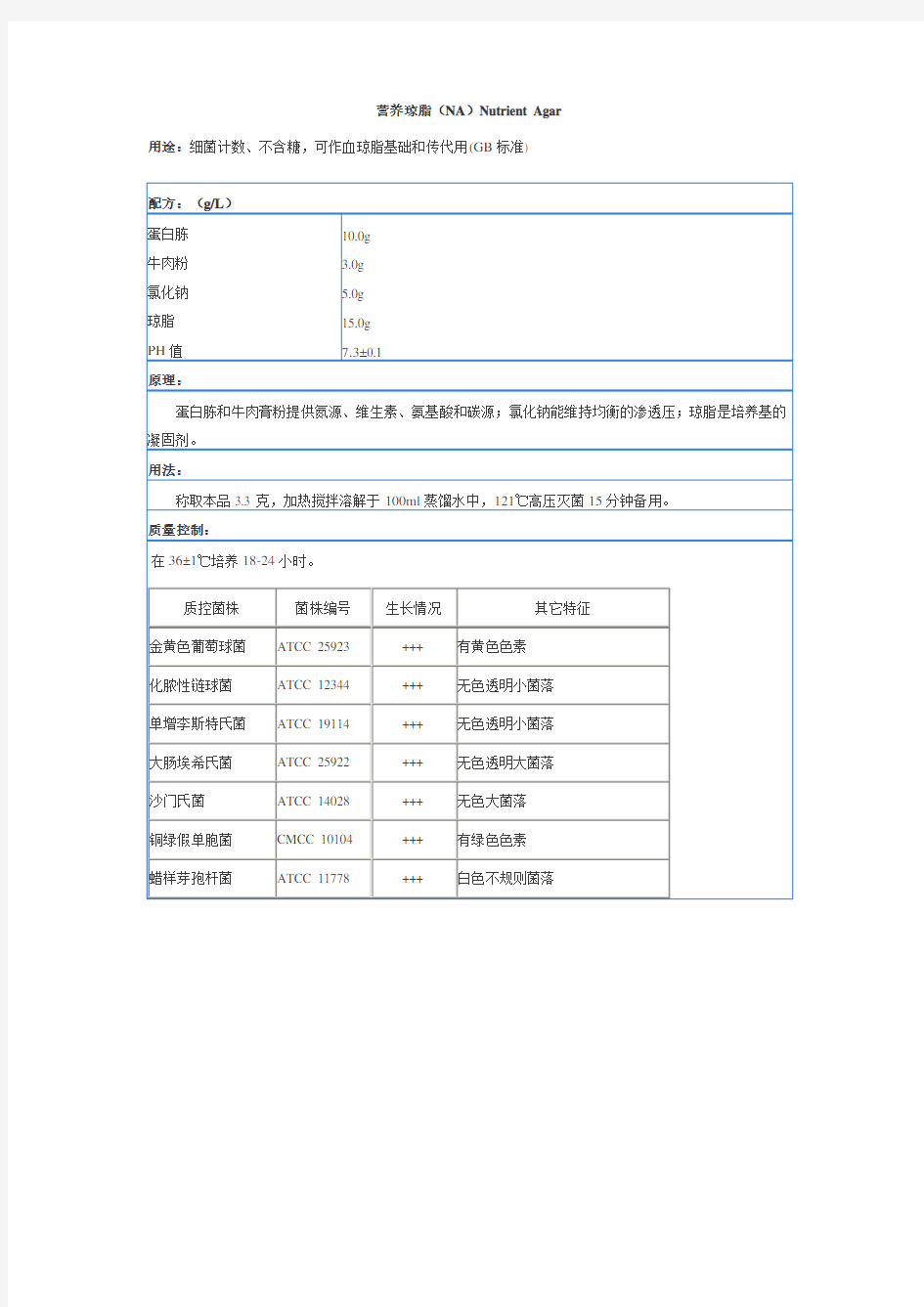
营养琼脂(NA)Nutrient Agar 用途:细菌计数、不含糖,可作血琼脂基础和传代用(GB标准)
微生物发酵培养基的优化方法
工业发酵进展
微生物发酵培养基的优化方法 对于微生物的生长及发酵,其培养基成份非常复杂,特别是有关微生物发酵的培养基,各营养物质和生长因子之间的配比,以及它们之间的相互作用是非常微妙的。面对特定的微生物,人们希望找到一种最适合其生长及发酵的培养基,在原来的基础上提高发酵产物的产量,以期达到生产最大发酵产物的目的。发酵培养基的优化在微生物产业化生产中举足轻重,是从实验室到工业生产的必要环节。能否设计出一个好的发酵培养基,是一个发酵产品工业化成功中非常重要的一步。以工业微生物为例,选育或构建一株优良菌株仅仅是一个开始,要使优良菌株的潜力充分发挥出来,还必须优化其发酵过程,以获得较高的产物浓度(便于下游处理),较高的底物转化率(降低原料成本)和较高的生产强度(缩短发酵周期)。设计发酵培养基时还应时刻把工 实验室最常用的优化方法是单次单因子法,这种方法是在假设因素间不存在交互作用的前提下,通过一次改变一个因素的水平而其他因素保持恒定水平,然后逐个因素进行考察的优化方法。但是由于考察的因素间经常存在交互作用,使得该方法并非总能获得最佳的优化条件。另外,当考察的因素较多时,需要太多的实验次数和较长的实验周期[3]。所以现在的培养基优化实验中一般不采用或不单独采用这种方法,而采用多因子试验。 2.多因子试验 多因子试验需要解决的两个问题: (1)哪些因子对响应具有最大(或最小)的效应,哪些因子间具有交互作用。 (2)感兴趣区域的因子组合情况,并对独立变量进行优化。
3.正交实验设计 正交实验设计是安排多因子的一种常用方法,通过合理的实验设计,可用少量的具有代表性的试验来代替全面试验,较快地取得实验结果。正交实验的实质就是选择适当的正交表,合理安排实验的分析实验结果的一种实验方法。具体可以分为下面四步: (1)根据问题的要求和客观的条件确定因子和水平,列出因子水平表; (2)根据因子和水平数选用合适的正交表,设计正交表头,并安排实验; (3)根据正交表给出的实验方案,进行实验; (4)对实验结果进行分析,选出较优的“试验”条件以及对结果有显著影响的因子。 正交试验设计注重如何科学合理地安排试验,可同时考虑几种因素,寻找最佳因 次 报道。CastroPML报道用此法设计20种培养基,做24次试验,把gamma干扰素的产量提高了45%。 6.部分因子设计法 部分因子设计法与P1ackett-Burman设计法一样是一种两水平的实验优化方法,能够用比全因子实验次数少得多的实验,从大量影响因子中筛选出重要的因子。根据实验数据拟合出一次多项式,并以此利用最陡爬坡法确定最大响应区域,以便利用响应面法进一步优化。部分因子设计法与Plaekett-Burman设计法相比实验次数稍多,如6因子的26-2部分因子设法需要进行20次实验,而Plackett-Burman设计法只需要7次实验。 7.响应面分析法
微生物培养基成分及其用途
[Note]:When cultivation of Bacillus,5mg of to MnSO4.H2O may be added . It is favorable to promote spore formation . 适用范围:产气气杆菌、粪产碱杆菌、蜡状芽孢杆菌、蜡状芽孢杆菌蕈状变种、地衣形芽孢杆菌、巨大芽孢杆菌、多粘芽孢杆菌、尘埃芽孢杆菌、短小芽孢杆菌、嗜热脂肪芽孢杆菌、枯草芽孢杆菌、枯草芽孢杆菌深黑变种、苏云金芽孢杆菌、苏云金芽孢杆菌蜡螟亚种(青虫菌)、苏云金芽孢杆菌戈尔斯德变种、苏云金芽孢杆菌猝倒亚种、产氨短杆菌、黄色短杆菌、谷氨酸棒状杆菌、北京棒杆菌、大肠埃希氏菌(大肠杆菌)、铜绿假单胞菌(绿脓杆菌)、凸形假单胞杆菌、荧光假单胞菌、弯曲假单胞菌、恶臭假单胞菌、假单胞杆菌、藤黄八叠球菌、亚黄八叠球菌、尿素八叠球菌、金黄色葡萄球菌、运动发酵单孢菌 3. Azotobacter Medium (固氮菌培养基) KH2PO4 0.2g K2HPO4 0.8g MgSO4.7H2O 0.2g CaSO4.2H2O 0.1g Na2MoO4.2H2O Trace(微量) Yeast axtract(酵母膏) 0.5g Mannitol(甘露醇) 20g FeCl3 Tract(微量) Distilled water (蒸馏水) 1000ml Agar (琼脂) 15g Adjust (调) pH to 7.2 适用范围:固氮菌、胶质芽孢杆菌 4. Corn Meal Medium (玉米粉培养基) Maize flour (玉米粉) 5g Peptone (蛋白胨) 0.1g Glucose (葡萄糖) 1g Tap water (自来水) 1000ml [Note]:Boil the mixture in autoclave at 121℃for 1 hr. distribute the medium into 18ⅹ18 mm tubes , each contains 10 ml of the liquid , then autoclave at 121℃for 1 hr . again (15磅蒸煮1小时,分装入18ⅹ18毫米试管,每管深度达6厘米。15磅再次灭菌15小时。) 5. Lactic-bacteria Medium I (乳酸菌培养基I ) Yeast extract (酵母膏) 7.5g Peptone (蛋白胨) 7.5g Glucose (葡萄糖) 10g KH2PO4 2g Tomato juice (西红柿汁) 100ml Tween (吐温) 80 0.5ml Distilled water (蒸馏水) 900ml pH 7.0 适用范围:植物乳杆菌(胚芽乳杆菌)、嗜热乳酸链球菌 6. Lactic-bacteria Midium Ⅱ(乳酸菌培养基Ⅱ) Lacto-casein peptone (乳酪蛋白胨) 10g Beef extract (蛋白胨) 10g Yeast extract (酵母膏) 5g Glucose (葡萄糖) 5g Tween (吐温) 80 1g K2HPO4 2g Na-acetate (醋酸钠) 5g Diamine citrate (柠檬酸二胺) 2g MgSO4.7H2O 0.2g MnSO4.H2O 0.05g Distilled water (蒸馏水) 1000m pH 6.5-6.8 适用范围:植物乳杆菌(胚芽乳杆菌) 7. Peotone Glucose Yeast extract Medium PGY (蛋白胨、酵母膏、葡萄糖培养基)Peptone(蛋白胨)10g Yeast extract (酵母膏)5g Glucose (葡萄糖)1g Distilled water (蒸馏水)1L 8. Glycerol Agar (甘油琼脂) Peptone (蛋白胨)5g Beef extract (酵母膏)3g Glycerol (甘油)20g Top water (自来水)1000ml Agar (琼脂)15g pH 7.0-7.2 9. Rhizobium medium (根瘤菌培养基)AS 9 Yeast eztract (酵母膏)1g Soil eztract (土壤浸提液)200ml Mannitol (甘露醇)10g Agar (琼脂)15g
培养基模拟灌装方法
精心整理*ml灌装线培养基模拟灌装验证方案 审批 目录 1.介绍……………………………………………………………………………………………............. ..错误!未指定书签。 2.目的……………………………………………………………………………………………..错误!未指定书签。 3.范围……………………………………………………………………………………………..错误!未指定书签。 4.职责……………………………………………………………………………………………..错误!未指定书签。 4.1.生产部职责 ....................................................................................... 错误!未指定书签。
4.2.质量保证部职责 (4) 4.3质量控制部职责 (4) 4.4.设备部、物资管理部门各职责 ............................................................. 错误!未指定书签。 5. 法规和指南…………………………………………………………………………………… ..错误!未指定书签。 5.1.法规................................................................................................. 错误!未指定书签。 5.2.指南................................................................................................. 错误!未指定书签。 6.参考文件………………………………………………………………………………………..错误!未指定书签。 7.生产工艺描述…………………………………………………………………………………..错误!未指定书签。 7.12.风险评估 ................................................................................................. 7.13.工艺风险分析 .......................................................................................... 错误!未指定书签。 7.14.模拟项目 ................................................................................................. 错误!未指定书签。 7.14.1模拟灌装过程 .......................................................................................... 错误!未指定书签。 7.14.2灌装机各分装器具经灭菌后的无菌组装 .................................................. 错误!未指定书签。 7.14.3模拟最多进入灌装间的人数..................................................................... 错误!未指定书签。 7.14.4人员干预.................................................................................................. 错误!未指定书签。 7.14.5模拟人员活动 .......................................................................................... 错误!未指定书签。 7.14.6模拟最差条件 .......................................................................................... 错误!未指定书签。
培养基的选择-整理
培养基的选择和优化(初稿) 一、培养基的概念:culture medium 是人们提供微生物生长繁殖和生物合成各种代谢产物需要的多种营养物质的混合物。其成分和配比对微生物的生长、发育、代谢产物的合成,甚至对于发酵工业的生产工艺都有很大的影响。 二、用途和分类: 用途:筛选菌种、保藏菌种、检验杂菌、培养种子、发酵生产。 分类: 1.按成分不同:天然:用化学成分还不清楚或化学成分不恒定的天然有机物配制。 例:牛肉膏蛋白胨培养基、麦芽汁培养基。 合成:化学成分完全了解的物质配制而成的培养基。 例:查氏培养基、高氏 1号培养基 复合(半合成培养基):天然成分+化学试剂 2.按物理状态:固体:加入一定量的凝固剂,琼脂含量1.5%-- 3.0%, 常用来微生物的分离、鉴定、活菌计数及菌种保藏。 半固体:琼脂0.3%--0.5%,观察运动特征,分类鉴定 液体:不加任何凝固剂, 大规模生产及在实验室进行微生物的基础理论和应用方面的研究。 3.按实验目的:基础:适合大多数微生物生长的培养基,如牛肉膏蛋白胨培养基 加富:在基础培养基中加入某些特殊营养物质制成的一类培养基。如高糖培养基 选择:在培养基中加入相应的特殊营养物质或化学物质,抑制不需要的微生物的生长,有利于所需微生物的生长。如麦康凯培养基 鉴别:用于鉴别不同微生物的培养基,微生物产生某种代谢产物,与培养基中的化学物质发生化学反应,产生明显的特征变化,如EMB培养基 三、成分来源: (人工配制的、适合微生物生长、繁殖或产生代谢产物的营养基质,是微生物学研究和微生物发酵生产的基础。任何培养基都应具备微生物所需要的六大营养要素,且其间的比例合适。) 营养: 有机体吸取和利用营养物质的过程。 营养物质: 微生物为了生存就必须从环境中吸取各种物质以合成细胞物质、提供能量以及在新陈代谢中起调节作用。这些物质就称为营养物质。
微生物培养基
培养基 培养基(medium或culturemedium)是一种人工配制的、适合微生物生长繁殖或产生代谢产物用的混合养料。因此任何培养基都应具备微生物所需要的六大营养要素,且其间的比例是合适的。任何培养基一旦配成,必须立即进行灭菌,否则很快引起杂菌丛生,并破坏其固有成分和性质。 一、选用和设计培养基的原则和方法 在微生物学研究和生产实践中,配制合适的培养基是一项最基本的工作。但是,许多工作不但要求我们去选用一种现成的培养基,而且还经常要求亲自去设计一种更合适的培养基,这就要求人们除了熟悉微生物的营养知识和规律外,还要有一套科学的设计培养基所应遵循的基本原则和方法。不巧的是,在一般的书籍中,这方面的内容不易找到。为此,这里根据自己的体会,提出了四个原则和四种方法,以作为总结这类工作的一个尝试。 (一)四个原则 1.目的明确在设计新培养基前,首先要明确配制该培养基的目的,例如,要培养何菌?获何产物?用于实验室作科学研究还是用于大规模的发酵生产?作生产中的“种子”,还是用于发酵?等等。 如果某培养基将用于实验室研究,则一般不必过多地计较其成本。但必须明确对该培养基是作一般培养用,还是作精细的生理、代谢或遗传等研究用。如属前者,可尽量按天然培养基的要求来设计,如系后者,则主要应考虑设计一种组合培养基(即“合成培养基”,详后)。拟培养的微生物对象也十分重要。不同大类的微生物,对培养基中碳源与氮源间的比例、pH的高低、渗透压的大小、生长因子的有无以及特殊成分的添加等都要作相应的考虑。 如果某培养基将用于大规模的发酵生产上,则用作“种子”的培养基,一般其营养成分宜丰富些,尤其氮源的含量应较高(即C/N比低);相反,如拟用作大量生产代谢产物的发酵培养基,则从总体来说,它的氮源含量宜比“种子”培养基稍低(即C/N比高)。除了对不同类型的微生物应考虑其特定条件外,在设计发酵培养基时,还应特别考虑到生产的代谢产物是主流代谢产物,或是次生代谢产物。如属主流代谢产物(一般指通过主要代谢途径产生的那些结构较简单、产量较高、价值较低的降解产物),则生产不含氮的有机酸或醇类时,培养基中所含的碳源比例自然要比生产含氮的氨基酸类产物时高,反之,生产氨基酸类含氮量高的代谢产物时,氮源的比
培养基模拟灌装实验试卷答案
培养基模拟灌装实验方案考试卷 一、填空题(5分/题,共50分) 1. 本次培养基模拟灌装实验为新改建的洁净厂房内实施,为培养基模拟试验的首次验证,因此通过连续三批模拟灌装实验及结果有限性的评价,确认结果的重现性。 2. 对无菌灌装区的设备台面及可能接触到的表面进行无菌程度的检查,其合格标准为:灌装机设备台面微生物数量<3个,设备输送带<5个。 3. 培养基模拟灌装过程中对操作人员的无菌服、五指手套、口罩等部位微生物数量进行检测, 其合格标准为:五指手套微生物数量<3个,一个操作人员双臂、前胸微生物总数<5个,口罩微生物数量<3个。 4. 粉针剂无菌分装间应控制合适的温度及相对湿度,其合格标准为:房间温度:20-22 ℃,相对湿度:45-50%。 5. 模拟分装过程:采用先灌装乳糖、再注入液体培养基的方式,其阳性对照样品为枯草芽孢杆菌和白色念珠菌。 6. 微生物培养条件:将全部样品在适宜的温度下培养14天,先在较低的温度(23-28℃)培养7天,然后在较高的温度下(30-35℃)培养7天,在第三天和第七天之间至少观察培养基样品的微生物的生长情况,通过最后一天的观察,确认有无微生物生长。 7. 对于培养基/乳糖样品的培养结果,若发现污染应明确记录瓶号、瓶数,同时应检查胶塞、铝盖的密封情况;若有破损应记录并检查其破损原因。对于被污染的样品进行鉴别试验,至少包括菌落数、细胞形态学记革兰染色特性等。 8. 试验结果与评价:评价无菌模拟灌装实验结果的主要指标就是污染水平,不管实验的数量有多少,其结果污染瓶均要为零,如果连续三批实验结果均出现1瓶,应进行再次实验,培养结果如出现2瓶以上,应停止生产,进行污染调查。 9. 对于已投入使用的粉针剂生产线,每年至少进行2次培养基模拟灌装实验,其生产线的每一位员工至少每年参加一次成功的培养基模拟灌装实验。 10. 当生产设备、设施、操作人员的结构、操作方法发生变动时,必须进行培养基模拟灌装实验,已确认其变动没有对该生产线的无菌保证产生影响。 二、问答题(50分) 1.简述培养基模拟灌装实验方案验证内容(15分)。 答:①培养基制备及无菌性检查,②培养基促生长实验,③无菌原料的制备、无菌性及抑菌性检验,④模拟灌装最差条件选择,⑤模拟分装过程,⑥灌装产品的培养,⑦根据培养,⑧结果确定本次模拟灌装实验的有效性,⑨模拟灌装过程记录。
微生物培养基种类大全
摘要:1、营养琼脂(普通琼脂)成份:牛肉浸液(或其它浸液,消化液或肉膏汤)100毫升琼脂(视天气,琼脂质量而定)制法:将上物加热溶解,补足水,调ph至7.6,过滤分装121℃,高压灭菌15分钟。用途:作普通琼脂平皿。2、血琼脂平板(BA)制法:取营养琼脂(PH7.6),加热使其溶解待冷至45-50℃,以灭菌操作于每100毫升营养 1、营养琼脂(普通琼脂) 成份:牛肉浸液(或其它浸液,消化液或肉膏汤) 100毫升 琼脂(视天气,琼脂质量而定) 制法:将上物加热溶解,补足水,调ph至7.6,过滤分装121℃,高压灭菌15分钟。 用途:作普通琼脂平皿。 2、血琼脂平板(BA) 制法:取营养琼脂(PH7.6),加热使其溶解待冷至45-50℃,以灭菌操作于每100毫升营养琼脂加灭菌脱纤维羊血或兔血5-10毫升,轻轻摇匀,立即倾注于平板或分装试管,制成斜面备用。 用途:1.一般棉拭子均接种此培养基。 2.尿液,脓液 3.分离细菌标本用。 3、基础培养基(肉膏汤BB) 成份:蛋白胨10克牛肉膏5克 氯化钠5克水1000毫升 制法:将以上各物称好,加水煮沸溶解,用1NNOH校正PH至7.6,过滤分瓶,121℃高压灭菌,20分钟备用。 用途:1 作耐药试验,增菌用分装小管。 2 作普通琼脂斜面。 4、血液培养基(大管肉汤培养基) 成份:1 新鲜牛肉浸液1000毫升 2 PABA(对氨基苯甲酸〔相当于10mg/毫升〕) 1g% 1毫升 3 MgSO 4 [相当于0.493/100毫升] 49.3% 1毫升 4 枸椽酸钠0.3g 制法:1 将1号,4号混合液,2号,3号液分装高压灭菌。
2 取灭菌1,4号混合液用无菌法加入PABA,MgSO4,再分管,行无菌试验三天方可使用。 用途:作血,骨髓培养用。 5、肠道杆菌培养基(伊红美兰琼脂) 成份:蛋白胨10克乳糖10克 氯化钠5克琼脂25(22)克 水1000毫升2%伊红溶液20毫升 0.5%美兰溶液20毫升 制法:将蛋白胨,氯化钠琼脂称好,加水1000毫升使溶解,校正PH7.4过滤,补足失水,加入2%伊红溶液20毫升,0.5%美兰溶液20毫升,(115℃高压20分钟),冷却至50℃左右倾注平板,凝固后存冰箱备用。(高压以后方可再加乳糖) 用途:用作分离沙门氏,志贺氏菌属,也作菌群调查。 1 6、罗文斯坦培养基 成份:磷酸二氢钾2.4克硫酸镁0.24克 枸椽酸钠0.6克天门冬素3.6克 纯甘油(丙三醇) 12毫升水600毫升 马铃薯粉30克鸡蛋1000毫升(约3公斤) 2%孔雀绿水溶液20毫升 制法:1 除鸡蛋外(还有孔雀绿)。可将其它物品称好,放入大三角瓶包扎好,高压灭菌。 2 鸡蛋用75%酒精泡30分钟,灭菌法打蛋,倒入盛有玻璃珠的灭菌三角烧瓶内充分将鸡蛋摇散。 3 将各成份按比例配好,分装每管约5毫升。 4 间歇灭菌第一次90℃1小时,第二次80℃半小时,第三次80℃半小时(或放85℃烤箱内连续二次)。 质控标准: 1 灭菌试验合格。 2 接种结核杆菌要求两星期生长良好。 用途:作结核分枝杆菌培养用。
培养基模拟灌装(小容量注射剂)无菌生产工艺验证方案11
分发部门: 培养基模拟灌装(小容量注射剂)无菌生产工艺验证小组
一、概述 厂区无菌操作生产线,按2010版GMP 及其附录要求进行设计,是专用于小容量注射剂非最终灭菌产品生产使用。 某某产品因无法进行F 0≥8分钟湿热灭菌,以达到SAL ≤10-6 ,但处方可以通过微生物滞留过滤器过滤,故采用除菌过滤和无菌工艺相结合的灭菌方法。 无菌生产工艺是制药领域中最难的工艺之一,确保产品无菌是该工艺最大的难点,减少无菌工艺药品污染风险的两项重要措施为:①人员的培训 ②无菌工艺验证。 按SFDA 化学药品注射剂基本技术要求:培养基灌装验证是对设备、环境以及人员操作的一种系统验证,是判断无菌保证水平的关键手段。故在正式生产前必须按某某产品生产工艺进行培养基模拟灌装验证。 1 本次验证关键生产工艺流程图 2 验证原理 将培养基暴露于设备、容器密封系统的表面和关键环境条件中,并模拟实际生产完成工艺操作。对装有培养基的密闭容器进行培养以检查微生物的生长并评价结果,确定实际生产中产品污染的可能性。对于失败的验证进行菌种分析并调查,确认并解决可能造成失败的原因后,重新进行验证。 3验证次数 按2010版GMP 附录1要求因该生产线为新建厂区设施,为培养基模拟灌装试验的首次验证,故需进行
二、验证目的 1通过该工艺验证活动证明新设计厂房采用既定的无菌生产工艺能保证产品的无菌要求; 2通过该工艺验证活动证明无菌操作相关人员资格,降低人员带入无菌的风险; 3通过该工艺验证活动确保生产符合现行GMP法规要求。 三、验证范围和实施时间 1本验证方案适用于厂区小容量注射剂车间无菌生产线正式投入使用前某某品种小容量注射剂无菌生产工艺培养基模拟灌装验证活动; 2计划验证实施时间为2013年3月~4月连续三个批次。 四、验证小组和职责 1 验证小组 根据验证的内容和验证管理文件要求,成立验证小组,验证小组成员见下表,小组人员应在最终验证报告中签名确认。在验证实施前,方案起草人应对所有相关参与人员进行验证方案的培训,做好培训记录,并将记录附于验证报告后。
培养基模拟灌装试验验证方案
页眉 培养基模拟灌装试验验证方案(10ml) 2011年08月 (10ml)培养基模拟灌装试验验证方案验证方案的起草与审批页脚
页眉验证小组成员 方案起草 方案批准
录目.......................................................................................................................................... 3 . 1概述.. (4) 验证目的2.页脚 页眉 3风险评估 (4) 4验证参考标准 (5) 5.验证范围 (5) 6.验证职责 (5) 7验证前提条件 (6) 8 验证批次和时间 (7) 9 验证步骤 (8) 10培养基的培养和检查............................................................................................................. 14 11试验结果评价........................................................................................................................ 14 12试验结果分析........................................................................................................................ 15 13风险的评估与接受................................................................................................................. 15 14验证结果评审和结论............................................................................................................. 15 15方案修改记录........................................................................................................................ 15 16再验证周期............................................................................................................................ 15 17附件....................................................................................................................................... 15
培养基模拟灌装试验管理规
1 主题内容与适用范围 本文件规定了培养基模拟灌装试验的程序和要求。 本文件适用于培养基模拟灌装试验的管理。 2 引用标准 《药品生产质量管理规范》2010年修订 3 术语 培养基模拟灌装试验(以下简称试验):英文名称MFT——Media Fill Test的英文缩写,是用一种模拟替代物质来模拟整个无菌生产过程,在所得的模拟产品中加注培养基,再对所得的全部培养基样品进行无菌培养。培养基模拟试验是无菌生产工艺的验证手段,是任何非最终无菌药品生产必须进行的一项验证。 最差条件:导致工艺及产品失败的概率高于正常工艺的条件或状态,即标准操作规程范围以内工艺的上限和下限。但这类最差条件不一定必然导致产品或工艺的不合格。 4 职责 4.1 生产部门负责试验方案的制定、组织实施、试验报告的撰写、偏差的报告等。 4.2 质监中心负责试验培养基的促生长试验、灌装物的培养等。 4.3 质量保证部负责试验过程的监督管理。 5 管理规定 5.1 试验目的:规范公司培养基模拟灌装试验,评估无菌原料药和无菌制剂的生产工艺,为所生产产品无菌性的可信限度达到可接受的合格标准提供证据,证明其具有生产无菌原料药和无菌制剂的能力并具有可重现性,符合现行GMP要求和相关技术指南要求。 5.2 试验要求 5.2.1 试验频次 培养基模拟灌装试验的首次验证,每班次应当连续进行3次合格试验。培养基模拟灌装试验按照生产工艺每班次半年进行1次,每次至少一批。单一规格品种再验证周期为半年,正常生产的多规格品种每一规格再验证周期为一年。每位无菌操作人员每年至少参加一次成功的培养基模拟灌装试验。空气净化系统、设备、生产工艺及人员重大变更后,应当重复进行培养基模拟灌装试验。 5.2.2 试验批量及容器的数量、装量 培养基灌装批量及容器的数量、装量应当足以保证评价的有效性。批量较小的产品,培
培养基配方
1、PDA培养基(用于分离、培养植物内生真菌): 马铃薯(去皮)200g , 葡萄糖20g , 蒸馏水1000 ml , 琼脂粉15g。用于分离内生真菌时在倒平板之前加入已过滤除菌的氯霉素和硫酸链霉素各50 μ g/ml,用于抑制细菌的生长。2、NA培养基(用于分离、培养植物内生细菌): 牛肉膏3g,蛋白胨5g,葡萄糖2.5g,琼脂粉15g,蒸馏水1000ml,pH 7.0。用于分离内生细菌时在倒平板之前加入已过滤除菌的放线菌酮50μg/ml,用于抑制真菌生长。115℃,20min 灭菌。 3、LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g 蒸馏水至1000 mL,pH=7.0; 4、DSM1培养基:磷酸三钾26.631 g(pH=7.0),二水柠檬酸三钠9.999 g,硫酸镁0.2465 g,硫酸铵19.821 g,牛肉膏3 g,NaCl 5 g,胰蛋白胨10 g,葡萄糖1 g 蒸馏水至1000 mL,pH=7.0; 5、DSM2培养基:磷酸三钾26.631 g(pH=7.0),二水柠檬酸三钠9.999 g,硫酸镁0.2465 g,硫酸铵19.821 g,牛肉膏3 g,NaCl 5 g,细菌学蛋白胨10 g,葡萄糖1 g 蒸馏水至1000 mL,pH=7.0; 6、Msgg培养基:磷酸钾5 mmoL/L(pH7.0),MOPs 100 mmoL/L(pH7.0),MgCl2 2 mmoL/L,CaCl2 700 mmoL/L,MnCl2 50 μM,FeCl3 50 μM,ZnCl2 1 μM,VB1 2 μM,甘油0.5 %,谷氨酸0.5 %,色氨酸50 μg/mL,苯丙氨酸50 μg/mL,蒸馏水1000 mL,pH 7.0。 7、N%NA培养基:牛肉膏3.0 g,细菌学蛋白胨10 g,NaCl 5 g,琼脂粉N*10 g, 8、BGM1培养基:牛肉膏3 g,胰蛋白胨10 g,NaCl 5 g,磷酸三钾26.631 g(pH7.0),二水柠檬酸三钠9.999 g,硫酸镁0.2465 g,硫酸铵19.821 g,葡萄糖1 g,蒸馏水1000 mL,pH 7.0。 9、BGDM培养基:牛肉膏3 g,细菌学蛋白胨10 g,NaCl 5 g,磷酸三钾26.631 g(pH7.0),二水柠檬酸三钠9.999 g,硫酸镁0.2465 g,硫酸铵19.821 g,葡萄糖1 g ,蒸馏水1000 mL,pH 7.0。 10、镰刀菌酸配制:10 mM标准品FA储存液(40 μg/mL)的配制:精密称取0.1792 g定溶于18%(v/v)谱纯甲醇100L,用1N NaOH 调节pH到6.5。换算的质量浓度(w/v)=1792 μg /mL。 11、LB培养基:胰蛋白胨1 g,酵母提取物0.5 g,NaCl 1 g,琼脂1.5 g,水100 mL,pH7.0, 121℃20 min。 24、PCR产物的电泳 主要仪器: 电泳仪、电泳槽、凝胶成像系统、水浴锅、微波炉、离心机等。 主要实验试剂: 1、50×TAE (2 M Tris,1M 醋酸,50 mM EDTA(pH8.0)) 2、10×上样缓冲液(loading buffer) 3、分子量标准DNA Marker 4、琼脂糖 5、EB (溴化乙锭)(黑暗保存) 25、琼脂糖凝胶电泳检测基因组DNA 三羟甲基氨基甲烷(Tris)、硼酸、乙二胺四乙酸(EDTA)、溴酚蓝、蔗糖、琼脂糖、溴化乙锭、DNA marker(λHindIII digest,自带6×loading Buffer,在103房间海尔冰箱中存放)
培养基模拟灌装无菌生产工艺验证方案11.docx
审批 部门姓名签名日期起草人品质管理部 起草人生产技术部 起草人针剂车间 审核人针剂车间 审核人生产技术部 审核人质检中心 审核人品质管理部 批准人质量负责人 分发部门: 培养基模拟灌装(小容量注射剂)无菌生产工艺验证小组 一、概述 厂区无菌操作生产线,按2010 版 GMP及其附录要求进行设计,是专用于小容量注射剂非最终灭菌产品 生产使用。 某某产品因无法进行F0≥8 分钟湿热灭菌,以达到SAL≤ 10-6,但处方可以通过微生物滞留过滤器过滤,
故采用除菌过滤和无菌工艺相结合的灭菌方法。 无菌生产工艺是制药领域中最难的工艺之一,确保产品无菌是该工艺最大的难点,减少无菌工艺药品污染风险的两项重要措施为:①人员的培训②无菌工艺验证。 按 SFDA化学药品注射剂基本技术要求:培养基灌装验证是对设备、环境以及人员操作的一种系统验证, 是判断无菌保证水平的关键手段。故在正式生产前必须按某某产品生产工艺进行培养基模拟灌装验证。 1 本次验证关键生产工艺流程图 安瓿的清洗称量配料工器具清洗和灭菌 除菌过滤 干热灭菌 灌封 灯检 D级背景 C 级背景 A 级背景一般区 2验证原理 将培养基暴露于设备、容器密封系统的表面和关键环境条件中,并模拟实际生产完成工艺操作。对装有培养基的密闭容器进行培养以检查微生物的生长并评价结果,确定实际生产中产品污染的可能性。对于失败的验证进行菌种分析并调查,确认并解决可能造成失败的原因后,重新进行验证。 3验证次数 按 2010 版 GMP附录 1 要求因该生产线为新建厂区设施,为培养基模拟灌装试验的首次验证,故需进行 连续三个批次的验证活动。 二、验证目的 1通过该工艺验证活动证明新设计厂房采用既定的无菌生产工艺能保证产品的无菌要求; 2通过该工艺验证活动证明无菌操作相关人员资格,降低人员带入无菌的风险; 3通过该工艺验证活动确保生产符合现行GMP法规要求。 三、验证范围和实施时间 1 本验证方案适用于厂区小容量注射剂车间无菌生产线正式投入使用前某某品种小容量注射剂无菌生产工艺培养基模拟灌装验证活动;
高产微生物油脂菌株培养基及发酵条件优化方法
课堂报告名称:高产微生物油脂菌株培养基及发酵条件优化方法 一、课堂报告依据的知识背景 1. 培养基及其分类 人类想要研究利用微生物,就必须先培养微生物。培养微生 物要有适合微生物生长繁殖的环境条件,还要适宜的营养条 件。由人工配置的适合微生物生长繁殖或积累代谢产物的营 养基质,称作培养基。 ◆按用途分类:增殖培养基;选择培养基;鉴别培养基。 ◆按状态分类:液体培养基;固体培养基;半固体培养基。 ◆按化学成分分类:天然培养基;合成培养基;半合成培养基。 ◆按目的分类:种子培养基;发酵培养基。 1). 培养基包含成分 a)水:水分是微生物重要组成部分,微生物不能脱离水而生 存,微生物所需的营养也只有溶于水才能很好地吸收,水 利于调节细胞温度,保持细胞生活环境的温度恒定。水分 为两种状态,自由水和结合水。前者以游离态存在,是细 胞内的溶剂;后者与细胞内其他成分结合,不易蒸发,不 冻结,不渗透,也不能作为溶剂。 b)碳源:提供为生物细胞组成和代谢产物中碳素来源的物质。 提供微生物生长繁殖所需的能量。 碳源分类很多,无机碳化合物有二氧化碳、碳酸盐等;有
机含碳化合物,如糖类、醇类、有机酸、蛋白质及其分解 产物。 c)氮源:可提供为生物细胞组成和代谢产物中氮素来源的物 质。氮源用来合成氨基酸和碱基进而合成蛋白质、核酸等 细胞成分以及含氮代谢产物。 氮源分类: 1.分子态氮,存在大气中,仅有少数微生物可以利用; 2.无机态氮,如铵盐、硝酸盐等,多数微生物可以利用; 3.有机态氮,蛋白质及各种分解产物、尿素、嘌呤碱、 嘧啶碱等。 d)能源:提供微生物生命活动过程中所需的能量来源的物质。 异养微生物能源为碳源;自养微生物能源是日光。 e)生长因子:微生物不能自行合成,但生命活动又不可缺少 的微量有机营养物质。 功能:构成细胞的组成成分,如嘌呤、嘧啶是核酸的组成 成分;调节代谢,维持正常的生命活动。 自养微生物不需要生长因子,能自行合成;异养微生物有三 种情况:有些异养微生物需要生长因子,如谷氨酸的短杆菌, 需要添加生物素才能使菌体生长良好;有些不需要生长因子; 有些不但不需要还能在自身积累某些维生素,如肠道微生物 分泌大量维生素供机体吸收利用,大肠杆菌合成维生素K。 f)无机盐类:微生物生长过程中不可缺少的营养物质。从量
培养基综合介绍
生物培养基综合介绍 来源:添加时间:2010-2-1 10:42:00 1 概述 一培养基:是提供微生物生长繁殖盒合成代谢产物需要的按一定比例配制的多种营养物质的混合物:氮源、碳源、无机盐、微量元素、前体、诱导物。 二培养基组成影响细胞分化和产物形成 细胞分化:微生物细胞在一定条件下会发生细胞形态、生理功能和化学组成上彼此不同的变化。培养基中各种成分如二价阳离子核阴离子聚合物、表面活性剂和固形物含量,以及各种成分的浓度,培养液的PH都会影响细胞的分化,进而影响产物的合成。在青霉素丝状菌发酵过程中,控制菌丝形态使其保持适当的分支和长度,避免结球,是获得青霉素高产的关键。二价阳离子易引起菌丝体呈球状体生长,如果有阴离子聚合物(阴离子交换树脂)同时存在可阻止二价阳离子的影响。试验证明二价阳离子能与细胞表面的部分阴离子基团结合,通过盐桥或者克服细胞间阳电荷间的斥力,导致细胞间的相互作用,促进菌丝体呈球状体的形成。 三配制工业发酵培养基的一般要求 1 营养物质的成分比例合适,组成比较丰富,浓度恰当,能够满足菌种发芽和生长繁殖成有生理功能的菌丝体的需要,更重要的是能显示出产物合成的潜力。 2 在一定条件下,各组分彼此间不产生化学反反应,理化性质相对稳定。 3 粘度适中,具有适当的渗透压。 4 要考虑所选用的原材料的品种和浓度与代谢产物生物合成过程中的调节关系,要利于主要产物的生物合成并能维持较长时间的最高生产速率。 5 生产过程中既不影响通气和搅效果,又不影响产物的分离精制和废物处理。 6 大生长中选用的原材料尽量做到因地制宜、价廉、低成本。 2 培养基的成分 培养基的原材料归纳起来有碳源、氮源、无机盐、微量元素、水、生长因子、前体、诱导物等 一碳源 凡是构成微生物细胞和代谢产物碳素的物质来源,都可称为碳源。生产中常用碳源的来源主要有:糖类、脂肪、有机酸、醇等 (一)糖类 单糖:葡萄糖双糖:蔗糖,麦芽糖多糖:淀粉糊精纤维素 玉米淀粉:呈小颗粒结构、难溶于水,在热水中膨胀成胶状物。120-130℃淀粉被完全液化(酸性条件下),胶化和液化的淀粉可被微生物产生的胞外淀粉酶和糖化酶逐步分解成葡萄糖,被菌丝体利用。 (二)脂肪 一般的说在培养基中糖类缺乏或发酵至某一阶段,菌体利用油脂.发酵中添加油脂起消泡和补充谭源的双重作用。菌体利用油脂的作碳源的时候好氧量增加,因此必须充分地供氧,否则易导致有机酸积累,发酵液PH降低。 (三)有机酸醇 (四)碳氢化合物 二氮源 氮源是指构成微生物细胞和代谢产物中的氮素来源的营养物质。其主要功能是构成微生物细胞和含氮的代谢物,当培养基碳源不足时,可以作为补充碳源。铵盐:硫酸铵NH4CL 硝酸盐:Na
培养基模拟生产验证方案
培养基模拟生产验证 1 概述:对无菌灌装过程进行胰酪胨大豆肉汤培养基模拟灌装试验,通过对其污染率的测试,来确认预充式无菌灌装过程和各种规程防止微生物污染的水平能达到可接受的合格标准。2目的与范围: 2.1无菌生产环境、人员消毒卫生状况与产品无菌保证的验证。 2.2用棉球擦拭的方法验证设备设施清洁消毒效果。 2.3验证的试验过程中监测底塞、卡式瓶的无菌性,使之始终符合卡式瓶生产工艺要求。2.4验证除菌过滤的可靠性,保证生产出合格的中间体半成品。 2.5验证物料转移过程中物料的无菌性,使之满足卡式瓶生产工艺需要。 2.6模拟无菌灌装试验来考察灌装操作过程微生物的污染率不大于0.1%,进而证明灌装工艺条件符合无菌灌装的工艺要求。 2.7通过轧盖密封后瓶内抽真空进行气密性测试,证明与轧盖相关的工艺条件符合卡式瓶生产工艺要求。 3 职责: 3.1相关生产人员必须依照本规程进行生产操作。 3.2生产部门负责人及QA负责指导与监查本文件的执行。 3.3文件的修定和定期审核应由生产部门负责人员和QA负责。 3.4所有参与本验证过程的生产人员都必须依照本方案进行生产操作。 3.5验证过程应严格按照规定的内容进行,若因特殊原因确实需要变更时,应填写验证方案变更申请及批准书(附表1),报验证委员会批准。 4 参考文献: 4.1Validation of aseptic filling for solution drug product 4.2药品生产验证指南(2003 版)5设备及仪器:
6物料 7验证内容 7.1判断标准 产品无菌性的可信限:95% 产品允许污染的概率:警戒限为<0.05%,可信限为>0.1% 7.2培养基配制、灭菌和过滤: 7.2.1按30g胰酪胨大豆培养基溶于1L 蒸馏水的比例配制适量的培养基溶液,搅拌并加热溶解或直接量取70℃以上的蒸馏水,搅拌溶解后,,将盛放培养基的桶在蒸汽灭菌柜内121℃ 灭菌15 分钟,待灭菌后自然冷却 7.2.2配制用于验证分装生产线的无菌性的培养基溶液体积应满足灌装3000支以上的量(一 般灌装5000 支左右)。 7.2.3冷却后用已灭菌的0.22um 的套筒过滤器过滤于已灭菌的相应容量的不锈钢桶中。注:过滤过程应遵守无菌操作。 7.3培养基无菌性试验: 将用于模拟灌装的胰酪大豆培养基另外用50ml 试管配制4 管(20ml/管),在121℃灭菌15 分钟,盖塞、封口后将其中2管在20~25℃培养7天,另外2管在30~35℃培养7天。7天内若各试管中应无任何微生物生长,则判断合格。结果填于附表2 7.4培养基微生物生长性能试验: 将配制好的灭菌培养基分装于10 支50ml 试管中(20ml/ 管),在其中4支管内接种<100CFU的枯草杆菌,和1 支不接种枯草杆菌的TSB试管(空白对照)同时在30~35℃下培养7 天,在另4支试管内接种<100CFU的白色念珠菌,和1 支不接种白色念珠菌的TSB试管(空白对照)同时在20~25℃培养7天,培养过程中每天观察微生物生长情况,七天内若50%以上接种的各试管的培养基应出现明显的所接种的微生物的生长,空白试验无菌生长,则判断合格。结果填于附表3。 7.5无菌灌装试验: 7.5.1无菌灌装所用的瓶和塞塞经灭菌处理后,进行模拟灌装、轧盖。每瓶和托盘都需标
培养基模拟灌装方案
******药业有限公司验证方案 ****生产线培养基灌装
小组主要成员及职责 根据《确认与验证管理规程》规定,组织成立***培养基灌装验证小组,验证小组成员及职责如下表:
方案会签及审批
目录 一、概述 (6) 1.验证原因 (6) 2.验证原理 (6) 二、验证目的 (7) 三、参考文件 (7) 1.参考标准 (7) 2.公司规程 (7) 四、风险评估 (8) 五、验证范围 (15) 六、验证计划 (16) 七、方案培训 (16) 八、验证可接受标准 (16) 九、验证内容 (17) 1.配制 (17) 2.冷藏、除菌过滤 (18) 3.洗瓶 (18) 4.灌封 (20) 5.环境及人员卫生监测(动态) (21) 6.培养 (22) 7.培养基灌装后清洁确认 (23) 十、漏项与偏差处理 (24)
十一、再验证周期 (24) 十二、确立文件 (24) 十三、附件 (25) 附件1: (26)
一、概述 1.验证原因 公司****按照2010版GMP 附录1《无菌药品》的要求进行设计,洁净区级别分为A 级、B 级、C 、级、D 级,该线用于小容量注射剂非最终灭菌产品(****)生产使用。 现按2010版GMP 附录1要求对**生产线进行产品培养基灌装验证,以考察该线的无菌保证水平。本次为第四次培养基模拟灌装(上次验证报告编号R.4-001/2015),故只进行一个批次的验证活动。 验证关键生产工艺流程图如下: 2.验证原理 将培养基暴露于设备、容器密封系统的表面和关键环境条件中,并模拟实际生产完成工艺操作。对装有培养基的密闭容器进行培养以检查微生物的生长并评价结果,确定实际生产中产品污染的可能性。对于失败的验证进行菌种分析并调查,确认并解决可能造成失败的原因后,重新进行验证。 3.验证的先决条件 ? 参与培养基验证的人员经过培训。 ? 涉及培养基灌装试验使用的配液系统、冷藏系统、除菌过滤系统、灌封系统、洗瓶机、杀菌干燥
