探究斐林试剂和双缩脲试剂的使用条件

常用试剂的配制.
常用试剂的配制 1.无Ca2+、Mg2+Hanks液 NaCl 4.5g KCl 0.2g NaHCO 3 0.175g Na 2HPO 4 ·12H 2 O 0.076g KH 2PO 4 0.03g 葡萄糖 0.5g 0.4%酚红 2.5ml 将上述成分依次溶解或加入到双蒸水中, 最后补加双蒸水至500ml, 以5.6%NaHCO 3调整 pH 值至7.4,4℃冰箱保存备用。 2.甲基红试剂 (1)成份 甲基红 0.1g 蒸馏水 200ml 95%乙醇 300ml (2)用途:测定甲基红反应。 3.Hanks液(原液) 原液甲: NaCl 160g KCl 8g MgSO 4·7H 2 O 2g MgCl 2·6H 2 O 2g 上述试剂加入800ml双蒸水。溶解。 CaCl 2 2.8g溶于100ml双蒸水 上述二液混合,加双蒸水至1000ml,再加2ml氯仿防腐,4℃保存。 原液乙: Na 2NPO 4 ·12H 2 O 3.04g KH 2PO 4 1.2g 葡萄糖 20g 加入800ml双蒸水,溶解。 0.4%酚红溶液100ml 上述二液混合,加双蒸水至1000ml,再加2ml氯仿防腐,4℃保存。 使用时甲,乙原液按下列比例配成Hanks 液使用液:原液甲1份、原液乙1份、双蒸水18份滤过,8磅20min灭菌,放4℃冰箱保存,使用前用NaHCO 3 调整PH值。 4.0.4%酚红溶液 称取0.4g酚红置研钵中研碎,逐渐加入0.lmol/LNaOH并不断研磨,直到所有的颗粒
几乎完全解,加入0.lmol/LNaOHl0ml,然后倒入容量瓶中,并加蒸馏水至l00ml,棕色瓶保存备用。 5.pH7.2 Tris-NH 4 CI溶液(红细胞崩解液) Tris (三羟甲基氨基甲烷) 1.03g NH 4 Cl(氯化氨) 3.735g 加双蒸水至500ml,用浓HCl调pH=7.2,10磅15min灭菌后放4℃保存。 6.0.05moI/L pH8.6 巴比妥缓冲液 巴比妥 1.84g 加蒸馏水 200ml 加热溶解 巴比妥纳 10.3g 叠氮纳 0.2g 加蒸馏水溶解 , 并补加到 1000ml 。 7.磷酸盐缓冲液(PB) A 液:为 0.2mol/L 磷酸二氢钠水溶液 ,NaH 2PO 4 ·H 2 O 27.6g, 溶于蒸馏水中, 最 后补加蒸馏水至 1000ml 。 B 液:为 0.2mol/L 磷酸氢二钠水溶液 ,Na 2HPO 4 .7H 2 O 3.6g(或 Na 2 HPO 4 ·12H 2 O 71.6g, 或Na 2HPO 4 · 2H 2 O 35.6g ), 加蒸馏水溶解,最后加水至 1000ml。若再加 蒸馏水至200ml则成为0.1mol/LPB。 8.0.1mol/LPH8.4 硼酸缓冲液(BBS) 硼酸钠(Na 2B 4 O 7 .10H 2 O) 0.46g 硼酸(H 2BO 3 ) 0.51g 加蒸馏水至100ml 溶解。9.PH7.4 0.01mol/L 磷酸盐缓冲液(PBS)配制方法一: 0.2mol/L Na 2HPO 4 ( Na 2 HPO 4 ·12H 2 O 71.6g加蒸馏水至1000ml) 0.2mol/L NaH 2PO 4 (NaH 2 PO 4 ·2H 2 O 35.6g加蒸馏水至1000ml) 取0.2mol/L Na 2HPO 4 81.0ml 加0.2mol/L NaH 2 PO 4 19ml,再加1900mlH 2 O和 17gNaCl即为PH7.4 0.01mol/L PBS。 PH7.4 0.01mol/L PBS再加入0.05%Tween-20即为ELISA试验的洗涤液。 配制方法二: 甲液(0.1mol/LKH 2PO 4 溶液):KH 2 PO 4 13.608g,加蒸馏水至1000ml。 乙液(0.1mol/L Na 2HPO 4 溶液):Na 2 HPO 4 35.814g,加蒸馏水至1000ml。 取甲液19ml,乙液81ml NaCl8.5g、Tween-20 0.5ml混合后加蒸馏水至1000ml即可。
高中生物实验常用的试剂(人教版,很全)
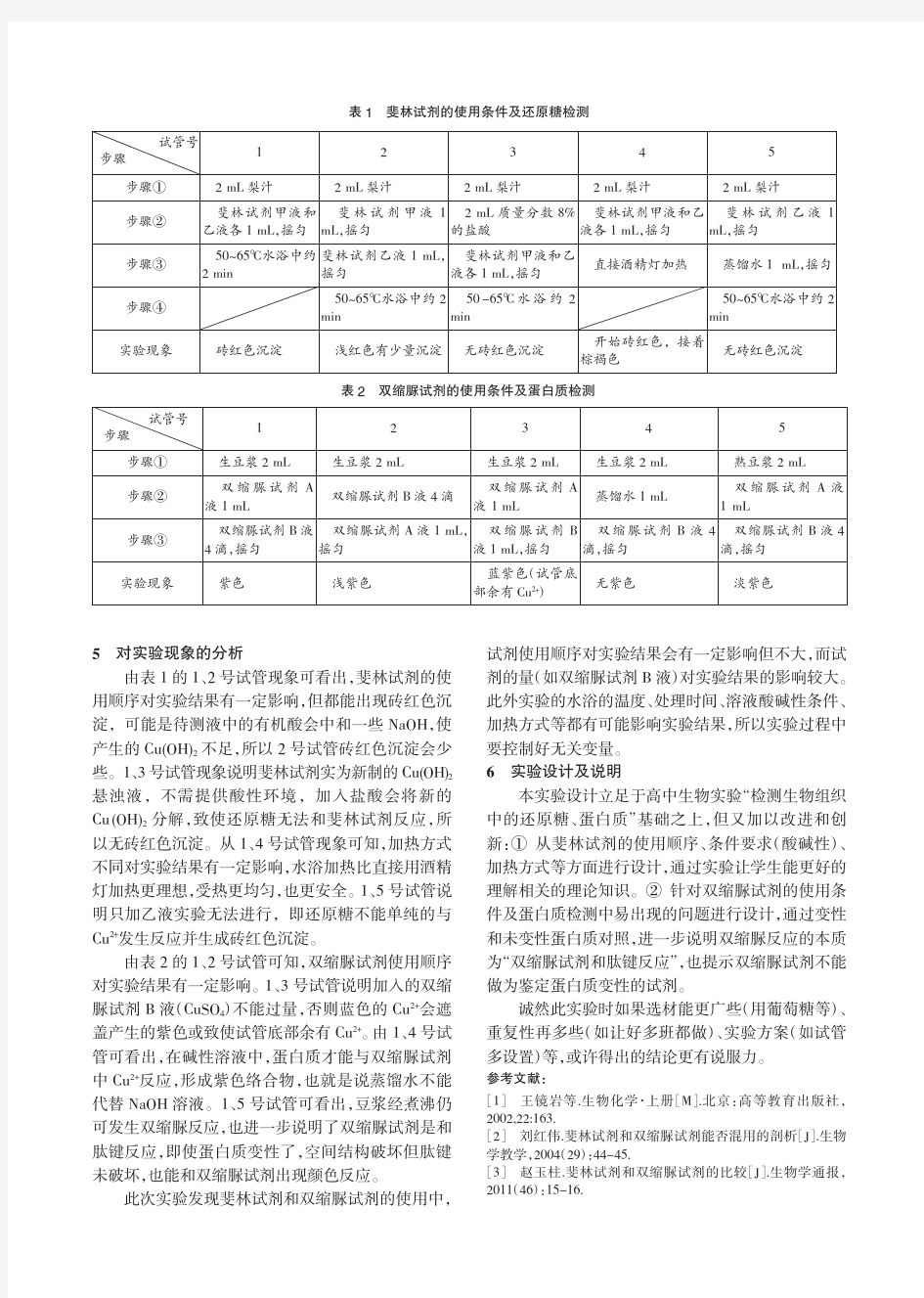
生物学中常用的试剂: (乙液)。用法:将1.斐林试剂:成分:0.1g/ml NaOH(甲液)和0.05g/ml CuSO 4 斐林试剂甲液和乙液混合,再将混合后的斐林试剂倒入待测液,水浴加热,如待测液中存在还原糖,则呈砖红色。 2.班氏糖定性试剂:为蓝色溶液。和葡萄糖混合后沸水浴会出现砖红色沉淀。用于尿糖的测定。 (乙液)。用法:向3.双缩脲试剂:成分:0.1g/ml NaOH(甲液)和0.01g/ml CuSO 4 待测液中先加入2ml甲液,摇匀,再向其中加入3~4滴乙液,摇匀。如待测中存在蛋白质,则呈现紫色。 4.苏丹Ⅲ:用法:取苏丹Ⅲ颗粒溶于95%的酒精中,摇匀。用于检测脂肪。可将脂肪染成橘黄色(被苏丹Ⅳ染成红色)。 5.二苯胺:用于鉴定DNA。DNA遇二苯胺(沸水浴)会被染成蓝色。 6.甲基绿:用于鉴定DNA。DNA遇甲基绿(常温)会被染成蓝绿色。 吡罗红:检测RNA,呈红色 7、50%的酒精溶液:用于洗去苏丹Ⅲ在脂肪上的浮色。 8、70%的酒精溶液:用于医学临床上的消毒灭菌。 9、95%的酒精溶液:冷却的体积分数为95%的酒精可用于凝集DNA
10、15%的盐酸:和95%的酒精溶液等体积混合可用于解离根尖。 11.龙胆紫溶液或醋酸洋红:碱性染料,用于染色体染色时,前者呈深蓝色,后者呈红色 改良苯酚品红染液:检测染色体,红色 健那绿:检测线粒体,专一性让线粒体染色呈蓝绿色 12.20%的肝脏、3%的过氧化氢、3.5%的氯化铁:用于比较过氧化氢酶和Fe3+的催化效率。(新鲜的肝脏中含有过氧化氢酶) 13、3%的可溶性淀粉溶液、3%的蔗糖溶液、2%的新鲜淀粉酶溶液:用于探索淀粉酶对淀粉和蔗糖的作用实验。 14.碘液:用于鉴定淀粉的存在。遇淀粉变蓝。遇糖原变红 15.丙酮:用于提取叶绿体中的色素 16.层析液:(成分:20份石油醚、2份丙酮、和1份苯混合而成,也可用93号汽油)可用于色素的层析,即将色素在滤纸上分离开。 17.二氧化硅:在色素的提取的分离实验中研磨绿色叶片时加入,可使研磨充分。 18.碳酸钙:研磨绿色叶片时加入,可中和有机酸,防止在研磨时叶绿体中的色素受破坏。
双缩脲试剂
(一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1-10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。(二)试剂与器材 1. 试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml 的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH 配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4&8226;5H2O)和6.0克酒石酸钾钠(KNaC4H4O6&8226;4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH 溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2. 器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1. 标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。用未加蛋白质溶液的第一支试管作为空白对照液。取两组测定的平均值,以蛋白质的含量为横座标,光吸收值为纵座标绘制标准曲线。 2、样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。注意样品浓度不要超过10mg/ml。
“温度对酶活性影响实验”中不用斐林试剂原因的探究
“温度对酶活性影响实验”中不用斐林试剂原因的探究 ◆董红宇甘肃省天水市第一中学741000 新人教版《生物》必修1教材中,有一个探究影响酶活性的条件的实验,其中之一是探究温度对酶活性的影响,最后用的鉴定试剂是碘液而不是斐林试剂。众所周知,斐林试剂是鉴定还原性糖的常用试剂,在此实验中为何不用?是无法鉴定还是有什么别的原因?这个问题在K12论坛上也是众说纷纭、各持己见。笔者为此进行了相关探究,实验如下: 实验结果与预期不符,0℃下的试管中也出现了砖红色沉淀。 分析原因:在水浴温度65℃时用斐林试剂检测,0℃和60℃的试管中都有砖红色沉淀。出现这种结果的原因,应该是用65℃水浴加热时,使原本处于受抑制状态的酶逐渐恢复了活性,导致预期不应该发生的反应出现了,对实验结果干扰很大。这就是我们常给学生讲的:因为斐林试剂在使用过程中要加热,0℃试管中的酶会逐渐恢复活性,所以此实验不能用斐林试剂鉴定。 事实果真如此吗? 笔者继续以下实验: 其它条件不变,只将上述实验中加斐林试剂时65℃水浴变成沸水浴即可,结果只有60℃试管中有砖红色沉淀,结果和预想一致。 分析原因:应该是沸水使淀粉酶立即失去活性所致,而前面实验中所用的65℃水浴恰好是α-淀粉酶活性最强的适宜温度,所以不同的水浴温度对实验结果影响很大。 斐林试剂是新制的Cu(OH)2溶液,PH值呈较强的碱性,对酶活性是否也有影响呢?笔者继续做以下探究:将各试管中的物质按下表顺序依次加好
结果分析: 第一组是α-淀粉酶活性最强的条件,作为对照,砖红色最深。 第二组中斐林试剂已让α-淀粉酶失活。 第三组结果表明:将酶、斐林试剂、淀粉同时加入,酶没有立即失活,还可以水解部分淀粉(分别是附图中的试管1、2、3)。 本实验证明:斐林试剂对酶活性的影响与斐林试剂和酶接触的先后顺序有很大关系。不放底物,直接与酶混合,酶会立即失活;若与底物和酶一起混合,酶还可水解部分淀粉;如果最后放斐林试剂,则不影响实验结果。 由于α-淀粉酶溶液有一定的颜色,虽然实验现象也明显,但颜色与真实情况有一定差距。笔者又用无色的唾液淀粉酶做了以上实验,各试管中的颜色与预期最接近,而且在65℃水浴下唾液淀粉酶就已失去了活性,实验结果与预期相符(附图中的6、7号试管)。 综上所述:在温度对酶活性影响实验中,可以用斐林试剂做鉴定,选择唾液淀粉酶做实验效果最好。但在实验过程中需注意以下两点:斐林试剂不能与酶直接接触,必须最后一步加;水浴加热必须为沸水,才能保证结果与预期相符,如果实验过程稍不严谨,就会影响实验结果。鉴于上述原因,此实验一般不选斐林试剂作为鉴定试剂。
斐林试剂与双缩脲试剂的比较
斐林试剂与双缩脲试剂的比较 1.主要区别 2.典型例题赏析 例1.现提供新配置的斐林试剂甲液(0.1g/ml NaOH溶液)、乙液(0.05g/ml CuSO4溶液)、蒸馏水,则充分利用上述试剂及必需的实验用具,能鉴别出下列哪些物质() ①葡萄糖②蔗糖③胰蛋白酶④DNA A.只有① B.①和② C.①和③ D.②、③和④ 错解:A 分析:一般只看到了斐林试剂甲液(0.1g/ml NaOH溶液)、乙液(0.05g/ml CuSO4溶液)可以鉴定还原性糖,所以选A。而忽略了婓林试剂乙液可被蒸馏水稀释到0.01g/ml CuSO4溶液,即双缩脲试剂B液,故可以来鉴定蛋白质。 正解:主要考查审题的细心认真程度,“蒸馏水”是关键词。婓林试剂甲液、婓林试剂乙液可以来鉴定葡萄糖等可溶性还原性糖,而蔗糖不是还原性糖。婓林试剂和双缩脲试剂的成分区别是:斐林试剂甲液=双缩脲试剂A液,都是0.1g/ml NaOH溶液;斐林试剂乙液和双缩脲试剂B液成分都是CuSO4溶液,但浓度不同,分别是0.05g/ml、0.01g/ml。根据题意,双缩脲试剂B液可以通过蒸馏水和斐林试剂乙液来稀释而成。故答案选C。 例2.在下列四个试管中分别加入一些物质,甲试管:豆浆;乙试管:氨基酸溶液;丙试管:牛奶和蛋白酶;丁试管:人血液中的红细胞和蒸馏水。上述四个试管中加入双缩脲试剂振荡后,有紫色反应的是() A.甲、丁 B.甲、乙、丁 C.甲、乙、丙 D.甲、丙、丁 错选:C 分析:很多学生误认为氨基酸含有肽键,能被双缩脲试剂鉴定成紫色。而红细胞中没有蛋白质。 正解:豆浆和牛奶的主要成分是蛋白质。牛奶在蛋白酶的催化作用下,分解成多肽。蛋白酶的本质是蛋白质。人成熟的红细胞中含有血红蛋白,把它放在清水中,会吸水胀破,血红蛋白会释放出来。甲乙丙试管中加入双缩脲试剂,能出现紫色。氨基酸中不含肽键。从中可以看出,双缩脲试剂是鉴定含有肽键的化合物,如蛋白质、多肽等。正确答案选D 精选
斐林试剂与双缩脲试剂的使用释疑
斐林试剂与双缩脲试剂的使用释疑 王升友(江苏省赣榆县城头中学,222131) 中学生物教学,2003年第6期 在教学过程中,发现许多学生对于用斐林试剂鉴定可溶性还原糖与用双缩脲试剂鉴定蛋白质的实验中存在着许多疑难问题,为便于学生理解和掌握,现归纳总结如下: 1可溶性还原糖鉴定及蛋白质的鉴定原理不同 1 1可溶性还原糖鉴定原理 可溶性还原糖如葡萄糖、果糖、麦芽糖等的分子内都含有游离的具有还原性半缩醛羟基,当与新配制的一定浓度的Cu(OH)2悬浊液混合后,在加热的条件下,将Cu(OH)2还原为砖红色的Cu2O沉淀,而还原性糖本身则被氧化为相应的有机酸。以葡萄糖为例的反应式如下: 1 2蛋白质的鉴定原理 在碱性溶液中,双缩脲能与Cu2+作用,形成紫色或紫红色的络合物。故双缩脲试剂可鉴定双缩脲的存在,而蛋白质分子中含有很多与双缩脲结构相似的肽键。因此,蛋白质都可与双缩脲试剂发生颜色反应。 2斐林试剂与双缩脲试剂的配制与使用不同 2 1斐林试剂的配制 甲液:质量浓度为0 1g·mL-1的NaOH溶液 乙液:质量浓度为0 05g·mL-1的CuSO4溶液使用时临时配制,将4滴~5滴乙液滴入2mL甲液中,振荡混合均匀后即可使用。 2 2双缩脲试剂的配制 取10gNaOH放入量筒内加水至100mL,待充分溶解后倒入试剂瓶中配制成质量浓度为0.1g·mL-1的NaOH溶液,瓶口塞上胶塞,贴上标签,写上试剂A。取1gCuSO4放入量筒中,加水至100mL,待充分溶解后倒入试剂瓶中配制成质量浓度为0.01g·mL-1的CuSO4溶液,瓶口塞上胶塞,贴上标签,写上试剂B。使用时,先向试管中加入2mL试剂A,摇荡均匀,再向试管中加入3滴~4滴试剂B,摇荡均匀即可。 3反应过程中,出现的颜色变化及原因不同 3 1用斐林试剂鉴定还原糖的实验 因先加入刚配制的Cu(OH)2,故溶液变成浅蓝色;加热后,部分Cu(OH)2被还原为砖红色的Cu2O,因二者混合故呈现棕色;随着反应的继续进行,Cu(OH)2被全部还原为Cu2O,故而出现砖红色的沉淀。颜色变化为:浅蓝色→棕色→砖红色(沉淀)。 3 2用双缩脲试剂鉴定蛋白质的实验 加入双缩脲试剂A,溶液为无色;加入双缩脲试剂B,因有Cu(OH)2生成,故呈现浅蓝色;振荡均匀后,由于反应的进行,出现紫色的络合物。颜色变化为:无色→浅蓝色→紫色。 4实验过程中,应熟练掌握的问题 4 1斐林试剂为何要现配现用?因斐林试剂很不稳定,容易生成蓝色Cu(OH)2沉淀,所以应将甲液、乙液分别配制储存,使用时再临时配制。 4.2用斐林试剂鉴定时,为何不能先加入NaOH,后加入CuSO4,而必须混合后再加入?因为若先
总糖和还原糖的测定——斐林氏法
总糖和还原糖测定方法较多,如3,5—二硝基水杨酸法、碱性铜试剂法、蒽酮比色法、斐林氏法等。这里只介绍斐林氏法。 一、目的 学习掌握生产实践中常用的快速定糖方法。 二、原理 还原糖在碱性溶液中能将Ag+,Hg+,Cu2+,Fe(CN)3-等金属离子还原,而糖本身则氧化成各种羟酸,利用这一特性可以对还原糖进行定量测定。本实验采用斐林试剂热滴定法,氧化剂是斐林试剂,它是由甲乙两种溶液组成,甲液中含有硫酸铜、次甲基蓝;乙液中含有氢氧化钠、酒石酸钾钠和亚铁氰化钾(黄血盐)。当甲乙两液混合时,硫酸铜和氢氧化钠作用形成氢氧化铜沉淀,由于溶液中存在酒石酸钾钠,它和氢氧化铜形成了可溶性络合物。 酒石酸络铜(Ⅱ)钾钠盐在与还原糖共热时,二价铜离子即被还原成一价的氧化亚铜红色沉淀。 此氧化亚铜与试剂中亚铁氰化钾反应生成可溶性的亚铁氰酸络铜(Ⅰ)钾盐。 Cu2O + K4Fe(CN)6 + 3 H2O →K2Cu2Fe(CN)6 + 2 KOH + 2 H2O 亚铁氰化钾亚铁氰酸络铜(Ⅰ)钾盐 斐林试剂中二价铜的还原力比次甲基蓝强,因此所滴入的标准葡萄糖溶液首先使二价铜还原,只有当二价铜被还原完毕后,才能使次甲基蓝(甲烯蓝)还原为无色,测定中以此作为滴定终点。 在测定时先做一对照管(不加样品),用标准葡萄糖滴定求知一定体积斐林试剂中二价铜和次甲基蓝的量,即测定对照管消耗的标准葡萄糖量(A)。再做样品管,样品中还原糖消耗斐林试剂中一部分二价铜,剩余的量再用标准葡萄糖来滴定,即样品消耗的标准葡萄糖量(B)。将(A)减去(B)就可求得样品中还原糖量。 三、器材及试剂: 1.器材: ①山芋粉②广范试纸pH1~12。 ③吸管5毫升(×4),10毫升(×2)④容量瓶100毫升(×3)
高中生物学中常用的试剂
高中生物学中常用的试剂 1、斐林试剂:成分:质量浓度为0.1g/ml 的NaOH(甲液)和质量浓度为0.05g/ml 的CuSO4(乙液)。用法:将斐林试剂甲液和乙液等体积混合,再将混合后的斐林试剂倒入待测液,水浴加热或直接加热,如待测液中存在还原糖,则呈砖红色。 2.碘液:用于鉴定淀粉的存在。遇淀粉变蓝。 3、双缩脲试剂:成分:质量浓度为0.1g/ml的NaOH(A液)和质量浓度为0.01g/ml的CuSO4(B液)。用法:向待测液中先加入2ml A 液,摇匀,再向其中加入3~4滴B 液,摇匀。如待测中存在蛋白质,则呈现紫色。 4、苏丹Ⅲ:用法:取苏丹Ⅲ颗粒溶于体积分数为95%的酒精中,摇匀。用于检测脂肪。可将脂肪染成橘黄色(被苏丹Ⅳ染成红色)。 5、二苯胺:用于鉴定DNA。DNA遇二苯胺(沸水浴)会被染成蓝色。 6、甲基绿:用于鉴定DNA。DNA遇甲基绿(常温)会被染成蓝绿色。 7、50%的酒精溶液:在脂肪鉴定中,用苏丹Ⅲ染液染色,再用50%的酒精溶液洗去浮色。 8、75%的酒精溶液:用于杀菌消毒,75%的酒精能渗入细胞内,使蛋白质凝固变性。低于这个浓度,酒精的渗透脱水作用减弱,杀菌力不强;而高于这个浓度,则会使细菌表面蛋白质迅速脱水,凝固成膜,妨碍酒精透入,削弱杀菌能力。75%的酒精溶液常用于手术前、打针、换药、针灸前皮肤脱碘消毒以及机械消毒等。 9、体积分数为95%的酒精溶液:冷却的体积分数为95%的酒精可用于凝集DNA。 10、体积分数为15%的盐酸:和95%的酒精溶液等体积混合可用于解离根尖。 11、龙胆紫溶液:(质量浓度为0.01g/ml或0.02g/ml)用于染色体着色,可将染色体染成紫色,通常染色3~5分钟。(也可以用醋酸洋红染色) 12、20%的肝脏、3%的过氧化氢、3.5%的氯化铁:用于比较过氧化氢酶和Fe3+的催化效率。(新鲜的肝脏中含有过氧化氢酶) 13、3%的可溶性淀粉溶液、3%的蔗糖溶液、2%的新鲜淀粉酶溶液:用于探索淀粉酶对淀粉和蔗糖的作用实验。 14、丙酮:用于提取叶绿体中的色素。 15.二氧化硅:有助于提取色素过程中研磨得更充分。 16.碳酸钙:防止提取色素过程中研磨时色素被破坏。 17.层析液:色素能溶解在层析液中,由于溶解度不同使色素分子随层析液扩散的速度不同,而使色素分子分离开。 18.秋水仙素:用于育种工作中,使单倍体植株变成纯合正常植株,原理是抑制分裂过程中纺锤体的形成,使染色单体无法分离,而染色体数目加倍。
斐林试剂
斐林试剂、双缩脲试剂和班氏试剂比较 苗树新 斐林试剂和双缩脲试剂的成分相同,但二者的使用方法及原理不尽相同。斐林试剂和班氏试剂都是检验还原性糖的试剂,二者的使用方法及原理、成分也有区别,下面就从这几种试剂的使用原理、成分及使用方法等方面做一简单总结。 1. 斐林试剂和双缩脲试剂 斐林试剂和双缩脲试剂都由溶液和溶液组成,但二者有如下三点不同: (1)溶液浓度不同 斐林试剂中溶液称为斐林试剂甲,其浓度为溶液称为斐林试剂乙,其浓度为;双缩脲试剂中溶液(双缩脲试剂A)的浓度为,溶液(双缩脲试剂B)的浓度为。 (2)使用原理不同 斐林试剂是新配制的溶液,它在加热条件下与醛基反应,被还原成砖红色的沉淀,可用于鉴定可溶性还原糖的存在。用斐林试剂鉴定可溶性还原糖时,溶液的颜色变化过程为:浅蓝色→棕色→砖红色(沉淀)。 鉴定生物组织中是否含有蛋白质时,常用双缩脲法,使用的是双缩脲试剂,发生的是双缩脲反应。双缩脲反应实质是在碱性环境下的与双缩脲试剂发生的紫色反应。而蛋白质分子中含有很多与双缩脲()结构相似的肽键,所以蛋白质都能与双缩脲试剂发生颜色反应,可以用双缩脲试剂鉴定蛋白质的存在。 (3)使用方法不同 斐林试剂使用时,先反溶液和溶液混合(将滴溶液滴入溶液中),而后立即使用:双缩脲试剂使用时,先加入溶液(2mL),振荡摇匀,造成碱性的反应环境,然后再加入3~4滴溶液,振荡摇匀后观察现象。 2. 斐林试剂和班氏试剂 关于斐林试剂和班氏试剂,可用下面的例题引出其异同点:例:你可用什么方法,检验人的尿液中是否含有糖? 答案: 方法一:在试管中加入人的尿液0.1mL,加入班氏糖定性试剂1mL,混合均匀后,将试管放
总蛋白检测试剂盒(双缩脲比色法)
总蛋白检测试剂盒(双缩脲比色法) 简介: 总蛋白(Total Protein ,TP)由白蛋白和球蛋白组成。对于生物体液(血清、尿液、脑脊液)中总蛋白质含量的测定,一般要基于如下两个假设:1、所有蛋白质分子由纯多肽组成,含氮量的质量百分比为16%;2、体液中含有数百个蛋白质分子,每个分子对测定反应都具有非常相似的特性。目前常用的方法有:双缩脲法、紫外分光光度法、染料结合法、凯氏定氮法、沉淀法等。 Leagene 总蛋白检测试剂盒(双缩脲比色法)多用于人或动物血清、血浆、组织等样本中的总蛋白含量测定。双缩脲反应的原理是在呈蓝色的碱性硫酸铜溶液存在的情况下,铜离子与肽键形成有色螯合的铜复合物,呈紫色,所产生的颜色密度与参与反应肽键数成比例。可通过比色法分析浓度,在紫外可见光谱中的波长。双缩脲法测定蛋白浓度兼容性亦很好,不受大部分样本中其他成分的影响,但易受铜离子螯合剂影响。本试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。 组成: 自备材料: 1、 离心管或小试管 2、 水浴锅或恒温箱 3、 比色杯 4、 分光光度计 操作步骤(仅供参考): 1、 取蛋白标准配制液或稀释液加入到蛋白标准中,充分溶解后配制成的蛋白标准溶液,配 制后可立即使用,溶解后的蛋白标准溶液应-20℃保存。亦可按自己试验要求继续进行稀释,如稀释至1mg/ml 。特别提示:待测蛋白溶解于什么样的稀释液中,蛋白标准也宜溶解于什么样的稀释液中。例如待测蛋白溶解于蔗糖中,亦取蛋白标准溶解于蔗糖中。一般也可以用NaCl 或PBS 作为溶解总蛋白标准品的稀释液。 编号 名称 TC0547 120T Storage 试剂(A): 双缩脲试剂 250ml 4℃ 试剂(B): 蛋白标准 20mg RT 试剂(C): 蛋白标准配制液 5ml RT 试剂(D): 双缩脲空白试剂(备选) 100ml 4℃ 使用说明书 1份
实验四斐林试剂法法测定还原糖含量
一、实验目的: 掌握园艺产品中糖的测定方法。 二、实验原理 利用糖的还原性,与斐林试剂(氧化剂)中的二价铜离子还原为一价铜,进行氧化还原反应,而进行测定。非还原糖必须转化为还原糖,再进行测定。 斐林试剂中酒石酸钾钠铜是一种氧化剂,反应的终点可用次甲基蓝作指示剂,在碱性、沸腾环境下还原呈无色。根据斐林试剂完全还原所需的还原糖量,计算出样品还原糖量。 三、试剂与材料 1、斐林试剂 甲:加水溶解并定容至1000ml; 乙:346g酒石酸钾钠+100gNaOH加水溶解并定容至1000ml; 2、1%次甲基蓝,1g次甲基蓝加水溶解并定容至100ml,棕色瓶保存; 3、%标准葡萄糖,2g 105℃烘干到恒重的葡萄糖加水定容到1000ml; 4、碱式滴定管; 5、电炉,各种玻璃器皿。 四、操作方法 1、斐林试剂标定 取甲液5ml加入5ml乙液中,置于250ml三角瓶中,加入水10ml,从滴定管中加入%的标准葡萄糖若干毫升(约23ml)。(量控制在后滴定时消耗葡萄糖在-。 电炉上加热至沸,并保持微沸2分钟,加2滴1%次甲基蓝溶液,趁沸以每两秒1滴的速度继续滴加葡萄糖标准溶液,用%标准葡萄糖滴定至蓝色消失,有红棕色沉淀,溶液清亮为终点止。记录耗用的葡萄糖量为V0,必须在1min内完成。 (注意:还原的次甲基蓝易被空气中的氧氧化,恢复成原来的蓝色,所以滴定过程中必须保持溶液成沸腾状态,并且避免滴定时间过长。) 2、样品滴定预备试验 同上法取斐林试剂,加10ml样品液,摇匀于电炉上加热至沸,保持微沸2分钟,加2滴1%次甲基蓝,用%葡萄糖滴定至蓝色消失。记录耗用的葡萄糖量为V1。 3、样品滴定 同上法吸取斐林试剂加10ml样品液(预先稀释),补加(V0-V1)ml水,并从滴定管中预先加入(V1-1)ml %葡萄糖,摇匀至电炉上加热至沸,保持2min微沸,加入2滴1%次甲基蓝,继续用葡萄糖滴定至蓝色消失。记录消耗的标准葡萄糖体积为V毫升。 五、结果计算 还原糖含量(以葡萄糖计)(g/ml)=(Vo-V)××1/10×n 式中:Vo--------斐林试剂标定值,ml V---------样品糖液测定值,ml 标准葡萄糖溶液浓度,g/ml 10--------样品糖液体积,ml n---------样品稀释倍数 六、思考题:
斐林试剂与双缩脲试剂的比较完整版
斐林试剂与双缩脲试剂 的比较 标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]
斐林试剂与双缩脲试剂的比较 1.主要区别 2.典型例题赏析 溶例1.现提供新配置的斐林试剂甲液(0.1g/mlNaOH溶液)、乙液(0.05g/mlCuSO 4液)、蒸馏水,则充分利用上述试剂及必需的实验用具,能鉴别出下列哪些物质() ①葡萄糖?②蔗糖?③胰蛋白酶?④DNA? A.只有① B.①和② C.①和③ D.②、③和④
错解:A? 分析:一般只看到了斐林试剂甲液(0.1g/mlNaOH溶液)、乙液(0.05g/mlCuSO 溶液)可 4 溶以鉴定还原性糖,所以选A。而忽略了婓林试剂乙液可被蒸馏水稀释到0.01g/ml?CuSO 4液,即双缩脲试剂B液,故可以来鉴定蛋白质。 正解:主要考查审题的细心认真程度,“蒸馏水”是关键词。婓林试剂甲液、婓林试剂乙液可以来鉴定葡萄糖等可溶性还原性糖,而蔗糖不是还原性糖。婓林试剂和双缩脲试剂的成分区别是:斐林试剂甲液=双缩脲试剂A液,都是0.1g/ml?NaOH溶液;斐林试剂乙液和双缩脲试剂B液成分都是CuSO 溶液,但浓度不同,分别是 0.05g/ml、0.01g/ml。根据题 4 意,双缩脲试剂B液可以通过蒸馏水和斐林试剂乙液来稀释而成。故答案选C。 例2.在下列四个试管中分别加入一些物质,甲试管:豆浆;乙试管:氨基酸溶液;丙试管:牛奶和蛋白酶;丁试管:人血液中的红细胞和蒸馏水。上述四个试管中加入双缩脲试剂振荡后,有紫色反应的是()A.甲、丁B.甲、乙、丁C.甲、乙、丙D.甲、丙、丁错选:C? 分析:很多学生误认为氨基酸含有肽键,能被双缩脲试剂鉴定成紫色。而红细胞中没有蛋白质。
实验室常用生化试剂配方
实验室常用生化试剂配方 1.常用抗生素配制以及使用说明(参考链霉菌室操作手册2019版) 抗生素 英文名称及缩写 抗性基因 贮藏液浓度(mg/ml) 100 25(无水乙醇配) 50 25 50 50 25(DMSO配) 100 50 35 25(0.15M NaOH配) 50(DMSO配) 50 50 MM 使用终浓度(μg/ml)链霉菌 2CM YEME 大肠杆菌 LA或LB 氨苄青霉素氯霉素潮霉素卡那霉素壮观霉素链霉素硫链丝菌素红霉素阿泊拉霉素紫霉素萘锭酮酸 TMP Ampicillin, Amp bla Chloramphenicol, Cml Hygromycin, Hyg Kanamycin, Km Spectinomycin, Spc Streptomycin, Str Thiostrepton, Thio Erythomycin, Ery Apramycin, Am Viomycin,Vio Nalidixic acid Trimethoprim cat hyg aac/aph aadA str tsr ermE aac(3)IV vph -* 10 10 2 5 10 5 100 10 -- 25 25 20 25 10 - 50 ------ 2.5 - 5 50-100 25 - 25 50 25 25 20 10-30
注意事项: (1) –表示无记录或不能使用,贮存液除特别说明外均用无菌水配制,配制过程请 确保抗生素粉末充分溶解混匀后再分装; (2)Km 和Am有交叉抗性,同时具有这两种抗性基因时应适当提高抗生素的量,并 设置阴性对照; (3)Hyg、Vio易见光分解,配制好后应用锡箔纸包好,使用过程中建议避光操作。有些抗生素需要在低盐的环境(如DNA培养基)下筛选效率较高,如Hyg, Km, Vio (4)用无菌水配制的抗生素需在超净工作台内用0.22 μm一次性过滤器过滤除菌并 分装;氯霉素、TMP、硫链丝菌素可以在超净工作台外配制分装,无需过滤除菌,但需确 保配制贮存液所用溶剂(无水乙醇、DMSO)未遭受污染,建议配制氯霉素时使用新的无水 乙醇,不要使用抽提质粒或总DNA时用的无水乙醇,以防止污染;DMSO,即二甲亚砜,易 挥发,有剧毒; (5)长期不用的抗生素请置于-20℃保存,抗生素粉末按照使用说明一般置于4℃保存,经常使用时可以暂置于4℃保存; (6)抗生素的实际使用浓度请结合实验经验进行适当调整; (7)配制抗生素时应尽量一次性称取抗生素粉末,配制过程中建议穿工作服,戴一次 性橡胶手套及口罩,及时清理称量配制抗生素时使用的台面及器具,以避免抗生素及溶剂 对自身的损伤及对工作环境的污染。 注意事项: (1)表中所列酶均可以用无菌水配制,也可以用相应的缓冲液配制,缓冲液配制方法 参考《分子克隆实验指南(第3版)》: 蛋白酶 K缓冲液:50 mM Tris(pH 8.0),1.5 mM 乙酸钙; RNase A缓冲液:TE (pH 7.6):10 mM Tris-HCl,1 mM EDTA;溶菌酶缓冲液:10 mM Tris-HCl(pH 8.0); (2) RNase A配制好后沸水浴处理5 min,取出贮存RNase A后首次使用时也需沸水 浴处理5 min后再使用; (3)制备原生质体时使用的溶菌酶配制时需过滤除菌,其他情况一般无需过滤除菌; (4)所有酶均应在-20℃保存,使用过程中避免反复冻融,配制过程中尽量避免外界 污染。 (1)IPTG用无菌水配制,0.22μm一次性滤膜过滤除菌,分装保存于-20℃;
蛋白质测定方法之双缩脲法(Biuret法)
一)实验原理 双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。 紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。测定范围为1~10mg蛋白质。干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。 此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。主要的缺点是灵敏度差。因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。 (二)试剂与器材 1.试剂: (1)标准蛋白质溶液:用标准的结晶牛血清清蛋白(BSA)或标准酪蛋白,配制成10mg/ml 的标准蛋白溶液,可用BSA浓度1mg/ml的A280为0.66来校正其纯度。如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。牛血清清蛋白用H2O 或0.9%NaCl配制,酪蛋白用0.05N NaOH配制。 (2)双缩脲试剂:称以1.50克硫酸铜(CuSO4?5H2O)和6.0克酒石酸钾钠(KNaC4H4O6?4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。此试剂可长期保存。若贮存瓶中有黑色沉淀出现,则需要重新配制。 2.器材: 可见光分光光度计、大试管15支、旋涡混合器等。 (三)操作方法 1.标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。用未加蛋白质溶液的第一支试管作为空白对照液。取两组测定的平均值,以蛋白质的含量为横座标,光吸收值为纵座标绘制标准曲线。 2、样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。注意样品浓度不要超过10mg/ml。 三、Folin—酚试剂法(Lowry法) (一)实验原理
高中生物实验常用的试剂(归纳总结)
生物学中常用的试剂: 1.斐林试剂:成分:0.1g/ml NaOH(甲液)和0.05g/ml CuSO4(乙液)。用法:将斐林试剂甲液和乙液混合,再将混合后的斐林试剂倒入待测液,水浴加热,如待测液中存在还原糖,则呈砖红色。 2.班氏糖定性试剂:为蓝色溶液。和葡萄糖混合后沸水浴会出现砖红色沉淀。用于尿糖的测定。 3.双缩脲试剂:成分:0.1g/ml NaOH(甲液)和0.01g/ml CuSO4(乙液)。用法:向待测液中先加入2ml甲液,摇匀,再向其中加入3~4滴乙液,摇匀。如待测中存在蛋白质,则呈现紫色。 4.苏丹Ⅲ:用法:取苏丹Ⅲ颗粒溶于95%的酒精中,摇匀。用于检测脂肪。可将脂肪染成橘黄色(被苏丹Ⅳ染成红色)。 5.二苯胺:用于鉴定DNA。DNA遇二苯胺(沸水浴)会被染成蓝色。 6.甲基绿:用于鉴定DNA。DNA遇甲基绿(常温)会被染成蓝绿色。 吡罗红:检测RNA,呈红色 7、50%的酒精溶液:用于洗去苏丹Ⅲ在脂肪上的浮色。 8、70%的酒精溶液:用于医学临床上的消毒灭菌。 9、95%的酒精溶液:冷却的体积分数为95%的酒精可用于凝集DNA 10、15%的盐酸:和95%的酒精溶液等体积混合可用于解离根尖。 11. 龙胆紫溶液或醋酸洋红:碱性染料,用于染色体染色时,前者呈深蓝色,后者呈红色 改良苯酚品红染液:检测染色体,红色 健那绿:检测线粒体,专一性让线粒体染色呈蓝绿色 12.20%的肝脏、3%的过氧化氢、3.5%的氯化铁:用于比较过氧化氢酶和Fe3+的催化效率。(新鲜的肝脏中含有过氧化氢酶) 13、3%的可溶性淀粉溶液、3%的蔗糖溶液、2%的新鲜淀粉酶溶液:用于探索淀粉酶对淀粉和蔗糖的作用实验。 14.碘液:用于鉴定淀粉的存在。遇淀粉变蓝。遇糖原变红 15.丙酮:用于提取叶绿体中的色素 16.层析液:(成分:20份石油醚、2份丙酮、和1份苯混合而成,也可用93号汽油)可用于色素的层析,即将色素在滤纸上分离开。 17.二氧化硅:在色素的提取的分离实验中研磨绿色叶片时加入,可使研磨充分。 18.碳酸钙:研磨绿色叶片时加入,可中和有机酸,防止在研磨时叶绿体中的色素受破坏。 19、0.3g/mL的蔗糖溶液:相当于30%的蔗糖溶液,比植物细胞液的浓度大,可用于质壁分离实验。 20、0.1g/mL的柠檬酸钠溶液:与鸡血混合,防凝血 21、氯化钠溶液:①可用于溶解DNA。当氯化钠浓度为2mol/L、0.015mol/L时DNA的溶解度最高,在氯化钠浓度为0.14 mol/L时,DNA溶解度最低。②浓度为0.9%时可作为生理盐水。 22、胰蛋白酶:①可用来分解蛋白质。②可用于动物细胞培养时分解组织使组织细胞分散于。 23、秋水仙素:人工诱导多倍体试剂。用于萌发的种子或幼苗,可使染色体组加倍,原理是可抑制正在分裂的细胞纺缍体的形成。 24、氯化钙:增强细菌细胞壁的通透性,可用于基因工程。 25.石磊试剂:检验溶液酸碱性→判断光合速率与呼吸速率快慢的关系; 26、NaHCO3/ Na2CO3 Na2HPO4/ NaH2PO4:酸碱缓冲对→调节PH27.NaCl:配制生理盐水(0.9%)或用于提取DNA(0.14M或2M) 28.溴麝香草酚蓝水溶液:检测CO2,由蓝变绿再变黄
(完整版)斐林试剂和双缩脲试剂区别
斐林试剂和双缩脲试剂区别 1、试剂的浓度和配制方法不同 斐林试剂:甲液: 0.1g/mL 的NaOH 溶液;乙液:0.05g/mL 的4CuSO 溶液。使用前临时配制,在2mL 的甲液中滴入4滴~5滴乙液,振荡使混合均匀后即可。 双缩脲试剂:A 液:0.1g/mL 的NaOH 溶液;B 液:0.01g/mL 的4CuSO 溶液。 分别配制好A 液和B 液即可。 2、试剂的作用和鉴定原理不同 斐林试剂: 作用:可鉴定可溶性还原糖。 原理:甲液和乙液混合后产生 2)OH (Cu 沉淀,2)OH (Cu 与含醛基(—CHO )的可溶性还原糖,在加热条件下反应,将 2)OH (Cu 还原为砖红色的O Cu 2沉淀。双缩脲试剂: 作用:可鉴定蛋白质溶液。 原理:在碱性溶液(NaOH )中,双缩脲(22CONH NH NCO H )能与2Cu 反应,形成紫色络合物。由于蛋白质分子中含有许多与双缩脲结构相似的肽键(— CO —NH —), 因此,蛋白质都可以与双缩脲试剂发生反应而使溶液呈现紫色。3、试剂的使用方法不同 斐林试剂:使用时现配现用,要水浴加热。如果斐林试剂放置一段时间, 因2)OH (Cu 沉淀在溶液底部而无法使用。使用时,甲液和乙液不可分别加入到待测液中,否则,待测液(苹果组织样液)中的有机酸会中和NaOH ,使产生的2)OH (Cu 不足而影响鉴定。 双缩脲试剂:使用时,双缩脲试剂A 液和双缩脲试剂 B 液要分别先后加入到待测液中,不需要加热。双缩脲试剂A 液和双缩脲试剂 B 液不可以混合后再加入待测液。如先混合,则会产生2)OH (Cu 沉淀而无2Cu 产生。加入的双缩脲试剂 B 液(4CuSO )也不能过量,
实验四 斐林试剂法法测定还原糖含量(1)
实验四斐林试剂法测定果品蔬菜中还原糖含量 一、实验目的: 掌握园艺产品中糖的测定方法。 二、实验原理 利用糖的还原性,与斐林试剂(氧化剂)中的二价铜离子还原为一价铜,进行氧化还原反应,而进行测定。非还原糖必须转化为还原糖,再进行测定。 斐林试剂中酒石酸钾钠铜是一种氧化剂,反应的终点可用次甲基蓝作指示剂,在碱性、沸腾环境下还原呈无色。根据斐林试剂完全还原所需的还原糖量,计算出样品还原糖量。 三、试剂与材料 1、斐林试剂 甲:69.3g CuSO4.5H2O加水溶解并定容至1000ml; 乙:346g酒石酸钾钠+100gNaOH加水溶解并定容至1000ml; 2、1%次甲基蓝,1g次甲基蓝加水溶解并定容至100ml,棕色瓶保存; 3、0.2%标准葡萄糖,2g 105℃烘干到恒重的葡萄糖加水定容到1000ml; 4、碱式滴定管; 5、电炉,各种玻璃器皿。 四、操作方法 1、斐林试剂标定 取甲液5ml加入5ml乙液中,置于250ml三角瓶中,加入水10ml,从滴定管中加入0.2%的标准葡萄糖若干毫升(约23ml)。(量控制在后滴定时消耗葡萄糖在0.5-1.0ml)。 电炉上加热至沸,并保持微沸2分钟,加2滴1%次甲基蓝溶液,趁沸以每两秒1滴的速度继续滴加葡萄糖标准溶液,用0.2%标准葡萄糖滴定至蓝色消失,有红棕色沉淀,溶液清亮为终点止。记录耗用的葡萄糖量为V0,必须在1min内完成。 (注意:还原的次甲基蓝易被空气中的氧氧化,恢复成原来的蓝色,所以滴定过程中必须保持溶液成沸腾状态,并且避免滴定时间过长。) 2、样品滴定预备试验 同上法取斐林试剂,加10ml样品液,摇匀于电炉上加热至沸,保持微沸2分钟,加2滴1%次甲基蓝,用0.2%葡萄糖滴定至蓝色消失。记录耗用的葡萄糖量为V1。 3、样品滴定 同上法吸取斐林试剂加10ml样品液(预先稀释),补加(V0-V1)ml水,并从滴定管中预先加入(V1-1)ml 0.2%葡萄糖,摇匀至电炉上加热至沸,保持2min微沸,加入2滴1%次甲基蓝,继续用葡萄糖滴定至蓝色消失。记录消耗的标准葡萄糖体积为V毫升。 五、结果计算 还原糖含量(以葡萄糖计)(g/ml)=(Vo-V)×0.002×1/10×n 式中:V o--------斐林试剂标定值,ml V---------样品糖液测定值,ml 0.002-----标准葡萄糖溶液浓度,g/ml 10--------样品糖液体积,ml
斐林试剂与班氏试剂
斐林试剂与班氏试剂 高中生物教材(实验修订本)的有关实验中用到了斐林试剂和班氏试剂,二者都可用于鉴定可溶性还原糖,但两种试剂的配制、反应原理及使用方法均有所不同,教材只介绍了斐林试剂的配制和使用方法,对班氏试剂的配制和反应原理没做任何解释。班氏试剂是如何配制的?与斐林试剂的配制、反应原理有何不同?学生对此有较多疑问,现解释如下。 1.斐林试剂的配制、使用方法及反应原理 斐林试剂由甲液(0.1g/mlNaOH)和乙液(0.05g/mlCuSO4)组成,用于鉴定可溶性还原糖,使用时将等量的甲、乙液混合均匀,取适量加入待测液,此时溶液呈蓝色。沸水浴加热2min左右,即可观察到有砖红色沉淀生成,说明待测液中有可溶性还原糖。 甲、乙液混合时,生成了Cu(OH)2,而新制的Cu(OH)2在还原性糖的作用下,被还原为CuO砖红色沉淀。实验过程中,必须先把甲、乙液等量混合均匀,使Cu(OH)2充分生成。如果先后或者分别把NaOH和CuSO4溶液加入到含有还原性糖的组织提取液中,其中的有机酸会与NaOH迅速反应,使反应物中没有Cu(OH)2或者Cu(OH)2量不足,从而使还原性糖与Cu(OH)2的反应不能进行或现象不明显,影响还原性糖的鉴定。 2.班氏试剂的配制、使用方法及反应原理 班氏试剂一般用于尿糖的测定,有时也用于其他实验中可溶性还原糖的鉴定。配制方法:取柠檬酸钠86.5g和无水碳酸钠50g放入1000ml锥形瓶中,加水350ml,加热至溶解。另取100ml锥形瓶加入硫酸铜8.65g,加水约50ml,加
热溶解。待二者冷却至室温,将硫酸铜溶液慢慢倒入前液,随时搅匀,并补足水量至500ml。 使用时,取1ml班氏试剂加入试管,加入糖尿病患者的尿液0.1ml,混匀后沸水浴加热,可观察到溶液开始为蓝色,后来出现黄绿色、土黄色或砖红色沉淀,分别反映出患者尿液中糖含量的多少,结果见下表。 沸水浴加热后的现象葡萄糖含量(g/dL) 透明蓝色无 加热时无变化,仅冷却后有少量沉淀微量,约0.5以下 加热1min后即出现少量黄绿色沉淀少量,约0.5~1 加热约10~15s即再现土黄色沉淀中量,约1~2 加热时很快出现多量砖红色沉淀大量,约2以上班氏试剂在配制过程中,当把硫酸铜溶液倒入由柠檬酸钠和无水硫酸钠配制的溶液中时,硫酸铜与硫酸钠和柠檬酸钠相遇,能产生出一种可溶性的又能离解出Cu2+的可溶性络盐,即柠檬酸钠此时能防止氢氧化铜沉淀的形成,做了一种亲水性掩蔽络合物形成剂。 当利用班氏试剂测定还原性糖时,还原性糖在这种碱性溶液中能将Cu2+还原为Cu+,Cu+再与OH-合成黄色的CuOH,加热后,CuOH即变成砖红色的氧化亚铜(CuO)沉淀。 综上所述,斐林试剂与班氏试剂在配制和使用上均有所不同,不能混为一谈。另外,斐林试剂不稳定,必须现配现用,而班氏试剂配制好以后可较长时间保存。
