化学选修四化学方程式
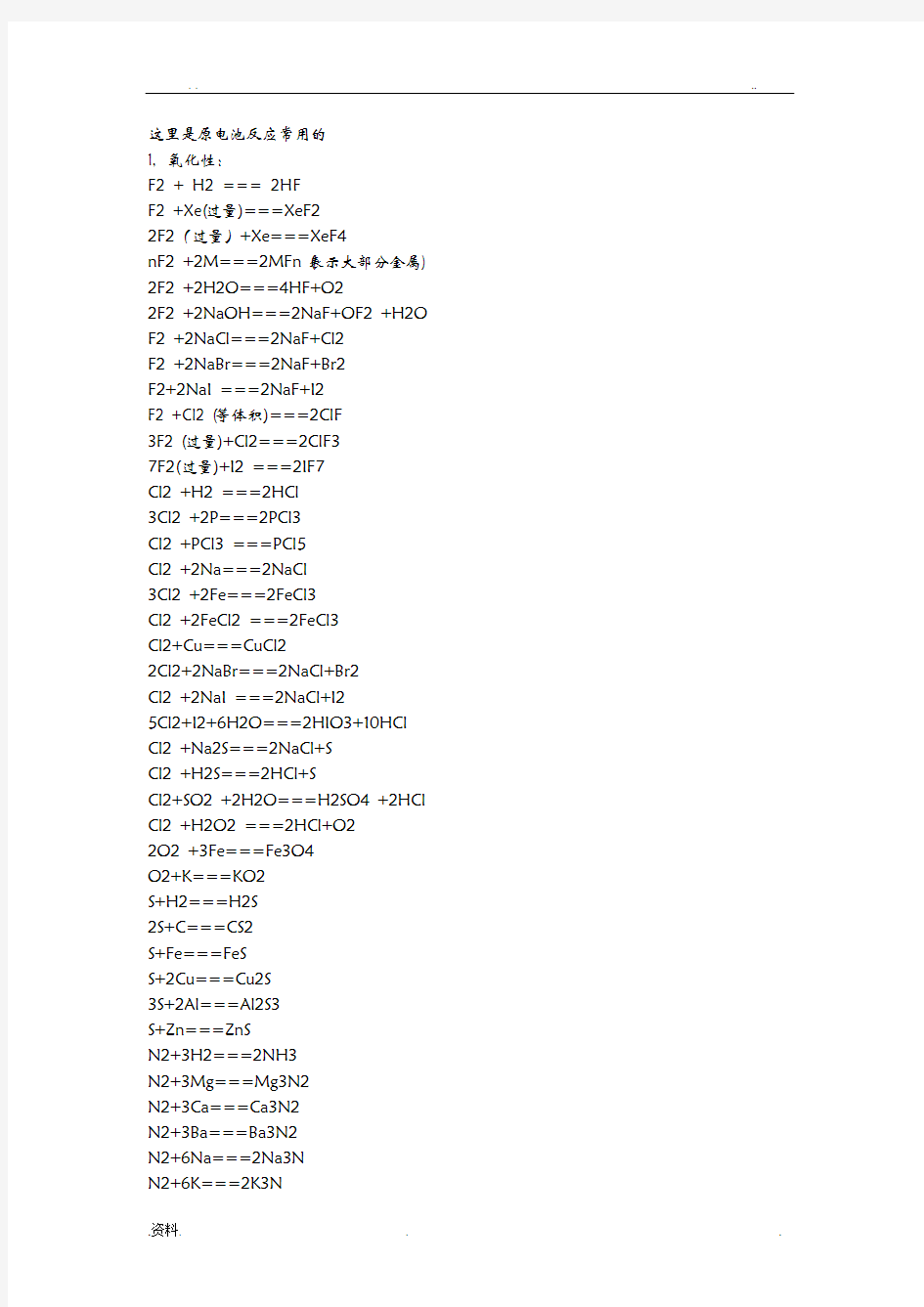

这里是原电池反应常用的
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
3,(碱中)歧化
Cl2+H2O===HCl+HClO
(加酸抑制歧化,加碱或光照促进歧化)
Cl2+2NaOH===NaCl+NaClO+H2O
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O
3S+6NaOH===2Na2S+Na2SO3+3H2O
4P+3KOH(浓)+3H2O===PH3+3KH2PO2
11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO
3C+SiO2===SiC+2CO
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2 高中化学方程式大全
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O 3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
2,酸性:
4HF+SiO2===SiF4+2H2O
(此反应广泛应用于测定矿样或钢样中SiO2的含量)
2HF+CaCl2===CaF2+2HCl
H2S+Fe===FeS+H2
H2S+CuCl2===CuS+2HCl
H2S+2AgNO3===Ag2S+2HNO3
H2S+HgCl2===HgS+2HCl
H2S+Pb(NO3)2===PbS+2HNO3
H2S+FeCl2===
2NH3+2Na==2NaNH2+H2
(NaNH2+H2O===NaOH+NH3)
3,碱性:
NH3+HCl===NH4Cl
NH3+HNO3===NH4NO3
2NH3+H2SO4===(NH4)2SO4
NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl
(此反应用于工业制备小打,打)
4,不稳定性:
2HF===H2+F2
2HCl===H2+Cl2
2H2O===2H2+O2
2H2O2===2H2O+O2
H2S===H2+S
2NH3===N2+3H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
3 高中化学方程式大全
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾) SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
3,与水的作用:
SO2+H2O===H2SO3
SO3+H2O===H2SO4
3NO2+H2O===2HNO3+NO
N2O5+H2O===2HNO3
P2O5+H2O===2HPO3
P2O5+3H2O===2H3PO4
(P2O5极易吸水,可作气体干燥剂
P2O5+3H2SO4(浓)===2H3PO4+3SO3)
CO2+H2O===H2CO3
4,与碱性物质的作用:
SO2+2NH3+H2O===(NH4)2SO3
SO2+(NH4)2SO3+H2O===2NH4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,
再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+MgO===MgSO4
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na2CO3+H2O
CO2(过量)+NaOH===NaHCO3
CO2+Ca(OH)2(过量)===CaCO3+H2O
2CO2(过量)+Ca(OH)2===Ca(HCO3)2
CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3
CO2+C6H5ONa+H2O===C6H5OH+NaHCO3
SiO2+CaO===CaSiO3
SiO2+2NaOH===Na2SiO3+H2O
(常温下强碱缓慢腐蚀玻璃)
SiO2+Na2CO3===Na2SiO3+CO2
SiO2+CaCO3===CaSiO3+CO2
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
3,与水的作用:
Na2O+H2O===2NaOH
2Na2O2+2H2O===4NaOH+O2
(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;
2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)
MgO+H2O===Mg(OH)2 (缓慢反应)
4,与酸性物质的作用:
Na2O+SO3===Na2SO4
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO3===MgSO4
MgO+H2SO4===MgSO4+H2O
Al2O3+3H2SO4===Al2(SO4)3+3H2O
(Al2O3是两性氧化物:
Al2O3+2NaOH===2NaAlO2+H2O)
FeO+2HCl===FeCl2+3H2O
Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2S(g)===Fe2S3+3H2O
Fe3O4+8HCl===FeCl2+2FeCl3+4H2O
化学选修四化学方程式
这里是原电池反应常用的 1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N
《选修4化学反应原理》焓变知识点总结
【 一、焓变、反应热 要点一:反应热(焓变)的概念及表示方法 化学反应过程中所释放或吸收的能量,都可以用热量来描述,叫做反应热,又称焓变,符号为ΔH,单位为kJ/mol,规定放热反应的ΔH为“—”,吸热反应的ΔH为“+”。 特别提醒: (1)描述此概念时,无论是用“反应热”、“焓变”或“ ΔH”表示,其后所用的数值必须带“+”或“—”。 (2)单位是kJ/mol,而不是kJ,热量的单位是kJ。 (3)在比较大小时,所带“+”“—”符号均参入比较。 要点二:放热反应和吸热反应 1.放热反应的ΔH为“—”或ΔH<0 ;吸热反应的ΔH为“+”或ΔH >0 ?H=E(生成物的总能量)-E(反应物的总能量) ?H=E(反应物的键能)-E(生成物的键能) 2.常见的放热反应和吸热反应 ①放热反应:活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应。 ②吸热反应:多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳的反应 3.需要加热的反应,不一定是吸热反应;不需要加热的反应,不一定是放热反应 4.通过反应是放热还是吸热,可用来比较反应物和生成物的相对稳定性。 如C(石墨,s)C(金刚石,s)△H3= +1.9kJ/mol,该反应为吸热反应,金刚石的能量高,石墨比金属石稳定。 二、热化学方程式的书写 书写热化学方程式时,除了遵循化学方程式的书写要求外,还要注意以下几点: 1.反应物和生成物的聚集状态不同,反应热的数值和符号可能不同,因此必须注明反应物和生成物的聚集状态,用s、l、g分别表示固体、液体和气体,而不标“↓、↑”。 2.△H只能写在热化学方程式的右边,用空格隔开,△H值“—” 表示放热反应,△H值“+”表示吸热反应;单位为“kJ/mol”。 3.热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子数或原子数,因此,化学计量数可以是整数,也可以是分数。 4.△H的值要与热化学方程式中化学式前面的化学计量数相对应,如果化学计量数加倍,△H也要加倍。 5.正反应若为放热反应,则其逆反应必为吸热反应,二者△H的数值相等而符号相反。 三、燃烧热、中和热、能源 要点一:燃烧热、中和热及其异同
化学选修四化学方程式
化学选修四化学方程式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
这里是原电池反应常用的 1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N
化学选修四第一章知识点
第一章化学反应与能量 一、焓变反应热 1.反应热:一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应 (1).符号:△H(2).单位:kJ/mol 3.产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热) △H 为“-”或△H <0 吸收热量的化学反应。(吸热>放热)△H 为“+”或△H >0 ☆ 常见的放热反应: ① 所有的燃烧反应② 酸碱中和反应③ 大多数的化合反应④ 金属与酸的反应 ⑤ 生石灰和水反应⑥ 浓硫酸稀释、氢氧化钠固体溶解等 ☆ 常见的吸热反应:① 晶体Ba(OH)2?6?18H2O与NH4Cl② 大多数的分解反应③ 以H2、CO、C为还原剂的氧化还原反应④ 铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强(25℃101KPa可以不标注)。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25 ℃,101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101 kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1 mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol) 四、中和热 1.概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。2.强酸与强碱的中和反应其实质是H+和OH-反应,其热化学方程式为: H+(aq) +OH-(aq) =H2O(l) ΔH=-57.3kJ/mol 3.弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。4.中和热的测定实验 五、盖斯定律 1.内容:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关,如果一个反应可以分几步进行,则各分步反应的反应热之和与该
化学选修四化学方程式
化学选修四化学方程式 This manuscript was revised on November 28, 2020
这里是原电池反应常用的 1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2
化学选修四化学方程式精编
化学选修四化学方程式 精编 Document number:WTT-LKK-GBB-08921-EIGG-22986
这里是原电池反应常用的 1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3N P2+6H2===4PH3
人教版高中化学选修四第一章
高中化学学习材料 (精心收集**整理制作) 人教版选修4第一章《化学反应与能量》测试题 广州市高二化学中心组提供2008.9 本试卷分第一部分(选择题)和第二部分(非选择题),满分100分,考试时间40分钟。 第一部分选择题(共50分) 一、选择题(每小题5分,每小题有1.~.2.个.选项符合题意,错选0分,漏选2分,共50分。)1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 ①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能 A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧ 2.下列说法中正确的是 A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 D.ΔH的大小与热化学方程式的计量系数无关 3.下列过程中△H小于零的是 A. 氯酸钾分解制氧气 B. 氯化铵分解得氨气 C.碳酸钙分解得二氧化碳 D. 实验室制备氢气 4.已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为 A.920 kJ B.557 kJ C.436 kJ D.188 kJ
5.同温同压下,已知下列各反应为放热反应,下列各热化学方程式中反应热最小的是A.2A ( l ) + B ( l ) = 2C (g ) △H1 B.2A ( g ) + B ( g ) = 2C (g ) △H2 C.2A ( g ) + B ( g ) = 2C ( l ) △H3 D.2A ( l ) + B ( l ) = 2C ( l ) △H4 6.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H =-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是A.△H1>△H2>△H3B.△H1<△H2<△H3 C.△H1>△H2=△H3D.△H1=△H2<△H3 7.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生 成新物质硫化亚铁。这现象说明了 A. 该反应是吸热反应 B. 该反应是放热反应 C. 铁粉和硫粉在常温下难以发生反应 D. 硫化亚铁的总能量高于铁粉和硫粉的总能量 8.以N A代表阿伏加德罗常数,则关于热化学方程式C2H2 ( g ) +5/2O2 ( g ) →2CO2 ( g )+H2O ( l ) △H = —1300kJ / mol 的说法中,正确的是 A. 当10 N A个电子转移时,该反应放出1300kJ的能量 B. 当1 N A个水分子生成且为液体时,吸收1300kJ的能量 C. 当2 N A个碳氧共用电子对生成时,放出1300kJ的能量 D. 当8 N A个碳氧共用电子对生成时,放出1300kJ的能量 9.下列说法或表示法正确的是 A.等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 B.由C(石墨)→C(金刚石) ΔH = +119 kJ·mol—1可知,石墨比金刚石稳定 C.在稀溶液中:H++OH-===H2O ΔH = -57.3 kJ·mol—1,若将含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液混合,放出的热量小于57.3 kJ D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+ O2(g)===2H2O(l)ΔH = +285.8 kJ·mol—1 10.一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的洁净水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物有关数据如下:
高二化学选修4知识点总结
高二化学知识点总结 化学反应原理复习(一) 第1章、化学反应与能量转化 化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收。 一、化学反应的热效应 1、化学反应的反应热 (1)反应热的概念: 当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。用符号Q表示。 (2)反应热与吸热反应、放热反应的关系。 Q>0时,反应为吸热反应;Q<0时,反应为放热反应。 (3)反应热的测定 测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下: Q=-C(T2-T1) 式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。实验室经常测定中和反应的反应热。 2、化学反应的焓变 (1)反应焓变 物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H,单位为kJ·mol-1。 反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。 (2)反应焓变ΔH与反应热Q的关系。 对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。 (3)反应焓变与吸热反应,放热反应的关系: ΔH>0,反应吸收能量,为吸热反应。 ΔH<0,反应释放能量,为放热反应。 (4)反应焓变与热化学方程式: 把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H2(g)+O2(g)=H2O(l);ΔH(298K)=-285.8kJ·mol-1 书写热化学方程式应注意以下几点: ①化学式后面要注明物质的聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。 ②化学方程式后面写上反应焓变ΔH,ΔH的单位是J·mol-1或kJ·mol-1,且ΔH后注明反应温度。 ③热化学方程式中物质的系数加倍,ΔH的数值也相应加倍。 3、反应焓变的计算 (1)盖斯定律 对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律。 (2)利用盖斯定律进行反应焓变的计算。 常见题型是给出几个热化学方程式,合并出题目所求的热化学方程式,根据盖斯定律可知,该方程式的ΔH为
(完整版)化学选修4(新人教版)
新人教版《化学反应原理》全册知识点归纳 第一章化学反应与能量 一、焓变反应热 1.反应热(Q):一定条件下,一定物质的量的反应物之间完全反应所放出或吸收的热量 2.焓变(ΔH)的意义:在恒压条件下进行的化学反应的热效应 (1).符号:△H(2).单位:kJ/mol(3)△H=H(生成物)-H(反应物) 3.微观角度解释产生原因:化学键断裂——吸热化学键形成——放热 放出热量的化学反应。(放热>吸热)△H为“-”或△H<0 吸收热量的化学反应。(吸热>放热)△H为“+”或△H>0 注:(高中阶段Q与△H二者通用) (4)影响晗变的主要因素:①发生变化的物质的物质的量,在其他条件一定时与变化物质的物质的量程正比。②物质的温度和压强 ☆常见的放热反应: ①所有的燃烧反应②酸碱中和反应 ③大多数的化合反应④金属与酸或水的反应 ⑤生石灰和水反应⑥浓硫酸稀释、氢氧化钠固体溶解等 ☆常见的吸热反应: ①晶体Ba(OH)2?8H2O与NH4Cl②大多数的分解反应 ③以H2、CO、C为还原剂的氧化还原反应④铵盐溶解等 二、热化学方程式 书写化学方程式注意要点: ①热化学方程式必须标出能量变化。 ②热化学方程式中必须标明反应物和生成物的聚集状态(g,l,s分别表示固态,液态,气态,水溶液中溶质用aq表示) ③热化学反应方程式要指明反应时的温度和压强。 ④热化学方程式中的化学计量数可以是整数,也可以是分数 ⑤各物质系数加倍,△H加倍;反应逆向进行,△H改变符号,数值不变 三、燃烧热 1.概念:25℃,101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。燃烧热的单位用kJ/mol表示。 ※注意以下几点: ①研究条件:101kPa ②反应程度:完全燃烧,产物是稳定的氧化物。 ③燃烧物的物质的量:1mol ④研究内容:放出的热量。(ΔH<0,单位kJ/mol)
高二化学选修4知识点总结
高二化学知识点总结 化学反应原理复习(一) 第1章、化学反应与能量转化 化学反应得实质就是反应物化学键得断裂与生成物化学键得形成,化学反应过程中伴随着能量得释放或吸收。 一、化学反应得热效应 1、化学反应得反应热 (1)反应热得概念: 当化学反应在一定得温度下进行时,反应所释放或吸收得热量称为该反应在此温度下得热效应,简称反应热。用符号Q表示。 (2)反应热与吸热反应、放热反应得关系。 Q>0时,反应为吸热反应;Q<0时,反应为放热反应。 (3)反应热得测定 测定反应热得仪器为量热计,可测出反应前后溶液温度得变化,根据体系得热容可计算出反应热,计算公式如下: Q=-C(T2-T1) 式中C表示体系得热容,T1、T2分别表示反应前与反应后体系得温度。实验室经常测定中与反应得反应热。 2、化学反应得焓变 (1)反应焓变 物质所具有得能量就是物质固有得性质,可以用称为“焓”得物理量来描述,符号为H,单位为kJ·mol-1。 反应产物得总焓与反应物得总焓之差称为反应焓变,用ΔH表示。 (2)反应焓变ΔH与反应热Q得关系。 对于等压条件下进行得化学反应,若反应中物质得能量变化全部转化为热能,则该反应得反应热等于反应焓变,其数学表达式为:Qp=ΔH=H(反应产物)-H(反应物)。 (3)反应焓变与吸热反应,放热反应得关系: ΔH>0,反应吸收能量,为吸热反应。 ΔH<0,反应释放能量,为放热反应。 (4)反应焓变与热化学方程式: 把一个化学反应中物质得变化与反应焓变同时表示出来得化学方程式称为热化学方程式,如:H2(g)+O2(g)= H2O(l);ΔH(298K)=-285、8kJ·mol-1 书写热化学方程式应注意以下几点: ①化学式后面要注明物质得聚集状态:固态(s)、液态(l)、气态(g)、溶液(aq)。 ②化学方程式后面写上反应焓变ΔH,ΔH得单位就是J·mol-1或 kJ·mol-1,且ΔH后注明反应温度。 ③热化学方程式中物质得系数加倍,ΔH得数值也相应加倍。 3、反应焓变得计算 (1)盖斯定律 对于一个化学反应,无论就是一步完成,还就是分几步完成,其反应焓变一样,这一规律称为盖斯定律。 (2)利用盖斯定律进行反应焓变得计算。 常见题型就是给出几个热化学方程式,合并出题目所求得热化学方程式,根据盖斯定律可知,该方程式得ΔH为 上述各热化学方程式得ΔH得代数与。 (3)根据标准摩尔生成焓,Δf H mθ计算反应焓变ΔH。对任意反应:aA+bB=cC+dD ΔH=[cΔf H mθ(C)+dΔf H mθ(D)]-[aΔf H mθ(A)+bΔf H mθ(B)] 二、电能转化为化学能——电解
选修四《反应热-焓变--热化学方程式》精品习题及答案
反应热焓变热化学方程式精品习题 一、选择题(每小题4分,每小题有1~2个正确选项) 1.下列说法正确的是() A.在化学反应中发生物质变化的同时,不一定发生能量变化 B.ΔH>0表示放热反应,ΔH<0表示吸热反应 C.ΔH的大小与热化学方程式中化学计量数无关 D.生成物释放的总能量大于反应物吸收的总能量时,ΔH<0 2.将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。该现象说明了() A.该反应是吸热反应 B.该反应是放热反应 C.铁粉和硫粉在常温下难以发生反应 D.生成物硫化亚铁的总能量高于反应物铁粉和硫粉的总能量 3.在相同温度和压强下,将等质量的硫分别在足量的纯氧气中、空气中燃烧,设前者放出的热量为Q1,后者放出的热量为Q2,则Q1和Q2相对大小的判断正确的是() A.Q1=Q2B.Q1>Q2 C.Q1 A.铝片与稀盐酸的反应 B.Ba(OH)2·8H2O和NH4Cl的反应 C.灼热的炭与CO2的反应 D.甲烷在氧气中的燃烧反应 6.(2012·江苏江安中学检测)已知反应A+B===C+D为放热反应,对该反应的下列说法中正确的是() A.A的能量一定高于C B.B的能量一定高于D C.A和B的能量总和一定高于C和D的能量总和 D.因该反应为放热反应,故不必加热就可自动进行 7.已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出的热量为Q1。又知胆矾分解的热化学方程式为: CuSO4·5H2O(s)===CuSO4(s)+5H2O(l); ΔH=+Q2kJ·mol-1 则Q1和Q2的关系为() A.Q1 第2课时热化学方程式中和热的测定 一、选择题 1.热化学方程式2H2(g)+O2(g)===2H2O(g)ΔH=-483.6 kJ·mol-1中,化学式前面的化学计量数表示() A.分子数B.体积 C.质量D.物质的量 答案 D 解析热化学方程式与普通化学方程式不同,热化学方程式中化学计量数只表示物质的量,不表示分子个数。 2.热化学方程式C(s)+H2O(g)===CO(g)+H2(g)ΔH=+131.3 kJ·mol-1表示() A.碳和水反应吸收131.3 kJ能量 B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气吸收131.3 kJ热量 C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气吸收131.3 kJ热量 D.1个固态碳原子和1分子水蒸气反应吸热131.3 kJ 答案 C 解析反应热表示按照热化学方程式计量数的物质的量反应时吸收或放出的热量,单位是kJ·mol-1,该热化学方程式表示1 mol固态碳和1 mol 水蒸气反应生成1 mol一氧化碳气体和1 mol氢气吸收131.3 kJ的热量。 3.化学反应N2+3H2===2NH3的能量变化如下图所示,该反应的热化学方程式是() A .N 2(g)+3H 2(g)===2NH 3(l)ΔH =2(a -b -c )kJ·mol -1 B .N 2(g)+3H 2(g)===2NH 3(g)ΔH =2(b -a )kJ·mol -1 C.12N 2(g)+32H 2(g)===NH 3(l)ΔH =(b +c -a )kJ·mol -1 D.12N 2(g)+32H 2(g)===NH 3(g)ΔH =(a +b ) kJ·mol -1 答案 A 解析 由题图可以看出,12 mol N 2(g)+32 mol H 2(g)断裂化学键生成1 mol N 和 3 mol H 吸收的能量为a kJ ,1 mol N +3 mol H 形成1 mol NH 3(g)释放的能量为b kJ , 所以有12N 2(g)+32H 2(g)===NH 3(g) ΔH =(a -b ) kJ·mol -1,而1 mol NH 3(g)转化为1 mol NH 3(l)放出c kJ 的热量,所以有12N 2(g)+32H 2(g)===NH 3(l) ΔH =(a -b -c ) kJ·mol -1,即N 2(g)+3H 2(g)===2NH 3(l) ΔH =2(a -b -c ) kJ·mol -1。 4.下列对H 2(g)+Cl 2(g)===2HCl(g) ΔH (298 K)=-184.6 kJ/mol 的叙述正确的是( ) A .1分子H 2和1分子Cl 2反应,放出热量184.6 kJ B .1 mol H 2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ C .在25 ℃、101 kPa 的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol HCl(g),放出的热量为184.6 kJ D .在25 ℃、101 kPa 的条件下,1 mol H 2(g)和1 mol Cl 2(g)完全反应生成2 mol 这里就是原电池反应常用得 1, 氧化性: F2+H2=== 2HF F2+Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn(表示大部分金属) 2F2 +2H2O===4HF+O2 2F2+2NaOH===2NaF+OF2 +H2OF2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 F2 +Cl2(等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2+H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2+2Na===2NaCl 3Cl2+2Fe===2FeCl3 Cl2 +2FeCl2===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2+2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N 高中化学选修四方程式 非金属单质(F2,Cl2 , O2 , S, N2 , P , C , Si) 1.氧化性: F2 + H2 === 2HF 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+6Na===2Na3N 2.还原性 S+O2===SO2 S+6HNO3(浓)===H2SO4+6NO2+2H2O 3S+4 HNO3(稀)===3SO2+4NO+2H2O N2+O2===2NO 2C+O2(少量)===2CO C+O2(足量)===CO2 C+CO2===2CO C+H2O===CO+H2(生成水煤气) 2C+SiO2===Si+2CO(制得粗硅) Si(粗)+2Cl===SiCl4 (SiCl4+2H2===Si(纯)+4HCl) Si(粉)+O2===SiO2 Si+C===SiC(金刚砂) Si+2NaOH+H2O===Na2SiO3+2H2 3.歧化 Cl2+H2O===HCl+HClO (加酸抑制歧化,加碱或光照促进歧化) Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O 3S+6NaOH===2Na2S+Na2SO3+3H2O 3C+SiO2===SiC+2CO 二,金属单质(Na,Mg,Al,Fe)的还原性 2Na+H2===2NaH 4Na+O2===2Na2O 2Na2O+O2===2Na2O2 2Na+O2===Na2O2 2Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2 2Na+2NH3===2NaNH2+H2 4Na+TiCl4(熔融)===4NaCl+Ti Mg+Cl2===MgCl2 Mg+Br2===MgBr2 2Mg+O2===2MgO Mg+S===MgS Mg+2H2O===Mg(OH)2+H2 2Mg+TiCl4(熔融)===Ti+2MgCl2 2Mg+CO2===2MgO+C 2Mg+SiO2===2MgO+Si Mg+H2S===MgS+H2 Mg+H2SO4===MgSO4+H2 1-1-2 热化学方程式 教学目标 知识与技能: 认识热化学方程式的意义并能正确书写热化学方程式 过程与方法: 通过讨论、分析、对比的方法,培养学生的分析能力和主动探究能力 情感态度与价值观: 培养学生尊重科学、严谨求学、勤于思考的态度,树立透过现象看本质的唯物主义观点 教学重点:热化学方程式的书写 教学难点:热化学方程式的书写 教学过程: 【过渡】通过上一节的学习我们知道化学反应过程中的反应热与断裂反应物中化学键吸收的能量和形成生 成物中化学键放出的能量有关,即能量的变化时以发生变化的物质为基础的,那么如何更准确的表示一个化学反应的热效应?如如何准确地描述物质间的化学反应及其能量变化?下面我们来学习热化学方程式。 【板书】二、热化学方程式(thermochemical equation) 1. 定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。 例:H 2(g)+I 2(g) 2HI(g);△H= -14.9 kJ/mol 【投影】例:H 2(g)+21O 2(g) = H 2O(g);△H=-241.8 kJ/mol ,表示 lmol 气态 H 2和2 1mol 气态 O 2 反应生成 lmol 水蒸气,放出 241.8kJ 的热量。(在 101kPa 和 25℃时) H 2(g)十 21O 2 (g)=H 2O(l);△H=-285.8kJ/mol ,表示lmol 气态H 2与 2 1mo 气态O 2反应在101 kPa 和 25℃时,生成lmol 液态水,放出285.8kJ 的热量。 【小结】描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。 【讲解】热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。那么热化学 方程式的书写有什么要求或者需要注意哪些事项呢? 【板书】2.书写热化学方程式的注意事项: 第一章化学反应与能量 第一节化学反应与能量的变化 (第一课时) 教学目标: 1.知识与技能 ①了解反应热和焓变的含义 ②理解吸热反应和放热反应的实质 2.过程与方法 从化学反应的本质即旧键断裂与新键形成的角度研究反应热产生的原因 3.情感态度与价值观 通过了解简单过程中的能量变化中的热效应 教学重点 理解吸热反应和放热反应的实质 教学难点 能量变化中的热效应 教学用具: 投影仪 学习过程 引言:我们知道:一个化学反应过程中,除了生成了新物质外,还有 思考 (1)你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗? 活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应反应物具有的总能量 > 生成物具有的总能量 (2)你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗? 多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧碳生成一氧化碳 反应物具有的总能量 < 生成物具有的总能量 1:当能量变化以热能的形式表现时: 我们知道:一个化学反应同时遵守质量守恒定律和能量守恒,那么一个反应中的质量与能量有没有关系呢? 有能量的释放或吸收是以发生变化的物质为基础,二者密不可分,但以物质为主。 能量的多少则以反应物和产物的质量为基础。那么化学反应中能量到底怎样变化 2:反应热,焓变 化学反应过程中为什么会有能量的变化?(用学过的知识回答) 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,从新组合成生成物的分子的过程。旧键断裂需要吸收能量,新键形成需要放出能量。而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中会有能量的变化。 反应热焓变 化学反应过程中所释放或吸收的能量,都可以热量(或换算成相应的热量)来表述,叫做反应热,又称为“焓变”。符号:ΔH ,单位:kJ/mol 或kJ?mol-1 ?H为“-”为放热反应,?H为“+”为吸热反应 思考:能量如何转换的?能量从哪里转移到哪里?体系的能量如何变 化?升高是降低?环境的能量如何变 化?升高还是降低?规定放热反应的 ΔH 为“-”,是站在谁的角度?体系还 是环境? 放热反应ΔH为“—”或ΔH〈 0 吸热反应ΔH为“+”或ΔH 〉0 ?H=E(生成物的总能量)- E(反应物的总能量) 化学选修四所有知识点总结 2016-09-25 第1章、化学反应与能量转化 化学反应的实质是反应物化学键的断裂和生成物化学键的形成,化学反应过程中伴随着能量的释放或吸收。 一、化学反应的热效应 1、化学反应的反应热 (1) 反应热的概念: 当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温度下的热效应,简称反应热。用符号Q表示。(2) 反应热与吸热反应、放热反应的关系。 Q> 0时,反应为吸热反应;C K 0时,反应为放热反应。 (3) 反应热的测定 测定反应热的仪器为量热计,可测出反应前后溶液温度的变化,根据体系的热容可计算出反应热,计算公式如下: Q=- CE—T1) 式中C表示体系的热容,T1、T2分别表示反应前和反应后体系的温度。实验室经常测定中和反应的反应热。 2、化学反应的焓变 (1) 反应焓变 物质所具有的能量是物质固有的性质,可以用称为“焓”的物理量来描述,符号为H单位为kJ ?mol-1。 反应产物的总焓与反应物的总焓之差称为反应焓变,用ΔH表示。 (2) 反应焓变ΔH与反应热Q的关系。 对于等压条件下进行的化学反应,若反应中物质的能量变化全部转化为热能,则该反应的反应热等于反应焓变,其数学表达式为:Qp=ΔH= H(反应产物)—H(反应物)。 (3) 反应焓变与吸热反应,放热反应的关系: ΔH> 0,反应吸收能量,为吸热反应。 ΔH< 0,反应释放能量,为放热反应。 (4) 反应焓变与热化学方程式: 把一个化学反应中物质的变化和反应焓变同时表示出来的化学方程式称为热化学方程式,如:H(g) + Q(g)= fθ(l) ; ΔH(298K)=- 285.8kJ ? mol -1 书写热化学方程式应注意以下几点: ①化学式后面要注明物质的聚集状态:固态(S)、液态(I)、气态(g)、溶液(aq)。 ②化学方程式后面写上反应焓变ΔH,ΔH的单位是J ?mol-1或kJ ?mol-1,且ΔH后注明反应温度。 ③热化学方程式中物质的系数加倍,ΔH 的数值也相应加倍。 3、反应焓变的计算 (1) 盖斯定律 对于一个化学反应,无论是一步完成,还是分几步完成,其反应焓变一样,这一规律称为盖斯定律。 (2) 利用盖斯定律进行反应焓变的计算。 常见题型是给出几个热化学方程式,合并出题目所求的热化学方程式,根据盖斯定律可知,该方程式的ΔH为上述各热化学方程式的ΔH的代数和。 (3) 根据标准摩尔生成焓,△ f H mθ计算反应焓变ΔHo 对任意反应:aA+ bB= cC+ dD 精心整理 这里是原电池反应常用的 1,氧化性: F2+H2===2HF F2+Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2+2M===2MFn(表示大部分金属) 2F2+2H2O===4HF+O2 2F2+2NaOH===2NaF+OF2+H2O 3F2( 7F2( S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3N P2+6H2===4PH3 P+3Na===Na3P 2P+3Zn===Zn3P2 2.还原性 S+O2===SO2 S+O2===SO2 S+6HNO3(浓)===H2SO4+6NO2+2H2O C+O2( Si(粗 Si(粉 3 3S+6NaOH===2Na2S+Na2SO3+3H2O 4P+3KOH(浓)+3H2O===PH3+3KH2PO2 11P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO 3C+SiO2===SiC+2CO 二,金属单质(Na,Mg,Al,Fe)的还原性 2Na+H2===2NaH 4Na+O2===2Na2O 2Na2O+O2===2Na2O2 2Na+O2===Na2O2 2Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2 2Na+2NH3===2NaNH2+H2 4Na+TiCl4(熔融)===4NaCl+Ti Mg+Cl2===MgCl2 Mg+Br2===MgBr2 2Mg+O2===2MgO Mg+S===MgS 2 (Al,Fe 3Fe+4H2O(g)===Fe3O4+4H2 Fe+2HCl===FeCl2+H2 Fe+CuCl2===FeCl2+Cu Fe+SnCl4===FeCl2+SnCl2 (铁在酸性环境下,不能把四氯化锡完全 还原为单质锡Fe+SnCl2==FeCl2+Sn) 三,非金属氢化物(HF,HCl,H2O,H2S,NH3) 1,还原性: 4HCl(浓)+MnO2===MnCl2+Cl2+2H2O高一化学选修4热化学方程式中和热的测定
化学选修四化学方程式
高中化学选修四方程式
人教版高中化学选修四 1-1-2 热化学方程式(教案)
高中化学人教版选修4教案
化学选修四所有知识点总结
化学选修四化学方程式
