溶液浓度及温度对电沉积效果的影响

溶液浓度及温度对电沉积效果的影响1
孙达,储洪强,赵明,张洪智,苗成祥,蒋林华
河海大学材料科学与工程系(210098)
E-mail(sunda0315@https://www.360docs.net/doc/0d1042219.html,)
摘要:就电沉积方法修复混凝土裂缝中溶液浓度及温度对电沉积效果的影响进行了试验研究,测定了电沉积过程中的试件质量增加率、表面覆盖率、裂缝愈合率及20d后裂缝填充深度,比较了不同温度下砂浆试件距沉积面5mm处的总孔体积,结果表明:表面覆盖率、裂缝愈合率随电沉积溶液浓度的增大而降低,而20d后裂缝填充深度随浓度的增大而升高,质量增加率随浓度的变化无明显的规律;表面覆盖率随温度的升高而降低,裂缝愈合率随温度升高而升高,质量增加率随温度的变化无明显的规律,温度对20d后裂缝填充深度影响不大,30℃时总孔体积最大。
关键词:电沉积溶液浓度温度电沉积效果
1. 引言
电沉积方法是修复钢筋混凝土结构裂缝的一项新技术,日本自80年代后期开始电沉积技术修复海工混凝土结构裂缝的研究,以带裂缝的海工混凝土结构中的钢筋为阴极,同时在海水中放置难溶性阳极,两者之间施加弱电流,在电位差的作用下正负离子分别向两极移动,并发生一系列的反应,最后在海工混凝土结构的表面和裂缝里生成沉积物,覆盖混凝土表面,愈合混凝土裂缝。这些沉积物不仅为混凝土提供了物理保护层,而且也在一定程度上阻止各种有害物质侵蚀混凝土。根据这一原理日本、美国近年来对电沉积方法修复陆上混凝土裂缝的可行性及经电沉积方法修复后具有干缩裂缝混凝土性能的影响进行了初步研究[1-3],国内对该项技术的研究才刚刚起步。研究表明[4-5]:辅助电极、电极距离、混凝土参数等因素均对电沉积效果均有影响,而溶液浓度及温度对电沉积效果的影响尚不清楚,所以本文就电沉积方法修复混凝土裂缝中溶液浓度与温度对电沉积效果的影响进行了试验研究。
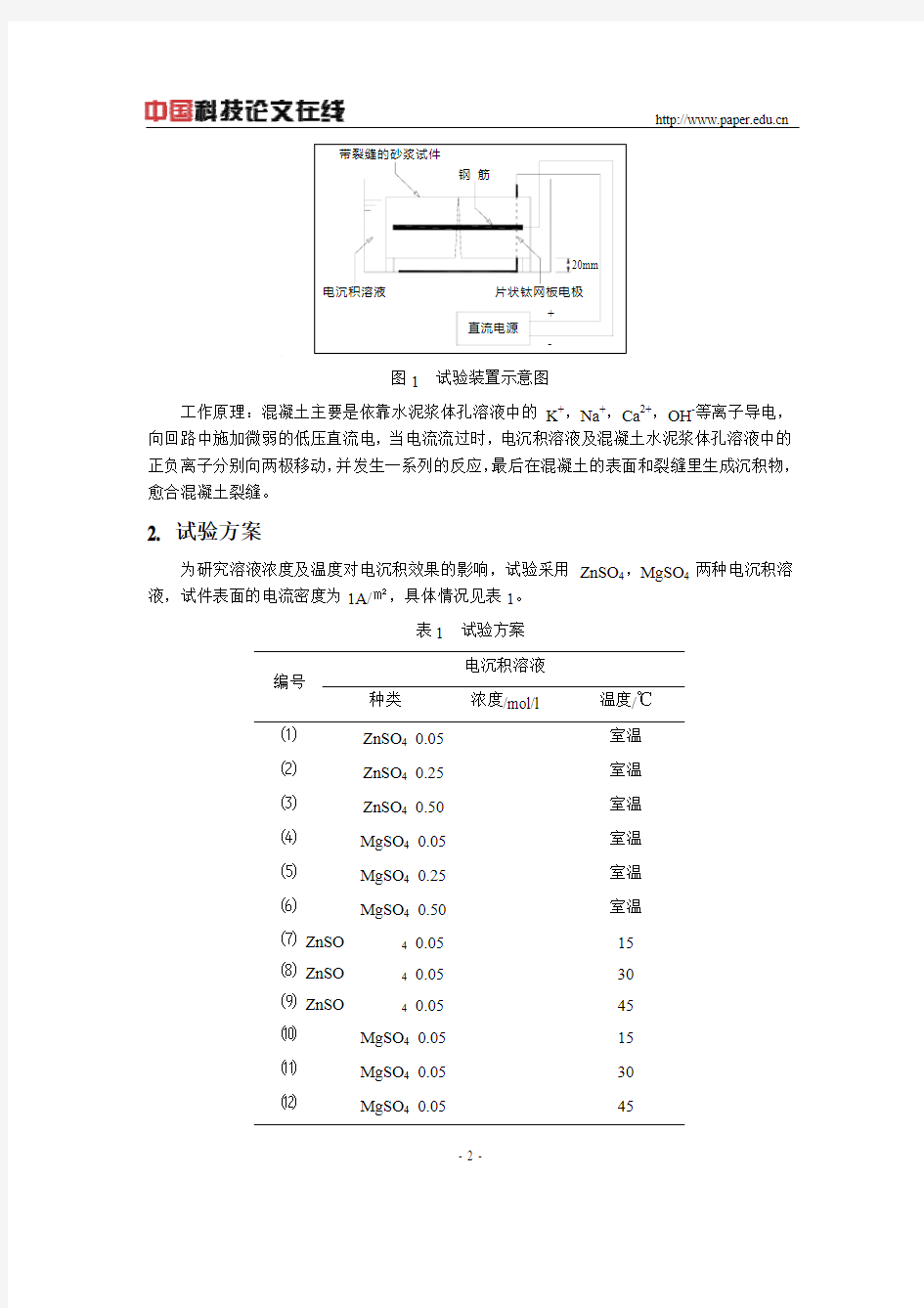
2. 试验装置及工作原理
将带有裂缝的水泥砂浆试件放入电解槽中,试件中预先埋入钢筋并引出导线,该导线与电源的负极相连作为阴极,同时将片状钛网板放入电解槽底部,并与电源的正极相连作为阳极,然后注入电沉积溶液。这样水泥砂浆试件、电沉积溶液、辅助电极、导线、电源就构成一个回路,如图1所示。裂缝所在面朝下与钛网板电极相对,以直接形成电场。
1本课题得到高等学校博士学科点专项科研基金(项目编号:20020294012)资助。
- 1 -
图1 试验装置示意图
工作原理:混凝土主要是依靠水泥浆体孔溶液中的K+,Na+,Ca2+,OH-等离子导电,向回路中施加微弱的低压直流电,当电流流过时,电沉积溶液及混凝土水泥浆体孔溶液中的正负离子分别向两极移动,并发生一系列的反应,最后在混凝土的表面和裂缝里生成沉积物,愈合混凝土裂缝。
2. 试验方案
为研究溶液浓度及温度对电沉积效果的影响,试验采用ZnSO4,MgSO4两种电沉积溶液,试件表面的电流密度为1A/㎡,具体情况见表1。
表1 试验方案
电沉积溶液
编号
种类浓度/mol/l 温度/℃
⑴ZnSO4 0.05 室温
⑵ZnSO4 0.25 室温
⑶ZnSO4 0.50 室温
⑷MgSO4 0.05 室温
⑸MgSO4 0.25 室温
⑹MgSO4 0.50 室温
⑺ ZnSO4 0.05 15
⑻ ZnSO4 0.05 30
⑼ ZnSO4 0.05 45
⑽MgSO4 0.05 15
⑾MgSO4 0.05 30
⑿MgSO4 0.05 45
- 2 -
每组3个试件,用于本次试验的试件共有36个;每5d更换一次溶液,以使溶液的浓度基本保持恒定,试验持续20d。
3. 试件制作
试验采用水泥砂浆试件,尺寸40mm×40mm×160mm,水泥为32.5级普通硅酸盐水泥,水灰比0.60,胶砂比1∶2.5,钢筋ф6mm,预先埋置于砂浆试件中,保护层厚度(钢筋外边缘与裂缝所在面之间的距离)15mm。试件在标准条件下养护28d后,在NYL-600型压力试验机下施加横向劈裂荷载,则在其纵向中部位置附近产生贯穿裂缝,缝宽0.3mm±0.05mm。为保证沉积物只在裂缝所在面生成,在其他面上均涂上硅橡胶。试件表面(本文指裂缝所在面)及裂缝的情况见图2。
图2 试件表面及裂缝情况
4. 试验过程与结果分析
接通电路后,在砂浆试件与辅助电极的表面立即产生气泡,5d后0.5mol/LZnSO4溶液中3个试件裂缝处出现灰色沉积物,表面为白色物质(见图3),其余试件的表面及裂缝处均出现白色沉积物;10d后这3个试件表面同时出现灰色物质(见图4),20d后将试件沿着裂缝横向切开可以发现这3个试件裂缝里却是白色沉积物。
图3 5d后试件表面及裂缝的沉积情况
图4 10d后试件表面及裂缝的沉积情况
4.1 质量增加率
每隔5d取出试件放入温度20℃±2℃,相对湿度60%±5%的恒温室内,待24h后称其质量,试件质量增加率按式⑴计算,其随时间的变化曲线见图5。
- 3 -
- 4 -
%100m ×=
M
M R i
⑴ 式中:R m ——试件质量增加率,‰;
M i ——试件质量增加量,g ; M ——试件沉积前质量,g 。
(a )不同浓度(ZnSO 4溶液) (b )不同浓度(MgSO 4溶液)
(c )不同温度(ZnSO 4溶液) (d )不同温度(MgSO 4溶液)
图5 质量增加率随时间的变化曲线
4.2 试件表面覆盖率
每隔5d 待称完质量后,对每个试件拍摄数码照片,试件表面覆盖率按式⑵计算。
%100×=
A
A R c
a ⑵ 式中:R a ——试件表面覆盖率,%;
A c ——试件表面被沉积物覆盖的面积,mm 2; A ——试件表面总面积,mm 2。
- 5 -
采用二值化图像分割与统计软件等对图形进行处理,由于灰色物质仍是沉积物,所以测量表面覆盖率时应计算在内。试件表面覆盖率随时间的变化曲线见图6。
(a )不同浓度(ZnSO 4溶液) (b )不同浓度(MgSO 4溶液)
(c )不同温度(ZnSO 4溶液) (d )不同温度(MgSO 4溶液)
图6 表面覆盖率随时间的变化曲线
4.3 裂缝愈合率
裂缝愈合率按下式计算,采用MapInfo 系统测出同一比例下未愈合裂缝的长度及裂缝总长度,裂缝愈合率按式⑶计算。裂缝愈合率随时间的变化见图7。
%100×=L
L R c
l ⑶ 式中:R l ——裂缝愈合率,%;
L c ——愈合裂缝长度,mm ; L ——裂缝总长度,mm 。
(a)不同浓度(ZnSO4溶液)(b)不同浓度(MgSO4溶液)
(c)不同温度(ZnSO4溶液)(d)不同温度(MgSO4溶液)
图7 裂缝愈合率随时间的变化曲线
4.4 裂缝填充深度
20d后将试件沿着裂缝横向切开,等间距选取10个点,然后用游标卡尺量取每个点的填充深度,再求均值。裂缝填充深度随电沉积溶液浓度及温度变化情况见图8。
图8 裂缝填充深度随电沉积溶液浓度及温度变化情况
- 6 -
4.5 结果分析
研究表明[4],当采用ZnSO4电沉积溶液时,试件表面和裂缝处的白色沉积物主要矿物成分为ZnO,而灰色沉积物的主要矿物成分为3Zn(OH)2·ZnSO4·5H2O,两者相比,灰色沉积物颗粒较大,排列疏松,而且颗粒中存在较多孔隙,其对带有裂缝的混凝土结构抗渗、抗碳化等耐久性能的提高效果应该不如白色沉积物。
由图5,6,7,8可知,试件表面覆盖率、裂缝愈合率随电沉积溶液浓度的增大而降低,而20d后裂缝填充深度随浓度的增大而升高,质量增加率随浓度的变化无明显的规律,原因可能是由于更多的离子在裂缝内部结合生成沉积物,而试件表面及裂缝处沉积物的量相应减少。试件表面覆盖率随温度的升高而降低,裂缝愈合率随温度升高而升高,原因可能是存在两种作用影响沉积物的生成速度,一种是电沉积温度升高加速沉积物的生成;另一种是由于电沉积温度升高使某一部位瞬间有较多的物质同时结晶沉淀下来,还加快水泥的水化,使砂浆试件更密实,从而增加了OH-的从试件内部析出的阻力,这种作用降低了沉积物的生成速度;在试件表面由于面积相对较大,使后一种作用在沉积过程中占主导地位,而裂缝内部横断面相对较小,导致前一种作用在沉积过程中很明显,所以试件表面覆盖率随温度的升高而降低,裂缝愈合率随温度升高而升高;质量增加率随温度的变化无明显的规律,温度对20d 后裂缝填充深度影响不大。
采用COULTER SA3100比表面积和孔径分析仪对用于研究温度对电沉积效果影响的每个试件在距沉积面5mm处取样分析,得出总孔体积(BJH Total)分别为:59.13×10-3ml/g (15℃),66.49×10-3ml/g(30℃)和42.80×10-3ml/g(45℃),可得30℃时总孔体积最大,原因可能是在电沉积过程中,对砂浆试件孔结构有影响的主要有两个作用:未水化的水泥颗粒继续水化及沉积物填充试件内部孔隙,其中水化随温度的升高而加快,即在微小变化过程中,水泥石内的毛细孔体系可视为一封闭体系,这样由热力学定律得出:dG=-SdT,式中dG 为自由能微小变化,S为熵,dT为温度微差,而试件为一实心体,内外存在着温度差,小孔中水分子的熵比大孔中的大,获得的自由能大,由上式可知这样增加了体系中的自由能差,增加了水分子的活性,加速了水泥水化硬化,从而降低了砂浆试件内部的孔体积;另外沉积物生成速度随温度的升高而加快,由于在某一部位迅速集中使得沉积物填充孔隙的效果反而降低;所以在上述两种互斥作用的共同影响下,导致30℃时总孔体积最大。
5. 结论
a.试件表面覆盖率、裂缝愈合率随电沉积浓度的增大而降低,20d后裂缝填充深度随电沉积浓度的增大而升高。
b.试件表面覆盖率随温度的升高而降低,裂缝愈合率随温度升高而升高,温度对20d 后裂缝填充深度影响不大。
c.试件质量增加率随浓度、温度的变化无明显的规律。
- 7 -
参考文献
[1] Otsuki,N.,Hisada,M.,Ryu,J.S.,etal. Rehabilition of concrete cracks by electrodeposition[J].Concrete
International,1999,21(3):58-63.
[2] Otsuki,N. and Ryu,https://www.360docs.net/doc/0d1042219.html,e of electrodeposition for repair of concrete with shrinkage cracks[J].Materials in
Civil Engineering,2001,13(2):136-142.
[3] Ryu,J.S. and Otsuki,N..Crack closure of reinforced concrete by electrodeposition technique[J].Cement and
Concrete Research,2002,32(1):159-164.
[4] 储洪强,蒋林华.辅助电极及电极距离对沉积效果的影响.中国科技论文在线
[EB/OL].http;https://www.360docs.net/doc/0d1042219.html,,2004.7.27
[5] 蒋林华,储洪强.混凝土技术参数对沉积效果的影响[J].水利水电科技进展,2005,25(2):23-25
Influence of Concentration and Temperature of Electrolyte Solution on Electrodeposition Effect
Da Sun HongQiang Chu Ming Zhao HongZhi Zhang
ChengXiang Miao LinHua Jiang
(Department of materials science and engineering, Hohai University, Nanjing, PRC, 210098)
Abstract
The influence of concentration and temperature of electrolyte solution on electrodeposition effect was investigated, four parameters such as rate of weight gain,surface coating ,crack closure and filling depth of crack were measured, and the total pore volume was compared between different temperature at the point which is 5mm away from the electrodeposition surface. Results showed that rate of surface coating and crack closure decrease, while rate of filling depth of crack increases as concentration of electrolyte solution increases, and the regularity of weight gain versus concentration of electrolyte solution is not evident. Rate of surface coating decreases, while rate of crack closure increases as temperature of electrolyte solution increases, rate of weight gain doesn’t vary with crack width regularly, influence of temperature of electrolyte solution on electrodeposition effect is very small, and the total pore volume at 30℃is the biggest.
Keywords:Electrolyte solution; concentration of electrolyte solution; temperature of electrolyte solution; electrodeposition effect
- 8 -
电位差计的原理和使用
实验八 电位差计的原理和使用 【实验目的】 1.掌握电位差计的工作原理和正确使用方法,加深对补偿法测量原理的理解和运用。 2.训练简单测量电路的设计和测量条件的选择。 【实验仪器】 UJ31型直流电位差计、SS1791双路输出直流稳压电源、标准电池、标准电阻、AC15/5灵敏电流计、FJ31型直流分压箱、滑线变阻器、直流电阻箱、待校验电表、待测干电池、待测电阻、开关和导线等。 【实验原理】 如图5.8.1所示,电位差计的工作原理是根据电 压补偿法,先使标准电池E n 与测量电路中的精密电阻R n 的两端电势差U st 相比较,再使被测电势差(或电压)E x 与准确可变的电势差U x 相比较,通过检流计G 两次指零来获得测量结果。电压补偿原理也可从电势差计的“校准”和“测量”两个步骤中理解。 校准:将K 2打向“标准”位置,检流计和校准电路联接,R n 取一预定值,其大小由标准电池E S 的电动势确定;把K 1合上,调节R P ,使检流计G 指零,即E n = IR n ,此时测量电路的工作电流已调好为 I = E n /R n 。校准工作电流的目的:使测量电路中的R x 流过一个已知的标准电流I o ,以保证R x 电阻盘上的电压示值(刻度值)与其(精密电阻R x 上的)实际电压值相一致。 测量:将K 2打向“未知”位置,检流计和被测电路联接,保持I o 不变(即R P 不变),K 1合上,调节R x ,使检流计G 指零,即有E x = U x = I o R x 。 由此可得x n n x R R E E = 。由于箱式电位差计面板上的测量盘是根据R x 电阻值标出其对应的电压刻度值,因此只要读出R x 电阻盘刻度的电压读数,即为被测电动势E x 的测量值。 所以,电位差计使用时,一定要先“校准”,后“测量”,两者不能倒置。 【实验装置】 1. UJ31型电位差计 UJ31型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或mV V 17110-μ(1K 置10?档)。使用 图5.8.1 电位差计的工作原理 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
电极电势变化对电极反应速率的影响
电极电势变化对电极反应速率的影响 电极上电势变化是怎样影响反应速率的?布特勒尔(Butler)和伏尔默(Volmer)假 设得电子或失电子的步骤均为基元步骤,并应用化学动力学中的过渡态理论导出了电极过程动力学的基本方程-"布特勒尔-伏尔默方程"-以说明这一问题。布特勒尔-伏尔默提出的模型简单,能说明一些实验规律,为一重要关系式。但分析问 题时仅从能量观点出发,没有虑及可能存在的过程细节,故有一定的局限性。 在化学动力学中,反应速率r与反应速度常数k以及反应级数n之间有如下关系: 对于以下电极基元反应,在不考虑电子的作用时,反应为一级的: 由活化络合物理论可知,反应速率常数取决于反应物通过势垒的频率以及反应的活化焓(),即 而电极反应速率r与电流密度i之间满足下式: 将上式联系起来: 在一定温度下为一常数。式(11-72)表述了电极反应在无外加电场影响(即电极表面不带电荷)时的反应速率(以电流密度表示)。在这种条件下进行的反应为纯化学反应,而非电极反应,其速率常数以k区别之。 事实上,电极上同时进行着还原反应和氧化反应:
若以分别表示还原电流密度和氧化电流密度,而c1和c2分别表示氧化态物质和还原物质浓度,其对应的常数分别为k0,1和k0,2,则: 在加上外加电压条件下,例如,在阴极加上一电势φi(φi为负值),则额外能量为,这一能量中,将有一部分用于加速还原反应而另一部分用于减慢氧化反应的进行。设作用于还原部分为a,而作用于氧化反应为(1-a),a称为对称因子(Symmetry factor)。由动力学观点,这相当于使还原反应的活化焓由变为,因为φi为负电势,实质上相当于使其势垒降低,反应加速。而氧化反应的活化焓则由变为,相当于使其势垒提高,反应减慢(参考图)。而还原电流密度和氧化电流密度分别可表示为:
多孔阳极氧化铝为模板电沉积制备纳米线的研究进展_倪似愚
多孔阳极氧化铝为模板电沉积制备 纳米线的研究进展 倪似愚1郑国渠2曹华珍2郑华均2张九渊2 (1.中国科学院上海硅酸盐研究所,上海200050;2.浙江工业大学材料科学与工程研究所,浙江杭州310032) 摘要:多孔阳极氧化铝为模板制备纳米结构材料具有独特的优越性,颇受人们的关注,近年来获得了深入的研究.介绍了以多孔阳极氧化铝为模板采用电化学沉积方法制备各种有序纳米线阵列结构材料的最新研究进展,其中包括多孔氧化铝模板的制备和电沉积制备纳米材料的工艺及方法,同时展望了纳米线作为功能材料的应用前景. 关键词:金属材料;模板;多孔氧化铝;纳米线;电沉积 中图分类号:TG174.451文献标识码:A文章编号:1001-7119(2003)06-0466-04 Research development of nano-wires fabrication by electrochemical deposition into porous anodic alumina NI Si-yu1Z HE NG Guo-qu2C AO Hua-zheng2Z HE NG Hua-jun2Z HANG Jiu-yuan2 (1.Shanghai Ins ti tute of Ceramics,Chanese Acade my of Sciences,Shanghai200050,China; 2.Ins ti tute of Material Science and Engineering,Zhejiang Uni versity of Technology,Hangz hou310032,China) Abstract:Alumina template-synthesized nanostructured mater ial has uniq ue property,which is very attractive and has been re-searched deeply in recent years.In this paper,the latest research progress in the fabrication of various ordeded nano-wire arrays materials by electrodeposi ting into template-porous anodic aluminum,includi ng the preparation of alumina-template,electrochemical technology process and methods,is reviewed.the application prospects of nano-wire for functional materials are also discussed. Key words:metal material;template;porous alu mina;nano-wire;electrodeposition 0前言 自1970年G.E.Possin首次提出利用多孔膜作为模板制备纳米纤维材料以来[1],利用模板法已制备了一系列的纳米结构材料.由于模板合成法制备纳米结构材料具有独特的优点[2]而引起了凝聚态物理界、化学界及材料科学界科学家们的关注,近年来成为纳米材料研究的一个热点.用作模板的材料主要有两种:一种是径迹蚀刻(track-etch)聚合物膜;另一种是多孔阳极氧化铝膜.相对于聚合物模板,氧化铝模板具有较好的化学稳定性、热稳定性和绝缘性,且采用阳极氧化法生长的有序纳米多孔氧化铝膜制备纳米材料,方法简单、可行性强.当然,模板在制备过程中仅起到模具作用,纳米材料仍然要利用常规的化学反应来制备,如电化学沉积[3,4]、化学镀[5]、溶胶-凝胶沉积[6]、化学气相沉积法[7]等.电化学沉积作为一种传统的材料制备方法,其优点是显而易见的:1工艺简单,技术灵活,容易控制金属离子的沉积量,便于实现工业化生 Vol.19No.6 Nov.2003 科技通报 B ULLETIN OF SCIENCE AND TE C HNOLOGY 第19卷第6期 2003年11月 收稿日期:2002-11-11 基金项目:浙江省自然科学基金资助项目(501071) 作者简介:倪似愚,女,1976年生,安徽淮南人,博士研究生.
(浓度和温度对化学平衡的影响)
(浓度和温度对化学平衡的影响)
魏县第五中学王校磊 浓度对化学平衡的影响 【教学背景】 新课程改革要求教师的教育观念、教育方式、教学行为等都要发生很大的转变,使学生由以前的“学会”到“想学”再到“会学”,“引导--探究”式教学法就是在这种理念下应运而生的,该教学法以解决问题为中心,注重学生的独立钻研,着眼于创造思维能力的培养,充分发挥学生的主动性和创造性。它不仅重视知识的获取,而且更重视学生获取知识的过程及方法,更加突出地培养学生的学习能力,在问题的推动下、在教师的引导下,学生学得主动,学得积极,真正体现了“教为主导,学为主体”的思想。依据上述新课程理念,本人在本学期教研活动中尝试着用“引导---探究”式教学法讲了《浓度对化学平衡的影响》。【案例】 一、课前活动: (一)、分析教材:本节的教学内容是高中新课改选修4教材《化学平衡的移动》中的一部分。化学平衡是中学化学的重要理论之一,是中学化学中所涉及的溶解平衡、电离平衡、水解平衡等知识的中心,对很多知识的学习起到指导作用。本节在掌握化学平衡的建立和平衡状态的特征的基础上通过实验探究浓度和温度对化学平衡的影响,为下节归纳总结出化学平衡移动原理(勒夏特列原理)奠定基础。而化学平衡移动原理(勒夏特列原理)对解决化工生产中存在的实际问题具有重要意义。
(二)、分析学生 在《化学平衡》的第一课时的教学中学生已经掌握了可逆过程(反应)及其特征,了解任何可逆过程在一定条件下都是有限度的,并在此基础上掌握了溶解平衡和化学平衡状态的建立及特征,对化学平衡是动态平衡以有正确认识——化学平衡是建立在一定条件下的,当条件改变是平衡也将发生变化。在此基础上学习外界条件对化学平衡的影响时机成熟,但结合本班学生(理科普通班)的实际情况和《外界条件对平衡影响》内容的知识量本节学习其中浓度对化学平衡的影响。(三)、教学目标 1、知识与能力:通过学习使学生掌握浓度对化学平衡影响的规律;通过浓度的改变对正、逆反应速率的影响的分析使学生理解浓度对化学平衡影响的原因。 2、过程与方法:先利用已掌握浓度对化学反应速率的影响规律对本节教材设定的实验进行分析并提出问题引导学生对可能会出现的实验现象进行科学猜想,再通过学生分组实验让学生去验证科学猜想是否成立,从而得到浓度的改变对化学平衡影响的规律,然后通过对速率-时间的图象分析使学生理解平衡移动具体原因,最后可以联系实际生产让学生理解学习该理论的意义,使学生了解理论学习对生产实际有指导作用。 3、情感态度与价值观:培养学生分析问题和解决问题的能力,使学生在应用化学理论解决一些相应的化工问题的同时,体会化学理论学习的重要性。(四)、教学重点及难点 教学重点:浓度对化学平衡的影响 教学难点:浓度改变引起平衡移动的原因 (五)、确定教学思路
电极电势
电极电势 一,电极电势(electrode potential)的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double layer theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 2.标准电极电势 为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势, 而确定各种不同电极的相对电极电势E值。1953年国际纯粹化学与应用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。 (1)标准氢电极电极符号: Pt|H2(101.3kPa)|H+(1mol.L-1) 电极反应: 2H+ + 2e = H2(g) E?H+/ H2 = 0 V 右上角的符号“?”代表标准态。 标准态要求电极处于标准压力(100kPa或1bar)下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为100kPa;组成电对的有关离子(包括参与反应的介质)的浓度为1mol.L-1(严格的概念是活度)。通常测定的温度为298K。 (2) 标准电极电势:用标准氢电极和待测电极在标准状态下组成电池,测得该电池的电动势值,并通过直流电压表确定电池的正负极,即可根据E池 = E (+)- E(-)计算各种电极的标准电极电势的相对数值。 例如在298k,用电位计测得标准氢电极和标准Zn电极所组成的原电池的电动势(E池)为0.76v,根据上式计算Zn2+/Zn电对的标准电极为-0.76v。用同样的办法可测得Cu2+/Cu电对的电极电势为+0.34v。 电极的 E?为正值表示组成电极的氧化型物质,得电子的倾向大于标准氢电极中的H+,如铜电极中的 Cu2+;如电极的为负值,则组成电极的氧化型物质得电子的倾向小于标准氢电极中的H+,如锌电极中的Zn2+。 实际应用中,常选用一些电极电势较稳定电极如饱和甘汞电极和银-氯化银电极作为参比电极和其它待测电极构成电池,求得其它电极的电势。饱和甘汞电极的电极电势为0.24V。银-氯化银电极的电极电势为0.22V。 3. 标准电极电势表
实验五氧化还原反应与电极电势(精)
实验五氧化还原反应与电极电势 一、实验目的 1、掌握电极电势对氧化还原反应的影响。 2、定性观察浓度、酸度对电极电势的影响。 3、定性观察浓度、酸度、温度、催化剂对氧化还原反应的方向、产物、速度的影响。 4、通过实验了解原电池的装置。 二、实验原理 氧化剂和还原剂的氧化、还原能力强弱,可根据她们的电极电势的相对大小来衡量。电极电势的值越大,则氧化态的氧化能力越强,其氧化态物质是较强氧化剂。电极电势的值越小,则还原态的还原能力越强,其还原态物质是较强还原剂。只有较强的氧化剂才能和较强还原剂反应。即φ氧化剂-φ还原剂﹥0时,氧化还原反应可以正方向进行。故根据电极电势可以判断氧化还原反应的方向。 利用氧化还原反应而产生电流的装置,称原电池。原电池的电动势等于正、负两极的电极电势之差:E = φ正-φ负。根据能斯特方程: 其中[氧化型]/[还原型]表示氧化态一边各物质浓度幂次方的乘积与还原态一边各物质浓度幂次方乘积之比。所以氧化型或还原型的浓度、酸度改变时,则电极电势φ值必定发生改变,从而引起电动势E将发生改变。准确测定电动势是用对消法在电位计上进行的。本实验只是为了定性进行比较,所以采用伏特计。浓度及酸度对电极电势的影响,可能导致氧化还原反应方向的改变,也可以影响氧化还原反应的产物。 三、仪器和药品 仪器:试管,烧杯,伏特计,表面皿,U形管 药品:2 mol·L-1 HCl,浓HNO3, 1mol·L-1 HNO3,3mol·L-1HAc,1mol·L-1 H2SO4,3mol·L-1 H2SO4,0.1mol·L-1 H2C2O4,浓NH3·H2O(2mol·L-1),6mol·L- 1NaOH,40%NaOH。 1mol·L-1 ZnSO4,1mol·L-1 CuSO4,0.1mol·L-1KI,0.1mol·L-
多孔阳极氧化铝为模板电沉积制备纳米线的研究进展解析
Vol.19No.6Nov.2003 科技通报 BULLETINOFSCIENCEANDTECHNOLOGY 第19卷第6期 2003年11月 多孔阳极氧化铝为模板电沉积制备 纳米线的研究进展 倪似愚郑国渠曹华珍郑华均 1 2 2 2 2 (1.中国科学院上海硅酸盐研究所,上海200050;2.浙江工业大学材料科学与工程研究所,浙江310032) 摘要:,究.,其景. 关键词:金属材料;;电沉积 451:A文章编号:1001-7119(2003)06-0466-04 Researchdevelopmentofnano2wiresfabricationbyelectrochemical depositionintoporousanodicalumina NISi2yu ZHENGGuo2qu CAOHua2zheng ZHENGHua2jun ZHANGJiu2yuan (1.ShanghaiInstituteofCeramics,ChaneseAcademyofSciences,Shanghai200050,China; 2.InstituteofMaterialScienceandEngineering,ZhejiangUniversityofTechnology,Hangzho u310032,China) 2 2 2 2 Abstract:Aluminatemplate2synthesizednanostructuredmaterialhasuniqueproperty,which isveryattractiveandhasbeenre2searcheddeeplyinrecentyears.Inthispaper,thelatestresearch progressinthefabricationofvariousordedednano2wirearraysmaterialsbyelectrodepositingi ntotemplate2porousanodicaluminum,includingthepreparationofalumina2template,electr ochemicaltechnologyprocessandmethods,isreviewed.theapplicationprospectsofnano2wir
第二节 电极电势
2-1 第二节 电极电势 知识要点 一、电极电势和电池电动势 1. 电极电势 (金属-金属离子电极) 在铜锌原电池中,为什么电子从Zn 原子转移给Cu 2+ 离子而不是从Cu 原子转移给Zn 2+ 离子? 这与金属在溶液中的情况有关,一方面金属M 表面构成晶格的金属离子和极性大的水分子互相吸引,有一种使金属棒上留下电子而自身以水合离子M n + (aq)的形式进入溶液的倾向,金属越活泼,溶液 越稀,这种倾向越大,另一方面,盐溶液中的M n + (aq) 离子又有一种从金属M 表面获得电子而沉积在金属表面上的倾向,金属越不活泼,溶液越浓,这种倾向越大.这两种对立着的倾向在某种条件下达到暂时的平衡: M n + (aq)+ne - M 在某一给定浓度的溶液中,若失去电子的倾向大于获得电子的倾向,到达平衡时的最后结果将是金属离子M n + 进入溶液,使金属棒 上带负电,靠近金属棒附近的溶液带正电,如右图所示,这时在金属和 盐溶液之间产生电位差,这种产生在金属定于温度. 在铜锌原电池中,Zn 片与Cu 片分别插在它们各自的盐溶液中,构成Zn 2+ /Zn 电极与Cu 2+ /Cu 电 极.实验告诉我们,如将两电极连以导线,电子流将由锌电极流向铜电极,这说明Zn 片上留下的电子要比Cu 片上多,也就是Zn 2+ /Zn 电极的上述平衡比 Cu 2+/Cu 电极的平衡更偏于右方,或Zn 2+ /Zn 电对与Cu 2+ /Cu 电对两者具有不同的电极电势,Zn 2+ /Zn 电对的电极电势比Cu 2+ /Cu 电对要负一些.由于两极电势不同,连以导线,电子流(或电流)得以通过. 2. 原电池的电动势 电极电势 φ表示电极中极板与溶液之间的电势差.当用盐桥将两个电极的溶液连通时,若认为两溶液之间等电势,则两极板之间的电势差即两电极的电极电势之差,就是电池的电动势.用 E 表示电动势,则有E =φ+ -φ- 若两电极的各物质均处于标准状态,则其电动势为电池的标准电动势,E ○— =φ ○— (+) -φ ○— (-) 电池中电极电势 φ大的电极为正极,故电池的电动势 E 的值为正.有时计算的结果 E 为负值,这说明计算之前对于正负极的判断有误.E > 0 是氧化还原反应可以自发进行的判据. 3. 标准氢电极 (气体 - 离子电极) 电极电势的绝对值无法测量,只能选定某种电极作为标准,其他电极与之比较,求得电极电势的相对值,通常选定的是标准氢电极. 标准氢电极是这样构成的:将镀有铂黑的铂片置于H +浓度(严格的说应为活度a )为 1.0mol·kg -1 的硫酸溶液(近似为 1.0mol·dm - 3)中,如右图.然后不断地通入压力为1.013×105Pa 的纯H 2,使铂黑吸附H 2达到饱和,形成一个氢电极.在这个电极的周围发生了如下的平衡: 2H + +2e - H 2 氢电极属于气体 -离子电极.标准氢电极作为负极时,可以表示为 Pt | H 2(1.013×105Pa) | H +(1mol·dm - 3) 这时产生在标准氢电极和硫酸溶液之间的电势,叫做氢的标准电极电势,将它作为电极电势的相对标准,令其为零.在任何温度下都规定标准氢电极的电极电势为零(实际上电极电势同温度有关).所以很难制得上述那种标准氢电极,它只是一种理想电极. 用标准氢电极与其他各种标准状态下的电极组成原电池,测得这些电池的电动势,从而计算各种电极的标准电极电势,通常测定时的温度为298K.所谓标准状态是指组成电极的离子其浓度为1mol·dm - 3(对于氧化还原电极来讲,为氧化型离 子和还原型离子浓度比为1),气体的分压为1.013×105Pa,液体或固体都是纯净物质.标准电极电势用符号φ○— 表示. 例如:标准氢电极与标准铜电极组成的电池,用电池符号表示为 (-)Pt | H 2(p ○— ) | H +(1mol·dm - 3)‖Cu 2+(1mol·dm - 3) | Cu(+) 在298K,用电位计测得该电池的电动势E ○— = 0.34V E ○— =φ○— (+) -φ○— (-),得φ○— (+) = E ○— +φ○— (-), 故φ○— ( Cu 2+/Cu)= E ○— +φ○— (H +/H 2)
温度对化学平衡的影响
温度对化学平衡的影响 班级姓名学号 一、选择题 1.设C + CO22CO△H>0,反应速率为v1;N2 + 3H22NH3△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为 A.同时增大B.同时减小C.v1增大,v2减小D.v1减小,v2增大 2.一定温度下,某密闭容器里发生如下可逆反应: CO(g) + H2O(g) CO2(g) + H2(g)△H>0,当反应达到平衡时,测得容器中各物质均为n mol.欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施中可采用的是 A.升高温度B.增大压强 C.再通入n mol CO和n mol H2O(g)D.再通入n mol CO和2n mol H2O(g) 3.某温度时有以下反应:S2Cl2(l、无色)+Cl2(g)2SCl2(l、红色)△H<0,在密闭容器中达到平衡,下列说法不正确的是 A.升高温度,而压强不变,液体颜色变浅 B.温度不变,而缩小容器体积,液体颜色加深 C.温度不变,而增大容器体积,S2Cl2的转化率降低 D.温度降低,而体积不变,Cl2的转化率降低 4.在一密闭容器中进行合成氨的反应 N2+3H22NH3△H<0,达到化学平衡后给体系降温,下列变化正确的是 A.反应混和物中NH3的含量增多B.N2的转化率降低 C.NH3的产率降低 D.混和气体的总物质的量增多 5.在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+2NO(g);△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 A.当X表示反应时间时,Y表示混合气体的密度 B.当X表示压强时,Y表示NO的产率 C.当X表示温度时,Y表示NO2的物质的量 D.当X表示NO2的物质的量时,Y表示O2的物质的量 6.在一定条件下,发生CO + NO2CO2+ NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是 A.该反应为一吸热反应B.该反应为一放热反应 C.降温后CO的浓度增大D.降温后各物质的浓度不变 7.下列各反应达到化学平衡后,加压和降温使平衡移动的方向不一致的是 A.2NO2N2O4;△H<0B.C(s) + CO22CO;△H>0 C.N2 + 3H22NH3;△H<0D.2O33O2;△H<0 8.在一密闭容器中进行反应A(g)+B(g)C(g),达到化学平衡后给容器升高温度,结果混和气体中A的含量降低,则△H A.△H > 0 B.△H < 0 C.△H = 0 D.无法判断 9.反应2X(g)+Y(g) 2Z(g)(正反应放热),在不同温度(T1和T2)及压强(p1和p2)下,产物Z 的物质的量[n(Z)]与反应时间(t)的关系如图2—24所示,下述判断正确的是 A.T1<T2,p1<p2B.T1<T2,p1>p2 C.T1>T2,p1>p2D.T1>T2,p1<p2
电沉积
镍电解沉积 镍电解沉积(electrowinning of nickel) 采用不溶阳极,在直流电作用下使硫酸镍或氯化镍溶液中的镍离子在电解槽阴极上呈金属镍沉积的镍电解方法。此法于1960年在芬兰奥托昆普公司(Outok—umpuOy)实现工业化,中国于20世纪70年代开始用于工业生产。 硫酸镍溶液电解沉积以铅锑合金为不溶性阳极,镍片为阴极,净化后的硫酸镍溶液作电解液,电解沉积在隔膜电解槽内进行。当往电解槽通直流电时,在阴极上发生金属镍沉积的反应:
在新的铅锑合金阳极表面上,铅能生成PbO 而起保护层作用,使阳极变为不溶阳极。 2 净化后的电解液用泵输送,通过一台热交换器进入电解槽。电解液的温度约为336K,pH为3.2,镍离子浓度75g/L,并含有硫酸钠及硼酸。电解液进入阴极室后,pH升至4.0。电解沉积过程平均电流密度为183A/m2,电流效率为94%。阴、阳极室保持有一定的液面差,使阴极液通过隔膜流入阳极室,变成阳极液的一部分。阳极上有氧析出,导致阳极液的H+增加。阳极液一般含游离酸40g/L,需排出一部分送浸出车间用于粗镍或镍锍的浸出。阳极上覆盖聚乙烯薄膜罩,用以收集析出的氧气。产品阴极镍可达到一号镍标准。 氯化镍溶液电解沉积挪威克里斯蒂安松(Kris—tiansand)镍精炼厂于20世纪70年代建成了一座年产6800t镍的氯化镍溶液
电积工厂。以石墨或具有贵金属氧化物活性层的钛板为不溶阳极,镍片为阴极,阴极反应与硫酸镍电积的相同,在阳极上发生生成氯气的反应: 电积的电流密度一般为220~230A/m2,也可高达600A/m2,电流效率可达99.97%。用玻璃纤维强化聚脂(FRP)或其他材料制作的阳极罩来收集氯气送浸出车间作氧化剂或制盐酸。
2.2.4温度、催化剂对化学平衡移动的影响 学案(含答案)
2.2.4温度、催化剂对化学平衡移动的影响学 案(含答案) 第第44课时课时温度温度..催化剂对化学平衡移动的影响催化剂对化学平衡移动的影响核心素养发展目标 1.变化观念与平衡思想从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度.催化剂改变,平衡将会发生移动而建立新的平衡。 2.证据推理与模型认知通过实验论证说明温度.催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型勒夏特列原理。 一.温度.催化剂对化学平衡移动的影响1温度对化学平衡移动的影响1实验探究温度对化学平衡移动的影响按表中实验步骤要求完成实验,观察实验现象,填写下表实验原理2NO2g红棕色N2O4g无色H 56.9kJmol1实验步骤实验现象热水中混合气体颜色加深;冰水中混合气体颜色变浅实验结论混合气体受热颜色加深,说明NO2浓度增大,即平衡向逆反应方向移动;混合气体被冷却时颜色变浅,说明NO2浓度减小,即平衡向正反应方向移动2温度对化学平衡移动的影响规律任何化学反应都伴随着能量的变化放热或吸热,所以任意可逆反应的化学平衡状态都受温度的影响。
当其他条件不变时温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。 3用vt图像分析温度对化学平衡移动的影响已知反应mAgnBgpCgH0,当反应达平衡后,若温度改变,其反应速率的变化曲线分别如下图所示。t1时刻,升高温度,v正.v逆均增大,但吸热反应方向的v逆增大幅度大,则v逆v正,平衡逆向移动。t1时刻,降低温度,v正.v逆均减小,但吸热反应方向的v逆减小幅度大。 则v正v逆,平衡正向移动。 2催化剂对化学平衡的影响1催化剂对化学平衡的影响规律当其他条件不变时催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。 2用vt图像分析催化剂对化学平衡的影响t1时刻,加入催化剂,v正.v逆同等倍数增大,则v正v逆,平衡不移动。 提醒一般说的催化剂都是指的正催化剂,即可以加快反应速率。特殊情况下,也使用负催化剂,减慢反应速率。 用速率分析化学平衡移动的一般思路1温度可以影响任意可逆反应的化学平衡状态2催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率3升高温度,反应速率加快,化学平衡正向移动4升高温度,反应速率加快,但反应物的转化率可能降低5对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大6升高温度,化学平衡常数增大7
电沉积
电沉积是指简单金属离子或络合金属离子通过电化学途径在材料表面形成金属或合金镀层的过程。电沉积的应用范围广泛,在材料科学技术(一级学科);材料科学技术基础(二级学科);材料合成、制备与加工(二级学科);表面改性和涂层技术(二级学科)等学科中都有研究。 电沉积主要分为两个方面,分别是; (一)金属或合金从其化合物水溶液、非水溶液或熔盐中电化学沉积的过程; (二)电泳涂漆中的一个过程,在直流电场作用下带电荷的树脂粒子到达相反电极,通过 放电(或得到电子)析出不溶于水的漆膜沉积在被涂物表面。 对电沉积现象的研究主要分为两个方面,分别是对电沉积形态的研究和对电沉积引起的晶格畸变的研究。 对电沉积形态的研究主要有电沉积中结晶形态控制技术[1]与合金薄层电沉积形态研究[2]等。前者将分形几何引入到电化学中,基于DLA模型,通过将沉积粒子设置不同的沉积几率,成功模拟了射流电沉积中枝晶的可控交织生长,后者以铅锡合金为例,研究铅锡合金薄层电沉积物的形态及其形态随电解液含不同铅锡离子浓度的转变。 对电沉积引起的晶格畸变现象的研究,包括电沉积引起的位错现象与电沉积引起的孪晶现象的研究。在电沉积过程中,不同工艺操作条件会使金属镀层产生内应力,同时产生大量位错[3]。在电沉积的过程中也会产生孪晶。分析表明,孪晶现象的产生会提高金属的力学能力,产生高强度金属材料[4-6]。 对电沉积的应用有电镀、电沉积塑性等。其中,电沉积银在工业中得到了广泛的应用。对电沉积银的研究包括对电沉积银的生长过程研究[7]、以及使用电沉积法制备新型发泡银催化剂[8]。 [1]田宗军,王桂峰,沈理达,刘志东,黄因慧.电沉积中结晶形态控制技术[J].创新交 流.2011.(3):29-35. [2]杜燕军,尹志刚,夏同驰.铅锡合金薄层电沉积形态研究[J].电化学.2007.13(3):312-315. [3]赵祖欣.镍镀层内应力及镍镀层中的位错[J].表面技术.1992.21(5).205-207. [4]朱未. 超高强度高导电性的纳米孪晶纯铜[J].华通技术.2006.(1):42. [5]卢磊,卢柯.纳米孪晶金属材料[J].金属学报.2010.46(11):1422-1427. [6]卢磊,陈先华,黄晓旭,卢柯.纳米孪晶纯铜的极值强度及纳米孪晶提高金属材料综合 强韧性[J].中国基础科学.2010.(1):16-18.
中科院电化学问答答案
2005年电化学和电分析化学 1、标准电极电位和条件电位 各种标准状态下的被测电极与标准氢电极组成原电池,标准氢电极作为阳极(发生那氧化反应)用实验的方法测得的该电池电动势的数值,就是被测电极的标准电极电位。 对于实际体系,在某一特定条件下,该电对的氧化型的总浓度和还原型的总浓度均为1mol/L时的实际电位,就叫条件电位。 2、双电层 当电极插入溶液中后,在电极和溶液之间便有一个界面。如果导体电荷带正电荷,会对溶液中的负离子产生吸引作用,同时对正离子也有一定的排斥作用。结果在电极附近就会聚集很多负离子,叫做吸附层,在吸附层外一微小区域,由于静电引力的存在,也有电荷过剩现象存在,称为扩散层,这种结构就叫做双电层。3、极限电流和扩散电流 在电化学反应中,电解开始后,随着外加电压的继续增大,电流急剧上升,最后当外加电压增加到一定数值时,电流不再增加,达到一个极限值。此时的电流称为极限电流。极限电流与残余电流之差称为扩散电流。 4、半电池的形式电势 5、交流伏安法 在电路里负载两端并联一电压表,电路里串联电流表,通过电压和电流计算出阻抗,包括电容的容抗和电感的感抗。 二简答题 1、何谓循环伏安法?主要用于研究什么?从可逆性角度简述循环伏安曲线有几 类?具体依据及特点? 循环伏安法是以快速线性扫描的形式施加以三角波电压于工作电极上,得到循环伏安曲线的一种方法。 一般用于研究电极过程的可逆性、吸附性以及测定可逆体系标准电极电位,鉴别电极反应产物和研究化学反应控制的各个电极过程。 从可逆性的角度可有三类循环伏安曲线:(1)可逆过程ΔEp= 2.2RT/nF = 56.5/n mv,一般说来,ΔEp与实验条件有关,其数值在55/n ~65/n mv 时,可判断为
温度对化学平衡的影响练习题20141110
温度对化学平衡的影响 一、选择题 1.()设C + CO22CO ;△H>0,反应速率为v1;N2 + 3H22NH3 ;△H<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为 A.同时增大B.同时减小C.v1增大,v2减小D.v1减小,v2增大 2.()一定温度下,某密闭容器里发生如下可逆反应: CO(g) + H2O(g) CO2(g) + H2(g) △H>0,当反应达到平衡时,测得容器中各物质均为n mol.欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施中可采用的是 A.升高温度B.增大压强 C.再通入n mol CO和n mol H2O(g) D.再通入n mol CO和2n mol H2O(g) 3.()某温度时有以下反应:S2Cl2(l、无色)+Cl2(g) 2SCl2(l、红色)△H<0,在密闭容器中达到平衡,下列说法不正确的是 A.升高温度,而压强不变,液体颜色变浅 B.温度不变,而缩小容器体积,液体颜色加深C.温度不变,而增大容器体积,S2Cl2的转化率降低D.温度降低,而体积不变,Cl2的转化率降低4.()在一密闭容器中进行合成氨的反应 N2+3H22NH3△H<0,达到化学平衡后给体系降温,下列变化正确的是 A.反应混和物中NH3的含量增多B.N2的转化率降低 C.NH3的产率降低D.混和气体的总物质的量增多 5.()在一定条件下,固定容积的密闭容器中反应:2NO 2(g) O2(g)+2NO(g);△H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是 A.当X表示反应时间时,Y表示混合气体的密度 B.当X表示压强时,Y表示NO2的转化率 C.当X表示温度时,Y表示NO2的物质的量 D.当X表示NO2的物质的量时,Y表示O2的物质的量 6.()在一定条件下,发生CO + NO2CO2 + NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是 A.该反应为一吸热反应B.该反应为一放热反应 C.降温后CO的浓度增大D.降温后各物质的浓度不变 7.()下列各反应达到化学平衡后,加压和降温使平衡移动的方向不一致的是 A.2NO2N2O4;△H<0 B.C(s) + CO22CO;△H>0 C.N2 + 3H22NH3;△H<0 D.2O33O2;△H<0 8.()在一密闭容器中进行反应A(g)+B(g)C(g),达到化学平衡后给容器升高温度,结果混和 气体中A的含量降低,则△H A.△H > 0 B.△H < 0 C.△H = 0 D.无法判断 9.()反应2X(g)+Y(g) 2Z(g)(正反应放热),在不同温度 (T1和T2)及压强(p1和p2)下,产物Z的物质的量[n(Z)]与反应时间(t) 的关系如图2—24所示,下述判断正确的是 A.T1<T2,p1<p2 B.T1<T2,p1>p2 C.T1>T2,p1>p2 D.T1>T2,p1<p2 10.
电极电势
电极电势 1.电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double layer theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质愈活泼,这种趋势就愈大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度愈大,这种趋势也愈大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 2.标准电极电势 为了获得各种电极的电极电势数值,通常以某种电极的电极电势作标准与其它各待测电极组成电池,通过测定电池的电动势, 而确定各种不同电极的相对电极电势E值。1953年国际纯粹化学与应用化学联合会(IUPAC)的建议,采用标准氢电极作为标准电极,并人为地规定标准氢电极的电极电势为零。 (1)标准氢电极电极符号: Pt|H2(101.3kPa)|H+(1mol.L-1) 电极反应: 2H+ + 2e = H2(g) EφH+/ H2 =0 V 右上角的符号“φ”代表标准态。 标准态要求电极处于标准压力(101.325kPa)下,组成电极的固体或液体物质都是纯净物质;气体物质其分压为101.325kPa;组成电对的有关离子(包括参与反应的介质)的浓度为1mol.L-1(严格的概念是活度)。通常测定的温度为298K。 (2) 标准电极电势用标准氢电极和待测电极在标准状态下组成电池,测得该电池的电动势值,并通过直流电压表确定电池的正负极,即可根据E池= E(+)-E(-)计算各种电极的标准电极电势的相对数值。 例如在298k,用电位计测得标准氢电极和标准zn电极所组成的原电池的电动势(E池)为0.7628v,根据上式计算Zn2+/Zn电对的标准电极为-0.7628v。用同样的办法可测得Cu2+/Cu电对的电极电势为+0.34v。 电极的E?为正值表示组成电极的氧化型物质,得电子的倾向大于标准氢电极中
电化学原理思考题答案解析
第三章 1.自发形成的双电层和强制形成的双电层在性质和结构上有无不同为什么2.理想极化电极和不极化电极有什么区别它们在电化学中有什么重要用途答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。 3.什么是电毛细现象为什么电毛细曲线是具有极大值的抛物线形状 答:电毛细现象是指界面张力随电极电位变化的现象。溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 4.标准氢电极的表面剩余电荷是否为零用什么办法能确定其表面带电状况答:不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\ 偶极子双电层\金属表面电位。可通过零电荷电位判断电极表面带电状况,测定氢标电极的零电荷电位,若小于0则电极带正电,反之带负电。 5.你能根据电毛细曲线的基本规律分析气泡在电极上的附着力与电极电位有什么关系吗为什么有这种关系(提示:液体对电极表面的润湿性越高,气体在电极表面的附着力就越小。)6.为什么在微分电容曲线中,当电极电位绝对值较大时,会出现“平台”7.双电层的电容为什么会随电极电位变化试根据双电层结构的物理模型和数学模型型以解释。 8.双电层的积分电容和微分电容有什么区别和联系9.试述交流电桥法测量微分电容曲线的原理。10.影响双电层结构的主要因素是什么为什么 答:静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。11.什么叫ψ1电位能否说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关ψ1电位的符号是否总是与双电层总电位的符号一致为什么 答:距离电极表面d处的电位叫ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时ψ1电位的符号与双电层总电位的符号不一致。 12.试述双电层方程式的推导思路。推导的结果说明了什么问题 13.如何通过微分电容曲线和电毛细曲线的分析来判断不同电位下的双电层结构答:14.比较用微分电容法和电毛细曲线法求解电极表面剩余电荷密度的优缺点。15.什么是特性吸附哪些类型的物质具有特性吸附的能力答:溶液中的各种粒子还可能因非静电作用力而发生吸附称为特性吸附。大部分无机阴离子,部分无机阳离子以及表面活性有机分子可发生特性吸附。
