(整理)《怪物猎人P3》素材出处查询表.
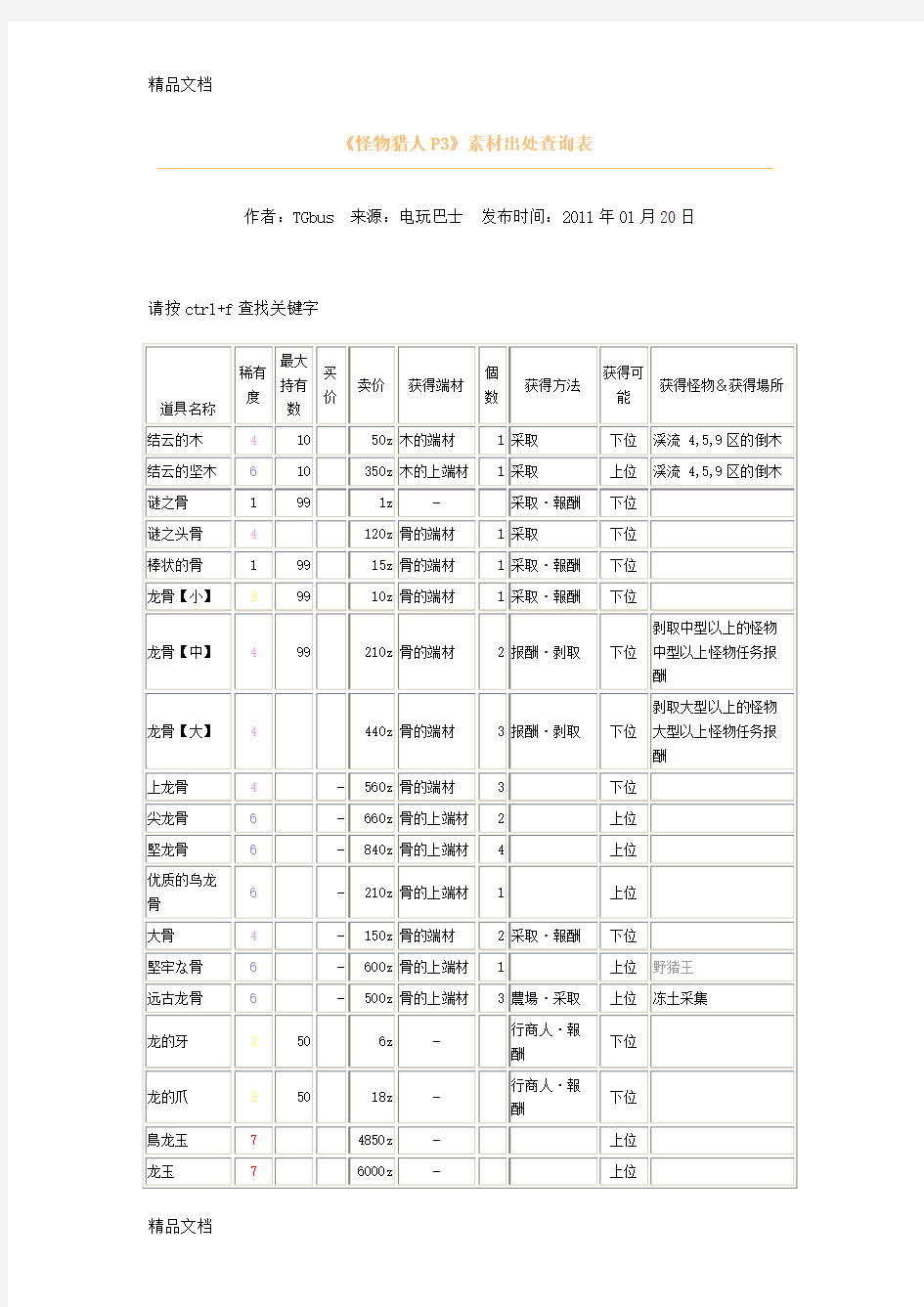
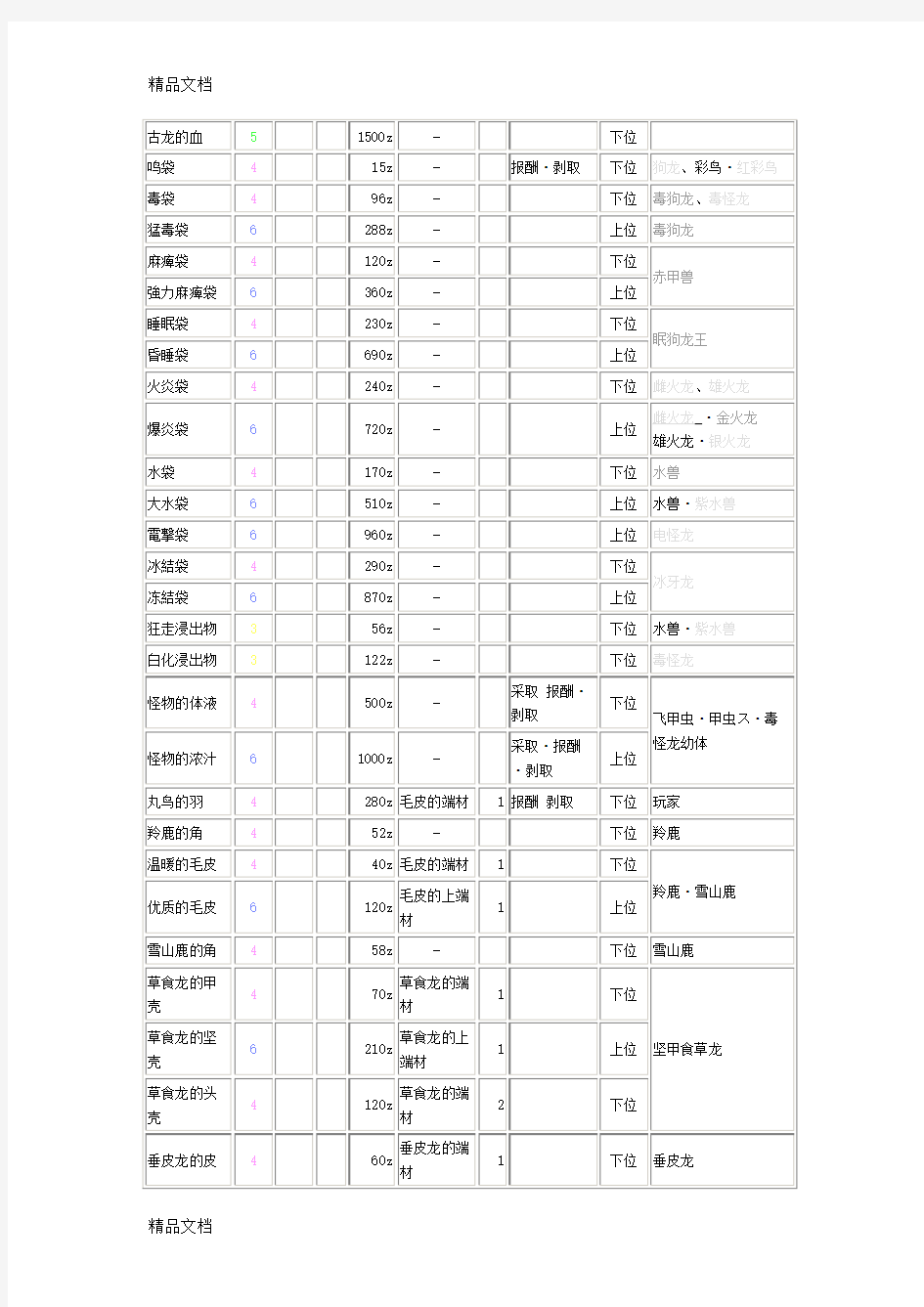
《怪物猎人P3》素材出处查询表
作者:TGbus 来源:电玩巴士发布时间:2011年01月20日请按ctrl+f查找关键字
精 高中化学元素周期表知识点详解
第一节 元素周期表 一.元素周期表的结构 周期序数=核外电子层数主族序数=最外层电子数 原子序数 = 核电荷数 = 质子数=核外电子数 短周期(第1、2、3周期) 周期:7个(共七个横行) 周期表 长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA 族:16个(共18个纵行)副族 7个:IB-ⅦB 第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素 【练习】 1.主族元素的次外层电子数(除氢) A .一定是8个 B .一定是2个 C .一定是18个 D .是2个、8个或18个2.若某ⅡB 族元素原子序数为 x ,那么原子序数为x+1的元素位于A .ⅢB 族B .ⅢA 族 C .ⅠB 族 D .ⅠA 族 3.已知A 元素原子的最外层电子数是次外层电子数的3倍,B 元素原子的次外层电子数是 最外层电子数的 2倍,则A 、B 元素 A .一定是第二周期元素 B .一定是同一主族元素 C .可能是二、三周期元素 D .可以相互化合形成化合物二.元素的性质和原子结构(一)碱金属元素: 1.原子结构 相似性:最外层电子数相同,都为 _______个 递变性:从上到下,随着核电核数的增大,电子层数增多 2.碱金属化学性质的相似性: 4Li + O 2 Li 2O 2Na + O 2 Na 2O 2 2 Na + 2H 2O =2NaOH + H 2↑ 2K + 2H 2O = 2KOH + H 2↑ 2R + 2 H 2O = 2 ROH + H 2 ↑产物中,碱金属元素的化合价都为+1价。结论:碱金属元素原子的最外层上都只有 _______个电子,因此,它们的化学性质 相似。 3.碱金属化学性质的递变性: 递变性:从上到下(从Li 到Cs ),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从 Li 到Cs 的金属性逐渐增强。 结论:1)原子结构的递变性导致化学性质的递变性。2)金属性强弱的判断依据: 与水或酸反应越容易,金属性越强;最高价氧化物 对应的水化物(氢氧化物)碱性越强,金属性越强。4.碱金属物理性质的相似性和递变性: 1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有 展性。 2)递变性(从锂到铯):①密度逐渐增大( K 反常) ②熔点、沸点逐渐降低 点燃 点燃
最新作文素材分类整理(认识自我)
[作文素材分类整理]作文素材分类整理 1 一、正面素材 2 (一)古代 3 1.鲍叔牙:认清自己的能力,荐管仲为相。 4 2.皇太极:认清形势,不急于大举进攻明王朝。 5 3.刘邦:攻进成阳后,能认清实力和形势,虽爱财而秋毫无犯,并约法三章收6 服民心。 7 4.庄子:充分认识自己的本性,在楚国相位诱惑面前持竿不顾。 8 (二)现代 9 1.史铁生:认清现实,从事文学创作。 10 2.可持续发展战略:中央认清中国是人均GDP耗能最高的国家所提出的经济发11 展战。 12 3.丁俊晖:认清自己兴趣所在,小小年纪成为台球名将。 13 4:周杰伦:认清自己,坚持走自己的音乐之路,不跟风。 14 5.张越:央视《半边天》主持人,认清自我,不盲从,形成自己独特的主持风15 格。 16 6.李素丽:认清自己的工作岗位,虽然平凡但能作出不平凡的贡献。 17 7.刘翔:原来从事跳高,后来认清自己的优势,改练田径110米跨栏,终成世18 界冠军他还拒绝剧组邀请出演。 19
8.马连良:能认清自己嗓音沙哑的特点.创造低回婉转、回味悠长的马派唱腔。 20 9.陈省身:认清自己不善交际,埋首数学研究,终成大师。 21 (三)外国 22 1.赖斯:认清自己,从学习钢琴转向从政,成为国际政坛风云人物。 23 2.德国:正视耻辱历史,认清自己所应承担的历史责任。 24 3.新加坡:弹丸小国能认清自己独特的旅游优势--阳光。 25 4.马克?吐温:开始热衷发明,后来经商,都不成功,逐步认清自己能力所在,26 从事写作成名家。 27 5.爱因斯坦:认清自己兴趣和能力在物理领域.拒绝出任以色列总统。 28 6.梵高:即使生前没卖出一幅画,但能认清自己的理想追求永不放弃,终被后29 世认可。 30 7.卓别林:认清自己,把容貌不佳转化成喜剧优势。 31 8.比尔·盖茨:上大学时中途辍学,从事软件开发,找准了人生定位,终成世32 界首富。 33 9.霍金:身体虽残,但能认清自己在理论物理方面的优势和潜力,写成《时间34 简史》等畅销世界的科普著作。 35 (四)文学作品及其他 36 电影《霍元甲》:霍元甲经过一番磨难,认清了武术的精神,终成一代宗师。 37 鹰击长空,鱼翔浅底,驼走大漠,虎啸深山:它们都找到各自生命的位置。38 象棋:每个棋子都有它的位置和作用。 39
化学元素周期表知识整理
1 原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2 元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到 +7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同 (3) 所有单质都显零价 3 单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增 4 元素的金属性与非金属性 (1)同一周期的元素电子层数相同。因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增; (2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。 5 最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6 非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 7 单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。 [编辑本段]推断元素位置的规律 判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2)主族元素的序数等于最外层电子数。
高一化学元素周期表知识精讲.doc
高一化学元素周期表 【本讲主要内容】 元素周期表 元素周期表中主族元素性质的递变规律、原子结构、元素性质及元素在周期表中位置三者的关系、元素周期表的结构及应用、元素的推断等。其中元素周期表的结构及应用是学习的重点。 【知识掌握】 【知识点精析】 二. 原子结构、元素性质及元素在周期表中位置三者的关系 主族序数 原子半径 1.同周期左右: 非金属性增强。 2.同主族上下: 化学性质相似, 但又有递变。 1. 原子结构与元素在周期表中的位置关系: (1)核外电子层数=周期数
(2)主族元素的最外层电子数=价电子数=主族序数=最高正价数 (3)质子数=原子序数=原子核外电子数=核电荷数 (4)负价绝对值=8-主族数(限ⅣA~ⅦA) (5)原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物的相应水化物碱性越强,其离子的氧化性越弱。 (6)原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成最高价氧化物的相应水化物酸性越强,其离子的还原性越弱。 2. 周期表与电子排布 (1)最外层电子数等于或大于3(小于8)的一定是主族元素。 (2)最外层有1个或2个电子,则可能是ⅠA、ⅡA族元素又可能是副族或零族元素氦。 (3)最外层电子数比次外层电子数多的元素一定位于第二周期。 (4)某元素阴离子最外层电子数与次外层相同,该元素位于第三周期。 (5)电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。 3. 从元素周期表归纳元素化合价的规律 (1)主族元素的最高正价数等于主族序数,等于主族元素原子的最外层电子数,其中氟无正价。非金属元素除氢外,均不能形成简单阳离子,金属元素不能形成简单阴离子。 (2)主族元素的最高正价数与最低负价数的绝对值之和为8,绝对值之差为0、2、4、6的主族依次为ⅣA、ⅤA、ⅥA、ⅦA族。 (3)非金属元素的正价一般相差2,如氯元素正化合价有+7、+5、+3、+1等,某些金属也符合此规律,如锡元素正化合价有+4、+2价 (4)短周期正价变化随原子序数递增,同周期有一个+1到+7价的变化(ⅠA~ⅦA);长周期有两个+1到+7价的变化(ⅠA~ⅦB,ⅠB~ⅦA)。 三. 元素周期表的结构 1. 周期 元素周期表分7个周期,第一、二、三为短周期,元素种类依次为2、8、8;第四、五、六周期为长周期,元素种类依次为18,18,32;第七周期为不完全周期,目前有32种元素。 除第一周期外,每一周期的元素都是从碱金属开始,逐渐过渡到卤族元素,最后以稀有气体元素结束。 2. 族 元素周期表中有18个纵行,分为16个族,其中7个主族、7个副族,还有1个零族和1个第Ⅷ族。 过渡元素包括全部副族和第Ⅷ族,都是金属,又称过渡金属。 除短周期外;族序数从左到右的顺序为:ⅠA→ⅡA→ⅢB→…ⅦB→Ⅷ→ⅠB→ⅡB→ⅢA →…→ⅦA→0族,前后从1→8更迭两次。 金属、非金属的分界线
语文作文素材分类整理
有关作文素材的积累和运用 很开心可以为大家写关于语文作文的心得,作为一名作文高一高二一直一般的文学素养颇低的普通人,在高三开窍之后,在一两个月的时间里,作文狂飙并且稳定在52+的分数,我想告诉大家,语文作文不是什么难题,是有章可循有法可依的大块。 大家可能普遍觉得语文作文只要一个平均分数45分左右就可以了,反正大家也拉不开差距,有这个时间还不如去写数学题可能提高的更快。其实这也是一个误区,因为凡事存在一个极限,你花一年去学数学就可以满分了吗?真的不一定。 应试教育要的就是你不能有短板,而作文对大部分人而言,还有大幅度的提升空间,花这个时间去提高作文在效率上,是绝对划算的买卖。 接下来我会分享一些素材积累和文采提升的窍门,干货满满哦,希望对大家有帮助。但是我更想强调的是一种方法和思路,面对一个未知的领域,我们应该拿出怎么样的态度来应对才是最佳方案,这是我们在接下来人生需要面对的课题,所以我更希望吸收的是这种思路,而不是材料本身。 一,素材积累方法 关于素材的积累,很多人觉得拿个小本本抄起来没事读读背背就可以了,可你会不会有这种感觉,背了好多,可是一到要用,脑子里一片空白,这是因为素材在脑子里混乱不堪,杂乱无章,导致要使用时没有一条线索让我们找到合适的素材,所以接下来介绍的方法,可以帮助大家很大程度的挖掘运用已经有的素材,做到信手拈来。 ( 1).简单化 这个点包含两层意思:第一是记忆简单的素材,第二是人为简化素材。 简单的素材,最大的有点是好记!!只有记忆下来才会运用是吧!接下来给出一些字数极少可是用起来得心应手的好素材。 1.我想去相信某个人,非常想。——七堇年(信任) 2.孩子,这是你的罪孽,亦是你的福祉。——史铁生《我与地坛》(事物都有两面性,我们要看见好的一面,也要看见坏的一面) 3.林中似有几只狼在嚎叫,听真些,不过是松涛。——张碧华《诱僧》(很有感触的道理,有时候我们觉得前行万般艰苦,但真正走上去了,不过云淡风轻。我们习惯把困难看的太重,把努力看的太轻,其实当我们迈出第一步才发现,我早就离成功那么近。努力,困难,迈出第一步,过程) 4.这是一个欲望大的惊人的掘金时代。——王开玲(欲望)
高中元素周期表知识点
高中元素周期表知识点 高中元素周期表知识点 元素周期表共分18纵行: 其中 第1、2、13、14、15、16、17七个纵行依次为ⅠA族、ⅡA族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族(纵行序号的'个位数与主族序数相等); 第3、4、5、6、7、11、12七个纵行依次为ⅢB族、ⅣB族、ⅤB 族、ⅥB族、ⅦB族、ⅠB族、ⅡB族(纵行序号个位数与副族序数相等); 第8、9、10三个纵行为合称为Ⅷ族;第18纵行称为0族。 ⅠA族称为碱金属元素(氢除外); ⅡA族称为碱土金属元素; ⅢA族称为铝族元素; ⅣA族称为碳族元素; ⅤA族称为氮族元素; ⅥA族称为氧族元素; ⅦA族称为卤族元素。 元素周期表共有七个横行,称为七个周期, 其中第一(2种元素) 二(8种元素)
三(8种元素)周期为短周期(只有主族元素) 第四(18种元素) 五(18种元素) 六(32种元素)周期为长周期(既有主族元素,又有过渡元素); 第七周期(目前已排26种元素)为不完全周期。 在元素周期表中,越在左下部的元素,其金属性越强;越在右上 部的元素(惰性气体除外),其非金属性越强。金属性最强的稳定性 元素是铯,非金属性最强的元素是氟。 在元素周期表中位于金属与非金属分界处的金属元素,其氧化物或氢氧化物通常具有两性,如Be、Al等。 主族元素的价电子是指其最外层电子;过渡元素的价电子是指其 最外层电子和次外层的部分电子;镧系、锕系元素的价电子是指其最 外层电子和倒数第三层的部分电子。 在目前的112种元素中,只有二十二种非金属元素(包括6种稀 有气体元素),其余九十种都是金属元素;过渡元素全部是金属元素。 在元素周期表中,位置靠近的元素性质相近。通常在周期表的右上部的元素用于合成新农药;金属与非金属分界处的元素用于制造半 导体材料;过渡元素用于制造催化剂和耐高温、耐腐蚀的合金材料等等。 从原子序数为104号往后的元素,其原子序数的个位数与其所在的副族序数、Ⅷ族(包括108、109、110三号元素)、主族序数分别 相等。第七周期若排满,最后0族元素的原子序数为118号。 同周期第ⅡA族和第ⅢA族元素的原子序数之差可能为1(第二、 三两周期)或11(第四、五两周期)或25(第六周期)。 若主族元素xA所在的第n周期有a种元素,同主族的yB元素所在的第n+1周期有b种元素,当xA、yB位于第IA族、ⅡA族时, 则有:y=x+a;当xA、yB位于第ⅢA~ⅦA族时,则有:y=x+b。
经典短句素材分类整理
经典短句素材(作文纸条收录) 成长 1.内心湛然,则无往而不乐(梁实秋) 适用主题:内心平静,淡泊名利,调整心态,和谐自我。 出处:梁实秋《闲暇处才是生活》 示例:风景随心,无处不在。倘若你内心湛然,纵然处于穷山恶水中,也能看见青山绿水。听闻鸟语虫鸣。风雨磨砺也好,世事浮沉也好,只有这颗清澈沉静、朴实无华的心能够让你坦然处之,时刻感受到生活的美好,领略人生的诗意,获得快乐与幸福。 2.人之知识,若登梯然。进一级,则所见愈广。(陆九渊) 适用的主题;开阔眼界,积极向上,好学与进步。 出处:《陆象山集·语录》。 示例:学习知识就像登梯子一样,每登上一级,我们的视野就便是越宽广,所看到的风景也越是不同。李四光出身于农村家庭,但由于他对自然科学非常感兴趣,因而勤奋努力,最终改变了自己的命运,成为了我国著名的地质学家。我们不能选择我们出生的时间、家庭和地域,但我们可以选择不断的学习和充实自身,到达想去的远方。 3.岁月送给我苦难,也随赠我清醒与冷静。(毕淑敏) 适用主题:对时间岁月流逝思考,珍惜时间,在反思中成长等。 出处:语出毕淑敏《养心的妙药》。 示例:对于大多数人而言,时间的流逝是一种悲哀与遗憾,因为那意味着失去和衰败。然而,从出生到死亡,随着时间的流逝,我们又何尝不是得到更多呢?岁月送给我们快乐的体验,送给我们苦难的磨砺,也随赠我们清醒与冷静,稳重与内敛。这些是时间的礼物,不经历风霜,我们依旧是那个毛头小孩。时间在流逝,我们也在不断地得到。
4.且视他人之疑目如盏盏鬼火,大胆地去走你的夜路。(史铁生) 适用主题:认识自我,坚守信念,坚持自己的选择等主题。 出处:语出史铁生《病隙碎笔》。 示例:生活在当下快节奏的互联网时代,满目都是标签、满耳都是评价,当耳目都被“他人”堵塞,“自我”还剩几何?若世上本没有路,不应苦等他人走出路来,而应听从自己的内心,于无路处走出属于自己的康庄大道。史铁生说:“且视他人之疑目如盏盏鬼火,大胆地去走你的夜路。”随波逐流者或笑愚公之执,人云亦云者或嘲夸父之痴,但如劲竹傲松者则有“任尔东西南北风”之姿,故能驭风凌寒,青云直上。 5.经一番挫折,长一番识见。容一番横逆,增一番器度。《格言联璧》 适用主题:个人修养,为人的气节,君子气度等。 出处:语出金缨的《格言联璧》。意为:经历一番挫折的磨练,就能增长一些见识。经过一些蛮横无理的对待,就能增长一些气度。 示例:人生挫折常在,不经历也就不会成长;蛮横无礼的人也常有,不遇见也就不懂得人世的真实。一个人的成长和好的气度修养往往都是经历了一番磨练才能够最终达成的,没有过此番经历的人,自然也就不会真正懂得人生中的酸甜苦辣,他的人生其实是不圆满的。 5.人的每一种身份都是一种自我绑架,唯有失去是通向自由之途。(刘瑜) 适用主题:人有各种不同身份,身份是自我的束缚,自由的归宿,断舍离的思维等主题。出处:刘瑜《送你一颗子弹》。 示例:年纪小的时候,人的身份是孩童,天真烂漫,无所拘束;年纪稍长,少年的身份有着青春的美好,也有成长的烦恼,人生的酸甜正一点点被品尝;再过些年,家庭的重担、工作的压力、生活的烦恼一股脑儿翻涌而上,苦痛开始蔓延,焦虑不断燃烧,各种身份带来的无形压力束缚着人们。其实,自由并不困难,给自己的生活做减法,抛去无用的身份,便是给幸福做乘法,给自己自由!
元素周期表与元素周期律知识点归纳完美版
元素周期表与元素周期律知识点归纳 1、元素周期表共有横行,个周期。其中短周期为、、。所含元素种类为、、。长周期包括、、。所含元素种类为、、。 第七周期为不完全周期,如果排满的话有种元素。 2元素周期表有个纵行个族。包括个主族,个副族,一个族,一个第Ⅷ族(包括个纵行)按从左到右的顺序把16个族排列 。过度元素共包括个纵行(第纵行到第纵行)。包括哪些族。过渡元素全为元素。又称为。 3、写出七个主族和0族元素的名称和元素符号 ⅠA族 ⅡA族 ⅢA族 ⅣA族 ⅤA族 ⅥA族 ⅦA族 0族 4.同一周期第ⅡA族和第ⅢA族原子序数之间的关系 若元素位于第二、三周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第四、五周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 若元素位于第六周期,第ⅡA族的原子序数为a,则第ⅢA族的原子序数为 5、同一主族上下相邻两个周期原子序数之间的关系 若A在B的上一周期,设A的原子序数为a ⑴若A、B位于第ⅠA族或ⅡA族(过度元素的左边)则B的原子序数为。 ⑵若A、B位于第ⅢA族——ⅦA族(过度元素的右边)则B的原子序数为。 。 6、微粒半径大小判断的方法 。 。 。 7 与He原子电子层结构相同的简单离子。 与Ne原子电子层结构相同的简单离子。 与Ar原子电子层结构相同的简单离子。 阳离子与周期稀有气体原子的电子层结构相同。阴离子与周期稀有气体原子的电子层结构相同。 8、阴上阳下规律 9原子得电子能力强弱判断的方法 ⑴、原子得电子能力越强——单质的氧化性——元素的非金属性——阴离子的还原性——单
质与氢气化和的能力——生成的气态氢化物越——最高价氧化物对应水化物的酸性。 ⑵、另外可以通过单质间的置换反应判断得电子能力的强弱 如Cl2+Na2S=2NaCl+S得电子能力ClS 10、原子失电子能力强弱判断的方法 ⑴、原子失电子能力越强——单质的还原性——元素的金属性——阳离子的氧化性——单质与水或酸反应置换出氢的能力——最高价氧化物对应水化物的碱性。 ⑵、另外可以通过单质间的置换反应判断失电子能力的强弱 如Fe+CuSO4=FeSO4+Cu失电子能力FeCu 11、同一主族元素及其化合物性质的递变性: 同主族元素的原子,最外层电子数,决定同主族元素具有的化学性质。从上到下原子的核电荷数依次,原子的电子层数依次,原了半径逐渐;原子失电子能力逐渐,元素的金属性逐渐,单质的还原性逐渐,对应阳粒子的氧化性逐渐,单质与水或酸反应置换出氢气的能力逐渐,最高价氧化物对应水化物的碱性逐渐;原子得电子能力逐渐,元素的非金属性逐渐,单质的氧化性逐渐,对应阴离子的还原逐渐,单质与氢气化合的能力逐渐,最高价氧化物对应水化物的酸性逐渐。气态氢化物的稳定性逐渐。 12、同一周期元素及其化合物性质的递变性: 在同一周期中,各元素原子的核外电子层数,但从左到右核电荷数依次,最外层电子数依次,原子半径逐渐(稀有气体元素除外)。原子失电子能力逐渐,元素的金属性逐渐,单质的还原性逐渐,对应阳粒子的氧化性逐渐,单质与水或酸反应置换出氢气的能力逐渐,最高价氧化物对应水化物的碱性逐渐。 原子得电子能力逐渐,元素的非金属性逐渐,单质的氧化性逐渐,对应阴离子的还原逐渐,单质与氢气化合的能力逐渐,最高价氧化物对应水化物的酸性逐渐,气态氢化物的稳定性逐渐。 1.位、构、性的关系 根据原子结构、元素周期表的知识及相关条件可推算原子序数,判断元素在周期表中的位置等。 2.周期表中数字与性质的关系 (1)由原子序数确定元素位置的规律:只要记住稀有气体元素的原子序数就可以确定主族元素的位置。 He:2、Ne:10、Ar:18、Kr:36、Xe:54、Rn:86 ①若比相应的稀有气体元素的原子序数多1或2,则应处在下一周期的ⅠA或ⅡA,如88号元素,88-86=2,则应在第7周期第ⅡA。 ②若比相应的稀有气体元素的原子序数少1~5时,则应在第ⅦA~ⅢA,如84号元素在第6周
愚拙的4种素材整理分类方法
愚拙的4种素材整理分类方法 信息时代,面对海量的素材,如何进行分类存储才更科学高效?其实,不同岗位面临不同方面、不同量级的素材,很难找到一个标准答案,主要还是根据具体实际需要。这里,愚拙同读者分享五个分类方法。 一、按业务分类 中华人民共和国中央人民政府官网”政策“栏目中的”文件库“为两办综合人员提供了一个很好的按主题分类范例,共22类: 1.国务院组织机构, 2.综合政务, 3.国民经济管理、国有资产监管, 4.财政、金融、审计, 5.国土资源、能源, 6.农业、林业、水利, 7.工业、交通, 8.商贸、海关、旅游, 9.市场监管、安全生产监管,10.城乡建设、环境保护,11.科技、教育,12.文化、广电、新闻出版,13.卫生、体育,14.人口与计划生育、妇女儿童工作,15.劳动、人事、监察,16.公安、安全、司法,17.民政、扶贫、救灾,18.民族、宗教,19.对外事务,20.港澳台侨工作,21.国防,22.其他。 (PS.1.此网站也是愚拙拟审公文的一大法宝哈,对于一些拿不准、使用频次较少的文种,经常从中找遵循、找范例。2.具体业务部门/科处室的同志,可找对口部/委/厅局的网站/领导讲话看看,基本能找到一个这些年来约定俗成的一个业务分类标准,按此分类,对收集到的资料分别进行电子建档和纸质建档,拟稿时研读上情下情内情外情更快捷) 二、按词句分类 愚拙在泛读精读资料的存储实践中,逐步建立健全了词句分
类方法,主要成果就是愚拙每周末在“公文选萃”公众号分享的”机关公文常用词句动态集锦“,目前共分10类: 1.词语, 2.短句, 3.分类语句, 4.功能套件, 5.提纲标题, 6.党建, 7.经典范例, 8.经典专题, 9.典籍素材,10.方法技巧. (ps.词和短句主要解决会“爬”的问题,主要来源于人民日报等主流报刊及领导讲话材料,这是以文叙事、以文辅政的基础。句主要解决能“跑”的问题,主要选萃方法论性表述,对形成务实态度、掌握科学方法有所助益。) 三、按方法分类 愚拙一直尝试按照工作开展的逻辑进行词、句的具体分类。比如,四字词语从分类上,已基本涵盖到各类材料的共性方法论,目前共分42类: 成果、领导、形势、调研、群众、谋划、落实、措施、状态、奋斗、担当、推进、组织、责任、重点、问题、难点、精准、学习、效率、信念、廉洁、治党、督查、巡察、综治、市场、理念、军队、做人、评价、表态、地位、天气、改革、创新、信访、团结、宣传、宣讲、制度。 再比如,语句方面,目前共分40类: 1.理念, 2.思想, 3.战略, 4.规划, 5.大局, 6.谋划, 7.领导, 8.调研, 9.部署,10.落实,11.实干,12.状态,13.担当,14.责任,15.创新,16.试点,17.问题导向,18.难点,19.重点,20.学习,21.改革,22.督查,23.检查,24.制度,25.法治,26.资金,27.团结,28.民生,29.信访,30.人才,31.安全生产,32.宣传,33.宣讲,34.军队,35.扶贫,36.典型,37.办公,38.评价,39.成果,40.机构改革
元素周期表知识点总结(终极版)
元素周期表的高中化学问题终极总结 一、最外层电子数规律 1.最外层电子数为1的元素: 主族(IA族)、副族(I B、VIII族部分等)。 2.最外层电子数为2的元素: 主族(IIA族)、副族(II B、III B、IV B、VIIB族)、0族(He)、VIII族(26Fe、27Co等)。 3.最外层电子数在3~7之间的元素一定是主族元素。 4.最外层电子数为8的元素:0族(He除外)。 二、数目规律 1.元素种类最多的是第IIIB族(32种)。 2.同周期第IIA族与第IIIA族元素的原子序数之差有以下三种情况:(1)第 2、"3周期(短周期)相差1; (2)第 4、"5周期相差11; (3)第 6、"7周期相差
25。" 3.设n为周期序数,每一周期排布元素的数目为: 奇数周期为;偶数周期为。如第3周期为种,第4周期为种。 4.同主族相邻元素的原子序数: 第I A、IIA族,下一周期元素的原子序数=上一周期元素的原子序数+上一周期元素的数目;第IIIA~VIIA族,下一周期元素的原子序数=上一周期元素的原子序数+下一周期元素的数目。 三、化合价规律 1.同周期元素主要化合价: 最高正价由+1+7(稀有气体为0价)递变、最低负价由-4-1递变。 2.关系式: (1)最高正化合价+|最低负化合价|=8; (2)最高正化合价=主族族序数=最外层电子数=主族价电子数。 3.除第VIII族元素外,原子序数为奇(偶)数的元素,元素所在族的序数及主要化合价也为奇(偶)数。 四、对角线规律 金属与非金属分界线对角(左上角与右下角)的两主族元素性质相似,主要表现在第 2、"3周期(如Li和Mg、Be和Al、B和Si)。 五、分界线规律
雅思口语part 2 素材分类整理
做有偿工作的人 Describe a person you know who is doing a paid job. You should say: Who this person is What job it is; How long the job lasted; And explain why you or this person chose to do this job. 让你笑的小孩 Describe a time that a child did something that made you laugh. You should say: When this happened Who the child was What the child did And explain why it was funny 特殊的旅行 Describe an educational trip you went on when you were in school. You should say: When and where you went; Who you went with; What you did; And explain what you learned on this trip.
Describe an electronic machine you want to buy. You should say: What it is When you know this machine What specific And explain why you want this machine 难忘的广告 Describe an unforgettable advertisement (that you saw or heard liked) You should say: Where you saw or heard it What kind of advertisement it was What the contents of the advertisement were (or, what product or service was advertised) And explain how you felt when you saw or heard this advertisement/why you like it
元素周期表38个知识点归纳
人教版化学必修2第一章第一节元素周期表38个知识点归纳1、元素定义:核电荷数相同的同一类原子的总称,一种元素可能有多种形式的原子存在 形式,如:氢元素的几种形式:H、D(2 1H)、T(3 1 H)、H+、H-。 2、元素符号:在元素周期表中每个小格分四层,元素符号在第一层,黑色字体,用拉丁文大写字母表示,当大写字母相同时,加一个小写字母予以区别。 例如:H(氢)、He(氦);C(碳)、Cl(氯)、Ca(钙);N(氮)、Ne(氖)、Na (钠);Al(铝)、Ar(氩)。 3、元素名称:在元素周期表中每个小格分四层,元素名称在第二层,黑色字体,大多数元素的名称是由形声字构成,气态非金属的名称有气字头,固态非金属的名称有石头旁,液态非金属用三点水旁(溴),液态金属用水字底(汞),金属的名称都有金字旁,个别的元素的名称不是形声字,例如:氮不读“炎”音。 4、元素分类: (1)按元素所在的周期分类:同周期元素和不同周期元素 同周期元素共同点:电子层数相同,在元素周期表中处于同一行中,处于左右关系。 不同周期元素不同点:电子层数不相同,在元素周期表中不处于同一行中。 (2)根据元素的原子序数分类:前20号元素或第n号元素 (3)按元素所在的族分类:主族元素、副族元素、第VIII族元素、0族元素 (4)按元素周期表(新课标人教版化学必修2)分类:金属、非金属、过渡元素 其中金属元素专指主族元素的金属元素,非金属包括主族非金属和稀有气体,过渡元素是指所有副族金属元素和Ⅷ族金属元素,。 5、元素的特有数值:元素的原子序数和元素的相对原子质量。 (1)原子序数=核电荷数=质子数,原子序数在核组成符号中处于元素符号的左下角位置,在元素周期表中每个小格内的第一层,位于元素符号的左下角,数字呈鲜红色。 (2)元素的相对原子质量就是按照元素各核素原子的相对原子质量所占的一定百分比计算出的平均值(见课本P10),元素的相对原子质量在元素周期表中每个小格内的第四层,通常保留有效数字4位,数字呈黑色。 6、元素周期表 (1)将化学元素依照某种特有数值从小到大顺序依次排成一行,并将化学性质相似的元素依照某种特有数值从小到大排成一列所形成的表格叫元素周期表。 (2)元素周期表中特有数值:原子序数和相对原子质量。 (3)门捷列夫的元素周期表依照的特有数值是相对原子质量,现行的元素周期表依照的特有数值是原子序数。 7、元素周期表的结构:由七行和十八列构成,其中每一行为一个周期,从左到右第8、9、10列合起来为VIII族,其余每一列为一族,所以元素周期表由7个周期和16个族构成。
作文素材分类整理(认清自己)
作文素材分类整理[认清自己] 一、正面素材 (一)古代 1.鲍叔牙:认清自己的能力,荐管仲为相。 2.皇太极:认清形势,不急于大举进攻明王朝。 3.刘邦:攻进成阳后,能认清实力和形势,虽爱财而秋毫无犯,并约法三章收服民心。 4.庄子:充分认识自己的本性,在楚国相位诱惑面前持竿不顾。 (二)现代 1.史铁生:认清现实,从事文学创作。 2.可持续发展战略:中央认清中国是人均GDP耗能最高的国家所提出的经济发展战。 3.丁俊晖:认清自己兴趣所在,小小年纪成为台球名将。 4:周杰伦:认清自己,坚持走自己的音乐之路,不跟风。 5.张越:央视《半边天》主持人,认清自我,不盲从,形成自己独特的主持风格。 6.李素丽:认清自己的工作岗位,虽然平凡但能作出不平凡的贡献。 7.刘翔:原来从事跳高,后来认清自己的优势,改练田径110米跨栏,终成世界冠军他还拒绝剧组邀请出演。 8.马连良:能认清自己嗓音沙哑的特点.创造低回婉转、回味悠长的马派唱腔。 9.陈省身:认清自己不善交际,埋首数学研究,终成大师。 (三)外国 1.赖斯:认清自己,从学习钢琴转向从政,成为国际政坛风云人物。 2.德国:正视耻辱历史,认清自己所应承担的历史责任。 3.新加坡:弹丸小国能认清自己独特的旅游优势——阳光。4.马克?吐温:开始热衷发明,后来经商,都不成功,逐步认清自己能力所在,从事写作成名家。5.爱因斯坦:认清自己兴趣和能力在物理领域.拒绝出任以色列总统。 6.梵高:即使生前没卖出一幅画,但能认清自己的理想追求永不放弃,终被后世认可。 7.卓别林:认清自己,把容貌不佳转化成喜剧优势。 8.比尔·盖茨:上大学时中途辍学,从事软件开发,找准了人生定位,终成世界首富。 9.霍金:身体虽残,但能认清自己在理论物理方面的优势和潜力,写成《时间简史》等畅销世界的科普著作。 (四)文学作品及其他 电影《霍元甲》:霍元甲经过一番磨难,认清了武术的精神,终成一代宗师。 鹰击长空,鱼翔浅底,驼走大漠,虎啸深山:它们都找到各自生命的位置。 象棋:每个棋子都有它的位置和作用。 二、反面素材 (一)古代 1.杨修:恃才放旷,认不清自己的位置,终被诛杀。 2.六国:面对强秦,认不清形势,反而争相赂秦,国力日弱。 3.赵括:认不清实战状况,盲目自信;终致失败。 4.项羽:乌江自刎之时,尚不能认清自己的过失.以为“天亡我也”。 5.李煜:认不清自己的职责,终成亡国之囚。 6.诸葛亮:认不清天下大势。六出祁山.病死在五丈原。 7.韩信:认不清自己的位置,终被贬杀。 (二)现代 1.部分大学毕业生:毕业谋职时,认不清自己,好高骛远。 2.芙蓉姐姐:认不清自己,在网上搔首弄姿。 4.超女:其负面影响就是使得成千上万的少男少女盲目跟风,迷失自我。
元素周期表知识点总结
第一章物质结构元素周期律 第一节元素周期表 知识回顾: 1、原子的结构: 肿f时示F 原子是由原子核和电子组成;原子核由质子和中子组成 原子的质量集中在原子核上,电子的质量很小,几乎可以忽略不计 一个质子带一个单位的正电荷,一个电子带一个单位的负电荷,中子不带电,所以原子对外显中性 2、元素的定义:具有相同核电荷数(质子数)的一类原子的总称 一、元素周期表的结构 1、原子序数 原子序数=核电荷数=质子数=核外电子数 2、周期 按原子序数递增的顺序,把电子层数相同的元素自左向右排成横行,每行叫做一个周期。 元素周期表共有七个周期,从上到下依次命名为第一周期、第二周期等 各周期内的信息表
3、族 按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,每一个纵行称为一个族?共18行 元素周期表共有十八个纵行,除& 9、10三个纵行叫第毗族外,其余每个纵行各为一个族,它们又被划分为十六个族。 族分为主族和副族,主族用罗马数字加“ A”表示,如I A族;副族用罗马数字 加” B”来表示,如U B。0族和毗族则不加“ A”或“ B” 注意:① 1,2行对应为I A,n A;13---17行对应为川A---A ②3---7行对应为川B --- W B; 11,12行对应为I B,n B o ③8,9,10对应为忸 ④18行对应0族 二、元素的性质与原子结构 1、碱金属元素 知识回顾:Na的物理性质和化学性质 从上到下原子的电子层数在增加,原子半径逐渐增大,所以失电子的能力逐渐增强从上到下金属性逐渐增强(金属性包括 碱金属元素的化学性质 R+2H2O====2ROH+H 4Li+Q====2L2O 4Na+Q====2Na;O(缓慢氧化) Na+Q==A ===Na s O2 2 卤族元素的主要物理性质
五年级上册语文素材 词语积累分类整理 人教新课标
其实,任何一门学科都离不开死 记硬背,关键是记忆有技巧,“死记”之后会“活用”。不记住那 些基础知识,怎么会向高层次进军?尤其是语文学科涉猎的范围 很广,要真正提高学生的写作水平,单靠分析文章的写作技巧是 远远不够的,必须从基础知识抓起,每天挤一点时间让学生“死记”名篇佳句、名言警句,以及 丰富的词语、新颖的材料等。这样,就会在有限的时间、空间里 给学生的脑海里注入无限的内容。日积月累,积少成多,从而收到 水滴石穿,绳锯木断的功效。 要练说,得练听。听是说的前提,听得 准确,才有条件正确模仿,才能不断地 掌握高一级水平的语言。我在教学中, 注意听说结合,训练幼儿听的能力,课 堂上,我特别重视教师的语言,我对幼 儿说话,注意声音清楚,高低起伏,抑 扬有致,富有吸引力,这样能引起幼儿 的注意。当我发现有的幼儿不专心听别 人发言时,就随时表扬那些静听的幼儿,或是让他重复别人说过的内容,抓住教 育时机,要求他们专心听,用心记。平 时我还通过各种趣味活动,培养幼儿边 听边记,边听边想,边听边说的能力, 如听词对词,听词句说意思,听句子辩 正误,听故事讲述故事,听谜语猜谜底,听智力故事,动脑筋,出主意,听儿歌
上句,接儿歌下句等,这样幼儿学得生 动活泼,轻松愉快,既训练了听的能力, 强化了记忆,又发展了思维,为说打下 了基础。 教师范读的是阅读教学中不可缺少的部 分,我常采用范读,让幼儿学习、模仿。 如领读,我读一句,让幼儿读一句,边 读边记;第二通读,我大声读,我大声 读,幼儿小声读,边学边仿;第三赏读, 我借用录好配朗读磁带,一边放录音, 一边幼儿反复倾听,在反复倾听中体验、 品味。人教五年级语文上册词语积累分 类整理 第1单元 词语积累 绿林好汉滚瓜烂熟中西贯通古今贯通文理贯通毫 不犹豫流光溢彩呐喊助威津津有味天长日久 如醉如痴浮想联翩泪落如珠囫囵吞枣不求甚解 悲欢离合牵肠挂肚如饥似渴不言而喻花纹驳杂 黯然神伤千篇一律沉甸甸天高气爽云淡日丽香 飘四野别出心裁与众不同大显身手眼泪花花 真情实感心安理得念念不忘呕心沥血 【与读书有关的词语】 学富五车博古通今满腹经纶手不释卷一目十行【表示爱读书的词语】 如饥似渴隔篱听讲织帘诵书挑灯苦读圆木警枕【带“书”字的词语】 知书达理无巧不成书书香门第 第2单元
化学元素周期表存在严重错误
化学元素周期表存在严重错误 (一)表中出现明显的错误与不足化学元素周期表是化学学科的经典理论工具表,是自然学科中最有成效,最完整、最系统的理论规律表。它是世界各国无数科学工作者在不同地区以各种不同研究方式,采用各种科技手段经过无数次的磋磨、分析得出各种不同或相同的化学理论,共同综合,溶合、汇聚、整理、编制成的化学元素性质变化规律表。所以它是无数科技智慧的最高结晶,是一块不朽的科技丰碑,是人类征服自然、认识自然、初步掌握自然的重要工作。在这半个多世纪以来,推进化学事业在全世界普遍地蓬勃地发展,使各项科技事业得到很大的促进与发展。 化工产品充实到家家户户,充实到人类生活的各个方面。在人类社会高速发展的高科技时代中,化学元素周期表立下了无数的杰出功勋。但是化学元素周期表和其它学科的各种理论一样,都在一定的时代局限的环境中诞生,也在一定局限性的时代条件下应用,难免存在着当时各种不足因素的片面影响或时代局限,存在着这样或那样的误差与不足,这是难免的,也是科技理论从不完整到完整,从不成熟到成熟的必然发展规律。由于化学元素周期表涉及面宽、应用范围广,所以纠正它存在的差错是极其重要的大事。在我国,正在学习使用化学元素周期表的大、中学生有上亿万名以上。还有各行各业的科学工作者、技师、技术人员、研究人员,以及正在攻读研究生、博士生的人才不计其数。尤其是广大的教师更应该弄清这些差错,不能再将这错误的东西传授给学生。现在我们先来讲讲化学元素周期表中出现的明显错误与不足。这里所讲的“明显”是指包括初中生在内的一切所有学习使用过化学元素周期表的人们。只要稍加注意,或多作比较、对照,就可直接发觉化学元素周期表中有很多自相矛盾、解释不清的地方,我们称这些直接可以在本表范围内觉察到其错误的地方为“明显”的错误之处。当然在这些明显错误的启示之下,深入钻研必然就会发现更严重的差错。 一、出现在第二周期中的明显错误在化学元素周期表第二周期有锂、硼、碳、氮、氧、氟、氖8个元素,从表面上看,它们从左到右依次由活泼金属到不活泼的非金属元素,又从不活泼的非金属元素直至最活泼的非金属元素,最后是周期分界元素惰性气体。好象与其它周期上的元素排列的周期性基本相
元素周期表知识大全
一、元素周期表的结构 (一)编排三原则: 1. 按原子序数递增顺序从左到右排列。 2. 将电子层数相同的元素排列成一个横行。 3. 把最外电子层的电子数相同的元素按电子层数递增的顺序由上而下排列成纵行。 (二)周期:具有相同电子层数的元素按照原子序数递增的顺序排列的一行,叫周期。 (1)周期序数= 电子层数。周期序数用阿拉伯数字表示。 (2)元素周期表目前有7个周期。 第1、2、3周期称为短周期,分别含有2、8、8种元素;第4、5、6、7周期称为长周期,分别含有18、18、32、26种元素;第7周期又称为不完全周期。 (三)族 (1)元素周期表有18个纵行,称为族,共16个族。族序数用罗马数字表示。 (2)元素周期表中含有7个主族(ⅠA族~ⅦA族)、7个副族(ⅢB族~ⅦB族、ⅠB族~ⅡB族)、1个第Ⅷ族(三个纵行)和1个0族(稀有气体)。 (3)主族元素族序数= 最外层电子数。 (4)稀有气体元素化学性质不活泼,很难与其他物质发生化学反应,把它们的化合价定为0,因而叫做0族。 二、元素的性质与元素在周期表中位置的关系 (一)元素的金属性和非金属性与元素在周期表中位置 1、同周期从左到右,元素的金属性减弱,非金属性增强。 2、同主族从上至下,元素的金属性增强,非金属性减弱。 3、 (1 (2 域; (3 1 2、主族元素化合价的判断。 (1)元素最高正化合价的数值=族的序数=最外电子层电子数(即价电子数) (2)非金属元素最低负化合价的绝对值=8-其最高正化合价
三、元素周期律和元素周期表的意义 1869年,门捷列夫发现了元素周期律,并编制了第一张元素周期表。元素周期表是学习研究的一种重要工具。门捷列夫用元素周期律预言了未知元素,为发现新元素提供了线索。元素周期律与元素周期表可以指导工农业生产。 【典型例题】 [例1] 对比下列两组元素性质: (1)下列各组元素最高价氧化物对应的水化物碱性逐渐减弱、酸性逐渐加强的是( ) A. NaOH 、2)(OH Mg 、43PO H 、42SO H B. KOH 、NaOH 、42SO H 、4HClO C. 2)(OH Ca 、2)(OH Ba 、4HBrO 、4HClO D. 2)(OH Mg 、2)(OH Ba 、43PO H 、42SO H (2)下列各组气态氢化物稳定性由强到弱的顺序正确的是( ) A. 4SiH 、3PH 、S H 2、HCl B. HF 、HCl 、HBr 、HI C. 3PH 、S H 2HCl 、HF D. 3NH 、3PH 、3AsH 、HF 精析: (1)A 项第三周期的Na 、Mg 、P 、S 四元素最高价氧化物的水化物的碱性逐渐减弱,酸性逐渐增强。B 项钾、钠是同主族,钾在钠的下方,则KOH 的碱性大于NaOH 的碱性。钠、硫、氯又是同一周期元素且按原子序数增加顺序排列的,由同周期元素组成最高价氧化物的水化物的碱性逐渐减弱,酸性逐渐增强的规律,推断出NaOH 、42SO H 、4HClO 符合此规律。C 项2)(OH Ca 与2)(OH Ba 的碱性22)()(OH Ca OH Ba ,因同主族钡在钙下方,碱性强。不难推断C 项不符题意。D 项Mg 、Ba 同主族,钡在下面碱性强于2)(OH Mg 与C 项相似。 (2)是气态氢化物稳定性的对比,这就需要对比元素的非金属性强弱。先确立元素位置再根据递变规律进行推断。A 项硅、磷、硫、氯分别是14、15、16与17号元素且在同一周期,其非金属性逐渐加强,故其氢化物稳定性逐渐增强,不符合题意。B 项氟、氯、溴、碘是VIIA 族卤素且按原子序数递增顺序排列的。其气态氢化物稳定性由强到弱,符合题意。C 项磷、硫、氯是同周期按原子序数递增排列的,其非金属性逐渐增强,气态氢化物稳定性逐强。氯、氟同主族其气态氢化物稳定性也是逐渐加强,不符合题意。D 项氮、磷、砷是按原子序数递增排列的,同主族元素其气态氢化物稳定性逐渐减弱,符合题意。但氮、氟同周期,氟位于氮的右方,非金属性强,当然更强于磷、砷的非金属性,从整体看不符合题意。 答案:(1)A 、B (2)B
