注册电气工程师 普通化学知识点总结(可打印版)

注册电气工程师普通化学知识点总结一、物质的结构与状态
(一)波函数Ψ
Ψ(n,n,n),确定一个原子轨道:
主量子数n:电子离核的远近和电子能量的高低,n越大,电子能量越高。
n = 1, 2, 3, 4, ...
角量子数l:亚层,确定原子轨道的形状;对于多电子原子,与n一起确定原子轨道的能量。l = 0, 1, 2, ..., n-1
磁量子数m:确定原子轨道的空间取向。
一个电子层内,波函数Ψ数目=n2
Ψ(n,l,m,m s),确定一个电子完整的运动状态。
自旋量子数m s:电子自身两种不同的运动状态。
m s= ±1/2
(二)原子核外电子分布三原则
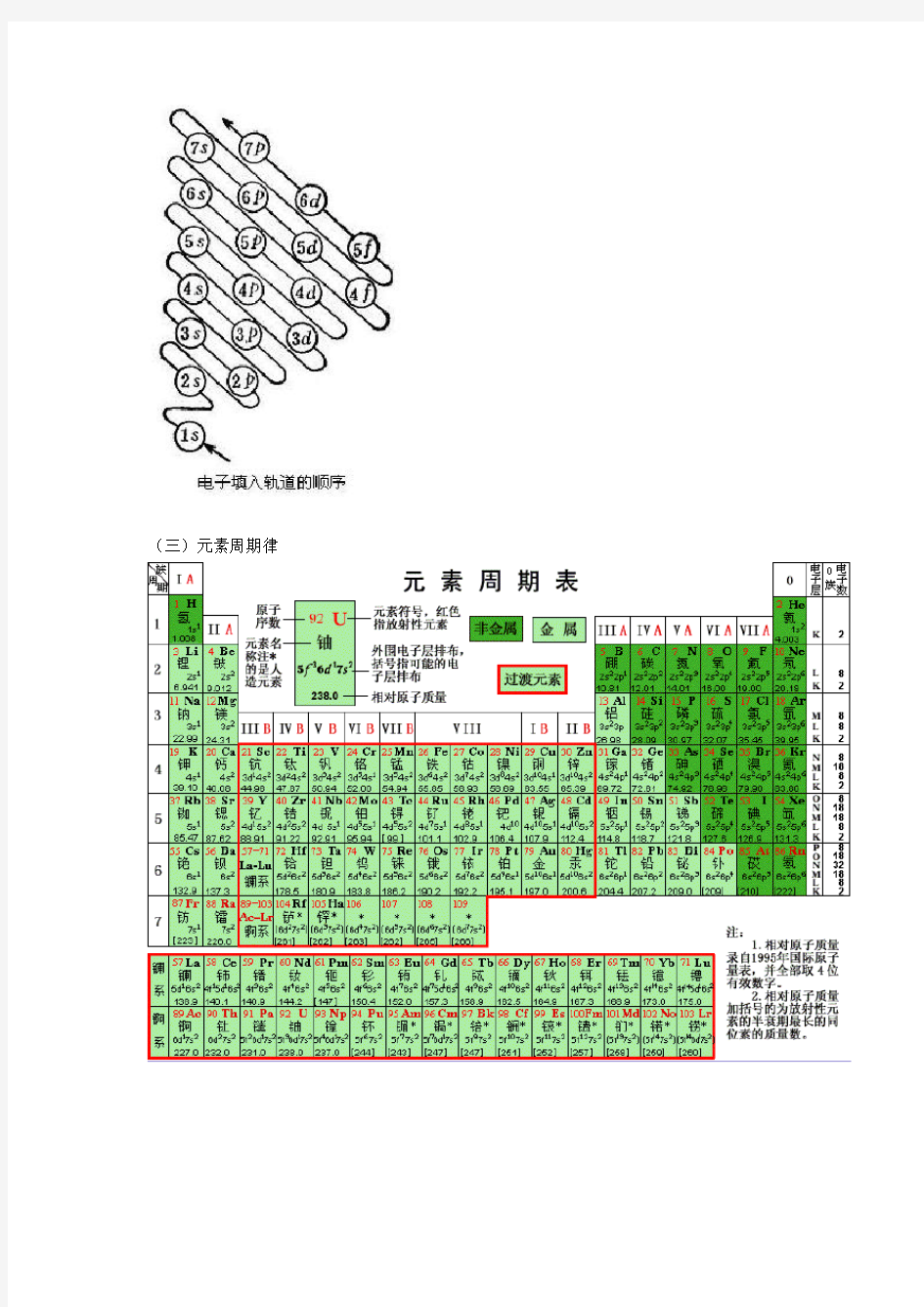
1)能量最低原理:电子由能量低的轨道向能量高的轨道排布(电子先填充能量低的轨道,后填充能量高的轨道.
2)Pauli(保利)不相容原理:每个原子轨道中只能容纳两个自旋方向相反的电子(即同一原子中没有运动状态完全相同的电子,亦即无四个量子数完全相同的电子).
3)Hunt(洪特)规则:电子在能量简并的轨道中, 要分占各轨道,且保持自旋方向相同. 保持高对称性, 以获得稳定. 包括: 轨道全空, 半充满,全充满三种分布.
(三)元素周期律
元素在周期表中的分区
(四)化学键与分子结构
σ键:头碰头
氢键
物质的熔点与沸点
同类型的单质和化合物,一般随摩尔质量的增加而增大。含有氢键的比不含的要大。
物质的溶解性
相似者相溶,(非)极性易溶于(非)极性。
(五)晶体结构
离子晶体,离子电荷与半径规律如下:
1)同一周期,从左到右,电荷数增多,半径减小;
2)同一元素,电荷数增多,半径减小;
3)同一族,从上到下,离子半径增大;
(六)物质状态
1)理想气体的状态方程:
①摩尔表示:
克拉珀龙方程pV=nRT
其中p为气体压强,单位帕斯卡(帕 Pa)
V为气体体积,单位为立方米(m3)
n为气体的物质的量,单位为摩尔(摩 mol)
T为体系的热力学温度,单位开尔文(开 K)
R为比例常数,单位是焦耳/(摩尔·开),即J/(mol·K)
对任意理想气体而言,R是一定的,约为8.31441±0.00026 J/(mol·K).
②质量表示:
pV=mrT
此时r是和气体种类有关系的,r=R/M,M为此气体的平均分子量
③分子数表示:
pV=NKT
N为分子数
K为波尔兹曼常数,K=1.38066×10-23J/K
2)道尔顿分压定律
气体混合物总压力等于各组分气体分压总和:
p=p
a +p
b
+...
混合气体中某组分气体的分压等于总压力乘以该组分气体的摩尔分数:
p i =(n
i
/n)*p=x
i
p
式中x i为摩尔分数
二、溶液
(一)溶液溶度
1)质量分数(%)= 溶质的质量(g)/溶剂的质量(g)· 100%
2)物质的量溶度(c) = 溶质的物质的量(mol)/溶液的体积(dm3)
3)质量摩尔溶度(m)= 溶质的物质的量(mol)/溶液的质量(kg)
4)摩尔分数(x)=
溶质(或溶剂)的物质的量(mol)/溶质的物质的量(mol)+ 溶剂的物质的量(mol)(二)拉乌尔定律
①蒸气压下降?p=
n B
n A+n B
?p0
n A溶剂摩尔数,n B溶质摩尔数,p0溶剂的蒸气压
②沸点上升?T b=K b?m
K b溶剂的摩尔沸点上升常数(K·kg/mol),m质量摩尔溶度③凝固点下降?T f=K f?m
K f溶剂的摩尔凝固点下降常数(K·kg/mol),m质量摩尔溶度
④渗透压π=cRT=nRT V
V为溶液的体积,n为溶质的物质的量,c为物质的量溶度
以上性质仅与溶液中溶质的粒子数相关,称为溶液的依数性。
(三)依数性的大小比较
1)沸点和渗透压
A2B或AB2型强电解质溶液 > AB型强电解质溶液 > 弱电解质溶液 > 非电解质溶液
2)凝固点和蒸气压
A2B或AB2型强电解质溶液 < AB型强电解质溶液 < 弱电解质溶液 < 非电解质溶液
(四)弱电解质溶液的解离平衡
①水的电离平衡
水的离子积:K w=c(H+)?c(OH),25℃时K w=1.0×10-14
pH值:pH=?lg{c(H+)} ,pOH=?lg{c(OH?)},pH+pOH=14
②一元弱酸的解离平衡
解离常数K a只与温度有关,越大则酸性越强。
K a<10?4时,c(H+)≈√K a C a,解离度n≈√K a/C a,其中C a为酸的物质的量溶度
②一元弱碱的解离平衡
解离常数K b只与温度有关,越大则碱性越强。
K b<10?4时,c(H+)≈√K b C b,c(OH?)=K w/c(H+)c,其中C b为碱的物质的量溶度
③多元弱酸的解离平衡
K a1?K a2,忽略二级解离,可近似按一级解离处理,c(H+)≈√K a1C a
④盐类水解平衡及溶液的酸碱性
1)强碱弱酸:溶液呈碱性,K h=K w/K a
2)强酸弱碱:溶液呈酸性,K h=K w/K a
3)弱酸弱碱:视K a,K b相对强弱大小
4)强酸强碱:溶液呈中性,pH=7
⑤同离子效应
弱电解质溶液中,加入相同离子的强电解质,使得弱电解质的解离度降低。
⑥缓冲溶液
1)弱酸-弱酸盐:过量的弱酸和强碱反应后的溶液,
如过量HAc和NaOH, 反应后为HAc-NaAc
2)弱碱-弱碱盐:过量的弱碱和强酸反应后的溶液,
如过量NH3?H2O和HCl,反应后为NH3?H2O?NH4Cl
3)多元酸-酸式盐:多元酸的两种不同酸式盐,
如H2CO3?NaHCO3,NaHCO3?Na2CO3,NaH2PO4?Na2HPO4
pH值计算
c(H+)=K a?c(酸)
c(盐)
,c(OH?)=K a?
c(碱)
c(盐)
配置一定pH值的缓冲溶液,应使共轭酸的pK a≈pH
(五)难溶电解质的多相解离平衡
①溶度积常数
沉淀溶解平衡:A n B m=nA m++mB n+
溶度积:K s={c(A m+)}n{c(B n?)}m在一定温度下为一常数②溶解度S(mol/dm3)
③溶度积规则
非平衡状态Q={c(A m+)}n{c(B n?)}m
Q
④同离子效应
难溶电解质溶液中,加入相同离子的易溶电解质,使得难溶电解质的溶解度降低。三、化学反应速率及化学平衡
(一)反应热
等压反应热:焓变数值上等于等压热效应,?U=q p,?H时放热,?H时吸热。
盖斯定律:在恒容或恒压的条件下,化学反应的反应热只与反应的初态和终态有关,而与变化的途径无关。
若反应(3)= 反应(1)±反应(2),则?H3=?H1±?H2
物质的标准摩尔生成焓:?f H m(单质,298.15K)=0
反应的标准摩尔焓变:对于反应:aA+bB=gG+dD,
?r H m(298.15K)
={g?f H m(G,298.15K)+d?f H m(D,298.15K)}
?{a?f H m(A,298.15K)+b?f H m(B,298.15K)},
单位kJ/mol
反应的焓变基本不随温度而变。
(二)化学反应速率
温度升高,速率常数(正、逆)升高,反应速率升高。
增大浓度,活化分子增多,反应速率升高。
活化能Ea越低,速率常数(正、逆)升高,反应速率升高。
催化剂改变反应历程,降低反应活化能,提高反应速率,但本身保持不变。
(三)化学反应方向判断
反应但熵变基本不随温度而变化。
①吉布斯自由能判断反应方向
②反应商判断反应方向
四、氧化还原反应及电化学
(一)基本概念
失去电子的反应为氧化反应,失去电子的物质是还原剂,如Zn?2e?1=Zn2+,化合价升高。
得到电子的反应为还原反应,得到电子的物质是氧化剂,如Cu2++2e?1=Cu,化合价降低。
歧化反应:同一物质的化合价既升高又降低。
(二)原电池
1)负极:氧化反应,正极:还原反应
2)Zn+Cu2+=Zn2++Cu,
3)反应图式:
(三)电极电势
任何温度下,标准氢电极电势为零,
标准电极电势:标准条件下,电极相对于标准氢电极的电极电势,一定温度下为一常数。(四)能斯特方程
(五)氧化剂、还原剂强弱
电极电势的代数值越大,电对中氧化态物质氧化性越强,还原态物质还原性越弱。
(六)金属的腐蚀与防护
电化学腐蚀,发生氧化反应的负极称为阳极,发生还原反应的正极称为阴极。
阴极保护法:牺牲阳极保护法、外加电流法,被保护金属作为阴极。
五、有机化学
(一)烃
(二)烃的衍生物
(三)链烃及其衍生物的命名原则
(四)有机物的重要化学反应
①氧化反应
1)双键的部分氧化
2)三键的部分氧化
3)芳烃的氧化
烷基取代基氧化为羧基。
4)醇的氧化
被氧化能力:伯醇>仲醇>叔醇,伯醇-》醛-》羧酸,仲醇-》酮,叔醇不易氧化。5)醛的氧化
被氧化能力:醛>酮,被氧化成羧酸。多伦试剂、裴林试剂区分醛和酮。
②取代反应
烷烃和芳烃,氢原子被其他原子或原子团代替。
③消去反应
从化合物中消去一个小分子化合物(HX、H2O等)的反应。
1)醇的消去,脱水。
2)卤代烃的消去,HX。
3)醛的消去,脱水。
④加成反应
不饱和键的π键断裂,两个一价的原子或原子团加到不饱和键的两个碳原子上。
(完整版)苏教版化学必修一知识点总结
苏教版化学必修1 专题知识点 物质的分类及转化 物质的分类(可按组成、状态、性能等来分类) 物质的转化(反应)类型 四种基本反应类型:化合反应,分解反应,置换反应,复分解反应 氧化还原反应和四种基本反应类型的关系 氧化还原反应 1.氧化还原反应:有电子转移的反应 2. 氧化还原反应实质:电子发生转移 判断依据:元素化合价发生变化 氧化还原反应中概念及其相互关系如下: 失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)氧化还原反应中电子转移的表示方法 双线桥法表示电子转移的方向和数目 注意:a.“e-”表示电子。 b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素, 应标出“得”与“失”及得失电子的总数。 c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂 d.被氧化得到的产物是氧化产物,被还原得到的产物是还原产物 氧化性、还原性强弱的判断 (1)通过氧化还原反应比较:氧化剂+ 还原剂→ 氧化产物+还原产物氧化性:氧化剂> 氧化产物
还原性:还原剂> 还原产物 (2)从元素化合价考虑: 最高价态——只有氧化性,如Fe3+、H2SO4、KMnO4等; 中间价态——既具有氧化性又有还原性,如Fe2+、S、Cl2等; 最低价态——只有还原性,如金属单质、Cl-、S2-等。 (3)根据其活泼性判断: ①根据金属活泼性: 对应单质的还原性逐渐减弱 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 对应的阳离子氧化性逐渐增强 ②根据非金属活泼性: 对应单质的氧化性逐渐减弱 Cl2Br2I2S 对应的阴离子还原性逐渐增强 (4) 根据反应条件进行判断: 不同氧化剂氧化同一还原剂,所需反应条件越低,表明氧化剂的氧化剂越强;不同还原剂还原同一氧化剂,所需反应条件越低,表明还原剂的还原性越强。 如:2KMnO4 + 16HCl (浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O MnO2 + 4HCl(浓) =△= MnCl2 + Cl2↑ + 2H2O 前者常温下反应,后者微热条件下反应,故物质氧化性:KMnO4 > MnO2 (5) 通过与同一物质反应的产物比较: 如:2Fe + 3Cl2 = 2FeCl3Fe + S = FeS 可得氧化性Cl2 > S 离子反应 (1)电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。 注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。 (2)离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。 复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。 离子方程式书写方法: 写:写出反应的化学方程式 拆:把易溶于水、易电离的物质拆写成离子形式 删:将不参加反应的离子从方程式两端删去 查:查方程式两端原子个数和电荷数是否相等 (3)离子共存问题 所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。 1、溶液的颜色如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-
研发工程师工作总结
研发工程师工作总结 篇一:XX年终工作总结研发工程师 XX年个人年终总结报告 时间飞逝,转眼一年又即将过去,来公司三年半了,首先非常感谢公司领导平时的耐心指点以及各位同事的关心帮助,让我在工作中得到不断成长和磨练,同时也领悟了很多为人处事的道理。学会真诚待人,努力严格要求自己,实实在在地努力工作,少言多行,尽职尽责做好自己的本职工作。通过多看书多学习来不断提高自身的修养素质和工作能力,做到平静于心,自律于行。下面我对XX年这一年来的工作、收获以及XX年努力的方向及自我要求进行总结如下: 1、总结XX年度个人与部门的收获与不足: 这一年来,本人爱岗敬业,从不迟到早退,本着实事求是的做事原则,认真遵守公司内部的规章制度以及员工手册,虚心向自己的上级领导和同事求教,认真学习和巩固自己的专业知识和技能,做好自己本职工作。通过不断的学习和培训,熟知公司的体系文件、质量管理体系知识,熟悉自己的岗位职责及作业指导书,日常做好5S工作,通过不断学习来掌握公司产品的检测方法,学会锡膏、锡线、助焊剂的非常规检验方法,协助编制或修改产品相关的技术工艺文件,协助领导解决客户在产品应用中出现的问题。现在的实验技能操作方面也比较专业化、规范化了,对自己检测的结果数
据一直持负责任的态度,不弄虚作假。工作中,遇到问题,及时向自己的上级领导反馈情况,做到有效地解决分析问题。平时积极主动认真地查阅资料,协助领导购买评估需要完善的仪器设备,不断完善公司产品、包材的质量允收标准。不断完善及规范公司产品的生产工艺及检验标准等体系文件,协助翻译产品的英文资料。认真配合并协助部门其他同事的工作需要,团结一致,齐心协力,积极有效地完成公司上级领导交待的各项工作任务。 这一年里,个人与部门在工作上都收获了不少,但也存在这样、那样的不足之处。所以自我评价是88分,不够优秀,现将问题总结如下: 个人不足:还存在很多不足之处,第一是不够谦卑,好胜心强,比如与人沟通时,有时会比较急躁,急于表述自己的观点,有点自我为中心,导致没有站在对方的立场去思考问题。第二是不够沉稳、淡定,容易自己生闷气,不够宽容他人无心的过错,没能做到虚心地接受他人善意的批评、教诲。第三是未能够保持一颗平静的心,得失心太重,遇到不顺心的事会心浮气躁,偶尔还会抱怨,没能做到失意时坦然,得意时泰然。第四还不够好学,没能坚持每天都学习,只有心情好有空时才端起书本学习他人的为人处事方法。第五不够有仁慈心,还是有分别心,经常遇到那些行乞或者需要帮助的路人都要考虑下才会施舍,甚至看到那些四肢健全的年
工程师技术工作总结
工程师技术工作总结 工程师技术工作总结 本人从参加工作以来 严格地遵守国家的各项法律和法规 从未 参与各种违法违纪的活动。坚决拥护中国共产党的领导,坚持党的改 革开放,为建设中国有特色的社会主义作出自己应有的贡献。对于单 位制订的各项规章制度,我都严格遵守,严从律己,宽以待人,起着 带头的作用。在工作中,我不断地学习、钻研、总结经验和教训,从 一个建筑行业的“门外汉”到现在的专业技术能力和管理能力都全 面成熟的工程资料技术员,独立承担过房建、桥梁、道路和排水工程 等资料工作,在政治思想、职业道德、专业水平等方面都取得了很大 的成绩,现总结如下: 一、 工作态度和职业道路 由于资料员的工作本身就比较繁琐, 但进入公司以来我一直以积 极工作态度去处理工作中遇到的事情,虽然偶尔会出现一些情绪问 题,但我很快能够处理好自身问题,积极投入到工作中去,对工作勤 勤恳恳、任劳任怨,有始有终,能够正确认真的对待每一项工作;认 真学习公司的各项规章制度,认真遵守劳动纪律,保证按时出勤,对 于再苦再累的项目,我都坚持圆满完成,并做出成效,从不计较个人 得失,坚守在岗位上,完成一个个工程,看着一幢幢高楼大厦和一条 条的银灰大道竣工完成,我心中感到无比地自豪和光荣,自己曾经付 出的无数艰辛和汗水,得到了社会的好评,我内心也就无怨无悔,心 满意足了。 二、 学识水平、专业能力 在工作中,我不断地学习文化知识和专业知识,努力提高自己的 学识水平和专用能力。对于建筑行业的新规范、
新标准和新定额,每 一次一出台,我必购买并认真学习和研究,掌握新规范、新标准和新 定额,把规范、标准和定额应用于工程建设中,不断地总结经验和教 训。每一个工程竣工验收时,我都认真作好工程验收记录,并整理成 册,存入自己的工程竣工验收记录档案中,经常分析和研究竣工验收 记录,发现自己在工程修建中存在哪些问题,哪些方面值得提高,哪 些方面值得继续发扬。 三、技术资料员工作的一些心得: 技术资料员工作的一些心得: 、明确责任分工,督促流程执行。 及时收集整理,及时问题反 馈。 定期资料整改, 再次资料核查。 目录及时跟进, 完美资料归档。 通过以上措施,及时发现了问题,并在第一时间进行了整改,坎坷而 又圆满地通过了一次次检查。 、施工技术资料严格受控:施工技术资料是指导正确、规范、 科学施工的文件,以及工程变更情况的正式文件,而且变更、洽商、 图纸会审要经过设计、 建设单位签字, 施组、 方案要经过公司级审批, 交底要施工队签认。一旦遇到工程纠纷或其它特殊情况,此类情况是 解决纠纷的最基本、最重要的资料,因此,对此类资料要严加管理, 一般不外借,谨防丢失,不得不借时,执行严格的借阅登记制度。另 外,本工程边设计边施工,工程变动频繁,设计变更、工程洽商多。 设计变更、 工程洽商直接影响到施工进展、 工程结算。 如果因为变更、洽商传不及时而造成经济损失, 那么整个项目部的辛苦工作便失去了 意义。因此,一定要及时把变更、洽商发放到项目部相关人员手中, 并由技术人员在第一时间内以交底形式传达到施工最前线的施工队。 、施工测量记录要图示详尽:施工测量记录是确保工程定位、 尺寸、标高、位置等的资料。 “失之毫厘,谬之千里” ,由于放线的疏 忽给后续施工带来麻烦的例子
(苏教版)九年级上册化学知识点总结
三一文库(https://www.360docs.net/doc/1d6968826.html,)/初中三年级 〔(苏教版)九年级上册化学知识点总结 [1]〕 (1)单质与氧气的反应:(化合反应) 1. 镁在空气中燃烧 2. 铁在氧气中燃烧: 3. 铜在空气中受热: 4. 铝在空气中燃烧: 5. 氢气中空气中燃烧: 6. 红磷在空气中燃烧: 7. 硫粉在空气中燃烧: 8. 碳在氧气中充分燃烧: 9. 碳在氧气中不充分燃烧: (2)化合物与氧气的反应: 10. 一氧化碳燃烧: 11. 甲烷燃烧 12. 酒精燃烧: 13.加热高锰酸钾:(实验室制氧气原理1)14.过氧化氢分解: 15.水在直流电的作用下分解:16.生石灰溶于水: 17.二氧化碳可溶于水: 18.镁燃烧: 19 铁和硫酸铜溶液反应: 20.氢气还原氧化铜 21. 镁还原氧化铜 23. 碳充分燃烧: 24.木炭还原氧化铜: 25.焦炭还原氧化铁:
26.大理石与稀盐酸反应(实验室制二氧化碳): 27.碳酸不稳定而分解: 28.二氧化碳可溶于水: 29.高温煅烧石灰石(工业制二氧化碳): 30.石灰水与二氧化碳反应(鉴别二氧化碳): 31.一氧化碳还原氧化铜: 32.一氧化碳的可燃性: 33.碳酸钠与稀盐酸反应(灭火器的原理): 34. 锌和稀盐酸 35. 铁和稀盐酸 36. 铁和硫酸铜溶液反应: 二、常见物质的颜色的状态 1、白色固体:MgO、P2O5、CaO、、KClO3、KCl、、NaCl、无水CuSO4;铁、镁为银白色(汞为银白色液态) 2、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O4▲KMnO4为紫黑色 3、红色固体:Cu、Fe2O3 、HgO、红磷 4.硫:淡黄色 6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色) 7.(2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒) 三、化学之最 1、地壳中含量最多的金属元素是铝。 2、地壳中含量最多的非金属元素是氧。
2020软件工程师年终工作总结以及工作计划范文
总结是应用写作的一种,是对已经做过的工作进行理性的思考。那么软件工程师年终工作总结以及工作计划该怎样写呢?下面就是给大家带来的软件工程师年终工作总结以及工作计划,希望大家喜欢! 软件工程师年终工作总结以及工作计划 (一) 我于20 年月加入至今,严格履行软件工程师的岗位职责,认真学习,努力工作,较好地完成了本职工作和领导交给的各项任务。在这年终之际,现对来公司20 年的时间里所作的工作汇报如下: 一、思想政治表现 能认真学习马列主义、毛泽东思想和邓小平理论,拥护党的领导,坚持四项基本原则,热爱祖国,遵纪守法,具有良好的思想素质和职业道德,能用的要求来指导自己的行动。积极要求进步,团结友善,明礼诚信。 二、工作情况 1、新产品研发:由于我参加工作较长,在软件行业领域这么多年来积累了丰富的经验。刚进入公司被划分到产品小组,参与了此产品的需求收集、分析、设计编码工作。此产品的前台控制端的框架设计是我采用当今流行的先进技术架构搭建而成。目前此产品雏形已经完毕,处在后期测试完善阶段。当初由于部门人手不够,我与我的搭档相互鼓励,还有部门领导的大力支持,我们每天充满激情的迎接自己的工作。回过头来,看到自己辛勤工作的成果,还是欣慰的。 2、综合事务管理:日常事务性工作都是些琐碎的事情,统计考勤,报销费用、部门审计工作等等。以前我一直做得是自己的专业知识工作,初次接受这些琐碎的工作时我就告诫自己做就要做好,一定做到腿勤、口勤。使票据及时报销,账目清楚,协助领导建立健全各项制度,保持良好的工作秩序和工作环境,使各项管理日趋正规化、规范化。完成办公日常用品购置、上下沟通、资料报刊订阅等日常事务,各类事项安排合理有序。整理部门工作周报、月报,为部门工作的正常开展提供了有效保证。 3、部门项目/产品进度跟踪及归档:我担负着部门项目/产品的进度跟踪工作,为保证文档、代码版本的准确性,我主动联系质量保障部在公司服务器上给我们部门开通了空间并且给部门每位员工开通了自己的账户,定时督促部门相关成员把文档与产品代码维护到版本控制服务器上,现在大家已养成习惯,要找文档模板、公司制度等等都会自动去此服务器上寻找,项目阶段性文档,代码也会自动维护进去,我会定时察看并监督。这样保障了代码准确性,公司成果不流失,同时也为同事工作提供便利。 三、存在不足 行业对于我来说是个全新的行业,还有目前工作较繁杂,从而无法进一步提高自己的工作能力。再说计算机领域是个宽广的领域,技术发展是日益月新,计划下一年合理的安排自己的工作,使自己的业务知识与技术水平更有所提高。
工程师技术工作总结范文(新编版)
工程师技术工作总结范文(新 编版) Through the summary, we can fully and systematically understand the past work situation, and can correctly understand the advantages and disadvantages of the past work. ( 工作总结 ) 部门:______________________ 姓名:______________________ 日期:______________________ 编号:MZ-SN-0363
工程师技术工作总结范文(新编版) 工程师技术工作总结范文 作为一名硬件工程师,但在我心中,xxx就是我的家,领导就是我的家长,同事就是我的兄弟姐妹,德容的事就是我自己的事,我要通过我自己的不懈努力将公司的项目做到完美,使得我们xx的产品能够尽快推向市场。我明白作为xxx的一名硬件工程师的责任与义务。回顾过去的一年我将我的工作总结以下几个方面:在过去的这一年中,我从对公司项目的熟悉,逐步成长到可以承担公司项目的部分模块,并且在这些方面为公司做出了应有的贡献,对我个人而言自己的能力也得到了相应的提高。但是公司的项目复杂,要学习的东西还有很多,因此我要继续努力,对项目中的细节和难点更加深入的理解,希望通过自己的努力看到产品的完美
诞生。 在这一年里我主要完成了以下任务: 1、在20xx年的基础上对电台的各项指标进行细化和研究,并且根据邓工的建议与民航的指标总结出了我们自己的电台测试方法,并且对我们电台进行了详细测试,根据测试记录对电台进行了各项性能的评估。 2、根据对电台的跟踪测试,陆续整理出了电台现有存在的问题,并且将各个模块的相应参数做出了修改。随后修改了每个模块的原理图,针对发射机频合的小数分频问题、发射机谐波大问题等提出了解决方案。 3、历时一个半月对整个电台的系统原理图进行了整合修改,同时更加明确了整个电台的各路信号含义,为后面的研发与测试奠定了基础。 4、根据发射机的测试数据对发射机做出了相应评估,提出了一些问题,例如功率不稳定、不精确、调制度漂移、失真度大、PTT超时等,随后与西工大配合解决发射机的相关问题。在此期间通过配
注册电气工程师专业考试复习心得精华版q(供参考)
发输变注电(专业考试)复习心得 1、把考试用书通读三遍,再做练习题,把练习题混淆的内容再看两遍。距离考试还有时间,再看两遍考试用书,再做练习题,加深记忆。 3、多看规范和原教科书,教科书上每一节内容多通了考试自然不难,通过就是必然的 4、复习时间2个月,将考试用书看两遍,习题做一遍,参加了考前辅导班,但是认为考前辅导班作用不大,主要是看书,并将规范看一遍,主要熟悉各章内容,熟悉规范的各章内容的位置。在最后可以浏览各章大体内容。 5、专业参考书除《电力工程电气设计手册》(电气一次部分),《工业和民用配电设计手册》(第三版),重要外,还有《钢铁企业电力设计手册》重要,我就是没有《钢铁企业电力设计手册》,所以拖动方面没有作好,但是《钢铁企业电力设计手册》不太好买。 6、考专业,短路计算是不能回避的,跟它有关系的还是比较多的,如果短路计算不会,想专业考试通过是有点难度的 7、我是06年通过供配电考试的,05年参加一次培训,对考试范围有了一定的了解,只复习教材和规范,当年差2分未通过,06年增加一本)《工业和民用配电设计手册》(第三版),我认为重点是吃透规范,无论是教材还是手册,其主要内容都离不开规范。从时间上讲坚持每天一小时。
复习考试技巧 1、按大纲要求通读复习用书,查阅有关规范。弄清概念,不必太多推敲。 2、典型案例和计算一定要掌握。 3、充分利用可选题机会,所以复习知识面尽量放宽。有时电力工程问题很简单,不如做电力工程的问题。 4、题型要求一定要看清楚。历次考试教训多多。 专业考试复习重点 掌握国策:1)大纲中3、4有关安全、节能及谐波防治是近几年的热门话题。安全还包括接地安全;节能还包括照明节能。2)国家规范强制性条文。 掌握电气工程的重点问题: 1)供配电系统有关问题; 2)选址、选型问题,如变电所选址,电器设备、电缆选型等;3)继电保护和自动装置的设计; 掌握有关计算问题:1)负荷计算;2)短路电流计算;3)继电保护整定计算;4)防雷设计计算;5)照度计算;6)电动机启动、制动及保护配置计算。
高中化学(苏教版)知识点总结最终版
专题1 化学家眼中的物质世界 第一单元丰富多彩的化学物质 一、物质的分类 (1)从物质的组成分类:可以从混合物和纯净物、单质和化合物、非金属单质和金属单质、无机化合物和有机化合物等入手将物质进行分类。 (2)从物质的导电性分类:可将物质分为导体和绝缘体。 (3)从物质的状态分类:气体物质、液体物质和固态物质。 (4)从物质在水中的溶解能力分类:可将物资分为可溶、难溶。 另外,还可以从物质的用途、物质的来源等其他角度对它们进行分类。 二、物质的转化 1.物质的性质及其变化 (1)物质的性质 (2)物质的变化 2.无机化学反应一般规律 (1)金属+非金属→无氧酸盐Mg+Cl2MgCl2 (2)碱性氧化物+酸性氧化物→含氧酸盐CaO+CO2=CaCO3 (3)酸+碱→盐+水2HCl+Ba(OH)2=BaCl2+H2O (4)盐+盐→两种新盐AgNO3+NaCl=AgCl↓+NaNO3 一般参加反应的两种盐可溶,反应向生成更难溶物质的方向进行。 (5)金属+氧气→碱性氧化物2Cu+O22CuO (6)碱性氧化物+水→碱CaO+ H2O=Ca(OH)2 一般生成的是可溶性的强碱,如CuO、Fe2O3等不能与H2O反应生成相应的氢氧化物(碱)。
(7) 碱+盐→新碱+新盐 Ca(OH)2+Na 2CO 3=CaCO 3↓+2NaOH (8) 非金属+氧气→酸性氧化物 S+ O 2 SO 2 (9) 酸性氧化物+水→对应含氧酸 SO 3+ H 2O=H 2SO 4 (10) 酸+盐→新酸+新盐 CaCO 3+2HCl =CaCl 2+ H 2O+CO 2↑ 一般要符合强酸制弱酸或高沸点酸制低沸点酸(难挥发性酸制易挥发性酸)。 (11) 盐+金属→新盐+新金属 Zn+CuSO 4=ZnSO 4+Cu 符合盐是可溶性的、金属的活泼性强于新金属、金属活泼性不能太强(K 、Na 、Ca 等与盐溶液接触立即与水反应置换出氢)等条件。 (12) 金属+酸→盐+氢气 Zn+ H 2SO 4= ZnSO 4+H 2↑ 金属与酸反应置换出氢的规律应注意:一是金属在活动性顺序表中应排在氢以前,二是酸不能是氧化性酸(浓硫酸、浓、稀硝酸等) (13) 碱性氧化物+酸→盐+水 CuO+2HCl =CuCl 2+ H 2O (14) 酸性氧化物+碱→盐+水 CO 2+Ca (OH )2= CaCO 3↓+ H 2O (15) 同(7) (16) 同(10) 三、 物质的量 11.物质的量 是表示大量粒子的集合体中的粒子的多少。是国际单位制中的基本物理量, 用符号n 表示。 12.摩尔 是物质的量的单位,每摩尔物质含有阿伏加德罗常数个粒子。摩尔简称摩,符号mol 。 使用摩尔表示物质的量时,应该用化学式指明粒子的种类。不能用于描述宏观物质。 13.阿伏加德罗常数 1mol 任何微粒的集合体中的微粒数叫做阿伏加德罗常数,用N A 表示, 通常使用近似值6.02×1023mol - 1。 物质的量、阿伏加德罗常数与粒子数的关系:n = A N N 四、 摩尔质量 (1) 摩尔质量 1mol 任何物质所具有的质量叫做这种物质的摩尔质量,当物质的质量以克 为单位时,其数值上等于该物质的相对原子质量或相对分子质量。摩尔质量的单位 g·mol - 1,符号为M 。 物质的量、物质的质量和物质的摩尔质量之间存在如下关系:n = M m 五、 物质的聚集状态 (1) 影响物质体积大小的因素有:①微粒数目;②微粒大小;③微粒之间的距离。 (2) 对于固态或液态物质,影响其体积的主要因素是微粒的数目和微粒的大小; 对于气态物质,影响其体积的主要因素是微粒的数目和微粒间距离。 (3) 对于一定量的气体,影响其体积的因素是温度和压强。 温度一定,压强越大,气体体积越小,压强越小,气体体积越大; 压强一定,温度越高,气体体积越大,温度越低,气体体积越小。 六、 气体摩尔体积 (1)气体摩尔体积 单位物质的量的气体所占的体积叫做气体摩尔体积。气体摩尔体积的
研发工程师,工作总结
研发工程师, 工作总结 篇一:XX 个人上半年工作总结研发部技术部工程师 XX年上半年个人工作总结 ——研发部某某某 时光的轮毂滚滚前行,XX年的时光转眼已经过去半年了。这半年的时光,之于公司,是向上,发展的半年,之于我,是学习,收获的时间。 回顾这半年的时间,我在工作上取得了一定的成绩,但也存在了诸多不足。作为一名工程师,我现将我个人工作总结如下,敬请各位领导及同事提出宝贵意见及建议。 一、工作总结 在过去半年,是忙碌充实的半年,非标准项目的增加及公司业务的发展,对我在负责相关项目时的效率提高与质量保证有了更高的要求。在这半年里,我主要完成了某某项目(列举数个)等项目的设计和图纸绘制工作。在此期间还参与了某某项目的结构改制,更新及完善;在这过去的半年里,工作量和项目难度要求的不断提升,对我既是挑战又是一种鞭策,让我明白,只有不断学习,改良工作方法,才能更好地胜任这一工作,而我,也在不断地尝试努力着。在这段时间里,我在完成相关任务的同时,也不断地优化改进着相关设计的细节设计,以便满足装配,外观等要求,进一及提升设备的兼容性,操作实用性及标准化程度。 而在这过去的半年时间里,由于公司部门内部人员的调整,某某
项目工作在人员方面也有所影响,从项目本身的设备而言,其标准化程度目前还较低,且受影响的因素较多,标准化的难度也较大;而在非标项目上,多处结构改动及整体重新设计的情况相对较多,这对工作效率和工作质量有了更高的要求,对我而言也是一个较大的挑战;而在这项目工作中,个人认为项目进度协调工作还是比较重要的,做为主要是客户订单的非标设备,当计划项目中途插入紧急时应该如何处理;我想这是一个需要考虑处理的问题; 当然,有挑战就有收获,在这过去的半年里,从主要负责标准项目到标准非标项目的兼并负责,个人认为在收获上是值得肯定的。领导同事的指导,新项目的摸索,设计研发,使我在实践中有了更进一步的提升。 而收获也让挑战成为了鞭策,让我以更好的状态投入到工作中去。并继续不断改进工作方法,提升技能,争取更好地胜任这一工作. 二、工作中存在的不足在这半年的工作中,虽然我认为自己的努力是值得自已肯定的,但在工作过程中,仍然出现了一些不足,诸如工作方法,项目进度处理有待进一步改进,机械设计技能要进一步提高等。以后我会更加留意并改进以上不足。 三、展望 XX年上半年是公司研发、非标项目较多,常规订单较少 的时间,作为机械研发部团队的成员之一,我会在接下来的时间里继续虚心向周围同事学习,多了解同行业的设备更新情况,拓展知识
工程师个人专业技术工作总结
个人专业技术工作总结 二○一三年四月二十日 个人专业技术工作总结 我于2005年毕业于内蒙古科技大学自动化系测控专业,2006年来到卓资发电厂从事200MW机组热工检修工作。在这5年中,通过自己的不懈努力学习专业技术,不断提高业务水平,从理论到实践,又从实践到理论,将自己在学校里所学到的课本知识和实际有机地结合起来,从而更加充实了自己的头脑,武装了自己的才能,也成为了本专业的岗位和专业技术能手。回顾这几年所走过的历程,充满了对专业技术的学习,对工作岗位的热爱和对工作的勤恳。现总结如下: 一、不断加强学习,严格要求自己,提升自己的综合素质,适应现代化电厂的需要。随着社会的发展和进步,电力生产的发展也越来越走向现代化,我厂的四台机组的除尘、除灰以及除渣系统均采用PLC程控系统控制整个工艺,自动化程度较高。为了更好驾驭系统,需要掌握的知识就必须更加全面,更加扎实,才能适应电力系统的发展,我为了适应现代化电厂的需要,在业余时间对自己加强电脑知识的培训和学习,学习网络知识以及PLC、DCS系统的知识,跟着厂家学习逻辑和组态,为以后的热工主检工作打下了坚实的基础。这期间我对微机的工作原理、构成和组装都有了深入的认识,尤其对电脑的操作更加得心应手,从而使我对现场微机的操作相当熟练,为机组的安全稳定运行得到了保障,为事故处理赢得了时间。 二、来到公司热工专业已有5个年头了,在最近的两年生活中,我担任了热工锅炉组组长,热工汽机组长职务,内心非常内心感谢领导的帮助与指导,在这两年里不仅在专业技术方面有了更全面的发展,而且在为人处事方面有了更多的学习机会 2006年在热工外围组时,从事2年的热工主检职位,外围的热工设备品种很多,但这也给我创造了一个学习的机会,也就是在那是有幸能够了解了DCS控制系统,除渣、除灰系统的PLC逻辑控制,并且在维护中对于测量元件安装位置及其用途有了初步的了解,正是在这2年中的不懈努力才为我以后的道路打下了坚硬的基础
注册电气工程师《供配电》知识点总结
注册电气工程师《供配电》知识点总结 “一寸光阴一寸金,寸金难买寸光阴”时间是宝贵的,但也是无情的。我们应该好好地利用宝贵的时间,来勤奋学习。今天为大家了注册电气工程师《供配电》知识点,更多相关内容请关注应届毕业生。 现代传感器在原理与结构上千差万别,如何根据具体的测量目的、测量对象以及测量环境合理地选用传感器,是在进行某个量的测量时首先要解决的问题。当传感器确定之后,与之相配套的测量方法和测量设备也就可以确定了。测量结果的成败,在很大程度上取决于传感器的选用是否合理。 1)根据测量对象与测量环境确定传感器的类型 要进行—个具体的测量工作,首先要考虑采用何种原理的传感器,这需要分析多方面的因素之后才能确定。因为,即使是测量同一物理量,也有多种原理的传感器可供选用,哪一种原理的传感器更为合适,则需要根据被测量的特点和传感器的使用条件考虑以下一些具体问题:量程的大小;被测位置对传感器体积的要求;测量方式为接触式还是非接触式;信号的引出方法,有线或是非接触测量;传感器的,国产还是进口,价格能否承受,还是自行研制。 在考虑上述问题之后就能确定选用何种类型的传感器,然后再考虑传感器的具体性能指标。 2)灵敏度的选择
通常,在传感器的线性范围内,希望传感器的灵敏度越高越好。因为只有灵敏度高时,与被测量变化对应的输出信号的值才比较大,有利于信号处理。但要注意的是,传感器的灵敏度高,与被测量无关的外界噪声也容易混入,也会被放大系统放大,影响测量精度。因此,要求传感器本身应具有较高的信噪比,尽量减少从外界引入的干扰信号。 传感器的灵敏度是有方向性的。当被测量是单向量,而且对其方向性要求较高,则应选择其他方向灵敏度小的传感器;如果被测量是多维向量,则要求传感器的交叉灵敏度越小越好。 3)频率响应特性 传感器的频率响应特性决定了被测量的频率范围,必须在允许频率范围内保持不失真的测量条件,实际上传感器的响应总有—定延迟,希望延迟时间越短越好。 传感器的频率响应高,可测的信号频率范围就宽,而由于受到结构特性的影响,机械系统的惯性较大,因有频率低的传感器可测信号的频率较低。在动态测量中,应根据信号的特点(稳态、瞬态、随机等)响应特性,以免产生过火的误差 4)线性范围 传感器的线形范围是指输出与输入成正比的范围。以理论上讲,在此范围内,灵敏度保持定值。传感器的线性范围越宽,则其量程越大,并且能保证一定的测量精度。在选择传感器时,当传感器的种类确定以后首先要看其量程是否满足要求。
最新苏教版高中化学全部知识点
高中化学复习知识点 1 高中化学所有知识点整理 一.中学化学实验操作中的七原则 掌握下列七个有关操作顺序的原则,就可以正确解答“实验程序判断题”。 1.“从下往上”原则。以Cl2实验室制法为例,装配发生装置顺序是:放好铁架台→摆好酒精灯→根据酒精灯位置固定好铁圈→石棉网→固定好圆底烧瓶。 2.“从左到右”原则。装配复杂装置应遵循从左到右顺序。如上装置装配顺序为:发生装置→集气瓶→烧杯。 3.先“塞”后“定”原则。带导管的塞子在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏仪器。 4.“固体先放”原则。上例中,烧瓶内试剂MnO2应在烧瓶固定前装入,以免固体放入时损坏烧瓶。总之固体试剂应在固定前加入相应容器中。 5.“液体后加”原则。液体药品在烧瓶固定后加入。如上例中浓盐酸应在烧瓶固定后在分液漏斗中缓慢加入。 6.先验气密性(装入药口前进行)原则。 7.后点酒精灯(所有装置装完后再点酒精灯)原则。 化学反应及其能量变化 化学反应及其能量变化总结 核心知识 氧化还原反应 核心知识 一、几个基本概念 1.氧化还原反应:凡有电子转移的反应,就是氧化还原反应.表现为元素的化合价发生变化. 2.氧化反应和还原反应:物质失去电子的反应(体现为元素化合价有升高)是氧化反应;物质得电子的反应(体现为元素化合价降低)是还原反应. 3.氧化产物和还原产物:还原剂在反应中失去电子后被氧化形成的生成物为氧化产物.氧化剂在反应中得电子被还原形成的生成物为还原产物. 4.氧化性和还原性:物质在反应中得电子为氧化剂,氧化剂具有氧化性;物质在反应中失电子为还原剂,还原剂具有还原性. 各概念间的关系为:
[职称总结]工程师个人专业技术工作总结(中级职称)
个人专业技术工作小结 本人自XX年XX月参加工作以来,认真工作,苦练本领,在各位前辈和师傅们的指导和帮助下,已成长为一个具有较强业务能力的技术人员,以下是本人的一点心得: 一、态度端正、严谨科学 路桥建设工作是一项非常艰苦的行业,风吹日晒,还要到处跑,而且又需要细心工作,所以没有乐观的人生态度和严谨科学的工作精神是不成的。测量和试验工作虽说不上搞科研,但也绝对来不得半点马虎,“差之毫厘,失之千里”正好用来比喻测量工作,而“一子错,全盘皆落索”又正好用来形容试验工作。 二、小心推敲、认真求证 在测量和试验工作中,非常需要“小心推敲、认真求证”的工作精神,因为这不但是工作作风的问题,还直接关系到工作的质量问题。 在测量和施工之前,必须认真审图,对图上有误的地方要及时向设计、监理单位提出来。在测量放线之前,要利用图纸给出的数据,运用各种公式去验证,还要采用不同的计算方法(如正算、反算等)重复计算,确保万无一失。 在准备试验之前,要先重温一次图纸,看设计图纸对材料是否有特殊要求,或者和现行规范有没有冲突的地方,如有冲突则采取“从严不从宽”的原则处理,并及时向总监作出书面报告。试验前还要进行重温一次操作规程,确保操作无误,不能边操作边看书,就算对很简单的试验也不能马虎对待。
对各种原始数据要注意保存和及时整理,因为“经验,是从众多的数据中总结出来的”! 三、不断进取、精益求精 在工作上要不断学习,善于总结经验。至今工作五年多来,我除了在工作中认真学习本职业务外,参加了各种各样的培训班、学习班,如: ①在01年4月至7月参加了省劳动厅在肇庆市举行的试验员培训,并通过考核于01年10月取得了“公路工程材料试验员”的中级技工证书。 ②在01年9月至12月参加了南海市人事局和建设局联合举办的“建筑系列专业技术人员培训班”。 ③在02年4月至11月参加了南海市建设局举办的“质安员培训班”。…… ④03年8月份又参加了省市政协会在东莞举办的“市政工程统一用表学习班”; ⑤经过自学,于03年12月31日通过了全国专业技术人员计算机应用能力考试。 社会在进步,时代在发展,只有不断学习,才能与时俱进。各种新的施工材料和施工机具不断地应用到路桥施工中来,相对的,也出现了更多的施工工艺和施工方法,各项规范也跟着发展。不能自我提高,就只有落后,就不能适应路桥建设工作的发展。 四、结合实际、推陈出新 在工作中,要不断地总结经验和教训,不断提高,并把学到的知识结合实际运用到工作中,以提高工作效率。如:
注册电气工程师考试公共基础公式总结
注册电气工程师考试公共基础公式总结 高等数学 1. 两平面的交线的方向向量:z y x z y x b b b a a a k j i b a s =?= 2. 曲线C 绕y 轴旋转所成的旋转曲面的方程为() 0,22=+±z x y f 3. ()???z A A z z A ??+??=?? 4. 22x z A ??=,y x z B ???=2,22y z C ??=,02>-B AC ,是极值点,02<-B AC ,不是极值点 5. 1sin lim 0=→x x x ,e x x x =?? ? ??+∞→11lim 6. ()111 -≠++= +?μμμμ C x dx x 7. C x x dx +=-?arcsin 12 8. C x xdx x dx +==?? tan sec cos 22 9. C x xdx x dx +-==??cot csc sin 22 10. C a a dx a x x +=?ln 11. x dx x 21=? 12. x dx x 1 12 -=? 13. () θθθθ2sin 241 cos 2+=?d 14. ()()θρρθρθρd d f dxdy y x f D D ????=sin ,cos , 15. 当 12 1 < 16. 椭圆抛物面方程z y x =+22,圆锥面方程 222z y x =+。 17. 平面曲线的弧长() dx y s b a ? +=2 /1,(直角坐标形式)。 18. 几何级数∑∞ =-1 1n n aq ,当1 苏教版《实验化学》必记知识点总结 【专题1】1、海带灰化目的是使有机物分解,呈气体逸散,待测的金属或非金属以氧化物或无机盐的形式残留下来。所用仪器有坩埚、坩埚钳、酒精灯、玻璃棒、三脚架、泥三角 2、现用CCl4从碘水中萃取碘并用分液漏斗分离出两种溶液时,注意分液漏斗使用前须 检查旋塞及玻璃塞处是否漏水。 分液时将漏斗上口的玻璃塞打开目的是与大气相通,使液体顺利流下。 能用CCl4萃取碘的原因是CCl4与水互不相溶;I2在CCl4中溶解度比在水中的大。 3、纸层析法作为一种物质分离的简单方法,是色谱分析法的一种。它以滤纸作为惰性支持物,附着在纸上的水是固定相,不与水混溶的有机溶剂作为流动相(又称展开剂),这种方法的基本原理是利用混和物中各组分在流动相和固定相间的分配比的不同而使之分离。 为使观察效果更明显,实验中采用氨熏显色。请写出Fe3+、Cu2+分别与足量氨水反应的离子方程式。Fe3++3NH3·H2O==Fe(OH)3↓+3NH4+、Cu2++4NH3·H2O==Cu(NH3)42++4H2O 显色反应结果是滤纸上方颜色呈蓝色,下方呈棕黄色(均在原点之上),说明Fe3+和Cu2+得到了分离。由此可以得出Fe3+和Cu2+在流动相和固定相中的分配情况是Fe3+在流动相中分配的多一些,随流动相移动的速度快一些Cu2+在固定相中分配的多一些,随流动相移动的速度慢一些。 在用纸层法进行层析操作时,为什么不能让滤纸上的试样点接触展开剂?如接触,样点里要分离的离子或者色素就会进入展开剂,导致实验失败。 4、要制备颗粒较大的硝酸钾晶体,应选择的结晶条件是减慢溶液的冷却速度。 当溶液发生过饱和现象时,如何操作使晶体析出振荡容器,用玻璃棒搅动或轻轻的摩擦器壁,或投入几粒晶种,都可促使晶体析出。 加热蒸发浓缩NaNO3和KCl的混合液时,为什么NaCl先析出?NaNO3、KCl、KNO3在高温时具有较大的溶解度,温度降低时,NaNO3、KCl的溶解度明显减小,而KNO3的溶解度则急剧下降;NaCl的溶解度随温度变化不大。 趁热过滤的原因防止温度降低KNO3结晶析出如何趁热过滤 用已预热过的布氏漏斗进行抽滤,过滤装置如图1—8所示,采用这种装置 过滤的主要目的是过滤速度较快;可以得到比较干燥的沉淀。 这种装置工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强 降低,使过滤的速度加快。 这种装置要有布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,其 安全瓶的作用是防止倒吸,导管应短进长出。布氏漏斗的颈口斜面与吸 滤瓶的支管口相对,以便于吸滤。吸滤完毕时,应先拆下连接抽气泵和吸滤瓶的橡皮管,然后关闭水龙头。 减压过滤不宜用于过滤胶状沉淀或颗粒太小的沉淀。 欲将KNO3粗产品提纯,可采取的方法是__重结晶。具体操作是按粗产品∶水=2∶1(质量比)的比例,将粗产品溶于蒸馏水中。加热、搅拌、待晶体全部溶解后停止加热。(若溶液沸腾时,晶体还未全部溶解,可再加极少量蒸馏水使其溶解。)待溶液冷却至室温后抽滤。 为什么选用这方法可使产品获得较高的纯度?可以除去晶体中微量的杂质 【专题2】5.破坏铝表面氧化膜的方法有①用砂纸擦②用NaOH溶液③用稀酸浸泡设计一实验证明铝表面氧化膜已被破坏将一片擦去氧化膜的铝片放入CuSO4溶液中,铝片表面有红色物质析出。增强铝表面氧化膜保护的方法有放入冷的浓硝酸或浓硫酸中浸泡。 设计一实验证明将一片擦去氧化膜的铝片放入冷的浓硝酸或浓硫酸中浸泡后,洗净放入CuSO4溶液中,铝片表面无红色物质析出。 6、使苯酚晶体变成苯酚液体的方法有用乙醚或用热水浴加热融化 实验室制乙烯时要注意哪些问题乙醇中慢加浓硫酸,混合液温度迅速上升到170℃ 7、检验牙膏中的摩擦剂是否为CaCO3,宜选用的试剂是盐酸与石灰水,相关反应的离子方程式为CaCO3+2H+===Ca2++H2O+ CO2↑。 检验牙膏中的保湿剂是否为甘油,宜选用的试剂是新制的氢氧化铜,实验现象为出现绛蓝色溶液 软件开发工程师个人年终工作总结 以下提供一篇个人工作总结给大家参考! 作为一个软件开发工程师,所实在的如果每年只做那么一两个项目,年终工作总结写起来也应该得心应手的,我们只需要把本年度该项目的基本情况简历表述一下,自己在项目中的角色以及自己在项目中遇到的重点问题及解决方案描述一下,最后展望一下下一年度的工作计划,ok,本年度的工作总结基本完成。下面我给大家看一篇别人写的我认为比较好的个人年终工作总结范文:软件开发工程师个人年终工作总结范文 2014年2月2日,我有幸成为北京 超图一员,应聘为公司的java软件工程师。入任职以来,在部门领导的带领下,自己感觉无论学习、技术、生活等方面都有很大的提升。 2014年里我主要完成的工作有三方面: 1、荆门石油石化巡检系统的调研和开发。 该项目是我工作以来第一次涉及到调研,对我来说算是一个不小的挑战。在调研过程中,让我学会了如何通过和客户的沟通来了解客户的需求。由于自己的工作经验不足,在调研工作中体现出一些问题。不能很直接的在和客户沟通中非常准确的了解客户的更多需求,有很多需要和客户交流沟通多次才能明白客户的最终需求,也没有把自己作为最终用户并站在用户的角度上来考虑问题,这些都是我在以后的工作中需要提高和改进的地方。在巡检系统的开发工作中,让我进一步巩固和加强了自己的开发能力。 2、电信12530增值业务的开发与维护。 从5月以来我就开始接手公司的主要业务之一,12530电信增值业务。由于前面负责这个项目的同事突然离职,导致这个项目的交接工再做得不够好,对我顺利接手这个项目造成很大的困难。而刚一接手这个项目,马上就需要新上一个投票活动,并要对一些主要代码进行修改,让我倍感压力,几乎都快放弃。最后在金总的指导和鼓励下,顺利的完成这次活动。在完成这次投票活动后,为了避免下一个接手这个项目同事与我遇到同样困难,我第一时间将这个项目的相关技术文档补充完全,保证别人能够顺利的进行该项目工作。通过这个项目,让我加强了自己在高强高压下工作的能力,也让我找到更多自信。 3、襄樊、鄂州家政网络服务中心的开发与实施。 在这两个项目中,除了承担开发工作以外,也逐渐涉及到项目管理的职责,p 时,级数收敛。 23. 一阶线性非齐次方程的通解为()()()?? ????+??=?-C dx e x Q e y dx x P dx x P 24. 一对共轭复根βαi r ±=2,1,通解为()x C x C e y x ββαsin cos 21+= 线性代数 若α,β,γ三线共面,则三条线的方向向量0=i h g f e d c b a 。 概率论 1. 当X 为连续型随机变量时,如果X 的概率密度函数为()x p ,那么规定X 的数学期望为 ()()dx x xp X E ?+∞ ∞ -=。 2. 当),(~2σμN X ,有()() 2 ,~σμa b a N b aX ++。 3. 正态分布()()2 2 221σμσ π-- = x e x p ,其μ=EX ,2σ=DX
高考苏教版《实验化学》必记知识点复习总结(新)
软件开发工程师个人年终工作总结
