2016年中考化学备考复习推断题教案

C
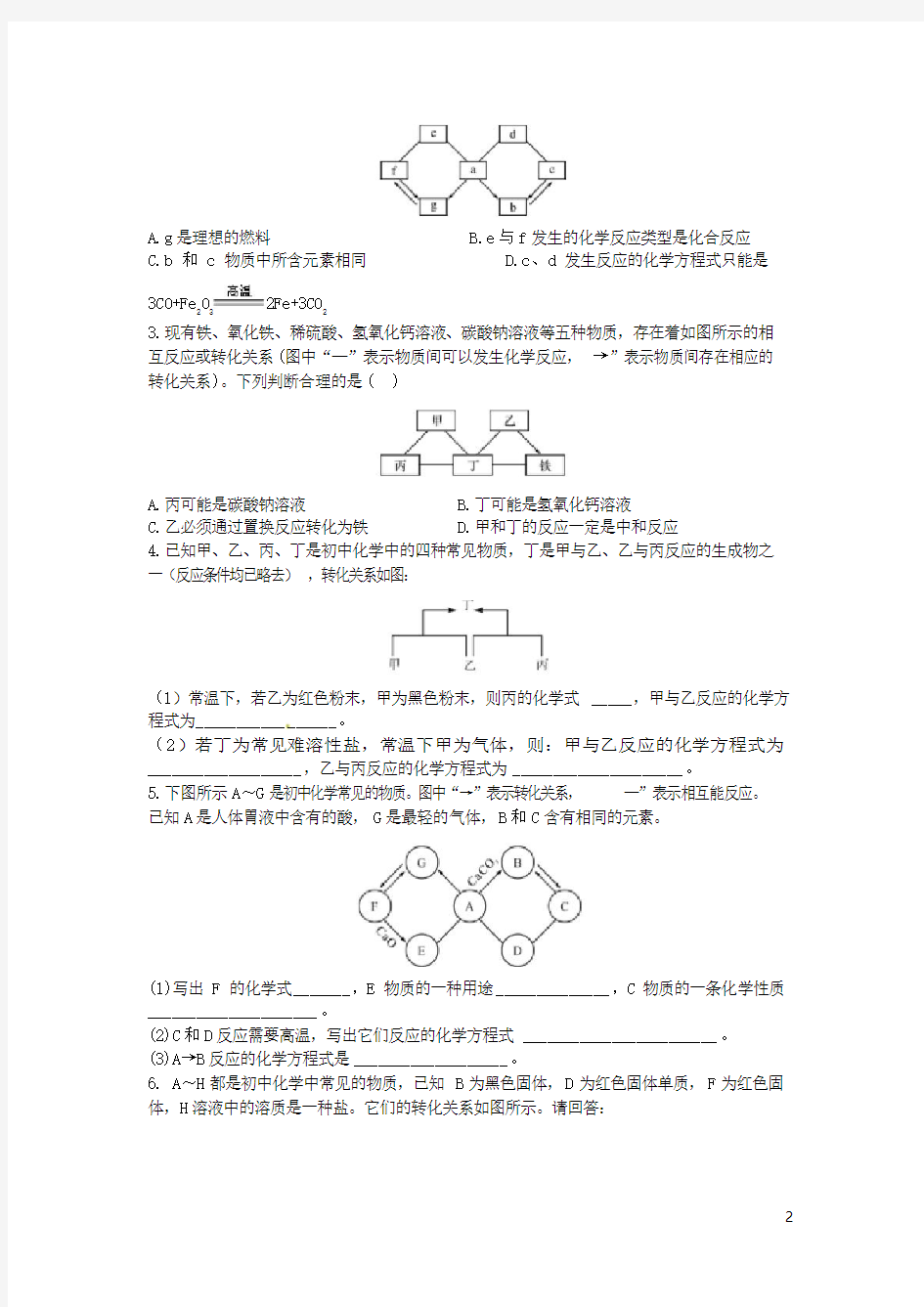
C D C B C
“
推断题
一、题型简介
推断题是初中化学试题中常见,但却十分重要的一类题型。该类题目考查知识面广、变化多端、思维量大、综合性强,是考查学生求异思维、发散思维、抽象思维及逻辑推理能力的一类好题。
二、方法指导
解答推断题的总体原则:典型突破,综合分析,检验把关,验证答案。解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征及结构特征)并以此为突破口,顺藤摸瓜,最终推出答案。
题型之一框图型推断
框图型推断题中,整个框图会分成两支或多支,但是彼此有联系,可根据图中已知条件,分
别得出相应的结论,各个击破,然后综合推断,得出最后的结论。
例1A~D是初中化学所学的常见物质,其转化关系如图所示(部分反应物和生成物、反应条件已略去),A、B常温下为无色气体且组成元素相同,、D均为黑色粉末。请回答下列问题:
(1)写出反应②的化学方程式:__________________。
(2)反应③的基本反应类型是:___________。
(3)物质A的一种用途____________________________。
思路点拨:由A、B常温下为无色气体且组成元素相同,且A与B可以相互转化,可知A、B 为CO、CO
2
,、均为黑色粉末,且A、可以得到B和D,可知A为CO,为CO
2
,为Fe
3
O
4
,D 为Fe,据此便可解答。
练习
1.下图中甲、乙、丙是初中化学中常见的物质,图中“—”表示相连的物质之间可以在溶液中发生化学反应,→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条
件已略去)。下列说法中不正确的是()
A.甲、乙、丙可能依次为Fe、NaOH、CO
2
B.丙物质只能是氧化物或盐
C.当乙为NaOH时,它可由Ca(OH)
2
与Na
2
CO
3
反应生成
D.当甲为一种碱时,它与硫酸铜溶液的反应可能产生两种沉淀
2.如图所示a-g是初中化学常见的物质。图中“→”表示转化关系,—”表示相互能反应。已知a是人体胃液中含有的酸,g是最轻的气体,b、c、d、e、f都是氧化物。以下说法不正确的是()
A.g 是理想的燃料
B.e 与 f 发生的化学反应类型是化合反应
C.b 和 c 物质中所含元素相同
D.c 、 d 发生反应的化学方程式只能是
3CO+Fe 2O 3 2Fe+3CO 2
3.现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相 互反应或转化关系(图中“—”表示物质间可以发生化学反应, →”表示物质间存在相应的 转化关系)。下列判断合理的是( )
A.丙可能是碳酸钠溶液
B.丁可能是氢氧化钙溶液
C.乙必须通过置换反应转化为铁
D.甲和丁的反应一定是中和反应
4.已知甲、乙、丙、丁是初中化学中的四种常见物质,丁是甲与乙、乙与丙反应的生成物之 一(反应条件均已略去),转化关系如图:
(1)常温下,若乙为红色粉末,甲为黑色粉末,则丙的化学式_____,甲与乙反应的化学方 程式为___________ ______。
( 2 )若丁为常见难溶性盐,常温下甲为气体,则:甲与乙反应的化学方程式为 ___________________,乙与丙反应的化学方程式为_____________________。
5.下图所示 A ~G 是初中化学常见的物质。图中“→”表示转化关系, —”表示相互能反应。 已知 A 是人体胃液中含有的酸,G 是最轻的气体,B 和 C 含有相同的元素。
(1)写出 F 的化学式_______,E 物质的一种用途______________,C 物质的一条化学性质 _____________________。
(2)C 和 D 反应需要高温,写出它们反应的化学方程式________________________。 (3)A →B 反应的化学方程式是___________________。
6. A ~H 都是初中化学中常见的物质,已知 B 为黑色固体,D 为红色固体单质,F 为红色固 体,H 溶液中的溶质是一种盐。它们的转化关系如图所示。请回答:
“
“
(1)物质B和E的化学式为B:____、E:____;
(2)反应①的化学方程式为:________________________;
(3)写一个能实现反应④的化学方程式:_______________________。
7.已知A、B、C三种物质含有同种金属元素,其中A是大理石的主要成分,B为氧化物;D、
E、F三种物质含有同种非金属元素,其中F是单质,E是易与血液中血红蛋白结合的有毒气体。它们之间的转化关系如图所示(有些转换关系,反应条件等略去),试回答:
(1)写出E、F的化学式:E_____、F_____;
(2)用化学方程式表示以下转换关系:
A→D:___________________________;C→A:________________________。
8.已知A、B、C、D四种物质中含有相同的金属元素,A为红色固体,C、D中所含元素种类相同,B→A反应过程较为复杂。→”表示一种物质转化为另一种物质,四种物质转化关系如下:
(1)C物质的化学式是_____;
(2)A→B化学方程式为。B→D化学方程式为___________________,该反应能够发生的原因是___________________。
9.A、B、C、D、E、F均为中学化学中常见的物质。已知D是大理石的主要成分。“→”表示物质间存在着相应的转化关系,—”表示物质间能发生反应(部分反应物、生成物和反应条件未标出),它们之间存在如图的转化关系。请回答下列问题:
(1)D的化学式是_____。
(2)写出E→F的化学方程式_______________________。
(3)图示转化关系中未涉及到四种基本反应类型中的______________。
10.绝大多数金属都能与Cl
2
直接化合生成金属氯化物,如2Na+Cl
2
点燃
2NaCl、
Cu+Cl
2
去)。
点燃CuCl
2
等。已知A、B、C、D、E五种物质有如下图转化关系(个别反应条件已略
Z
已知 A 是地壳中含量仅次于铝的金属元素的单质,C 为紫红色金属单质,A 、C 都能与 Cl 2 直 接化合生成相应的金属氯化物 B 、E 。回答下列问题: (1)A 为_____,B 为_____。
(2)D 与 Cl 2 化合生成 E 的化学方程式为_______________________。
(3)A 与 E 也可以化合生成 D ,请写出化学反应方程式__________________________。
11.下图表示某些物质间转化关系(反应条件和部分产物已省略)。常温下 A 、C 是由相同元素 组成的无色液体,且 A 具有消毒杀菌作用;D 、I 、J 均为无色气体,其中 I 能使澄清石灰水 变浑浊;K 为红棕色粉末。请回答下列问题:
(1)反应①中 B 物质的作用是________________。
(2)图中标出的反应①到⑦中是化合反应的是____(填数字序号)。 (3)在图中标出的 12 种物质中,单质有____种。
(4)反应②中的现象为_______________________________。
(5)写出 I 使澄清石灰水变浑浊的化学方程式_____________________________。
12.如图表示的是物质 A-H 相互间的关系(“→”表示物质间的转化关系,“—”表示两端的 物质能发生化学反应)。A 、G 都是单质,气体 C 常用于灭火,F 是一种蓝色溶液,可用于配 制农药波尔多液。请你回答:
(1)C 的化学式______,H 可能是_____;
(2)写出标号①、②、③、④的化学方程式:
①_______________________;②____________________; ③_______________________;④____________________。
13. A-Z 都是初中化学的常见物质,其中 A 是发酵粉的一种主要原料,俗称小苏打,B 是胃酸的 主要成分,C 和 M 的组成元素相同,常温下 E 是液体,Y 、 是黑色固体,N 是红色粉末,G 是一种 碱,农业上常用于改良酸性土壤。它们之间有如下反应关系:
请根据以上信息回答下列问题: (1)D 的化学式为_________;
(2) 反 应 ③ 的 化 学 方 程 式 为 ________________________, 反 应 ⑤ 的 化 学 方 程 式 为 _________________________。
14.如图所示的是物质 A ~F 相互间的关系(“→”表示物质间存在的转化关系, —”表示两 端的物质能发生化学反应)。通常情况下 A 是能参与绿色植物光合作用的气体;B 在工业上 广泛用于玻璃、造纸、纺织和洗涤剂生产等领域;D 的溶液呈蓝色;E 是地壳中含量 最多的 金属元素的单质。
请回答下列问题:
(1)A 参与光合作用所得的气体产物是________,B 的化学式为________。 (2)F 可能是___________。
(3)C 和 D 在溶液中反应的化学方程式是___________________。 (4)E 和 F 在溶液中反应的化学方程式是___________________。
题型之二 文字叙述型推断
文字推断的特点:题眼在题干和题目中,需要先通览全题后,抓住题目的“题眼” 进行分 析推理,从而得出结论。
例 2 现有氢氧化铜、硫酸铜、氯化铜三种物质,分别将它们依次加入到 A 、B 、C 三种无色 溶液中,恰好完全反应后,均得到同一种溶质的溶液。则A 是_______溶液、B 是_______溶 液、C 是________溶液。
思路点拨:由题意可知 A 、B 、C 三种物质含有相同的酸根离子,又由于氢氧化铜是不溶于水 的碱,由碱的性质可以推断出 A 为酸;根据硫酸根离子、氯离子的特点可以推出 B 、C 的阳 离子,即可得出 A 、B 、C 三种物质。 练习
1.经过实验测定,某物质中只含有一种元素,下列推断正确的是( ) A.该物质一定是单质 B.该物质一定是混合物 C.该物质一定不是化合物 D. 该物质一定是纯净物
2.某一种或几种物质的水溶液中,可能含有以下几种离子:Na +、Cl -、Ca 2+、Ba 2+、SO 42-、CO 32-, 现取两份 100 mL 溶液进行实验:(1)第一份加入 AgNO 3 溶液有沉淀产生;(2)第二份加足量 的 Ba(NO 3)2 溶液,有白色沉淀产生,再加入过量的稀硝酸沉淀部分溶解。根据上述实验,以 下推测正确的是( )
A.一定存在 Cl -
B.一定存在 CO 32-,可能存在 Ba 2+
C.一定存在 Na +
D.一定存
在 SO 42-,可能存在 Ca 2+
3.现有 X 、Y 、Z 三种肥料,已知它们分别是碳酸氢铵、氯化钾、硝酸钾中的一种。将三种肥 料各取适量分别加氢氧化钠钙研磨,Z 有强烈的氨味,X 、Y 无氨味;将 X 、Y 分别配成溶液, 各取适量分别滴入硝酸银溶液,X 溶液中有白色沉淀产生,Y 溶液中未见到明显变化。根据 上述实验现象判断 X 、Y 、Z 依次是( ) A.氯化钾、碳酸氢铵、硝酸钾 B.氯化钾、硝酸钾、碳酸氢铵 C.碳酸氢铵、氯化钾、硝酸钾 D.硝酸钾、氯化钾、碳酸氢铵
4.某无色气体可能由 H 2、CH 4、CO 、CO 2 中的几种组成。将这些混合气体通过过量的澄清石灰 水,出现白色浑浊;将剩余气体导出,经干燥后点燃,罩在火焰上方的干燥烧杯内壁有水珠 生成。该混合气体的可能组成是( ) A.H 2、CH 4 B.H 2、CO C.H 2、CH 4、CO D.CH 4、CO 、CO 2
5.有一包白色粉末,可能含有 Ba(NO 3)2、Na 2SO 4、Na 2CO 3、NaNO 3 中的一种或几种,某同学分 析其成分做了如下实验。该同学 分析正确的是(
)
实验步骤 1
2
实验操作
取样加足量水,充分振荡,静置
过滤后,往滤渣中加过量稀盐
酸
实验现象 有白色沉淀产生
沉淀部分溶解
A.该包白色粉末中一定含有 Ba(NO 3)2、Na 2SO 4、Na 2CO 3、NaNO 3
B.该包白色粉末中一定含有 Ba(NO 3)2、Na 2CO 3,可能含有 Na 2SO 4
C.该包白色粉末中一定含有 Ba(NO 3)2、Na 2SO 4,可能含有 NaNO 3、Na 2CO 3
D.该包白色粉末中一定含有 Ba(NO 3)2、Na 2SO 4、Na 2CO 3,可能含有 NaNO 3
6.某化学兴趣小组的同学将一枚洁净的铁钉放入硫酸铜溶液中,观察到铁钉表面有红色物质 析出,且产生少量的气体,于是他们重新配制硫酸铜溶液,再次实验,又观察到相同的现象。 关于该实验有如下说法:①产生的气体可能是氢气;②完全反应后溶液呈黄色;③实验中一 定发生了置换反应;④由实验可以得出金属活动性顺序:Cu >Fe ;⑤硫酸铜溶液可能显酸性; ⑥重做实验没有任何意义。其中正确说法的个数有( ) A.2 个 B.3 个 C.4 个 D.5 个
7. A 物质是石灰岩的主要成分。A 物质经高温分解后得到氧化物B 和气体 C 。B 和水反应得 到 D 物质。将 C 气体通入 D 物质的澄清溶液中反应,又得到 A 物质。请你写出 A 、D 两种物 质的化学式,并计算出相对 分子质量。
A 物质的化学式___________,相对分子质量_______; D 物质的化学式___________,相对分子质量_______。
8.有一包白色粉末,可能含有 Ba(OH)2、KNO 3、FeCl 3、Na 2CO 3、Na 2SO 4 中的一种或几种。为了 确定其成分,进行如下实验:
①取一定量的白色粉末加入足量的水,振荡,静置,得白色沉淀,上层清液为无色。 ②过滤,在白色沉淀中加入足量稀盐酸,白色沉淀全部溶解,且有气泡产生。
(1) 据此推断,该白色粉末中一定含有 __________;可能含有 __________;一定不含有 __________。
(2)写出步骤②中发生反应的化学方程式:_________________________。
9.有一无色水溶液,已知其溶质是由 H 2SO 4、BaCl 2、CuSO 4、Na 2CO 3、KCl 、HCl 、MgCl 2 等七种 化合物中的两种组成。对该溶液进行相关实验,得出以下实验现象或结论: ①用 pH 试纸测试,溶液的 pH 为 1;
②加入过量的氢氧 化钠溶液,没有沉淀生成。
请根据上述实验现象或结论确定该溶液有可能的组成是(以下空格可以不填满): _________、___________、___________、_________。
点燃 10.有三种元素 A 、B 、C ,已知 A 元素的离子 A +结构示意图为: ;B 元素原子核内只
有一个质子,C 元素和 B 元素组成一种氧化物,该氧化物是常用的溶剂。
(1)A 、B 、C 三种元素可组成一种化合物 D ,D 的化学式是__________;这种化合物的俗名是 _________(只填一种);
(2)化合物 D 溶于水所得溶液的 pH______7(填“大于”“小于”或“等于”);化合物 D 曝露 在空气中容易吸收水分,表面潮湿并逐渐溶解,这种现象叫__________;
(3)将一种硫酸盐溶液加入到化合物 D 的溶液中发生反应,有一种蓝色的沉淀生成,写出这 一反应的化学方程式:__________________________。
11. A 、B 、C 、D 分别是 Na 2SO 4 溶液、稀盐酸、Na 2CO 3 溶液和 BaCl 2 溶液中的一种,已知 A 和 B 反应有白色沉淀生成,在沉淀中加入 D 溶液,沉淀不溶解。A 和 C 反应有白色沉淀生成, 在 沉 淀 中 加 入 D 溶 液 , 沉 淀 全 部 溶 解 。 则 四 种 溶 液 分 别 是 : A________.,B.___________,C._________,D.__________。
12.根据已知物质和未知物质的特性,运用实验的方法,可以鉴别某些物质。有 3 包白色粉 末,它们分别是碳酸钠、氯化钠、氧化钙中的一种,现用实验的方法将它们一一区分。
(1)取少量 3 种粉末,分别装入编号为甲、乙、丙的三支试管中,加水后都能溶解。其中甲 试管壁明显变热,由此可知甲试管中加的粉末是____________。
(2)取甲试管中的溶液分别滴入另两支试管中,乙试管中出现白色沉淀,丙试管中无明显现 象。请写出乙试管中发生反应的化学方程式_____________________。
13.现有一包白色粉末,可能是食盐、纯碱或干燥剂(主要成分生石灰)中的一种或几种物 质组成。为了研究白色粉末的组成,进行了如下实验:
(1)将部分粉末放入烧杯中,加适量水充分搅拌后,得澄清溶液,溶液温度升高,滴加酚 酞试液,溶液变红,得出:粉末中一定含有____________,可能有_______________;
(2)向(1)中澄清溶液滴加过量稀硝酸,然后再滴加硝酸银溶液,发现有白色沉淀生成, 请你写出该反应的化学方程式:___________________________。
题型之三 化学反应型推断
化学反应型推断的特点:以化学反应的形式考查,要求学生熟悉物质之间的相互反应,找准 “题眼”(即特殊的物质、实验现象等),进行分析推理得出结论。
例 3 现有 A 、B 、C 、D 、E 、F 六种化合物 和甲、乙、丙三种单质,其中 A 为黑色固体、C 属 于盐类。它们在一定条件下有如下转化关系:
①甲+乙 ??→
B ②甲+丙 A ③A+D → C+B ④C+E → F ↓(蓝色)+NaCl
(1)反应①属于反应______________(填基本反应类型)。
(2)三种物质的化学式:甲________、C________、D_________。 (3)反应④的化学方程式_____________________。
思路点拨:由④中 F 为蓝色沉淀,且 C 为盐可知该反应为可溶性的碱与可溶性盐反应,可推 知 C 和 D 物质;由甲、乙、丙为单质,且 A 为黑色固体,可知③为金属氧化物与酸的反应, ②为金属与氧气的反应,①为非金属与氧气的反应。 练习
1.在 A+B →盐+水的反应中,A 和 B 不可能是( )
A.HCl和NaOH
B.CO
2
和NaOH C.H
2
SO
4
和Fe
2
O
3
D.H
2
SO
4
和BaCl
2
2.某化学兴趣活动小组在准备实验时,甲同学配制了Na
2
SO
4
、K
2
CO
3
、BaCl
2
、稀盐酸四种溶
液,但没有及时贴标签。乙同学在使用时为区分四种无色溶液,将溶液分别编号为①、②、
③、④并进行如下表所示实验,由此推断①、②、③、④依次是()
实验内容
实验现象
①+②
有白色沉淀生成
②+④
有白色沉淀生成
①+③
有气泡冒出A.稀盐酸、Na
2
SO
4
溶液、K
2
CO
3
溶液、BaCl
2
溶液 B.K
2
CO
3
溶液、BaCl
2
溶液、稀盐酸、
Na
2
SO
4
溶液
C.BaCl
2
溶液、K
2
CO
3
溶液、Na
2
SO
4
溶液、稀盐酸 D.Na
2
SO
4
溶液、BaCl
2
溶液、K
2
CO
3
溶
液、稀盐酸
3.现有a、b、c、d四种无色溶液,分别是碳酸钾溶液、硫酸溶液、氯化钡溶液、盐酸中的
一种。两两混合后出现如图所示的现象,请确定a、b、c、d分别是()
A.硫酸溶液、碳酸钾溶液、氯化钡溶液、盐酸
B.氯化钡溶液、盐酸、碳酸钾溶液、
硫酸溶液
C.碳酸钾溶液、硫酸溶液、盐酸、氯化钡溶液
D.盐酸、硫酸溶液、碳酸钾溶液、氯
化钡溶液
4.下表各组物质中,物质之间按箭头方向通过一步反应就能实现转化的是()
选项
物质
甲乙丙丁A
B
C
D
Cu
CaCO
3
Na
2
CO
3
CO
CuO
CaO
NaOH
CO
2
Cu(OH)
2
Ca(OH)
2
Na
2
O
CaCO
3
CuSO
4
CaCl
2
NaCl
C
5.如图所示,现有甲、乙、丙、X、Y、Z六种物质,其中连线两端的甲、乙、丙溶液两两之
间能发生反应;X、Y、Z之间只通过一步反应就能实现如箭头所指方向的转化。下列符合上
述要求的一组物质是()
A
B
C
D
甲
HCl
HCl
H
2
SO
4
H
2
SO
4
乙
NaOH
Ba(OH)
2
NaOH
Ba(OH)
2
丙
Na
2
CO
3
Na
2
CO
3
K
2
CO
3
K
2
CO
3
X
Cu
H
2
O
C
CaO
Y
CuO
H
2
O
CO
Ca(OH)
2
Z
CuSO
4
O
2
CO
2
CaCO
3
“ “
6.甲、乙、丙、丁四种物质在一定条件下能发生如下反应:甲+乙→丙+丁
1)若甲、丙为化合物,乙、丁为单质,则上述反应的基本反应类型是_________,写出一个 符合该反应类型的方程式:___________________。
(2)若甲、乙、丙、丁均为化合物,且甲溶液呈蓝色,乙为烧碱,则乙的化学式为______, 反应发生时观察到的现象是_____________________。
(3)若甲、乙、丙、丁均为化合物,且丙为水,丁为盐,则该反应___________(填“一定” 或“不一定”)是中和反应,理由是_________________________。
(4)若甲、乙、丙为化合物,丁为单质,且乙、丙是组成元素相同的气体,该反应在工业 上的用途是____________。
7.有 A 、B 、C 、D 四种物质的溶液,它们分别是硫酸钠、盐酸、氢氧化钡、碳酸钠中的一种, 它们之间能发生如下反应:①A+C →E ↓+F;②B+C →G ↓+F;③B+D →H+J+K ↑。 根据以上关系推断(填化学式):A._____;B._____;C._____;D._____。
8.有失去标签的硝酸钾、碳酸钠、硝酸银、硝酸钙和稀盐酸五瓶溶液。将其任意编号:A 、B 、 C 、D 、E ,进行两两混合,其现象如下表:
实验
现象
A+B
产生沉淀
A+E
产生沉淀
B+C
产生沉淀
B+E
产生气泡
(1)试推断并写出五种溶液中溶质的化学式。
A._____,
B._____,
C._____,
D._____,
E._____。 (2)写出有关反应的化学方程式:
A+E :______________________;B+E :_______________________。 9.已知 A 、B 、C 、D 、E 、F 6 种物质的转化关系如下:
(1)A+B → C+H 2O; (2)C+KOH → D ↓(蓝色)+E; (3)B+D → C+H 2O; (4)E+BaCl 2 → F ↓(白色, 不溶于稀硝酸)+KCl 。
根据上述变化关系,推断有关物质的化学式:
A._____;
B._____;
C._____;
D._____;
E._____;
F._____。
10.A 、B 、C 、D 、E 、F 都是初中化学中常见的化合物,其中 A 、D 是盐,E 是酸。它们相互间
在溶 液中可发生如下反应:①C+E
A+2F ②2B+E D+2F ③A+2B C ↓+D
根据上述信息回答问题:
(1)写出下列物质的化学式:F_____,E_____;
(2) 写 出 下 列 反 应 的 化 学 方 程 式 : 反 应 ① _____________________ ; 反 应 ③ _____________________。
11.现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠4 瓶失去标签的溶液,分别编号为 A 、B 、C 、D 。 每次取少量溶液两两混合,所观察到的现象记录在下表中( —”表示无明显现象; ↓”表 示有沉淀生成;“↑”表示有气体生成)。
A
B C D A ↑ ↓ - B ↑ ↓ ↑ C ↓ ↓ -
D
-
↑
-
由此推断 4 瓶溶液中的溶质的化学式分别为:A._____;B._____;C._____;D._____。
写出上述实验过程的有关反应方程式:A+B :__________________;C+D :________________。
题型之四
流程图问题
流程图型推断题的特点:以一种或两种物质发生反应,得到的生成物再与其他物质发生反应, 解决此类题目,主要找准一个突破口(题眼),依据反应的流程推出物质。
例 4 轻质碳酸钙广泛应用于橡胶、塑料、油漆、水性涂料以及造纸等行业,日常生活中的牙 膏也常用它作摩擦剂。目前轻质碳酸钙的生产主要是碳化法,工艺流程见下图:
请分析轻质碳酸钙的生产流程,回答下列问题: (1)物质 B 的化学式为_________;
(2)在 A →B 之间,过滤操作的目的是____________________;
(3)在 B+C →CaCO 3 的过程中,应控制物质 C 的流量,原因是_______________________(用化 学方程式表示);
(4)生产轻质碳酸钙的方法很多请再设计一种制备方法 ________________________(用化学 方程式表示)。
思路点拨:(1)由石灰石高温煅烧,可知 A 、B ;(2)由于氢氧化钙不易溶于水,所以需要过 滤;(3)氢氧化钙和二氧化碳反应生成碳酸钙和水,在过量的二氧化碳存在时会继续发生反 应,生成碳酸氢钙;(4)产生碳酸钙可以用碱和盐反应,也可以运用盐和盐的反应。 练习
1.由一种可溶性碱和两种可溶性盐组成的固体混合物 A ,为探究其组成,取适量混合物A 进 行如下实验:
根据上述实验推断:
(1)蓝色沉淀是________。
(2) 原 混 合 物 A 中 一 定 含 有 的 一 种 物 质 是 _______ ; 另 外 两 种 物 质 可 能 的 组 合 是 _______________或________________或__________________或_________________。
2.有一包白色固体粉末可能由 NaCl 、NaNO 3、MgCl 2、CuSO 4 中的一种或多种物质组成。小明 为探究其成分,设计并完成了如下图所示的实验。
根据以上实验,回答: (1)操作①是________。
(2)原固体粉末中一定没有的成分是__________。
(3)生成沉淀 A 的化学方程式是____________________。
(4)根据上述实验_____(填“能”或“不能”)确定原固体粉末中含有 NaCl 、NaNO 3。
3. 某 兴 趣 小 组 在 实 验 室 发 现 了 一 块 绿 色 的 孔 雀 石 标 本 , 查 阅 资 料 知 其 主 要 成 分 是 Cu 2(OH)2CO 3。他们以 Cu 2(OH)2CO 3 为原料制取铜,其工艺流程如下图所示:
(1)过滤操作中用到的铁质仪器为__________。
(2)无色气体 A 的化学式是_____,大气中该气体含量不断上升,会导致_______增强,全球 气候变暖。
(3)写出蓝色溶液 B 与铁粉反应的化学方程式_______________________ 。 (4)试剂 E 可选用_________溶液。
4.一包白色粉末由 CuSO 4、CaCO 3、BaCl 2、Na 2SO 4、NaOH 中的三种混合而成,为探究其组成, 进行以下实验:
分析实验过程,回答:
(1)白色粉末中一定有________________,一定没有___ _______________;
(2)白色粉末三种成分的可能组合为____________________,_________________。
5.黑白复印机用的墨粉中常添加 Fe 3O 4 粉末。Fe 3O 4 是由 Fe 2+、Fe 3+和 O 2-按 1∶2∶4 的个数比 构成的。下图是氧化沉淀法生产复印用 Fe 3O 4 粉末的流程简图。已知第④步反应中各元素化 合价保持不变。
(1)Fe 3O 4 粉末在复印机的电磁场作用下能使墨粉形成字迹或图案,这不仅利用了 Fe 3O 4 有磁 性,还利用了 Fe 3O 4 是______色。
(2)第②步加入试剂 X ,生成 Fe(OH)2 的反应方程式为_____________________。
(3)在第③步反应中要控制通入 O 2 的量,以使生成的 Fe(OH)2 和 Fe(OH)3 的质量比等于 ________,才能确保最终生成 Fe 3O 4。操作 Y 的名称为______。
6.木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学实验小组设计回收 铜的方案如下:
(1)过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和 _________,其中玻璃棒的作用是
____________。
(2)反应①的化学方程式为______________________。
(3)滤液Ⅱ中的溶质为_________。
(4)试剂A最好选用下列_________溶液(填序号)。
①H
2
SO
4
②CuSO
4
③MgSO
4
(5)为了完善实验方案,可对滤渣Ⅰ中的______进行回收。
7.以黄铁矿(主要成分是FeS
2
)为原料,生产硫酸的简要流程图如下:
(1)写出流程图中一种氧化物的名称______________。
(2)将黄铁矿粉碎,目的是_______________________。
(3)流程中SO
2
转化为SO
3
的化学方程式为_________________________。
(4)实验室稀释浓硫酸应注意什么?____________________________________________。
(5)炉渣(Fe
2
O
3
)在工业上可用来_________________。
8.某化学兴趣小组的同学在教师的指导下开展如下探究活动。
探究一:物质推断。A、B、C、D分别是碳酸钠、氢氧化钠、氢氧化钙、硫酸钠中的一种,
它们之间的部分转化关系如图一所示。(“→”表示物质之间的转化关系,─”表示物质之
间可以发生化学反应)
阳离子
阴离子
部分酸、碱和盐的溶解性表(室温)
OH-NO
3
-Cl-SO
4
2-CO
3
2-H+
Na+
Ca2+
Ba2+
Mg2+
溶
微
溶
不
溶、挥
溶
溶
溶
溶
溶、挥
溶
溶
溶
溶
溶
溶
微
不
溶
溶、挥
溶
不
不
微
(1)四种物质中属于盐类的物质是____________________________(填化学式,下同)。
(2)物质D是_______。
探究二:设计了一个优化实验方案,验证某氯化钠溶液中混有碳酸钠、硫酸钠、氢氧化钠并
提纯氯化钠,其实验流程及部分实验现象如
下图二所示。
(3)样品溶液的pH_____7(填“大于”“等于”或“小于”),试剂甲是_____溶液。
(4)第Ⅲ实验中还可观察到的实验现象是_____________________________。
(5)证明样品中含有NaOH的证据是_____________________;第Ⅳ得到的滤液中除指示剂外
还含有的溶质是___________________。
9.某钢铁厂高炉炼铁的主要原料是焦炭、赤铁矿石(主要含 Fe 2O 3)、空气等,主要反应过程 如下:
请回答:
(1)A 的化学式______。
(2)反应②的化学方程式_______________________。 (3)反应③的化学方程式_______________________。
(4)向硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,反应停止后过滤,得到滤渣和滤 液。向滤渣中滴加稀盐酸,无气泡产生,则滤渣中一定含有__________(填化学式),滤液中 一定含有的溶质是_________(填化学式)。
(5)用含杂质的铁 10 g(杂质不溶于水,也不参加反应)与 100 g 稀硫酸恰好完全反应,滤去 杂质,得到滤液质量为 108.1 g ,则含杂质的铁中,铁的质量分数为________。
10.硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分 是 ZnCO 3,并含少量的 Fe 2O 3、FeCO 3、MgO 等,工艺流程简化示意图如下:
根据上图回答下列问题:
(1)将菱锌矿研磨成粉的目的是使_____________________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是 Fe 、O 和 H ,相 对分子质量是 89,针铁矿中铁原子数∶氧原子数∶氢原子数=________。
(3)请写出氢氧化锌和稀硫酸反应的化学方程式________________________。该反应的基本 类型是_____________。
(4)“滤液 3”之前加入锌粉的目的是__________________。
(5)“滤液 3”之后的操作依次为_________________________、干燥。
(6)分析图中数据 ,菱锌矿粉中 ZnCO 3 的质量分数不低于___________×100%。
参考答案
题型之一 框图型推断
例 1 (1)4CO+Fe 3O 4
4CO 2+3Fe (2)化合反应 (3)作燃料或冶炼金属
练习
1.B
2.D
3.A
4.(1)H 2(或 CO )2Fe 2O 3+3C
4Fe+3CO 2↑(2)CO 2+Ca(OH)2
CaCO 3
↓+H 2O [或 Ba(OH)2+CO 2 BaCO 3↓+H 2O ] Na 2CO 3+Ca(OH)2
CaCO 3↓+2NaOH [或
Ba(OH)2+Na 2CO 3
BaCO 3↓+2NaOH ]
5.(1)H 2O 建筑材料(或改良酸性土壤或生产农药、漂白粉、烧碱等)
可燃性(或毒性或还
原性) (2)Fe 2O 3+3CO 等)
2Fe+3CO 2(或 Fe 3O 4+4CO 3Fe+4CO 2 或 CuO+CO Cu+CO 2
(3)CaCO 3+2HCl
(3)Fe+CuSO 4
CaCl 2+H 2O+CO 2↑ 6.(1)CuO CO (2)C+2CuO
FeSO 4+Cu 7.(1)CO C (2)CaCO 3 CaO+CO 2↑
2Cu+CO 2↑
CO 2+Ca(OH)2 CaCO 3↓+H 2O 8.(1)FeCl 3[或 Fe 2(SO 4)3] (2)Fe 2O 3+3CO
2Fe+3CO 2
Fe+2HCl
FeCl 2+H 2↑(或 Fe+CuCl 2 FeCl 2+Cu) 在金属活动性顺序里,铁排在氢(或铜)
前面 9.(1)CaCO 3 (2)Na 2CO 3+Ca(OH)2
CaCO 3↓+2NaOH [或 K 2CO 3+Ca(OH)2
CaCO 3↓+
2KOH ] (3)置换反应 10.(1)Fe CuCl 2 (2)2FeCl 2+Cl 2
(3)2FeCl 3+Fe
3FeCl 2 11.(1)催化作用 (2)②④⑤
2FeCl 3
(3)4 (4)红色粉末变为黑色 (5)Ca(OH)2+CO 2 CaCO 3↓+H 2O 12.(1)CO 2 HCl(合理即可)
(2)①2C+O 2
点燃
2CO ②2NaOH+CO 2 Na 2CO 3+H 2O ③Na 2CO 3+Ca(OH)2
CaCO 3↓+2NaOH
④Fe+CuSO 4
Cu+FeSO 4
13.(1)NaCl (2)3CO+Fe 2O 3
2Fe+3CO 2 Ca(OH)2+CO 2 CaCO 3↓+H 2O 14.(1)O 2
Na 2CO 3 (2)盐酸(或硫酸) (3)Ca(OH)2+CuSO 4
(4)2Al+6HCl
2AlCl 3+3H 2↑
Cu(OH)2↓+CaSO 4
题型之二
文字叙述型推断
例 2 HNO 3 Ba(NO 3)2 AgNO 3 练习
1.C
2.C
3.B
4.D
5.D
6.B
7.CaCO 3 100 Ca(OH)2 74
8.(1)Ba(OH)2、Na 2CO 3 KNO 3 FeCl 3、Na 2SO 4
(2)BaCO 3+2HCl
BaCl 2+H 2O+CO 2↑ 9.H 2SO 4、HCl BaCl 2、HCl KCl 、HCl H 2SO 4、KCl
10.(1)NaOH 烧碱(或火碱、苛性钠) (2)大于 潮解 (3)CuSO 4+2NaOH
Cu(OH)2↓
+Na 2SO 4 11.BaCl 2 溶液 Na 2SO 4 溶液 Na 2CO 3 溶液 稀盐酸 12.(1)氧化钙(CaO) (2)Na 2CO 3 +Ca(OH)2
NaCl+AgNO 3
CaCO 3↓+2NaOH 13.(1)干燥剂(或 CaO 或生石灰) 食盐(或 NaCl ) (2)
AgCl ↓+NaNO 3(或同时写两个反应均可)
题型之三 化学反应型推断
例 3 (1)化合 (2)O 2 CuCl 2 HCl (3)2NaOH+CuCl 2
Cu(OH)2↓+2NaCl
练习
1.D
2.B
3.D
4.B
5.D
6.(1)置换反 应 Fe+CuSO 4
FeSO 4+Cu (2)NaOH 有蓝色
沉淀从溶液中析出
(3)不一定 某些金属氧化物与酸反应生成盐和水,某些非金属氧化物与碱反应生成盐和 水 (4)冶炼金属(或炼铁) 7.Na 2SO 4 Na 2CO 3 Ba(OH)2 HCl 8.(1)AgNO 3 Na 2CO 3 Ca(NO 3)2 KNO 3 HCl
(2)AgNO 3+HCl
AgCl ↓+HNO 3
Na 2CO 3+2HCl 2NaCl+H 2O+CO 2↑ 9.CuO
H 2SO 4
C uSO 4 Cu(OH)2 K 2SO 4 BaSO 4 10.(1)H 2O H 2SO 4 (2)Cu(OH)2+H 2SO 4
CuSO 4+2KOH
Cu(OH)2+K 2SO 4
CuSO 4+2H 2O
11.H 2SO 4 Na 2CO 3 Ba(OH)2 HCl
H 2SO 4+Na 2CO 3
Ba(OH)2+2HCl
BaCl 2+2H 2O
Na 2SO 4+H 2O+CO 2↑
