第五章--热力学基础Word版

第五章 热力学基础
一、基本要求
1.掌握理想气体的物态方程。 2.掌握内能、功和热量的概念。 3.理解准静态过程。
4.掌握热力学第一定律的内容,会利用热力学第一定律对理想气体在等体、等压、等温和绝热过程中的功、热量和内能增量进行计算。
5.理解循环的意义和循环过程中的能量转换关系。掌握卡诺循环系统效率的计算,会计算其它简单循环系统的效率。
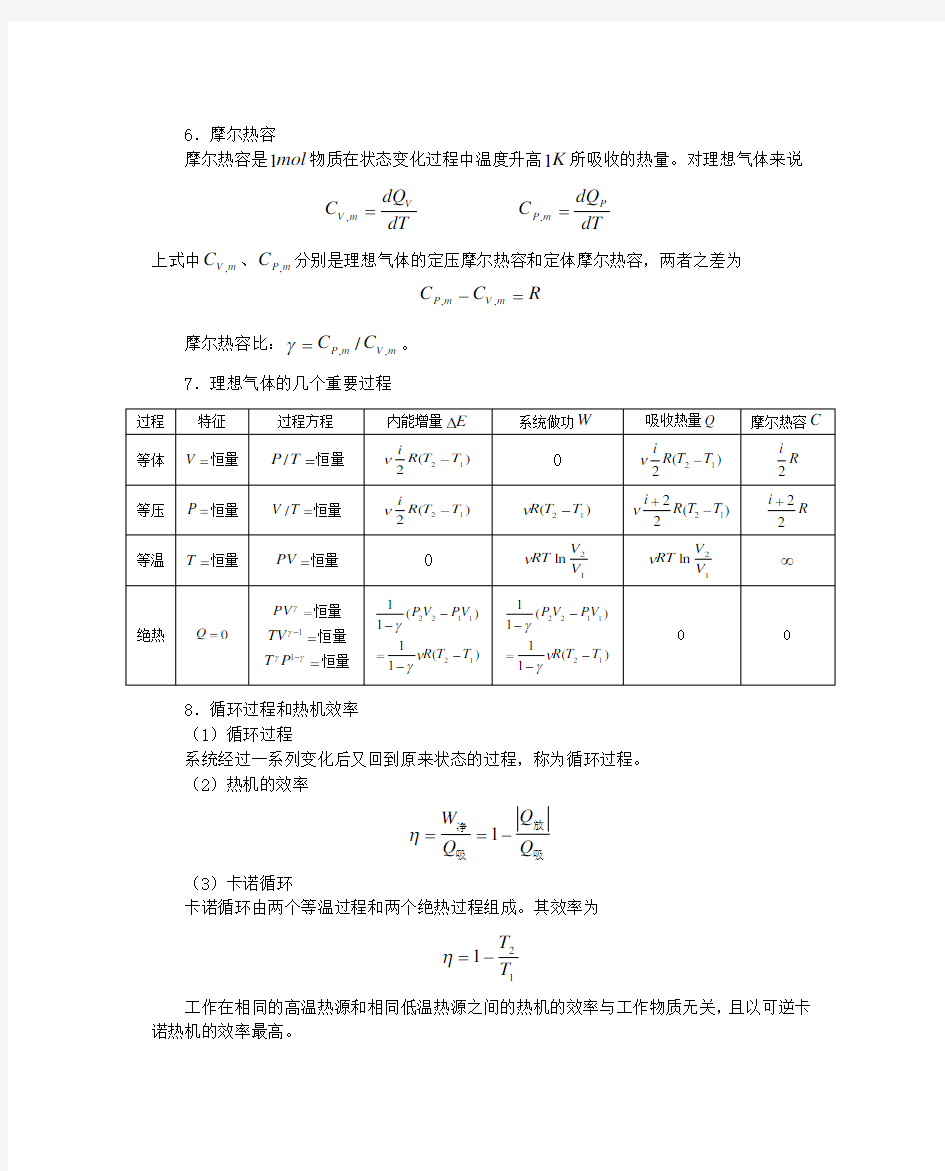
6.了解热力学第二定律和熵增加原理。 二、本章要点 1.物态方程
理想气体在平衡状态下其压强、体积和温度三个参量之间的关系为
RT M
m
PV =
式中是m 气体的质量,M 是气体摩尔质量。
2.准静态过程
准静态过程是一个理想化的过程,准静态过程中系统经历的任意中间状态都是平衡状态,也就是说状态对应确定的压强、体积、和温度。可用一条V P -曲线来表示
3.内能
是系统的单值函数,一般气体的内能是气体温度和体积的函数),(V T E E =,而理想气体的内能仅是温度的函数)(T E E =。
4.功、热量
做功和传递热量都能改变内能,内能是状态参量,而做功和传递热量都与过程有关。气体做功可表示为
?=2
1
V V PdV W
气体在温度变化时吸收的热量为
T C M
m
Q ?=
5.热力学第一定律
在系统状态发生变化时,内能、功和热量三者的关系为
W E Q +?=
应用此公式时应注意各量正负号的规定:0>Q ,表示系统吸收热量,0 界对系统做功。 6.摩尔热容 摩尔热容是mol 1物质在状态变化过程中温度升高K 1所吸收的热量。对理想气体来说 dT dQ C V m V = , dT dQ C P m P =, 上式中m V C ,、m P C ,分别是理想气体的定压摩尔热容和定体摩尔热容,两者之差为 R C C m V m P =-,, 摩尔热容比:m V m P C C ,,/=γ。 7.理想气体的几个重要过程 8.循环过程和热机效率 (1)循环过程 系统经过一系列变化后又回到原来状态的过程,称为循环过程。 (2)热机的效率 吸 放吸 净Q Q Q W - == 1η (3)卡诺循环 卡诺循环由两个等温过程和两个绝热过程组成。其效率为 1 2 1T T - =η 工作在相同的高温热源和相同低温热源之间的热机的效率与工作物质无关,且以可逆卡诺热机的效率最高。 9.热力学第二定律 热力学第二有两种表述既开尔文表述和克劳修斯表述,两种表述是等效的。热力学第一定律说明一切过程的进行都必须遵循能量守恒定律 热力学第二定律进一步说明,并非所有能量守恒的过程都能实现,自然界中出现的过程是有方向性的。热力学第二定律的实质是:自然界一切与热现象有关的宏观过程都是不可逆过程。 三、例题 5-1 如图所示,在一个具有绝热壁的刚性圆柱形气缸内,装有一绝热活塞L,起初活塞紧贴气缸B端的内壁,在整个气缸内装有摩尔数M m v /=的单原子理想气体,温度为T 。现设法无摩擦地把活塞缓慢地拉至某一位置,外界对气体作功为w ,则气缸中气体的温度变为_____。 解:根据热力学第一定律A E Q +?=,且过程中0=Q (绝热过程),则 w A E =-=? 又)(2 3 230T T vR T vR E -=?= ?,所以 mR Mw T vR w T T 323200+ =+= 5-2 如图,一定量的理想气体由状态A变 化到状态B,无论经过什么过程,系统必然是( A )。 (A)内能增加 (B)从外界吸热 (C)对外界做正功 解:内能是状态量,而热量,功与过程有关。例如如图所示的AB 和ACDEFB 两过程,都是B A →,但功和热量却不相等(ACDEFB 过程的功和热量可为负值)。选(A)。 5-3 图a 、b 、c 各表示一个循环过程,则循环( )的净功为正;循环( )的净功为负;循环( )的净功为零。 解:(C )(B )(A ) 循环过程的净功等于pv 图上循环曲线包围的面积(顺时针为正)。 5-4 1摩尔刚性双原子分子理想气体作绝热变化,温度降低20℃,则气体对外做功__________。 解:气体对外做功为 J T vR E A 5.415)20(31.812 5 25=-???-=?-=?-= 5-5 有一气筒,竖直放置,除底部外都是绝热的,上面是一个可以上下无摩擦运动的活塞,中间有一块隔板,把筒分为体积相等的两部分A和B,各盛有一摩尔的氮气,并且处于相同的状态,压强为Pa p 5 1101?=,现在由底部慢慢地把332.4焦耳的热量传递给气体,活塞上的压强始终保持1大气压,在下列两种情况下,分别求A和B的温度改变量以及它们各得到的热量? ⑴如果中间隔板是固定的导热板,且其热容量可略去不计。 ⑵如果中间隔板是绝热的且可以自由无摩擦地上下滑动。 解:(1)上部即A 部为等压过程,下部B 为等体过程。因为B A T T T ?=?=?,所以 T C A E Q P A ?=+?= T C A E Q V B ?=+?= T C C Q Q Q V P B A ?+=+=)( =?=?B A T T K C C Q T V P 67.631.8)2 527(4 .332=?+=+= ? J T R Q A 9.19367.631.827 27=??=???= J T R Q B 5.13867.631.82 5 25=??=???= (2)上部A 状态保持不变,下部B 为等压过程。因为0=A Q ,0=?A T ,J Q B 4.332=,且B P B T C Q ?= ,所以 K C Q T P B B 5.1131.82 74 .332=?== ? 5-6 各为1mol 的氢气和氦气,从同一初状态(0p ,0V )开始作等温膨胀。若氢气膨胀后体积变为02V ,氦气膨胀后压强变为2/0p ,则它们从外界吸收热量之比为________。 解:等温过程系统吸收的热量为 000ln v v v p Q ==p p v p 000ln 把已知条件代入,容易得 2 ln 002v p Q Q He H == 112::=He H Q Q 5-7 气体分子的质量可以由气体的定体比热算出来(气体的定体比热定义为:单位质量的气体经历等体过程、温度升高1度所需吸收的热量)。试根据定体摩尔热容量与定体比热的关系推导由定体比热计算分子质量的公式。已知某种单原子分子气体的定体比热 )/(314K kg J V C ?=,求每个该种原子的质量。 解:气体定体摩尔热容量为R i C V 2 =,则定体比热 mol mol V V M R i M C c 2== 式中mol M 为气体分子摩尔质量。 因为分子m N M mol 0=(0N 为阿伏加德罗常数),所以单个分子质量 kg c N R i m V 26 2301059.6314 1002.631.8232-?=???== 分子 5-8 同种理想气体的定压摩尔热容p C 大于定容摩尔热容V C ,因为______________。解:理想气体等压膨胀过程中吸收的热量不仅用来增加自身的内能,同时还要对外做功。 5-9 一定量的理想气体经历a-b-c 的变化过程,如图所示,其中气体( D )。 (A)只吸热,不放热。 (B)只放热,不吸热。 (C)有吸热也有放热,吸热量大于放热量。 (D)有吸热也有放热,放热量大于吸热量。 解:作如图所示的绝热线ac ,构成正循环acba 。对该循环,既有放热,又有吸热,且放吸Q Q >。考虑到ac 过程绝热,所以cba 过程既有吸热,又有吸热,且放吸Q Q >。反过来,对abc 过程, 有吸热也有放热,放热量大于吸热量。选(D)。 5-10 一系统由如图所示的a 状态沿acb 到达b 状态,有 320J热量传入系统,而系统对外做功 126J。(1)若adb 过程系统对外做功42J,问有多少热量传入系统?(2)当由b 状态沿曲线ba 返回状态a 时,外界对系统做功84J,试问系统是吸热还是放热?热量是多少? 解:对b c a →→过程:J Q 320=,J A 126=。所以内能增量 J A Q E E E a b 194=-=-=? (1)对b d a →→过程:J A 421=,J E E E a b 1941=-=?。所以吸热 )(23642194111J A E Q =+=+?= (2)对a b →过程:J A 842-=,J E E E b a 1942-=-=?。所以吸热 )(27842194222J A E Q -=--=+?= 负号表示系统放热。 5-11 一摩尔单原子理想气体从300K加热至350K,(1)体积没有变化;(2)压强保持不变。问在这两个过程中各吸收了多少热量?增加了多少内能?气体对外做了多少功? 解:(1)对等体过程 0=A )(1023.65031.82 3 232J T R E ?=??=?= ? E A E Q ?=+?=J 21023.6?= (2)对等压过程 )(1004.1502 5 3J R T Cp Q ?=??= ?= )(1023.65031.823 232J T R E ?=??=?=? J E Q A 21016.4?=?-= 5-12 如图AB 、DC 为绝热过程,CEA 为等温过程,BED 为任 意过程,组成一循环。若EDCE 所围面积为70J ,EABE 所围的面积为30J ,CEA 过程中系统放热100J ,则整个循环系统对外所做的净功_____ J 。在BED 过程中系统从外界吸热______ J 。 解:整个循环过程系统所做的净功为 )(403070J S S A EABE EDCE =-=-=净 对整个循环,净放吸净A Q Q Q =-=。考虑到AB 、DC 为绝热过程,CEA 过程放热,则BED 过程中系统从外界吸热 )(14040100J A Q Q Q BED =+=+==净放吸 5-13 一个绝热容器,用质量可忽略的绝热板分成体积相等的两部分。两边分别装入质 量相等、温度相同的氢气与氧气,开始时隔板固定。隔板释放后将发生移动,在达到新的平衡位置后( B )。 (A)氢气比氧气温度高 (B)氢气比氧气温度低 (C)两边温度总是相等 解:利用RT M m PV mol = 得,隔板释放前 V RT M m P molH H 22= V RT M m P molO O 22= 因为22molO molH M M <,故22O H P P >。所以隔板释放后,氢气绝热膨胀,温度降低;氧气绝热收缩,温度升高。选(B )。 5-14 用隔板将用绝热材料包着的容器分成左右两室,左室充有理想气体,压强为P ,温度为T ,右室为真空。将隔板抽掉,则气体最终的压强和温度为( A )。 (A ) 21P ,T (B )γ2/p ,T (C )P ,21T (D )21P ,21T ( E )γ 2/p ,21T 解:此过程为自由绝热膨胀,故内能不变,即温度不变。由RT pV ν=知,体积增大一倍时压强减为2/p 。选(A )。 5-15 理想气体在下列各图所示的循环过程中,哪些是物理上不可能实现的?(图中T表示等温线,Q表示绝热线) 解:(a )、(c)在物理上不可实现,因为在pv 图上同一点,绝热线应当比等温线陡;(d) 在物理上不可实现,因为在pv 图上,两条绝热线不能相交于一点;(b )可以实现。 5-16 如图,在PV图中有两条邻近的绝热线(Ⅰ、Ⅱ),则AB 为_________过程, FG 为___________过程。(填“吸热”,或“放热”,或“绝热”) 解:作等体线BC 和GH ,则构成两正循环ABCA 和HGFH 。 对ABCA 循环,BC 为放热过程,CA 为绝热过程,所以AB 必定为吸热过程;对HGFH 循环,HG 为放热过程,FH 为绝热过程,所以GF 必定为吸热过程,反过来,FG 一定是放热过程。 5-17 如图所示,Ⅰ为绝热过程,若各过程吸热用Q 表示,相应的比热用C 表示,则过程Ⅰ有( B E ),过程Ⅱ有( A F ),过程Ⅲ有( C D )。 (A)0>Q (B)0=Q (C)0 解:I 为绝热过程,故0=Q ,0=C 。 对正循环adca ,ca 为绝热过程,dc 为放热过程,所以ad 一定是吸热过程。又因为a →d 温度降低,所以ad 过程的比热为负。 对正循环acba ,ac 为绝热过程,cb 为放热过程,所以ba 一定是吸热过程,反过来,ab 一定是放热过程。又因为a →b 温度降低,所以ab 过程的比热为正。 5-18 3.2克氧气贮在一配有活塞的圆筒内,起始时压强为5 101?帕,体积为10升,先在等压情况下加热,使体积加倍,再在体积不变情况下加热,使压强加倍,然后经过一绝热膨胀,使温度降至开始时的数值。 (1)在PV图上画出该气体所经历的过程。 (2)求在每一过程中传给气体的热量、气体所做的功和气体内能的变化。 解:(1)气体所经历的过程如图所示。 (2)对等压过程B A →: )(100.11010101)(3351J V V P A A B A ?=???=--= )(105.2)(2 5 )(231J V P V P T T vR i E A A B B A B ?=-=-= ? J A E Q 3111105.3?=+?= 对等体过程C B →: 02=A J V P V P T T vR i E Q B B C C B C 322100.5)(2 5 )(2?=-=-= ?= 对绝热过程D C →: 03=Q J V P V P V P V P T T vR i E C C A A C C D D C D 331057)(2 5 )(25)(2??-=-=-=-= ? (由于D 、A 处在同一条等温线上,所以D D A A V P V P =) J E A 3331057??=?-= 5-19 一个可以无摩擦地在左右滑动的绝热薄隔板,把容积为 02V 的外部固定的绝热容器分为相同的两半Ⅰ和Ⅱ,其中各盛有一摩 尔的单原子的理想气体,两部分开始时的温度都是270 C 。如果用外力推动隔板使之向Ⅰ慢慢移动,使Ⅰ的体积变为原来的一半,求外力所做的功。 解:由于Ⅰ和Ⅱ进行的都是绝热过程,所以外力做功等于总内能增量。 两部分气体内能的增量分别为 )(23011T T R E -= ? )(23 022T T R E -=? 外力所做的功 ()0212122 3 T T T R E E E A -+= ?+?=?= 因为 100122111---==γγγV T V T V T 所以 3 2 01 01 100122 ?=?=? ?? ? ??=--T T V V T T γγ 3 201 01 20023232?? ? ???=? ? ? ???=??? ? ??=--T T V V T T γγ 因此 )(1031.1232230031.823232223332 32 32320J RT A ?=??? ?????-??? ??+???=????????-??? ??+= 5-20 一个测定空气γ的实验如下:大玻璃瓶内装有干燥空气,瓶上有一小活门和大气相通,又有一连通器和气压计相连。开始时,已将活门关闭,并使瓶中气体的初温T1与室 温相同,初压强P1比大气压P0稍高。现打开活门让气体膨胀,一见其压强与大气压强平衡时便迅速关上活门,此时气体的温度已略有降低。待气体温度与室温重新平衡时,压强又略有上升并到达P2,试证明空气的γ为 2 10 1/ln /ln P P P P = γ 解:气体先后经过绝热膨胀过程和等体过程,如图所示。 对绝热过程,有 r r r r T P T P ----=2 101 11 统计热力学基础 一、选择题 1. 下面有关统计热力学的描述,正确的是:( ) A. 统计热力学研究的是大量分子的微观平衡体系 B. 统计热力学研究的是大量分子的宏观平衡体系 C. 统计热力学是热力学的理论基础 D. 统计热力学和热力学是相互独立互不相关的两门学科B 2. 在研究N、V、U有确定值的粒子体系的统计分布时,令刀n i = N,刀n i & i = U , 这是因为所研究的体系是:( ) A. 体系是封闭的,粒子是独立的 B 体系是孤立的,粒子是相依的 C. 体系是孤立的,粒子是独立的 D. 体系是封闭的,粒子是相依的C 3. 假定某种分子的许可能级是0、&、2 £和3 &,简并度分别为1、1、2、3四个这样的分子构成的定域体系,其总能量为3£时,体系的微观状态数为:() A. 40 B. 24 C. 20 D. 28 A 4. 使用麦克斯韦-波尔兹曼分布定律,要求粒子数N 很大,这是因为在推出该定律时:( ) . 假定粒子是可别的 B. 应用了斯特林近似公式 C. 忽略了粒子之间的相互作用 D. 应用拉氏待定乘因子法A 5. 对于玻尔兹曼分布定律n i =(N/q) ? g i ? exp( - £ i/kT)的说法:(1) n i是第i能级上的粒子分布数; (2) 随着能级升高,£ i 增大,n i 总是减少的; (3) 它只适用于可区分的独立粒子体系; (4) 它适用于任何的大量粒子体系其中正确的是:( ) A. (1)(3) B. (3)(4) C. (1)(2) D. (2)(4) C 6. 对于分布在某一能级£ i上的粒子数n i,下列说法中正确是:() A. n i 与能级的简并度无关 B. £ i 值越小,n i 值就越大 C. n i 称为一种分布 D. 任何分布的n i 都可以用波尔兹曼分布公式求出B 7. 15?在已知温度T时,某种粒子的能级£ j = 2 £ i,简并度g i = 2g j,则「和£ i上 分布的粒子数之比为:( ) A. 0.5exp( j/2£kT) B. 2exp(- £j/2kT) C. 0.5exp( -£j/kT) D. 2exp( 2 j/k£T) C 8. I2的振动特征温度? v= 307K,相邻两振动能级上粒子数之n(v + 1)/n(v) = 1/2的温度是:( ) A. 306 K B. 443 K C. 760 K D. 556 K B 9. 下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:( ) A. S、G、F、C v B. U、H、P、C v C. G、F、H、U D. S、U、H、G B 10. 分子运动的振动特征温度?v是物质的重要性质之一,下列正确的说法是: ( ) A. ? v越高,表示温度越高 B. ?v越高,表示分子振动能越小 C. ?越高,表示分子处于激发态的百分数越小 D. ?越高,表示分子处于基态的百分数越小 C 11. 下列几种运动中哪些运动对热力学函数G与 第八章 热力学基础 一、选择题 [ A ]1.(基础训练4)一定量理想气体从体 积 V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A → C 等温过程;A → D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ?+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =; AB 等压过程:AB AB E A Q ?+=,且0 >?AB E [ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板 抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 (A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ. 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+?得 0E ?=, ∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =. [ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则应有 (A) 0......0=???=?S E 【提示】由上题分析知:0=?E ;而绝热自由膨胀过程是孤立系统中的不可逆过 第13章 热力学基础作业题答案 一 简答题: 1、什么是准静态过程? 答:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。 2、 比较摩尔定体热容和摩尔定压热容的异同。 答:相同点:都表示1摩尔气体温度升高1摄氏度时气体所吸收的热量。 不同点:摩尔定体热容是1摩尔气体,在体积不变的过程中,温度升高1摄氏度时气体所吸收的热量。摩尔定压热容是1摩尔气体,在压强不变的过程中,温度升高1摄氏度时气体所吸收的热量。两者之间的关系为R C C v p += 3、简述热力学第二定律的两种表述。 答:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。 克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。 4、什么是熵增加原理 答:一切不可逆绝热过程中的熵总是增加的,可逆绝热过程中的熵是不变的。把这两种情况合并在一起就得到一个利用熵来判别过程是可逆还是不可逆的判据——熵增加原理 二、选择题(每个题至少有一个正确答案) 1、对于理想气体的内能,下列说法中正确的是(B ) ( A ) 理想气体的内能可以直接测量的。 (B) 理想气体处于一定的状态,就有一定的内能。 (C )当理想气体的状态改变时,内能一定跟着变化。 (D )理想气体的内能变化与具体过程有关。 2、如图:一绝热容器被隔板K 隔开成ab 两部分,已知a 有一稀薄气体,b 内为真空。抽开隔板K 后,a 内气体进入b ,最终达到平衡状态,在此过程中(B ) ( A )气体对外做功,内能减少。 (B) 气体不做功,内能不变。 (C )气体压强变小,温度降低。 (D )气体压强变小,温度降低。 统计热力学基础 题 择 一、选 1. 下面有关统计热力学的描述,正确的是:( ) A. 统计热力学研究的是大量分子的微观平衡体系 B. 统计热力学研究的是大量分子的宏观平衡体系 C. 统计热力学是热力学的理论基础 D. 统计热力学和热力学是相互独立互不相关的两门学科B 2.在研究N、V、U 有确定值的粒子体系的统计分布时,令∑n i = N,∑n iεi = U, 3.这是因为所研究的体系是:( ) A. 体系是封闭的,粒子是独立的 B 体系是孤立的,粒子是相依的 C. 体系是孤立的,粒子是独立的 D. 体系是封闭的,粒子是相依的 C 4.假定某种分子的许可能级是0、ε、2ε和3ε,简并度分别为1、1、2、3 四个这样的分子构成的定域体系,其总能量为3ε时,体系的微观状态数为:( ) A. 40 B. 24 C. 20 D. 28 A 5. 使用麦克斯韦-波尔兹曼分布定律,要求粒子数N 很大,这是因为在推出该定律 6.时:( ) . 假定粒子是可别的 B. 应用了斯特林近似公式 C. 忽略了粒子之间的相互作用 D. 应用拉氏待定乘因子法 A 7.对于玻尔兹曼分布定律n i =(N/q) ·g i·exp( -εi/kT)的说法:(1) n i 是第i 能级上的 粒子分布数; (2) 随着能级升高,εi 增大,n i 总是减少的; (3) 它只适用于可区分的独 8.立粒子体系; (4) 它适用于任何的大量粒子体系其中正确的是:( ) A. (1)(3) B. (3)(4) C. (1)(2) D. (2)(4) C 9.对于分布在某一能级εi 上的粒子数n i ,下列说法中正确是:( ) 10.A. n i 与能级的简并度无关 B. εi 值越小,n i 值就越大 C. n i 称为一种分布 D.任何分布的n i 都可以用波尔兹曼分布公式求出 B 11. 15.在已知温度T 时,某种粒子的能级εj = 2εi,简并度g i = 2g j,则εj 和εi 上分布的粒子数之比为:( ) A. 0.5exp( j/2εk T) B. 2exp(- εj/2kT) C. 0.5exp( -εj/kT) D. 2exp( 2 j/kεT) C 12. I2 的振动特征温度Θv= 307K,相邻两振动能级上粒子数之n(v + 1)/n(v) = 1/2 的温度 13.是:( ) A. 306 K B. 443 K C. 760 K D. 556 K B 14.下面哪组热力学性质的配分函数表达式与体系中粒子的可别与否无关:( ) A. S、G、F、C v B. U、H、P、C v C. G、F、H、U D. S、U、H、G B 15. 分子运动的振动特征温度Θv 是物质的重要性质之一,下列正确的说法是: ( ) A.Θv 越高,表示温度越高 B.Θv 越高,表示分子振动能越小 C. Θv 越高,表示分子处于激发态的百分数越小 D. Θv 越高,表示分子处于基态的百分数越小 C 16.下列几种运动中哪些运动对热力学函数G 与A 贡献是不同的:( ) A. 转动运动 B. 电子运动 C. 振动运动 D. 平动运动 D 17.三维平动子的平动能为εt = 7h 2 /(4mV2/ 3 ),能级的简并度为:( ) 统计热力学基础 一、单选题 1) 统计热力学主要研究(A )。 (A) 平衡体系(B) 近平衡体系(C) 非平衡体系(D) 耗散结构(E) 单个粒子的行为 2) 体系的微观性质和宏观性质是通过( C)联系起来的。 (A) 热力学(B) 化学动力学(C) 统计力学(D) 经典力学(E) 量子力学 3) 统计热力学研究的主要对象是:( D) (A) 微观粒子的各种变化规律(B) 宏观体系的各种性质 (C) 微观粒子的运动规律(D) 宏观系统的平衡性质 (E) 体系的宏观性质与微观结构的关系 4) 下述诸体系中,属独粒子体系的是:(D ) (A) 纯液体(B) 理想液态溶液(C) 理想的原子晶体(D) 理想气体(E) 真实气体 5) 对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:(B ) (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论(D) 统计学原理(E) 能量均分原理 6) 在台称上有7个砝码,质量分别为1g、2g、5g、10g、50g、100g,则能够称量的质量共有:(B ) (A) 5040 种(B) 127 种(C) 106 种(D) 126 种 7) 在节目单上共有20个节目序号,只知其中独唱节目和独舞节目各占10个,每人可以在节目单上任意挑选两个不同的节目序号,则两次都选上独唱节目的几率是:(A ) (A) 9/38 (B) 1/4 (C) 1/180 (D) 10/38 8) 以0到9这十个数字组成不重复的三位数共有(A ) (A) 648个(B) 720个(C) 504个(D) 495个 9) 各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:(B ) (A)?ε t > ?ε r > ?ε v > ?ε e(B)?ε t < ?ε r < ?ε v < ?ε e (C) ?ε e > ?ε v > ?ε t > ?ε r(D)?ε v > ?ε e > ?ε t > ?ε r (E)?ε r > ?ε t > ?ε e > ?ε v 10) 在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:(C ) (A) 气体和晶体皆属定域子体系(B) 气体和晶体皆属离域子体系 (C) 气体属离域子体系而晶体属定域子体系(D) 气体属定域子体系而晶体属离域子体系 11) 对于定域子体系分布X所拥有的微观状态t x为:( B) 一、选择题 [ A ]1.(基础训练4)一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ?+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =; AB 等压过程:AB AB E A Q ?+=,且0>?A B E [ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板 分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真 空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是(A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ . 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+?得 0E ?=,∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =. [ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则应有 (A) 0...... 0=???=?S E 【提示】由上题分析知:0=?E ;而绝热自由膨胀过程是孤立系统中的不可逆过程,故熵增加。 [ D ]4.(自测提高1)质量一定的理想气体,从相同状态出发,分别经历等温过程、等压过程和绝热过程,使其体积增加1倍.那么气体温度的改变(绝对值)在 (A) 绝热过程中最大,等压过程中最小. (B) 绝热过程中最大,等温过程中最小. (C) 等压过程中最大,绝热过程中最小. (D) 等压过程中最大,等温过程中最小. 【提示】如图。等温AC 过程:温度不变,0C A T T -=; 等压过程:A B p p =,根据状态方程pV RT ν=,得: B A B A T T V V =,2B A T T ∴=,B A A T T T -= 第六章 统计热力学基础 内容提要: 1、 系集最终构型: 其中“n*”代表最可几分布的粒子数目 2.玻耳兹曼关系式: 玻耳兹曼分布定律: 其中,令 为粒子的配分函数。玻耳兹曼分布定律描述了微观粒子能量分布中最可几的分布方式。 3、 系集的热力学性质: (1)热力学能U : (2)焓H : **ln ln ln ! i n i m i i g t t n ≈=∏ 总2,ln ( )N V Q U NkT T ?=?i i i Q g e βε-=∑ *i i i i i i i i n g e g e N g e Q βεβεβε---==∑ m ln ln S k t k t ==总 (3)熵S : (4)功函A : (5)Gibbs 函数G : (6)其他热力学函数: 4、粒子配分函数的计算 (1)粒子配分函数的析因子性质 粒子的配分函数可写为: ,ln ln ln ()m N V S k t Q Q Nk NkT Nk N T =?=++? (i) t v e n r kT i i kT kT kT kT kT t r v e n t r v e n t r v e n Q g e g e g e g e g e g e Q Q Q Q Q εεεεεε------===∑∑∑∑∑∑2,ln N V Q H U pV NkT NkT T ??? =+=+ ????ln Q A NkT NkT N =--ln Q G NkT N =-() 22 ln ln ln ln V V U Q Q C Nk Nk T T T ????? ==+ ?????? 第十三章习题 热力学第一定律及其应用 1、如图所示,一定量理想气体从体积V1,膨胀到体积V2分别经历的过程是:A→B等压过程,A→C等温过程;A→D绝热过程,其中吸热量最多的过程。 2、一定量的理想气体,分别经历如图(1) 所示 的abc过程,(图中虚线ac为等温线),和图(2) 所 示的def过程(图中虚线df为绝热线).判断这两 种过程是吸热还是放热. abc过程 热,def过程热. 3、如图所示,一绝热密闭的容器,用隔板分成相等的两部 分,左边盛有一定量的理想气体,压强为p0,右边为真空.今 将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压 强是。(= γC p/C V) 4、一定量理想气体,从同一状态开始使其体积由V1膨胀到2V1,分别经历以下三种过程:(1) 等压过程;(2) 等温过程;(3)绝热过程.其中:__________过程气体对外作功最多;____________过程气体内能增加最多;__________过程气体吸收的热量最多. 答案 1、是A-B吸热最多。 2、abc过程吸热,def过程放热。 3、P0/2。 4、等压,等压,等压V V 理想气体的功、内能、热量 1、有两个相同的容器,容积固定不变,一个盛有氦气,另一个盛有氢气(看成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢气,使氢气温度升高,如果使氦气也升高同样的温度,则应向氨气传递热量是 。 2、 一定量的理想气体经历acb 过程时吸热500 J .则 经历acbda 过程时,吸热为 。 3、一气缸内贮有10 mol 的单原子分子理想气体,在压缩过程中外界作功209J , 气体升温1 K ,此过程中气体内能增量为 _____ ,外界传给气体的热量为___________________. (普适气体常量 R = 8.31 J/mol· K) 4、一定量的某种理想气体在等压过程中对外作功为 200 J .若此种气体为单 原子分子气体,则该过程中需吸热_____________ J ;若为双原子分子气体,则 需吸热______________ J. 5、 1 mol 双原子分子理想气体从状态A (p 1,V 1)沿p -V 图所示直线变化到状态B (p 2,V 2),试求: (1) 气体的内能增量. (2) 气体对外界所作的功. (3) 气体吸收的热量. (4) 此过程的摩尔热容. (摩尔热容C =T Q ??/,其中Q ?表示1 mol 物质在过程中升高温度T ?时所吸收的热量.) p (×105 Pa) -3 m 3) p p p 12 第七章统计热力学基础 一、选择题 1、统计热力学主要研究()。 (A) 平衡体系(B)单个粒子的行为案(C) 非平衡体系(D) 耗散结构 2、能量零点的不同选择,在下面诸结论中哪一种说法是错误的:( ) (A) 影响配分函数的计算数值(B) 影响U,H,F,G 的数值 (C) 影响Boltzmann分布数N 的数值(D) 影响能级能量εi的计算数值 3、最低能量零点选择不同,对哪些热力学函数值无影响:( ) (A) U (B) S (C) G (D) H 4、统计热力学研究的主要对象是:() (A) 微观粒子的各种变化规律 (B) 宏观体系的各种性质 (C) 微观粒子的运动规律 (D) 宏观系统的平衡性质 5、对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:() (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论(D) 统计学原理 6、以0到9这十个数字组成不重复的三位数共有() (A) 648个(B) 720个(C) 504个(D) 495个 7、各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:() (A) t > r > v > e(B) t < r < v < e (C) e > v > t > r(D) v > e > t > r 8、在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:() (A) 气体和晶体皆属定域子体系 (B) 气体和晶体皆属离域子体系 (C) 气体属离域子体系而晶体属定域子体系 (D) 气体属定域子体系而晶体属离域子体系 9、对于定域子体系分布X所拥有的微观状态t x为:() (A) (B) 热力学基础作业 班级:_____________ 姓名:_____________ 学号:_____________ 日期:__________年_______月_______日 成绩:_____________ 一、选择题 1. 一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度 (A) 将升高. (B) 将降低. (C) 不变. (D)升高还是降低,不能确定. [ ] 2. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了 (A)0.500. (B) 400. (C) 900. (D) 2100. [ ] 3. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为: (A) pV / m . (B) pV / (kT ). (C) pV / (RT ). (D) pV / (mT ). [ ] 4. 理想气体向真空作绝热膨胀. (A) 膨胀后,温度不变,压强减小. (B) 膨胀后,温度降低,压强减小. (C) 膨胀后,温度升高,压强减小. (D) 膨胀后,温度不变,压强不变. [ ] 5. 对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值? (A) 等体降压过程. (B) 等温膨胀过程. (C) 绝热膨胀过程. (D) 等压压缩过程. [ ] 6. 如果卡诺热机的循环曲线所包围的面积从图 中的abcda 增大为da c b a '',那么循环abcda 与da c b a ''所作的净功和热机效率变化情况是: (A) 净功增大,效率提高. (B) 净功增大,效率降低. (C) 净功和效率都不变. (D) 净功增大,效率不变. [ ] 7. 两个卡诺热机的循环曲线如图所示,一个工作在温度为T 1 与T 3的两个热源之间,另一个工作在温度为T 2 与T 3的两个热源之间,已知这两个循环曲线所包围的面积相等.由此可知: (A ) 两个热机的效率一定相等. (B ) 两个热机从高温热源所吸收的热量一定相等. c ' d T 2 a b b ' c T 1V O p 《大学物理学》热力学基础 一、选择题 13-1.如图所示,bca 为理想气体的绝热过程,b 1a 和b 2a 是任意过程,则上述两过程中气体做功与吸收热量的情况是 ( ) (A )b 1a 过程放热、作负功,b 2a 过程放热、作负功; (B )b 1a 过程吸热、作负功,b 2a 过程放热、作负功; (C )b 1a 过程吸热、作正功,b 2a 过程吸热、作负功; (D )b 1a 过程放热、作正功,b 2a 过程吸热、作正功。 【提示:体积压缩,气体作负功;三个过程中a 和b 两点之间的内能变化相同,bca 线是绝热过程,既不吸热也不放热,b 1a 过程作的负功比b 2a 过程作的负功多,由Q W E =+?知b 2a 过程放热,b 1a 过程吸热】 13-2.如图,一定量的理想气体,由平衡态A 变到平衡态B ,且他们的压强相等,即A B P P =。问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然 ( ) (A )对外作正功;(B )内能增加; (C )从外界吸热;(D )向外界放热。 【提示:由于A B T T <,必有A B E E <;而功、热量是 过程量,与过程有关】 13-3.两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性理想气体),开始时它们的压强和温度都相同,现将3 J 的热量传给氦气,使之升高到一定的温度,若氢气也升高到同样的温度,则应向氢气传递热量为 ( ) (A )6J ; (B )3J ; (C )5J ; (D )10J 。 【提示:等体过程不做功,有Q E =?,而2 mol M i E R T M ?= ?,所以需传5J 】 13-4.有人想象了如图所示的四个理想气体的循环过程,则在理论上可以实现的是( ) A () C () B () D () 第七章统计热力学基础 1. 设有一个体系,由三个定位的单维简谐振子所组成,体系能量为11/2 hν,这三个振子在三个固定的位置上振动,试求体系全部的微观状态数。 2. 当热力学体系的熵函数S增加0.418 J/K时,则体系的微观状态数增加多少?用ΔΩ/Ω1表示。 3. 对于双原子分子,证明: U r=NkT U v=NkT 设基态振动能为零,≈1+x 。 4.将N2气在电弧中加热,从光谱中观察到处于第一激发态的相对分子数 N(v=1)/N(v=0)=0.26,式中ν为振动量子数N(v=0)为基态占有的分子数,N(v=1)为第一激发振动态占有的分子数,已知N2的振动频率ν= 6.99×, (1) 计算气体温度。 (2) 计算振动能量在总能量(包括平动,转动和振动)中所占的百分数。 5.设某理想气体A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级的能量为ε,其简并度为2,忽略更高能级。 (1)写出A分子的总配分函数的表达式。 (2)设ε=kT,求出相邻两能级上最概然分子数之比n1/n0。 (3)设ε=kT,试计算1 摩尔该气体的平均能量是多少? 6.某气体的第一电子激发态比基态能量高400 kJ/mol,试计算 (1)在300 K时,第一激发态分子所占的百分数? (2)若要使激发态的分子数占10%,则需多少温度? 7.零族元素氩(Ar)可看作理想气体,相对分子量为40,取分子的基态(设其简并度为1)作为能量零点,第一激发态(设其简并度为2)与基态能量差为ε,忽略其它高能级。 (1)写出氩分子的总的配分函数表达式。 (2)设ε=5kT,求在第一激发态上最可几分布的分子数占总分子数的百分数。 大学物理课堂作业 热力学基础 一、填空题 1 在p?V图上 (1) 系统的某一平衡态用_____________来表示; (2) 系统的某一平衡过程用________________来表示; (3) 系统的某一平衡循环过程用__________________来表示; 2.处于平衡态A的一定量的理想气体,若经准静态等体过程变到平衡态B,将从外界吸收热量416 J,若经准静态等压过程变到与平衡态B有相同温度的平衡态C,将从外界吸收热量582 J,所以,从平衡态A变到平衡态C的准静态等压 过程中气体对外界所作的功为____________________. 3.一定量的某种理想气体在等压过程中对外作功为200 J.若此种气体为单 原子分子气体,则该过程中需吸热_____________ J;若为双原子分子气体,则 需吸热______________ J. 4.可逆卡诺热机可以逆向运转.逆向循环时, 从低温热源吸热,向高温热源放热,而且吸的热量和放出的热量等于它正循环时向低温热源放出的热量和从高温热源吸的热量.设高温热源的温度为T1 =450 K , 低温热源的温度为T2 =300 K, 卡诺热机逆向循环时从低温热源吸热Q2 =400 J,则该卡诺热机逆向循环一次外界必须 作功W=_________. 5. 一热机从温度为727℃的高温热源吸热,向温度为527℃的低温热源放热.若 热机在最大效率下工作,且每一循环吸热2000 J ,则此热机每一循环作功_____ ____________ J. 6. 从统计的意义来解释, 不可逆过程实质上是一个________________________ __________________________的转变过程, 一切实际过程都向着_____________ _____________________________的方向进行. γC p/C V为已知)的循环过程如T-V图所示,其中CA为绝热过程,7. 1 mol 理想气体(设= A点状态参量(T1,V1)和B点的状态参量(T2,V2)为已知.试求C点的状态参量: 第一次 热力学基础练习与答案 班 级 ___________________ 姓 名 ___________________ 班内序号 ___________________ 一、选择题 1. 如图所示,一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程 是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最 多的过程 [ ] (A) 是A →B. (B) 是A →C. (C) 是A →D. (D) 既是A →B 也是A →C , 两过程吸热一样多。 2. 有两个相同的容器,容积固定不变,一个盛有氨气,另一个盛有氢气(看 成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢 气,使氢气温度升高,如果使氨气也升高同样的温度,则应向氨气传递热量 是: [ ] (A) 6 J. (B) 5 J. (C) 3 J. (D) 2 J. 3.一定量的某种理想气体起始温度为T ,体积为V ,该气体在下面循环过程中经过三个平衡过程:(1) 绝热膨胀到体积为2V ,(2)等体变化使温度恢复为T ,(3) 等温压缩到原来体积V ,则此整个循环过程中 [ ] (A) 气体向外界放热 (B) 气体对外界作正功 (C) 气体内能增加 (D) 气体内能减少 4. 一定量理想气体经历的循环过程用V -T 曲线表示如图.在此循 环过程中,气体从外界吸热的过程是 [ ] (A) A →B . (B) B →C . (C) C → A . (D) B → C 和B →C . 5. 设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在 一次卡诺循环中,传给低温热源的热量是从高温热源吸取热量的 [ ] (A) n 倍. (B) n -1倍. (C) n 1倍. (D) n n 1 倍. 6.如图,一定量的理想气体,由平衡状态A 变到平衡状态 B (p A = p B ),则无论经过的是什么过程,系统必然 [ ] (A) 对外作正功. (B) 内能增加. (C) 从外界吸热. (D) 向外界放热. V V 第七章统计热力学基础 一、单选题 1.统计热力学主要研究()。 (A) 平衡体系(B) 近平衡体系(C) 非平衡体系 (D) 耗散结构(E) 单个粒子的行为 2.体系的微观性质和宏观性质是通过()联系起来的。 (A) 热力学(B) 化学动力学(C) 统计力学(D) 经典力学(E) 量子力学 3.统计热力学研究的主要对象是:() (A) 微观粒子的各种变化规律(B) 宏观体系的各种性质 (C) 微观粒子的运动规律(D) 宏观系统的平衡性质 (E) 体系的宏观性质与微观结构的关系 4.下述诸体系中,属独粒子体系的是:() (A) 纯液体(B) 理想液态溶液(C) 理想的原子晶体 (D) 理想气体(E) 真实气体 5.对于一个U,N,V确定的体系,其微观状态数最大的分布就是最可几分布,得出这一结论的理论依据是:() (A) 玻兹曼分布定律(B) 等几率假设(C) 分子运动论 (D) 统计学原理(E) 能量均分原理 6.在台称上有7个砝码,质量分别为1g、2g、5g、10g、50g、100g,则能够称量的质量共有:() (A) 5040 种(B) 127 种(C) 106 种(D) 126 种 7.在节目单上共有20个节目序号,只知其中独唱节目和独舞节目各占10个,每人可以在节目单上任意挑选两个不同的节目序号,则两次都选上独唱节目的几率是:() (A) 9/38 (B) 1/4 (C) 1/180 (D) 10/38 8.以0到9这十个数字组成不重复的三位数共有() (A) 648个(B) 720个(C) 504个(D) 495个 9.各种不同运动状态的能级间隔是不同的,对于同一种气体分子,其平动、转动、振动和电子运动的能级间隔的大小顺序是:() (A)△e t >△e r >△e v >△e e(B)△e t <△e r <△e v <△e e (C) △e e >△e v >△e t >△e r(D)△e v >△e e >△e t >△e r (E)△e r >△e t >△e e >△e v 10.在统计热力学中,对物系的分类按其组成的粒子能否被分辨来进行,按此原则:() (A) 气体和晶体皆属定域子体系(C) 气体属离域子体系而晶体属定域子体系 (B) 气体和晶体皆属离域子体系(D) 气体属定域子体系而晶体属离域子体系 11.对于定位系统分布X所拥有的微观状态t x为:(B) (A)(B) 第六章热力学基础作业新答案 课件一补充题: (2)先等压压缩,W 2=P(V 2-V 1)=-8.1J 对全过程,有 Q 2=W 2+?E =-8.1J ?E=0 (T 1=T 2) 对全过程 等容升压,W 3=0 (1)等温过程, ?E=0 122 11111 V V ln ln V R P V T V Q W ν===561001020 ln 1.0131016.3J 100-=-??=? [补充题] 把P =1a tm ,V =100cm 3的氮气压缩到20cm 3 ,求若分别经历 的是下列过程所需吸收的热量Q 、对外所做的功W 及内能增量,(1)等温压缩;(2)先等压压缩再等容升压回到初温。 (2)系统由状态b 沿曲线ba 返回状态a 时,系统的内能变化: 204()ba ab E E J =-=- 204(282)486()ba ba Q E W J ∴=?+=-+-=- 即系统放出热量486J 6-22 64g 氧气的温度由0℃升至50℃,〔1〕保 持体积不变;(2)保持压强不变。在这两个过程中氧气各吸收了多少热量?各增加了多少内能?对外各做了多少功? 解:(1)3.6458.31(500) 2.0810()322v m Q vC T J =?=???-=? 32.0810()E J ?=? W =0 (2)3.64528.31(500) 2.9110()322p m Q vC T J +=?=???-=? 32.0810()E J ?=? 32(2.91 2.08)108.310()Q E J W -?=-?==? 6-24 一定量氢气在保持压强为4.00×510Pa 不 变的情况下,温度由0.0 ℃ 升高到50.0℃时,吸收了6.0×104 J 的热量。 (1) 求氢气的量是多少摩尔? 第三章统计热力学基础 返回上一页 1. 设有一个体系,由三个定位的单维简谐振子所组成,体系能量为11/2 hν,这三个振子在三个固定的位置上振动,试求体系全部的微观状态数。 2. 当热力学体系的熵函数S增加0.418 J/K时,则体系的微观状态数增加多少?用ΔΩ/Ω1表示。 3. 对于双原子分子,证明:U r=NkT U v=NkT 设基态振动能为零,≈1+x 。 4.将N2气在电弧中加热,从光谱中观察到处于第一激发态的相对分子数 N(v=1)/N(v=0)=0.26,式中ν为振动量子数N(v=0)为基态占有的分子数,N(v=1)为第一激发振动态占有的分子数,已知N2的振动频率ν= 6.99×, (1) 计算气体温度。 (2) 计算振动能量在总能量(包括平动,转动和振动)中所占的百分数。 5.设某理想气体A,其分子的最低能级是非简并的,取分子的基态作为能量零点,相邻能级的能量为ε,其简并度为2,忽略更高能级。 (1)写出A分子的总配分函数的表达式。 (2)设ε=kT,求出相邻两能级上最概然分子数之比n1/n0。 (3)设ε=kT,试计算1 摩尔该气体的平均能量是多少? 6.某气体的第一电子激发态比基态能量高400 kJ/mol,试计算 (1)在300 K时,第一激发态分子所占的百分数? (2)若要使激发态的分子数占10%,则需多少温度? 7.零族元素氩(Ar)可看作理想气体,相对分子量为40,取分子的基态(设其简并度为1)作为能量零点,第一激发态(设其简并度为2)与基态能量差为ε,忽略其它高能级。 (1)写出氩分子的总的配分函数表达式。 (2)设ε=5kT,求在第一激发态上最可几分布的分子数占总分子数的百分数。(3)计算1 mol Ar气在标准状态下的统计熵值。设Ar 的核和电子的简并度均等于1。 8. Na原子气体(设为理想气体)凝聚成一表面膜 (1)若Na原子在膜内可自由运动(即二维平动),试写出此凝聚过程的摩尔平动熵变的统计表达式。 (2)若 Na原子在膜内不动,其凝聚过程的摩尔平动熵变的统计表达式又将如何? (要用相对原子质量Ar,体积V,表面积A,温度T等表示的表达式) 本 章 要 点 1.体积功 2 1 d V V W p V = ? 2.热力学第一定律 21Q E E W E W =-+=?+ d d d Q E W =+ 3. 气体的摩尔热容 定容摩尔热容 2V i C R = 定压摩尔热容 (1)2 P i C R =+ 迈耶公式 C P =R+C V 4.循环过程 热机效率 2111Q W Q Q η= =- 制冷系数 22 12 Q T e W T T = =- 5. 卡诺循环 卡诺热机效率 211 1T W Q T η= =- 卡诺制冷机制冷系数 22 12 Q T e W T T = =- 6. 热力学第二定律定性表述:开尔文表述、克劳修斯表述;热力学第二定律的统计意义; 7. 熵与熵增原理 S=klnW 1 2ln W W k S =?≥0 2 211 d ( )Q S S S T ?=-= ? 可逆 习题10 一、选择题 10. A 二、填空题 1. 15J 2. 2/5 3. 4 1.610J ? 4. ||1W -; ||2W - 5. J ; J 6. 500 ;700 7. W /R ; W 2 7 8. 112 3 V p ;0 9. 22+i ; 2 +i i 10. 8.31 J ; J 三、计算题 1. -700J 2. (1)T C =100 K; T B = 300 K . (2) 400J AB W =; W BC = 200 J; W CA =0 (3)循环中气体总吸热 Q = 200 J . 3. (1) W da =-×103J ; (2) ΔE ab =×104 J ; (3) 净功 W = ×103 J ; (4)η= 13% 4. (1)10%η= ;(2)4 310bc W J =? 习题10 一 选择题 1. 1摩尔氧气和1摩尔水蒸气(均视为刚性分子理想气体),在体积不变的情况下吸收相等的热量,则它们的: (A )温度升高相同,压强增加相同。 (B )温度升高不同,压强增加不同。 (C )温度升高相同,压强增加不同。 (D )温度升高不同,压强增加相同 。 [ ] 2. 一定量理想气体,从状态A 开始,分别经历等压、等温、绝热三种过程(AB 、AC 、AD ), 其容积由V 1都膨胀到2V 1,其中 。 (A) 气体内能增加的是等压过程,气体内能减少的的是等温过程。 (B) 气体内能增加的是绝热过程,气体内能减少的的是等压过程。 (C) 气体内能增加的是等压过程,气体内能减少的的是绝热过程。 (D) 气体内能增加的是绝热过程,气体内能减少的的是等温过程。 [ ] 3. 如图所示,一定量的理想气体,沿着图10-17中直线从状态a ( 压强p 1 = 4 atm ,体积V 1 =2 L )变到状态b ( 压强p 2 =2 atm ,体积V 2 =4 L ).则在此过程中: (A ) 气体对外做正功,向外界放出热量. (B ) 气体对外做正功,从外界吸热. (C ) 气体对外做负功,向外界放出热量. (D ) 气体对外做正功,内能减少. [ ] 图10-17 图10-18 4. 若在某个过程中,一定量的理想气体的内能E 随压强p 的变化关系为一直线(其延长线过 p (atm) p 第三章 统计热力学基础 思考题: 1.当系统的U ,V ,N 一定时,由于粒子可以处于不同的能级上,因而分布数不同所以系统总微观数不能确定,这句话是否正确? 2.由离域子系统和定域子系统熵与配分函数的关系可以看出,定域子系统熵比离域子系统的熵大S=klnN!,但是一般说来晶体总比同温度下气体的熵小,为什么? 3.分子能量零点的选择不同,所有热力学函数的值都要改变,对吗? 4.三维平动子第一激发态的简并度是多少?一维谐振子第一激发态的简并度是多少? 5.对于单原子理想气体在室温下的一般物理化学过程,若要通过配分函数来求过程热力学函数的变化值,只须知道g t 这一配分函数值就行了,对吗? 选择题: 1.1mol 双原子理想气体常温下热力学能为: (A)RT 23 (B) RT 25 (C) RT 2 7 (D) 无法确定 2.下列化合物中,298.15K 时标准摩尔熵ΔS 0最大的是: (A) He (B) N 2 (C) CO (D) 一样大 3.在作N 、V 、U 有确定值的粒子体系的统计分布时,令∑n i = N ,∑n i εi = U ,这是因为所研究的体系是: (A) 体系是封闭的,粒子是独立的 (B) 体系是孤立的,粒子是相依的 (C) 体系是孤立的,粒子是独立的 (D) 体系是封闭的,粒子是相依的 4.下列哪个体系不具有玻尔兹曼-麦克斯韦统计特点 : (A) 每一个可能的微观状态以相同的几率出现 (B) 各能级的各量子态上分配的粒子数,受保里不相容原理的限制 (C) 体系由独立可别的粒子组成,U = ∑n i εi (D) 宏观状态参量 N 、U 、V 为定值的封闭体系 5. HI 的转动特征温度Θr =9.0K ,300K 时HI 的摩尔转动熵为: (A) 37.45J ·K -1·mol -1 (B) 31.70J ·K -1·mol -1 (C) 29.15J ·K -1·mol -1 (D) 都不正确 6. 对于单原子分子理想气体,当温度升高时,小于分子平均能量的能级上分布的粒子数: (A) 不变 (B) 增多 (C) 减少 (D) 不能确定 7. O 2的转动惯量J = 19.3 × 10-47 kg ·m 2,则O 2的转动特征温度是: (A) 10K (B) 5K (C) 2.07K (D) 8K 8. 各种运动形式的配分函数中与压力有关的是: (A) 电子配分函数 ; (B) 平动配分函数 ; (C) 转动配分函数 ; (D) 振动配分函数 。?E 表示内能增加,0W 系统对外界做功,0
C (E)0=C (F)0
第七章、统计热力学基础习题和答案
热力学作业 答案
第13章 热力学基础答案
第七章、统计热力学基础习题和答案
统计热力学基础复习整理版汇总
第八章的热力学作业(答案详解)
物理化学答案——第六章-统计热力学
第13章 热力学基础 之习题及参考答案
第七章 统计热力学基础
热力学基础习题
(完整word版)大学物理学热力学基础练习题
07章统计热力学基础(1)
热力学基础作业
1热力学基础练习题与答案
第七章 统计热力学基础
第六章 热力学基础作业新答案
第三章 统计热力学基础 (2)
热力学基础习题解答
第三章 统计热力学基础.
