医疗器械产品技术要求

医疗器械产品技术要求编号:
XXXXXX
1产品型号/规格及其划分说明
型号命名
P 2 0 0
设计序号
产品代号
结构组成(不同型号如有结构组成的差异,应分型号列明)
XXXXXX(以下简称XX)主要有X射线管组件(组合式)、限束器、操作台、影像处理系统、C形臂及可移动机架、医用X射线影像增强器组成。
型号说明(如有多个型号此条适用,列表标明型号间差异)
表1 型号说明
工作条件
a)环境温度:10℃-40℃;
b)相对湿度:30%-75%;
c)大气压力:700 hPa-1060 hPa。
d)电源:AC 220V±22V;50Hz±1Hz
e)额定输入功率:xxVA。
2性能指标
外观
……….
2. X安全要求
XXX安全要求应符合GB 的要求,产品主要特征见附录C。(适用设备)XXX安全要求应符合GB 的要求,产品主要特征见附录C。(适用设备)2. X电磁兼容(适用设备)
电磁兼容应符合YY 0505-2012的要求。
2. X电磁兼容(适用设备)
电磁兼容应符合GB/T 的要求。
2. X电磁兼容(体外诊断类适用设备)
电磁兼容应符合GB/T 及GB/T 的要求。
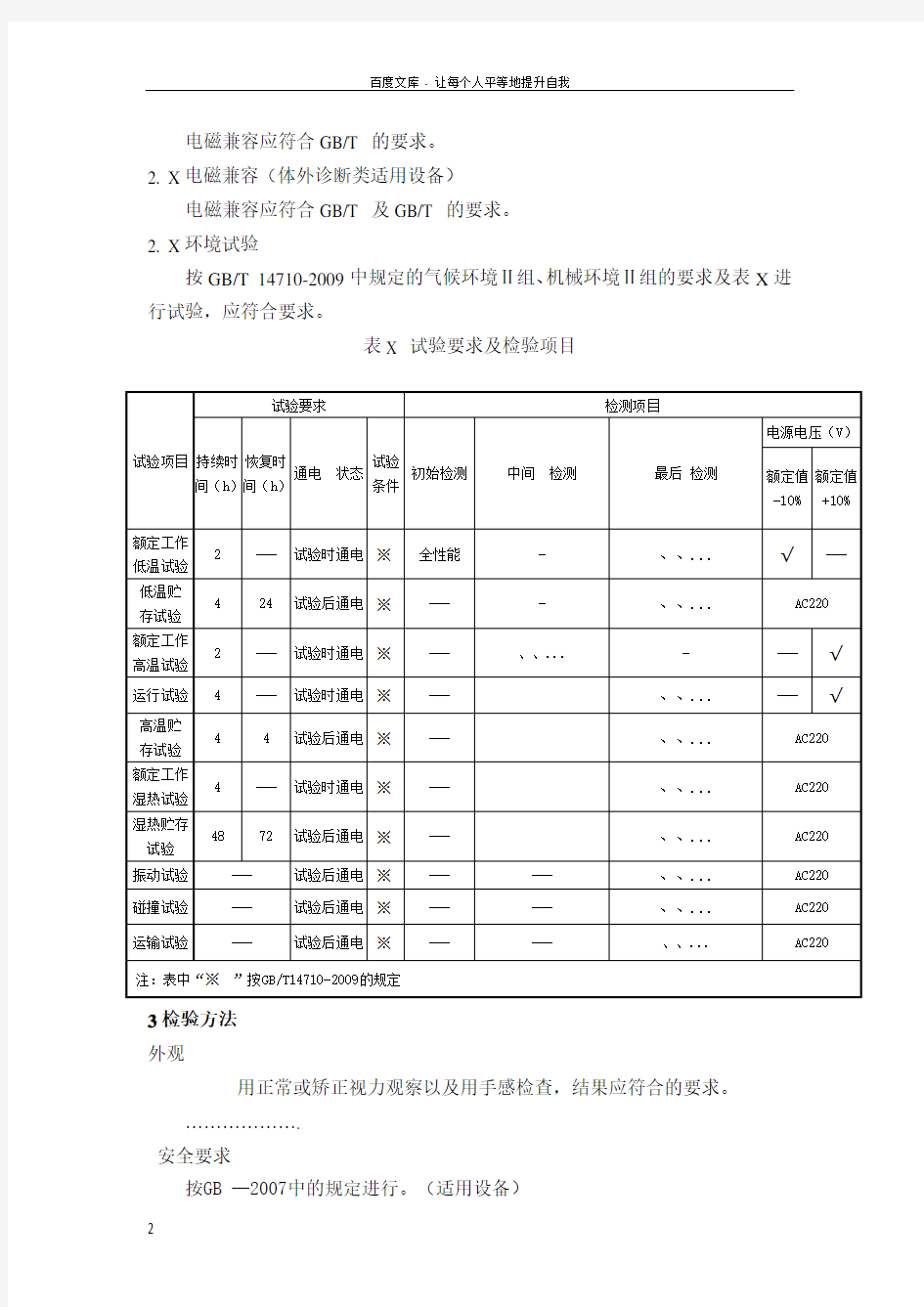
2. X环境试验
按GB/T 14710-2009中规定的气候环境Ⅱ组、机械环境Ⅱ组的要求及表X进行试验,应符合要求。
表X 试验要求及检验项目
3检验方法
外观
用正常或矫正视力观察以及用手感检查,结果应符合的要求。
……………….
安全要求
按GB —2007中的规定进行。(适用设备)
按GB 中的规定进行。(适用设备)
电磁兼容(适用设备)
电磁兼容试验按YY0505-2012的要求进行。
电磁兼容(适用设备)
电磁兼容试验按GB/T 的要求进行。
电磁兼容(体外诊断类适用设备)
电磁兼容试验按GB/T 及GB/T 的要求进行。
4术语
GB/T 10149-1988和GB/T 确立的术语和定义适用于本技术要求。
如有其他情况此通用模版无法表述,按实际情况确定!
附录A 产品引用标准及说明
1 规范性引用文件
下列文件对本文件的应用是必不可少的,凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有修改单)
适用于本标准。
GB/T 191-2008 包装储运图示标志
GB —2007 医用电气设备第1部分:安全通用要求YY 0076—1992 金属制件的镀层分类技术条件
。。。。。。
