高中历史 第二单元 商鞅变法知识点归纳与总结 人民版选修1知识分享

高中历史第二单元商鞅变法知识点归纳与总结人民版选修1
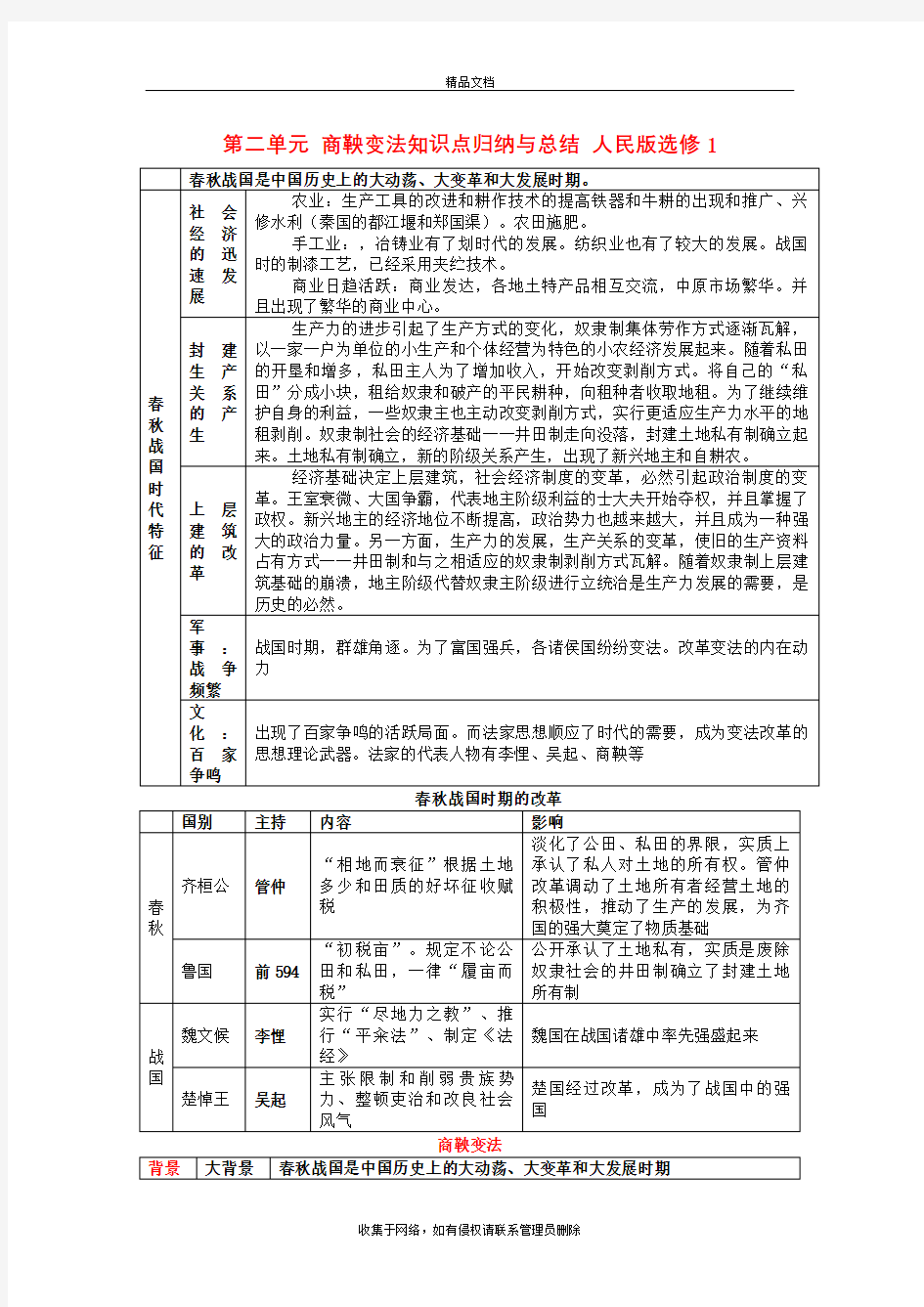
第二单元商鞅变法知识点归纳与总结人民版选修1
重农抑商政策的评价:
对秦的影响主要是积极的:在商品经济不发达的秦国,农业是经济基础,保证了封建国家的财源和兵员,促进了小农经济的发展,为秦国的统一准备了物质条件,这一政策对于农业生产的发展、封建制度的巩固曾起过积极的作用。
对后世的影响主要是消极的:历代统治者在商品经济逐渐发展的时候,仍然推行此政
策,抑制了商品经济和工商业的发展,阻碍了明朝中期后的资本主义萌芽的发展,进而造成中国近代落后,.同时,重农抑商政策,往往限制了社会经济的平衡发展,导致经济结构过分单一。历史上往往因为政策上的原因、认识上的偏差,造成一定消极影响。如为扩大耕地面积,人为地毁林开荒、围湖造田,导致了环境的恶化。
启示:商品经济、农业经济都是社会经济的重要组成部分,不可忽视任何一方;品经济
的发展有其内在的发展规律,不应该认为地禁锢他的发展;当今世界经济的多极化发展,商品经济前途广阔,随着现代化步伐加快,他将居于主导地位
化学选修三,人教版知识点总结
选修三知识点 第一章原子结构与性质 1能级与能层 ⑴构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。 能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错。说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而
是指这样顺序填充电子可以使整个原子的能量最低。 (2)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。 (3)泡利(不相容)原理:基态多电子原子中,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。 (4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则 洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。 4.基态原子核外电子排布的表示方法 (1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。 ②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。 ③外围电子排布式(价电子排布式) (2)电子排布图(轨道表示式)是指将过渡元素原子的电子排布式中符合上一周期稀有气体的原子的电子排布式的部分(原子实)或主族元素、0族元素的内层电子排布省略后剩下的式子。每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。如基态硫原子的轨道表示式为 二.原子结构与元素周期表
人教版高中历史必修二知识点总结
历史必修二基础知识点 第1课发达的古代农业 一、古代农业耕作方式演变 (1)刀耕火种(原始农业) (2)石器锄耕(耒耜) (3)铁犁牛耕:春秋出现。汉代后,铁犁牛耕成为传统农业的主要耕作方式。 二、农业的精耕细作 生产工具:春秋战国—铁犁;西汉—耦犁、耧车(播种工具);隋唐—曲辕犁 耕作方法:春秋战国—垄作法(当时世界上最先进的耕作方法);西汉—代田法 水利工程:都江堰(战国);漕渠、白渠、龙首渠(汉) 灌溉工具:翻车(三国)、筒车(唐朝)、高转筒车(宋朝)、风力水车(明清) 三、男耕女织的小农经济 时间:春秋战国 原因:错误!未找到引用源。春秋战国时期,铁农具的出现和牛耕的普及,提高了生产力。(根本原因) 错误!未找到引用源。封建土地私有制的确立 特点:错误!未找到引用源。以家庭为生产单位错误!未找到引用源。农业和家庭手工业相结合错误!未找到引用源。是一种自给自足的自然经济 地位:小农经济在中国封建经济中占据主导地位,是中国传统农业社会生产的基本模式。 评价:积极:错误!未找到引用源。提高农民生产的积极性错误!未找到引用源。 为我国农业的精耕细作做出了贡献 消极:错误!未找到引用源。小农经济比较脆弱,容易破产错误!未找到引用源。 是我国封建社会繁荣的原因,也是中国封建社会发展缓慢和长期延续的重要原因。 第2课古代手工业的进步 一、手工业的发展形态 官营手工业、民营手工业、家庭手工业 二、手工业的发展 青铜:商周—鼎盛(青铜时代)代表:司母戊鼎、四羊方尊等 冶铁:西周晚期出现铁器,东汉杜诗发明水排(水利鼓风冶铁工具) 炼钢:南北朝—灌钢法(水排和灌钢法使中国的冶炼技术在16世纪前一直领先于世界) 商朝—原始瓷器;东汉—青瓷;北朝—白瓷唐朝;唐朝—南青北白;宋朝—五大名窑明朝—青花瓷、彩瓷;景德镇成为瓷都(明代有些瓷器带有阿拉伯文和梵文装饰) 清朝—珐琅彩 商朝—出现丝织品;西周—斜花提纹织物;唐代—吸收了波斯的织法和图案风格 宋朝—写实风格,图案生动;明清—丝织业鼎盛时期(苏州和杭州成为全国丝织业中心)三、资本主义萌芽 时间:明朝中后期地区:江南 原因:社会生产力和商品经济的发展 含义:一些手工业部分出现资本主义性质的生产关系(雇佣与被雇佣) 标志:“机户出资,机工出力”这种带有雇佣与被雇佣关系的手工工场的出现。 发展缓慢的原因:封建制度的束缚(根本原因)、重农抑商、闭关锁国 第3课古代商业的发展 一、古代国内商业的发展 “商人”:商朝人善于经商,所以后人把善于经商的人称为商人。 隋唐—柜坊(中国最早银行的雏形)和飞钱(汇票)相继问世 北宋出现了世界上最早的纸币—交子(益州)原因:商业环境相对宽松(宋代城市中市和坊的界限被打破,旧时日中为市的经营时间限制也被打破) 元代:大都成为国家性的城市明清:商帮的出现(徽商和晋商) 二、对外贸易 繁荣唐朝:对外贸易重要港口——广州;外贸易机构——市舶使 两宋:海上丝绸之路异常繁荣,海外贸易税成为南宋政府的重要财源。 元朝:对外贸易的重要港口——泉州(被誉为世界第一大港) 特点:朝贡贸易(目的是为了宣扬国威,而不是获取最大的经济效益) 衰落:明清的海禁与闭关锁国政策打击,仅允许广州十三行与外国通商。 第4课古代的经济政策 一、土地制度的演变 原始社会:土地公有制(氏族公社所有) 奴隶社会(夏商西周):井田制——奴隶社会的土地国有制 封建社会(秦汉——明清):封建社会的土地私有制 封建社会自身无法解决的问题:土地兼并(根本原因:封建土地私有制) 二、重农抑商 1、首倡“重农抑商”政策的是:战国时期秦国商鞅变法。 2、目的:维护自然经济,确保赋役征派和地租征收,维护政治稳定,巩固封建统治。 3、积极作用:保护了农业生产和小农经济,促进农业经济发展;封建社会初期巩固新兴地主政权。消极后果:强化自然经济,阻碍工商业发展,阻碍资本主义萌芽的发展。 三、“海禁”与闭关锁国 闭关锁国的含义:严格限制同外国的往来,而非完全禁绝。清朝在广州设立十三行统一管理对外贸易。 冶金 瓷器丝织业演变
高中化学选修一知识点总结《选修1·化学与生活》
高中化学选修一知识点总结 《选修1·化学与生活》 第一章关注营养平衡第一节生命的基础能源—糖类 1、糖类是绿色植物光合作用的产物。由C、H、O三种元素组成的一类有机化合物,也叫碳水化合物(通式为C n(H20)m),但其实此名称并不能真实反应糖类的组成和特征,如鼠李糖C6H12O5是糖却不符合此通式,而符合此通式的,如甲醛HCHO、乙酸CH3COOH却不是糖类。 2、葡萄糖分子式C6H12O6,是一种白色晶体,有甜味,能溶于水 3、葡萄糖的还原性: 和银氨溶液反应: ; 和新制Cu(OH)2反应: 。 4、葡萄糖为人体提供能源 ①葡萄糖提供能量的方程式:; ②粮食中的糖类在人体中转化成葡萄糖而被吸收,在体内有三条途径,即:a、直接氧化供能;b、转化成糖元被肝脏和肌肉储存,当血液中的葡萄糖即血糖的质量分数比正常值低时,糖元就释放出来维持血糖浓度的相对稳定;c、转变为脂肪,储存在脂肪组织里。 5、蔗糖和麦芽糖是二糖,它们水解的化学方程式分别是: 6、淀粉是一种重要的多糖,分子式(C6H10O5)n,是一种相对分子质量很大的天然高分子有机化合物,没有甜味,是一种白色粉末,不溶于冷水,但在热水中一部分淀粉溶解在水中,一部分悬浮在水里,长时间或高温可产生糊化。它能水解。淀粉在人体内的水解过程可表示 为,也可在酸的 催化下逐步水解,其方程式。淀粉的特性:I2能使淀粉溶液变成蓝色。这是实验室检验淀粉或I2存在的重要原理。 7、纤维素是绿色植物通过光合作用生成的,是构成植物细胞的基础物质,它是白色,无色无味的物质,是一种多糖,属于天然有机高分子化合物。纤维素在酶或浓硫酸催化下发生 水解,其化学方程式为。纤维素不能作为人类的营养食物,但在人体内不可或缺,如:能刺激肠道蠕动和分泌消化液,有助于失误和废物的排泄……。 第二节重要的体内能源—油脂
高中历史必修二知识点
必修二经济复习提纲 1、古代中国耕作方式变革: 原始社会刀耕火种,距今七八千年进入耜耕(石器锄耕)阶段。 战国时期,牛耕初步推广,此后,铁犁牛耕逐步成为中国传统农业的主要耕作方式。耕作工具:唐代出现曲辕犁。 2古代中国农业土地制度演变: 最早是原始社会土地共有;夏商周土地国有(井田制);秦建立封建土地所有制,延续两千多年。 北魏和隋唐前期实行的均田制是也是国有土地的形式。 3、古代中国农业经济的基本特点是:精耕细作、自给自足、小农经济。 4、古代中国手工业的发展: ⑴冶铜技术:青铜器最繁荣时期在商周时代,商代司母戊鼎是代表作。 ⑵冶铁技术:西周晚期有铁器,春秋晚期能制造钢剑,东汉的杜诗发明水排,用水力鼓风冶铁。魏晋南北朝发明灌钢法,16世纪以前中国的炼钢技术保持世界领先地位。 ⑶制瓷业:中国是世界是最早发明瓷器国家,商朝最早烧制出原始瓷器,东汉技术成熟,唐代形成南青北白两大系统,宋代出现一批名窑,元代景德镇成为全国制瓷中心,能制青花瓷。明清景德镇成为瓷都,明烧制五彩瓷,清发明珐琅彩。瓷器从唐代输出国外,明清通过海上丝绸之路输往海外。 ⑷丝织业:中国是世界上最早的养蚕织绸国家,明清时期进入鼎盛时期,苏州、杭州是最著名丝纺业中心。 5、古代中国手工业发展的特征:生产部门不断增多,技术不断进步,规模不断扩大;历史悠久,领先世界。 6、古代中国商业发展概貌:西汉市区和住宅区严格分开,按时开市、闭市。唐代长安城内有坊和市,市分东市和西市。唐后期坊市的界限逐渐被打破。宋元时期商业发展到顶峰,;明清时期商业继续发展,出现了商帮,以晋商徽商为代表。 7、古代中国商业发展的特点:商业产生后不断发展,宋元时期空前繁荣;国内外贸易、边境贸易全面繁荣;唐代出现柜坊飞钱,宋代出现世界上最早纸币—交子;政府对商业的控制逐渐减少。
高中化学选修4-第三章知识点归纳(很不错)
第三章 水溶液中的离子平衡 一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下能导电的化合物, 非电解质 :在水溶液中或熔化状态下都不能导电的化合物 强电解质 : 在水溶液里全部电离成离子的电解质 弱电解质: 在水溶液里只有一部分分子电离成离子的电解质 。 ! 2、电解质与非电解质本质区别: 电解质——离子化合物或共价化合物 非电解质——共价化合物 注意:①电解质、非电解质都是化合物 ②SO 2、NH 3、CO 2等属于非电解质 ③强电解质不等于易溶于水的化合物(如BaSO 4不溶于水,但溶于水的BaSO 4全部电离,故BaSO 4为强电解质)——电解质的强弱与导电性、溶解性无关。 3、影响电离平衡的因素: A 、温度:电离一般吸热,升温有利于电离。 B 、浓度:浓度越大,电离程度 越小 ;溶液稀释时,电离平衡向着电离的方向移动。 C 、同离子效应:在弱电解质溶液里加入与弱电解质具有相同离子的电解质,会 减弱 电离。 D 、其他外加试剂:加入能与弱电解质的电离产生的某种离子反应的物质时,有利于电离。 4、电离方程式的书写:用可逆符号 弱酸的电离要分布写(第一步为主) 5、电离常数:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积,跟溶液中未电离的分子浓度的比是一个常数。叫做电离平衡常数,(一般用Ka 表示酸,Kb 表示碱。 ) — 表示方法:AB A ++B - Ki=[ A +][ B -]/[AB] 6、影响因素: a 、电离常数的大小主要由物质的本性决定。 b 、电离常数受温度变化影响,不受浓度变化影响,在室温下一般变化不大。 C 、同一温度下,不同弱酸,电离常数越大,其电离程度越大,酸性越强。如:H 2SO 3>H 3PO 4>HF>CH 3COOH>H 2CO 3>H 2S>HClO 二、水的电离和溶液的酸碱性 1、水电离平衡:: 水的离子积:K W = c[H +]·c[OH -] 25℃时, [H +]=[OH -] =10-7 mol/L ; K W = [H +]·[OH -] = 1*10-14 注意:K W 只与温度有关,温度一定,则K W 值一定 ; 物质 单质 @ 化合物 电解质 非电解质: 非金属氧化物,大部分有机物 。如SO 3、CO 2、C 6H 12O 6、CCl 4、CH 2=CH 2…… 强电解质: 强酸,强碱,大多数盐 。如HCl 、NaOH 、NaCl 、BaSO 4 弱电解质: 弱酸,弱碱,极少数盐,水 。如HClO 、NH 3·H 2O 、Cu(OH)2、H 2 O …… 混和物 纯净物
高中化学选修三知识点总结
高中化学选修三知识点总结 第一章原子结构与性质 1、电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图。离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小。 2、电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 3、原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。 4、原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子。 5、原子核外电子排布原理: (1)能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道;
(2)泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子;(3)洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同。 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1 6、根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 7、第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1)原子核外电子排布的周期性 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化: 每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到 ns2np6的周期性变化.
北师大版高一历史必修二知识总结
高一历史必修二知识总结 第一单元 古代中国经济的基本结构与特点 第1课 农业的主要耕作方式和土地制度 一、古代农业耕作方式演变 (1)刀耕火种(原始农业) (2)石器锄耕(耒耜) (3)铁犁牛耕:春秋出现,汉代后,铁犁牛耕成为传统农业的主要耕作方式。 二、土地制度的演变 原始社会:土地公有制(氏族公社所有) 奴隶社会(夏商西周) :井田制——奴隶社会的土地国有制 封建社会(秦汉——明清):封建社会的土地私有制 封建社会自身无法解决的问题:土地兼并(根本原因:封建土地私有制) 第2课 精耕细作的传统农业 一、男耕女织的小农经济 时间:春秋战国 原因:①春秋战国时期,铁农具的出现和牛耕的普及,提高了生产力。(根本原因) ②封建土地私有制的确立 特点: ①以家庭为生产单位②农业和家庭手工业相结合③是一种自给自足的自然经济 地位:小农经济在中国封建经济中占据主导地位,是中国传统农业社会生产的基本模式。 评价:积极 ①提高农民生产的积极性 ②为我国农业的精耕细作做出了贡献 消极 ①小农经济比较脆弱,容易破产 ②是我国封建社会繁荣的原因,也是中国封建社会发 展缓慢和长期延续的重要原因 二、农业的精耕细作 生产工具:春秋战国—铁犁;西汉—耦犁、耧车(播种工具);隋唐—曲辕犁 水利工程:都江堰(战国);郑国渠 灌溉工具:翻车(三国)、筒车(唐朝) 第3课 享誉世界的手工业 一、手工业的发展形态 古代手工业经营模式 :官营手工业,私营手工业、家庭手工业三种主要经营形态 二、手工业的发展 青铜:商周—鼎盛(青铜时代) 代表:司母戊鼎、四羊方尊等 冶铁:西周晚期出现铁器 ,东汉杜诗发明水排(水利鼓风冶铁工具) 炼钢:南北朝—灌钢法(水排和灌钢法使中国的冶炼技术在16世纪前一直领先于世界) 商朝—原始瓷器;东汉—青瓷;北朝—白瓷;唐朝—南青北白; 元朝—青花瓷; 明朝—彩瓷 第4课 商业的发展 一、先秦商业产生 商朝时期:“商人”(商朝人善于经商,所以后人把善于经商的人称为商人。)出现、货币为贝壳、商业由官府控制; 二、唐宋元商业品经济的发展与繁荣 唐—柜坊(中国最早银行的雏形)和飞钱(汇票)相继问世 北宋出现了世界上最早的纸币—交子(益州)原因:商业环境相对宽松 宋代城市中市和坊的界限被打破,旧时日中为市的经营时间限制也被打破 演变 冶金 瓷 器
高考化学选修三知识点总结
高中化学选修3知识点全部归纳(物质的结构与性质) ▼第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势.
化学选修三知识点总结
化学选修三知识点总结 第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.
(2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. ①根据构造原理,基态原子核外电子的排布遵循图⑴箭头所示的顺序。 ②根据构造原理,可以将各能级按能量的差异分成能级组如图⑵所示,由下而上表示七个能级组,其能量依次升高;在同一能级组内,从左到右能量依次升高。基态原子核外电子的排布按能量由低到高的顺序依次排布。 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性.
历史必修二知识点汇总
历史必修二复习提纲 第1课 发达的古代农业 一、古代农业耕作方式演变 (1)刀耕火种(原始农业) (2)石器锄耕(耒耜) (3)铁犁牛耕:春秋出现,汉代后,铁犁牛耕成为传统农业的主要耕作方式。 二、农业的精耕细作(A ) 生产工具:春秋战国—铁犁;西汉—耦犁、耧车(播种工具);隋唐—曲辕犁 耕作方法:春秋战国—垄作法(当时世界上最先进的耕作方法);西汉—代田法 水利工程:都江堰(战国);漕渠、白渠、龙首渠(汉) 灌溉工具:翻车(三国)、筒车(唐朝)、高转筒车(宋朝)、风力水车(明清) 三、男耕女织的小农经济(C ) 时间:春秋战国 原因:①春秋战国时期,铁农具的出现和牛耕的普及,提高了生产力。(根本原因) ②封建土地私有制的确立 特点: ①以家庭为生产单位②农业和家庭手工业相结合③是一种自给自足的自然经济 地位:小农经济在中国封建经济中占据主导地位,是中国传统农业社会生产的基本模式。 评价:积极 ①提高农民生产的积极性 ②为我国农业的精耕细作做出了贡献 消极 ①小农经济比较脆弱,容易破产 ②是我国封建社会繁荣的原因,也是中 国封建社会发展缓慢和长期延续的重要原因 第2课 古代手工业的进步 一、手工业的发展形态 官营手工业、 民营手工业 、家庭手工业 二、手工业的发展(A ) 青铜:商周—鼎盛(青铜时代) 代表:司母戊鼎、四羊方尊等 冶铁:西周晚期出现铁器 ,东汉杜诗发明水排(水利鼓风冶铁工具) 炼钢:南北朝—灌钢法(水排和灌钢法使中国的冶炼技术在16世纪前一直领先于世界) 商朝—原始瓷器;东汉—青瓷;北朝—白瓷唐朝;唐朝—南青北白;宋朝—五大名窑 明朝—青花瓷、彩瓷;景德镇成为瓷都(明代有些瓷器带有阿拉伯文和梵文装饰) 清朝—珐琅彩 商朝— 出现丝织品;西周—斜花提纹织物;唐代—吸收了波斯的织法和图案风格 宋朝—写实风格,图案生动;明清—丝织业鼎盛时期(苏州和杭州成为全国丝织业中心) 三、资本主义萌芽(C ) 时间:明朝中后期 地区:江南 原因:社会生产力和商品经济的发展 含义:一些手工业部分出现资本主义性质的生产关系(雇佣与被雇佣) 标志:“机户出资,机工出力”这种带有雇佣与被雇佣关系的手工工场的出现。 发展缓慢的原因:封建制度的束缚(根本原因)、重农抑商、闭关锁国 第3课 古代商业的发展 一、古代国内商业的发展(A ) “商人”:商朝人善于经商,所以后人把善于经商的人称为商人。 冶金 瓷器 丝织 业
(完整版)高中化学选修3知识点总结
高中化学选修3知识点总结 二、复习要点 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。 2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。 3、电子云与原子轨道 (1)电子云:电子在核外空间做高速运动,没有确定的轨道。因此,人们用“电子云”模型来描述核外电子的运动。“电子云”描述了电子在原子核外出现的概率密度分布,是核外电子运动状态的形象化描述。 (2)原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图称为原子轨道。s电子的原子轨道呈球形对称,ns能级各有1个原子轨道;p电子的原子轨道呈纺锤形,n p能级各有3个原子轨道,相互垂直(用p x、p y、p z表示);n d能级各有5个原子轨道;n f能级各有7个原子轨道。 4、核外电子排布规律 (1)能量最低原理:在基态原子里,电子优先排布在能量最低的能级里,然后排布在能量逐渐升高的能级里。 (2)泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反。 (3)洪特规则:电子排布在同一能级的各个轨道时,优先占据不同的轨道,且自旋方向相同。 (4)洪特规则的特例:电子排布在p、d、f等能级时,当其处于全空、半充满或全充满时,即p0、d0、f0、p3、d5、f7、p6、d10、f14,整个原子的能量最低,最稳定。 能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。 电子数 (5)(n-1)d能级上电子数等于10时,副族元素的族序数=n s能级电子数 (二)元素周期表和元素周期律 1、元素周期表的结构 元素在周期表中的位置由原子结构决定:原子核外的能层数决定元素所在的周期,原子的价电子总数决定元素所在的族。 (1)原子的电子层构型和周期的划分 周期是指能层(电子层)相同,按照最高能级组电子数依次增多的顺序排列的一行元素。即元素周期表中的一个横行为一个周期,周期表共有七个周期。同周期元素从左到右(除稀有气体外),元素的金属性逐渐减弱,非金属性逐渐增强。 (2)原子的电子构型和族的划分 族是指价电子数相同(外围电子排布相同),按照电子层数依次增加的顺序排列的一列元素。即元素周期表中的一个列为一个族(第Ⅷ族除外)。共有十八个列,十六个族。同主族周期元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。 (3)原子的电子构型和元素的分区 按电子排布可把周期表里的元素划分成5个区,分别为s区、p区、d区、f区和ds区,除ds区外,区的名称来自按构造原理最后填入电子的能级的符号。 2、元素周期律
高中历史必修二专题三知识总结(人民版)
人民版高中历史必修二知识点总结 专题三中国社会主义建设道路的探索 专题线索: 党领导全国各族人民从新民主主义转变为社会主义和建设社会主义时期,有重大成就, 一、社会主义制度建立的背景 1、政治上:中华人民共和国成立 2、经济上:国民经济的恢复和发展,为国家开展有计划的经济建设和社会主义改造奠定了基础。 二、★过渡时期总路线 1、内容:一化三改造(一化:实现社会主义工业化;三改造:对农业、手工业、资本主 义工商业的社会主义改造) 2、实质:体现了社会主义建设和社会主义改造并举(即发展生产力和变革生产关系并举) 三、“一五计划”:根据过渡时期总路线制定“一五计划”: 1、基本任务: 一是集中发展重工业,建立社会主义工业化的初步基础。这是从中国工业基础特别是重工业基础薄弱的国情出发做出的必然选择; 二是建立对农业、手工业以及资本主义工商业进行社会主义三改造的基础。 四、第一个五年计划 1、标志着我国大规模的有计划的社会主义建设的开始是:第一个五年计划(1953——1957 年); 2、第一个五年计划目的:把我国建设成社会主义工业化国家。 3、第一个五年计划中工矿业建设的突出成就有:鞍山钢铁公司三大工厂、长春第一制造 厂、沈阳机床厂和飞机制造厂等。 4、“一五计划”的意义:为社会主义工业化奠定了初步的基础。 五、★三大改造(农业、手工业、资本主义工商业) 1、时间:1953——1956年底,我国基本上完成三大改造, 2、内容:(1)农业——农业生产合作社 (2)手工业——手工业生产合作社 (3)资本主义工商业——公私合营
3、实质:使生产资料由私有制转变为社会主义公有制。 4、意义:标志着社会主义制度在中国基本建立起来。 六、《论十大关系》(1956年9月):提出了开辟一条与苏联不同的中国社会主义建设道路的重大问 题的是。 七、中共八大 1、时间:1956年9月 2、背景:正确分析了国内形势和国内主要矛盾的变化 (1)国内形势:社会主义改造已经取得决定性的胜利,即三大改造的完成; (2)国内主要矛盾:即阶级矛盾已基本解决, 3、内容: (1)★八大确定的主要矛盾是:人民日益增长的物质需要和落后的生产力之间的矛盾;(先 进的社会制度和落后的生产力之间的矛盾)。 (2)中共八大确定的主要任务是:把我国尽快地从落后的农业国变为先进的工业国。 4、评价:中共八在提出的许多方针和设想富有创造性和正确性,是对我国建设社会主义 道路的一次成功探索。 八、“左”倾错误泛滥--大跃进和人民公社化运动 1、1958年中共八大二次会议提出总路线:“鼓足干劲,力争上游,多快好省地建设社会主 义”。 2、大跃进: (1)表现:大办工业、农业,片面追求经济发展的高速度和高指标——完全违反客观经济 规律。 (2)启示:社会主义建设必须实事求是,尊重客观规律。 3、人民公社化运动: (1)内容:一大二公:公有制程度高;绝对平均主义; (2)启示:生产关系的变革必须与生产力水平相适应。 4、★主要标志:高指标、瞎指挥、浮夸风、共产风 5、后果:是我党在探索中国的社会主义道路过程中一次严重的失误,造成1959—1961三 年经济困难。 6、面对三年经济困难,中共中央开始纠正农村工作中“左”的错误,对国民经济提出“调 整、巩固、充实、提高”的八字方针,其中核心为调整。调整的含义是:调整国民经济的 比例。 7、1966年国民经济呈上升趋势的原因有:1965年国民经济调整任务基本完成,经济建设 进入新的发展时期;“文革”动乱海没有扩展到经济领域。 九、文化大革命(1966—1976) 1、1973年国民经济的发展趋势是:复苏。原因是:周恩来主持中央日常工作,着手恢复 调整国民经济。 2、1975年国民经济的发展趋势是:迅速回升。原因是:邓小平主持中央日常工作,提出 全面整顿的思想。以铁路整顿为突破口。 十、★50-70年代社会主义建设的经验教训? 1、社会主义建设必须从国情出发,正确分析国内主要矛盾。 2、始终坚持以经济建设为中心,把发展生产力放在首位。 3、从实际出发,实事求是,尊重客观规律,生产关系的变革必须与生产力水平相适应。 不能急于求成,片面追求高速度 4、保持社会安定团结,及时抓住发展机遇。
(完整版)高中化学选修3物质结构与性质全册知识点总结,推荐文档
高中化学选修3知识点总结 主要知识要点: 1、原子结构 2、元素周期表和元素周期律 3、共价键 4、分子的空间构型 5、分子的性质 6、晶体的结构和性质 (一)原子结构 1、能层和能级 (1)能层和能级的划分 ①在同一个原子中,离核越近能层能量越低。 ②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。 ③任一能层,能级数等于能层序数。 ④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。 ⑤能层不同能级相同,所容纳的最多电子数相同。 (2)能层、能级、原子轨道之间的关系 每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理 (1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。 (2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。 (3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、 E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。 原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np (4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。 根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。 (5)基态和激发态 ①基态:最低能量状态。处于最低能量状态的原子称为基态原子。 ②激发态:较高能量状态(相对基态而言)。基态原子的电子吸收能量后,电子 跃迁至较高能级时的状态。处于激发态的原子称为激发态原子。 ③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出 (激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原 子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定 元素。 3、电子云与原子轨道
高中化学选修3:物质结构与性质-知识点总结
选修三物质结构与性质总结 一.原子结构与性质. 1、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度 越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子 层.原子由里向 外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用 s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f 轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7. 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述 .在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具 有较低的能量和较大的稳定性.如24Cr[Ar]3d54s1、29Cu[Ar]3d104s1. (3).掌握能级交错1-36号元素的核外电子排布式. ns<(n-2)f<(n-1)d 人教版高中历史必修二知识点归纳 高中的学生在学习历史知识时,要通读课本内内容,并且学会总结,下面就是给大家带来的人教版高中历史必修二知识点归纳,希望大家喜欢! 高中历史必修二知识点 一、开辟新航路 1、开辟新航路的背景: (一)必要性(原因): (1)经济根源:西欧商品经济的发展和资本主义的萌芽(根本原因) (2)社会根源:欧洲人的“寻金热”(开辟新航路的动机) (3)宗教根源:传播天主教 (4)商业危机:奥斯曼土耳其占领传统商路(直接原因) (二)可能性(条件):西欧生产力的发展、航海技术的提高、造船技术的发展、地理知识的提高、西班牙和葡萄牙王室的支持 2、最早探询新航路的国家是:葡萄牙和西班牙 3、第一个进行新航路开辟的航海家是:1487年,葡萄牙人迪亚士,在葡萄牙王室的支持下,其航线是—沿非洲西海岸向南航行,发现非洲的最南端→“好望角”。 5、直达印度的航海家是:葡萄牙人达﹒伽马 6、横渡大西洋发现美洲大陆航海家是哥伦布,他是在西班牙王室支持下远航的。 7、1519-1522年麦哲伦船队环球航行的路线是:从西班牙出发,横渡大西洋,绕过美洲南端的海峡,横渡太平洋和印度洋,绕过非洲,回到欧洲。 8、新航路开辟的影响(世界市场形成):加强了欧洲同亚、非、拉经济和贸易联系; 地区性贸易开始向世界性贸易扩展,世界市场的雏形开始出现; 欧洲的贸易中心由原来的地中海地区转移到大西洋沿岸 9、你怎样评价这些航海家? 探险家们具有勇于进取的开拓精神;但掠夺行为给殖民地人们带来灾难。 高中历史必修二知识要点 “斯大林模式” 主要表现:㈠优先发展重工业(农业和轻工业为重工业的发展提供基金); 第二章分子结构与性质 一.共价键 1.共价键的本质及特征 共价键的本质是在原子之间形成共用电子对,其特征是具有饱和性和方向性。 2.共价键的类型 ①按成键原子间共用电子对的数目分为单键、双键、三键。 ②按共用电子对是否偏移分为极性键、非极性键。 ③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。 3.键参数 ①键能:气态基态原子形成1 mol化学键释放的最低能量,键能越大,化学键越稳定。 ②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。 ③键角:在原子数超过2的分子中,两个共价键之间的夹角。 ④键参数对分子性质的影响键长越短,键能越大,分子越稳定. 4.等电子原理:原子总数相同、价电子总数相同的分子具有相似的化学键特征,它们的许多性质相近。常见的等电子体:CO和N2 二.分子的立体构型 1.分子构型与杂化轨道理论 杂化轨道的要点当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的空间形状不同 2分子构型与价层电子对互斥模型 价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。 (1)当中心原子无孤对电子时,两者的构型一致; (2)当中心原子有孤对电子时,两者的构型不一致。 3.配位化合物(1)配位键与极性键、非极性键的比较:都属共价键(2)配位化合物 ①定义:金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物。 电离方程式:[Zn(NH3)4]SO4===[Zn(NH3)4]2++ SO42- 配合物内界稳定不电离参加化学反应,外界电离后参加反应 高中化学选修3知识点全部归纳(物质的结 构与性质) 高中化学选修3知识点全部归纳(物质的结构与性质) 第一章原子结构与性质. 一、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义. 1.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小. 电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q. 原子轨道(能级):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7。 2.(构造原理) 了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布. (1).原子核外电子的运动特征可以用电子层、原子轨道和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子. (2).原子核外电子排布原理. ①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道. ②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子. ③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同. 洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1. (3).掌握能级交错图和1-36号元素的核外电子排布式. 3.元素电离能和元素电负性 第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。常用符号I1表示,单位为kJ/mol。 (1).原子核外电子排布的周期性. 随着原子序数的增加,元素原子的外围电子排布呈现周期性的变化:每隔一定数目的元素,元素原子的外围电子排布重复出现从ns1到ns2np6的周期性变化. (2).元素第一电离能的周期性变化. 随着原子序数的递增,元素的第一电离能呈周期性变化: ★同周期从左到右,第一电离能有逐渐增大的趋势,稀有气体的第一电离能最大,碱金属的第一电离能最小; ★同主族从上到下,第一电离能有逐渐减小的趋势. 说明: ①同周期元素,从左往右第一电离能呈增大趋势。电子亚层结构为全满、半满时较相邻元素要大即第ⅡA 族、第ⅤA 族元素的第一电离能分别大于同周期相邻元素。Be、N、Mg、P ②.元素电离能的运用: a. 用来比较元素的金属性的强弱. I1越小,金属性越强,表征原子失电子能力强弱. b .电离能是原子核外电子分层排布的实验验证. 分析原子核外电子层结构,如某元素的I n+1?I n,则该元素的最外层电子数为n。 (3).元素电负性的周期性变化. 元素的电负性:元素的原子在分子中吸引电子对的能力叫做该元素的电负性。 随着原子序数的递增,元素的电负性呈周期性变化:同周期从左到右,主族元素电负性逐渐增大;同一主族从上到下,元素电负性呈现减小的趋势.人教版高中历史必修二知识点归纳
江苏高考化学复习期末必看——高中化学选修三知识点全归纳:第二章
高中化学选修3知识点全部归纳(物质的结构与性质)资料
