氨的测定 纳氏试剂分光光度法
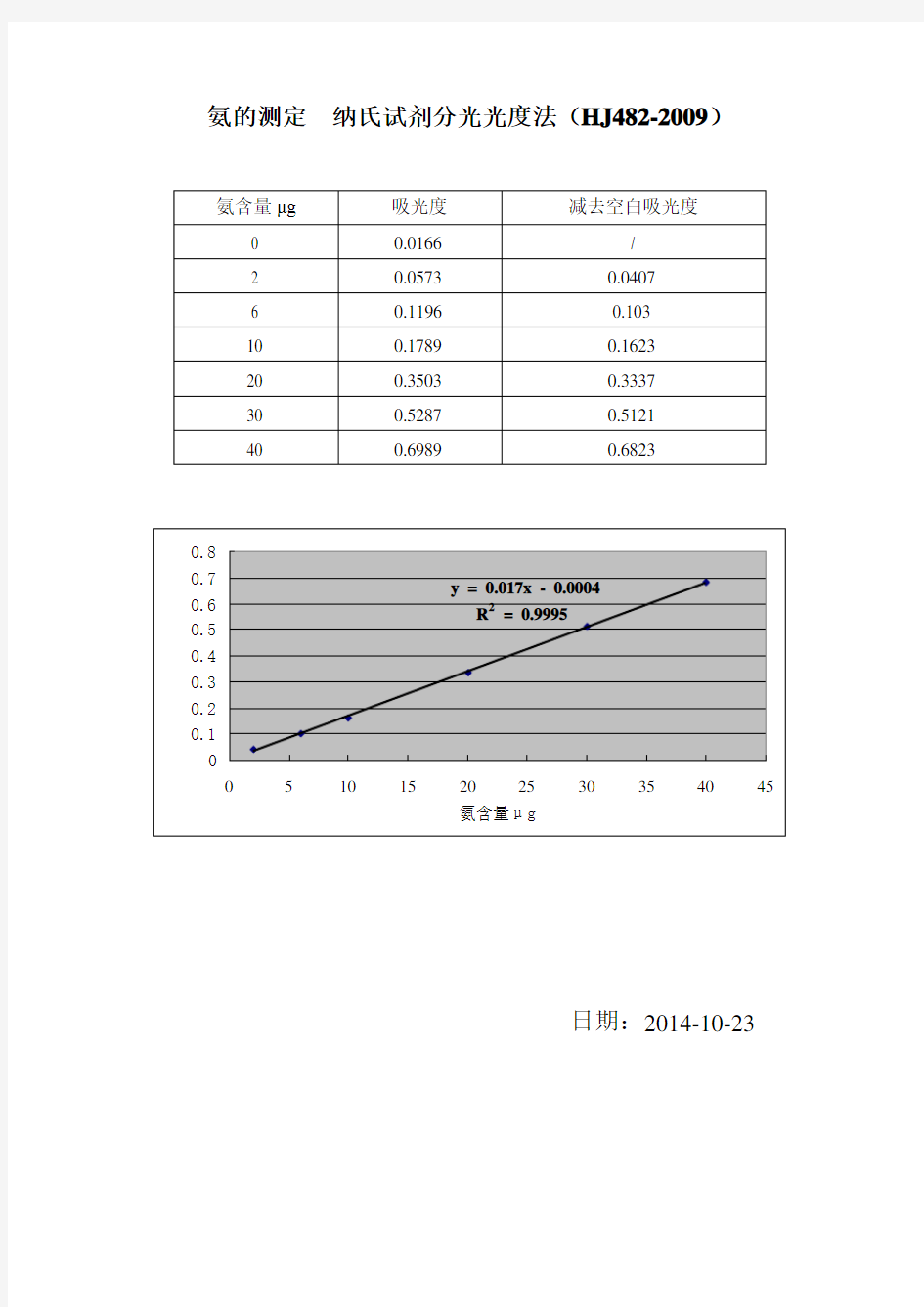
氨的测定纳氏试剂分光光度法(HJ482-2009)
日期:2014-10-23
氨氮的测定纳氏试剂法
实验4 水中氨氮的测定(纳氏试剂比色法) HJ535-2009代替GB 7479-87 一.实验目的 1.了解水中氨氮的测定意义。 2.掌握水中氨氮的测定方法和原理。 二.实验原理 氮是蛋白质、核酸、酶、维生素等有机物中的重要组分。纯净天然水体中的含氮物质是很少的,水体中含氮物质的主要来源是生活污水和某些工业废水。当含氮有机物进入水体后,由于微生物和氧的作用,可以逐步分解或氧化为无机氨(NH 3)、铵(NH 4+)、亚硝酸 盐(NO 2-)和最终产物(NO 3-)。 氨和铵中的氮称为氨氮(Ammonia nitrogen 简称NH 3-N )。水中氨氮的含量在一定程度 上反映了含氮有机物的污染情况。在污水综合排放标准(GB8978-1996)和地表水环境质量标准(GB3838-2002)中,氨氮都是重要的监测指标。 以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,该络合物的吸光度与氨氮含量成正比,于波长420 nm 处测量吸光度。 氨氮与纳氏试剂反应生成棕色胶态化合物, 干扰及消除:水样中含有悬浮物、余氯、钙镁等金属离子、硫化物和有机物时会产生干扰,含有此类物质时要作适当处理,以消除对测定的影响。 若样品中存在余氯,可加入适量的硫代硫酸钠溶液去除,用淀粉-碘化钾试纸检验余氯
是否除尽。在显色时加入适量的酒石酸钾钠溶液,可消除钙镁等金属离子的干扰。若水样 浑浊或有颜色时可用预蒸馏法或絮凝沉淀法处理。 三. 仪器与试剂 1.尤尼柯WFJ7200型可见分光光度计,具20mm比色皿。 2.纳氏试剂(碘化汞-碘化钾-氢氧化钠(HgI 2 -KI-NaOH)溶液): 称取 16.0g氢氧化钠(NaOH),溶于50ml水中,冷却至室温。称取7.0g碘化钾(KI) 和10.0g碘化汞(HgI 2 ),溶于水中,然后将此溶液在搅拌下,缓慢加入到上述50ml氢氧化钠溶液中,用水稀释至100ml。贮于聚乙烯瓶内,用橡皮塞或聚乙烯盖子盖紧,于暗处存放,有效期1年。 3.酒石酸钾钠溶液:称取50.0g酒石酸钾钠(KNaC 4H 4 O 6 ·4H 2 O)溶于100mL水中,加热煮 沸以驱除氨,充分冷却后稀释至100ml。 4.氨氮标准贮备溶液(1000μg/ml):称取3.8190g氯化铵(NH 4 Cl,优级纯,在100~105℃干燥2h),溶于无氨水中,移入1000ml容量瓶中,稀释至刻度,摇匀。可在2~5℃保存1个月。 5.氨氮标准工作溶液(10μg/mL):吸10.00ml氨氮标准贮备溶液于1000ml容量瓶内,用无氨水稀释至刻度,摇匀。临用前配制。 以下为水样需预处理时所需试剂 6. 硫代硫酸钠溶液(3.5g/L):称取3.5g硫代硫酸钠(Na 2S 2 O 3 )溶于水中,稀释至1000ml。
纳氏试剂分光光度法
纳氏试剂分光光度法 一、原理 碘化汞和碘化钾的碱性溶液与氨反映生成淡红棕色胶态化合物,其色度与氨氮含量成正比,通常可在波长410~425nm范围内测其吸光度,计算其含量. 本法最低检出浓度为0.025mg/L(光度法),测定上限为2mg/L.采用目视比色法,最低检出浓度为0.02mg/L.水样做适当的预处理后,本法可用于地面水,地下水,工业废水和生活污水中氨氮的测定. 二、仪器 1 带氮球的定氮蒸馏装置:500mL凯氏烧瓶,氮球,直形冷凝管和导管. 2 分光光度计 3 pH计 四、试剂 配制试剂用水均应为无氨水 1 无氨水可选用下列方法之一进行制备: 1.1 蒸馏法:每升蒸馏水中加0.1mL硫酸,在全玻璃蒸馏器中重蒸馏,弃去 50mL初馏液,按取其余馏出液于具塞磨口的玻璃瓶中,密塞保存. 1.2 离子交换法:使蒸馏水通过强酸型阳离子交换树脂柱. 2 1mol/L盐酸溶液. 3 1mol/L氢氧化纳溶液. 4 轻质氧化镁(MgO):将氧化镁在500℃下加热,以出去碳酸盐. 5 0.05%溴百里酚蓝指示液:pH60.~7.6. 6 防沫剂,如石蜡碎片. 7 吸收液: 7.1 硼酸溶液:称取20g硼酸溶于水,稀释至1L. 7.2 0.01mol/L硫酸溶液. 8 纳氏试剂:可选择下列方法之一制备: 8.1 称取20g碘化钾溶于约100mL水中,边搅拌边分次少量加入二氯化汞(HgCl2)结晶粉末(约10g),至出现朱红色沉淀不易溶解时,改写滴加饱和二氯化汞溶液,并充分搅拌,当出现微量朱红色沉淀不再溶解时,停止滴加二氯化汞溶液. 另称取60g氢氧化钾溶于水,并稀释至250mL,冷却至室温后,将上述溶液徐徐注入氢氧化钾溶液中,用水稀释至400mL,混匀.静置过夜将上清液移入聚乙烯瓶中,密塞保存. 8.2 称取16g氢氧化纳,溶于50mL水中,充分冷却至室温. 另称取7g碘化钾和碘化汞(HgI2)溶于水,然后将此溶液在搅拌下徐徐注入氢氧化纳溶液中,用水稀释至100mL,贮于聚乙烯瓶中,密塞保存. 9 酒石酸钾纳溶液:称取50g酒石酸钾纳KNaC4H4O6·4H2O)溶于100mL水中,加热煮沸以除去氨,放冷,定容至100Ml. 10 铵标准贮备溶液:称取3.819g经100℃干燥过的优级纯氯化铵(NH4Cl)溶于水中,移入1000mL容量瓶中,稀释至标线.此溶液每毫升含1.00mg氨氮. 11 铵标准使用溶液:移取5.00mL铵标准贮备液于500mL容量瓶中,用水稀释至标线.此溶液每毫升含0.010mg氨氮. 五、测定步骤
分光光度法测定水中铁离子含量.
专业项目课程课例 项目十二分光光度法测定水中铁离子含量 一、项目名称:分光光度法测定水中铁离子含量 二、项目背景分析 课程目标:本课程是培养分析化学操作技能和操作方法的一门专业实践课,以定量分析的基本理论为基础,以实验强化理论,以期提高化工工作者的分析操作能力。 功能定位:在定量分析中我们常常用到分光光度分析法,它具有操作简便、快速、准确等优点,在工农业生产和科学研究中具有很大的实用价值。是仪器分析的基础实验,也是一种重要的定量分析方法。分光光度法测定水中铁离子含量的测定项目综合训练了学生分光光度计使用、系列标准溶液配制、标准曲线绘制等多个技能。 学生能力:学生通过相关基础学科的学习已经具备了相应的化学知识和定量分析知识,也具备一定的独立操作和思维能力。 项目实施条件:该项目是仪器分析的基础实验,一般中职学校具备相关的实训实习条件,学生有条件完成相应的实习任务。 三、教学目标 1、了解721可见分光光度计的构造 2、了解分光光度法测定原理 3、掌握721可见分光光度计的操作方法 4、掌握分光光度法测定分析原始记录的设计 5、掌握分光光度法测定分析报告的设计 6、掌握分光光度法测定水中铁离子含量的测定方法 7、掌握分光光度法测定水中铁离子含量的分析原始记录和分析报告的填写 四、工作任务 1
2 五、参考方案 参考方案一 1、邻二氮杂菲-Fe 2+ 吸收曲线的绘制 用吸量管吸取铁标准溶液(20μg/mL )0.00、2.00、4.00mL ,分别放入三个50mL 容量瓶中,加入1mL 10%盐酸羟胺溶液,2mL 0.1%邻二氮杂菲溶液和5mL HAc-NaAc 缓冲溶液,加水稀释至刻度,充分摇匀。放置10min ,用3cm 比色皿,以试剂空白(即在0.0mL 铁标准溶液中加入相同试剂)为参比溶液,在440~560nm 波长范围内,每隔20~40nm 测一次吸光度,在最大吸收波长附近,每隔5~10nm 测一次吸光度。在坐标纸上,以波长λ为横坐标,吸光度A 为纵坐标,绘制A 和λ关系的吸收曲线。从吸收曲线上选择测定Fe 的适宜波长,一般选用最大吸收波长λmax 。 2、标准曲线的制作 用吸量管分别移取铁标准溶液(20μg/mL )0.00、2.00、4.00、6.00、8.00、10.00mL ,分别放入6个50mL 容量瓶中,分别依次加入1.00mL 10%盐酸羟胺溶液,稍摇动;加入2.00mL 0.1%邻二氮杂菲溶液及5.00mL HAc-NaAc 缓冲溶液,加水稀释至刻度,充分摇匀。放置10min ,用1cm 比色皿,以试剂空白(即在0.00mL 铁标准溶液中加入相同试剂)为参比溶液,选择λmax 为测定波长,测量各溶液的吸光度。在坐标纸上,以含铁量为横坐标,吸光度A 为纵坐标,绘制标准曲线。 3、水样中铁含量的测定 取三个50mL 容量瓶,分别加入5.00mL (或10.00mL 铁含量以在标准曲线范围内为合适)未知试样溶液,按实验步骤2的方法显色后,在λmax 波长处,用1cm 比色皿,以试剂空白为参比溶液,平行
邻二氮菲分光光度法测定微量铁
邻二氮菲分光光度法测定微量铁 一、实验原理 邻二氮菲(1,10—二氮杂菲),也称邻菲罗啉是测定微量铁的一个很好的显色剂。在pH2—9范围内(一般控制在5—6间)Fe2+与试剂生成稳定的橙红色配合物Fe(Phen)32+lgK=,在510nm下,其摩尔吸光系数为, )Fe3+与邻二氮菲作用生成兰色配合物,稳定性较差,因此在实际应用中常加入还原剂盐酸羟胺使Fe2+还原为Fe3+: 2 Fe3++2NH2OHHCl=2 Fe2++N2+4H++2H2O+2Cl- 二、试剂与仪器 仪器: 1.721型分光光度计 2.50mL容量瓶8个,100mL1个,500mL1个 3.移液管:2 mL1支,10 mL1支 4.刻度吸管:10mL、5mL、1mL各1支 试剂: 1.铁标准储备溶液100ug/mL:1000 mL(准确称取铁盐NH4Fe(SO4)212H2O置于烧杯中,加入3moL/LHCI20mL和30ml水,然后加水稀释至刻度,摇匀。) 2.铁标准使用液10ug/mL:用移液管移取上述铁标准储备液 mL,置于100 mL容量瓶中,加入3moL/和少量水,然后加水稀释至刻度,摇匀。 3.HCI3moL/L:100mL 4.盐酸羟胺100g/L(新鲜配制):100mL 5.邻二氮菲溶液L(新鲜配制):200mL 6.HAc—NaAc缓冲溶液(pH=5)500 mL:称取136gNaAc,加水使之溶解,再加入120 mL 冰醋酸,加水稀释至500 mL 7.水样配制(mL):取2mL100ug/mL铁标准储备溶液加水稀释至500mL 三、实验步骤 1.配置mL的铁标准溶液。 1.绘制吸收曲线:用吸量管吸取铁标准溶液(10ug/mL)、、、、、分别放入50 mL容量瓶中,加入1 mL10%盐酸羟胺溶液、 L邻二氮菲溶液和5 mL HAc—NaAc缓冲溶液,加水稀释至刻度,充分摇匀,放置5分钟,用3cm比色皿,以试剂溶液为参比液,于721型分光光度计中,在440—560nm波长范围内分别测定其吸光度A值。当临近最大吸收波长附近时应间隔波长5—10nm测A值,其他各处可间隔波长20—40nm测定。然后以波长为横坐标,所测A值为纵坐标,绘制吸收曲线,并找出最大吸收峰的波长。 2.标准曲线的绘制:用吸量管分别移取铁标准溶液(10ug/mL)、、、、、、 mL依次放入7只50mL 容量瓶中,分别加入10%盐酸羟胺溶液1 mL,稍摇动,再加入%邻二氮菲溶液 mL及5 mL HAc —NaAc缓冲溶液,加水稀释至刻度,充分摇匀,放置5分钟,用3cm比色皿,以不加铁标准溶液的试液为参比液,选择最大测定波长为测定波长,依次测A值。以铁的质量浓度为横坐标,A值为纵坐标,绘制标准曲线。 3.水样分析:分别加入(或,铁含量以在标准曲线范围内为宜)未知试样溶液,按实验步骤2的方法显色后,在最大测定波长处,用3cm比色皿,以不加铁标准溶液的试液为参比液,平行测A值。求其平均值,在标准曲线上查出铁的质量,计算水样中铁的质量浓度。 四、数据记录与结果计算
水质氨氮的测定纳氏试剂分光光度法
水质氨氮的测定方法纳氏试剂分光光度法 1. 含义本测定方法适用于地表水、地下水、生活污水和工业废水中氨氮的测定。 当水样体积为50 ml ,使用20 mm 比色皿时,本方法的检出限为0.025 mg/L,测定下限为0.10 mg/L ,测定上限为 2.0 mg/L (均以N 计)。 2. 方法原理以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,该络合物的吸光度与氨氮含量成正比,于波长420 nm 处测量吸光度。 3. 检测依据 水质氨氮的测定纳氏试剂分光光度法HJ 535-2009 4. 检测程序 4.1 试剂和材料 除非另有说明,分析时所用试剂均使用符合国家标准的分析纯化学试剂,实验用水为按4: 1 制备的水。 4.1.1 无氨水,在无氨环境中用下述方法之一制备。 (1 )离子交换法 蒸馏水通过强酸性阳离子交换树脂(氢型)柱,将流出液收集在带有磨口玻璃塞的玻璃瓶内。每升流出液加10 g 同样的树脂,以利于保存。 (2)蒸馏法 在 1 000 ml 的蒸馏水中,加0.1 ml 硫酸(ρ=1.84 g/ml ),在全玻璃蒸馏器中重蒸馏,弃去前50 ml 馏出液,然后将约800 ml 馏出液收集在带有磨口玻璃塞的玻璃瓶内。每升馏出液加10 g 强酸性阳离子交换树脂(氢型)。 (3)纯水器法用市售纯水器临用前制备。 4.1.2 轻质氧化镁(MgO)不含碳酸盐,在500 ℃下加热氧化镁,以除去碳酸盐。 4.1.3 盐酸,ρ (HCl)=1.18 g/ml 。 4.1.4 纳氏试剂,可选择下列方法的一种配制。 (1)二氯化汞- 碘化钾- 氢氧化钾(HgCl 2-KI-KOH )溶液 称取15.0 g 氢氧化钾(KOH),溶于50 ml 水中,冷却至室温。称取 5.0 g 碘化钾
实验四邻菲罗啉分光光度法测定铁的含量(精)
实验四邻菲罗啉分光光度法测定水样中的铁 一、实验目的: 1、掌握邻菲罗啉分光光度法测定微量铁的原理和方法; 2、学会标准曲线的绘制方法及其使用。 二、原理: 亚铁离子(Fe2+)在pH=3~9时与邻菲罗啉生成稳定的橙红色络合物,应用此反应可用比色法测定铁。橙红色络合物的吸光度与浓度的关系符合朗伯-比耳定律。若用还原剂(如盐酸羟胺)把高铁离子还原为亚铁离子,则此法还可测定水中的高价铁和总铁的含量。 三、仪器: 721型分光光度计、1cm比色皿、具赛比色管(50ml)、移液管、吸量管、容量瓶等。 四、试剂: 1、铁贮备液(100μg/mL):准确称取0.7020克分析纯硫酸亚铁铵 [(NH4)2Fe(SO4)2·6H2O]于100毫升烧怀中(或0.8640g分析纯的 NH4Fe(SO42·12H2O,其摩尔质量为482.18g/mol),加50毫升1+1 H2SO4,完全溶解后,移入1000ml的容量瓶中,并用水稀释到刻度,摇匀,此溶液中Fe的质量浓度为 100.0μg/mL。(实验室准备好) 2、铁标准使用液(20μg/mL):准确移取铁贮备液20.00ml于100ml 容量瓶中,用水稀释至刻度,摇匀。此溶液中Fe2+的质量浓度为20.0μg/mL。(学生配制)
3、0.5%邻菲罗啉水溶液:配制时加数滴盐酸能助溶液或先用少许酒精溶解,再用水稀释至所需体积。(临用时配制) 4、10%盐酸羟胺水溶液: 5、醋酸-醋酸钠缓冲溶液(pH=4.6):称取40克纯醋酸铵加到50毫升冰醋酸中,加水溶解后稀释至100毫升。 五、测定步骤: 1、标准曲线的绘制: (1)分别吸取铁的标准溶液0.00、1.00、2.00、4.00、6.00、8.00、10.00ml于7支50ml比色管中,加水至刻度; (2)依次分别加入10%盐酸羟胺溶液1ml,混匀,加入5ml醋酸-醋酸铵缓冲溶液,摇匀,加入0.5%邻菲罗啉溶液2ml,摇匀,(3)放置15分钟后,在510nm波长处,用1cm比色皿,以空白作为参比,测定各溶液的吸光度。 (4)以吸光度为纵坐标,铁含量(μg,50ml)为横坐标,绘制出标准曲线。 2、试样中铁含量的测定 吸取待测水样溶液10.00ml于50ml比色管中,按绘制标准曲线的操作,测得水样的吸光度A,由标准曲线查得相应的铁含量,计算出试样的铁的质量浓度。做平行样。 实验四邻菲罗啉分光光度法测定水样中的铁原始记录表
纳氏试剂测定氨氮技巧
纳氏试剂比色法测定水体中氨氮常见问题与解决办法 纳氏试剂比色法是测定水中氨氮的国家标准方法,文献[2]介绍了纳氏试剂比色法的等效方法。标准方法和等效方法对氨氮测定的介绍较为详细,但实际工作中情况复杂,很多问题需要分别深入探讨并加以解决。不少专家学者和专业技术人员对纳氏试剂比色法测定氨氮作了研究,我们根据工作经验,对纳氏试剂比色法测定水体中氨氮常见问题进行了总结,以期更好的指导实际工作。 1实验原理 1.1纳氏试剂配制原理纳氏试剂的正确配制,影响方法的灵敏度。了解纳氏反应机理,是正确配制纳氏试剂的关键。纳氏试剂由Nessler于1856年发明,有2种配制方法,常用HgCl2与KI反应的方法配制,其反应过程如下: 显色基团为[HgI4]2-,它的生成与I-浓度密切相关。开始时,Hg2+与I-按反应(1)式生成红色沉淀HgI2,迅速与过量I-按反应(2)式生成[HgI4]2-淡黄色显色基团;当红色沉淀不再溶解时,表明I-不再过量,应立即停止加入HgCl2,此时可获得最大量的显色基团。若继续加入HgCl2,反应(3)式和(4)式就会显著进行,促使显色基团不断分解,同时产生大量HgI2红色沉淀,从而引起纳氏试剂灵敏度的降低。 1 2氨氮反应原理 了解氨氮反应原理对我们理解反应过程,控制反应条件有重要意义。纳氏试剂与氨氮反应的情况较为复杂,随反应物质含量不同而分别按方程式(5)~(9)进行。 一般情况,纳氏试剂主要用于微量氨氮测定,其反应式为(5)式和(8)式。(9)式表明NH3与NH4+在水溶液中可相互转化,主要受溶液pH的影响。 1.3酒石酸钾钠掩蔽原理 水体中常见金属离子有Ca2+、Mg2+、Fe2+、Mn2+等,若含量较高,易与纳氏试剂中OH-或I-反应生成沉淀或浑浊,影响比色。因而在加入纳氏试剂前,需先加入酒石酸钾钠,以掩蔽这些金属离子,其掩蔽原理如下: 2氨氮实验的影响因子及解决方法 2.1商品试剂纯度 纳氏试剂比色法实验所用试剂主要有KNaC4H6O6·4H2O、KI、HgCl2、KOH。某些市售分析纯试剂常达不到要求,从而给实验造成较大影响,据我们的经验,影响实验的试剂主要是KNaC4H6O6·4H2O和HgCl2。 不合格酒石酸钾钠会导致实验空白值高和引起实际水样浑浊,影响测定。不纯试剂从外
邻二氮菲分光光度法测定微量铁实验报告
实验一邻二氮菲分光光度法测定微量铁 实验目的和要求 1.掌握紫外可见分光光度计的基本操作; 2.掌握邻二氮菲分光光度法测定微量铁的原理和方法; 3.掌握吸收曲线绘制及最大吸收波长选择; 4.掌握标准曲线绘制及应用。 实验原理 邻二氮菲(1,10—邻二氮杂菲)是一种有机配位剂,可与Fe2+形成红色配位离子: Fe2++3 N N N N 3 Fe 2+ 在pH=3~9范围内,该反应能够迅速完成,生成的红色配位离子在510nm波长附近有一吸收峰,摩尔吸收系数为1.1×10-4,反应十分灵敏,Fe2+ 浓度与吸光度符合光吸收定律,适合于微量铁的测定。 实验中,老师我们又见面了采用pH=4.5~5的缓冲溶液保持标准系列溶液及样品溶液的酸度;采用盐酸羟胺还原标准储备液及样品溶液中的Fe3+并防止测定过程中Fe2+被空气氧化。 实验仪器与试剂 1.752S型分光光度计 2.标准铁储备溶液(1.00×10-3mol/L) 3.邻二氮菲溶液(0.15%,新鲜配制) 4.盐酸羟胺溶液(10%,新鲜配制) 5.NaAC缓冲溶液 6.50ml容量瓶7个 7.1cm玻璃比色皿2个 8.铁样品溶液 实验步骤 1.标准系列溶液及样品溶液配制,按照下表配制铁标准系列溶液及样品溶液。
2.吸收曲线绘制用1cm比色皿,以1号溶液作为参比溶液,测定4号溶液在各个波长处的吸光度,绘制吸收曲线,并找出最大吸收波长。 3.标准曲线制作
在选定最大吸收波长处,用1cm 比色皿,以1号溶液作为参比溶液,分别测定2至7号溶液的吸光度,平行测定3次,计算吸光度平均值,绘制标准曲线。 实验数据处理 1、 样品中铁的计算 2.50 50.00 C C X ? =读取值 Cx=4.65×10-5 ×50.00/2.50=9.30×10-4 mol/L 2、 摩尔吸光系数计算 在标准曲线的直线部分选择量两点,读取对应的坐标值,计算邻二氮菲配位物在最大吸收波长出的摩尔吸光系数: 1 21 2c -c A A ε-= ε=(0.460-0.233)/(0.00006-0.00004)=2.00×10-5 7 样品溶液 4.65×10-5 mol/ml
水质 肼的测定 对二甲氨基苯甲醛分光光度法
HZHJSZ0092 水质肼的测定对二甲氨基苯甲醛分光光度法 HZ-HJ-SZ-0092 水质对二甲氨基苯甲醛分光光度法 1 范围 本方法规定了测定水中肼的对二甲氨基苯甲醛分光光度法 试料体积1~10mL±?·?·¨?ì2a?Tò??????a0.002mg/L 更高浓度的样品 氨基脲脲素分别高达20200mg/L以上时干扰测定 NO2ˉ 大于1mg/L时产生干扰 肼与对二甲基苯甲醛作用于波长458nm 处进行分光光度测定 本方法所有试剂均为符合国家标准或专业标准的分析纯试剂 3.1 盐酸 3.2 盐酸溶液HCl 3.3 乙醇95% 3?è?4g对二甲氨基苯甲醛溶于200 mL 95%乙醇和20mL 盐酸Array 中 155g/L剧毒)15.5g 溶于水中如叠氮化钠中含肼 将叠氮化钠溶于适量水中滤液置烧杯中不断搅拌待大部分叠氮化钠析出后经无水乙醇脱水后 2放在干燥器内冷却 注意精制操作应在通风柜内进行 100mg/L2HCl)或0.4060g硫酸肼(N2H4 H2SO4) 3.2?¨á?ò?è?1000mL容量瓶中 3.7 肼标准溶液吸取肼标准贮备液(3.6)10.0mLó?HCl 溶液(3.2)稀释至标线 4.1 分光光度计 4.2 具塞比色管 5 试样制备 5.1 采样与贮存样品均使用玻璃瓶 用盐酸固定可保存24h ·?±e?óè???±ê×?èüòo(3.7)0.5 2.00 6.00 10.00mL加入10mL对二甲氨基苯甲醛溶液 混匀用10cm光程的比色皿于458nm 波长处测定吸光度
含量为横坐标绘制校准曲线 检查水样pH值 将水样调至7左右 加蒸馏水稀释至25mL标线20min 后用10cm光程的比色皿于458nm 波长处测定吸光度 6.3 空白试验 取10mL蒸馏水代替水样 7 结果计算 试样中肼含量C(mg/L)按下式计算 mìg 分析试样体积 8 精密度和准确度 8个实验室对0.1000.800mg/L的标准溶液结果如下 0.9% 8.2 再现性 三个浓度的实验室间相对标准偏差分别为4.4%0.9% 9 参考文献 GB/T 15507-1995 è????ù?Do?óD?¢D?μ?1ìì???á£?úè¥?aê???3?μ?êyoáéy???ùoó?òà?D?è¥3y?ó?ê è???±e???ùóD??12′?ê± 3.2?ù?ó1% 的碘化钾0.4mL混匀再按操作步骤(6.2)进行 用20%氢氧化钠溶液调至水样成红色于通风柜中加HCl (3.2)至红色消失 3.1再按操作步骤(6.2)进行 水样的酸度调到1N后 A3 计算 如测定结果以水合肼计因1.56份N2H4
03氨氮的测定 纳氏试剂比色法 HJ535-2009
水质氨氮检测标准操作规程 纳氏试剂分光光度法 一、目的 规范测定水中氨氮的纳氏试剂分光光度法标准操作规程。 二、适用范围 1、适用于地表水、地下水、生活污水和工业废水中氨氮的测定。 2、当水样体积为50 ml时,本方法的检出限为0.025 mg/L,测定下限为0.10 mg/L,测定上限为2.0mg/L(均以N计)。 三、责任者 实验室检验人员及负责人。 四、正文 1、方法原理 以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,该络合物的吸光度与氨氮含量成正比,于波长420nm处测量吸光度。 2、仪器 2.1、分析天平、紫外可见分光光度计、30mm比色皿、50ml具塞玻璃比色管、实验室常用玻璃仪器等。 2.2、氨氮蒸馏装置:由500ml凯式烧瓶、氮球、直形冷凝管和导管组成,冷凝管末端可连接一段适当长度的滴管,使出口尖端浸入吸收液液面下。亦可使用500 ml 蒸馏烧瓶。 3、试剂 分析时所用试剂均使用符合国家标准的分析纯化学试剂,实验用水为制备的无氨水。
3.1、无氨水:用市售纯水器临用前制备。 3.2、轻质氧化镁(MgO):将氧化镁在500℃下加热,以除去碳酸盐。 3.3、纳氏试剂: 碘化汞-碘化钾-氢氧化钠(HgI2 -KI-NaOH)溶液 称取16.0g氢氧化钠(NaOH),溶于50ml水中,冷却至室温。 称取7.0g碘化钾(KI)和10.0g碘化汞(HgI2),溶于水中,然后将此溶液在搅拌下,缓慢加入到上述50ml氢氧化钠溶液中,用水稀释至100ml。贮于聚乙烯瓶内,用橡皮塞或聚乙烯盖子盖紧,于暗处存放,有效期1年。 3.4、ρ =500g/L酒石酸钾钠溶液 称取50.0g酒石酸钾钠(KNaC4H4O6·4H2O)溶于100mL水中,加热煮沸以除去氨,充分冷却后,定容至100mL。 3.5、ρ=3.5g/L硫代硫酸钠溶液 称取3.5g硫代硫酸钠(Na2S2O3)溶于水中,稀释至1000ml。 3.6、ρ=100g/L硫酸锌溶液 称取10.0 g硫酸锌(ZnSO4·7H2O)溶于水中,稀释至100ml。 3.7、ρ=250g/L氢氧化钠溶液 称取25g氢氧化钠溶于水中,稀释至100ml。 3.8、c(NaOH)=1mol/L氢氧化钠溶液 称取4g氢氧化钠溶于水中,稀释至100 ml。 3.9、c(HCl)=1mol/L盐酸溶液 量取8.5ml浓盐酸于适量水中用水稀释至100 ml。 3.10、ρ=20g/L硼酸(H3BO3)溶液 称取20g硼酸溶于水,稀释至1L。 3.11、ρ=0.5g/L溴百里酚蓝指示剂(bromthymol blue),。 称取0.05g溴百里酚蓝溶于50ml水中,加入10 ml无水乙醇,用水稀释至100ml。 3.12、氨氮标准溶液 3.12.1、ρN =1000μg/ml氨氮标准贮备溶液 称取3.8190g氯化铵(NH4Cl,优级纯,在100~105℃干燥2 h),溶于水中,移入1000 ml容量瓶中,稀释至标线,可在2~5℃保存1个月。
水中铁离子测定方法 二氮杂菲分光光度法
水中铁离子含量测定方法-- 二氮杂菲分光光度法 铁在深层地下水中呈低价态,当接触空气并在pH大于5时, 便被氧化成高铁并形成氧化铁水合物(Fe2O3?3H2O)的黄棕色沉淀,暴露于空气的水中, 铁往往也以不溶性氧化铁水合物的形式存在。当pH值小于5时,高铁化合物可被溶解。因而铁可能以溶解态、胶体态、悬浮颗粒等形式存在于水体中, 水样中高铁和低铁有时同时并存。 二氮杂菲分光光度法可以分别测定低铁和高铁,适用于较清洁的水样;原子吸收分光光度法快速且受干扰物质影响较小。水样中铁一般都用总铁量表示。 1 、二氮杂菲分光光度法 应用范围 本法适用于测定生活饮用水及其水源水中总铁的含量。 钴、铜超过5mg/L,镍超过2mg/L,锌超过铁的10倍对此法均有干扰,饿、镉、汞、钼、银可与二氮杂菲试剂产生浑浊现象。 本法最低检则量为μg, 若取50ml 水样测定, 则最低检测浓度为L。原理 在pH3~9的条件下,低铁离子能与二氮杂菲生成稳定的橙红色络合物,在波长510nm处有最大光吸收。二氮杂菲过量时,控制溶液pH为~,可使显色加快。 水样先经加酸煮沸溶解铁的难溶化合物,同时消除氰化物、亚硝酸盐、多磷酸盐的干扰。加入盐酸羟胺将高铁还原为低铁,还可消除氧化剂的干扰。水样不加盐酸煮沸,也不加盐酸羟胺,则测定结果为低铁的含量。仪器 100ml三角瓶。 50ml具塞比色管。分光光度计。试剂铁标准贮备溶液:称取硫酸亚铁铵[Fe(NH4)2(SO4)2?6H2O],溶于70ml 20+50硫酸溶液中,滴加L 的高锰酸钾溶液至出现微红色不变,用纯水定容至1000ml。此贮备溶液含铁。铁标准溶液(使用时现配):吸取铁标准贮备溶液移入容量瓶中,用纯水定容至100ml。此铁标准溶液含μg铁。%二氮杂菲溶液:称取氮杂菲(C12H8N2?H2O) 溶解于加有2滴浓盐酸的纯水中,并稀释至100ml。此溶液1ml可测定100μg以下的低铁。注:二氮杂菲又名邻二氮菲、邻菲绕啉,有水合物(C12H8N2?H2O)及盐酸盐 (C12H8N2?HCl)两种,都可用。 10%盐酸羟胺溶液:称取10g盐酸羟胺 (NH2OH?HCl),溶于纯水中,并稀释至100ml。乙酸铵缓冲溶液: 称取250g乙
实验分光光度法测定铁
实验分光光度法测定铁 The following text is amended on 12 November 2020.
实验十四邻二氮菲分光光度法测定铁的含量 一、实验目的 1.学习吸光光度法测量波长的选择方法; 2.掌握邻二氮菲分光光度法测定铁的原理及方法; 3. 掌握分光光度计的使用方法。 二、实验原理 分光光度法是根据物质对光选择性吸收而进行分析的方法,分光光度法用于定量分析的理论基础是朗伯比尔定律,其数学表达式为:A=εb C 邻二氮菲(又称邻菲罗啉)是测定微量铁的较好试剂,在pH=2~9的条件下,二价铁离子与试剂生成极稳定的橙红色配合物。摩尔吸光系数ε=11000 L·mol-1·cm-1。在显色前,用盐酸羟胺把Fe3+还原为Fe2+。 2Fe3++2NH 2OHHCl→2Fe2++N 2 +4H++2H 2 O+2Cl- Fe2+ + Phen = Fe2+ - Phen (橘红色) 用邻二氮菲测定时,有很多元素干扰测定,须预先进行掩蔽或分离,如钴、镍、铜、铅与试剂形成有色配合物;钨、铂、镉、汞与试剂生成沉淀,还有些金属离子如锡、铅、铋则在邻二氮菲铁配合物形成的pH范围内发生水解;因此当这些离子共存时,应注意消除它们的干扰作用。 三、仪器与试剂 1.醋酸钠:l mol·L-1; 2.盐酸:6 mol·L-1; 3.盐酸羟胺:10%(用时配制); 4.邻二氮菲(%):邻二氮菲溶解在100mL1:1乙醇溶液中; 5.铁标准溶液。 (1)100μg·mL-1铁标准溶液:准确称取(NH 4) 2 Fe(SO 4 ) 2 ·12H 2 0于烧杯中, 加入20 mL 6 mol·L-1盐酸及少量水,移至1L容量瓶中,以水稀释至刻度,摇匀. 6.仪器:7200型分光光度计及l cm比色皿。 四、实验步骤 1.系列标准溶液配制 (1)用移液管吸取10mL100μg·mL-1铁标准溶液于100mL容量瓶中,加入2mL 6 mol·L-1盐酸溶液, 以水稀释至刻度,摇匀. 此溶液Fe3+浓度为10μg·mL-1. (2) 标准曲线的绘制: 取50 mL比色管6个,用吸量管分别加入0 mL,2 mL,4 mL, 6 mL, 8 mL和10 mL10μg·mL-l铁标准溶液,各加l mL盐酸羟胺,摇匀; 经再加2mL邻二氮菲溶液, 5 mL醋酸钠溶液,摇匀, 以水稀释至刻度,摇匀后放置 10min。 2.吸收曲线的绘制 取上述标准溶液中的一个, 在分光光度计上,用l cm比色皿,以水为参比溶液,用不同的波长,从440~560 nm,每隔10 nm测定一次吸光度,在最大吸收波长
亚甲基蓝分光光度法测定工业及生活污水中硫的含量
本科毕业论文题目:亚甲基蓝分光光度法测定工业及 生活废水中的硫化物含量 学院:化学与化工学院 班级:06级化学五班 姓名:张翠云 指导教师:王海青职称:副教授完成日期:2010年06 月05 日
亚甲基蓝分光光度法测定工业及 生活废水中的硫化物含量 摘要:本文采用亚甲基蓝分光光度法测定工业及生活废水中硫化物的含量。实验结果表明:最低检出限浓度为0.02μg·mL-1,在0~25μg·mL-1范围内,相关系数r=0.9992,符合标准曲线对相关系数的要求(r>0.9990),即所测定硫化物含量具有真实性,是测定工业及生活废水中的硫化物含量的一种有效方法。 关键词:亚甲基蓝分光光度法;硫化物;水质分析
目录 1 引言 (1) 2 实验部分 (2) 2.1 实验原理 (2) 2.2 仪器和试剂 (2) 2.2.1 仪器 (2) 2.2.2 试剂 (3) 2.3 实验过程 (4) 2.3.1 水样采集及固定 (4) 2.3.2 标准曲线的绘制 (4) 2.3.3 样品的测定 (5) 2.3.4 空白测定 (6) 3 结果与讨论 (6) 3.1 实验结果分析 (6) 3.2 实验影响因素 (7) 3.2.1 水样预处理过程的影响 (7) 3.2.2 标定过程的影响 (7) 3.2.3 显色过程的影响 (8) 3.3 实验问题及解决 (8) 参考文献 (9) 致谢 (10)
1引言 此论文依据中华人民共和国环境保护行业标准GB-T 16489-1996,亚甲基蓝分光广度法测定水质硫化物[1,3]所写。该标准适用于地下水,化工,选矿等工业废水和生活废水中硫化物的测定,本次实验主要对大同地区矿水,甘河,高地,小站等四个采样点的水中硫化物进行测定。 我们通常说的水质硫化物系指水中溶解性的无机硫化物和酸溶性金属硫化物,具体包括溶解性的H2S、HS-、S2-以及存在悬浮物中的可溶性硫化物和酸可溶性金属硫化物和一些未电离的有机,无机类硫化物。它们是细菌在厌氧条件分解水中硫酸盐和有机含硫化合物而产生的。 由于这些硫化物随废水排出,往往以硫化氢的形式不断溢散于空气中,毒性很大。它可与人体细胞色素,氧化酶及该物质中的二硫键(-S-S)作用,影响细胞的氧化过程,造成细胞缺氧而危害人的生命,硫化氢除自身腐蚀金属外还可使污水中的生物氧化生成硫酸进而腐蚀下水道。因此硫化物的含量已成为水体污染的一项重要指标,近几年来水质硫化物的测定已成为一项常规的监测项目。 对于水和废水中硫化物的测定方法已有很多报道,属仪器测定方法的有荧光法,间接原子吸收法,紫外分光广度法,亚甲基蓝分光光度法等。属化学分析法的则有碘量法等各种容量滴定法。紫外分光广度法简便快速,但灵敏度较差;荧光法和间接原子吸收法有较好的选择性,主要用于废水中微量硫化物的测定,测定范围通常为0.007~0.8μg·mL-1。亚甲基蓝分光光度法和碘量法则是测定废水中硫化物的经典法。通常样品中硫化物含量小于1mg·L-1时采用前者,样品中硫化物含量大于1mg·L-1时采用后者。但由于某些废水成分复杂,干扰因素较多,用碘量法测定时有时存在较大误差,即碘量法的适用范围有一定限制,一般适用于硫化物含量较高且干扰因素较少的水样。而亚甲基蓝分光光度法由于灵敏度高,最低检出限浓度为0.02μg·mL-1,选择性好,加上予处理装置一般能消除干扰,因此作为首选方法。 采用该方法测定的关键几步:水样采集及固定;标准曲线的绘制;样品的测定;空白测定等。注意的是,由于水中硫化物含量与气象因素及环境因素等有关,即在硫化物的测定中,影响因素[12-14]很多,尤其是水样的采集固定以及
纳氏试剂光度法测定氨氮
水质 氨氮的测定 纳氏试剂分光光度法 方法学验证报告 验证起始日期 :2018年 月 日 结束日期:2018年 月 日 一、实验目的 1、掌握比色法测定水中氨氮含量的测定方法及原理。 2、熟悉纳氏试剂分光度法测定氨氮的方法学验证。 二、依据标准文献 HJ 535-2009 水质 氨氮的测定 纳氏试剂分光光度法 化学分析方法确认和验证指南 GB/T 27417-2017 三、适用范围 适用于地表水、地下水、生活污水和工业废水中氨氮的测定。 四、方法原理 以游离态的氨或铵离子等形式存在的氨氮与纳氏试剂反应生成淡红棕色络合物,该络合物的吸光度与氨氮含量成正比,于波长420 nm 处测量吸光度。 氨氮与纳氏试剂反应生成棕色胶态化合物, [][]KI O H I NH O Hg NH KOH HgI K 7232222342++?=++ 五、仪器设备 紫外可见分光光度计 型号:T6新世纪 出厂编号:26-1650-01-1108 厂家:北京普析 六、试剂材料 1. 20mm 比色皿,50毫升比色管,实验室用超纯水机。 2. 纳氏试剂(碘化汞-碘化钾-氢氧化钠(HgI 2-KI-NaOH )溶液): 称取 16.0g 氢氧化钠(NaOH ),溶于50ml 水中,冷却至室温。 称取7.0g 碘化钾(KI )和10.0g 碘化汞(HgI 2),溶于水中,然后将此溶液在搅拌下,缓慢加入到上述50ml 氢氧化钠溶液中,用水稀释至100ml 。贮于聚乙烯瓶内,用橡皮塞或聚乙烯盖子盖紧,于暗处存放,有效期1年。 3. 酒石酸钾钠溶液:称取50.0g 酒石酸钾钠(KNaC 4H 4O 6·4H 2O )溶于100mL 水中,加热煮沸以驱除氨,充分冷却后稀释至100ml 。 4. 氨氮标准贮备溶液(1000μg/ml ):称取3.8190g 氯化铵(NH 4Cl ,优级纯,在100~105℃干燥2h ),溶于无氨水中,移入1000ml 容量瓶中,稀释至刻度,摇匀。可在2~5℃保存1个月。 5. 氨氮标准工作溶液(10μg/mL ):吸10.00ml 氨氮标准贮备溶液于1000ml 容量瓶内,用无氨水稀释至刻度,摇匀。临用前配制。 以下为水样需预处理时所需试剂 6. 硫代硫酸钠溶液(3.5g/L ):称取3.5g 硫代硫酸钠(Na 2S 2O 3)溶于水中,稀释至1000ml 。 7. 硫酸锌溶液(100g/L ):称取10.0g 硫酸锌(ZnSO 4·7H 2O )溶于水中,稀释至100ml 。 8. 氢氧化钠溶液(250g/L ):称取25g 氢氧化钠溶于水中,稀释至100ml 。
实验5 分光光度法测定微量铁的条件试验
实验5 分光光度法测定微量铁的条件试验 一、目的要求 1. 通过本实验学习确定实验条件的方法; 2. 学习Vis-723G型分光光度计的使用方法。 二、基本原理在可见光分光光度测定中,通常是将被测物质与显色剂反应,使之生成有色物质,然后测量其吸光度,进而求得被测物质的含量。因此,显色反应的完全程度和吸光度的物理测量条件都影响到测定结果的准确性。显色反应的完全程度取决于介质的酸度,显色剂的用量、反应的温度和时间等因素。在建立分析方法时,需要通过实验确定最佳反应条件。为此,可改变其中一个因素(例如介质的pH值),暂时固定其它因素,显色后测量相应溶液的吸光度,通过吸光度-pH曲线确定显色反应的适宜酸度范围。其它几个影响因素的适宜值,也可按这一方式分别确定。本实验以邻二氮菲为显色剂,找出测定微量铁的适宜显色条件。 三、仪器及试剂 1. 仪器 Vis-723G型分光光度计(上海分析仪器厂);容量瓶50mL,250mL;吸量管5mL,10mL; 吸量管25mL,10 mL,5 mL,2 mL;pH计;玻璃复合电极。 2.试剂 ①铁盐标准溶液 准确称取若干克(自行计算)优级纯的铁铵矾NH4Fe(SO4)2·12H2O于小烧杯中,加水溶解,加入6mo1·L -1 HCl溶液5mL,酸化后的溶液转移到250mL容量瓶中,用蒸馏水稀释至刻度,摇匀,所得溶液每毫升含铁0.100mg。然后吸取上述溶液25.00mL置于250mL容量瓶中,加入6mo1·L-1 HCl 溶液5mL, 用蒸馏水稀释至刻度,描匀,所得溶液含铁0.0100mg·mL—1。 ②0.1%邻二氮菲(又称邻菲咯啉)水溶液③1%盐酸羟胺水溶液 ④HAc-NaAc缓冲溶液(pH=4.6) 称取136g优级纯醋酸钠,加120mL冰醋酸,加水溶解后,稀释至500mL。⑤0.1mo1.L-1NaOH溶液⑥0.1mo1.L-1HCl溶液⑦广泛pH试纸和不同范围的精密pH 试纸注上述试剂中,有特殊说明的除外,其余均为分析纯试剂或由分析纯试剂所配制。 四、实验步骤 1.吸收曲线的绘制 用吸量管吸取0.0,5.0 mL的0.0100mg·mL—1的铁标准溶液分别注入三个50mL的容量瓶中,各加入1mL盐酸羟胺溶液、2mL邻二氮菲、5mL NaAc,用水稀释至刻度,摇匀。放置10分钟后,用1cm比色皿、以试剂空白(即0.0mL铁标液)为参比溶液,在440~560nm之间,每隔5nm测定一次吸光度。 2.酸度影响 于9只50mL容量瓶中,用吸量管各加入5.0mL 0.0100mg/mL的铁标准溶液,2.5mL盐酸羟胺溶液和5.0mL邻二氮菲溶液,然后按下表1分别加入HCl或NaOH溶液。 表1 HCl、NaOH溶液加入量
HJ535_2009水质氨氮的测定纳氏试剂分光光度法
氨氮的测定纳氏试剂分光光度法 目次 前言............................................................................. .................................................. ..................III 1适用范围............................................................................. .................................................. .. (1) 2方法原理............................................................................. .................................................. .. (1) 3干扰及消除............................................................................. .................................................. . (1) 4试剂和材料............................................................................. .................................................. . (1) 5仪器和设备............................................................................. .................................................. . (3) 6样品............................................................................. .................................................. . (3) 7分析步骤............................................................................. .................................................. .. (4) 8结果计算............................................................................. .................................................. .. (4) 9准确度和精密度 ............................................................................ .. (5) 10质量保证和质量控制 ............................................................................ . (5)
