不合格药品报告确认单
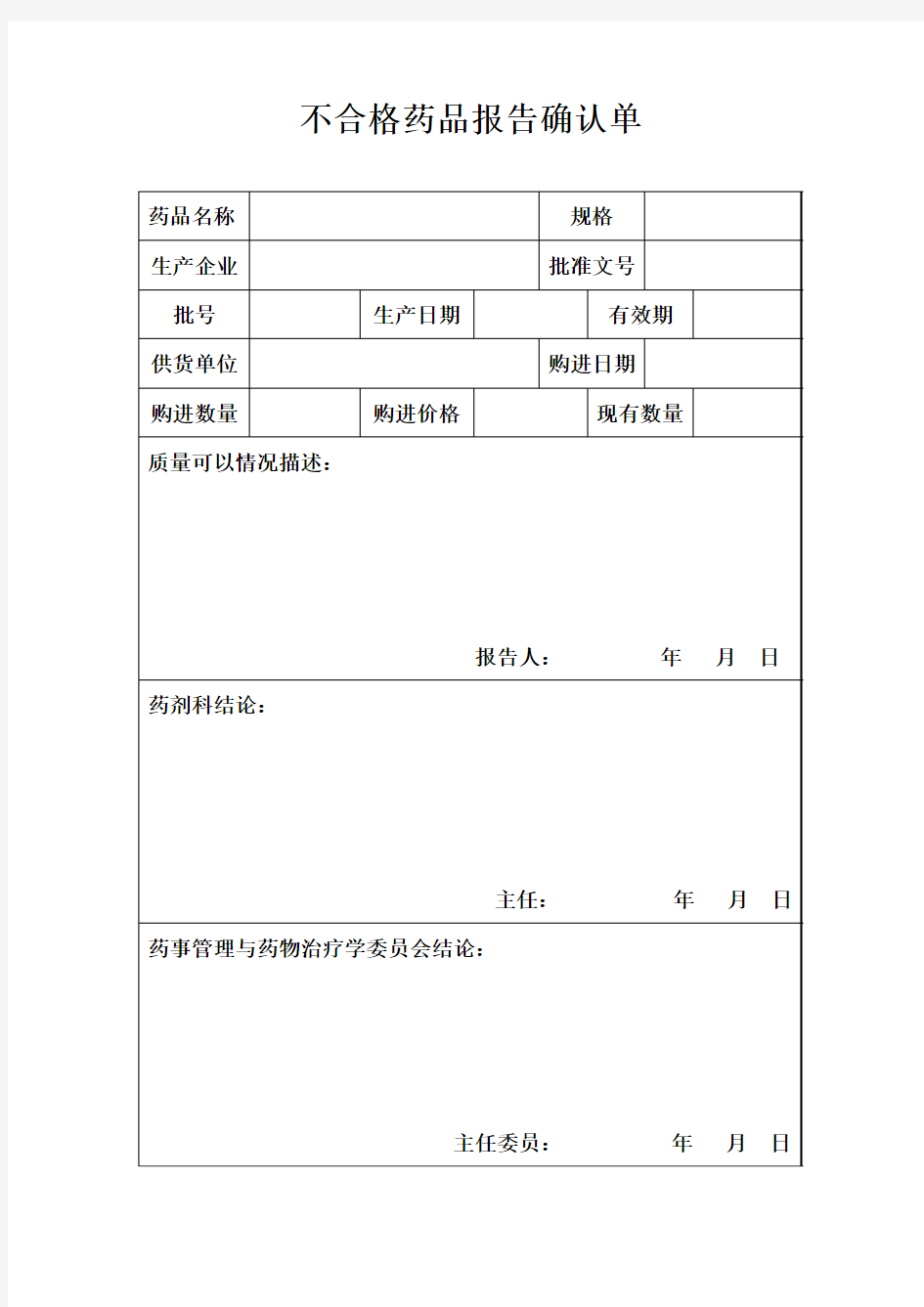

不合格药品报告确认单
麻醉药品和精神药品入库验收登记本等表格
附件:1. 麻醉药品和精神药品入库验收登记本 2. 麻醉药品和精神药品验收缺损登记本(药库专用) 3. 麻醉药品和精神药品进出库专用账册(药库专用) 4. 麻醉药品和精神药品进出库专用账册(药房、临床科室使用) 5.麻醉药品、第一类精神药品基数汇总表 6.药房麻醉药品、第一类精神药品基数表 7. 医疗机构疼痛诊疗专用病历(包括麻醉药品、第一类精神药品使用知情同意书) 8-1.麻醉药品、第一类精神药品消耗与空安瓿、废贴回收登记本(适用于注射剂和贴剂) 8-2. 麻醉药品、第一类精神药品消耗登记本(适用于口服制剂) 8-3. 麻醉药品、第一类精神药品消耗与空安瓿回收登记本【临床科室(病区)专用】 9. 麻醉药品、第一类精神药品不合格药品登记表 10. 麻醉药品和精神药品销毁登记本 11. 麻醉药品、第一类精神药品交接班登记本 AHA12GAGGAGAGGAFFFFAFAF
12. 麻醉药品、第一类精神药品回收登记本(药房专用) 13. 麻醉药品、第一类精神药品回收登记本(麻醉科专用) 14. 麻醉药品、第一类精神药品空安瓿、废贴销毁登记本 AHA12GAGGAGAGGAFFFFAFAF
附件1 麻醉药品和第一类精神药品入库验收登记本 第()本 年月日~年月日 _________医院药学部门 AHA12GAGGAGAGGAFFFFAFAF
麻醉药品和第一类精神药品入库验收登记表 AHA12GAGGAGAGGAFFFFAFAF
AHA12GAGGAGAGGAFFFFAFAF
附件2 麻醉药品和第一类精神药品验收缺损登记本 (药库专用) 第()本 年月日~年月日 _________医院药学部门 AHA12GAGGAGAGGAFFFFAFAF
不合格药品管理规定
不合格药品管理规定 This model paper was revised by the Standardization Office on December 10, 2020
不合格药品管理制度 1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符, 包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的.(3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销
售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问题药品、属假劣药品范围的不合格药品应报废,并在药品监督管理部门的监督下进行销毁处理。 10、不合格药品的确认、报告、报损、销毁应有完善的手续和记录。
医药有限公司不合格药品管理制度
医药有限公司不合格药品管理制度 目的:保证药品质量、防止不合格药品注入市场,特制定本制度。 范围:储运部、质管部、采购部、销售部、财务部。 内容: 1、公司人员在验收、检验、保管、养护和销售过程中发现有药品不符合相关的质量标准及有关规定时,应立即停止进货,并按本制度采取措施。 2、验收员在验收过程中发现药品不符合验收要求及有关规定时,应先填写《药品拒收报告单》,上报质管部审核,质管部审核确认该批药品不合格后应立即封存,按不合格药品管理制度处理并上报上级药监部门。 3、保管、养护过程中发现在库药品有质量问题,保管人员应立即将该批药品移入待验区,停止发货,立即上报质管部与主管领导。并对临近批次药品进行严格审查,若发现问题也应予以标识。确认为不合格的药品应存放在不合格品库(区),按不合格药品管理制度处理。
4、质管部负责不合格药品的调查、监控与处理: 4.1质理管理部负责对造成不合格的原因进行调查,填写《不合格药品报损审批表》,详细说明药品品名、产品、批号、生产企业、不合格原因、标准规定及验收的结果,分析造成不合格拉三扯四在,提出对不合格药品的处理意见,经质管部负责人签字后送主管领导和总经理审批,经审核批准后对不合格药品进行处理; 4.2登记《不合格药品台账》,并作为该品种进货的审核依据; 4.3查出内在质量不合格的药品应上报药品监督管理部门; 4.4经质管部判定需要销毁的不合格药品,应填写《不合格药品销毁审批表》,质管部负责人与主管领导审核批准后,在质量管理人员监督下销毁或交药品监督管理部门处理,并填写《不合格药品销毁记录》,执行人和监督人分别在记录上签字,送质管部归档保存; 4.5业务部、仓储部对需要销毁的不合格药品,填写《不合格药品报损审批表》经总经理批准后交财务部进行处理; 4.6对由于保管、运输等本公司管理原因而造成药品不合格,及时处理并制定应采取的措施,分清质量责任。纠正措施确定后,各有关部门负责纠正措施的落实,质管部负责实施的监督。
退货药品管理规定精编版
退货药品管理规定 GE GROUP system office room 【GEIHUA16H-GEIHUA GEIHUA8Q8-
不合格药品和退货药品管理制度 1.目的 为杜绝不合格药品流入市场,确保人民用药安全有效,特制定本制度。 2.依据 2.1《中华人民共和国药品管理法》及实施条例 3.职责 3.1质量管理员负责对不合格药品实施监控管理,行使药品质量的确认权、不 合格药品的处置权。 3.2采购员负责对不合格药品的退货等处理。 3.3保管员负责将不合格药品移入不合格区存放。 4.内容 4.1不合格药品应存放在不合格药品库(区)。不合格药品的确认、报损、销 毁应有完善的手续和记录。 4.2不合格药品的范围 4.2.1 药品所含成份与国家药品标准规定的成份不符的; 4.2.2 以非药品冒充药品或以他种药品冒充该种药品的; 4.2.3 国务院药品监管部门规定禁止使用的; 4.2.4 依照《中华人民共和国药品管理法》必需批准而未经批准生产、进 口,或必需检验而未经检验即销售的; 4.2.5变质的;被污染的;
4.2.6使用依照《中华人民共和国药品管理法》必需取得批准文号而未取 得批准文号原料药生产的; 4.2.7所标明适应症或功能主治超出规定范围的; 4.2.8未注明有效期或更改有效期的;超过有效期的; 4.2.9 不注明或更改生产批号的; 4.2.10 直接接触药品的包装材料和容器未经批准的; 4.2.11 擅自添加着色剂、防腐剂、香料、矫味剂及辅料的; 4.2.12 其他不符合药品标准规定的; 4.2.13 经抽样检验,其内在质量不符合药品标准的; 4.2.14 外包装严重破损或不符合国家有关规定的; 4.2.15 国家或省、市各级药品监督管理部门发布的通知或质量公告中不合 格的 4.3不合格药品的处理 4.3.1 对不合格药品由质量管理员发出药品停用通知,并及时收回所有问 题的药品。 4.3.2 不合格药品属供货企业或生产企业原因的,应立即停止采购并联系 退货事宜,。 4..3.3 对不能退货的药品,经质量管理小组审批、签字后,退回药库,由 药库人员填写《药品报损单》并进行统一销毁,对特殊管理药品必须在食品药品监督管理部门的监督下进行销毁并记录。 本制度自2005年5月修订起执行。
不合格药品处理的操作程序
编号:SY-AQ-04389 ( 安全管理) 单位:_____________________ 审批:_____________________ 日期:_____________________ WORD文档/ A4打印/ 可编辑 不合格药品处理的操作程序 Operation procedures for handling unqualified drugs
不合格药品处理的操作程序 导语:进行安全管理的目的是预防、消灭事故,防止或消除事故伤害,保护劳动者的安全与健康。在安全管 理的四项主要内容中,虽然都是为了达到安全管理的目的,但是对生产因素状态的控制,与安全管理目的关 系更直接,显得更为突出。 1.目的:为规范对不合格药品的管理,保证不合格药品按规定处理,根据《药品管理法》、GSP、质量管理制度及实际工作需要,制定本程序。 2.适用范围:门店不合格药品的管理。 3.责任:质量员 4.工作程序: 4.1质量管理员对验收、养护及销售退回等环节中出现的不合格药品进行确认。 4.1.1对验收环节中确认的不合格药品,质量验收人员拒收,填写拒收通知单,并通知收货员及时处理。同时,对拒收药品进行登记。 4.1.2对养护环节中确认的不合格药品,养护员挂红牌停止销售,将不合格药品移入不合格区并登记。 4.1.3对销售退回环节中确认的不合格药品,保管员将其存放于不合
格区并登记。 4.2不合格药品的报损销毁处理。 4.2.1需报损的不合格药品由门店企业负责人填写《不合格药品报损表》,经业务部门、质管部门审核后,由经理批准。 4.2.2经批准销毁的,由门店企业负责人填写《药品销毁记录》,经业务经理批准,按药监部门要求进行处理。 4.3药品质量公报公布的及药检机构抽检确认的不合格药品,质量管理部下通知停售,质量管理员负责收集信息,养护员将药品放入不合格药品区并填写《不合格药品登记表》,按食品药品监督管理部门要求进行处理。 4.4药检机构抽检确认的不合格药品,应就地封存,按药监部门的规定上报并处理。 这里填写您的公司名字 Fill In Your Business Name Here
不合格药品确认及处理程序
不合格药品确认及处理程序 1、为加强对不合格药品的管理,防止质量事故的发生和不合格药品流入市场,保证人民用药安全有效。质量管理小组负责不合格药品的确认、通报、查询、报损和监督处理。 2、上报 2.1验收人员在验收时发现质量可疑药品,通知质量管理小组确认,可疑药品暂时停止入库; 2.2养护员、保管员在工作中发现有质量可疑药品,挂“黄色暂停发货牌”,填写《药品质量复查报告单》上报质量管理小组确认; 2.3销售、使用人员在销售工作中发现质量可疑药品,暂时停止销售、使用,将样品送质量管理小组,质量管理科到现场取样、检查; 2.4质量管理小组在质量检验中发现不合格药品,应立即通知保管员将不合格药品放入不合格区; 2.5食品药品监督管理部门在检查和抽检中发现不合格药品,保管员应立即将其放置到不合格药品区。 3、确认 3.1依据 a、根据《中华人民共和国药品管理法》对假药或劣药的介定; b、法定药检所的检验报告书; c、国家食品药品监督管理部门下达的有关药品质量方面的文件、通知、质量通报等; d、《中华人民共和国药典》。 3.2确认程序 a、质量管理小组接到《药品质量复查报告单》后,在1个工作日内到现场复查,当不能确认时送市药检所检验; b、确认后,由质量管理科在《药品质量复查报告单》上填写复查情况和质量复查结论及处理意见。 4、追回。不合格药品确认后,立即组织人员将出库或已销售的不合格的药品追回。 5、保管。将库存和追回的不合格药品通知保管员放入不合格区,并做好不合格药品记录。记录内容:日期、品名、规格、数量、生产厂商、批号、质量情况、质量管理人员签字等。 6、报损。半年或一年一次,质量管理员填写不合格药品报损表,报损表上应有财务科、质量管理科、业务科负责人签写意见,然后上报分管质量领导批准。 7、销毁。批准销毁的药品由业务科室人员、保管员、质量管理科参加,邀请食品药品监督部门监督销毁。质量管理小组做好销毁记录。记录内容:品名、规格、数量、批号、生产厂商、销毁原因、销毁方法、销毁地址、监督人、时间等。 8、总结。对不合格药品进行汇总、分析,找出原因,制定防范措施。 9、流程图
新GSP认证不合格药品管理制度
不合格药品管理制度 一、目的: 严禁购进销售不合格药品,对经营过程中发现的不合格药品实行控制性管理,确保人民用药安全。 二、依据: 根据《药品经营质量管理规范》(卫生部第90号令)及《药品流通监督管理办法》。 三、适用范围: 适用于公司在入库验收,在库养护,出库复核和销售过程中发现不合格药品的管理。 四、内容: (一)不合格药品的范围 1、药品的内在质量不符合国家法定质量标准及有关规定的药品。 2、药品的外观质量不符合国家法定质量标准及有关规定的药品。 3、药品包装、标签及说明书不符合国家有关规定的药品。 (二)不合格药品的确认 1、入库验收时发现不合格药品,验收员填写“药品拒收报告单”,报质管部进行确认,确认为不合格的应拒收,并报业务部与供货单位联系处理,药品移入不合格品区。 1、在库药品养护时发现不合格品,应立即挂黄牌暂停发货,养护员填写“药品质量复查通知单”,报质管部复查。经质管部确认为不合格的药品,质管部填写“药品停售通知单”通知储运、业务部门,库房将其移入不合格药品区。 3、出库药品发现质量问题,应停止发货并报告质管员确认。严禁不合格药品进入流通领域。 4、已销售的药品发现质量问题,经质管部确认为不合格的,应由业务部发“销后药品退回通知单”经质管部签署意见后及时追回,由收货员直接移至不合格药品区,生成不合格药品记录。 5、对不合格药品,保管员填“不合格药品登记表”进行登记,每月汇总报质管部和业务部,质管部督促处理。 (三)不合格药品的处理 1、对于验收过程中发现的不合格药品应做拒收处理,由验收人员填写《药品拒收报告
单》报质量管理部确认后,通知业务部联系供货单位处理。 采购员供货单位处理。 2、凡在质量抽检时发现的和国家药品监督管理部门通知查处的不合格药品,质管部应填写“药品停售通知单”通知储运部和业务部,业务部应发“销后药品退回通知单”追回已销售的药品,并按药品监督管理部门的规定处理。 3、因质量变异的库存药品及销后退回的不合格药品,经质管部复查确认后,由质管部报告当地药监局,不得自行作销售或退换货处理。 4、不合格药品每年集中报损,由保管员填写“不合格药品报损审批表”,经业务、质管、财务部门审核签署意见后报质量副总及总经理审批。销毁药品,在业务、质管、财会和药监部门等人员监督下实施销毁。销毁人员填写“报损药品销毁表”,相关资料保存五年。 5、凡不合格药品均不得移作他用。对不顾后果销售不合格药品的,一经发现,严肃处理。 6、质管部应建立不合格药品档案,作为药品质量分析的重要依据。
药品安全自查整改报告
药品安全自查整改报告 王洼市场监督管理所: 我店在接到贵所关于“医疗机构药品安全自查”通知后,根据自查整改表8项32条要求,对我店情况进行了认真的自查与整改,其中达标项24条,合理缺项5条,未达标项3条。现将自查整改结果报告如下: 一、自查达标项: 1、制度管理:已建立以负责人为第一责任人的药品安全管理制度;并结合单位实际情况,每月开展两次培训学习,做到学习有记录;已建立不合格药械管理制度,并做好相关处理记录;建立健全药品不良反应监测制度。 2、许可证:合法取得药品经营许可证及营业执照,并按规定的许可范围执业,无超范围经营现象;所有从业人员均取得健康证且健康证在有效期内。 3、药品购进:所有药品全部从合法渠道购进;购进药品做到100%票货相符;有配送单位的有效资质,并与配送单位签订质量保证协议;对所有购进的药械全部索取检验合格证明并留档。 4、药品储存:库存药品建有温湿度监测记录,并按要求每日两次登记;药品按同批号堆码,无混堆及席地存放现象。 5、特殊管理药品:除含麻黄碱类药品外,再未使用其他特殊管理药品,含麻黄碱类药品全部按《含麻黄碱类药品管理办法》
管理及销售。 6、药品陈列:按照药品用途及剂型分类陈列;针剂及大输液类药品没有倒置存放现象;陈列药品有温湿度监测记录,并按要求做到每日记录两次;中药饮片柜斗全部正名正字,标签清楚且与药品一致;拆零药品集中存放并配有拆零所必需的工具及专用包装袋。 7、药品使用:严格按照《处方药管理办法》管理和销售处方药;不合格药品有专区存放,并有标识和记录,未发现过期及不合格药品;未擅自配制销售制剂,未使用其他医疗机构制剂。 8、设施设备:中药饮片有调配设备且效验准确;陈列、储存药品设施设备与品种规模相适应。 二、自查合理缺项:经自查以下5条不在执业范围或无执业经营权限。 1、无疫苗经营权限。 2、特殊药品除含麻黄碱类药品外其他无经营权限,含麻黄碱类药品严格按照《含麻黄碱类药品管理办法》管理。 3、没有无菌植入等一次性医疗器械经营权限。 4、无疫苗、诊断试剂等经营权限,所以没有配备冷藏柜。 5、没有医疗设备,所以无档案及记录。 三、自查未达标项及整改措施: 1、已建立药品不良反应监测制度,但未及时上报药品不良反应。发现此项未达标项后,及时与县市场监督管理局联系,已
药品销毁的管理制度
药品销毁的管理制度 1、目的:为了明确报损药品销毁工作的申请和监督管理,制定本制度。 2、依据:《中华人民共和国药品管理法》(中华人民共和国主席令第 31 号)、《药品管理法实施条例》(国务院令第 360 号)、《药品流通管理办法》(局令第 26 号)、《药品经营质量管理规范》(国家食品药品监督管理总局令第 28 号)、《药品经营质量管理规范现场检查指导原则》(食药监药化监【2016】160 号)、《广东省食品药品监督管理局药品零售企业分级分类的管理办法(试行)》(粤食药监局药通【2018】23 号)等有关法律法规。 3、适用范围:企业药品销毁的管理。 4、责任:质量管理环节负责人负责本制度的实施。 5、内容: 5.1、销毁申请:在集中销毁之前,质量管理人员要填报《不合格药品报损审批表》,经质量管理负责人批准后的不合格药品方可进行销毁,并填写《不合格药品登记表》。 5.2、销毁周期:每年进行一次报损药品的集中销毁工作。 5.3、销毁监控:药品在出库销毁之前,必须在质量管理人员的监控下,对账清点药品实物,防止不合格药品流失导致安全事故等不良后果。质量管理人员必须从出库到销毁结束全程监控。在进行药品销毁时,至少有2人在场,并在《不合格药品销毁记录表》上做记录并签字。 5.4、销毁记录:销毁的药品要进行登记,记录内容为:药品名称、规格、批号、销毁数量、销毁原因、经手人、确认人、销毁时间、地点、方式等,并将记录文件资料在事后三日内整理存档,记录保存5年。 5.5、销毁地点:药品的销毁应避免造成对环境的污染,销毁的地点应远离水源、住宅等,必要时需得到环保部门的批准。销毁可采取破碎深埋,燃烧等方式。 5.6、质量管理人员对不合格药品的销毁处理情况应每月进行汇总,并上报企业质量负责人。
不合格药品的确认和处理程序
1/2 1.目的:规范不合格药品管理,保证经营药品质量。 2.范围:适用于不合格药品处理的全过程。 3.责任:质量管理部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。 4.内容: 4.1 在药品入库验收和退货药品验收过程中,验收员发现不合格品时(包括包装质量不符合要求,内在质量不符合 要求,超过有效期等情况的品种)应: 4.1.1不属于内在质量问题的应拒收,不得入库; 4.1.2 属于内在质量问题的不能退货,应填写“不合格药品报告确认表”; 4.1.3确认为不合格品的药品应存放于不合格品库,挂红牌标志; 4.1.4发现假劣药,及时通知供货方,并报告当地药品监督管理局,不得擅自退货。 4.2在检查、养护库存药品或出库复核过程中发现不合格品时应: 4.2.1立即停止发货和出库,通知质量管理员电脑调成“停售”状态,并填写“不合格药品报告确认表”报告 质量管理部,并通知储运部、销售部停止销售和使用,并追回售出药品,不合格药品应及时移入不合格品库。 4.2.2质量管理部应及时进行质量查询,分清质量责任,与供货单位协商处理,挽回损失。并追回已销出的不 合格药品,将不合格药品移放于不合格药品库。 4.3上级药监部门抽查、检验判定为不合格品,或上级药监、药检部门公告、发文、通知查处不合格品时应: 4.3.1立即停止销售,并按销售记录追回已售出的不合格品; 4.3.2 将不合格药品移入不合格品库。 4.4不合格品的报损、销毁,应按以下规定进行: 4.4.1不合格品的报损由仓储运输部填写“药品报损审批表”,经部门经理审核批准后报损;同时报质量管理部 确认,业务部、财务部审核、并报企业负责人批准。 4.4.2不合格药品报损后需作销毁处理时,应在质量管理部和其他有关部门的监督下进行并填写“不合格药品销 毁记录”。 4.4.3对质量不合格的药品,应查明原因,分清责任,及时制定并采取纠正和预防措施。 4.5不合格品的上报 4.5.1储运部应及时做好药品报损登记,并按季送质量管理部统计汇总,重大不合格药品事件应随时上报; 4.5.2公司质量管理部对公司不合格品情况上报企业负责人。 4.6及时做好不合格药品处理记录,记录应保存三年。 4.7不合格药品的确认和处理流程图
麻醉药品和精神药品入库验收登记本等表格
. 附件:1. 麻醉药品和精神药品入库验收登记本 2. 麻醉药品和精神药品验收缺损登记本(药库专用) 3. 麻醉药品和精神药品进出库专用账册(药库专用) 4. 麻醉药品和精神药品进出库专用账册(药房、临床科室使用) 5.麻醉药品、第一类精神药品基数汇总表 6.药房麻醉药品、第一类精神药品基数表 7. 医疗机构疼痛诊疗专用病历(包括麻醉药品、第一类精神药品使用知情同意书) 8-1.麻醉药品、第一类精神药品消耗与空安瓿、废贴回收登记本(适用于注射剂和贴剂) 8-2.麻醉药品、第一类精神药品消耗登记本(适用于口服制剂) 8-3.麻醉药品、第一类精神药品消耗与空安瓿回收登记本【临床科室(病区)专用】 9. 麻醉药品、第一类精神药品不合格药品登记表 10. 麻醉药品和精神药品销毁登记本 11. 麻醉药品、第一类精神药品交接班登记本 12. 麻醉药品、第一类精神药品回收登记本(药房专用) 13. 麻醉药品、第一类精神药品回收登记本(麻醉科专用) 14. 麻醉药品、第一类精神药品空安瓿、废贴销毁登记本 精品
附件1 麻醉药品和第一类精神药品入库验收登记本 第()本 年月日~年月日 _________医院药学部门 精品
麻醉药品和第一类精神药品入库验收登记表 精品
附件2 麻醉药品和第一类精神药品验收缺损登记本 (药库专用) 第()本 年月日~年月日 _________医院药学部门 精品
麻醉药品和第一类精神药品验收缺损登记表 精品
附件3 麻醉药品和第一类精神药品进出库专用账册 (药库专用) 第()本 年月日~年月日 ________医院药学部门 精品
不合格药品管理制度培训资料.doc
不合格药品管理制度 1、不合格药品是指:药品的包装不合格、外观质量不合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、包装、标识不符, 包装污染、破碎及超过有效期的药品,并报质量管理员确认为不合格的.(3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单” 进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理员,质量管理员每季度对不合格药品进行汇总和分析,分清质量责任,制定处理和预防措施. 9、对于包装破损或者包装不符合规定的不合格药品,可由采购员根据协议及时联系退货处理;对过期失效药品、超过供货商负责期的有质量问 题药品、属假劣药品范围的不合格药品应报废,并在药品监督管理部门的 监督下进行销毁处理。 10、不合格药品的确认、报告、报损、销毁应有完善的手续和记录。
药品质量问题处理报告单
药品质量问题处理报告单 药品质量问题处理报告单 ?vbnert | 2009-09-10 16:00:34 ?有0人认为这个回答不错 | 有0人认为这个回答没有帮助 ?不合格药品管理程序 广州市东山区百济抗肿瘤药房 文件名称:不合格药品管理程序 编号:CX-BG-8-1 起草人: 审核人: 批准人: 颁发人: 起草日期:20050216 审核日期:20050218 批准日期:20050222 执行日期:20050224 分发人员:质量管理部门、购进部门、仓储部门、销售部门 1、目的:建立不合格药品控制性管理程序,规范不合格药品的管理工作。 2、依据:《药品经营质量管理规范》。 3、适用范围:本程序规定了企业不合格药品控制性管理的内容、方法和要求,明确了相关部门或 人员的职责,适用于药品验收、在库养护、和销售过程中发现的不合格药品的处理。 4、职责:质量管理部门、购进部门、仓储部门、销售部门对本程序的实施负责。 5、内容: 5.1 不合格药品的发现: 5.1.1 购进验收时不合格药品的发现:药品验收人员根据药品法定标准和购进合同规定的质量条款对购进药品进行验收,遇以下药品质量问题,需填写《药品拒收报告单》,报质量管理人员确认。 5.1.1.1 破损、污染、短少。 5.1.1.2 包装、标签、说明书不符合规定 5.1.1.3 批号、有效期不符合规定。 5.1.1.4 进口药品通关单不符合规定。 5.1.1.5 假药、劣药。 5.1.2 在库养护不合格药品的发现:在库发现以下质量可疑药品,需填写《药品质量复核单》,
报质量管理部门确认。 5.1.2.1 保管人员发现的质量可疑药品。 5.1.2.2 养护人员对在库药品养护检查中发现质量有疑问的药品。 5.1.2.3 超过有效期的药品。 5.1.3 售后不合格药品的发现:销售部门对售后药品发现质量问题或疑问应填写《药品质量复核单》,报质量管理部门确认。 5.1.3.1 购货单位发现质量不合格或有疑问而以口头、电话、书面函件等形式向销售人员或销售部门反映的药品。 5.1.4 供货单位发现留样有质量问题而通知购货单位回收的药品。 5.1.5 药品监督管理部门发文要求停止使用或回收的药品。 5.2 不合格药品的报告: 5.2.1 验收人员填写《药品拒收报告单》后,向质量管理人员报告。 5.2.2 养护人员、出库复核人员填写《药品质量复核单》后,向质量管理部门报告。 5.2.3 销售人员填写《药品质量复核单》后,向质量管理部门报告。 5.2.4 验收人员、销售人员在发生以下情况时,应立即向质量管理部门报告: 5.2.4.1 在药品经营过程中发现假劣药品。 5.2.4.2 销售人员被购货单位口头、电话或书面告之所销售药品发生新的或严重的不良反应以及发生临床事故。 5.2.5 质量管理部门接到购货单位口头、电话或书面通知有关5.2.4所述情况时,应立即向当地药品监督管理部门报告并做好记录。 5.3 不合格药品的确认: 5.3.1 验收过程中不合格药品的确认:质量管理人员根据《药品拒收报告单》所反映的情况,依据国家有关法规及企业内部有关规定,对验收过程中质量有疑问的药品进行复核,确认为不合格药品的予以签名,并通知保管人员将该药品移至不合格药品库(区)。 5.3.2 在库养护不合格药品的确认: 5.3.2.1 质量管理部门根据有关的法规和企业内部的规定对有质量疑问的药品进行质量复核,确认为不合格药品的予以签名,并通知保管人员将该药品移入不合格品(区)。 5.3.2.2 抽样检验为不合格药品的,即通知保管人员移入不合格库(区)。 5.3.2.3 质量管理部门对在库有效期还有10天的药品作停售处理,通知保管人员将这类药品移入不合格品库(区)。 5.3.3 售后不合格药品的确认: 5.3.3.1 销售部门接到购货单位口头或电话、书面等形式反映药品质量有问题后,应立即填写《药品质量复核单》,并向质量管理部门报告;质量管理部门立即与购货单位联系核实,必要时,抽样送法定检验机构确认。 5.4 不合格药品的处理:不合格药品由质量管理部门负责处理,并做好不合格药品处理记录。5.4.1 移库与存放: 5.4.1.1 质量管理部门进行现场复核,确认为不合格药品后,填写“移库单”,通知保管人员将药品移入不合格药品库(区)存放。 5.4.1.2 质量管理部门现场复核后不能确认的,应开具“抽样单”抽样送法定的药品检验机构检验(在购货单位抽样时,应征求购货单位同意),裁定为不合格药品的,填写“移库单”通知保管人员将其移入不合格品库(区)存放。在检验期间,库存药品应存放在待验库(区),并放置明显标志。 5.4.1.3 质量管理部门接到销售人员的《药品质量复核单》后,应首先暂停在库同批号药品的销售,并与购货单位联系核实(必要时,抽样送法定检验机构检验);确认为不合格药品时,填
药店档案
药店档案 xx药店企业档案(一) 1.药品经营许可证、营业执照、组织机构代码证、税务证等证照 2.企业近年来有关荣誉证书 3.特殊药品的批文(二类精神药品的经营批文) 4.企业筹建资料 5.企业现场验收资料 6.GSP申报资料 xx药店法律法规和技术标准档案(二) 1.《药品管理法》 2.《药品管理法实施条例》 3.《药品流通监督管理办法》 4.《药品经营许可证管理办法》 5.《药品零售企业GSP认证检查评定标准》 6.《药品零售企业GSP认证检查项目》 7.《处方药与非处方药分类管理办法》 8.《药品经营质量管理规范》 9.《药品经营质量管理规范实施细则》 10.药品包装、标签和说明书管理规定(暂 行) 11.《药品经营企业岗位知识培训教材》 xx 药 店 管 理 文 件 档 案(三) 1、管理制度汇总 2、工作程序汇总 3、《文件编制申请及批准表》 4、《文件分发记录》 5、《文件状态档案》 xx 药 店 评 审 考 核 档 案(四) 1、评审考核通知 2、《质量管理体系内审检查评定标准和评审结果汇总》 3、《质量管理体系评审项目内容和评审结果》 4、《质量管理体系内部评审记录》 5、《质量管理制度执行情况自(检)查评分表》 6、《质量管理制度考核情况反馈及其整改情况报告》 xx药店供货单位档案(含首营企业)(五)
1、《供货单位汇总表》 2.《合格供货方档案》 3、合格供货方有关资料包括①生产或经营许可证和营业执照复印件; ②质量保证书或协议;③GMP或GSP认证证书(已取得认证的企业) 4、《首营企业审批表》 5、首营企业有关资料包括①生产或经营许可证和营业执照复印件;②质量保证书或协议:③GMP或GSP认证证书复印件(已取得认证的企业); ④法人委托书、业务人员身份证复印件、上岗证。 6.采购合同或协议。 xx 药 店 药 品 质 量 档 案(含首营品种)(六) 1、《药品质量档案表》附该药品的质量标准、药品的包装、标签、说明书等一切与药品质量有关的材料 xx 药 店 质 量 信 息 档 案(七) 1、《药品质量信息传递单》和有关信息资料 2、《文件传阅处理单》和主管部门文件 3.《服务质量满意征询表》 xx 药 店 设 施 设 备 档 案(八) 1、《设施设备一览表》 2、《养护设备维修、保养记录》 3、《计量器具管理台帐》 4、《仪器、衡器校验记录》 5、设备计量器具使用说明书、保修卡、购进票据 6、每月装订好的《养护设备使用记录》 xx 药 店 员 工 资 质 档 案(九) 1、《员工名册》 2、《员工履历表》 3、各员工的学历证 4、执业或职业资格证书(职称证书) 5、药学技术人员的聘书 6、任命通知 xx 药 店 员 工培 训 档 案(十) 1、《年度培训计划》 2、《员工教育培训情况记录》 3、《员工个人教育培训档案》 4、各员工的继续教育有关证明 5、GSP岗位证书
药品经营质量风险评估报告
药品经营质量风险评估 报告 文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)
质量风险评估报告起草(签名/日期): 审核(签名/日期): 批准(签名/日期):
一、概述 质量风险管理是指贯穿产品生命周期的药品质量风险评估、控制、沟通和审核的系统过程。GSP的基本原则与药品质量风险管理的目标相一致。药品经营企业作为质量风险管理主体,在药品经营环节实施GSP过程中,通过运用质量风险管理的方法,正确识别质量风险、评估质量风险,科学控制质量风险,达到降低质量风险危害程度的目的,从而发挥质量风险管理对企业GSP贯彻实施的保证作用,进一步确保所经营药品的质量,切实保障公众用药的安全有效。 本报告的方案通过预先主动地制定方法以识别和控制在药品流通过程中存在的潜在质量问题,达到防范风险,预防质量事故的目的。 二、目的 通过质量风险分析评估,评估公司现有的质量管控措施是否全面,必要时完善相关管控措施,明确公司的风险控制策略。 三、范围 药品经营质量与企业组织机构、人员、管理制度与职责、过程管理、设备设施等诸多要素共同整合的复杂过程,任何一个要素发生问题都会影响所经营药品的质量,引发药品质量风险。 药品风险来源复杂,有人为因素,也有药品本身的“两重性”因素。人为因素可导致假药、劣药经营、药品质量问题、标识缺陷和包装质量问题、用药差错问题等,多属可控制风险;药品属性因素包括药品天然风险,其中包括药品已知风险和未知风险。已知风险包括药品已知不良反应和已知药物相互作用等,属可控制风险;
药品未知风险包括药品未知不良反应,非临床适应症患者使用,未试验人群的应用(如孕产妇、婴幼儿、老年人、肝肾功能障碍者等,他们一般被排除在临床试验入选标准之外),多属不可控制风险。 本风险分析包含组织机构、人员资质,管理制度与职责、设备设施、药品采购、药品检查、药品验收、药品储存、药品销售、药品运输等过程,主要是针对可控风险,不可控风险不在本报告的方案之内。四、风险评估小组组成及职责 公司于2017年3月3日成立了风险评估小组,定于3月6日开展风险评估活动。通知文件详见附件。小组主要成员见下表:
药店自查报告怎么写
竭诚为您提供优质文档/双击可除 药店自查报告怎么写 篇一:xxx人民医院药品自查报告 xxx人民医院 关于药品质量管理的自查报告 xxx人民医院始建于1956年,现已发展成为一所集预防、保健、教学、科研、康复等综合服务功能为一体的非营利性医疗机构,医院占地面积12403平方米,医疗用房面积17497平方米,编制200张床,实际开设床位240张,设有12个临床科室、5个医技科室、13个职能科室,20XX年成功创建为二级甲等医院。 我院根据上级下发的《宝塔区医疗机构药品监督检查工作实施方案》工作的通知,完全按照自查表的各项内容进行了自查,现将自查结果汇总如下: 一、领导重视,管理组织健全 我院成立了医院药事管理委员会,负责监督、指导本机构科 学管理药品和合理用药。药剂科设立了了药品质量管理
人员负责人具体负责药品质量管理的管理工作,确定各岗位职能,并建立健全药品质量管理各环节制度。目前我院现有药品品种575种(含西药与中成药),材料品种共计244种。20XX年药剂科在院领导的正确领导和支持下,紧紧围绕医院的工作重点和要求,科室成员以团结协作、求真务实、认真负责的精神状态开展工作,全年药剂科收入1738万元,其中药品收入1349万元,材料收入389万元,处方调配差错率控制在万分之一以下,顺利完成了全年的各项工作任务和目标。 二、药品的管理 1、我院已经于20XX年6月进行网上集中招标采购药品,药 品采购目录根据《国家基本药物目录》、《陕西省药品挂网公示》 及结合临床实际使用确定,并经医院药事管理委员会审核通过, 由药剂科按照目录进行网上采购。 2、根据医改要求,我院于20XX年7月开始严格执行药品统 一配送管理,并于20XX年7月药品零差率销售。 3、根据《药品管理法》及相关药品法律法规并结合我院
药店GSP记录全套填写指南
药店GSP记录全套填写指南 记录填写指导 一、基本要求 1、统一用黑色水性笔填写。 2、记录不得涂改、粘贴、不得留有空行。 3、记录时逐行填写,不得打省略号。 4、记录有误时,用直尺划一横线(红色)并在旁边注明更正日期和更正人姓名,另取一行重新填写正确的内容。 5、每项记录都要加上公司统一印制的专用封面,用塑料杆夹固定放入资料盒中备查。 6、记录封面应填写记录名称及起始日期。 二、温湿度记录 1、记录前先填好店名、月份。 2、手工填写适宜温度范围。 3、营业间:0~30 ℃;冷藏柜:2~8 ℃ 4、适宜相对湿度范围35﹪~75﹪ 5、每天上午9:00~10:00、下午3:00~4:00各填写一次,每次记录完毕应及时签名。 6、调控措施后应将调控到适宜范围内温湿度数据重新填写。 三、养护设备使用及维护记录
1、夏季开机时间从上午9时开始,至晚上21时左右为止,中间时间可视情况(室温降至26℃以下时)停机。 2、相对湿度达到或超过75﹪时,采用通风或开空调的方法除湿。 3、室温达到或超过8 ℃时,生物制品等需2℃~8 ℃以内保存的药品应放入冷藏柜密封保存(如:人血白蛋白注射液、人免疫球蛋白、诺和灵30R笔芯、胰岛素制剂、重组人干扰素α-2b凝胶等)。 4、室温达到或超过25℃时,需25 ℃以下保存的药品应放入冷藏柜密封保存,如:乌体林斯注射液;卡介菌多糖核酸注射液/斯奇康注射液;阿托伐他汀片/阿乐;非洛地平缓释片/波依定;双氯芬酸钠双释放肠溶胶囊/戴芬胶囊;去氧孕烯炔雌醇片/妈富隆;阿卡波糖片/拜糖平片;糠酸莫米松软膏/艾洛松氟伐他汀胶囊/来适可胶囊;阿司匹林维生素C泡腾片/拜阿司匹灵等。 5、填写时应标明以下内容:门店名称、设备名称、规格型号、设备编号、年份等。 6、空调、冷藏柜(无药品)未使用时,保持清洁卫生,保持随时启用状态,按月试机,作好记录。 四、药品养护记录、中药饮片养护记录 1、对陈列的药品每月进行检查。 2、近效期的药品、易霉变、易潮解的药品、拆零药品、冷藏药品作为重点养护品种,每月定期做好养护记录(可集中在每月的26日左右填写)。 3、夏季(6~9月)将栓剂、软膏剂、糖浆剂等易受气温影响的药品作为重点养护品种进行养护。 4、对储存中发现的有质量疑问的药品,应立即下柜,停止销售,填写《质量查询报告单》(一式两份),报质管部进行处理。 5、下列药品应在备注栏内说明:有效期在6个月以内的品种、拆零药品、冷藏柜贮存的药品、需要重点检查的其他药品。 五、近效期药品催销表
正确解读药品检验报告
正确解读药品检验报告 依据 根据《药品管理法》第七十八条,除但书(指立法表述中以“但是”、“但”作为转折连词,用以表例外的条件或行为的前提的句法模式)规定的几种情形外,对假劣药的处罚通知,必须载明药品检验机构的检验结果。药品质量检验结果即通常所说的药品检验报告书,是药品检验机构对抽验药品质量出具的技术鉴定,具法律效力,同时也是药品监管部门认定某种药品是否应定性为假劣药实施行政处罚的重要依据。 目的 然而,药品检验报告只载明检验结果是否合乎标准,却未对不合格药品进行定性,执法人员对检验结果理解不同就有可能得出不同的结论,这直接影响监管部门对药品生产、经营企业和使用单位药品质量的定性和行政处罚决定,关系到药品生产、经营企业和使用单位的利益和声誉,甚至影响其生存。 意义 因此,正确解读药品检验报告,对判定假劣药品,依法实施行政处罚具有相当重要的意义。 一、正确理解药品检验报告所反映的质量信息 (一)、理解药品标准是解读检验报告的前提 药品标准是国家对药品的质量、规格和检验方法所作的技术规定,是保证药品质量,进行药品生产、经营、使用、管理及监督检验的法定依据,是药品生产、流通、使用和监督检验中各环节、各单位所必须共同遵守的强制性标准。 药品标准包括二大部分: 1.必须经过药品检验机构检验的事项,如成份、规格、含量、允许的杂质及其限量、质量要求等; 2.无需经过药品检验机构进行专门技术检验的事项,如药品的通用名称、功能主治、适应症、有效期、生产批号等。 通常所说药品检验合格与否实际上是指所检验的项目是否符合规定,但检验项目合格不等同于药品符合国家药品标准。如药品的功能主治、适应症超出规定范围,擅自延长有效期、更改生产批号等,同样也是不符合药品标准。 对检验项目和非检验项目都合格的药品也不能放松警惕,如在药品中人为添加官能团结构相类似的物品或者在药品中非法加入对检测项目有干扰的成份等,依现有质量标准中检测项目却无法鉴别,都有可能使检验结果失真,导致假劣药品检验合格,这些假劣药品披上“合法”外衣,对民众用药安全的危害性更大,这就要求检验机构不断的提高检验水平,让假劣药品“无处藏身”,执法人员对检验合格的品种也要“掘地三尺”,利用其他渠道辨别药品的真伪。 (二)、分析检验项目,正确定性假劣药品 药品检验的项目通常包括性状、鉴别、检查和含量测定四大项,因各个药品剂型的质量标准要求不同,故其检验项目中所含的内容会有所不同,但不论检验项目多少,只要其中有一项不合格,该批药品总的结论便是不合格。检验报告书上对检验结果的描述仅为是否符合规定,却未载明对检验不合格药品的定性。因此,执法人员不仅要看检验报告的总结论,更需分析药品检验报告中各个检验项目不合格的原因,依据《药品管理法》相关条款来判断不合格药品是假药还是劣药。 1、性状药品性状是指药品制剂的物理特征或形态,包括了药品应具有的外观(例如色泽、臭味、溶解度、粘稠度等)以及各项物理常数(例如熔点、沸点、比重、折光率、比旋度、吸收系数等)。药品的色泽(包括药品的表面、截面和内容物等)、外形(如大小不均匀、破损、粘连结块、沉淀等)、气味与标准描述不符,溶解度、物理常数检测数据与标准不同,一般来说按劣药处理,但有时也应结合其他检验项目才能最终定性。
不合格药品管理制度示范文本
不合格药品管理制度示范 文本 In The Actual Work Production Management, In Order To Ensure The Smooth Progress Of The Process, And Consider The Relationship Between Each Link, The Specific Requirements Of Each Link To Achieve Risk Control And Planning 某某管理中心 XX年XX月
不合格药品管理制度示范文本 使用指引:此管理制度资料应用在实际工作生产管理中为了保障过程顺利推进,同时考虑各个环节之间的关系,每个环节实现的具体要求而进行的风险控制与规划,并将危害降低到最小,文档经过下载可进行自定义修改,请根据实际需求进行调整与使用。 1、不合格药品是指:药品的包装不合格、外观质量不 合格、内在质量不合格。 2、不合格药品的确认: (1)国家或省、市各级药品监督管理部门发布的通知 或质量公报中的不合格药品。 (2)质量验收、保管养护和销售过程中发现的外观、 包装、标识不符,包装污染、破碎及超过有效期的药品, 并报质量管理员确认为不合格的. (3)各级药品监督管理部门抽查检验不合格的药品。 (4)符合药品管理法中有关假、劣药品定义的。 (5)生产厂商、供货单位来函通知的不合格药品。 3、不合格药品一旦确认,即不能再销售,将不合格药
品移入不合格区,并做好“不合格药品台帐”记录. 4、入库验收发现不合格药品,验收员填写“药品拒收报告单”交质量管理员,由质量管理员确认后,提出处理意见进行处理。 5、在储存、养护或出库时发现质量有疑问药品,应立即挂黄牌暂停销售,填写“药品质量复查通知单”交质量管理员复验。复验合格,摘除黄牌;不合格,将不合格品移入不合格品区,填写“药品质量处理通知单”进行处理。 6、在门诊陈列、检查、销售过程中发现不合格药品应停止销售,立即下柜。 7、凡药监局公告或发文通知不合格的药品,以及抽查检验发现的不合格药品,应立即清查,集中存放于不合格区内,按要求上报。 8、各环节发现的不合格药品,均应及时报质量管理
