高中化学无机推断 集锦

A
B E
C D F G
H2O
高中化学无机推断题集锦
1、对从太空某星球外层空间取回的气体样品分析如下:
(1)将样品溶于水,发现其主要成分气体A极易溶于水,水溶液呈酸性;(2)将A的
浓溶液与KMnO4反应产生一种黄绿色气体单质B,将B通入石灰乳可生成两种钙
盐的混合物D。(3)A的稀溶液与锌粒反应生成气体C,C与B的气体充分混合经
光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。
据此回答下列问题:(1)写出A、B、C、D的化学式:
A________;B________C_________D___________。
(2)气体B与Ca(OH)2的化学反应方程式____________________,混合物D俗名是
__________________,它的有效成分是____________________,其有效成分与空
气里的二氧化碳和水蒸气反应的方程式是____________________________。
2、列物质间有如下转化关系
浅黄色固体W
E
③
②
气体甲
E
①
气体乙
白色悬浊液C
固体A
溶液B
点燃
液B
溶
④
液体E
气体丙液D
溶
溶液B
(1)W为__________
(2)固体A是一种重要的工业原料,1mol气体乙完全燃烧时生成1molE和2mol丙,
则乙的分子式为____________
(3)C溶液中的溶质和丙以物质的量之比1:2反应时,离子方程式为____ ______。
(4)利用图中有关物质实现C→B的转变,该物质是___________(填化学式)
(5)若甲和乙恰好完全反应,则A和W的物质的量之比为__________
3、有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系。已知:
○1A、B、C、D含同一种元素;○2A、B、C、D、E、F、G
都不是氧化物;③D、G是钠盐;
④A、E、F、G含同一种元素,且F为单质,E在常温下为气体。
回答下列问题:
(1)写出A、F的化学式:A_______F________
(2)写出下列反应的离子方程式:
○1D→C_______________________________
○2C+D→B_____________________________
4、A、B、C、D、E几种常见的化合物或单质之间
有如下转化关系:
(1)若E是酸酐,D是有刺激性气味的无色气体,则B的化学式是,工业
上实现D转化为E的化工设备的名称是。
(2)若C是酸性气体,B是碱性气体,则E是。工业生产实际中。合成
B选择一定的下列条件的依据是:
①压强②温度
(3)若A是日常生活中最常见的物质,C为黄绿色单质气体,则E的电子式为。
(4)若A是某有机物,其分子空间构型为正四面体,写出下列反应的化学方程式:
A→B+C;B→D。
5、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D
分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中
质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。
回答:(1)写出由B、C二元素所形成的原子个数比为1∶1的化合物的电子式
__________,其晶体中存在的化学键有____________________(填化学键名称)。
(2)写出两种均由A、B、C、D四种元素组成的化合物的化学式__________、
__________。这两种化合物的水溶液发生反应的离子方程式为________________。
(3)用A元素的单质与B元素的单质可制成新
型的化学电源,已在宇宙飞船中使用。其构造
如下图所示。两个电极均由多孔性碳制成,通
入的气体由孔隙中逸出,并在电极表面放电。
则a是____极,电极反应式为_________,b是
_____极,电极反应式为_______________。
6、甲、乙、丙、丁四种单质在点燃条件下反应
生成X、Y、Z、W四种化合物,转化关系如图所
示,又知:
①甲、乙、丙均为前三周期元素的单质,常温下均为
气态;丁是日常生活中的一种常见金属。
②常温下,X是无色液体,Y是黑色固体。
③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成
棕黄色的烟,W的水溶液呈黄色。
请填空:
(1)丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应方程式:
负极:____________________________ 正极:____________________________。
(2)将少量W的浓溶液滴入热的X中,反应的化学方程式为:_________________。
(3)将Y看成碱性氧化物,Y与Z的溶液发生反应的离子方程式是:__________。
(4)若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物
质的量之比为_____________。
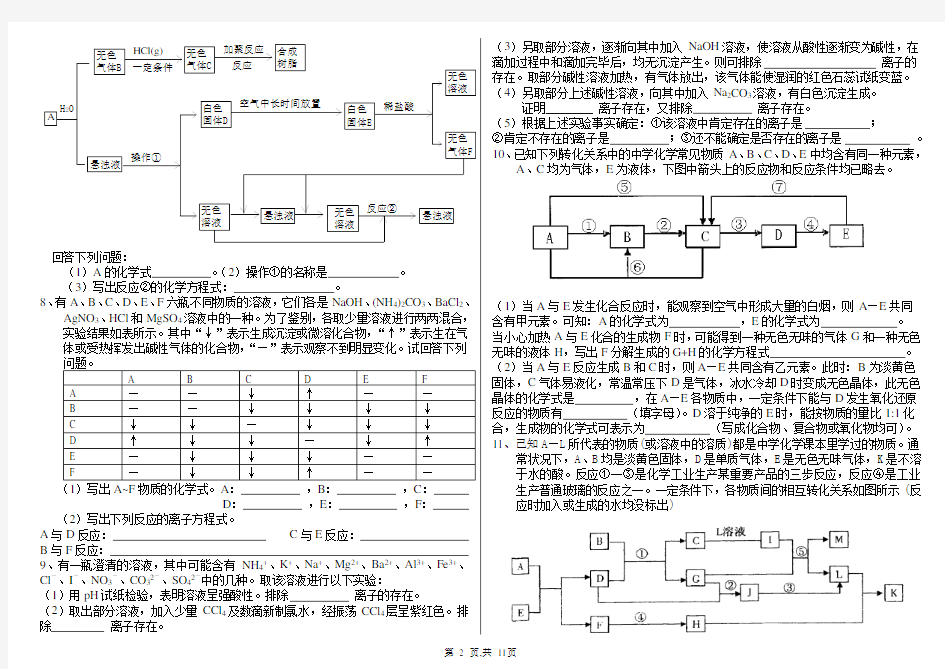
7、从固体物质A开始,可以发生如下图所示的一系列变化:
A
无色
气体B
HCl(g)
一定条件
无色
气体C反应
加聚反应合成
树脂
悬浊液
操作①
白色
固体D
空气中长时间放置
白色
固体E
稀盐酸
无色
溶液
无色
气体F
无色
溶液
悬浊液
反应②
无色
溶液
悬浊液
H2O
回答下列问题:
(1)A的化学式。(2)操作①的名称是。
(3)写出反应②的化学方程式:。
8、有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NaOH、(NH4)2CO3、BaCl2、
AgNO3、HCl和MgSO4溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。其中“↓”表示生成沉淀或微溶化合物,“↑”表示生在气体或受热挥发出碱性气体的化合物,“—”表示观察不到明显变化。试回答下列问题。
A B C D E F
A ——↓↑——
B ——↓↓↓↓
C ↓↓—↓↓↓
D ↑↓↓—↓↑
E —↓↓↓——
F —↓↓↑——
(1)写出A~F物质的化学式。A:,B:,C:
D:,E:,F:(2)写出下列反应的离子方程式。
A与D反应:C与E反应:
B与F反应:
9、有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Ba2+、Al3+、Fe3+、Cl-、I-、NO3-、CO32-、SO42-中的几种。取该溶液进行以下实验:
(1)用pH试纸检验,表明溶液呈强酸性。排除离子的存在。
(2)取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡CCl4层呈紫红色。排除离子存在。(3)另取部分溶液,逐渐向其中加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,均无沉淀产生。则可排除离子的存在。取部分碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。(4)另取部分上述碱性溶液,向其中加入Na2CO3溶液,有白色沉淀生成。
证明离子存在,又排除离子存在。
(5)根据上述实验事实确定:①该溶液中肯定存在的离子是;
②肯定不存在的离子是;③还不能确定是否存在的离子是。
10、已知下列转化关系中的中学化学常见物质A、B、C、D、E中均含有同一种元素,
A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A—E共同
含有甲元素。可知:A的化学式为,E的化学式为。
当小心加热A与E化合的生成物F时,可能得到一种无色无味的气体G和一种无色无味的液体H,写出F分解生成的G+H的化学方程式。(2)当A与E反应生成B和C时,则A—E共同含有乙元素。此时:B为淡黄色固体,C气体易液化,常温常压下D是气体,冰水冷却D时变成无色晶体,此无色晶体的化学式是,在A—E各物质中,一定条件下能与D发生氧化还原反应的物质有(填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为(写成化合物、复合物或氧化物均可)。
11、已知A—L所代表的物质(或溶液中的溶质)都是中学化学课本里学过的物质。通
常状况下,A、B均是淡黄色固体,D是单质气体,E是无色无味气体,K是不溶于水的酸。反应①一③是化学工业生产某重要产品的三步反应,反应④是工业生产普通玻璃的反应之一。一定条件下,各物质间的相互转化关系如图所示(反应时加入或生成的水均没标出)
(1)写出下列物质的化学式:B ;D的同素异形体
(2)写出A的电子式;E的结构式
(3)指出反应①、②、③是吸热反应,还是放热反应
①②③
(4)完成下列反应方程式:反应⑤的离子方程式:
反应④的化学方程式:
12、甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、
丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系:(反应中生成的水已略去)
←
(1)丙的名称是;C的化学式是;X属晶体。(2)A+D→C的反应属于下列何种反应类型(填序号)。
A.化合反应B.氧化还原反应C.非氧化还原反应 D.离子反。
A.化合反应B.氧化还原反应C.非氧化还原反应 D.离子反应(3)工业生产中,将D转化为E的反应条件是。
(4)写出A与H2O反应的化学方程式:。
(5)若用如图装置来证明A和H2O的反应:
①是放热反应,②生成了丙。简单合理的实验
操作是:①;
②。
13、(1)A+、B+、C-、D、E代表5种微粒(分子或离子),
它们分别含10个电子,已知它们有如下转化关系:A++C-=D+E B++C-=2D
①A+的电子式为;E分子的空间构型为。
②C-、D、E3种微粒结合质子(H+)的能力由强到弱的顺序为(用微粒的化学式表示);其理由是(用两个离子方程式表示),。
14、已知A~K所代表的各物质都是中学化学里常见的物质,且I是具有磁性的物质,D和K都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示:请回答:
(1)写出有关物质化学式:D是,H是。
(2)写出下列反应的方程式:
①化合物G的溶液不呈中性,其原因用离子方程式表示为,
②C+F?→
?H+I 。
15、如下图所示,A、B、C、D、E五种物质的相互转化关系
请回答:
(1)若A通常状态下为固态单质,A→E分别为(写化学式)A ;B ;
C ;
D ;
E 。
(2)若A通常状态下为气态单质,则A→E分别为(写化学式)A ;
B ;
C ;
D ;
E 。
(3)写出(2)中物质间转化的离子方程式E→C
16、根据如下转化关系
回答下列问题:
(1)物质的分子式:A 、B 、C 、D 、E 、F 。(2)写E→F的离子方程式。
17、A、B、C为三种不溶于水,透明、坚硬的固体。A在氧气中完全燃烧只得到一
种无色、无臭、密度为氧气密度的1.375倍(标准状况)的气体。B的粉末易溶于热的苛性钠溶液,向此溶液中加入过量盐酸时,析出一种不溶于水,酸性比碳酸还弱的酸。将B与石灰石,纯碱按一定比例混合高温溶融后得C。C在高温下能软化,但无固定的熔点。根据以上事实回答:
(1)A、B、C的名称:A B C
(2)写出有关化学反应的方程式:
X
甲
乙
A
D
C
B
E
丙
+
+丙
点燃
+丙
点燃
+丙
一定条件
+H2O
B和苛性钠反应:。B→C的主要的反应:。
18、已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元
素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E;
请回答以下问题:
(1)B分子中含有化学键为(写名称),A的分子式为,A分子的空间构型是。
(2)写出②中涉及反应的化学方程式。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式。(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式。
19、某新型无机材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨损、
耐腐蚀、耐高温、抗氧化的特性。它是用中学化学中的常见物质为原料来生产的。其生产流程如下图所示,其中虚线框内的转化是为了探究C的组成而设的。
已知C的相对分子质量为NH3的10倍,分子空间构型与甲烷相同。G、F、H 为难溶于水的白色固体,且H为高性能通讯材料光导纤维的主要原料。图中除M、K(均含A元素)外,其它字母代表的均为中学化学中常见的物质。
回答下列问题:
(1)K可能属于的晶体类型是________________。
(2)写出化学式:单质B__________,化合物F____________。
(3)写出下列反应的离子方程式:
反应⑤:________ _____反应⑥:_________________________
(4)反应④的化学方程式为:________________________
20、A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部
分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、
D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第_______周期、第_______族;
(2)写出反应①的化学方程式__ _________;
(3)写出反应④的离子方程式__ _______;
(4)写出反应③的电极方程式:
阳极:_______________ _____ 阴极:________ __________ 21、A+、B+、C-、D、E 等五种微粒(分子或离子),它们都分别含10个电子,其中B+有四个原子核。已知它们可进行如下转化:
①A++C-D+E↑ ②B++C-→2D ③E+B+→A++D
据此,回答下列问题:
⑴A+、B+、C-的化学式依次为、、。
⑵E的电子式为,它是(填“极性”或“非极性”)分子,它的空间构型为(用文字表示)。
⑶由①②③式反应可知,C-、D、E 三种微粒结合质子(H+)能力由强到弱的顺序是(用微粒的化学式表示)。
22、现有A、B、C、D、E、X、Y
和M等物质,它们均为纯净物,
在一定条件下,可发生如右图所示的
转化,其中X、Y为常见双原子气体
单质,其中X为有色气体,B为常见
金属单质,质软。E为由两种常见元
素(按原子个数1:1)组成的液体,
A为黑色化合物,上述各步转化中只
写出其中一种生成物,其它生成物没有写出(也有可能反应只有一种生成物)。
试回答:⑴写出化学式,X ,E ;
⑵写出离子方程式:A→X ;
C→D 。
⑶A+E反应的化学方程式为:。
23、甲、乙、丙、丁四种单质在点燃条件下
反应生成X、Y、Z、W四种化合物,其
转化关系如右图所示。又知:①甲、乙、
丙均为前三周期元素的单质,常温下均
为气态;丁是日常生活中一种常见的金
属。②常温下X是无色液体,Y是黑色
固体。③丙在乙中燃烧发出苍白色火焰,
丁在乙中燃烧生成棕黄色的烟,W的水
溶液呈黄色。
(1)丁在甲和X同时存在的条件下,
可发生电化腐蚀,写出正极上的电极反应式: 。 (2)将少量W 的饱和溶液滴入热的X 中,反应的化学方程式是 (3)若Z 、W 两溶液的pH 均等于5,则两溶液中由水电离出的H +的物质的量浓度之比为 。
(4)已知5.6L (标准状况)气体丙在甲中完全燃烧放出热量为71.45kJ ,则能正确表示丙燃烧热的热化学方程式为 。 24、图表示A 、B 、C 、D 、E 五种含氮物质相互转 化的关系图。其中A 、B 、C 、D 常温下都是气体, B 为红棕色,写出A 、B 、C 、D 、E 的化学式和有 关反应的化学方程式。
(1)各物质的化学式为:B. , D. ,
(2)写出A →C 的化学方程式和E →C 的离子方程式: A →C : E →C :
25、A 、B 、C 、D 为四种单质,常温时,A 、B 是气体,C 、D 是固体。E 、F 、G 、H 、I 为五种化合物,F 不溶水,E 为气体且极易溶水成为无色溶液,G 溶水得黄棕色溶液。这九种物质间反应的转化关系如图所示
(1)写出四种单质的化学式
A_________ B__________ C______ D________ (2)写出E +F →H +I 的离子方程式
26、以下三例是常见的化学实验
①将通入澄清的石灰水,溶液先浑浊,后澄清CO 2
②将稀盐酸逐滴滴入溶液,开始时无现象,后产生气体Na CO 23③将溶液逐滴滴入溶液,先产生白色沉淀,后沉淀消失NaOH AlCl 3
回答下列问题: (1)每例中均可用前后两个化学反应方程式来说明变化的现象,试用简要文字,说明这两个反应间的关系______________________
(2)每例中若要保证后一个反应发生,必须具备的条件是什么?
(3)将各例中前后两个反应方程式叠加,写出一个总的反应方程式。 ①___________________________________________________ ②___________________________________________________ ③___________________________________________________
27、物质A —H 有下图所示转化关系(部分反应物、生成物没有列出)。其中,B
的浓溶液与单质X 在加热时才能发生反应①,B 的稀溶液与足量X 发生反应②,向C 溶液中滴入KSCN 溶液呈红色。
试填写下列空白:(1)晶体A 是(化学式)________________________。 (2)反应②的离子方程式:______________________。
(3)根据图示信息判断,足量B 的浓溶液与单质X 共热时能否产生E ,说明理由(写出化学方程式回答):____________________。
(4)在反应⑤中,若生成物G 与H 的物质的量之比为4∶1,写出F 溶液与Na 2O 2反应的化学方程式:_______________________。
28、X 、Y 、Z 、W 4种元素都位于短周期, 且原子序数X (1) 的电子式__________ ___, (2)X 、Y 、Z 、W 组成的盐, 其原子数比为4:1:1:2, 其名称是________, 结构简式是__________。 29、A 、B 、C 是三种短周期元素的单质,甲、乙是两种常见的化合物。这些单质和化合物之间存在如右图所示的关系:据此判断: (1) 若单质A 是_____ ___,则单质B 、C 分别为________、________。 (2) 若单质A 是________,则单质B 、C 分别为________、________。 (3) 若单质A 是________,则单质B 、C 分别为________、________。 30、(1)化学科学家常用"等电子体"来预测不同物质的结构,例如CH 4与NH 4+ 有相同的电子及空间构形。依此原理将下表中空格填出相应的化学式 (2)工业上生产尾气中的H 2S 要经过处理成硫单质后方能排放,以防止大气污染,富玛克斯法治理硫化氢的方法和步骤如下: ①用2%~3%的Na 2CO 3溶液做吸收剂生成2种酸式盐; ②再加入一种RNO(R 表示芳香族有机物的基)与①生成的一种酸式盐的水溶液反应生成硫、碱和R-NHOH ; ③第②步生成的碱在溶液中与另一种酸式盐反应生成正盐; ④R-NHOH 与空气中的氧发生反应又得到RNO 。 (3)写出上述4步反应的化学方程式: ①___________________________ ②___________________________ ③___________________________ ④___________________________ 31、某厂废液中含有大量+ Ag 、+3Fe 、+ 3Al ,用下列图示方法进行分离(部分反 应条件省略): (1)写出下列物质的化学式: 试剂x__________、试剂z__________。晶体E________、固体G_________ (2)写出下列反应的离子方程式: 沉淀A+试剂y :__________________滤液D+过量2CO :________________ 32、已知某些金属氧化物跟熔融烧碱反应可生成盐。根据下图所示化学反应回答下列问题。 (1)单质F 的化学式为___________________________。 (2)写出下列反应的离子方程式 C+L —→F+E H+L (过量)—→I (3)C+L —→E+F ,若L 改用浓酸,则不能选用的浓酸是_________________。 33、下列图式中A ——N 代表的各物质均为中学化学中常见物质,它们在一定条件下有如下转化关系: 试写出有关反应的化学方程式(有机物写结构简式) (1)由D 制取H :____ __。 (2)Ⅰ与石灰水:_____ __。 ()△ :。3A (4)E 与J :_______。 34、(1)有原子序数依次增大的A 、B 、C 、D 、E5种短周期元素,它们可两两组合成甲、乙、丙、丁4种化合物。各种化合物中原子个数比关系如下表: 其中A 、B 两种原子的核电荷数之差等于它们的原子最外层电子数之和;B 原子最外层电子数比其次外层电子数多2个;在周期表中,C 是E 的邻族元素,C 的化学性质活泼;D 和E 则位于同一周期,且D 和E 的原子序数之和为30。已知乙的相对分子质量小于甲。请回答:①写出甲、乙、丙、丁的化学式: 甲:__ _乙:____ __丙:_ ____丁:_____ __。 ②丙的水溶液与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关的 离子方程式是_________。 (2)已知X和Y均为短周期元素,单质X在空气中点燃,能发出耀眼的白光。 在一定条件下,单质X和单质Y反应,生成化合物Z,Z与水作用可生成气体G 和白色沉淀P(如框图所示),已知气体G与氢气之密度比约 为8.5。 ①组成单质X和Y的元素分别属第____族和第____族。 ②化合物Z的化学式为____________。 ③每生成1mol的气体G,同时应得到___mol的沉淀P。 35、A,B,C,D四种化合物,它们的化学式都符合RX2型。组成这四种化合物的元素的原子序数都不超过20。构成这四种化合物的化学键为:A,B只有共价键,A熔点很低,B却熔点很高。C只有离子键,D既有离子键又有共价键。 A和C都难与各种氢卤酸反应;B、C都难深于水,D却与水剧烈反应。 A能在空气里烯烧,B、C、D则不能。 B可与某种氢卤酸反应,所产生的气体不能燃烧; D可与各种氢卤酸反应,所产生的气体极易燃烧。根据上述进行判断: (1). 写出四种化合物的分子式: A______________; B_____________; C_____________; D_____________。 (2). 写出有关化学反应方程式: a. A在空气中燃烧: _____________________________________________, b. B与氢卤酸反应: _____________________________________________, c. C与水反应: _________________________________________________。 36、某小型化工厂生产皓矾,结晶前的酸性饱和溶液中含有少量的Cu2+、Fe3+、Fe2+等杂质离子。为了除去杂质,获得纯净的皓矾晶体,该工厂设计如下工艺流程: 结晶 加②加③分离加过量①合并 过滤 加④ 过滤 已知:开始生成氢氧化物沉淀到沉淀完全的pH值范围分别为: Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0 试回答下列有关问题: (1)加入的试剂①应是;主要的离子方程式有:。(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用,其理由是。 (3)加入试剂③的目的是。 37、甲、乙是两种常见短周期元素的单质,其有关化合物性质如图,其中C为白色 沉淀,D为气体。 (1)若D为酸性气体,则A的化学式为____________. (2)若D为碱性气体,则A+H2O→C+D化学方程式:_______ _______. (3)若由两种元素组成的化合物M发生水解反应只生成两种酸N和P,则下列有关说法中,正确的是_______. A.M可能由两种非金属元素组成 B.N、P均一定为一元酸 C.M一定含有金属元素 D.此反应可能为氧化还原反应 E.生成物中无氧酸、含氧酸并存 38、化合物A、B在研钵里混和研磨后加水发生反应,其产物在一定条件下还能发生如下图所示的一系列变化。(F为无刺激性气味的气体) 推断各物质名称。 酸性饱 和溶液 溶液A 沉淀A 溶液B 滤液D 沉淀D 滤液C 沉淀C 皓矾 39、从化合物A 出发,发生下图所示的一系列变化: 已知:A 是由三种短周期元素组成的固体化合物,C 为浅黄色固体,D 、H 为无色气体,E 为黑色固体,G 为浅绿色溶液,E 为棕黄色溶液,X 为液体,Y 为某金属,试回答:(1)写出有关物质的分子式:A 是__________E 是__________X 是__________ (2)写出有关反应的离子方程式:①______________________ ⑤______________________ ⑥______________________ 40、下图是中学化学中常见的物质间化学反应关系的图示,其中A 的焰色反应呈黄色,E 、F 为有刺激性气味的气体,G 为强酸性溶液,H 为既难溶于水、也难溶于稀酸的白色固体。 试回答: (1)写出化学式:A ——;B ——。写出下列反应的离子方程式: [1] C E →:—— H D →:—— [2] G O H F E 2→++:—— 41、江苏省东临大海,利用海水等可制得多种化工产品。下图是以海水、贝壳等为 原料制取几种化工产品的转化关系图,其中E 是一种化肥,N 是一种常见的金属单质。 试填写下列空白: ⑴N 的化学式为: ; ⑵写出反应①的化学方程式: ; ⑶由K 溶液经如何处理才能制得N ? 42、A 为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g ·mol - 1,甲元素的原子最外层电子数与K 层相等,乙元素的氢化物水溶液显碱性。C 为单质,其原子半径在周期表中最小。D 为气体,其密度为相同条件下空气密度的1.103倍。 K 为乙元素的单质。在适当的条件下, 它们之间有如下图所示的转化关系: 试填写下列空白: ⑴ 甲元素的单质在空气中燃烧可得到_____________(填化学式)。 K 分子的结构式为___________ ⑵ 完成下列有关反应的化学方程式 E + D G + B _________________ E + CuO: ___________________________ ⑶ E 与G 在一定条件下若能反应,写出化学方程式;若不能,则说明理由。 A C D B E F D 催化 △ CuO G B K Cu H +D _________________ 答案 1、(1)A :HCl B :Cl 2 C :H 2 D :CaCl 2和Ca(ClO)2 (2)2Cl 2十2Ca(OH)2===Ca(ClO)2十CaCl 2+2H 2O ,漂白粉Ca(ClO)2 Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 2、(1)Na 2O 2 (2) C 2H 2 (3) CO 2+OH -=HCO - 3 (4) Na 2CO 3 (5) 1:5 3、1)Al 2S 3、S (2)①AlO 2-+4H +═Al 3++2H 2O ②3AlO 2-+Al 3++6H 2O ═4Al(OH)3↓ 4、(1)S 接触室 (2)NO 2 ①动力设备材料 化学平衡 化学反应速率等 ②反应速率 化学平衡 催化剂活性等 (3) (4)CH 4 C+2H 2 2C+O 2(不足) 2CO 5、(1) 离子键、非极性键 (2)NaHSO 3 NaHSO 4 H ++HSO ====SO 2↑+ H 2O (3)负 2H 2 +4OH — —4e - ====4H 2O 正 O 2 +2H 2O +4e -====4OH - 6、(1)Fe —2e -====Fe 2+ O 2+2H 2O +4e -====4OH -(4分) (2)FeCl 3 +3H 2O Fe (OH )3(胶体)+3HCl (2分) (3)Fe 3O 4+8H +====Fe 2++Fe 3++4H 2O (2分) (4)3∶ 4(2分) 7、(1)2CaC (2)过滤 (3)O H CaCO OH Ca HCO Ca 2322322)()(+↓=+ 8、(1)A :HCl B :MgSO 4 C :AgNO 3 D :(NH 4)2CO 3 E :BaCl 2 F :NaOH (2)CO 32-+2H +=H 2O+CO 2↑ Ag ++Cl -=AgCl ↓ Mg 2++2OH - =Mg(OH)2↓ 9、(1)CO 32- (2)NO 3- 、Fe 3+ (3)Mg 2+、Al 3+、Fe 3+(也可不写Fe 3+) (4)Ba 2+ SO 42- (5)①Ba 2+、I - 、NH 4+ ②Mg 2+、Al 3+、Fe 3+、CO 32-、SO 42-、、NO 3- ③K +、Na +、Cl - 10、(1)NH 3,HNO 3; NH 4NO 3 N 2O+2H 2O (2)SO 3;AB ;H 2S 2O 7或H 2SO 4·SO 3或2SO 3·H 2O 11、 (3)①放热反应②放热反应③放热反应 (4)2Fe 3++S02十2H 2O =SO 42-十2Fe 2++4H - (5)0.2 mol 12、(1)氧气;Na 2SO 4;离子。 (2)A 、B 。 (3)400℃~500℃,催化剂。 (4)2Na 2O 2+2H 2O=4NaOH+O 2↑。 ①将q 导管口插入水面下,打开分液漏斗活塞,反应后,q 导管口有气泡冒出则证明反应放热。 ②打开分液漏斗活塞,使之反应,然后用带火星的木条置 于p 管口,木条复燃则证明有O 2生成。( 13、 H (1)① [H ??N ??H]+ ;三角锥形。 H ②OH ->NH 3>H 2O ;OH -+NH +4=NH 3↑+H 2O ,NH 3+H 3O += NH +4+ H 2O 。( (2)①碳。 ②2KOCN+4KOH+3Cl =2CO 2+N 2+6KCl+2H 2O 。 ③35.5。 14、(1)Al 2O 3、H 2 (2)①Al 3++3H 2O Al (OH )3+ 3H + ②3Fe+4H 2O ? ==== Fe 3O 4+4H 2 15、(1)S 、H 2S 、SO 2、SO 3、H 2SO 4 (2)N 2、NH 3、NO 、NO 2、HNO 3 (3)3Cu+8H ++2NO 3 3Cu 2++2NO ↑+4H 2O 16、(1)(NH 4)2SO 3(或NH 4HSO 3); (NH 4)2SO 4(或NH 4HSO 4); SO 2; NH 3; K 2SO 3; K 2SO 4 (2)SO 32—+Br 2+H 2O SO 42—+2Br — +2H + 17、(1)金刚石、石英、玻璃 (2)SiO 2+2NaOH Na 2SiO 2+H 2O Na 2CO 3+SiO 2 Na 2SiO 3+CO 2↑ CaCO 3+SiO 2 CaSiO 3+CO 2↑ 18、(1)共价键 NH 3 三角锥形 (2)3NO 2+H 2O=2HNO 3+NO (3) 21N 2(g )+2 3H 2(g ) NH 3(g );△H=-46.2kJ ·mol — 1 (4)8NH 3+Cl 2=N 2+6NH 4Cl 19(1)原于晶体 (2)2Cl 32SiO H (3)O H SiO OH SiO 22322+=+-- · × · · -高温 高温 --+↓=++3322223222HCO SiO H O H CO SiO (4)343428)(3NH N Si NH Si +高温 隔绝空气 20⑴第四周期、第Ⅷ族 ⑵8Al +3Fe 3O 44Al 2O 3+9Fe ⑶ 2Al +2OH -+2H 2O =2AlO 2-+3H 2↑ ⑷阳极:3O 22--6e -=3O 2↑;阴极:2Al 3++6e -=2Al (5)①② 21. ⑴A +、B +、C - 依次为NH 4+、H 3O +、OH - ;⑵ ;极性 ;三角锥 ⑶OH - >NH 3>H 2O 22. ⑴ X Cl 2 Y H 2O 2 ⑵ MnO 2 + 4H ++ 2Cl - Mn 2+ +Cl 2↑+2H 2O Al 2O 3 +6H +=2Al 3+ +3H 2O ⑶ 2H 2O 2 2 H 2O +O 2↑ 23、(1)O 2+2H 2O+4e - 4OH - (2)FeCl 3+3H 2O Fe(OH)3(胶体)+3HCl (3)1:104(2分)H 2(g)+2 1 O 2(g) H 2O(I);△H=-285.8kJ ·mol -1 24、(1)B NO 2 D NH 3 (2) 3Cu+8H ++2NO 3-= 3Cu 2++2NO ↑+4H 2O 25、(1)A .H 2,B .Cl 2,C .Fe ,D .S , (2)FeS+2H +=Fe 2++H 2S ↑ (3)2FeCl 3+H 2S=2FeCl 2+S ↓+2HCl 26、(1)①两个反应是连续进行的 ②两个反应一前一后 ③前者的生成物是后 者的反应物 (2)前一反应的两个反应物中,必有某个反应物过量 (3)①2CO 2+Ca(OH)2=Ca(HCO 3)2 ②2HCl+Na 2CO 3=2NaCl+H 2O+CO 2↑ ③4NaOH+AlCl 3=NaAlO 2+3NaCl+2H 2O 27、1)NaNO 3 (2)3Fe+2NO 3+8H +3Fe 2++2NO ↑+4H 2O (或:Fe+NO 3-+4H +Fe 3++NO ↑+2H 2O2Fe 3++Fe 3Fe 2+) (3)由反应④:NO+2HNO 3(浓) 3NO 2+H 2O 可知在浓HNO 3中不能 生成NO (4)4Fe (NO 3)2+4Na 2O 2+6H 2O 4Fe (OH )3↓+O 2↑+8NaNO 3 28、 , 乙二酸铵, 29、(1)O 2、S 、H 2(3分)(2)Cl 2、S 、H 2(3分)(3)Mg 、C 、O 2 30、(1) 31、(1)O H NH 23?6126O H C (葡萄糖或CHO CH 3等含醛基的有机物) O H FeSO 247?32O Al (2)O H AlO OH OH Al 2232)(+=+- - -- +↓=++33222)(2HCO OH Al O H CO AlO 32、(1)2H (2) 22H Fe 2H Fe ++++ ↑; O 2H A14H AlO 23- 2++++ (3) 浓42SO H 、浓3HNO 33、(1)NaCl+NH 3+CO 2+H 2O==NaHCO 3↓+NH 4Cl (2)Na 2CO 3+Ca(OH)2==CaCO 3↓+2NaOH 34、(1)①H 2O 2;C 2H 4;AlCl 3;CCl 4 ②↓↑ ′Al +3HCO ==Al OH +3CO 23+3-32() (2)①Ⅱ A Ⅴ A 1′②Mg 3N 2 1′③1.5 35、(1).〖解答〗 A :CS 2 B :SiO 2 C: CaF 2 D: CaC 2 (2).〖解答〗a. CS 2 + 3O 2 = CO 2 + 2SO 2 b. SiO 2 + 4HF = SiF 4↑+ 2H 2O c. CaC 2 + 2HCl = CaCl 2 + C 2H 2 ↑ 36、(1)Zn (1分);Zn + Cu 2+ = Cu + Zn 2+;Zn + 2Fe 3+ = 2Fe 2+ + Zn 2+ (2分) (2)H 2O 2(1分);当氧化剂,又不带入其他杂质(2分) (3)调节溶液的pH 值(1分) 37、(1)AL 2S 3;(2)Mg 3N 2+6H 2O =3Mg (OH )2+2NH 3;(3)A·E (此项只同水解有关)。 38、A-NH 4HCO 3 B-CaC 2 C-CaCO 3 D-C 2H 2 E-NH 3 F-CO 2 G-Ca(HCO 3)2 39、(1)A 是Na 2S 2O 3 E 是FeS X 是HCl (2)①S 2O 32-+2H +===S ↓+SO 2+H 2O ⑤2Fe 3++H 2S ===2Fe 2++S ↓+2H + ⑥SO 2+2Fe 3++2H 2O ====SO 42-+2Fe 2++4H + 40、(1) A 为Na 2SiO 3(2分)B 为BaC 2l 。 (2) [1]--+↑+↑+OH H cl O H cl 222222通电 [2]-++↓=++cl H BaSO O H cl SO B a 224223 [3] - -+++=++24222242SO cl H O H so cl 41、⑴Mg ; ⑵NaCl (饱和)+NH 3+CO 2+H 2O==NaHCO 3↓+NH 4Cl ; ⑶MgCl 2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl 2晶体,熔融后电解才能制取金属镁 42、⑴ MgO 、Mg 3N 2、C N ≡N ⑵ 4NH 3 + 5O 2 △ 4NO + 6H 2O 2NH 3 + 3CuO △ N 2 + 3Cu + 3H 2O ⑶ 4NH 3 + 6NO = 5N 2 + 6H 2O E E气体乙点燃 溶液B A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。 (1)写出下列物质的化学式:B ;D 的同素异形体 (2)写出A 的电子式 ;E 的结构式 (3)指出反应①、②、③是吸热反应,还是放热反应 ① ② ③ (4)完成下列反应方程式:反应⑤的离子方程式: 反应④的化学方程式: 12、甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、 丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系:(反应中生成的水已略去) ← (1)丙的名称是 ;C 的化学式是 ;X 属 晶体。 (2)A+D →C 的反应属于下列何种反应类型(填序号) 。 A .化合反应 B .氧化还原反应 C .非氧化还原反应 D .离子反。 A .化合反应 B .氧化还原反应 C .非氧化还原反应 D .离子反应 (3)工业生产中,将D 转化为E 的反应条件是 。 (4)写出A 与H 2O 反应的化学方程式: 。 (5)若用如图装置来证明A 和H 2O 的反应: ①是放热反应,②生成了丙。简单合理的实验 操作是:① ; ② 。 13、(1)A +、B +、C - 、D 、E 代表5种微粒(分子或离子), 它们分别含10个电子,已知它们有如下转化关系:A ++C -=D+E B ++C - =2D ①A +的电子式为 ;E 分子的空间构型为 。 ②C - 、D 、E3种微粒结合质子(H +)的能力由强到弱的顺序为(用微粒的化学式表示) ;其理由是(用两个离子方程式表示) , 。 14、已知A ~K 所代表的各物质都是中学化学里常见的物质,且I 是具有磁性的物质,D 和K 都具有两性。一定条件下,各物质间的相互反应转化关系如下图所示: 请回答: (1)写出有关物质化学式:D 是 ,H 是 。 (2)写出下列反应的方程式: ①化合物G 的溶液不呈中性,其原因用离子方程式表示为 , ②C+F ?→? H +I 。 15、如下图所示,A 、B 、C 、D 、E 五种物质的相互转化关系 请回答: (1)若A 通常状态下为固态单质,A →E 分别为(写化学式)A ;B ; C ; D ; E 。 (2)若A 通常状态下为气态单质,则A →E 分别为(写化学式)A ; B ; C ; D ; E 。 (3)写出(2)中物质间转化的离子方程式E →C 16、根据如下转化关系 回答下列问题: (1)物质的分子式:A 、B 、C 、D 、E 、F 。 (2)写E →F 的离子方程式 。 17、A 、B 、C 为三种不溶于水,透明、坚硬的固体。A 在氧气中完全燃烧只得到一 种无色、无臭、密度为氧气密度的1.375倍(标准状况)的气体。B 的粉末易溶于热的苛性钠溶液,向此溶液中加入过量盐酸时,析出一种不溶于水,酸性比碳酸还弱的酸。将B 与石灰石,纯碱按一定比例混合高温溶融后得C 。C 在高温下能软化,但无固定的熔点。根据以上事实回答: (1)A 、B 、C 的名称:A B C (2)写出有关化学反应的方程式: X 甲 乙 A D C B E 丙 + +丙 点燃 +丙 点燃 +丙 一定条件 +H 2O 无机推断题复习 一、无机推断题复习方法和策略。 推断题融元素化合物、基本概念和理论于一体,侧重考查学生思维能力和综合应用能力。在解无机推断题时,读题、审题相当重要,在读题审题过程中,要认真辩析题干中有关信息,抓住突破口,分析无机推断中的转化关系,仔细推敲,挖掘出隐含条件。 (一)基本思路 读题(了解大意)→审题(寻找明显条件、挖掘隐含条件与所求)→解题(抓突破口)→推断(紧扣特征与特殊)→得出结论→正向求证检验 读题:读题的主要任务是先了解题目大意,寻找关键词、句,获取表象信息。切勿看到一点熟悉的背景资料就匆匆答题,轻易下结论,这样很容易落入高考试题中所设的陷阱。 审题:对读题所获信息提炼、加工,寻找明显的或潜在的突破口,更要注意挖掘隐含信息-“题眼”。“题眼”常是一些特殊的结构、状态、颜色,特殊的反应、反应现象、反应条件和用途等等。审题最关键的就是找出”题眼”。 解题:找到“题眼”后,就是选择合适的解题方法。解无机推断题常用的方法有:顺推法、逆推法、综合推理法、假设法、计算法、实验法等。通常的思维模式是根据信息,大胆猜想,然后通过试探,验证猜想;试探受阻,重新阔整思路,作出新的假设,进行验证。一般来说,先考虑常见的规律性的知识,再考虑不常见的特殊性的知识,二者缺一不可。 验证:不论用哪种方法推出结论,都应把推出的物质代入验证。如果与题设完全吻合,则说明我们的结论是正确的。最后得到正确结论时还要注意按题目要求规范书写,如要求写名称就不要写化学式。 (二)相关知识储备 解答无机推断题需要一定的背景知识为基础。下面以“考纲”为核心,以教材出发,结合对近几年高考试题的分析和对未来的预测,对常考的热点知识作如下归纳: 一、氮及其化合物练习题(含详细答案解析) 1.已知A是一种金属,其焰色反应呈黄色,B溶液能使酚酞试液变红;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系: (1)A的名称是___;F的化学式是__。 (2)B→D反应的化学方程式为__。 (3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是__。 (4)已知,气体D也能与Cl2发生反应,试写出当Cl2足量时该反应的化学方程式,并用双线桥法标出电子转移的数目___。 【答案】钠HCl NaOH+NH4Cl NaCl+NH3↑+ H2O HCl吸收水蒸气生成盐酸小液滴 【解析】 【分析】 A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F 相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl。 【详解】 (1)根据上面的分析可知,A的名称为钠,F的化学式为HCl,故答案为:钠; HCl; (2) 根据上面的分析可知,B是NaOH,C是NH4Cl,在加热条件下,氯化铵和氢氧化钠反应生成氯化钠、氨气和水,反应方程式为:NaOH+NH4Cl NaCl+NH3↑+ H2O;答案:NaOH+NH4Cl NaCl+NH3↑+ H2O; (3)根据上面的分析可知,F是HCl,F在空气中遇水蒸气产生白雾现象,这白雾实际上是HCl吸收水蒸气生成盐酸小液滴;答案:HCl吸收水蒸气生成盐酸小液滴; (4)根据上面的分析可知,D是NH3,气体D也能与Cl2发生反应生成氮气和 HCl,其反应的方程式为:3Cl2 + 2NH3 = 6HCl + N2 ,用双线桥法标出电子转移的数目 ;答案:。 2.已知如图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。 无机化学推断题做题方法 解题方法:解无机推断题的关键是找突破口,这是解无机推断题的根本方法。根据突破口的类型不同,解题方法可分为如下几种: 1. 特征现象(1)火焰颜色苍白色:H2在Cl2中燃烧。蓝色:CO在空气中燃烧。淡蓝色:H2S、CH4、H2在空气中燃烧。焰色反应:Na元素解题方法: 解无机推断题的关键是找突破口,这是解无机推断题的根本方法。根据“突破口”的类型不同,解题方法可分为如下几种: 1. 特征现象 (1)火焰颜色 苍白色:H2在Cl2中燃烧。 蓝色:CO在空气中燃烧。 淡蓝色:H2S、CH4、H2在空气中燃烧。 焰色反应:Na元素(黄色)、K元素(紫色)。【口诀:紫钾黄钠。紫钾可记为“指甲”】(2)有色溶液 含有的离子Fe2 Fe3 Cu2 MnO4 - 颜色浅绿 色 黄色蓝色紫红色 (3)有色固体 黑色:CuO FeO Fe Fe3O4Mn 红色:Cu、Cu2O、Fe2O3 红褐色:Fe(OH)3 白色:CaCO3、BaSO4、AgCl、BaSO3 (4)有色气体: 黄绿色:Cl2 红棕色:NO2 、Br2 (5)沉淀颜色:氯化银(白色)、溴化银(浅黄色)、碘化银(黄色)【颜色逐渐加深】氢氧化铜(蓝色絮状)磷酸银(黄色) ②铵盐: (2)与酸反应产生气体 ① ② (3)Na2S2O3(硫代硫酸钠)与酸反应既产生沉淀又产生气体:S2O32- 2H=S↓ SO2↑ H2O (4)与水反应产生气体 ①单质 ②化合物 (5)强烈双水解 (6)既能酸反应,又能与碱反应 ①单质:Al ②化合物:Al2O3、、弱酸弱碱盐、弱酸的酸式盐、氨基酸。 (7)与Na2O2反应 (8)2FeCl3+ H2S=2FeCl2+ S↓ +2HCl (9)电解 高三无机推断专题 1、A、B、C为3种单质(其中A为固体,B、C为气体),D的饱和溶液滴入沸水中继续煮沸,溶液呈红褐色,B、C反应的产物易溶于水得到无色溶液E。它们之间的转化关系如下图: 填写下列空白: (1)物质A是,B是,C是。 (2)F中加入NaOH溶液,并在空气中放置的化学方程式是, 。 2、A、B、C是3种短周期元素的单质,甲、乙是两种常见的化合物.这些单质和化合物之间存在如下图所示的关系:据此为判断: 若单质A是,则单质B、C分别为、。 若单质A是,则单质B、C分别为、. 若单质A是,则单质B、C分别为、。 3、 上图反应中,加入或生成的水及其它物质及分离操作均已略去.写出: (1)化学式:(a)(b)AK (2)化学方程式: C与D的反应:A生成J: G生成H:I+J K: 4、根据下图记录的实验现象,推断A、B各是什么物质。 (1)A是,B是(写化学式) (2)写出A、B等物质的量在水溶液中反应的离子方程式。 5、下图表示某些化工生产流程(有的反应条件和产物已略去) 试回答: (1)C的化学式是,L的名称是. (2)E→G的化学方程式是。 (3)G→H的反应中,氧化剂与还原剂的物质的量之比为。 (4)写出饱和食盐水+F+E→J+K(沉淀)的化学方程式. (5)写出由上述流程图中出现的元素组成的5种铵盐的化学式。 6。下图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的 物质均已略去),图中A 是单质,D 在常温下呈气态,F 可用作化肥,也可用来作炸药. (1)写出A 的电子式和F 的化学式 (2)写出下列变化的化学方程式: B →CE → C 7.在下列物质的转化关系中,A 是一种固体物质,E 是一种白色沉淀,据此填写下列空白: 8. 9. (1)B 的化学式是,B 在固态时属于晶体。 10.(2)B 和a 溶液反应的离子方程式是 11. (3)A 和a 溶液反应的化学方程式是 12.化合物X 、Y 、Z 是有短周期的三种元素两两结合而成。并且X 、N 、W 常温下均为液 态化合物,X 与N 组成元素相同,M 为固体。 则(1),WXZ(物质名称)。 (2),写出X 与W 反应的化学方程式. M+N X Y Z W Z 高中化学无机推断题解题技巧讲解 给出物质范围的表格型推断题。 解题关键:列表分析,对号入座;直观明快,谨防漏解。 总之,化学无机推断题解题技巧是:首先,读审仔细读题、审清题意。即弄清题意和要求,明确已知和未知条件,找出明显条件和隐蔽条件。其次,找突破口或“题眼”通过分析结构特征、性质特征、反应特征和现象特征及特征数据等等,确定某一物质或成分的存在,以此作解题突破口。第三,推理从突破口向外扩展,通过顺推法、逆推法、假设法得出初步结论,最后作全面检查,验证推论是否符合题意。 有机推断类试题 有机推断是一类综合性强,思维容量大的题型,其一般形式是推物质,写用语,判性质。当然,有的只要求推出有机物,有的则要求根据分子式推同分异构体,确定物质的结构;有的还要求写出有机化学方程式。由于有机化学中普遍存在同分异构现象,而有机物的分子式不能表示具体的物质,因此用语中特别强调写出有机物质的结构简式。 命题常以有机新材料、医药新产品、生活调料品为题材,以框图或语言描述为形式,主要考查有机物的性质与转化关系、同分异构、化学用语及推理能力。设计问题常涉及官能团名称或符号、结构简式、同分异构体判断、化学方程式书写、反应条件、反应类型、空间结构、 计算、检验及有关合成路线等。 【答题策略】 有机推断题所提供的条件有两类:一类是有机物的性质及相互关系(也可能有数据),这类题往往直接从官能团、前后有机物的结构差异、特殊反应条件、特殊转化关系、不饱和度等角度推断。 另一类则通过化学计算(也告诉一些物质性质)进行推断,一般是先求出相对分子质量,再求分子式,根据性质确定物质。至于出现情境信息时,一般采用模仿迁移的方法与所学知识融合在一起使用。推理思路可采用顺推、逆推、中间向两边推、多法结合推断。 元素或物质推断类试题 该类题主要以元素周期律、元素周期表知识或物质之间的转化关系为命题点,采用提供周期表、文字描述元素性质或框图转化的形式来展现题干,然后设计一系列书写化学用语、离子半径大小比较、金属性或非金属性强弱判断、溶液中离子浓度大小判断及相关简单计算等问题。此类推断题的完整形式是:推断元素或物质、写用语、判性质。 【答题策略】 元素推断题,一般可先在草稿纸上画出只含短周期元素的周期表,然后对照此表进行推断。 对有突破口的元素推断题,可利用题目暗示的突破口,联系其他条件,顺藤摸瓜,各个击破,推出结论; 对无明显突破口的元素推断题,可利用题示条件的限定,逐渐 无机化学推断题专题 无机化学推断题专题 高考化学推断题包括实验推断题、有机物推断题和无机物推断题,它对考生的思维能力和知识网络构造提出了较高的要求,即要求考生有较深厚的化学功底,知识网络清晰,对化学的所有知识点(如元素、化合物的性质)了如指掌。一、找到突破口进行联想:推断题首先要抓住突破口,表现物质特征处大都是突破口所在,所以考生在掌握化学知识概念点上,要注意总结它的特征。在推断题的题干中及推断示意图中,都明示或隐含着种种信息。每种物质都有其独特的化学性质,如物质属单质还是化合物,物质的颜色如何,是固体、液体还是气体,有怎样的反应条件,反应过程中有何现象,在生活中有何运用等,同时还要注意表述物质的限制词,如最大(小)、仅有的等。考生看到这些信息时,应积极联想教材中的相关知识,进行假设重演,一旦在某一环节出错,便可进行另一种设想。 二、在训练中找感觉:一般而言,推断题的思维方法可分三种:一是顺向思维,从已有条件一步步推出未知信息;第二种是逆向思维,从问题往条件上推,作假设;第三种则是从自己找到的突破口进行发散推导。解推断题时,考生还可同时找到几个突破口,从几条解题线索着手,配合推断。可以说化学推断题没有捷径可谈,它需要考生在训练中总结经验、寻找规律,发现不足后再回归课本,再进行训练,螺旋上升。如此而为,做推断题便会有“感觉”。 无机推断题既能考查元素及其化合物知识的综合应用,又能对信息的加工处理、分析推理、判断等方面的能力加以考查,因此此类题型应是考查元素及其化合物知识的最佳题型之一。 无机物的综合推断,可能是对溶液中的离子、气体的成分、固体的组成进行分析推断,可以是框图的形式,也可以是文字描述的形式(建议考生有时可以先在草稿纸上把文字描述转换成框图形式,这样可以一目了然)。不管以哪种方式出题,解题的一般思路都是:迅速浏览→产生印象→寻找突破口→注意联系→大胆假设→全面 2019年高考化学无机推断题解题技巧 无机推断题是集元素化合物知识、基本概念和基本理论于一体,且综合性强、考查知识面广、思维容量大、题型多变、能力要求高、推理严密,既能检查学生掌握元素化合物的知识量及熟练程度,又能考查学生的逻辑思维能力,在历年高考中频频出现,且体现出很好的区分度和选拔功能。无机推断题考查内容及命题主要呈现如下趋势: 1.限定范围推断:主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象(或必要的数据)进行分析,作出正确判断。解题关键:①审明题意,明确范围,注意题目所给的限定条件;②紧扣现象,正确判断;③要注意数据对推断结论的影响。 2.不定范围推断:常见元素化合物的推断。该题目的主要特点是:依据元素化合物之间相互转化时所产生的一系列实验现象,进行推理判断,确定有关的物质。题目往往综合性较强,具有一定的难度。从试题形式来看,有叙述型、图表型等。解题关键:见题后先迅速浏览一遍,由模糊的一遍“扫描”,自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象,然后从题中找出特殊现象或特殊性质的描述,作为解题的突破口,进而全面分析比较,作出正确判断。 3.给出微粒结构等的微粒(或元素)推断题。解题关键: ①熟记元素符号,直接导出;②掌握几种关系,列式导出;③利用排布规律,逐层导出;④弄清带电原因,分析导出;⑤抓住元素特征,综合导出;⑥根据量的关系,计算导出。 4.给出混合物可能组成的框图型(或叙述型)推断题。解题关键:解框图型(或叙述型)推断题一般是根据物质的转化关系,从其中一种来推知另一种(顺推或逆推),或找出现象明显、易于推断的一种物质,然后左右展开;有时需试探求解,最后验证。 5.给出物质间转化关系的代码型推断题。解题关键:此类推断题的特点是用代号表示各物质的转化关系,要求“破译”出各物质的分子式或名称等,看起来较复杂,其实在解题时,只要挖掘题眼,顺藤摸瓜,便可一举攻克。 6.给出物质范围的表格型推断题。解题关键:列表分析,对号入座;直观明快,谨防漏解。 1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理) 已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。 (1) A的化学式是;乙的化学式是。 (2) X是一种纯净物,X的化学式是;C中含有、。(填化学式) (3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由 。 2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示: (1) X的电子式是,G的化学式是。 (2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。 (3)反应“D+丙”的化学方程式是。 (4)写出X与D在稀硫酸中反应的离子方程式。 3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件 下的相互转化关系如下: 请填写以下空白: (1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物 是。 (2)在X、Z两种化合物的正价元素的化合价中,是。 A.前者高 B.后者高 C.不一定 原因是。 (3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。写出丙跟乙反应的化学方程式。 (4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。写出丙跟乙反应的化学方程式。 4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。它们之间的反应关系如下图所示: 请填写下列空白: (1)据此推断X、Y、Z的化学式:X 、Y 、Z 。 (2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。 (3)写出C+Y → A的离子方程式:。 5.根据以下反应关系图,回答下列问题: (1) A溶液所含溶质是:________________________; (2) A溶液跟B溶液反应的化学方程式是:_______________________________; (3) G转变为E的离子方程式是:__________________________________________。 6.甲、乙两种物质是常见的短周期元素的单质,其有关物质性质如图,其中C为白色沉淀,D为气体。 (1)若D为酸性气体,则A的化学式为。 (2)若D为碱性气体,则A的化学式为。 (3)若由两种元素组成的化合物M发生水解反应只生成两种酸N和P,则下列 有关说法中,正确的是。 A. M可能由两种非金属元素组成 B. N、P均一定为一元酸 C. M一定含有金属元素 D.此反应可能为氧化还原反应 E.生成物中的无氧酸和含氧酸并存 7、X、Y、Z、W为常见的4种单质。常温下,X是固体,Y是液体,Z是无色气 体,W为黄绿色气体。其反应关系如下,其中B的溶液显强酸性。 (1)根据反应推断X、Y、Z的化学式:__________、__________、 __________。 (2)指出X元素在元素周期表中的位置:__________。 (3)写出A溶于水后加入X的离子方程式:__________。 (4)写出C与过量W反应的离子方程式:__________。 8.A、B、C是所学过的三种单质,A、B、C及其它物质之间的反 应关系如下图所示。其中,B、D、E、F的水溶液呈酸性。 全国高考化学无机非金属材料的推断题综合高考真题汇总附详细答案 一、无机非金属材料练习题(含详细答案解析) 1.下列叙述正确的是 ①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生 ②浓硫酸可用于干燥氢气、碘化氢等气体,但不能干燥氨气、二氧化氮气体 ③Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱 ④玻璃、水泥、水晶项链都是硅酸盐制品 ⑤浓硫酸与铜反应既体现了其强氧化性又体现了其酸性 ⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得到相同的物质 A.①④⑤B.①⑤⑥C.②③④D.④⑤⑥ 【答案】B 【解析】 试题分析:①久置于空气中的氢氧化钠溶液和空气中的CO2反应生成变为碳酸钠,碳酸钠可以和盐酸反应生成氯化钠、水以及二氧化碳,①正确;②浓硫酸具有吸水性和强氧化性,浓硫酸可用于干燥中性、酸性且不具有还原性的气体,不能干燥还原性的碘化氢气体,不能干燥碱性气体如氨气等,②错误;③红热的铁与水蒸气反应生成四氧化三铁和氢气,没有碱生成,③错误;④玻璃、水泥主要成分是硅酸盐,都是硅酸盐制品,水晶的主要成分是二氧化硅,不属于硅酸盐制品,④错误;⑤浓硫酸具有酸性、吸水性、脱水性和强氧化性,浓硫酸与铜反应既体现了其强氧化性又体现了其酸性,⑤正确;⑥氯化铁属于强酸弱碱盐,溶液中铁离子水解生成氢氧化铁和HCl,加热促进水解,氯化铁胶体加热会聚沉,两者均产生红褐色沉淀氢氧化铁,灼烧后产物都是三氧化二铁,⑥正确.答案选B。 考点:考查常见物质的性质与用途。 2.对于足球烯C60的认识错误的是() A.是分子晶体B.含有非极性共价键 C.存在同素异形体D.结构稳定,难以发生化学反应 【答案】D 【解析】 【分析】 【详解】 A.C60之间的相互作用力是范德华力,属于分子晶体,A正确; B.足球烯中既有双键又有单键,化学键是共价键,且是非极性共价键,B正确; C.金刚石、石墨、足球烯都是碳的同素异形体,所以足球烯存在同素异形体,C正确;D.足球烯是属分子晶体,在常温下,碳碳之间键能大,也比较稳定,但其易发生加成反应,D错误; 答案选D。 3.下列各项操作中不发生先沉淀后溶解现象的是() 目录 第16章............................................................................................ - 2 -第22章............................................................................................ - 2 -第23章............................................................................................ - 2 - 第16章 1.有一种无色气体A,能使热的CuO还原,并逸出一种相当稳定得到气体B, 将A通过加热的金属钠能生成一种固体C,并逸出一种可燃性气体D。A能与Cl2分步反应。最后得到一种易爆的液体E。指出A、B、C、D和E各为何物?并写出各过程的反应方程式。 第22章 1.有一黑色固体化合物A,它不溶于水、稀醋酸和氢氧化钠,却易溶于热盐酸 中,生成一中绿色溶液B。如溶液B与铜丝一起煮沸,逐渐变棕黑色得到溶液C。溶液C若用大量水稀释,生成白色沉淀D。D可溶于氨溶液中,生成无色溶液E。E若暴露于空气中,则迅速变成蓝色溶液F。在溶液F中加入KCN时,蓝色消失,生成溶液G。往溶液G中加入锌粉,则生成红棕色沉淀H。H不溶于稀的酸和碱,可溶于热硝酸生成蓝色溶液I。往溶液I中慢慢加入NaOH溶液生成蓝色胶状沉淀J。将J过滤、取出。然后强热,又生成原来化合物A。试判断上述个字母所代表的物质,并写出相应的各化学反应方程式。 第23章 1.铬的某化合物A是橙红色溶于水的固体,将A用浓HCl处理产生黄绿色刺 激性气体B和生成暗绿色溶液C。在C中加入KOH溶液,先生成灰蓝色沉淀D,继续加入过量的KOH溶液则沉淀消失,变成绿色的溶液E。在E中加入H2O2加热则生成黄色溶液F,F用稀酸酸化,又变为原来的化合物A 的溶液。问A,B,C,D,E,F各是什么物质,写出每步变化的反应方程式。 2.有一锰的化合物,它是不溶于水且很稳定的黑色粉末状物质A,该物质与浓 硫酸反应得到淡红色溶液B,且有无色气体C放出。向B溶液中加入强碱得到白色沉淀D。此沉淀易被空气氧化成棕色E。若将A与KOH、KClO3一起混合熔融可得一绿色物质F,将F溶于水并通入CO2,则溶液变成紫色G,且又析出A。试问A,B,C,D,E,F,G各为何物,并写出相应的方程式。 3.金属M溶于稀HCl生成MCl2,其磁矩为5.0B.M.。在无氧条件下,MCl2与 NaOH作用产生白色沉淀A,A接触空气逐渐变成红棕色沉淀B,灼烧时,B变成红棕色粉末C。C经不完全还原,生成黑色的磁性物质D。B溶于稀HCl生成溶液E。E能使KI溶液氧化出I2,若出加入KI前加入NaF,则不会析出I2。若向B的浓NaOH悬浮液中通入氯气,可得紫红色溶液F,加入BaCl2时就析出红棕色固体G。G是一种很强的氧化剂。试确认M及由A到G所代表的化合物,写出反应方程式,画出各物质之间相互转化的相关图。 新高考化学27题——无机推断题 例1:浙江2015年9月份化学选考卷27题 某固体粉末中可能含有SiO2、Na2O、Ca0、Cu0、Fe2 03,某同学设计并完成如下实验: 请回答: (1)步骤②中生成蓝色沉淀的离子方程式为。 (2)步骤⑤中生成的白色沉淀是(填化学式)。 (3)根据实验现象,固体粉末中一定存在的组分是(填化学式)。 例2:浙江2015年10月份化学选考卷27题 某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。 请回答: (1)沉淀a中含有的单质是。 (2)沉淀c的化学式是。 (3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是。 例3:浙江2016年4月份化学选考卷27题 下图中,固体A是铁锈的主要成分。 请回答: (1) 白色沉淀E的化学式________。 (2) 写出A---B的化学方程式____ ____。 (3) 写出C---D在溶液中发生氧化还原反应的离子方程式____ ____。 例4:浙江2016年10月份化学选考卷27题 为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如下实验: 请回答: (1) X的组成元素为H、O和_______(用元素符号表示),化学式为__________。 (2) 写出经一步反应能得到X的化学方程式(要求非氧化还原反应)_________________。 练习1、(2017温州高二十校期末联考) 有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验: 请回答: (1)X的化学式_____________,挖出后在空气中容易发黄的原因___________________________。 (2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:_____________________________,_________________________。 练习2、(2017湖州高三期末) 为探究无机盐X(仅含三种元素,摩尔质量为238g·mol-1,原子个数比为1:1:4)的组成和性质,设计并完成了如下实验:将11.9gX与水共热,生成一种气体单质和某强酸的酸式盐溶液A。A的焰色 高中化学专题练习——推断题 1.下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X 是固 体,B 和G 是液体其余均为气体。根据图中关系推断: (1)化学式X A B (2)写出C →E 的化学反应方程式 (3)实验室收集气体D 和F 的方法依次是 法和 法。 2分)有X 、Y 、Z 三种单质,X 是金属,常温下Y 是液体,Z 是气体,反应关系为: (1)据此推断X 、Y 、Z 的化学式为:X_________,Y_________,Z__________。 (2)C+Y →A 的离子方程式:___________________________________________ (3)X 元素的核电荷数小于36,它是不是主族元素,简述理由。 ___________________________________________________________________________ ________________________________ 3.(6分)下图中每一个方框内的字母代表一种物质,常温常压下,A 、B 、C 、D 、均为单质,且B 为金属,其它三个为双原子分子的气体,它们在一定条件下,发生图中所示的化 合反应,得到化合物E 、 F 、 G 、 H 、 I 和 J ,这些化合物在常温常压下的状态及颜色已在图中注明, 有关反应的化学计 量数为: (1)A 与B 按物质的量之比n(A)∶n(B)=1∶2完全反应生成G (2)B 与C 按物质的量之比n(B)∶n(C)=3∶1完全反应生 X OH - H + A B C B Na 2O 2 D E F G Fe 微热 B E 无色气体J 棕色气体 I 无色气 体 H G白色固体F固体E无色气体 A B C D 全国高考化学氮及其化合物的推断题综合高考模拟和真题汇总 一、氮及其化合物练习题(含详细答案解析) 1.氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。 (1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是 _________,还原剂是________________________________________。 (2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为 ___________________________________。 (3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下: NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O 现有V L某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。 ①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。 ②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m =_________。 ③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)= _________。 【答案】6NO2+8NH37N2+12H2O NO2 NH3 2NO+2CO N2+2CO2 (m+n)/V 3∶2 (n-m)/(3m+n) 【解析】 【分析】 (1)氨气和二氧化氮在一定条件下反应生成氮气和水,反应中元素化合价降低的做氧化剂,元素化合价升高的物质做还原剂; (3)①根据气体和氢氧化钠的关系式计算; ②根据二氧化氮、一氧化氮和氢氧化钠反应的方程式中各个物理量之间的关系式计算; ③同一溶液中,c(NO3-):c(NO2-)等于其物质的量之比。 【详解】 (1)氨气和二氧化氮在一定条件下反应生成氮气和水,反应的化学方程式为:6NO2+ 8NH37N2+12H2O,反应中二氧化氮中氮元素化合价降低的做氧化剂,氨气中氮元素化合价升高的物质做还原剂, 故答案为:6NO2+8NH37N2+12H2O;NO2; NH3; (2)CO和NO发生反应生成对大气无污染的气体,所以生成物是氮气和二氧化碳,故化学方程式是:2NO+2CO N2+2CO2 故答案为:2NO+2CO N2+2CO2 (3)①根据方程式NO2+NO+2NaOH===2NaNO2+H2O 2NO2+2NaOH===NaNO2+NaNO3+H2O 知,只要NO不剩余,氮原子和氢氧化钠的关系式是1:1,所以完全吸收nmolNO2和 高一化学无机推断综合练习题 一、填空题 1.化合物X 由三种元素组成,为探究其组成的性质,设计并完成如下实验: 提示:化合物E 的焰色反应为紫色(透过蓝色钴玻璃) 请回答: (1)X 的化学式是___。强碱Y 的电子式为___。 (2)在常温和干燥的条件下,化合物X 可以稳定的存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀和一种气体单质。 ①化合物X 与水反应的离子方程式为___。 ②人们针对化合物X 的稳定性进行了大量的研究,并取得了一定的进展。下列物质可以提高化合物X 在水溶液由稳定性的是___。 A. 4KHSO B .23K CO C .3CH COOK D .23K SO ③为研究温度对化合物X 水溶液稳定性的影响,请设计一个实验方案:___ (3)化合物X 有多种制备方法其中一种方法是强碱Y 条件下用次氯酸钾红褐色沉淀B ,其化学方程式为___。 2.物质A 、B 、C 、D 、E 、F 、G 、H 、I 、K 存在如图所示转化关系,其中气体D 、E 为单质,试回答 写出下列物质的化学式: A 是______,D 是______,K 是______; 写出 的离子方程式______ 写出反应F G ??→的离子方程式______;加热K 的化学方程式为______ 在溶液Ⅰ中滴入NaOH 溶液,可以观察到的现象是______ 实验室检验溶液B中阴离子的方法是______ 金属A混有少量金属H,除去H简单的操作是______ 3.中学化学中几种常见物质的转化关系如下: 将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题: (1)红褐色胶体E粒子直径大小的范围:。 (2)A、B、H的化学式:A,B,H。 (3)① H O分子的电子式:。 22 ②写出C的酸性溶液与双氧水反应的离子方程式:。(4)写出鉴定E中阳离子的实验方法和现象:。 4.现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: (1)写出下列物质的化学式: B ; F ; (2)已知A的一种氧化物可以做核潜艇的供氧剂,则其氧化物供氧时的化学方程式为 _______________________ (3)①、④离子方程式:;。 5.A---J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种 备战高考化学无机非金属材料推断题综合试题及答案解析 一、无机非金属材料练习题(含详细答案解析) 1.下列关于硅单质及其化合物的说法正确的是() ①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、陶瓷都是硅酸盐产品 ③高纯度的硅单质广泛用于制作光导纤维 ④普通玻璃是氧化物,成分可表示为SiO2 ⑤粗硅制备单晶硅不涉及氧化还原反应 ⑥硅酸铜钡( BaCuSiO x,铜为+2价),x等于6,可用氧化物形式表示为 BaO·CuO·2SiO2 A.①②⑥B.①②③C.①②③④D.②③④⑤ 【答案】A 【解析】 【分析】 【详解】 ①硅元素在自然界以化合态存在,主要是硅酸盐和二氧化硅,是构成一些岩石和矿物的基本元素,①正确; ②水泥、玻璃、陶瓷都是传统无机非金属材料,主要是硅酸盐产品,制备原料都要用到含硅元素的物质,②正确; ③光导纤维的成分是二氧化硅,高纯度的硅单质广泛用于制作硅能电池,③错误; ④玻璃是混合物不是氧化物,主要成分是硅酸钠、硅酸钙、石英的混合物,成分可用氧化物的形式表示为:Na2O?CaO?6SiO2,④错误; ⑤粗硅制备单晶硅的反应是:Si+2Cl2Δ SiCl4、SiCl4+2H2 Δ Si+4HCl,在这个过程中涉及到的 反应为氧化还原反应,⑤错误; ⑥硅酸盐改写成氧化物形式时,活泼的金属氧化物写在前面,再写SiO2,含有氢元素的H2O最后写,所以硅酸铜钡用氧化物形式表示:BaO?CuO?2SiO2,⑥正确。 ①②⑥正确,答案选A。 2.对于足球烯C60的认识错误的是() A.是分子晶体B.含有非极性共价键 C.存在同素异形体D.结构稳定,难以发生化学反应 【答案】D 【解析】 【分析】 【详解】 A.C60之间的相互作用力是范德华力,属于分子晶体,A正确; B.足球烯中既有双键又有单键,化学键是共价键,且是非极性共价键,B正确; C.金刚石、石墨、足球烯都是碳的同素异形体,所以足球烯存在同素异形体,C正确; 必修一无机化学推断题 1、由短周期元素组成的单质A 、B 、C 和甲、乙、丙、丁、戊五种化合物有下图所示转换 关系,工业上电解熔融的甲可制取金属A 。请回答: (1)写出下列物质的化学式:A 甲 。 (2)写出乙物质的溶液中通入过量CO 2的现象: ; (3)写出丁与过量氨水反应的离子方程式: 。 2、下图中A ~H 均为中学化学中常见的物质,它们之间有如下转化关系。其中A 为金属单质, B 为非金属单质,A 与水反应生成 C 和最轻的气体 D ,C 的焰色反应呈黄色。 请回答以下问题: (1)C 的电子式为_____________。 (2)F 的化学式为_____________。 (3)写出某种金属与C 反应生成D 的化 学方程式________________________。 (4)写出H 与G 的稀溶液反应生成F 的离子方程式________________________。 3、下图所示各物质是由短周期部分元素组成的单质或其化合物,图中部分反应条件及物质 未列出。已知:A 、C 、D 、F 均为单质,C 、E 、F 、G 常温下是气体,J 为白色沉淀,既能溶于B ,又能溶于E ;物质B 、G 可以使湿润的红色石蕊试纸变蓝,且B 的焰色反应呈黄色。反应④是化肥工业的重要反应。 请回答下列问题: (1)A 的元素在元素周期表中的位置是 ,物质B 的电子式为 。 (2)上述反应①~⑥中,属于化合反应的是 。 (3)反应⑤的离子方程式为 。 (4)在I 的水溶液滴加B 溶液至过量的过程中,所观察到的现象为 。 通过量CO 2 通过量NH 3 C 乙 NaOH 溶液 A +B 甲 NaOH 溶液 HCl 溶液 乙 丁 丙 戊 A B E C D F G H2O 高中化学无机推断题集锦 1、对从太空某星球外层空间取回的气体样品分析如下: (1)将样品溶于水,发现其主要成分气体A极易溶于水,水溶液呈酸性;(2)将A的 浓溶液与KMnO4反应产生一种黄绿色气体单质B,将B通入石灰乳可生成两种钙 盐的混合物D。(3)A的稀溶液与锌粒反应生成气体C,C与B的气体充分混合经 光照发生爆炸又生成气体A,实验测得反应前后气体体积不变。 据此回答下列问题:(1)写出A、B、C、D的化学式: A________;B________C_________D___________。 (2)气体B与Ca(OH)2的化学反应方程式____________________,混合物D俗名是 __________________,它的有效成分是____________________,其有效成分与空 气里的二氧化碳和水蒸气反应的方程式是____________________________。 2、列物质间有如下转化关系 浅黄色固体W E ③ ② 气体甲 E ① 气体乙 白色悬浊液C 固体A 溶液B 点燃 液B 溶 ④ 液体E 气体丙液D 溶 溶液B (1)W为__________ (2)固体A是一种重要的工业原料,1mol气体乙完全燃烧时生成1molE和2mol丙, 则乙的分子式为____________ (3)C溶液中的溶质和丙以物质的量之比1:2反应时,离子方程式为____ ______。 (4)利用图中有关物质实现C→B的转变,该物质是___________(填化学式) (5)若甲和乙恰好完全反应,则A和W的物质的量之比为__________ 3、有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系。已知: ○1A、B、C、D含同一种元素;○2A、B、C、D、E、F、G 都不是氧化物;③D、G是钠盐; ④A、E、F、G含同一种元素,且F为单质,E在常温下为气体。 回答下列问题: (1)写出A、F的化学式:A_______F________ (2)写出下列反应的离子方程式: ○1D→C_______________________________ ○2C+D→B_____________________________ 4、A、B、C、D、E几种常见的化合物或单质之间 有如下转化关系: (1)若E是酸酐,D是有刺激性气味的无色气体,则B的化学式是,工业 上实现D转化为E的化工设备的名称是。 (2)若C是酸性气体,B是碱性气体,则E是。工业生产实际中。合成 B选择一定的下列条件的依据是: ①压强②温度 (3)若A是日常生活中最常见的物质,C为黄绿色单质气体,则E的电子式为。 (4)若A是某有机物,其分子空间构型为正四面体,写出下列反应的化学方程式: A→B+C;B→D。 5、A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D 分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中 质子数之和的2倍;四种元素形成的单质中有两种是气体;两种是固体。 回答:(1)写出由B、C二元素所形成的原子个数比为1∶1的化合物的电子式 __________,其晶体中存在的化学键有____________________(填化学键名称)。 (2)写出两种均由A、B、C、D四种元素组成的化合物的化学式__________、 __________。这两种化合物的水溶液发生反应的离子方程式为________________。 (3)用A元素的单质与B元素的单质可制成新 型的化学电源,已在宇宙飞船中使用。其构造 如下图所示。两个电极均由多孔性碳制成,通 入的气体由孔隙中逸出,并在电极表面放电。 则a是____极,电极反应式为_________,b是 _____极,电极反应式为_______________。 6、甲、乙、丙、丁四种单质在点燃条件下反应 生成X、Y、Z、W四种化合物,转化关系如图所 示,又知: ①甲、乙、丙均为前三周期元素的单质,常温下均为 气态;丁是日常生活中的一种常见金属。 ②常温下,X是无色液体,Y是黑色固体。 ③丙在乙中燃烧发出苍白色火焰,丁在乙中燃烧生成 棕黄色的烟,W的水溶液呈黄色。 请填空: (1)丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应方程式: 负极:____________________________ 正极:____________________________。 (2)将少量W的浓溶液滴入热的X中,反应的化学方程式为:_________________。 (3)将Y看成碱性氧化物,Y与Z的溶液发生反应的离子方程式是:__________。 (4)若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物 质的量之比为_____________。 7、从固体物质A开始,可以发生如下图所示的一系列变化:高中化学无机推断 集锦
高三专题复习_无机化学推断题方法与常见的物质归纳(1)
全国高考化学氮及其化合物的推断题综合高考模拟和真题汇总附答案解析
无机化学推断题做题方法
【精品】高考化学无机推断题目题目眼归纳
高中化学无机推断题解题技巧讲解
无机化学推断题专题
高考化学无机推断题解题技巧
高中化学无机推断框图题精选(附答案)
全国高考化学无机非金属材料的推断题综合高考真题汇总附详细答案
无机化学第四版(北师大)课后推断题附答案
2017年浙江新高考化学无机推断题试题练习
高中化学无机推断提高题
全国高考化学氮及其化合物的推断题综合高考模拟和真题汇总
高一化学无机推断综合练习题(附答案)
备战高考化学 无机非金属材料推断题综合试题及答案解析
必修一无机化学推断题
高中化学无机推断 集锦
