【化学】 化学计算题测试题及答案(word)

【化学】化学计算题测试题及答案(word)
一、中考化学计算题
1.将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间
0 10 20 30 40 5060(s)
溶液温度
20.5 20.6 20.7 20.8 20.920.8 20.7(℃)
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)
【答案】20.936.5%
【解析】
【分析】
根据图表可知当反应时间为40秒时,溶液的温度最高,所以当40秒时,反应恰好完全反应。当pH为7的时候,恰好完全反应,根据氢氧化钠的质量可以求出盐酸的质量分数。【详解】
(1)因为中和反应是放热反应,所以温度最高时恰好完全反应,所以恰好完全反应时的温度从表上可知为20.9℃
(2)设参加反应的盐酸的质量为x
x=3.65g
36.5%
所以参加反应的盐酸的质量是36.5%。
2.小明称取用侯氏制碱法制得的纯碱样品(杂质仅为氯化钠)12.4g,加入到100g溶质质量分数为7.3%的稀盐酸中,恰好完全反应。求所得溶液的溶质质量分数为__________。
【答案】12.5% 【解析】 【详解】
由题意得:100g 溶质质量分数为7.3%的稀盐酸中氯化钠的质量为100g ×7.3%=7.3g 。 设参加反应的Na 2CO 3质量为x ,生成的NaCl 的质量为y ,生成二氧化碳的质量为z 。
2322Na CO +2HCl =2NaCl +CO +H O 106
73
11744x 7.3g
y
z
1067311744
===x 7.3g y z
↑
解之得x=10.6g ,y=11.7g ,z=4.4g 。 纯碱样品中NaCl 的质量=12.4g-10.6=1.8g 反应后溶液中NaCl 的质量为=11.7g+1.8g=13.5g 。
反应后溶液中NaCl 的质量分数=12.4100 4.413.5g g g g
+-×100%=12.5%
故答案为:所得溶液中溶质的质量分数为12.5%。
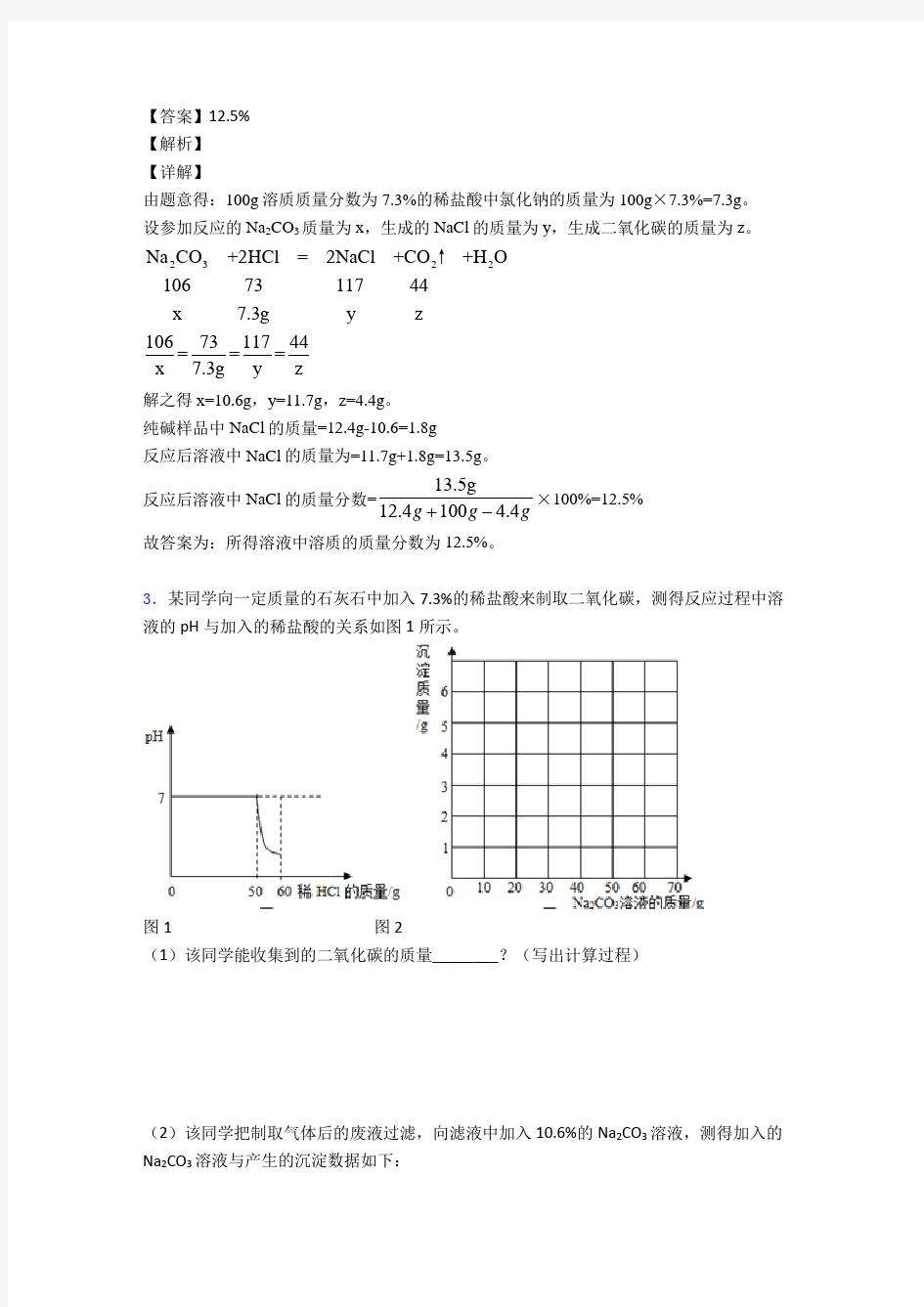
3.某同学向一定质量的石灰石中加入7.3%的稀盐酸来制取二氧化碳,测得反应过程中溶液的pH 与加入的稀盐酸的关系如图1所示。
图1 图2
(1)该同学能收集到的二氧化碳的质量________?(写出计算过程)
(2)该同学把制取气体后的废液过滤,向滤液中加入10.6%的Na 2CO 3溶液,测得加入的Na 2CO 3溶液与产生的沉淀数据如下:
Na2CO3溶液质量/g10203040506070
沉淀质量/g01n345m
则m=__________。
加入10gNa2CO3溶液后发生反应的化学方程式是
____________________________________。
请在图2中画出向废液中加入Na2CO3溶液时加入的Na2CO3溶液与产生的沉淀的曲线。
________
【答案】2.2g;5;Na2CO3+CaCl2=CaCO3↓+2NaCl
【解析】
试题分析:(1)设生成的二氧化碳的质量为x
与碳酸钙反应的HCl的质量= 50g×7.3%=3.65g
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
3.65g x
=x=2.2g
考点:化学方程式计算。
4.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在 20℃时,称取5g 样品,加入27g 水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去 10%的稀盐酸 36.5g。(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:
(1)样品中氢氧化钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
(3)已知 20℃时,氯化钠的溶解度为 36 g,试通过简单计算确定反应后所得溶液是否为20℃时该溶质的饱和溶液。
【答案】80% 10% 不是
【解析】
恰好完全反应时,消耗氯化氢的质量为:10%×36.5 g3.65g。设样品中氢氧化钠的质量为x,反应后所得溶液中溶质的质量为y
NaOH + HCl = NaCl+ H2O
40 36.5 58.5
x 3.65g y
40/x=36.5/3.65g x=4g
58.5/y=36.5/3.65g y=5.85g
反应后所得溶液中溶质的质量分数=4g÷5g×100%=80%。
反应后所得溶液中溶质的质量分数
5.8554
100%10%
52736.5
g g g
g g g
+-
?=
++
饱和溶液溶质的质量分数=溶解度÷(溶解度+100g)×100% , 20℃时,20℃时,氯化钠的溶解度为36g,其饱和溶液溶质的质量分数=36g÷(36g +100g)×100%≈26.5%>10%;
点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
5.绿矾(FeSO4·nH2O)是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。绿矾不稳定,加热时会失去结晶水生成硫酸亚铁,硫酸亚铁在空气中易被氧化。某化学兴趣小组为测定绿矾中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。称重B 装置,记为 n1 g。(已知碱石灰是氧化钙和氢氧化钠的混合物)
实验步骤如下:
Ⅰ.打开K1和K2,缓缓通入N2一段时间后连接好装置,关闭K1;Ⅱ.点燃酒精灯,加热一段时间;Ⅲ.熄灭酒精灯;Ⅳ.………称量A的质量为m3g,称量B的质量为n2g.
回答下列问题:
(1)步骤Ⅳ中“………”的具体操作是________________。
(2)装置B中发生反应的化学方程式为_______________________________。
(3)根据实验记录,如只选择装置A的数据计算绿矾中结晶水的百分含量为
________________(列式表示)。
(4)如选择实验前后B装置数据计算,则装置C的作用是
__________________________ 。若两组数据的计算结果都偏小,则可能的共同原因是
________________________________。
【答案】打开K1继续通N2至冷却到室温 H2O+CaO=Ca(OH)2
1
23
2
m-m
m-m×100% 防止空气中的二氧化碳和水分进入装置B中影响实验结果加热时间过短,结晶水未完全失去
【解析】
【详解】
(1)为了防止硫酸亚铁被氧化,故需要继续通入氮气至温度降低至室温。
(2)装置A中分解所得的水与装置B中的氧化钙反应生成氢氧化钙,反应的方程式为:H2O+CaO=Ca(OH)2
(3)由题意可知绿矾中结晶水的质量为:m2-m3;原来药品的质量为m2-m1,故质量分数
为:
1
23
2
m-m
m-m×100%
(4)B装置是通过测量吸收水的质量进行计算,故C装置的作用是防止空气中的二氧化碳和水分进入装置B中影响实验结果。当结晶水没有完全失去,测得的结果偏小。
6.某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。
求:(1)生成CO2的质量。
(2)该纯碱样品中Na2CO3的质量分数。
(3)根据条件,此题还可求算出下列中的(只填字母标号,不计算,可多选)。A.该纯碱样品中NaCl的质量分数;
B.反应所用稀盐酸的溶质质量分数;
C.反应后所得溶液中NaCl的质量分数;
D.反应生成水的质量。
【答案】(9分)
【解】(1)生成二氧化碳的质量为172.5g-163.7 g =" 8.8" g ┄┄┄┄┄┄(1分)(2)设:样品中碳酸钠的质量为x
Na2CO3+ 2HCl ="=" 2NaCl + CO2↑ + H2O ┄┄┄┄┄┄┄┄┄┄┄(2分)
106 44
x 8.8g ┄┄┄┄┄┄┄┄┄┄┄┄┄┄(1分)
┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄(1分)
x== 21.2 g ┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄(1分)
则该纯碱样品中碳酸钠的质量分数为
×100%="80" % ┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄┄(1分)
(3)ABCD ┄┄┄┄┄┄┄┄┄┄(2分,选四个得2分,选一至三个得1分)
答:(1)生成二氧化碳的质量8.8 g。
(2)该纯碱样品中Na2CO3质量分数为80%。
(3)ABCD
【解析】
(1)根据质量守恒定律,生成二氧化碳的质量为172.5g﹣163.7g=8.8g
(2)设:样品中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 44
x 8.8g
x==21.2g
则该纯碱样品中碳酸钠的质量分数为×100%=80%
答:(1)生成二氧化碳的质量8.8g;(2)该纯碱样品中Na2CO3质量分数为80%.
(3)A、利用样品质量与碳酸钠质量差即可求得样品中氯化钠的质量,氯化钠质量与样品质量比可计算样品中氯化钠的质量分数;故A正确;
B、根据反应的化学方程式,由二氧化碳质量可计算稀盐酸中HCl中质量;所加入稀盐酸溶液的质量172.5g﹣26.5g=146g,可以计算出反应所用稀盐酸的溶质质量分数;故B正确;
C、虽然可通过计算确定反应后所得氯化钠溶液中氯化钠的质量,题目说的是烧杯内物质的质量,所得溶液的质量就为163.7g,且其中没有不溶解于水的杂质存在.所以可以计算所得溶液的溶质的质量分数;故C正确;
D、根据反应的化学方程式,由生成二氧化碳的质量可计算出生成水的质量;故D正确;【点评】在对变化的曲线进行分析时,曲线的折点意味着恰好完全反应,此时总质量与反应前总质量的差即为反应放出气体的质量.
7.为测定某未知浓度的氢氧化钡溶液的溶质质量分数,取某稀硫酸溶液20 g,逐滴加入氢氧化钡溶液30 g,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示)。过滤后得滤液47.67 g。请你通过计算,求出氢氧化钡溶液的溶质质量分数。可能用到的相对原子质量:H—1 O—16 S—32 Ba—137
【答案】解:设参加反应的Ba(OH)2的质量为x
生成的BaSO 4质量为:20 g +30 g -47.67 g =2.33 g……………………(1分) Ba(OH)2+ H 2SO 4= BaSO 4↓+2H 2O …………………………………(1分) 171 233 x 2.33 g
=
…………………………………………………………(2分)
x =1.71 g ………………………………………………………………(1分)
Ba(OH)2的溶质质量分数=1.71 g÷25 g×100%=6.84% ………………(1分) 答:该溶液中Ba(OH)2的溶质质量分数为6.84%。 【解析】
本题考查的是根据化学反应方程式的计算,有关溶质质量分数的简单计算。解答本题关键是抓住反应前后溶液减轻的质量就是生成的沉淀硫酸钡的质量,然后结合图象得出加入的氢氧化钡质量为25g 时,稀硫酸和氢氧化钡恰好完全反应,只要分析清楚这两点即可较快解答该题。
先根据质量守恒定律求出生成沉淀硫酸钡的质量,再根据化学方程式求出氢氧化钡的质量,然后根据溶质质量分数=
100%溶质质量
溶液质量
求解。
根据质量守恒定律,生成BaSO 4质量为20g+30g-47.67g=2.33g 设参加反应的Ba (OH )2的质量为X Ba(OH)2+ H 2SO 4= BaSO 4↓+2H 2O 171 233 x 2.33 g
=
x =1.71 g
当加入的氢氧化钡质量为25g 时,溶液的PH=7,酸碱恰好中和。说明,此时稀硫酸和氢氧化钡恰好完全反应,故Ba(OH)2的溶质质量分数=1.71 g÷25 g×100%=6.84% 答:该溶液中Ba(OH)2的溶质质量分数为6.84%。
8.已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g 草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t 1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC 2O 4)固体;温度t 2℃时,草酸亚铁完全分解,发生反应:3FeC 2O 4
Fe 3O 4+4CO↑+2CO 2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC 2O 4的质量. (2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).
【答案】 (1)43.2g;(2)10.8g;(3)31.1%
【解析】
试题分析:(1)设,草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量为x,
3FeC2O4Fe3O4+4CO↑+2CO2↑
432 232
x 23.2g
x=43.2g
(2)该草酸亚铁晶体中结晶水的质量:54.0g﹣43.2g=10.8g;
(3)四氧化三铁中铁元素的质量:23.2g×=16.8g
该草酸亚铁晶体中铁元素的质量分数:=31.1%;
答:(1)草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量是43.2g;
(2)该草酸亚铁晶体中结晶水的质量是10.8g;
(3)该草酸亚铁晶体中铁元素的质量分数是31.1%.
考点:根据化学反应方程式的计算;化合物中某元素的质量计算
9.某同学将一定质量的锌粒放入200g稀硫酸溶液中,恰好完全反应,并产生了0.4g氢气。
计算:(1)参加反应的锌的质量。
(2)所用稀硫酸溶液中溶质的质量分数。
【答案】(1)13g(2)9.8%
【解析】
(1)设参与反应的锌的质量为x,200g稀硫酸溶液中硫酸的质量为y,
Zn+H2SO4=ZnSO4+H2↑
65 98 2
x y 0.4g
∴
x=13g
y=19.6g
(2)所用稀硫酸溶液中溶质的质量分数为:×100%=9.8%
答:(1)参加反应的锌的质量为13g.
(2)所用稀硫酸溶液中溶质的质量分数为9.8%
10.将6.5g石灰石样品投入到36.5g稀盐酸溶液中制取二氧化碳气体,恰好完全反应。反应后将溶液过滤、干燥,称量剩余固体残渣的质量为1.5g(提示:①石灰石样品中的杂质不溶于水,也不发生反应;②反应后生成的氯化钙完全溶解)。计算:
(1)该石灰石样品中碳酸钙的质量是多少?
(2)反应后所得溶液的溶质质量分数为多少?(计算结果保留一位小数)
【答案】解:(1)碳酸钙的质量:6.5g-1.5g=5g………………………………(1分)
(2)设反应后生成的氯化钙质量为x,生成的二氧化碳质量为y:
CaCO3+2HCl=CaCl2+CO2↑+H2O…………………(1分)
100 111 44
5g x y
=x=5.55g
=y=2.2g………………………………(1分)
反应后所得溶液质量为:5g+36.5g-2.2g=39.3g
反应后所得溶液的溶质质量分数为:×100%=14.1%………………(1分)
答:该石灰石样品中碳酸钙的质量为5克,反应后所得的溶液的溶质质量分数为
14.1%。………………………………………(设问和答共1分)
其它合理解答均可得分。
【解析】
分析:(1)由样品和剩余固体的质量即可求得该石灰石样品中碳酸钙的质量;
(2)由反应的碳酸钙的质量,根据反应方程式即可求得生成氯化钙和二氧化碳的质量;再
根据质量守恒定律即可求得反应后溶液的质量;最后根据溶质质量分数=溶质质量
溶液质量
×100%
即可求得反应后所得溶液的溶质质量分数.
解:(1)碳酸钙的质量:6.5g-1.5g=5g;
(2)设反应后生成的氯化钙质量为x,生成的二氧化碳质量为y:CaCO3+2HCl=CaCl2+CO2↑+H2O
100 111 44
5g x y
=x=5.55g
=y=2.2g
反应后所得溶液质量为:5g+36.5g-2.2g=39.3g;
反应后所得溶液的溶质质量分数为:×100%=14.1%;
答:该石灰石样品中碳酸钙的质量为5克,反应后所得的溶液的溶质质量分数为14.1%.点评:求反应后所得溶液的质量的计算是初中化学计算的一个重点内容,其方法一般是:所加入的所有物质的质量总和-生成气体的质量-生成沉淀的质量.
