2017GSP管理制度药品电子监管的管理规定
药品电子监管的管理规定
一、目的:为加强药品电子监管,特制定本制度。
二、依据:《国务院关于加强食品等产品安全监督管理的特别规定》,《关于实施药品电子监管工作有关问题的通知》(国食药监办[2008]165号),关于印发《药品电子监管工作实施方案》的通知(食药监办[2008]72号)。等法律法规。
三、范围:本制度适用于药品购进、销售的管理。
四、责任:验收员负责购进数据采集传送。保管员负责销售数据采集传送。
五、内容进入药品电子监管网《入网药品目录》的基本药物、中药注射液、血液制品除执行公司有关规定外还应执行以下规定:
1、公司应有质量管理人员和仓库管理人员(不少于2人)参加电子监管培训,参加培训人员应熟悉药品入出库业务流程并具备计算机基础知识
2、公司应配备信息系统维护人员1名,应具有良好的计算机和信息系统操作技能
3、应按要求配备监管码采集设备。
4、根据公司经营范围,办理药品电子监管网入网手续并对所经营的进入药品电子监管网《入网药品目录》的中药注射液、血液制品的购进、销售通过药品电子监管网进行数据采集和报送,实时监控。
5、购进:国家规定2008年10月31日以后购进必须审核药品电子监管码统一标识,无电子监管码统一标识的不得购进。
6、验收:
6.1、应检查产品外标签上加印(加贴)统一标识的药品电子监管码;药品包装应进行各级包装的赋码,凡进行单独流通的包装(含单独流通的过渡包装)都应赋码,并符合规定要求,否则视为不合格品,应拒收或按公司不合格药品处理规定执行
6.2、条码印刷空白区域尺寸:条码两侧空白区≥10倍最小模块宽度(即:10X),其中X≥0.17mm,上下空白区宽度≥1mm。
6.3、条码印刷颜色:条码中竖条颜色为黑色,空条颜色可为白色、黄色、橙色或红色。
6.4、条码外观检测:印刷无脱墨、污点、断线;条的边缘清晰,无发毛、虚晕或弯曲
现象。空白区宽度不小于本“条码印刷技术规范”规定的宽度。
6.5、条码技术参数:符合国标:GB/T 18347-2001;条码类型:Code 128C;数据类型:数字;条码密度:≥7mils;数据长度:20位;条码高度:≥8mm。
6.6、对未按规定加印或者加贴中国药品电子监管码,或者监管码的印刷不符合规定要求的应当拒收。
6.7、条码数据采集要有专人操作,做到采集准确及时,数据要及时备份,不得丢失。
6.8、手持终端有专人保管使用,不得丢失,发现故障及时排除或更换。
6.9、违反上述规定要追究有关人员责任,造成损失的负赔偿责任。
6.10、监管码信息与药品包装信息不符的,应当及时向供货单位查询,未得到确认之前不得入库,必要时向当地药品监督管理部门报告。
6.11、对实施电子监管的药品,应当按规定进行药品电子监管码扫码,并在验收后24小时内将数据上传至中国药品电子监管网系统平台。
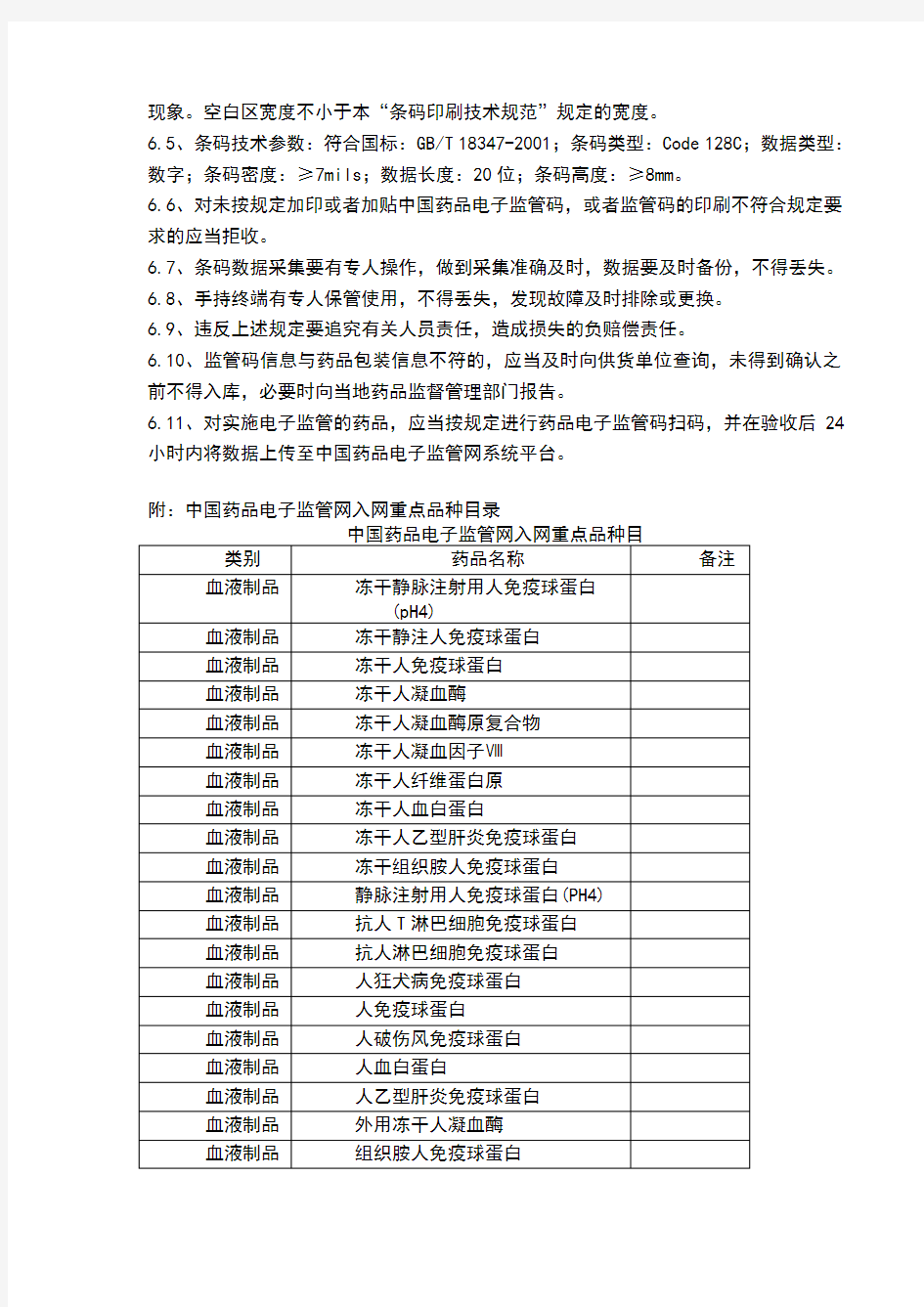
附:中国药品电子监管网入网重点品种目录
