《结构力学习题集》(含问题详解)

第三章 静定结构的位移计算
一、判断题:
1、虚位移原理等价于变形谐调条件,可用于求体系的位移。
2、按虚力原理所建立的虚功方程等价于几何方程。
3、在非荷载因素(支座移动、温度变化、材料收缩等)作用下,静定结构不产生力,但会有位移且位移只与杆件相对刚度有关。
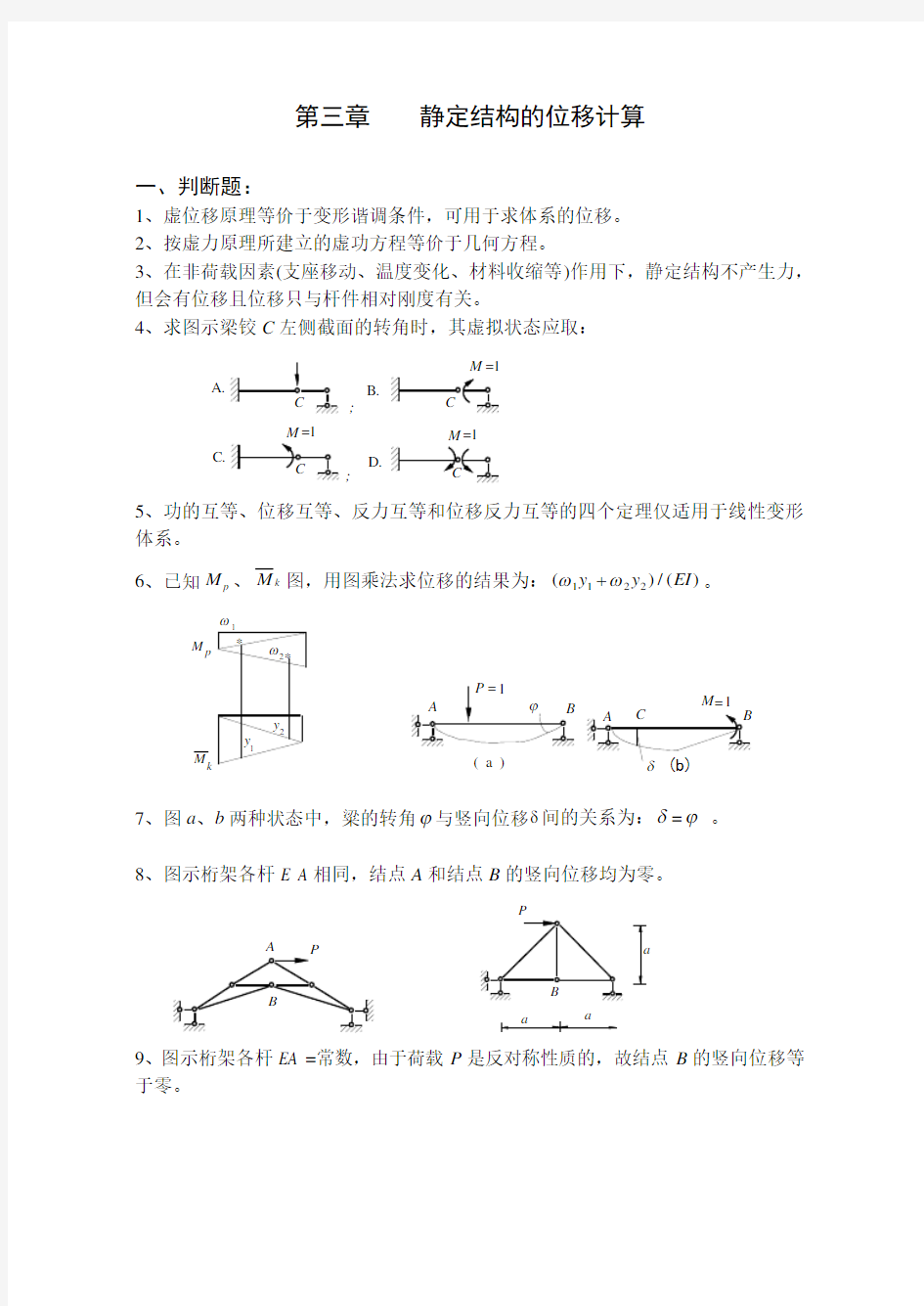
4、求图示梁铰C 左侧截面的转角时,其虚拟状态应取:
A.;
; B.
D.
C.M =1
=1
5、功的互等、位移互等、反力互等和位移反力互等的四个定理仅适用于线性变形体系。
6、已知M p 、M k 图,用图乘法求位移的结果为:()/()ωω1122y y EI +。
M k M p 21
y 1y 2**
ωω
( a )
M 1
7、图a 、b 两种状态中,粱的转角?与竖向位移δ间的关系为:δ=? 。
8、图示桁架各杆E A 相同,结点A 和结点B 的竖向位移均为零。
a a
9、图示桁架各杆EA =常数,由于荷载P 是反对称性质的,故结点B 的竖向位移等于零。
二、计算题:
10、求图示结构铰A 两侧截面的相对转角?A ,EI = 常数。
q l l l /2
11、求图示静定梁D 端的竖向位移 ?DV 。 EI = 常数 ,a = 2m 。
a a a 10kN/m
12、求图示结构E 点的竖向位移。 EI = 常数 。
l l l /3 2 /3/3q
13、图示结构,EI=常数 ,M =?90kN m , P = 30kN 。求D 点的竖向位移。
P 3m 3m 3m
14、求图示刚架B 端的竖向位移。
q
15、求图示刚架结点C 的转角和水平位移,EI = 常数 。
16、求图示刚架中D点的竖向位移。EI =常数。
l l
l/2
17、求图示刚架横梁中D点的竖向位移。EI=常数。
18、求图示刚架中D点的竖向位移。
E I = 常数。
q
l
l l/
22
19、求图示结构A、B两截面的相对转角,EI=常数。
l/3
l/3
20、求图示结构A、B两点的相对水平位移,E I = 常数。
l
l
21、求图示结构B点的竖向位移,EI = 常数。
l l
22、图示结构充满水后,求A、B两点的相对水平位移。E I = 常数,垂直纸面取1 m 宽,水比重近似值取10 kN / m3。
23、求图示刚架C点的水平位移?CH,各杆EI = 常数。
4m
4m
3m
2kN/m
24、求图示刚架B的水平位移?BH,各杆EI = 常数。
3m4m 4m
q
7kN/m
25、求图示结构C截面转角。已知:q=10kN/m , P=10kN , EI = 常数。
P
26、求图示刚架中铰C两侧截面的相对转角。
27、求图示桁架中D 点的水平位移,各杆EA 相同 。
a
28、求图示桁架A 、B 两点间相对线位移 ?AB ,EA=常数。 a 一
a 一a 一
29、已知b a b a
u u u u ]2/)([sin d cos sin 2?=,求圆弧曲梁B 点的水平位移,EI =常数。 A B
R
30
、求图示结构D 点的竖向位移,杆AD 的截面抗弯刚度为EI ,杆BC 的截面抗拉(压)刚度为EA 。
a
3
31、求图示结构D点的竖向位移,杆ACD的截面抗弯刚度为EI,杆BC抗拉刚度为EA 。
32、求图示结构S杆的转角?S。( EI = 常数,EA EI a
=/2)。
a
a
a a
33、刚架支座移动与转动如图,求D点的竖向位移。
/400
34、刚架支座移动如图,c1= a / 2 0 0 ,c2= a /3 0 0 ,求D点的竖向位移。
c
2
a a
35、图示结构B支座沉陷?= 0.01m ,求C点的水平位移。
36、结构的支座A发生了转角θ和竖向位移?如图所示,计算D点的竖向位移。
直线与圆(专题训练
直线与圆 1.已知直线l :y =k (x +3)和圆C :x 2+(y -1)2=1,若直线l 与圆C 相切,则 k =( ) A .0 B. 3 C.3 3 或0 D.3或0 解析:选D 因为直线l 与圆C 相切,所以圆心C (0,1)到直线l 的距离d =|-1+3k | 1+k 2 =1,解得k =0或k =3,故选D. 2.圆:x 2+y 2-2x -2y +1=0上的点到直线x -y =2距离的最大值是( ) A .1+ 2 B .2 C .1+ 2 2 D .2+2 2 解析:选A 将圆的方程化为(x -1)2+(y -1)2=1,即圆心坐标为(1,1),半径为1,则圆心到直线x -y =2的距离d =|1-1-2| 2=2,故圆上的点到直线x -y =2距离的最大值为d +1=2+1. 3.直线l :y =kx +1与圆O :x 2+y 2=1相交于A ,B 两点,则“k =1”是“|AB |=2”的( ) A .充分不必要条件 B .必要不充分条件 C .充要条件 D .既不充分也不必要条件
解析:选A 依题意,注意到|AB|=2=|OA|2+|OB|2等价于圆心O到直线l 的距离等于 2 2 ,即有 1 k2+1 = 2 2 ,k=±1.因此,“k=1”是“|AB|=2”的充分 不必要条件. 4.若三条直线l1:4x+y=3,l2:mx+y=0,l3:x-my=2不能围成三角形,则实数m的取值最多有( ) A.2个 B.3个 C.4个 D.6个 5.当a为任意实数时,直线(a-1)x-y+a+1=0恒过定点C,则以C为圆心,5为半径的圆的方程为( ) A.x2+y2-2x+4y=0 B.x2+y2+2x+4y=0 C.x2+y2+2x-4y=0 D.x2+y2-2x-4y=0 解析:选C 由(a-1)x-y+a+1=0得(x+1)a-(x+y-1)=0,由x+1=0且x+y-1=0,解得x=-1,y=2,即该直线恒过点(-1,2),∴所求圆的方程为(x+1)2+(y-2)2=5,即x2+y2+2x-4y=0. 6.与直线x+y-2=0和曲线x2+y2-12x-12y+54=0都相切的半径最小的圆的标准方程是( ) A.(x+2)2+(y-2)2=2 B.(x-2)2+(y+2)2=2 C.(x+2)2+(y+2)2=2
山东省2020中考化学试题及答案
2018年攀枝花市高中阶段教育学校招生统一考试 可能用到的相对原子质量: H - 1 C - 12 N - 14 O - 16 Na - 23 Mg - 24 Al - 27 S - 32 Cl - 35.5 Ca - 40 Fe - 56 Cu - 64 Zn - 65 Ag - 108 第Ⅰ卷 <选择题,共75分) 一、选择题<每小题2.5分,共75分,每小题只有一个选项符合题意) 化学部分 1.下列变化属于物理变化的是 A.菜刀生锈 B.汽油挥发 C.烟花燃放 D.大M酿酒 2.下列物质放入水中,能形成溶液的是 A.石蜡 B.面粉 C.蔗糖 D.植物油 3.下列物质是自来水厂对水净化过程常用的消毒剂,其中属于氧化物的是A.氯气
(化学)化学化学计算题题20套(带答案)及解析
(化学)化学化学计算题题20套(带答案)及解析 一、中考化学计算题 1.取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。求: (1)混合物CaCO3中的质量为_______; (2)稀盐酸中的溶质质量分数为________; (3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%) 【答案】10g7.3%12.6% 【解析】 试题分析:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:二氧化碳的质量为4.4g 设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y。 CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 73 111 44 x z y 4.4g x=10g z=7.3g y=11.1g (1)混合物CaCO3中的质量为10g; (2)稀盐酸中的溶质质量分数为100%=7.3%; (3)恰好完全反应时,所得不饱和溶液中溶质的质量分数 =100%≈12.6%。 考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算 2.现有碳酸钠和氯化钠的固体混合物12.6g,其中含氧元素4.8g,将该混合物加入到一定质量的稀盐酸中,恰好完全反应,得到137g氯化钠溶液。计算: (l)原固体混合物中碳酸钠的质量分数(结果保留至0.1%)______; (2)所用稀盐酸中溶质的质量分数(结果保留至0.1%)______。 【答案】84.1% 5.7%
【解析】 【分析】 【详解】 (l)原固体混合物中碳酸钠的质量分数4.8g÷=10.6g;混合物中碳酸钠的质量 分数为10.6g÷12.6g×100%≈84.1%; (2)设盐酸中溶质的质量为x,生成二氧化碳质量为y 2322 Na CO+2HCl=2NaCl+H O+CO 1067344 10.6g x y 10673 44 == 10.6g x y x=7.3g y=4.4g 所用稀盐酸中溶质的质量分数7.3g÷(137g+4.4g-12.6g)×100%≈5.7% 3.某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图 (1)纯碱恰好完全反应时,生成CO2的质量为___g (2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同) ____________ (3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?____________【答案】4.4g11.7%16.3% 【解析】 【分析】 (2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。进一步可求出样品中含氯化钠的质量分数。 (3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。再加上样品中原有氯化钠的质量,即为所得溶液中的溶质的质量。再根据
中考专题训练直线和圆的位置关系
2014年中考专题训练直线和圆的位置关系 一、选择题(每题4分,共40分) 1.如图,P是⊙O外一点,PA是⊙O的切线,PO=26cm,PA=24cm,则⊙O的周长为() A.18πcm B.16πcm C.20πcm D.24πcm 2.如图,AB是⊙O的切线,B为切点,AO与⊙O交于点C,若∠BAO=40°,则∠OCB的度数为()A.40°B.50°C.65°D.75° 3.如图所示,⊙O是线段AB上的一点,∠CDB=20°,过点C作⊙O的切线交AB的延长线于点E,则∠E等于()A.50°B.40°C.60°D.70° 第1题第2题第3题 4.Rt△ABC中,∠C=90°,AC=3cm,BC=4cm,以C为圆心,r为半径作圆,若圆C与直线AB相切,则r 的值为()A.2cm B.2.4cm C.3cm D.4cm 5.如图,△ABC中,AB=6,AC=8,BC=10,D、E分别是AC、AB的中点,则以DE为直径的圆与BC的位置关系是()A.相交B.相切C.相离D.无法确定 第5题第6题第7题 6.如图,以等边三角形ABC的BC边为直径画半圆,分别交AB、AC于点E、D,DF是圆的切线,过点F作BC的垂线交BC于点G.若AF的长为2,则FG的长为() A.4B.C.6D. 7.如图,CD是⊙O的直径,弦AB⊥CD于点G,直线EF与⊙O相切于点D,则下列结论中不一定正确的是()8.如图,AB为⊙O的直径,C为⊙O外一点,过点C作的⊙O切线,切点为B,连结AC交⊙O于D,∠C=38°.点E在AB右侧的半圆上运动(不与A、B重合),则∠AED的大小是() 第8题第9题第10题 9.如图,AB是⊙0的弦,BC与⊙0相切于点B,连接OA、OB.若∠ABC=70°,则∠A等于()A.15°B.20°C.30°D.70° 10.如图,已知线段OA交⊙O于点B,且OB=AB,点P是⊙O上的一个动点,那么∠OAP的最大值是()A.90°B.60°C.45°D.30° 二、填空题(每题6分,共30分)11.如图,AB是半圆O的直径,点P在AB的延长线上,PC切半圆O于点C,连接AC.若∠CPA=20°,则∠A= °. 第11题第12题第13题 12.如图,PA是⊙O的切线,A为切点,B是⊙O上一点,BC⊥AP于点C,且OB=BP=6,则BC= .13.如图,AB是⊙O的直径,点D在⊙O上,∠BAD=35°,过点D作⊙O的切线交AB的延长线于点C,则∠C= ° 14.如图,在△ABC中,AB=2,AC=,以A为圆心,1为半径的圆与边BC相切,则∠BAC的度数是° 第14题第15题 15.如图,已知△ABC内接于⊙O,BC是⊙O的直径,MN与⊙O相切,切点为A,若∠MAB=30°,则∠B= ° 三、解答题(每题8分,共80分) 16.如图,⊙O经过菱形ABCD的三个顶点A、C、D,且与AB相切于点A (1)求证:BC为⊙O的切线; (2)求∠B的度数. 17.已知AB是⊙O的直径,直线BC与⊙O相切于点B,∠ABC的平分线BD交⊙O于点D,AD的延长线交BC于点C. (1)求∠BAC的度数; (2)求证:AD=CD. 18.如图,已知AB是⊙O的直径,点C、D在⊙O上,点E在⊙O外,∠EAC=∠ B=60°. (1)求∠ADC的度数; (2)求证:AE是⊙O的切线.
2020山东省中考化学试题
绝密★启用前试卷类型:A 山东省xx年中等学校招生考试 化学试题 注意事项: 1.本试题分第1卷和第Π卷两部分。第I卷(选择题共16分);第ⅠⅠ卷(非选择题共 34分)。全卷共50分。考试时间为60分钟。 2.考生答第1卷前务必将自已的姓名、准考证号、考试科目涂写在答题卡上,考试结束,试卷和答题卡一并收回。 3.第I卷每题选出答案后,用2B铅笔把答题卡上对应题目的答案标号(ABCD))涂黑, 如需改动,必须用橡皮擦干净后,再选涂其它答案。 相对原子质量:H-l C一12 O~16 Na.~23 S-32 Fe-56 第1卷(选择题共16分) 一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意) 1.化学已经渗透到社会发展的各个方面,在①环境保护②能源开发利用③新材料研制④ 生命过程探索等领域中,与化学科学发展密切相关的是 A.只有①②③ B.只有②③④ C.只有①②① D.①②③④ 2.石油没有固定的沸点,炼油厂根据石油中各成分沸点的不同将其分离开来,得到汽油、煤 油、柴油等。由此推断石油属于 A.化合物 B.混合物 C.纯净物 D.单质 3.在化学实验中,我们经常需要取用一定量的药品。若需取用48g蒸馏水,下列最合适的仪 器是 A. 100mL的量筒 B.托盘天平 C.50mL的量筒 D.50mL的烧杯 4.对下列实验方法的理解,不正确的是 A.过滤与筛选的原理是类似的,都是把颗粒大小不同的物质分离开 B.蒸发就是使溶液中的溶剂分子在外界条件的影响下逸出液面 c.蒸馏就是使液体中的分子在外界条件的影响下逸出液面再重新凝结为液体 D.结晶就是把溶液中的溶质转化为难溶的沉淀析出 5.下列用微观图示表示的物质变化,属于化学变化的是
高中化学选修化学平衡习题及答案解析
第三节化学平衡练习题一、选择题 1.在一个密闭容器中进行反应:2SO 2(g)+O2(g) 2SO3(g) 已知反应过程中某一时刻,SO2、O2、SO3分别是L、L、L,当反应达到平衡时,可能存在的数据是() A.SO2为L,O2为L B.SO2为L C.SO2、SO3(g)均为L D.SO3(g)为L 2.在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡的标志是() A. C生成的速率与C分解的速率相等 B. A、B、C的浓度不再变化 C. 单位时间生成n molA,同时生成3n molB D. A、B、C的分子数之比为1:3:2 3.可逆反应H 2(g)+I2(g) 2HI(g)达到平衡时的标志是() A. 混合气体密度恒定不变 B. 混合气体的颜色不再改变 C. H2、I2、HI的浓度相等 D. I2在混合气体中体积分数不变 4.在一定温度下的定容密闭容器中,取一定量的A、B于反应容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)C(g)+D(g)已达平衡的是()A.混合气体的压强B.混合气体的密度 C.C、D的物质的量的比值D.气体的总物质的量 5.在一真空密闭容器中,通入一定量气体A.在一定条件下,发生如下反应:
2A(g) B(g) + x C(g),反应达平衡时,测得容器内压强增大为P %,若此时A 的转 化率为a %,下列关系正确的是( ) A .若x=1,则P >a B .若x=2,则P <a C .若x=3,则P=a D .若x=4,则P≥a 6.密闭容器中,用等物质的量A 和B 发生如下反应:A(g)+2B(g) 2C(g),反应 达到平衡时,若混合气体中A 和B 的物质的量之和与C 的物质的量相等,则这时A 的转化率为( ) A .40% B .50% C .60% D .70% 7.在1L 的密闭容器中通入2molNH 3,在一定温度下发生下列反应:2NH 3 N 2+3H 2, 达到平衡时,容器内N 2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N 2的百分含量也为a %的是( ) A .3molH 2+1molN 2 B .2molNH 3+1molN 2 C .2molN 2+3molH 2 D .++ 8.在密闭容器中发生反应2SO 2+O 2 2SO 3(g),起始时SO 2和O 2分别为20mol 和 10mol ,达到平衡时,SO 2的转化率为80%。若从SO 3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO 3的物质的量及SO 3的转化率分别为( ) A 10mol 10% B 20mol 20% C 20mol 40% D 30mol 80% 9.X 、Y 、Z 为三种气体,把a mol X 和b mol Y 充入一密闭容器中,发生反应X+2Y 2Z 。达到平衡时,若它们的物质的量满足:n (X )+n (Y )=n (Z ),则Y 的转 化率为( ) A . %1005 ?+b a B .%1005) (2?+b b a C .%1005)(2?+b a D .%1005) (?+a b a
高考数学专题直线和圆练习题
专题七:直线与圆 例1:不等式063<-+ay x )0(>a 表示的平面区域是在直线063=-+ay x ( ) 的点的集合。 (A )左上方 (B )右上方 (C )左下方 (D )右下方 [思路分析] 作出直线063=-+ay x ,又因为06003<-?+?a ,所以原点在区域内侧表示直线的左下方,故选取C 。 [简要评述] 用特殊值法解选择题是常用的方法。 例2:若直线k x y +=与曲线21y x -=恰有一个公共点,则k 的取值范围是 ( ) (A )2±=k (B )[)(]2,,2-∞-+∞ (C )() 2,2- (D )2-=k 或(-1,1] [思路分析] 数形结合的思想,k x y += 表示一组斜率为1的平行直线,21y x -= 表示y 轴的右半圆。如图可知,选(D ) [简要评述] 数形结合思想的灵活运用,此题 可以进一步拓展,21y x --=,21x y -±=等。 例3:如果实数x 、y 满足()322=+-y x ,那么x y 的最大值是 。 [思路分析] 解法一:设直线l :kx y =,则x y 表示直线l 的斜率,直线l 与圆 ()322=+-y x 距离为半径即可。 解法二:设圆的参数方程:?????=+=θ θsin 3cos 32y x 则 θ θcos 32sin 3+=x y 据三角知识求解。 解法三:设x y =t ,则???==+-tx y y x 3)2(22 只要解方程组,利用0=?可得解。
解法四:如图,联结圆心C 与切点M ,则由OM ⊥CM ,又Rt △OMC 中,OC=2,CM=3 所以,OM=1,得3==OM MC x y [简要评述] 小题小做,选方法四最为简单,数形结合的数学思想的灵活运用。 例4:已知两点)2,(m A ,)1,3(B ,求直线AB 的斜率与倾斜角。 [思路分析] 注意斜率存在的条件。当3=m 时,k 不存在。α= 2π,当3≠m 时, 31312tan -=--==m m k α;当3>m 时,3 1arctan -=m α,当3 此文档下载后即可编辑 有一份气体样品的质量是14.2 g,体积是4.48 L(标准状况下),该气体的摩尔质量是( ) A.28.4 B.28.4 g / mol C.71 D.71 g / mol D 解析:先据体积计算出n=0.2 mol,再据M=m/n ,计算出摩尔质量M=71 g / mol。 2、20 ℃时,KCl的溶解度为34 g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl溶液中KCl的物质的量浓度不可能是( ) A.2 mol /L B.3 mol /L C.4 mol /L D.5 mol /L D 解析:设溶液为0.1L,则该条件下溶液最浓时为饱和溶液:(34g/74.5g/mol) /0.1L=4.6 mol /L。 3、有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。则A的相对分子质量是( ) A.29 B.29 C.29 D.29 C 解析:依据mA / mB=MA / MB进行计算,即:相同条件下,两种气体的体积相同,则两种气体的物质的量相同,则其质量比等于相应的摩尔质量比。 4、300 mL某浓度的NaOH溶液中含有60 g溶质。现欲配制1 mol /L NaOH溶液,应取原溶液与蒸馏水的体积比约为( ) A.1∶4 B.1∶5 C.2∶1 D.2∶3 A 解析:原溶液浓度为5 mol /L,根据c1V1=c2V2,原溶液体积与稀溶液体积比为1∶5,则应取原溶液与蒸馏水的体积比约为1∶4。 5、下列溶液中的氯离子浓度与50 mL 1 mol /L的AlCl3溶液中氯离子浓度相等的是( ) A.150 mL 1 mol /L的NaCl B.75 mL 3 mol /L的NH4Cl C.150 mL 2 mol /L的KCl D.75 mL 2 mol /L的CaCl2 B解析:注意本题考查的是浓度,与体积无关。 6、某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( ) A.6.25 mol /L B.12.5 mol /L C.7 mol /L D.7.5 mol /L A 解析:根据m1w1=m2w2,,得原溶液质量为200 g。溶质质量为20 g,即0.5 mol,则浓缩后该溶液的物质的量浓度为0.5mol/0.08L=6.25 mol /L。 直线与圆的位置关系、切线》 培优训练 参考答案与试题解析 一.选择题(共12小题) 1. (2013杨浦区二模)00的半径为R,直线I与OO有公共点,如果圆心到直线I的距离为d ,那么d与R的大小关系是(B ) A d >R B d WR C d >R D d v R 考点:直线与圆的位置关系. 专题:探究型. 分析:直接根据直线与圆的位置关系进行解答即可. 解:???直线I与O0有公共点, 解答: ??直线与圆相切或相交,即d W R. 故选B. 点评: 本题考查的是直线与圆的位置关系,即判断直线和圆的位置关系:设O0的半径为r,圆心O 到直线I的 距离为d ,当d v r时,直线I和OO相交;当d=r时,直线I和00相切;当d > r 时,直线I和O0相离. 2. (2014?嘉定区一模)已知OO的半径长为2cm ,如果直线I上有一点P满足PO=2cm ,那么直线I与00的位 置关系是(D ) A相切B相交C相离或相切D相切或相交 第1页共19页 考点:直线与圆的位置关系? 分析: 情据讨线与相位置关系熠直线l和判断直线和?圖的位置分JOP垂直于直直线l和G OP相垂直直线r;(两直解答:解:当0P垂直于直线I时,即圆心0到直线I的距离d=2=r ,00与I相切; 当OP不垂直于直线I时,即圆心O到直线I的距离d v 2=r , 00与直线I相交. 故直线I与00的位置关系是相切或相交. 故选D. 点评:本题考查直线与圆的位置关系 .解决此类问题可通过比较圆心到直线距离d与圆半径大小关系完成判定. 3. (2013宝应县二模)在平面直角坐标系中,以点(3, - 5)为圆心,r为半径的圆上有且仅有两点到x轴所在直线的距离等于1,则圆的半径r的取值范围是(D) A r >4 B 0v r v 6 C 4 < r V D 4 v r v 6 绝密★启用前试卷类型:A 往年山东省中考化学试卷以及答案答案 化学试题 注意事项: 1.本试题分第1卷和第Π卷两部分。第I卷(选择题共16分);第ⅠⅠ卷(非选择题共 34分)。全卷共50分。考试时间为60分钟。 2.考生答第1卷前务必将自已的姓名、准考证号、考试科目涂写在答题卡上,考试结束,试卷和答题卡一并收回。 3.第I卷每题选出答案后,用2B铅笔把答题卡上对应题目的答案标号(ABCD))涂黑, 如需改动,必须用橡皮擦干净后,再选涂其它答案。 相对原子质量:H-l C一12 O~16 Na.~23 S-32 Fe-56 第1卷(选择题共16分) 一、选择题(本题包括8小题,每小题2分,共16分。每小题只有一个选项符合题意) 1.化学已经渗透到社会发展的各个方面,在①环境保护②能源开发利用③新材料研制④ 生命过程探索等领域中,与化学科学发展密切相关的是 A.只有①②③ B.只有②③④ C.只有①②① D.①②③④ 2.石油没有固定的沸点,炼油厂根据石油中各成分沸点的不同将其分离开来,得到汽油、煤 油、柴油等。由此推断石油属于 A.化合物 B.混合物 C.纯净物 D.单质 3.在化学实验中,我们经常需要取用一定量的药品。若需取用48g蒸馏水,下列最合适的仪 器是 A. 100mL的量筒 B.托盘天平 C.50mL的量筒 D.50mL的烧杯 4.对下列实验方法的理解,不正确的是 A.过滤与筛选的原理是类似的,都是把颗粒大小不同的物质分离开 B.蒸发就是使溶液中的溶剂分子在外界条件的影响下逸出液面 c.蒸馏就是使液体中的分子在外界条件的影响下逸出液面再重新凝结为液体 D.结晶就是把溶液中的溶质转化为难溶的沉淀析出 5.下列用微观图示表示的物质变化,属于化学变化的是 A.①② B.②③ C.①③ D.①②③ 6.化学上把“生成新物质的变化叫做化学变化”,下面对化学变化中“新物质”的解释,正 确的是 A.“新物质”就是自然界中不存在的物质 B.“新物质”就是与变化前的物质在颜色、状态等方面有所不同的物质 xxxXXXXX 学校XXXX 年学年度第二学期第二次月考 XXX 年级xx 班级 姓名:_______________班级:_______________考号:_______________ 一、计算题 (每空? 分,共? 分) 1、稀硝酸和铜反应的化学方程式:3Cu+8HNO 3(稀)=3Cu (NO 3)2+2NO ↑+4H 2O ,如果有3.2克铜和硝酸恰好完全反应,试计算: (1)在标准状况下产生气体的体积是多少? (2)将所得溶液加水配成200mL 溶液,则溶液的物质的量浓度是多少? 2、将一块质量为8.5g 的铁合金(成分为铁和碳)放入烧杯中,再向烧杯中加入91.9g 稀H 2SO 4,恰好与铁合金中的铁完全反应(碳不溶于稀H 2SO 4),所得氢气的质量为0.3g .已知含碳量高于2%的铁合金为生铁,含碳量低于2%的铁合金为钢,试根据计算回答: (1)该铁合金是生铁还是钢? (2)反应后所得溶液中溶质的质量分数是多少? 3、某100mL 硝酸和硫酸的混合液,其中硝酸的物质的量浓度为0.3mol/L ,硫酸的物质的量浓度为0.2mol/L ,向混合液中加入1.92g 铜粉,微热,待充分反应后,试求产生气体的体积以及Cu 2+ 的物质的量浓度。 4、有一种白色粉末是无水碳酸钠和碳酸氢钠的混合物,称取4.42g 灼烧至恒重,把放出的气体通入足量澄清石灰水中,生成2.00g 沉淀,灼烧后的残渣能与30mL 盐酸恰好完全反应.试求: (1)该白色粉末灼烧后产生气体在标准状况下的体积? (2)原混合物中各物质的质量. (3)所用盐酸的物质的量的浓度 5、浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L (标准状况下).已知:Cu+2H 2SO 4 (浓)CuSO 4+SO 2 ↑+2H 2O 试计算: (1)反应后生成硫酸铜的物质的量; 相对原子质量:H-1 C-12 O-16 Na-23 S-32 Ca-40 Zn-65 第I卷(选择题共20分) 一、选择题(本题包括20小题,每小题1分,共20分。每小题只有一个选项符合题意。) 1、“绿水青山就是金山银山”。你认为下列做法与这理念不相符的是 A.工业废水经处理达标后排放 B.使用一些新型可降解的塑料,减少”白色污染” C.自带水杯出行,不用一次性纸杯 D.将校园散落的塑料袋、树叶集中焚烧,保持整洁的环境 2、下列物质中。属于纯净物的是 A.空气 B.煤 C.蒸馏水 D.赤铁矿石 3、下列数据为常见水果的pH,其中酸性最强的是 4、下列物质由离子构成的是 A.二氧化碳 B.氯化钾 C.铜 D.氧气 5、实验室制取气体选择收集方法时,下列气体性质不需考虑的是 A.密度 B.可燃性 C.溶解性 D.能否与水反应 6、硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C高温Si +2CO↑, 该反应属于 A.化合反应 B.分解反应 C.置换反应 D.复分解反应 7、下列实验基本操作中,正确的是 8、下列化学肥料中属于复合肥料的是 A.硫酸钾[K2SO4] B.尿素[ CO(NH2)2] C.硝酸铵( NH4NO3] D.磷酸二氢钾[KH2PO4] 9、下列物品所使用的材料中,属于有机合成材料的是 10、制造C919大飞机采用的非金属材料氮化硅(Si3N4) ,其中氮元素的化合价是-3价,则硅 元素的化合价是 A. +1 B. +2 C. +3 D. +4 11、从安全的角度考虑,下列做法不合理的是 A.浓硫酸不慎沾到皮肤上,应立即用大量的水冲洗,再涂上氢氧化钠溶液 B.霉变的大米经洗净、高温蒸煮后也不能食用 C.误食重金属盐,可服用豆浆、牛奶等解毒,并及时就医 D.遇到火灾时,用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开现场 12、物质的性质决定其用途,下列关于物质的用途不正确的是 A.铜——做导线 B.小苏打——治疗胃酸过多 C.碳酸钡——用于钡餐透视 D.干冰——用于人工降雨 13、全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口 含汞产品,如电池、荧光灯、化妆品、温度计、血压计等。汞元素部分信息如图所示,下列说法不正确的是 A.汞为非金属元素 B.汞原子的核外电子数是80 C.汞原子的质子数为80 D.汞的相对原子质量为200.6 14、下列实验现象,描述错误的是 A.电解水时正极和负极产生气体的体积比为2:1 B.铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 C.将一氧化碳通入灼热的氧化铁,红色粉末逐渐变为黑色粉末 高一化学计算题常用解题技巧和方法 1、差量法 例题. 将质量为100克的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8克。求有多少克铁参加了反应。 解析: Fe + CuSO4= FeSO4+Cu 棒的质量增加 56 64 64-56=8 m (Fe) 100.8g-100g=0.8g 56∶8=m (Fe)∶0.8 答:有5.6克铁参加了反应。 归纳小结 差量法是根据物质变化前后某种量发生变化的化学方程式或关系式,找出所谓“理论差量”,这个差量可以是固态、液态物质的质量、物质的量之差。,也可以是气态物质的体积、物质的量之差等。。该法适用于解答混合物间的反应,且反应前后存在上述差量的反应体系。差量也是质量守恒定律的一种表现形式。仔细分析题意,选定相关化学量的差量。质量差均取正值。差量必须是同一物理量及其单位,同种物态。 差量法优点:不需计算反应前后没有实际参加反应的部分,因此可以化难为易、化繁为简。解题的关键是做到明察秋毫,抓住造成差量的实质,即根据题意确定“理论差值”,再根据题目提供的“实际差量”,列出正确的比例式,求出答案。差量法利用的数学原理:差量法的数学依据是合比定律,即 差量法适用范围 ⑴反应前后存在差量且此差量易求出。 只有在差量易求得时,使用差量法才显得快捷,否则,应考虑用其他方法来解。这是使用差量法的前提。 ⑵反应不完全或有残留物时,在这种情况下,差量反映了实际发生的反应,消除了未反应物质对计算的影响,使计算得以顺利进行。 经典习题 1.在稀H2SO4和CuSO4的混合液中,加入适量铁粉,使其正好完全反应。反应后得到固体物质的质量与所加铁粉的质量相等。则原混合液中H2SO4和CuSO4的质量比为( ) A.7:8 B.8:7 C.7:80 D.80:7 2016年专项练习题集-直线与圆相交的性质 选择题 1.直线x y 3+4+2=0与圆x y 22+=3的位置关系为( ) A .相离 B .相交但直线不过圆心 C .直线过圆心 D .相切 【分值】5 【答案】B 【易错点】计算错误。 【考查方向】本题主要考查了直线与圆的位关系的判断。 【解题思路】求出圆心到直线的距离,与半径进行比较。 【解析】圆心(0,0)到直线x y 3+4+2=0的距离 0+0+22=55,而20<<5,选B 。 2.若圆x y x y 22++2-4=0关于直线x y m 3++=0对称,则实数m 的值为( ). A .3- B .1- C .1 D .3 【分值】5 【答案】C 【易错点】忽略当圆关于直线对称时直线过圆的圆心这个条件。 【考查方向】本题主要考查了直线与圆相交的性质。 【解题思路】将圆心坐标代入直线方程,求出m 。 【解析】若圆x y x y 22++2-4=0关于直线x y m 3++=0对称,故圆心在直线x y m 3++=0上,又圆心坐标为(,)-12,故()m 3?-1+2+=0,解得1m =. 3.若点(,)A m n 在圆O :228x y +=上,则直线8mx ny +=与圆O 的位置关系是( ). A .相离 B .相切 C .相交 D .不确定 【分值】5 【答案】B 【易错点】本题容易将直线方程与圆的方程联立,并利用判别式求解,导致计算十分复杂而导致解题失败。 【考查方向】本题主要考查了点与圆的位置关系以及直线与圆相交的性质。 【解题思路】由点(,)A m n 在圆O :22 8x y +=上,得到关于,m n 的关系式,利用圆心到直线的距离公式求出O 到直线8mx ny +=的距离d ,利用d 与r 的关系大小关系判断直线与圆的位置关系。 【解析】点(,)A m n 在圆O :228x y +=上,故22 8m n +=,圆心(0,0)O 到直线 8mx ny +=的距离为 d r = ===,故直线4ax by +=与圆O 相切. 选B. 绝密★启用前试卷类型:A 临沂市初中学生学业考试试题 化学 注意事项: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共8页。满分100分,考试时间90分钟。答卷前,考生务必用毫米黑色签字笔将自己的姓名、准考证号、座号填写在试卷和答题卡规定的位置。考试结束后,将本试卷和答题卡一并交回。 2.答题注意事项见答题卡,答在本试卷上不得分。 第Ⅰ卷(共36分) 可能用到的相对原子质量:H-1 C-12 O-16 Cl- Cu— Zn—65 一、选择题(本题包括18小题,每小题2分,共36分。每小题只有一个正确答案) 1.下列变化中,只发生了物理变化的是 A.铁生锈 B.纸张燃烧 C.葡萄酿成酒 D.水结成冰 2.在空气中含量较多且化学性质不活泼的气体是 A.氧气B.二氧化碳 C.氮气D.水蒸气 3.下列实验现象的描述中,正确的是 A.木炭在氧气中燃烧,生成有刺激性气味的气体 B.硫在氧气中燃烧,发出淡蓝色火焰 C.红磷在空气中燃烧产生大量的白雾 D.铁丝在氧气中燃烧,火星四射,生成黑色固体 4.下列几种常见的物质中,不含有机物的是 A.牛奶B.柠檬汁 C.食醋D.矿泉水 5.下列图示实验操作中,正确的是 A B C D 6.分类是化学学习、研究的重要方法。下列物质中属于混合物的是 A .氯酸钾 B .石灰水 C .二氧化碳 D .氢氧化钠 7.关于物质的用途,下列说法错误的是 A .食品包装中充氮气以防腐 B .稀盐酸用来除铁锈 C .氢氧化钠固体干燥二氧化碳 D .用石墨制作电极材料 8.下列化学用语中,既能表示一种物质,还能表示一种元素的是 A .Na B .H C .Cl 2 D.2N 9.测定人体内或排出的液体pH ,可以帮助人们了解身体的健康状况。人体内的一些液 体的近似pH 如下: 液体 胃液 胰液 胆汁 血浆 pH — — — — 下列液体中,碱性最强的的是 A .胃液 B .胰液 C .胆汁 D .血浆 10.生铁和足量的稀盐酸充分反应后,总会有一些残渣剩余,残渣的成分主要是 A .铁 B.氯化铁 C .氯化亚铁 D.碳 11.锂电池是新型的高能电池,质量轻、电容量大,颇受手机、电脑等用户的青睐。某种锂电池的总反应可表示为Li + MnO 2 LiMnO 2。以下说法错误的是 A .该反应中Li 的化合价发生了变化 B .MnO 2中锰元素的化合价为+4价 C .LiMnO 2属于氧化物 读出液体的体积 液体的取用 点燃酒精灯 检查装置的气密性 第二章第三节氧化还原反应 一、选择题(只有1个正确答案;共6小题,每小题3分,共18分。) 1.有关氧化还原反应实质的说法中正确的是()A.是否有元素的电子转移B.是否有元素的化合价的变化 C.是否有氧元素的参加D.是否有原子的重新组合 2.下列有关四种基本反应类型与氧化还原反应关系的说法中正确的是()A.化合反应一定是氧化还原反应B.分解反应一定不是氧化还原反应 C.置换反应一定是氧化还原反应D.复分解反应不一定是氧化还原反应 3.下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是()A.实验室中用稀硫酸与锌粒反应制取H2B.实验室中用浓盐酸与二氧化锰加热制Cl2(见P3-20) C.实验室中用高锰酸钾加热分解制取O2D.实验室中用稀盐酸与石灰石反应制取CO2 4.下列化学反应中,属于氧化还原反应的是()A.Na2CO3+CaCl2===CaCO3↓+2NaCl B.Fe+CuSO4===Cu+FeSO4 C.2NaHCO3Na2CO3+CO2↑+H2O D.CaO+H2O===Ca (OH)2 5.氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是A.金属冶炼 B.燃放鞭炮C.食物腐败D.点制豆腐 6.从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是()A.Na2S B.S C.SO2 D.H2SO4 二、选择题(有1-2个答案,只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分, 选错一个该小题不给分。共10小题,每小题4分,计40分。) 7.下列说法中,能够判断一个反应是否是氧化还原反应的是()A.反应前后,元素是否有电子转移 B.反应前后,元素是否有化合价变化 C.反应前后,是否有氧元素参加 D.反应前后,是否有氢元素参加 8.对溶液中的离子反应存在下列几种说法,其中正确的是()A.不可能是氧化还原反应B.只能是复分解反应 C.可能是置换反应 D.可能是化合反应 9.下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是()A.Na+、Ba2+、Cl-、SO42-B.Ca2+、HCO3-、C1-、K+ 圆—直线与圆的位置关系 1. 已知⊙O的半径为5,圆心O到直线l的距离为3,则反映直线l与⊙O的位置关系的图形是( ) 2. 已知,⊙O的直径等于12cm,圆心O到直线l的距离为5cm,则直线l与⊙O的交点个数为( ) A.0个 B.1个 C.2个 D.无法确定 3.如图,从⊙O外一点P引⊙O的两条切线PA.PB,切点分别为A.B.如果∠APB=60°,PA=8,那么弦AB的长是( ) A.4 B.8 C.4 3 D.83 4.如图,点P在⊙O外,PA.PB分别与⊙O相切于A.B两点,∠P=50°,则∠AOB等于( ) A.150° B.130° C.155° D.135° 5.直线l与半径为r的⊙O相交,且点O到直线l的距离为5,则半径r的取值范围是( ) A. r>5 B. r=5 C.0<r<5 D.0<r≤5 6.如图,直线AB与⊙O相切于点A,⊙O的半径为2.若∠OBA=30°,则OB的长为( ) A.4 3 B.4 C.2 3 D.2 7. 如图所示,AB是⊙O的直径,点C为⊙O外一点,CA.CD是⊙O的切线,A.D为切点,连接BD.AD,若∠ACD=30°,则∠DBA的大小是( ) A.15° B.30° C.60° D.75° 8. 已知,⊙O的直径等于12cm,圆心O到直线l的距离为5cm,则直线l与⊙O的交点个数为( ) A.0个 B.1个 C.2个 D.无法确定 9. 已知直线l与⊙O相切,若圆心O到直线l的距离是5,则⊙O的半径是. 10. 已知⊙O的半径为3cm,圆心O到直线l的距离是4cm,则直线l与⊙O的位置关系是. 11. 如图,在Rt△ABC中,∠C=90°,∠A=60°,BC=4cm.以点C为圆心,以3cm长为半径作圆,则⊙C与AB的位置关系是. 12. 已知⊙O的半径是5,圆心O到直线AB的距离为2,则⊙O上有且只有个点到直线AB的距离为3. 13. ⊙O的半径为R,圆心O到直线l的距离为d.若D.R是方程x2-8x+16=0的两个实数根,则直线l 和圆O的位置关系是. 14. 如图,给定一个半径长为2的圆,圆心O到水平直线l的距离为d,即OM=d.我们把圆上到直线l的距离等于1的点的个数记为m.如d=0时,l为经过圆心O的一条直线,此时圆上有四个到直线l的距离等于1的点,即m=4,由此可知: (1)当d=3时,m=; (2)当m=2时,d的取值范围是. 15. 如图,直线PA过半圆的圆心O,交半圆于A.B两点,PC切半圆于点C.已知PC=3,PB=1,该半圆的半径为. 16. 如图,在直角坐标系中,点O′的坐标为(2,0),⊙O′与x轴相交于原点和点A,又B.C.E三点的坐标分别为(-1,0),(0,3),(0,b),且0<b<3. (1)求点A的坐标和经过B.C两点的直线的解析式; (2)当点E在线段OC上移动时,直线BE与⊙O有哪几种位置关系?求出每种位置关系时b的取值范围. 计算题 1.某班同学在做完“二氧化碳的制取和性质”实验后,废液缸中盛有大量的盐酸与氯化钙的混合溶液(不考虑其它杂质).为了对废液进行处理,某同学做了如下实验:取废液缸上层清液20.0g于烧杯中,逐滴滴入溶质质量分数为5.3%的碳酸钠溶液至过量,滴入碳酸钠溶液质量(/g)与生成沉淀的质量(/g)的变化关系如图所示.(计算结果精确到0.1%) 求:(1)当废液中盐酸完全反应时,生成的二氧化碳的质量. (2)实验过程中实际参加反应的碳酸钠溶液的质量为多少? (3)当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量分数. 2.将一些氧化铜粉末加入到100克质量分数为14%的硫酸溶液中,微热至氧化铜全部溶解,再向蓝色溶液中加入W克铁粉,充分反应后,过滤,烘干,得到干燥的固体物质仍是Wg,求: (1)原先氧化铜的质量是多少? (2)最后得到的溶液中溶质的质量分数为多少? (3)当W为何值时才能满足加入的铁粉和得到的固体质量相等? 3.市场上某补钙制剂的说明书如图所示:请计算(不要求写计算过程):(1)葡萄糖酸钙的相对分子质量为; (2)葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为; (3)此钙片中含葡萄糖酸钙的质量分数为. 4.20℃时硫酸的密度和溶质质量分数对照表: 密度(克/厘米3) 1.07 1.14 1.30 1.50 1.73 1.84 溶质质量分数(%)102040608098 为测定铜锌合金的组成,取试样5克,加入质量分数为10%的稀硫酸至恰好不再产生气体为止,收集到0.04克氢气.试计算: (1)铜锌合金中锌的质量分数是多少? (2)测定时用去10%的稀硫酸多少毫升? (3)要配制上述质量分数的稀硫酸500毫升,需98%的浓硫酸多少毫升?5.尿素是常用的一种化肥,其化学式为CO(NH2)2,根据其化学式进行计算 (1)尿素的相对分子质量; (2)尿素中氮元素的质量分数是多少? (3)60克尿素中含有氮元素多少克? (4)多少克碳酸氢铵(NH4HCO3)中所含的氮元素与60克尿素中所含的氮元素质量相等? 6.某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反高一化学计算题(完整资料)
培优训练之《直线与圆的位置关系、切线》专题
往年山东省中考化学真题试卷以及答案
高一上学期化学计算题及答案(1)
山东省泰安市2018年中考化学试题及答案(真题)
(完整word)高一化学计算题常用解题技巧和方法
2016年专项练习题集-直线与圆相交的性质
山东省临沂市中考化学真题试题含答案
精选高一化学氧化还原反应习题及答案解析
201X届中考数学专题复习圆-直线与圆的位置关系专题训练
年中考化学专题训练计算题含解析
