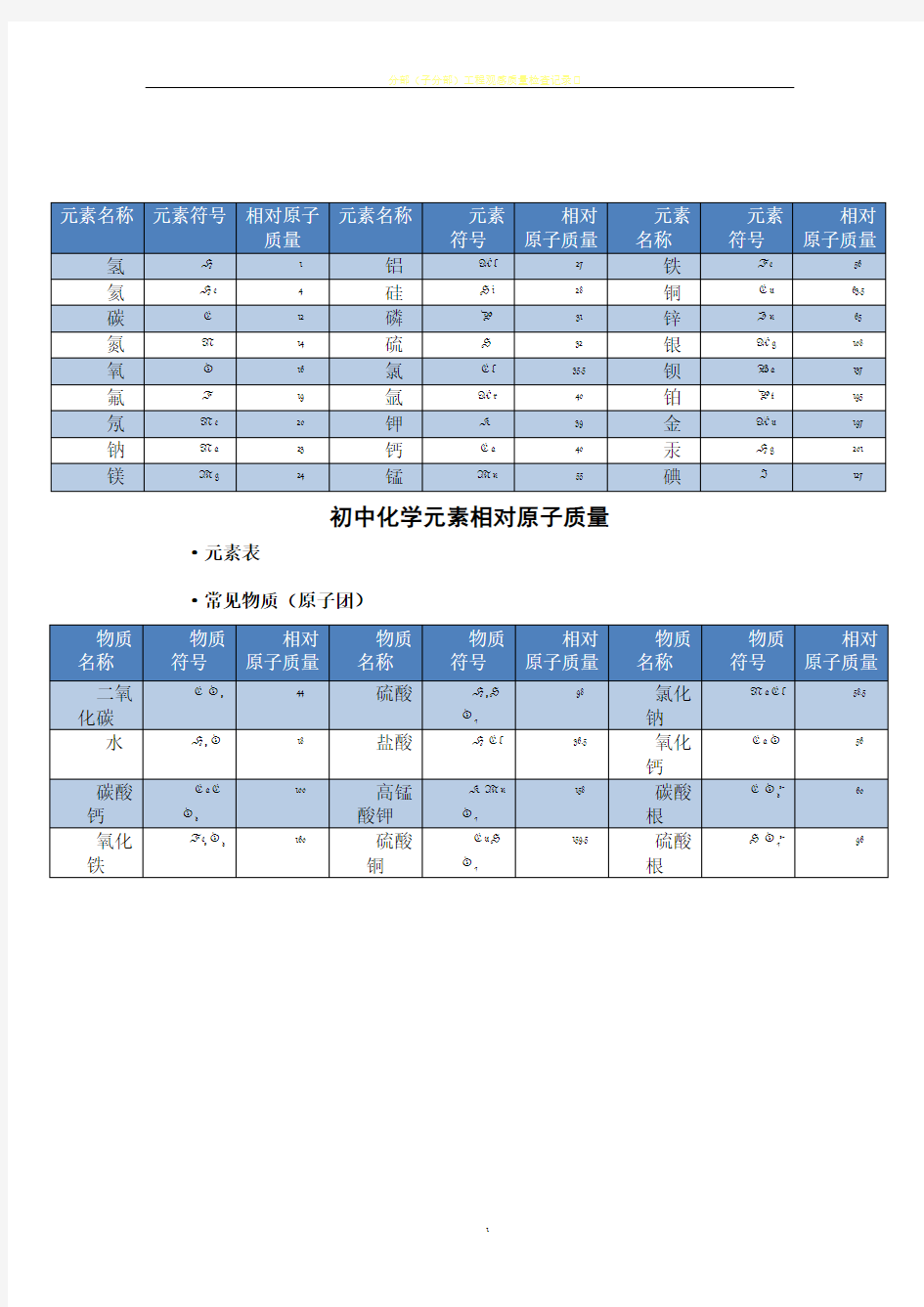
初中化学元素相对原子质量)
分部(子分部)工程观感质量检查记录
初中化学元素相对原子质量·元素表
·常见物质(原子团)
.1
相对原子质量
相对原子质量 百科名片 相对原子质量 由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为 1.674x10(-27)千克,(限于格式,10(-27)表示科学记数法,意为10的-27次幂,下同),一个氧原子的质量为 2.657x10(-26)千克。一个碳-12原子的质量为1.993x10(-26)千克。元素的相对原子质量是其各种同位素相对原子质量的加权平均值。 目录 原子的相对原子质量 定义 特点 国际上规定 计算方法 公式 元素的相对原子质量 算法 原子的相对原子质量 定义 特点 国际上规定 计算方法 公式 元素的相对原子质量 算法 展开 编辑本段原子的相对原子质量 定义 相对原子质量是以一个碳-12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。 特点 当我们计算一个水分子的质量是多少时,就会发现计算起来极不方便(一个水分子是由两个氢原子和一个氧原子组成的)。若是计算其它更复杂的分子质量时那就更麻烦了。因此国际上规定采用相对原子质量和相对分子质量来表示原子、分子的质量关系。 国际上规定 把一个碳-12原子的质量分为12等份,(碳原子有好几种,其中有一种碳原子它的原子核中含6个质子和6个中子,加起来是12,所以把它称为碳-12。当然还有其它如碳-14等,它含有8个中子和6个质子加起为14。国际上之所以要选用碳-12而不用碳-14是因为当选
用碳-12原子作标准时,其它原子的相对原子质量都接近整数,便于记忆与使用)。那每一份的质量就是:一个原子的质量/(1/12×一个碳-12原子的质量)=一个原子的质量/1.667e-27kg。 计算方法 (1.993e-26)/12=1.667e-27千克。然后再把其它某种原子的实际质量与这个数相比后所得的结果,这个结果的数值就叫做这种原子的相对原子质量。如氧原子的相对原子质量求法为:(2.657e-26)/(1.667e-27)=16(约),即氧原子的相对原子质量约为16,我们在计算时就采用16。这样就要简便得多。 其它原子的相对原子质量也是按相同的方法计算的。 相对原子质量看上去没有单位,其实是有单位的,它的国际基本单位是1。 相对原子质量的概念是以一种碳原子(原子核内有6个质子和6个中子的一种碳原子即C-12)的质量的1/12(约1.667e-27kg)作为标准,其它原子的质量跟它的比值,就是这种原子的相对原子质量。 该原子一个原子的实际质量(kg)=该原子的相对原子质量x一个碳-12原子实际质量的1/12(kg)ne 。 1mol物质的质量叫做该物质的摩尔质量,单位一般为g/mol。 一种原子(分子,离子)的摩尔质量在数值上等于其相对原子质量(式量),但请注意:只有当该原子、分子、离子的摩尔质量的单位为g/mol时,才符合本规律。 公式 相对原子质量=一个原子的实际质量/(一个碳原子实际质量的1/12)。 相对原子质量≈质子数+中子数(不能作为计算公式)。 符号:Ar(r为下脚标,小写)概念与元素氩不能混淆。 编辑本段元素的相对原子质量 算法 一种元素的摩尔质量是其各同位素的平均摩尔质量,通常等于该元素的平均相对原子质量(我们平常所说的该元素的相对原子质量),是按各种天然同位素原子丰度算出来的平均值。例如,氯有氯35和氯37两种同位素,通过下列数据即可计算出氯元素的相对原子质量: 34.969×0.7577+36.966 ×0.2423=35.453各种化学元素的相对原子质量=某原子质量/一种碳原子的1/12 M甲/M乙=Ar甲/Ar乙本表数据源自2005年IUPAC元素周期表(IUPAC 2005 standard atomic weights),以C12=12为标准。 本表方括号内的原子质量为放射性元素的半衰期最长的同位素质量数。 相对原子质量末位数的不确定度加注在其后的括号内。 112-118号元素数据未被IUPAC确定。 1 氢H 1.007 94(1) 2 氦He 4.002 602(2) 3 锂Li 6.941(2) 4 铍Be 9.012 182(3) 5 硼B 10.811(7) 6 碳C 12.0107(12) 7 氮N 14.006 7(14)
中考化学相对原子质量相对分子质量知识点分析
相对原子质量相对分子质量 1 2、熟练掌握有关化学式的计算(相对分子质量的计算、计算纯净物中各元素的质量比、 1、相对原子质量:以一个碳-12(质子数和中子数均为6的碳原子)原子质量的作为标准,某原子的质量跟它相所得的数值,即是该种原子的相对原子质量,计算某原子的相对原子质量的公式,相对原子质量是一个比值,它的国际单位制单位为符号为(书写时一般省略不写)。 2、相对分子质量:表示物质的化学式里所有原子的总和。相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得到的相对质量,它也是一个比值,国际单位制单位为“-”符号为“1” 1、怎样理解相对分子质量也是以一个碳-12原子的质量的1/12作为标准进行比较而得 2、硫酸(H2SO4)的相对分子质量是98克,对吗? 3、为什么质子数和中子数的和近似等于相对原子质量? 4、如何计算胆矾(CuSO4·5H2O) 相对分子质量? 5、能否根据物质中某元素的质量分数来判断该物质是否为纯净物?如碳元素质量分数为12%的石灰石是纯净物吗?判断某物质是否纯净物的标准是什么? 例题1、已知一个碳-12原子的质量为1.993×10-26千克,镁的相对原子质量为24,求
例题2、铁的某种氧化物中铁元素与氧元素的质量比为21:8,则该氧化物的相对分子质量为( ) A、 72 B、 160 C、 232 D、 256 思考:先由铁元素与氧元素的质量比推断铁的某种氧化物的化学式,然后计算相对分子质量。本题求化学式的方法有两种,请同学们自己推出。 例题3 一种含氧化铁的铁矿石,经测定含铁49%。求矿石中氧化铁的质量分数。 思考:求矿石中氧化铁的质量分数,就是求不纯的含Fe2O3的矿石中纯的Fe2O3质量分数。矿石中含铁元素的质量等于矿石中Fe2O3含有的铁元素质量。 矿石的质量×矿石中含铁的质量分数 = Fe2O3的质量× Fe2O3中含铁的质量分数 巩固知识 1、已知一个碳-12原子的质量为 1.993×10-26Kg,一个铁原子的质量为9.288×10-26Kg,则铁的相对原子质量为;氧原子的相对原子质量是16,则1个氧原子的质量是 Kg;银的相对原子质量是碳的相对原子质量的9倍,则银的相对原子质量是。 2、晶碱(Na2CO3·10H20)的相对分子质量是,晶碱中结晶水的质量分数为。 3、已知XgR2O中含有YgR,则表示R的相对原子质量的代数式为( ) A、(X-Y)/16 B、8Y/(X-Y) C、16/(X-Y) D、(X-Y)/8Y 4、原子中决定相对原子质量大小的主要微粒 ..是( ) A、质子 B、质子数 C、质子和中子 D、质子数和中子数 5、下列物质中,铁元素的质量分数最大的是() A、Fe2O3 B、FeO C、FeS D、Fe3O4 6、质量相等的CO和CO2中,氧元素的质量比为() A、1:1 B、11:14 C、1:2 D、2:1
相对原子质量教学设计
《相对原子质量》教学设计 【核心素养】 通过对相对原子质量的学习,培养学生科学的计量观念和计量意识。 【教学内容分析】 《相对原子质量》是人教2011课标版九年级化学上册第三单元《物质构成的奥秘》课题2《原子的结构》中第三课时的内容。本课时内容是原子结构的一部分,它使原子的知识体系更加完整。本课时是从量的角度,继续构建微观与宏观的联系,继续形成微粒观。同时,对相对原子质量的深刻理解也是后续的定量研究化学物质和化学反应的基础。通过学习相对原子质量,让学生体会衡量原子质量的大小,要用特定的标准,简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。 【学情分析】 通过前面的学习,学生在水分子的引领下进入了物质的微观世界,已经建立了分子、原子的微观概念,认识了原子的结构,并且知道原子质量很小,这是本课时的知识基础。在前面的学习中,学生已经形成了“原子质量到底有多小”、“怎么表示这么小的质量”、“用常见的方法行不行”等潜在疑问,这是本课时的生发点。学生之前并没有接触微观粒子的计量,而相对原子质量又比较抽象,对一般学生来讲理解起来有一定困难。 【教学设计思想】 1.科学创设问题情境,增强学习的针对性。从学生已有的原子结构的知识入手,引领学生根据原子结构分析、猜测原子质量的大小,再根据原子的实际质量比较原子质量的大小,最后通过相对原子质量比较原子质量的大小。通过几次有针对性的比较,让学生建立起原子、原子质量与相对原子质量之间的联系,突破本节课的难点。 2.重视科学观念的形成。通过学习相对原子质量,让学生把原子与原子质量、相对原子质量联系起来,体会衡量原子质量的大小,要用特定的标准,从而简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。
相对原子质量和相对分子质量及摩尔质量的比较
相对原子质量和相对分子质量及摩尔质量的比较 一、相对原子质量 1、相对原子质量的概念 一种核素的相对原子质量是以质量的作为标准,其他元素的原子质量跟它相比较所得的数值。相对原子质量的单位为“1”。 2、几个有关相对原子质量的概念的区别 (1)质量数在数值上等于原子中质子数和中子数之和。但质量数不只是微粒个 数,它是一个属于质量范畴的数值。质量数是对某种同位素而言的,如的质量数是35。对于一种元素来说,没有一种质量数跟它相对应,因此讲氯元素的质量数是35是错误的。 (2)同位素的相对原子质量是把该同位素原子质量与作为相对原子质量标准的 原子质量的的比值,通常它不是整数。一种元素通常有几种同位素,这几 种同位素原子因其核内中子数目不同而有着不同的质量,与的的比值也不 相同。如氯元素的两种同位素和,它们的相对原子质量分别是34.969和36.966。 (3)元素的相对原子质量是按该元素的各种天然同位素的相对原子质量和所占的物质的量分数(或称丰度)算出来的平均值(注意此处用的是原子的物质的量分数而不是质量分数),即元素的相对原子质量 [是各同位素的相对原子质量,a%,b%,c%…是各同位素原子的物质的量分数]。《国际原子量表》中列出的相对原子质量,就是各元素的平均相对原子质量。如天然氢是由两种同位素和组成,它们的同位素相对质量分别是1.00782和2.0140,同位素丰度分别是99.985%和0.015%,所以氢元素的相对原子质量 。 (4)元素的近似相对原子质量是按该元素的各种天然同位素的质量数和所占的原子的物质的量分数(或称丰度)计算出来的平均值。计算公式与元素的相对原子质量相同,只是式中M(A),M(B),M(C)…是表示各同位素的质量数。 例1:自然界中硼有两种同位素:和,又测得硼的相对原子质量为10.8,试求和的原子个数比。 解析:设自然界中硼的原子总数为100,其中含为x,含为。
相对原子质量
相对原子质量:H 1 He 4 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Fe 56 Cu 64 Ag 108 第Ⅰ部分选择题(50分) 一、单项选择题(本题包括20小题,1至10题每小题2分,11至20题每小题3分;合计共50分。) 1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。下列说法正确的是() A.化学不做实验,就什么都不知道B.化学不再需要实验 C.化学不再是纯实验科学D.未来化学的方向是经验化 2.对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的标志是() A B C D 3.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是() ①过滤②蒸发③溶解④向容量瓶转移液体 A.①和②B.①和③C.③和④D.①和④ 4.下列的分离方法不正确的是() A.用酒精萃取碘水中的碘B.用蒸馏的方法将自来水制成蒸馏水 C.用过滤的方法除去食盐水中的泥沙D.用淘洗的方法从沙里淘金 5.下列做法中,错误的是() A.实验台上的易燃、易爆药品要远离火源 B.如果浓硫酸沾到皮肤上应迅速用大量水冲洗,最后涂上小苏打溶液 C.眼睛里溅进了浓的碱液,应立即用水冲洗,并送医院诊治 D.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸6.下列各种仪器:①漏斗;②容量瓶;③试管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。常用于物质分离的是() A.①③⑦B.②⑥⑦C.①④⑧D.④⑥⑧ 7.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是() A.16g B.32g C.64g /mol D.32g /mol 8.下列叙述正确的是() A.1molH2O的质量为18g/mol B.CH4的摩尔质量为16g C.3.01×1023个SO2分子的质量为32g D.标准状况下,1mol任何物质体积均为22.4L/mol 9.下列实验操作中错误的是()
国际标准相对原子质量(新2014)
国际标准相对原子质量(新) 原子序数元素名称化学符号相对原子质量注脚脚注 1 hydrogen 氢H [1.007 84; 1.008 11] m 2 helium 氦He 4.002 602(2) g r 3 lithium 锂Li [6.938; 6.997] m 4 beryllium 铍Be 9.012 182(3) 5 boron 硼 B [10.806; 10.821] m 6 carbon 碳 C [12.0096; 12.0116] 7 nitrogen 氮N [14.006 43; 14.007 28] 8 oxygen 氧O [15.999 03; 15.999 77] 9 fluorine 氟 F 18.998 4032(5) 10 neon 氖Ne 20.1797(6) g m 11 sodium 钠Na 22.989 769 28 (2) 12 magnesium 镁Mg 24.3050(6) 13 aluminium (aluminum) 铝 Al 26.981 538 6 (8) 14 silicon硅Si [28.084; 28.086] 15 phosphorus 磷P 30.973 762(2) 16 sulfur 硫S [32.059; 32.076] 17 chlorine 氯Cl [35.446; 35.457] m 18 argon 氩Ar 39.948(1) g r 19 potassium 钾K 39.0983(1) 20 calcium 钙Ca 40.078(4) g 21 scandium 钪Sc 44.955 912(6) 22 titanium 钛Ti 47.867(1) 23 vanadium 钒V 50.9415(1) 24 chromium 铬Cr 51.9961(6) 25 manganese 锰Mn 54.938 045(5) 26 iron 铁Fe 55.845(2) 27 cobalt 钴Co 58.933 195(5) 28 nickel 镍Ni 58.6934(4) r 29 copper 铜Cu 63.546(3) r 30 zinc 锌Zn 65.38(2) r 31 gallium 镓Ga 69.723(1) 32 germanium 锗Ge 72.63(1) 33 arsenic 砷As 74.921 60(2) 34 selenium 硒Se 78.96(3) r 35 bromine 溴Br 79.904(1) 36 krypton 氪Kr 83.798(2) g m 37 rubidium 铷Rb 85.4678(3) g 38 strontium 锶Sr 87.62(1) g r 39 yttrium 钇Y 88.905 85(2) 40 zirconium 锆Zr 91.224(2) g
相对原子质量表
相对原子质量表 ——(1-56H-Ba)—— 原子序数元素名称元素符号相对原子质量1氢H1 2氦He4 3锂Li7 4铍Be9 5硼B10.8 6碳C12 7氮N14 8氧O16 9氟F19 10氖Ne20 11钠Na23 12镁Mg24.3 13铝Al27 14硅Si28 15磷P31 16硫S32
17氯Cl35.4 18氩Ar40 19钾K39 20钙Ca40 21钪Sc50 22钛Ti47.8 23钒V51 24铬Cr52 25锰Mn55 26铁Fe55.8 27钴Co59 28镍Ni58.6 29铜Cu63.5 30锌Zn65.4 31镓Ga69.7 32锗Ge72.6 33砷As75 34硒Se79 35溴Br80 36氪Kr83.798(2) 37铷Rb85.4678(3) 38锶Sr87.62(1)
40锆Zr91.224(2) 41铌Nb92.90638(2) 42钼Mo95.94(2) 43锝Tc[97.9072] 44钌Ru101.07(2) 45铑Rh102.90550(2) 46钯Pd106.42(1) 47银Ag107.8 48镉Cd112.411(8) 49铟In114.818(3) 50锡Sn118.7 51锑Sb121.760(1) 52碲Te127.60(3) 53碘I127 54氙Xe131.293(6) 55铯Cs132.9054519(2) 56钡Ba137.3——(57-71La-Lu镧系)—— 原子序数元素名称元素符号相对原子质量57镧La138.90547(7) 58铈Ce140.116(1) 59镨Pr140.90765(2)
相对原子质量
相对原子质量 原子量即相对原子质量 [1]由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为1.674x10-27千克,一个氧原子的质量为2.657x10-26千克。一个碳-12原子的质量为1.993x10-26千克。元素的相对原子质量是其各种同位素相对原子质量的加权平均值。元素周期表中最下面的数字为相对原子质量。 原子的相对原子质量 定义 相对原子质量(Ar)是指以一个碳-12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。 特点 当我们计算一个水分子质量是多少时,就会发现计算起来极不方便(一个水分子是由两个氢原子和一个氧原子组成的)。若是计算其它更复杂的分子质量时那就更麻烦了。因此国际上规定采用相对原子质量和相对分子质量来表示原子、分子的质量关系。
国际规定 把一个碳-12原子的质量分为12等份,(碳原子有好几种,其中有一种碳原子它的原子核中含6个质子和6个中子,加起来是12,所以把它称为碳-12。当然还有其它如碳-14等,它含有8个中子和6个质子加起为14。国际上之所以要选用碳-12而不用碳-14是因为当选用碳-12原子作标准时,其它原子的相对原子质量都接近整数,便于记忆与使用)。那每一份的质量就是:一个原子的质量/(1/12×一个碳-12原子的质量)=一个原子的质量/1.667e-27kg。 计算方法 (1.993e-26)/12=1.667e-27千克。然后再把其它某种原子的实际质量与这个数相比后所得的结果,这个结果的数值就叫做这种原子的相对原子质量。如氧原子的相对原子质量求法为:(2.657e-26)/(1.667e-27)=16(约),即氧原子的相对原子质量约为16,我们在计算时就采用16。这样就要简便得多。 其它原子的相对原子质量也是按相同的方法计算的。 相对原子质量看上去没有单位,其实是有单位的,它的国际基本单位是1。 相对原子质量的概念是以一种碳原子(原子核内有6个质子和6个中子的一种碳原子即C-12)的质量的1/12(约
元素相对原子质量表
原子序数元素名称元素符号相对原子质量 1 氢 H 1.007 94(7) 2 氦 He 4.002 602(2) 3 锂 Li 6.941(2) 4 铍 Be 9.012 182(3) 5 硼 B 10.811(7) 6 碳 C 12.017(8) 7 氮 N 14.006 7(2) 8 氧 O 15.999 4(3) 9 氟 F 18.998 403 2(5) 10 氖 Ne 20.179 7(6) 11 钠 Na 22.989 769 28(2) 12 镁 Mg 24.305 0(6) 13 铝 Al 26.981 538 6(8) 14 硅 Si 28.085 5(3) 15 磷 P 30.973 762(2) 16 硫 S 32.065(5) 17 氯 Cl 35.453(2) 18 氩 Ar 39.948(1) 19 钾 K 39.098 3(1) 20 钙 Ca 40.078(4) 21 钪 Sc 44.955 912(6) 22 钛 Ti 47.867(1) 23 钒 V 50.941 5(1) 24 铬 Cr 51.996 1(6) 25 锰 Mn 54.938 045(5) 26 铁 Fe 55.845(2) 27 钴 Co 58.933 195(5) 28 镍 Ni 58.693 4(2) 29 铜 Cu 63.546(3) 30 锌 Zn 65.409(4) 31 镓 Ga 69.723(1) 32 锗 Ge 72.64(1) 33 砷 As 74.921 60(2) 34 硒 Se 78.96(3) 35 溴 Br 79.904(1) 36 氪 Kr 83.798(2) 37 铷 Rb 85.467 8(3) 38 锶 Sr 87.62(1) 39 钇 Y 88.905 85(2) 40 锆 Zr 91.224(2) 41 铌 Nb 92.906 38(2) 42 钼 Mo 95.94(2) 43 锝 Tc [97.9072]
相对原子质量教学设计
“相对原子质量”教学设计 一、教学内容分析 “相对原子质量”是鲁教版五四学制初三化学第二单元第三节中的内容。本课时内容也是原子结构的一部分,它使原子的知识体系更加完整。本课时是从量的角度,继续构建微观与宏观的联系,继续形成微粒观。同时,对相对原子质量的深刻理解也是后续的定量研究化学物质和化学反应的基础。通过学习相对原子质量,让学生体会衡量原子质量的大小,要用特定的标准,简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。 二、教学对象分析 通过前面的学习,学生在水分子的引领下进入了物质的微观世界,已经建立了分子、原子的微观概念,认识了原子的结构,并且知道原子质量很小,这是本课时的知识基础。在前面的学习中,学生已经形成了“原子质量到底有多小”、“怎么表示这么小的质量”、“用常见的方法行不行” 等潜在疑问,这是本课时的生发点。学生之前并没有接触微观粒子的计量,而相对原子质量又比较抽象,对一般学生来讲理解起来有一定困难。 三、教学设计思想 1.科学创设问题情境,增强学习的针对性。从学生已有的原子结构的知识入手,引领学生根据原子结构分析、猜测原子质量的大小,再根据原子的实际质量比较原子质量的大小,最后通过相对原子质量比较原子质量的大小。通过几次有针对性的比较,让学生建立起原子、原子质量与相对原子质量之间的联系,突破本节课的难点。 2.重视科学观念的形成。通过学习相对原子质量,让学生把原子与原子质量、相对原子质量联系起来,体会衡量原子质量的大小,要用特定的标准,从而简化用宏观的单位进行计量带来的复杂,进而感悟科学计量的重要性,形成科学的计量观念和计量意识。 四、教学目标 (一)知识与技能目标 1.能应用概念计算原子的相对原子质量 2.能说出原子的实际质量与相对原子质量的区别与联系 3、会查相对原子质量表 (二)过程与方法目标 1.学习用相对值代表实际值的方法 2.会用查阅资料、观察分析、整理与归纳数据、推断与假设的科学探究方法 (三)情感态度价值观目标 1.体会科学计量的重要性,培养学生科学的计量观和计量意识以及敢于向权威质疑的科学精神。 2.结合张青莲教授的卓越贡献资料,对学生进行爱国主义教育。 五、教学重点和难点 1.教学重点:相对原子质量的概念和计算 2.教学难点:相对原子质量和原子的实际质量的比较。 六、教学过程
相对原子质量
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 Cl—35.5 Ca—40 一、选择题(本题共15小题,每小题只有一个选项符合题意。每小题1分,共15分)1.下列各图所示变化属于化学变化的是() A.灯泡通电发光 B.铁丝在氧气中燃烧 C.湿衣晾干 D.食盐水的蒸发 2.生活中常见的下列物质,属于溶液的是() A. 牛奶 B. 泥水 C. 蔗糖水 D. 花生油 3.某含铁盐溶液能够在高浓度的碱性环境下长期稳定存在,且具有较强的灭菌消毒功能,该盐是一种绿色、无污染的净水剂,其化学式为Na2FeO3。则其中铁元素的化合价是()A.+2 B.+3 C.+4 D.+6 4.下图所示的实验操作中正确的是() 5.据报道,科学家己经研制出世界上最薄的材料一碳膜片,其厚度只有一根头发的二十万分之一。如右图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是() A. 碳膜片属于单质 B.碳膜片与C60是同一种物质 C. 碳膜片属于人工合成的有机高分子材料 D.碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 6.学习化学的目的,不在于要成为化学家,重要的是要善于用化学知识去分析、解决生产、生活中的问题。从化学角度看,下列说法中错误的是() A.发现燃气(天然气、煤气或液化石油气等)泄漏,点火检查出泄漏处 B.进入小煤窑严禁吸烟 C.炒菜时油锅着火,可用锅盖盖灭火焰 D.面料厂、加油站严禁烟火
7.在氧化铁(Fe2O3)、氧化亚铁(FeO)和四氧化三铁(Fe3O4)这三种铁的氧化物中,铁的 质量分数按由大到小顺序排列的是 A.Fe3O4、Fe2O3、FeO B.FeO、Fe2O3、Fe3O4 C.FeO、Fe3O4、Fe2O3 D.Fe2O3、Fe3O4、FeO 8.为了区别CO(可能混有氧气)与CO2两瓶无色气体,下列方法中可行的是 A.分别通入少量澄清石灰水,振荡。B.伸入燃着的木条。 C.分别通入少量NaOH溶液,振荡。D.分别通入少量稀硫酸,振荡。 9.某同学在研究物质燃烧的条件时,做了如右图所示的实验:把一条粗金属丝绕成线圈,罩 在一支蜡烛的火焰上,火焰很快就熄灭了。对这一实验的说法不正确的是 A.金属丝有良好的导热性 B.可燃物的温度降到了着火点以下 C.若预先将金属丝加热,蜡烛就不会很快熄灭 D.金属线圈内的气体温度升高了 10.下列图象能正确反映其对应操作中各量变化关系的是 ( ) A.用一定质量的高锰酸钾加热制氧气 B.向一定质量的石灰石中加入过量的稀盐酸 C.向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体 D.分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量 11. 如要将100 g溶质质量分数为20%的硝酸钾溶液稀释成溶质质量分数为10%的硝酸钾溶 液,需加入水的质量为 A.50 g B.90 g C.100 g D.200 12. X、Y、Z、W是四种不同的金属,为比较金 属活动性的大小,某同学利用这四种金属单质、 盐酸、Z的硝酸盐、W的硝酸盐,进行有关实验, 结果如下表(能反应的记为“+”,不能反应的 记为“—”,无标记的表示未做该实验)。这四种金属的活动性顺序为 A.Y>W>X>Z B.W>X>Y>Z C.X>Y>W>Z D.Y>W>Z>X 13.化学用语是学习化学的主要工具,是国际通用的化学语言。下列说法正确的是
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5142 氧气O232 氢氧化钙(熟石灰)Ca(OH)274 氯气Cl271 氢氧化铜Cu(OH)298 氨气NH317 氢氧化钠NaOH 40 氮气N228 过氧化氢(双氧水)H2O234 一氧化碳CO 28 碱式碳酸铜(绿)Cu2(OH)2CO3222 二氧化碳CO244 盐酸(氯化氢)HCl 36.5 一氧化硫SO 48 氯化钙CaCl2111 二氧化硫SO264 氯化钾KCl 74.5 三氧化硫SO380 氯化铁(淡黄 FeCl3162.5 溶) 二氧化锰MnO287 氯酸钾KClO3122.5 碳酸H2CO362 高锰酸钾(灰锰氧)KMnO4158 碳酸钙CaCO3100 硫酸铜(白固蓝 CuSO4160 溶) 碳酸氢铵NH4HCO379 硫酸钠Na2SO4142 硝酸HNO363 硝酸铵NH4NO380 硫酸H2SO498 甲烷CH416 亚硫酸H2SO382 尿素CO(NH2)260 磷酸H3PO498 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H226 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO 72
硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161 初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量/ 一个 碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相 对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m: B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量
相对原子质量补充讲义
-相对原子质量 一、考查要求: 巩固质量数、质子数和中子数三者之间的关系 区分同位素的相对原子质量、质量数、元素的相对原子质量、元素的近似相对 原子质量的概念 二、知识梳理 1. 原子的质量和相对原子质量、近似相对原子质量 ①任何一个原子的质量都很小,用什么方法能称量出一个原子的质量? 12gC-12中含有6.02×1023个原子 一个C-12原子的质量: ②相对原子质量:以一个碳-12原子(126C)质量的1/12作为标准,任何一个原子 的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子 的。 一个O-16原子的质量:2.656×10-23g 相对原子质量的标准:一个C-12原子的质量的1/12即: 1.993×10-23g×1/12=g O-16的相对原子质量: (2.656×10-23g)÷(g)=(即为该原子的相对原子质量) 2. 近似相对原子质量 指某种元素的一种同位素相对原子质量的近似整数值 O-16的相对原子质量: (2.656×10-23g)÷(1.661×10-24g)=15.990 取近似值16 称为(即)。 3. 元素的平均相对原子质量 元素的平均相对原子质量是该元素的各种同位素的相对原子质量,乘上各同位素的 原子百分数计算而得平均值: 元素平均相对原子质量:A =A1×a1% +A2 ×a2% +A3 ×a3% …… 例: 35Cl原子相对原子质量为34.969 自然界中的含量(丰度)75.77%,37Cl 相对原子质量为36.966,自然界中的含量(丰度)24.23%。 Cl元素的平均相对原子质量: 4. 元素的近似平均相对原子质量 元素的近似平均相对原子质量:A =A1×a1% +A2 ×a2% +A3×a3% …… 上述公式中A1 A2A3用各同位素的质量数代入 例: 35Cl原子相对原子质量为34.969 自然界中的含量(丰度)75.77%,37Cl 相对原子质量为36.966,自然界中的含量(丰度)24.23%。 Cl元素的近似平均相对原子质量: 二、基础训练 1.据报道,某些建筑材料会产生质子数为86,质量数为222的放射性氡(Rn),从而对 人体产生伤害,该原子的中子数和质子数的差值为()
2016年国际标准原子量
At No Symbol Name Atomic Wt Notes 1 H Hydrogen 1.008 3, 6 2 He Helium 4.002602(2) 1, 2 3 Li Lithium 6.9 4 3, 6 4 Be Beryllium 9.0121831(5) 5 B Boron 10.81 3, 6 6 C Carbon 12.011 6 7 N Nitrogen 14.007 6 8 O Oxygen 15.999 6 9 F Fluorine 18.998403163(6) 10 Ne Neon 20.1797(6) 1, 3 11 Na Sodium 22.98976928(2) 12 Mg Magnesium 24.305 6 13 Al Aluminium 26.9815385(7) 14 Si Silicon 28.085 6 15 P Phosphorus 30.973761998(5) 16 S Sulfur 32.06 6 17 Cl Chlorine 35.45 3, 6 18 Ar Argon 39.948(1) 1, 2 19 K Potassium 39.0983(1) 20 Ca Calcium 40.078(4) 21 Sc Scandium 44.955908(5) 22 Ti Titanium 47.867(1) 23 V Vanadium 50.9415(1) 24 Cr Chromium 51.9961(6) 25 Mn Manganese 54.938044(3) 26 Fe Iron 55.845(2) 27 Co Cobalt 58.933194(4) 28 Ni Nickel 58.6934(4) 2 29 Cu Copper 63.546(3) 2 30 Zn Zinc 65.38(2) 2 31 Ga Gallium 69.723(1) 32 Ge Germanium 72.630(8) 33 As Arsenic 74.921595(6) 34 Se Selenium 78.971(8) 35 Br Bromine 79.904 6 36 Kr Krypton 83.798(2) 1, 3 37 Rb Rubidium 85.4678(3) 1 38 Sr Strontium 87.62(1) 1, 2 39 Y Yttrium 88.90584(2)
相对原子质量
相对原子质量:H :1 C :12 N :14 O :16 Na :23 Mg :24 K :39 Ca :40 Br :80 说明: 1.本试卷共6页,包含选择题(第1题~第20题,共40分)、非选择题(第21题~第28题)两部分。本卷满分100分,考试时间为100分钟。考试结束后,将本卷和答题卡一并交回。 2.答题前,考生务必将本人的姓名、准考证号填写在答题卡相应的位置上,同时务必在试卷的装订线内江本人的姓名、准考证号、毕业学校填写好,在试卷第一面的右下角填写好座位号。 3.所有试题都必须在专用的“答题卡”上作答,选择题用2B 铅笔作答,非选择题在指定位置用0.5毫米黑水笔作答。在试卷或草稿纸上答题无效。 一、单项选择题(本题包括15小题,每小题2分,共30分,每小题只有一个.... 选项符合题意) 1.“诗画瘦西湖,人文古扬州”是我市的旅游宣传语,清澈的瘦西湖水属于 A .混合物 B .纯净物 C .单质 D .化合物 2.我市是第六个国家级“光谷”,下列过程属于物理变化的是 A .二氧化硅(SiO 2)与焦炭制粗硅(Si ) B .氢气与四氯化硅(SiCl 4)制纯硅(Si ) C .太阳能热水器中冷水变热水 D .在催化剂作用下太阳能光解水制氢 3.如图是一幅贴在汽车加油站的宣传广告。下列叙述错误.. 的是 A .由玉米生产的乙醇可添加在汽油中作汽车燃料 B .玉米汁可作汽车燃料 C .推广玉米生产的燃料可在一定程度上缓解当前的能源危机 D .推广乙醇汽油可适度减轻汽车尾气对环境的污染 4.凯氏定氮法中用硼酸(H 3BO 3)等试剂进行蛋白质含氮量测定,硼酸中硼元素的化合价是 A .+1 B .+2 C .+3 D .+6 5.下列说法错误.. 的是 A .月饼盒中放入装有铁粉的小包装,可以防止月饼变质 B .液化气泄漏时,应首先关闭阀门,打开门窗换气 C .车船表面喷涂油漆,可防止生锈 D .石油、天然气、焦炉煤气是三大重要的化石燃料 6.科学家探索用CO 除去SO 2,该研究涉及的一个反应:SO 2 + 2CO ===== 2X + S ,则X 为 A .CO 2 B . C C .CS 2 D .COS 7.现有三种物质:①洁厕灵(含无机酸等)②生理盐水③烧碱溶液,pH 大小关系为 A .①>②>③ B .③>②>① C .②<①<③ D .③<①<② 8.人民币防伪技术之一是光学变色油墨。某变色油墨中含有汞的碘化物,汞的元素符号是 催化剂
相对原子质量表大全
氢气H2 2 五氧化二磷P2O5 142 氧气O2 32 氢氧化钙(熟石灰a(OH)2 74 氯气Cl2 71 氢氧化铜C U(OH)2 98 氨气NH3 17 氢氧化钠NaOH 40 氮气N2 28 过氧化氢(双氧水)2 34 一氧化碳CO 28 碱式碳酸铜绿)CU2(OH) CO 222 二氧化碳CO2 44 盐酸(氯化氢)HCI 36.5 一氧化硫SO 48 氯化钙CaCl2 111 二氧化硫SO2 64 氯化钾KCl 74.5 三氧化硫SO3 80 氯化铁(淡黄FeCl3 162.5 溶) 二氧化锰MnO2 87 氯酸钾KCIO3 122.5 碳酸H2CO3 62 高锰酸钾(灰锰氧MnO4 158 碳酸钙CaCQ 100 硫酸铜(白1 蓝CuSO4 160 溶 碳酸氢铵NH4HCO3 79 硫酸钠Na2SO4 142 硝酸HNO3 63 硝酸铵NH4NO3 80 硫酸H2SO4 98 甲烷CH4 16 亚硫酸H2SO3 82 尿素CO(NH2)2 60 磷酸H3PO4 98 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H2 26 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 四氧化三铁黑)FmO4 232 氧化铁(红)Fe2O3 160 氧化亚铁(黑)FeO 72
硫酸亚(淡绿)eSO 152 硫酸锌(白无)ZnSO4 161 初中化学常用计算公式 一.常用计算公式: (1)相对原子质量=某元素一个原子的质量/ 一个碳原子质量的 1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量Xm+ B的相对原子质量X ②A元素与B元素的质量比=A的相对原子质量X m: B的相对原子质量X n ③A元素的质量分数3 =A的相对原子质量X m /AmBn 的相对分 子质量
相对原子质量表大全
H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH40氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl 一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KCl FeCl3 三氧化硫SO380氯化铁(淡黄 溶) 二氧化锰MnO287氯酸钾KClO3 碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158 CuSO4160碳酸钙CaCO3100硫酸铜(白固蓝 溶) 碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO380硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)260磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO80乙炔C2H226氧化镁(白)MgO40乙酸(醋酸)CH3COOH60氧化钙(白)CaO56 四氧化三铁(黑)Fe3O4232 氧化铁(红)Fe2O3160 氧化亚铁(黑)FeO72 硫酸亚铁(淡绿)FeSO4152 硫酸锌(白/无)ZnSO4161
初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量 / 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B 的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn 的相对分子质量 (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100%
初中常见元素,原子团名称,化学式,化合价,相对原子质量,一览表
元素名称原子序数元素符号相对原子 化合价 质量 氢 1 H 1 +1 氦2He 4 锂3Li 7 铍4Be 9 硼5 B 11 碳6 C 12+2+4 氮7N 14-3、+2、+3、+4、 +5 氧8O 16-2 氟9 F 19-1 氖10Ne 20 钠11Na 23+1 镁12Mg 24+2 铝13Al 27+3 硅14Si 28+4 磷15P 31-3、+3、+5 硫16S 32-2、+4、+6 氯17Cl 35.5-1、+1、+5、+7氩18Ar 40 钾19K 39+1
钙20Ca 40+2 锰25 Mn 55 +2、+4、+6、+7 铁26 Fe 56 +2、+3 铜29 Cu 63.5 +1、+2 锌30 Zn 65 银47 Ag 108 钡56 Ba 137 铂78 Pt 195 金79 Au 197 汞80 Hg 201 碘53 I 127 溴35 Br 80 -1 氢氧根OH -1 硝酸根NO3-1 高锰酸根MnO4-1 氯酸根ClO3-1 硫酸根SO4-2 碳酸根CO3-2 铵根NH4+1
初中化学常见的原子团(根)及其化合价 根的名称根的符 号 常见化 合价 常见化合物 举例 铵根NH4+1 NH4Cl 硝酸根NO3-1 K NO3 氢氧根OH -1 Na OH 高锰酸 根 MnO4-1 K MnO4锰酸根MnO4-2 K2MnO4氯酸根ClO3-1 K ClO3醋酸根CH3CO O -1 CH3COO H 碳酸根CO3-2 Na2CO3碳酸氢 根 HCO3-1 Na HCO3硫酸根SO4-2 Cu SO4硫酸氢HSO4-1 Na HSO4
初中化学_常用计算公式
初中化学常用计算公式 一. 常用计算公式: (1)相对原子质量= 某元素一个原子的质量 / 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn的相对分子质量 (3)混合物中含某物质的质量分数(纯度)=纯物质的质量/混合物的总质量× 100% (4)标准状况下气体密度(g/L)=气体质量(g)/气体体积(L) (5)纯度=纯物质的质量/混合物的总质量× 100% = 纯物质的质量/(纯物质的质量+杂质的质量) × 100%= 1- 杂质的质量分数 (6)溶质的质量分数=溶质质量/溶液质量× 100% =溶质质量/(溶质质量+溶剂 质量) × 100% (7)溶液的稀释与浓缩 M浓× a%浓=M稀× b%稀=(M浓+增加的溶剂质量) × b%稀 (8)相对溶质不同质量分数的两种溶液混合 M浓× a%浓+M稀× b%稀=(M浓+M稀) × c% (9)溶液中溶质的质量 =溶液的质量×溶液中溶质的质量分数 =溶液的体积×溶液的密度 化学计算中的重要公式 1.溶解度S:固体~S=100m(质)/m(剂),气体~S=V(质)/V(剂);
2.饱和溶液的质量百分比浓度A%:A%=S/(100+S)×100% 3.质量分数A%:A%=m(质)/m(液)×100% 4.物质的量n:n=m/M=N/NA=V(L)/22.4(STP) 5.原子的绝对质量m:m=M/NA 6.平均摩尔质量M平:M平=(m1+m2+…)/(n1+n2+…) 7.物质的量浓度c:c=n/V=1000rA%/M=c1V1/V 8.25℃,Kw=[H+][OH-]=1.0×10-14,pH=-lg[H+],pOH=-lg[OH-] 9.PV=nRT=mRT/M,PM=mRT/V=rRT,PVNA=NRT,22.4P=RT 10.M(g)=22.4r(STP); 11.纯度:纯度=纯净物的质量/混合物的质量×100% 12.产率:产率=实际产量/理论产量×100% 13.电离度a:a=已电离分子数/原分子总数×100% 14.转化率:转化率=已反应的物质的量/起始时的物质的量×100% 15.a价金属与酸反应通式:2M+2aH+¾®2Ma++aH2~ m(M)/2M=m(H2)/2a m(M)/m(H2)=M/a(产生1 g H2所需要金属的质 1)相对原子质量= 某元素一个原子的质量/ 一个碳原子质量的1/12 (2)设某化合物化学式为AmBn ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数ω=A的相对原子质量×m /AmBn的相对分子质量
