球菌属总结
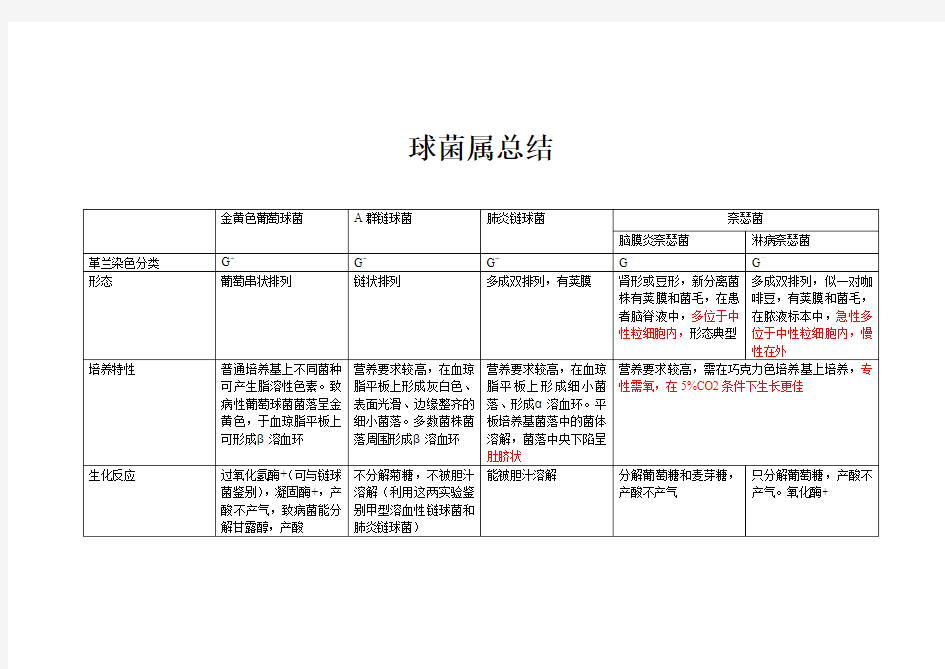

球菌属总结
链球菌属检验
1.概述 链球菌属是一群触酶试验阴性、呈链状排列的革兰阳性球菌。该菌属种类繁多,目前临床上仍沿用Lancefield血清学方法进行分群(A、B、C、D、F、G等18个群),或根据溶血现象(β溶血、α溶血或草绿色溶血、γ溶血或不溶血)进行分类。化脓性链球菌是临床上最重要的链球菌,属A群、β溶血的链球菌。 2. 标本类型 血液、尿液、痰、脑脊液、穿刺液、脓液等标本。 3. 鉴定 3.1 形态与染色革兰阳性球菌,固体培养基上呈单个或成双排列,较少呈链状排列,肉汤培养基中呈长链状排列,肺炎链球菌呈矛头状,成双或链状排列。 3.2 培养特性在血琼脂平板上菌落可出现三种溶血反应:α溶血周围有灰绿色的狭窄溶血环;β溶血周围有明显较大的完全透明环;γ溶血(不溶血性)无异常变化。肺炎链球菌菌落中央呈脐窝状、表面光滑、灰色、扁平,周围有草绿色α溶血环。 3.3 生化反应触酶试验阴性,对各种碳水化合物的分解因菌种而异,链球菌不被胆汁溶解。肺炎链球菌胆盐溶菌试验阳性,Optochin试验敏感(抑菌环>14mm)。 3.4 鉴别要点 3.4.1 本菌属特征革兰阳性球菌,单个、成双或链状排列,菌落较小,可出现β溶血、α溶血或不溶血,触酶试验阴性。 3.4.2 根据溶血及关键性试验,对链球菌进行推测性鉴定分群。 A群链球菌(化脓性链球菌):β溶血,杆菌肽敏感。 B群链球菌(无乳链球菌):β溶血,CAMP试验阳性,马尿酸钠试验阳性。 C群链球菌(似马链球菌、兽疫链球菌和马链球菌等):马尿酸钠、6.5%氯化钠耐盐试验均为阴性,血清学分型、杆菌肽耐药(抑菌试验阴性)。 D群肠球菌(粪肠球菌、屎肠球菌、鸟肠球菌等):胆汁七叶苷、6.5%氯化钠耐盐试验均为阳性,45℃生长。现归属于肠球菌属。 C、F及G群链球菌的鉴定常需用血清学方法。 非β溶血链球菌的鉴别见表1。 表1 非β溶血链球菌的鉴别 菌名Optochin试验胆汁溶菌试验胆汁七叶苷试验 肺炎链球菌+ + - 牛链球菌- - + 其他草绿色链球菌群- - - 3.5 操作步骤 3.5.1 涂片、染色观察菌落特征,挑取可疑菌落,涂片染色镜检。 3.5.2 触酶试验参见《触酶试验标准操作规程》。 3.5.3 鉴定从血琼脂平板上挑取纯菌落,用微生物鉴定仪或传统生化反应进行细菌鉴定。 4. 药敏 参见《药物敏感性试验标准操作规程》及CLSI M100-S20最新版本文件。 5. 质量控制 参见《质量管理程序》。 6. 检验结果解释与分析 6.1 草绿色链球菌是人体正常菌群的一部分,通常是不致病的,只有当草绿色链球菌出
链球菌属检验
文件页码:1/3 1.概述 链球菌属是一群触酶试验阴性、呈链状排列的革兰阳性球菌。该菌属种类繁多,目前临床上仍沿用Lancefield血清学方法进行分群(A、B、C、D、F、G等18个群),或根据溶血现象(β溶血、α溶血或草绿色溶血、γ溶血或不溶血)进行分类。化脓性链球菌是临床上最重要的链球菌,属A群、β溶血的链球菌。 2. 标本类型 血液、尿液、痰、脑脊液、穿刺液、脓液等标本。 3. 鉴定 3.1 形态与染色革兰阳性球菌,固体培养基上呈单个或成双排列,较少呈链状排列,肉汤培养基中呈长链状排列,肺炎链球菌呈矛头状,成双或链状排列。 3.2 培养特性在血琼脂平板上菌落可出现三种溶血反应:α溶血周围有灰绿色的狭窄溶血环;β溶血周围有明显较大的完全透明环;γ溶血(不溶血性)无异常变化。肺炎链球菌菌落中央呈脐窝状、表面光滑、灰色、扁平,周围有草绿色α溶血环。 3.3 生化反应触酶试验阴性,对各种碳水化合物的分解因菌种而异,链球菌不被胆汁溶解。肺炎链球菌胆盐溶菌试验阳性,Optochin试验敏感(抑菌环>14mm)。 3.4 鉴别要点 3.4.1 本菌属特征革兰阳性球菌,单个、成双或链状排列,菌落较小,可出现β溶血、α溶血或不溶血,触酶试验阴性。 3.4.2 根据溶血及关键性试验,对链球菌进行推测性鉴定分群。 A群链球菌(化脓性链球菌):β溶血,杆菌肽敏感。 B群链球菌(无乳链球菌):β溶血,CAMP试验阳性,马尿酸钠试验阳性。 C群链球菌(似马链球菌、兽疫链球菌和马链球菌等):马尿酸钠、6.5%氯化钠耐盐试验均为阴性,血清学分型、杆菌肽耐药(抑菌试验阴性)。 D群肠球菌(粪肠球菌、屎肠球菌、鸟肠球菌等):胆汁七叶苷、6.5%氯化钠耐盐试验均为阳性,45℃生长。现归属于肠球菌属。 C、F及G群链球菌的鉴定常需用血清学方法。 非β溶血链球菌的鉴别见表1。 表1 非β溶血链球菌的鉴别 菌名Optochin试验胆汁溶菌试验胆汁七叶苷试验 肺炎链球菌+ + - 牛链球菌- - + 其他草绿色链球菌群- - - 3.5 操作步骤 3.5.1 涂片、染色观察菌落特征,挑取可疑菌落,涂片染色镜检。 3.5.2 触酶试验参见《触酶试验标准操作规程》。 3.5.3 鉴定从血琼脂平板上挑取纯菌落,用微生物鉴定仪或传统生化反应进行细菌鉴定。 4. 药敏 参见《药物敏感性试验标准操作规程》及CLSI M100-S20最新版本文件。 5. 质量控制 参见《质量管理程序》。
肠球菌检测
肠球菌检测 致病性检测耐药性检测肠球菌鉴定 1.07肠球菌为革兰阳性(G+)球菌,广泛分布于自然环境及人和动物消化道内。20世纪80年代以来,肠球菌严重感染的发生率和病死率明显升高,并且由于肠球菌的固有耐药和获得性耐药,使许多常用抗菌药物在治疗肠球菌感染时失败。因此,从分子水平对肠球菌致病因子、肠球菌引起的感染机制与治疗的研究显得尤为重要。 细菌分类学上,肠球菌属早期并不存在,现今的一些菌种本归属于链球菌属,1989年,依据Facklam和Collins的分类,肠球菌属内包括十二个种及一个变异株,它们是:粪肠球菌(E.faecalis)屎肠球菌(E.faecium) 鸟肠球菌(E.avium)酪黄肠球菌(E.casseliflavus) 坚忍肠球菌(E.durans)鸡肠球菌E.galinarum) 芒地肠球菌(E.mundii)恶臭肠球菌(E.maladoratum) 希拉肠球菌(E.hirae)孤立肠球菌(E.solitarius) 棉子糖肠球菌(E.raffinosus)假鸟肠球菌(E.pseudoavium) 粪肠球变异株(E.faecalis var)。 肠球菌属包括粪肠球菌、屎肠球菌、鸟肠球菌、类鸟肠球菌、棉子糖肠球菌等21个种。 鉴定 形态与染色革兰阳性球菌,单个、成双或短链排列。 培养特性在血琼脂平板上35℃培养18~24小时,形成较小、灰白色,有溶血或溶血环的菌落。在康凯琼脂平板上形成较小、干燥、粉红色菌落。 生化反应触酶试验阴性,分解甘露醇,胆汁七叶苷试验阳性,在含6.5%NaCl肉汤中生长,多数菌株PYR试验阳性,对杆菌肽耐药。 操作步骤 涂片、染色观察菌落特征,挑取可疑菌落,涂片染色镜检。 触酶试验参见《触酶试验标准操作规程》。 鉴定从血琼脂平板上挑取纯菌落,用微生物鉴定仪或传统生化反应进行细菌鉴定。 科标生物检测中心从事饲料、土壤肥料、微生物及生物制剂、化妆品及日化用品、木材及木制品、其他生物材料等生物相关产品的性能测试、成分分析以及配方研发等工作。09
肠球菌属(新)
第三节肠球菌属 广泛分布在自然界,常栖居人、动物得肠道与女性生殖道,就是引起医院内感染得重要病原菌。 一、分类: 链球菌科,具有D群链球菌得D抗原,过去就是属于链球菌属得D 群,但种系分类法用DNA杂交研究发现,证实粪肠球菌与屎肠球菌不同于链球菌属细菌,与链球菌同源程度低,所以现将其从链球菌属中划分出来,命名为肠球菌属。由16SrRNA序列分析与核酸杂交等,证实有19种肠球菌,分成5群,临床标本分离得多属于群2。 二、临床意义: 最多见于尿路感染,多与尿路器械操作、留置导尿、尿路结构异常有关,就是重要得医院感染病原菌。腹腔与盆腔创伤时肠球菌也就是常见细菌。肠球菌引起得菌血症常发生于有严重基础疾病得老年人、长期住院接受抗生素治疗得免疫功能低下得患者。近年来不断上升得肠球菌感染率与广泛使用抗生素出现得耐药性有关。 三、微生物特性: G+球菌,单个、成双或短链状排列,琼脂平板上生长得细菌呈球杆状,液体培养基中呈卵圆形、链状排列。无芽胞与荚膜,个别菌种有稀疏鞭毛。 兼性厌氧菌,最适温度35℃,大多数菌株在10℃与45℃均能生长。所有菌株在含6、5%NaCl肉汤中能生长,在40%胆汁培养基中能分解七叶苷。
多数菌种具有吡咯烷酮芳基酰胺酶,能水解吡咯烷酮-β-萘基酰胺(PYR),氧化酶(-),触酶(-)但某些菌株触酶可出现弱(+)。当粪肠球菌培养于含血得培养基中,可合成细胞色素氧化酶或触酶或两者皆有。 含D群链球菌D抗原。 与链球菌得显著区别: 能在高盐(6、5%NaCl)、高碱(pH9、6)、高胆汁(40%)培养基、10℃与45℃均能生长、对许多抗菌药物表现天然耐药 四、微生物检查: (一)检验程序:图6-3 (二)标本采集: 血、尿、创伤标本等,标本1h内接种完毕。 (三)标本直接检查: G染色镜检 (四)分离培养与鉴定: BAP 若标本中含G-杆菌,可用选择鉴别培养基: ①叠氮胆汁七叶苷琼脂——可抑制G-菌生长,肠球菌分解七叶苷为黑色菌落; ②哥伦比亚多黏菌素-萘啶酸琼脂(CAN)与苯乙基乙醇琼脂(PEA)。35℃、24h形成灰白色、不透明、表面光滑、直径0、5~1mm大小得圆形菌落,羊血平板上为α溶血或不溶血,粪肠球菌得某些菌株在马
肠球菌介绍
肠球菌-病菌简介 肠球菌 肠球菌为院内感染的重要病原菌,不仅可引起尿路感染、皮肤软组织感染,还可引起危及生命的腹腔感染、败血症、心骨膜炎和脑膜炎,由于其固有耐药性,所致感染治疗困难。本文就肠球菌的生物学特性、所致感染的临床表现、肠球菌在院内感染中的地位、致病性、耐药性及所致感染的治疗作一综述。 肠球菌(Enterococcus)属链球菌科,是人类和动物肠道正常菌群的一部分,通常在引起腹腔和盆腔感染所分离的混合菌丝中发现,既往认为肠球菌是对人类无害的共栖菌,但近年研究已证实了肠球菌的致菌力。在需氧革兰阳性球菌中,它是仅次于葡萄球菌的重要院内感染致病菌[1],肠球菌亦可引起院外感染。肠球菌不仅可引起尿路感染、皮肤软组织感染,还可引起危及生命的腹腔感染、败血症、心内膜炎和脑膜炎等[2]。 肠球菌-生物学特性及分类 肠球菌为圆形或椭圆形、呈链状排列的革兰阳性球菌,无芽胞,无鞭毛,为需氧或兼性厌氧菌。本菌对营养要求 肠球菌 较高,在含有血清的培养基上生长良好。在血平板上经37℃培养18小时后,可形成灰白色、不透明、表面光滑、直径0.5~1mm大小的圆形菌落,不同的菌株表现为不同的溶血现象。与同科链球菌的显著不同在于本菌在生化反应上能耐受高盐和胆汁培养基,并对许多抗菌药物表现为固有耐药。 根据其利用糖类的特征可将肠球菌分为3组[3,4]:第一组以鸟肠球菌(E.avium)为代表;
第二组以粪肠球菌(E.faecalis)等;包括尿肠球菌(E.faecium)等;第三组以坚韧肠球菌(E.durans)为代表。其中对人类致病者主要为粪肠球菌和尿肠球菌[3,5]。在临床分离菌中粪肠球菌占85%~95%、尿肠球菌占5%~10%,其余少数为坚韧肠球菌和其他肠球菌。 肠球菌-临床表现 尿路感染为粪肠球菌所致感染中最为常见的,绝大部分为院内感染。据报道16%的院内尿路感染由肠球菌引起, 肠球菌 仅次于大肠杆菌居第2位[1]。其发生多与留置导尿管、其他器械操作和尿路结构异常有关[3]。一般表现为膀胱炎、肾盂肾炎,少数表现为肾周围脓肿等。 腹腔、盆腔感染[4~6]在肠球菌感染中居第2位。腹腔、盆腔感染中肠球菌的检出率为7.6%,低于大肠杆菌(19.7%)和脆弱拟杆菌(10.7%)居第3位,常系与后两者之一的混合感染。由于在这些部位肠球菌为正常寄殖菌之一,其致病作用较难评价[14]。但抗感染治疗若不覆盖肠球菌并寻其清除,有时会无效。 败血症[7,8] 在肠球菌感染中居第3位。院内感染败血症中肠球菌所致者占8%,低于凝固酶阴性葡萄球菌(26%)和金黄色葡萄球菌(16%)居第3位,其中87%为粪肠球菌、9%为尿肠球菌、4%为坚韧肠球菌。入侵途径多为中心静脉导管、腹腔、盆腔化脓性感染、泌尿生殖道感染、烧伤创面感染等,相关危险因素为肿瘤,中性粒细胞减少,肾功能不全,糖尿病,应用肾上腺皮质激素,对肠球菌无抗菌活性的广谱抗生素如头孢菌素,外科手术、烧伤、多发性创伤,重症监护室及新生儿监护室等。病死率12.6%~57%。 心内膜炎[7,9] 约5%~20%的心内膜炎由肠球菌引起,为引起心内膜炎的第3位病原菌,其中93%为粪肠球菌、 肠球菌
条件治病菌之(粪)肠球菌研究观察
条件致病菌肠球菌 摘要:肠球菌不像大多数的乳酸菌一样,它不被认为是“安全可靠”(GRAS)。对于肠球菌的安全评价仍存有争议。虽然肠球菌被认为是“积极“或在奶酪技术中有用,但它的隔离种群已经作为对人类的条件致病菌出现。因此,这些细菌对发酵乳制品是否有益处于似是而非的地位,以为它存在有潜在的危险。本篇综述是概述了肠球菌的积极的和消极的两种特性,并举例说明这个菌的具有争议的特性。根据食品安全评价准则,我们提出对于每个潜在的技术应变逐个进行评估,并且建议肠球菌在发酵食品中使用前进行个别研究。 1.简介 肠球菌最初列为D群链球菌,这种分类可以追溯到由兰斯菲尔德建立的计划。1984年,肠球菌给予了新的位置被列为肠球菌属,在经过DNA-DNA和DNA-RNA杂交的研究后证明它与链球菌属有较远的关系(Schleifer and Kilpper-Balz, 1984)。到目前为止32种已被提议列入肠球菌属(2005年10月26号)。肠球菌种适宜在6.5%氯化钠,40%胆汁盐且pH值在9.6,并可以在60°C的环境下生存30分钟。大多数品种也可以在10℃至45℃之间生长(Moellering,1992;Flahautet al.,1996)。粪肠球菌和屎肠球菌都是人类消化道微生物自然存在的菌种,在胃肠道中因为个体差异其含量差异变化很大(在每克消化系统内容物中含有102和108)。肠球菌通常从食品、植物、水和土壤中分离,可能由于它的来源是粪便使得他们的天性在恶劣环境中比较耐受(Giraffa,2002)。在牛奶和奶酪制品中通常会找到粪肠球菌、屎肠球菌和少量的坚忍肠球菌,偶然也会发现小肠肠球菌和铅黄肠球菌。不同于其他乳酸菌,肠球菌不能被认为是“一般认为安全”(GRAS),并且它在水中检测是作为粪便污染物的指标的(Godfree et al.,1997)。一般认为对于肠球菌的安全评价程序是一个模棱两可的状况。一方面,肠球菌在作为奶酪技术中作为发酵培养物被认为是由积极作用的(Giraffa,2003);另一方面,它们被认为是新兴的人类病原体(Moellering,1992)。这篇综述主要是根据现有知识总结了肠球菌的积极和消极的性状,来强调这种菌属的争议性。食品安全准则着重强调了对抗生素耐药性和毒力的因素,这样使我们建议在发酵食品中使用肠球菌前应对这几项进行研究。 2.分类和鉴定 由于肠球菌的表型多样性,这使得肠球菌种的生理测试鉴定一直存在问题(Devriese et al.,1993;Park et al.,1999)。此外,物种鉴定的常规实验往往需要很长的培养时间(Facklam et al.,2002)。使用16S和23S rDNA基因的基因型鉴定方法更加的准确,虽然它们还不能区分所有肠球菌的物种(例如鹑鸡肠球菌和铅黄肠球菌有99.8%的16S rDNA的同源性)。这种方法已经成功的在应用:1)rRNA基因间隔区的特异PCR扩增技术(Naimi et al.,1997),ddl和van基因(Satake et al.,1997;Kariyama et al.,2000),ace 基因(Duh et al.,2001),sodA 基因(Jackson et al.,2004),2)转录调控基因Ef0027的扩增(Liu et al.,2005),3)ddl 基因(Ozawa et al.,2000),cpn60 基因(Goh et al.,2000)和atpA 基因(Naser et al.,2005)的测序,和4)利用5‘端引物(GTG)的细菌基因组重复序列PCR技术(Svec et al.,2005)。 有许多人试图区分从人分离的菌株和从食物分离的菌株,大部分主要关注的DNA指纹图谱。这些研究使用了多种分子分型方法,如扩增rDNA限制性分析(ARDRA)(Ulrich and Muller,1998),脉冲场凝胶电泳(PFGE)的DNA宏观限制模式(Deschee-maeker et al.,1997;Gambarotto et al.,2001;Vancanneyt et al.,2002),随机扩增多态性DNA(RAPD)- PCR检测(Cocconcelli et al.,1995;Descheemaeker et al.,1997;Andrighetto et al.,2001;Cosentino et al.,2004;Martin et al.,2005)和扩增片段长度多态性(AFLP)技术(Antonishyn et al.,2000;Willems et al.,2000;Vancanneyt et al.,2002)。脉冲场凝胶电泳(PFGE)已成功地用于表现临床和食品株之间的差异,以及从家禽和住院患者分离的菌株
抗肠球菌感染药物的合理选择
抗肠球菌感染药物的合理选择 第二军医大学长海医院药学部朱全刚胡晋红 https://www.360docs.net/doc/5514735542.html,/ 肠球菌原本是人体肠道中的正常寄居菌,但近年来,随着免疫抑制剂及抗菌药物的广泛使用,肠球菌已成为重要的条件致病菌,可引起人体多种组织脏器的严重感染,感染发生率正在逐年上升。更值得关注的是,从临床标本分离的肠球菌属细菌中,有许多为多重耐药菌株,特别是氨基糖苷类高水平耐药肠球菌以及耐万古霉素肠球菌的出现,给临床治疗带来了很大的困难。了解和认识肠球菌检测结果的临床意义、肠球菌感染治疗的抗生素选择与临床应用,对提高临床肠球菌感染治疗效果将非常重要。 解读肠球菌检测结果的临床意义 肠球菌可分离于痰、尿、胆汁、血液等多种标本中,主要有粪肠球菌和屎肠球菌两种。根据美国临床和实验室标准化研究所(CLSI)颁布的《抗菌药物敏感性试验执行标准》(2009年1月,第19版)规定,药敏试验的结果按敏感、中介、耐药和不敏感分类报告(见表1)。 下载 (98.27 KB) 2010-5-10 20:45 对于肠球菌属,药敏试验报告的药物通常分A、B、C和U组。A组为首选并常规报告的药物,包括氨苄西林和青霉素。B组为首选但有选择性报告的药物,包括达托霉素、利奈唑胺、奎奴普丁/达福普汀及万古霉素。此类药物通常用于对A组过敏、耐受或无效的病例。C组为替代性或补充性报告的药物,包括庆大霉素和链霉素,除非对庆大霉素和链霉素高水平耐药。U组为仅用于泌尿道感染的替代药物,包括环丙沙星、左氧氟沙星、诺氟沙星、呋喃妥因和四环素。 通常情况下,对青霉素敏感非产β内酰胺酶的肠球菌,可预报其对氨苄西林、阿莫西林、氨苄西林/舒巴坦、阿莫西林/克拉维酸、哌拉西林、哌拉西林/他唑巴坦敏感。但对氨苄西林敏感肠球菌不能推定其对青霉素敏感,如需要青霉素药敏结果,则必须对青霉素进行试验。对四环素敏感菌株也被认为对多西环素和米诺环素敏感,但对四环素中介或耐药的某些株可以对多西环素、米诺环素敏感。磷霉素仅用于尿道分离粪肠球菌,红霉素、氯霉素不是泌尿道分离株常规报告药物。 因产β内酰胺酶导致的对氨苄西林或青霉素耐药的肠球菌,用常规纸片法或稀释法无法可靠地检测出来,所以对血和脑脊液分离株推荐用头孢硝噻酚β内酰胺酶试验。β内酰胺酶试验阳性,提示肠球菌对青霉素耐药,同时也对酰胺基、羧基-和脲基青霉素耐药。 抗肠球菌感染药物概况及临床选择 抗肠球菌感染的药物有多种(见表2),临床医师应根据抗生素应用的临床指征和实验室分离株的耐药情况合理选用抗生素,控制细菌耐药性增长,延长抗生素使用寿命。对肠球菌感染的治疗, 需要结合肠球菌的最新流行病学资料及耐药特点来选择相应的治疗方案(见表3)。
乳球菌属
乳球菌属 (一)乳球菌属的特征 乳球菌属的特征:球或卵圆形细胞,单生、成对或成链状,有时因细胞伸长似杆状、致使某些乳球菌错误地分到乳杆菌属内,乳杆菌属原先的这两个种现已重新分类,分别作为乳酸球菌的两个亚种。 乳球菌是革兰氏阳性,兼性厌氧菌,不运动。通常不溶血,仅有某些乳酸乳球菌的菌株显示微弱的a-溶血反应。所有的乳球菌通常能在4%NaCl生长,仅乳酸乳球菌乳脂亚种。只耐2%NaCl。乳球菌能在10℃下生长,但不能在45℃下生长,此生长温度特征可用于区分它们与链球菌及肠球菌。大多数的乳球菌能与N 型抗血清起反应,但并非乳球菌属的所有菌株都能与之反应,从鸡粪和河水中分离的与N型抗血清起反应的某些运动菌株在遗传上与乳球菌、肠球菌或链球菌无密切关系。 (二)乳球菌属内种和亚种的特征 从核酸杂交和比较血清学研究结果说明乳球属的成员关系密切,但又不同与肠球菌和链球菌。乳球菌属内乳酸乳球菌又形成单一的DNA同源群。但按其表型特征又足以将它们分为三个亚种。 对于乳球菌属内的格氏乳球菌和鱼病肠球菌的关系问题,近年来又有些研究报道。Teixeira等从患轻度乳腺炎的水牛体分离到一些非典型的格氏乳球菌的菌株,他们将这些菌株的全细胞蛋白图像与格氏乳球菌和鱼病肠球菌的模式菌株的图像进行对比,并用肠球菌的基因探针试验以及使用羟磷灰石法进行DNA相关性的研究,结果证明这些分离的格氏乳球菌菌株与鱼病肠球菌极相似,认为它们同属一个种。 (三)乳球菌的应用 乳球菌中乳酸乳球菌3个亚种的一些菌株在乳制品的生产中占有较重要的地位。它们的单一或混合培养物可产生不同类型的乳酪和发酵奶,培养黄油和生产酪蛋白。 乳酸乳球菌的一些菌株可产生细菌素,如Nisin ,Lactococcin和Bacteriocin 等。Nisin这种乳球菌肽的抗菌物质作为一种无毒的天然食品防腐剂,已被50多个国家和地区广泛应用与乳制品、罐头食品、鱼类制品和乙醇饮料等的防腐和保鲜。在食品中加入十万分之几到万分之几的这种物质,就足以抑制引起食品腐败的许多革兰氏阳性菌的生长和繁殖。
肠球菌
肠球菌 摘要:肠球菌不像大多数的乳酸菌一样,它不被认为是“安全可靠”(GRAS)。对于肠球菌的安全评价仍存有争议。虽然肠球菌被认为是“积极“或在奶酪技术中有用,但它的隔离种群已经作为对人类的条件致病菌出现。因此,这些细菌对发酵乳制品是否有益处于似是而非的地位,以为它存在有潜在的危险。本篇综述是概述了肠球菌的积极的和消极的两种特性,并举例说明这个菌的具有争议的特性。根据食品安全评价准则,我们提出对于每个潜在的技术应变逐个进行评估,并且建议肠球菌在发酵食品中使用前进行个别研究。 1.简介 肠球菌最初列为D群链球菌,这种分类可以追溯到由兰斯菲尔德建立的计划。1984年,肠球菌给予了新的位置被列为肠球菌属,在经过DNA-DNA和DNA-RNA杂交的研究后证明它与链球菌属有较远的关系(Schleifer and Kilpper-Balz, 1984)。到目前为止32种已被提议列入肠球菌属(http://www.bacterio.cict.fr/bacdico/ee/Enterococcus.html,2005年10月26号)。肠球菌种适宜在6.5%氯化钠,40%胆汁盐且pH值在9.6,并可以在60°C的环境下生存30分钟。大多数品种也可以在10℃至45℃之间生长(Moellering,1992;Flahautet al.,1996)。粪肠球菌和屎肠球菌都是人类消化道微生物自然存在的菌种,在胃肠道中因为个体差异其含量差异变化很大(在每克消化系统内容物中含有102和108)。肠球菌通常从食品、植物、水和土壤中分离,可能由于它的来源是粪便使得他们的天性在恶劣环境中比较耐受(Giraffa,2002)。在牛奶和奶酪制品中通常会找到粪肠球菌、屎肠球菌和少量的坚忍肠球菌,偶然也会发现小肠肠球菌和铅黄肠球菌。不同于其他乳酸菌,肠球菌不能被认为是“一般认为安全”(GRAS),并且它在水中检测是作为粪便污染物的指标的(Godfree et al.,1997)。一般认为对于肠球菌的安全评价程序是一个模棱两可的状况。一方面,肠球菌在作为奶酪技术中作为发酵培养物被认为是由积极作用的(Giraffa,2003);另一方面,它们被认为是新兴的人类病原体(Moellering,1992)。这篇综述主要是根据现有知识总结了肠球菌的积极和消极的性状,来强调这种菌属的争议性。食品安全准则着重强调了对抗生素耐药性和毒力的因素,这样使我们建议在发酵食品中使用肠球菌前应对这几项进行研究。 2.分类和鉴定 由于肠球菌的表型多样性,这使得肠球菌种的生理测试鉴定一直存在问题(Devriese et al.,1993;Park et al.,1999)。此外,物种鉴定的常规实验往往需要很长的培养时间(Facklam et al.,2002)。使用16S和23S rDNA基因的基因型鉴定方法更加的准确,虽然它们还不能区分所有肠球菌的物种(例如鹑鸡肠球菌和铅黄肠球菌有99.8%的16S rDNA的同源性)。这种方法已经成功的在应用:1)rRNA基因间隔区的特异PCR扩增技术(Naimi et al.,1997),ddl和van基因(Satake et al.,1997;Kariyama et al.,2000),ace 基因(Duh et al.,2001),sodA 基因(Jackson et al.,2004),2)转录调控基因Ef0027的扩增(Liu et al.,2005),3)ddl 基因(Ozawa et al.,2000),cpn60 基因(Goh et al.,2000)和atpA 基因(Naser et al.,2005)的测序,和4)利用5‘端引物(GTG)的细菌基因组重复序列PCR技术(Svec et al.,2005)。 有许多人试图区分从人分离的菌株和从食物分离的菌株,大部分主要关注的DNA指纹图谱。这些研究使用了多种分子分型方法,如扩增rDNA限制性分析(ARDRA)(Ulrich and Muller,1998),脉冲场凝胶电泳(PFGE)的DNA宏观限制模式(Deschee-maeker et al.,1997;Gambarotto et al.,2001;Vancanneyt et al.,2002),随机扩增多态性DNA(RAPD)- PCR检测(Cocconcelli et al.,1995;Descheemaeker et al.,1997;Andrighetto et al.,2001;Cosentino et al.,2004;Martin et al.,2005)和扩增片段长度多态性(AFLP)技术(Antonishyn et al.,2000;Willems et al.,2000;Vancanneyt et al.,2002)。脉冲场凝胶电泳(PFGE)已成功地用于表现临床和食品株之间的差异,以及从家禽和住院患者分离的菌株的差异(van den Braak et al.,1998;Lemcke and Bulte,2000)。虽然电泳是区分肠球菌属菌株的黄
屎肠球菌研究进展
屎肠球菌研究进展 【摘要】屎肠球菌(Enterococcus Faecium)属肠球菌属,是人及动物肠道中正常菌 群的一部分,在一定条件下可以致病,由于其耐药性强,目前对于屎肠球菌的治疗还没有什么很好的特效药。在饲料应用上,屎肠球菌作为应用广泛的一类益生菌,进入宿主可产生多种益生功效。本文主要对屎肠球菌的生理特征,致病性,耐药性,功能特性及其在仔猪上的应用进行了综述。 【关键词】屎肠球菌肠球菌耐药性功能免疫仔猪应用 1.生理特征 屎肠球菌属肠球菌属,是人及动物肠道中正常菌群的一部分,肠球菌为圆形或椭圆形、呈链状排列的革兰阳性球菌,无芽胞,无鞭毛。生长温度为30℃~40℃,适宜pH为5.0~7.5。最适生长温度为35~38℃。屎肠球菌是兼性厌氧的乳酸菌,和大多数的乳酸菌一样,其耐酸性耐高温性等抗逆性能差。 2.致病性 1998 年7月下旬至9月初, 江苏南通及其周围地区发生成批生猪发病, 数 以千计病猪死亡;与病猪密切接触者也多人发病, 病原菌为肠球菌。经中国药品生物制品检定所鉴定为屎肠球菌。40例患者中男36例、女4例。按临床表现分为轻症型7例, 脑膜炎型19例。中毒性休克综合征型14例[1]。 屎肠球菌属于人体正常肠道菌群。通常认为其毒力较弱, 较少引起人体感染, 只有抵抗力差或者儿童较容易感染,然而近年来,其感染所致发病率有逐年上升的趋势。 屎肠球菌对大多数抗生素耐药, 故临床治疗有一定的困难,其感染后的病死率高达22% ~ 73% 。研究屎肠球菌耐药基因及毒力基因,探讨耐药机制及致病 机制以寻找有效的治疗方法是预防和控制屎肠球菌感染最有效的方法[2]。吴利先试验表明屎肠球菌临床感染株hyl基因阳性率明显高于非临床感染菌株, 从而认为hyl基因可能是屎肠球菌致病的毒力基因之一[3]。hyl是一种侵袭性酶, 属于胞外酶, 它也是一种蛋白水解酶, 能特异性地分解细胞外基质成分透明质酸以协 助细菌在组织内播散。hyl可以通过破坏结缔组织间质中的透明质酸,分解结缔组织的蛋白多糖, 使细菌容易在组织中穿过而协助病原菌扩散。
肠球菌属检验
文件页码:1/2 1.概述 肠球菌属包括粪肠球菌、屎肠球菌、鸟肠球菌、类鸟肠球菌、棉子糖肠球菌等21个种。 2. 标本类型 血液、尿液、痰、穿刺液、脓液等标本。 3. 鉴定 3.1 形态与染色革兰阳性球菌,单个、成双或短链排列。 3.2 培养特性在血琼脂平板上35℃培养18~24小时,形成较小、灰白色,有α溶血或γ溶血环的菌落。在康凯琼脂平板上形成较小、干燥、粉红色菌落。 3.3 生化反应触酶试验阴性,分解甘露醇,胆汁七叶苷试验阳性,在含6.5%NaCl肉汤中生长,多数菌株PYR试验阳性,对杆菌肽耐药。 3.4 鉴别要点 3.4.1 本菌属特征革兰阳性球菌,触酶阴性,在含6.5%NaCl肉汤中生长,胆汁七叶苷和耐盐试验阳性,45℃生长。 3.4.2与链球菌属和乳球菌属的鉴别肠球菌属能在pH9.6肉汤和45℃生长,胆汁七叶甘和耐盐试验阳性,而链球菌属和乳球菌属则相反。 3.4.3 粪肠球菌与屎肠球菌、鸟肠球菌的鉴别粪肠球菌不分解L-阿拉伯糖,分解山梨醇。屎肠球菌能分解L-阿拉伯糖,不分解山梨醇。鸟肠球菌分解L-阿拉伯糖和山梨醇。 3.5 操作步骤 3.5.1 涂片、染色观察菌落特征,挑取可疑菌落,涂片染色镜检。 3.5.2 触酶试验参见《触酶试验标准操作规程》。 3.5.3 鉴定从血琼脂平板上挑取纯菌落,用微生物鉴定仪或传统生化反应进行细菌鉴定。 4. 药敏 参见《药物敏感性试验标准操作规程》及CLSI M100-S19最新版本文件。 5. 质量控制 参见《质量管理程序》。 6. 检验结果解释与分析 在β-内酰胺酶阴性肠球菌中,氨苄西林药敏试验结果可预测阿莫西林-克拉维酸、氨苄西林-舒巴坦、哌拉西林和哌拉西林-他唑巴坦等敏感性。青霉素药敏试验可预测氨苄西林、阿莫西林、阿莫西林-克拉维酸、氨苄西林-舒巴坦、哌拉西林和哌拉西林-他唑巴坦等药敏结果。粪肠球菌中氨苄西林药敏结果可以预测亚胺培南的药敏结果。对于血培养和脑脊液培养分离出的肠球菌需做β-内酰胺酶检测,若β-内酰胺酶阳性,则对氨基青霉素、羧基青霉素和脲基青霉素均耐药。为耐万古霉素肠球菌(VRE)加做氯霉素、红霉素、四环素和利福平药敏试验,根据结果进行治疗。氨基糖苷类高水平耐药株HLAR可用庆大霉素120μg/ml纸片筛选,无抑菌环为耐药,抑菌环≥10mm为非HLAR,对于抑菌环在7-9mm之间的菌株需用稀释法确认。对于肠球菌属,头孢菌素类、氨基糖苷类(仅筛选高水平耐药性)、磺胺甲恶唑、甲氧苄啶和克林霉素在体外可能有活性(敏感),但在临床上耐药,所以不能报告肠球菌对这些药物敏感。 7. 临床意义 粪肠球菌和屎肠球菌主要引起医院感染,最常见为尿道感染(大部分与尿道器械操作、导尿等有关),其次为腹部和盆腔等部位的创伤和外科术后感染。近年来,肠球菌属氨苄西
