普化实验B论文实验十二铬、锰、铁、钴、镍
各种氧化态的锰之间的转化
一、摘要
针对锰的氧化态多样,颜色变化丰富的特点,我们讨论了多种氧化态锰之间的转化,并对影响转化的实验条件进行了具体分析,经过查阅文献资料,我们得出了锰的各种氧化态的性质和锰在各种氧化态之间转化的原理以及反应条件对其的影响。
二、前言
锰是一种多氧化态的金属元素,有二价,三价,四价,六价,七价五种常见氧化态。在生活中具有广泛应用,研究它各种氧化态之间的相互转化对工业生产具有重大意义,是推动我国冶金工业的关键。在上次的实验中,我们进行了锰二价、四价、六价和七价之间的相互转化和反应。发现对于同一个氧化态的锰在不同的条件下发生了不同的反应,于是我们针对这一现象进行了深入探讨。
三、内容
1、通过自由能来解释
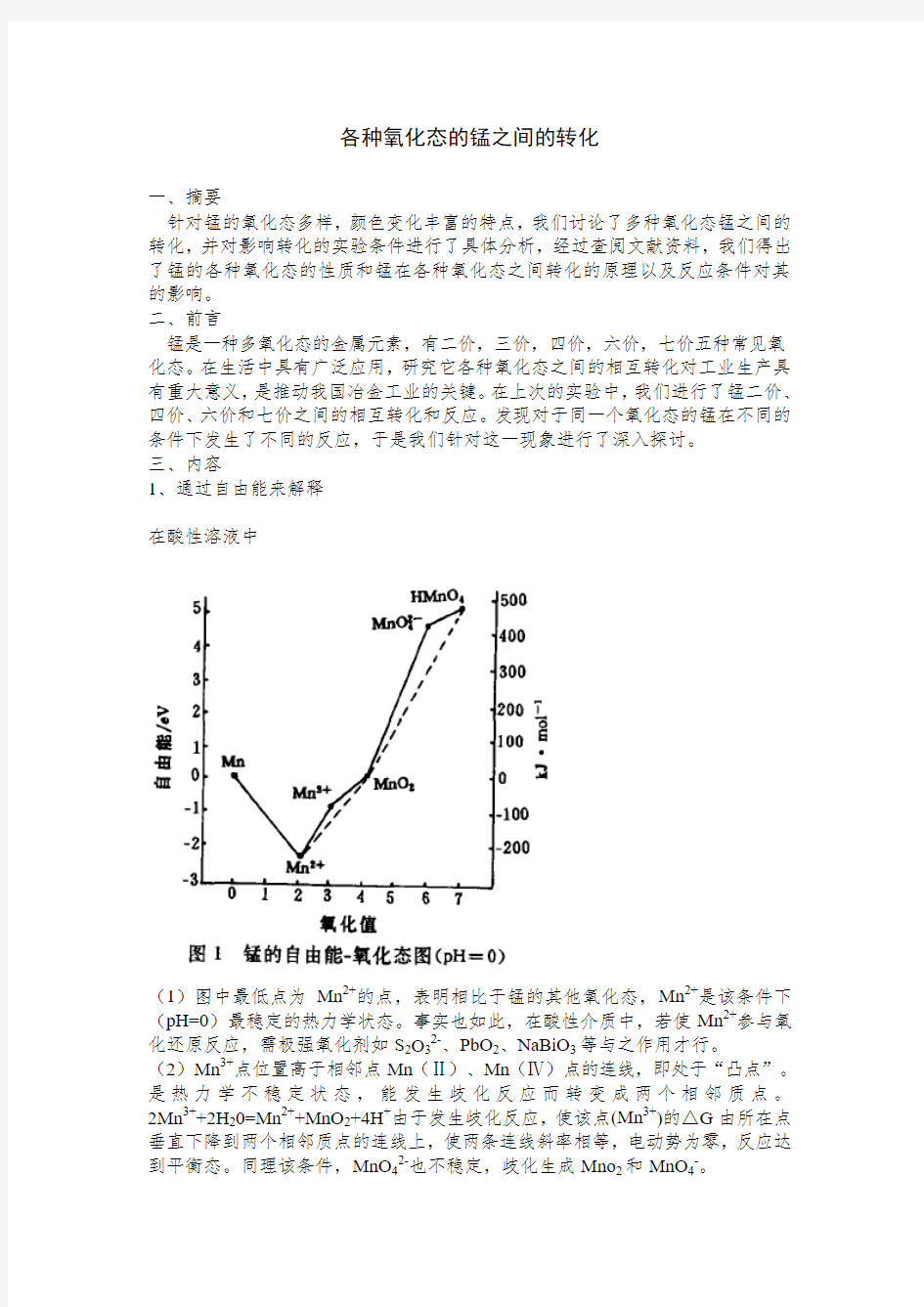
在酸性溶液中
(1)图中最低点为Mn2+的点,表明相比于锰的其他氧化态,Mn2+是该条件下(pH=0)最稳定的热力学状态。事实也如此,在酸性介质中,若使Mn2+参与氧化还原反应,需极强氧化剂如S2O32-、PbO2、NaBiO3等与之作用才行。
(2)Mn3+点位置高于相邻点Mn(Ⅱ)、Mn(Ⅳ)点的连线,即处于“凸点”。是热力学不稳定状态,能发生歧化反应而转变成两个相邻质点。2Mn3++2H20=Mn2++MnO2+4H+由于发生歧化反应,使该点(Mn3+)的△G由所在点垂直下降到两个相邻质点的连线上,使两条连线斜率相等,电动势为零,反应达到平衡态。同理该条件,MnO42-也不稳定,歧化生成Mno2和MnO4-。
(3)Mn(Ⅳ)点的位置处在相邻质点连线下方,即处于“凹”点位置。说明它比相邻质点的共存体系稳定。反应向归中反应方向进行。如在Mn2+过量情况下:
2MnO4-+3Mn2++2H20=5MnO2+4H+
(4)从氧化态看,在酸性介质中,可以稳定存在的Mn3+、MnO2、MnO4-都有一定的氧化能力,以MnO4-点的位置最高,氧化性最强,在酸性介质中是强氧化剂。
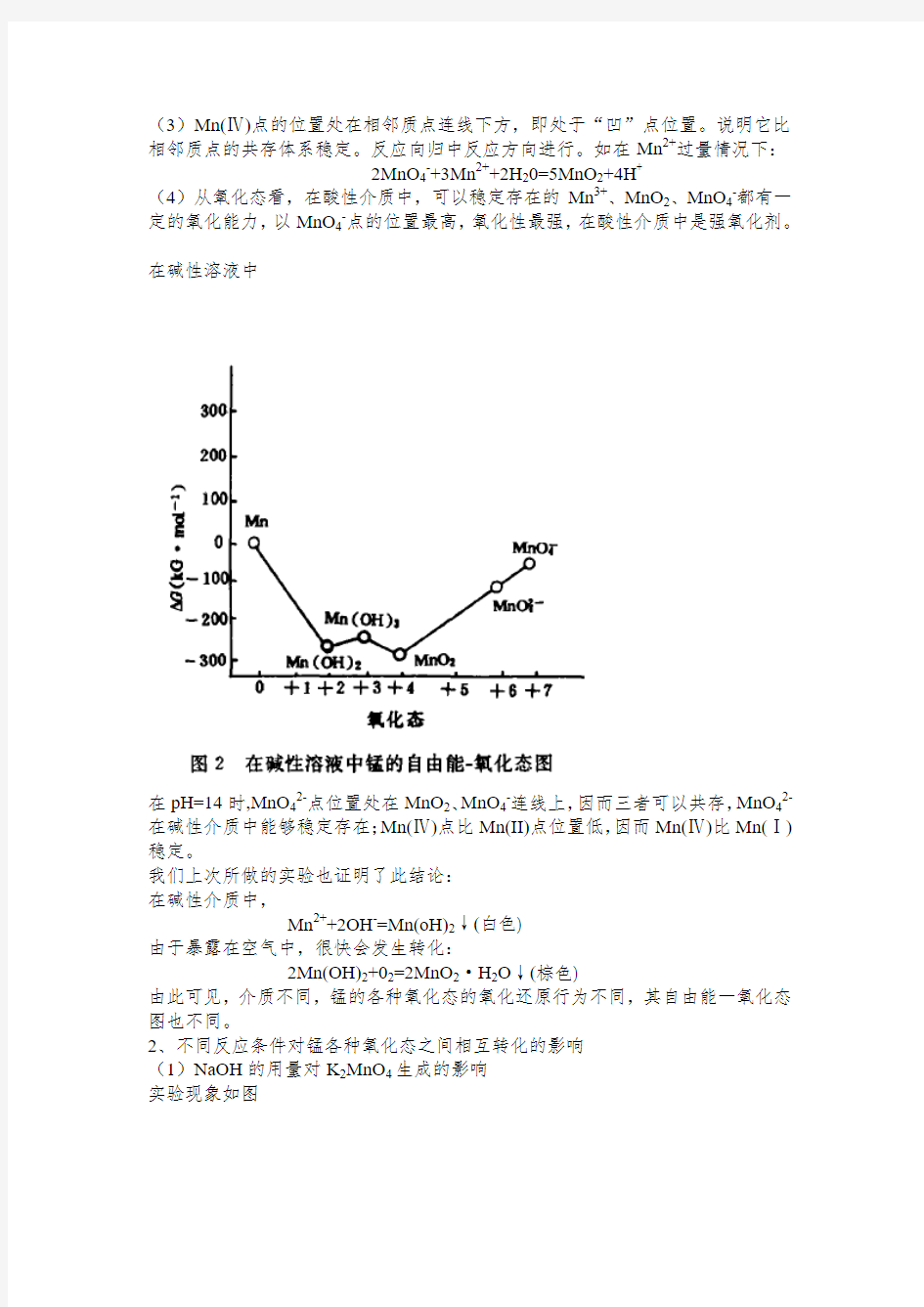
在碱性溶液中
在pH=14时,MnO42-点位置处在MnO2、MnO4-连线上,因而三者可以共存,MnO42-在碱性介质中能够稳定存在;Mn(Ⅳ)点比Mn(II)点位置低,因而Mn(Ⅳ)比Mn(Ⅰ)稳定。
我们上次所做的实验也证明了此结论:
在碱性介质中,
Mn2++2OH-=Mn(oH)2↓(白色)
由于暴露在空气中,很快会发生转化:
2Mn(OH)2+02=2MnO2·H2O↓(棕色)
由此可见,介质不同,锰的各种氧化态的氧化还原行为不同,其自由能一氧化态图也不同。
2、不同反应条件对锰各种氧化态之间相互转化的影响
(1)NaOH的用量对K2MnO4生成的影响
实验现象如图
在一般碱性的溶液里,锰的+VII、+VI、+IV氧化态对应的离子能够以相当的浓度共存。当碱性增强时,反应向有利于MnO42-生成的方向移动,随着MnO42-的不断生成,溶液的颜色发生上述一系列变化。
(2)KMnO 4的用量对K2MnO4生成的影响
取1/4米粒大小的MnO2固体于试管中,加入14滴6 mol·L -1NaOH溶液和一定量的0.01 mol·L-1KMnO4溶液,在80℃~90℃的水浴中加热,观察溶液颜色的变化。
实验现象如图:
反映出在NaOH的用量一定,KMnO4的用量相对较少时,得到绿色溶液的速度快,KMnO4过量时,它本身的紫红色会影响K2MnO4绿色溶液的观察(溶液长时间呈现蓝绿色)。故应使NaOH和KMnO4的用量相当。
将由1滴KMnO4生成的绿色溶液离心分离,转移清液至小试管中,用2 mol·L-1的H2SO4酸化得不到紫红色的溶液,溶液呈较浅的桔红色。采用3滴KMnO4进行实验时,很快得到紫红色的溶液,因此取用3滴KMnO4较为适宜。
(3)反应温度对实验现象的影响
K2MnO4绿色溶液的生成需要加热,振荡很难使溶液由紫色变成绿色,而温度的高低对绿色溶液的生成也会有较大的影响。取1/4米粒大小的MnO2固体于试管中,加入14滴6 mol·L-1 NaOH溶液和3滴0.01 mol·L-1KMnO4溶液,在不同的温度条件下加热反应,实验结果如图:
可知,温度越高,KMnO4向K2MnO4转化的速度越快。酒精灯直接加热时,溶液颜色变化快;水浴加热时,离心试管受热比较均匀,而且溶液一系列的颜色变化比较容易观察。所以实验时采取高温水浴加热(90℃左右)得到绿色溶液。(4)酸的用量对K2MnO4歧化反应的影响
取1/4米粒大小的MnO2固体于离心试管中,加入14滴6 mol·L -1NaOH溶液和3滴0.01 mol·L-1KMnO4溶液,在80℃~90℃水浴加热后得到深绿色K2MnO4溶液。离心分离,将清液转移到小试管中,逐滴加入2mol·L-1~3 mol·L-1~H2SO4酸化,考察K2MnO4的歧化情况。
实验现象见图:
可知,快速加入H2SO4得到的是红色溶液,放置一段时间后再加H2S04易得紫红色溶液。而用2mol·L-1~3 mol·L-1的硫酸都能得到紫红色溶液,即在这个浓度范围内硫酸的浓度对实验现象的影响不大,影响实验现象的主要因素是加人酸的速度。
综上所述,可得K2MnO4生成与歧化的实验方案:取1/4米粒大小的MnO2固体于离心试管中,加入12滴~14滴6 mol·L-1 NaOH溶液和3滴0.01 mol·L-1~KMnO4溶液,在80℃~90℃水浴加热后得到绿色K2MnO4溶液。离心分离,将清液转移到小试管中,逐滴加入2mol·L-1或3 mol·L-1H2SO 4酸化,放置,观察K2MnO4的歧化情况。
(5)Mn3+生成与歧化实验
通常实验中用MnSO4在冷的、强酸性环境下与KMnO4反应,观察红色溶液,即Mn3+的生成。再加碱中和,观察实验现象。实际操作过程中,许多条件对实验现象都有明显的影响。
仿照K2MnO4生成与歧化的研究思路,研究反应的温度、浓硫酸的用量、KMnO4溶液的用量等因素对Mn3+生成与歧化实验结果的影响,得到M3+生成与歧化反应的实验方案:取5滴0.2mol·L-1MnSO4溶液于试管中,加入5滴浓H2SO4后,放人冰水中冷却,再加入1滴~2滴0.01 mol·L-1KMnO4溶液,振荡后观察深红色溶液的生成。再用6 mol·L-1的NaOH中和,逐滴加入至20滴左右,观察溶液颜色变化及棕色沉淀的生成。
四、结论
锰各种氧化态之间的转化可以由自由能的大小解释,其中酸碱度、反应物用量、温度都会对锰各种氧化态之间的转化造成影响。
五、参考文献
[1]《普通化学实验(B)讲义》
[2]《对无机化学教材中引进锰的自由能——氧化态图的探讨》黄如丹赵宁1991
[3]《氧化态锰相互转化的实验教学研究》吕银华,付勤,余新武,刘江燕(湖北师
范学院化学与环境工程系,湖北黄石435002) No 3,2005 六、小组分工
实验七、八 铬、锰、铁、钴、镍
实验9 铬、锰及其化合物的性质 一、实验目的 掌握铬、锰主要氧化态化合物的性质。 二、实验原理 1、铬及其化合物的性质 Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2 Cr 2O 72-Cr 3+Cr 2+Cr 1.33-0.41-0.91-0.74 E A 0/V E B 0/V CrO 42-Cr(OH)3Cr(OH)2 Cr -0.13 -1.1 -1.4 在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3 + 的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质 中,+6氧化态稳定(CrO 42-)。 Cr 2O 3和Cr (OH )3显两性。 Cr 3+Cr(OH) 3 4]- ((绿色) -- 铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡: Cr 2O 72-CrO 4 2- +2H 2O H + 2+(橙红色)(黄色) 在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为CrO 42-。在酸性溶液中 CrO 42-转变为Cr 2O 72-。Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。 2、Mn 价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中: 酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+
H 2O 7Mn 2+ NaBiO 3H + Na +Bi 3+ MnO 4-25145+++5+2+ 碱性介质: Mn 2+2+OH - Mn(OH)2(白色沉淀) O 2 MnO(OH)2(棕色) Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。 Mn (VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4- E A 0/V E B 0/V MnO 4-MnO 42-MnO 2 MnO 4- MnO 42- MnO 2 0.56 2.26 0.56 0.60 MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。 三、实验内容 1.Cr 的化合物 (1)选择适当的试剂,完成Cr 化合物的转化 +Cr(OH)3(紫色)(灰蓝色)(绿色) OH -3Cr(OH)3+3HCl Cr 3+CrCl 3 H 2O + 3Cr(OH)3 + NaOH Na[Cr(OH)4]+ H 2O 2Cr 3+ + 3H 2O 2 +10OH - = 2CrO 42- + 8H 2O Cr 2O 72-CrO 4 2- +2H 2 O H + 2+(橙红色) (黄色) 2Cr 3++3S 2O 82-+7H 2O=Cr 2O 72-+6SO 42-+14H + (2)Cr 3+的性质 ① Cr(OH)3的生成和两性
UNS R30006钴铬钨合金成分
上海墨钜特殊钢主营:镍基合金、高温合金、耐蚀合金、超级不锈钢、精密合金、合结钢 UNS R30006钴铬钨合金成分 UNS R30006钴是一种钴合金。所引用的属性适用于退火条件。它在钴合金中具有相当低的延展性。另外,它具有适度的高导热性和适度的低拉伸强度。 UNS R30006机械性能 抗压强度1520兆帕220x 103磅/平方英寸 弹性(杨氏,拉伸)模量220GPa32x 106磅/平方英寸断裂伸长率1.0% 疲劳强度260兆帕38x 103磅/平方英寸 泊松比0.28 洛氏C 硬度40 剪切模量85GPa12x 106磅/平方英寸 拉伸强度:极限(UTS )900兆帕130x 103磅/平方英寸拉伸强度:屈服(证明)540兆帕78x 103磅/平方英寸UNS R30006热性能 聚变潜热320焦耳/克 熔融完成度(液体)1400°摄氏度2550°华氏度 融化开始(实心)1290°摄氏度2350°华氏度 比热容450J /kg·K0.11BTU /磅·°F 导热系数15瓦/米8.6BTU /小时·英尺·°F 热膨胀11μm / mK 1
UNS R30006电学特性 导电率:等体积IACS的1.6% 导电率:等重量(特定)IACS的1.7% 密度8.6克/厘米3540磅/英尺3 UNS R30006常用计算 弹性:终极(单位破裂工作)7.8兆焦/米3弹性:单位(弹性模量)670kJ/米3 重量刚度:轴向14分 重量刚度:弯曲23分 重量强度:轴向29分 重量强度:弯曲24点 热扩散率3.9m2/秒 抗热震性26分 UNS R30006合金成分 钴(Co)48.6至68.1 铬(Cr)27至32 钨(W) 4.0至6.0 镍(Ni)0至3.0 铁(Fe)0至3.0 碳(C)0.9至1.4 硅(Si)0至2.0 钼(Mo)0至1.0
实验五铁钴镍元素的鉴定
实验五:铁、钴、镍 铁、钴、镍属于第八族元素,又称铁系元素。氢氧化铁为红棕色固体,氢氧化亚铁为白色固体,但是氢氧化亚铁很容易被氧气氧化为氢氧化铁。在Fe3+的溶液中滴加NH4SCN会得到Fe3+的血红色配合物,而在Fe2+的溶液中滴加NH4SCN不会有沉淀生成,也不会有颜色; 在Co2+和Ni2+的溶液中滴加强碱,会生成粉红色氢氧化钴(II)和苹果绿色的氢氧化镍(II)沉淀,氢氧化钴(II)会被空气中的氧缓慢氧化为暗棕色的氧化物水合物Co2O3.xH2O。氢氧化镍(II)需要在浓碱溶液中用较强的氧化剂(如次氯酸钠)才能氧化为黑色的NiO(OH)。Co2O3和NiO(OH)会和水或酸根离子迅速发生氧化还原反应; 在水溶液中Fe3+和Fe2+的水配合物的颜色分别为淡紫色和淡绿色的形式存在。在Fe3+和Fe2+的溶液中分别滴加K4[Fe(CN)6]和K3[Fe(CN)6]溶液,都得到蓝色沉淀,它们是组成相同的普鲁士蓝和滕氏蓝,可以用来鉴定Fe3+和Fe2+的存在; 由于Co3+在水溶液中不稳定,所以一般是将Co2+的盐溶在含有配合物的溶液中,用氧化剂将其氧化,从而得到Co3+的配合物; 在含有Co2+的溶液中滴加NH4SCN溶液,会生成蓝色的[Co(NCS)4]2+,由此鉴定Co2+的存在; 在含有Ni2+的溶液中逐滴滴加氨水,会得到蓝色Ni2+的配合物,在此基础上继续滴加丁二酮肟,得到鲜红色鳌合物沉淀,由此鉴定Ni2+的存在。 实验内容: 1:Fe3+的氧化性、Fe2+的还原性及其离子鉴定 (1)离子鉴定:分别用K4[Fe(CN)6]、K3[Fe(CN)6]、NH4SCN和0.25%邻菲罗啉来鉴定Fe3+和Fe2+。(2)氧化还原特性; 2:铁、钴、镍的氢氧化物,Co2+和Ni2+二价氢氧化物的制备与对比; 3:钴、镍的配合物。Co2+和Ni2+的鉴定反应。 注意事项: (1)此次实验是定性实验,颜色变化是实验的关键内容,颜色变化和离子的价态一一对应,仔细观察实验并在实验报告中反映、思考; 药品:0.2M的FeCl3,2M的硫酸,铁粉,0.5M的NH4SCN,浓硝酸,0.1M的KMnO4,0.2M的Co(NO3)2,2M的NaOH,2M的HCl,0.2M的Ni(NO3)2,NH4Cl固体,6M的氨水,5%的H2O2,戊醇,饱和NH4SCN(溶解度:300C下,208克/100克水),0.2M的Ni(NO3)2,丁二酮肟(补加的药品)。
整理 铁、钴、镍的性质
实验六 铁、钴、镍的性质 一、实验目的 1、 试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质; 2、 试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。 二、实验原理 铁、钴、镍常见氧化值:+2和+3 另外 Fe 还有+6 1、Fe 2+ 、Co 2+ 、Ni 2+ 的还原性 (1)酸性介质 Cl 2 + 2Fe 2+ (浅绿)=2Fe 3+ (浅黄)+2Cl - (2)碱性介质 铁(II )、钴(II )、镍(II )的盐溶液中加入碱,均能得到相应的氢氧化物。 Fe(OH)2易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,最后成为红棕色的氢氧化铁。Co (OH )2也能被空气中的氧气慢慢氧化。 2、Fe 3+ 、Co 3+ 、Ni 3+ 的氧化性 由于Co 3+ 和Ni 3+ 都具有强氧化性,Co(OH)3,NiO(OH)与浓盐酸反应分别生成Co(II)和Ni(II),并放出氯气。CoO(OH)和NiO(OH )通常由Co (II )和Ni(II)的盐在碱性条件下用强氧化剂(Cl 2、Br 2)氧化得到。 Fe 3+ 易发生水解反应。Fe 3+ 具有一定的氧化性,能与强还原剂反应生成Fe 2+ 。 白色粉红绿色黑色 Co(OH)2Co(OH)3Fe(OH)2Fe(OH)3 还原性增强 氧化性增强 Ni (OH )2 Ni (OH )3 3、配合物的生成和Fe 2+ 、Fe 3+ 、Co 2+ 、Ni 2+ 的鉴定方法 (1)氨配合物 Fe 2+ 和Fe 3+ 难以形成稳定的氨配合物。在水溶液中加入氨时形成Fe(OH)2和Fe(OH)3沉淀。将过量的氨水加入Co 2+ 或Ni 2+ 离子的水溶液中,即生成可溶性的氨合配离子[Co(NH 3)6]2+ 或[Ni(NH 3)6]2+ 。不过[Co(NH 3)6]2+ 不稳定,易氧化成[Co(NH 3)6]3+ 。 (2)氰配合物 Fe 3+ ,Co 3+ ,Fe 2+ ,Co 2+ ,Ni 2+ 都能与CN -形成配合物。使亚铁盐与KCN 溶液作用得Fe(CN)2沉淀,KCN 过量时沉淀溶解。
铬、锰及其化合物的性质(精)
铬、锰及其化合物的性质 一、实验目的 掌握铬、锰主要氧化态化合物的性质。 二、实验原理 1、铬及其化合物的性质 Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2 Cr 2O 72-Cr 3+Cr 2+Cr 1.33-0.41-0.91-0.74 E A 0/V E B 0/V CrO 42-Cr(OH)3Cr(OH)2 Cr -0.13 -1.1 -1.4 在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3 + 的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质 中,+6氧化态稳定(CrO 42-)。 Cr 2O 3和Cr (OH )3显两性。 Cr 3+Cr(OH) 3 4]- ((绿色) -- 铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡: Cr 2O 72-CrO 4 2- +2H 2O H + 2+(橙红色)(黄色) 在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为CrO 42-。在酸性溶液中 CrO 42-转变为Cr 2O 72-。Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。 2、Mn 价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中: 酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+
H 2O 7Mn 2+ NaBiO 3H + Na +Bi 3+ MnO 4-25145+++5+2+ 碱性介质: Mn 2+2+OH - Mn(OH)2(白色沉淀) O 2 MnO(OH)2(棕色) Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。 Mn (VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4- E A 0/V E B 0/V MnO 4-MnO 42-MnO 2 MnO 4- MnO 42- MnO 2 0.56 2.26 0.56 0.60 MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。 三、实验内容 1.Cr 的化合物 (1)选择适当的试剂,完成Cr 化合物的转化 +Cr(OH)3(紫色)(灰蓝色)(绿色) OH -3Cr(OH)3+3HCl Cr 3+CrCl 3 H 2O + 3Cr(OH)3 + NaOH Na[Cr(OH)4]+ H 2O 2Cr 3+ + 3H 2O 2 +10OH - = 2CrO 42- + 8H 2O Cr 2O 72-CrO 4 2- +2H 2 O H + 2+(橙红色) (黄色) 2Cr 3++3S 2O 82-+7H 2O=Cr 2O 72-+6SO 42-+14H + (2)Cr 3+的性质 ① Cr(OH)3的生成和两性
2021年实验17 铬锰铁钴镍之欧阳学文创编
实验17 铬、锰、铁、钴、镍 欧阳光明(2021.03.07) 重点讲内容;: 性质 铬:《天大》P410—P414 铁;P423—427 锰;P418—421 钴;P423—427 镍;P423—427 一.实验目的; 1、掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。 2、掌握铬、锰重要氧化钛之间的转化反应及其条件 3、掌握铁、钴、镍配合物的生成和性质 4、掌握锰、铬、铁、钴、镍硫化物的生成和溶解性 5、学习Cr3+ Mn2+ Fe2+ Fe3+ Co2+ Ni2+ 二.实验原理; 铬、锰、铁、钴、镍是周期系第?周期第VIB—VIII族`元素,它们都是能形成多种氧化值的化合物。铬的重要氧化值为+3和+6;锰的重要氧化值为+2 +4 +6 +7; 铁、钴、镍的重要氧化值是+2 +3. Cr(OH)3是两性的氢氧化物。Mn(OH)2和Fe(OH)2都很容易被空气的O2氧化, Cr(OH)2也能被空气中的O2慢慢氧化。 由于Co3+和Ni3+都具有强氧化性。Co(OH)3和Ni(OH)3与浓盐酸反应,分别生成Co(II)和Ni(II)的盐在碱性条件下,用强
氧化剂氧化得到。例; 2Ni2+ + 6OH-+ Br2 ===2Ni(OH)3(s)+ 2Br-Cr3+和Fe3+都易发生水解反应。 Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+ 在酸性溶液中,Cr3+和MN2+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为CrO72-和MnO4- 在酸性条件下,利用Mn2+和NaBiO3的反应可以鉴定Mn2+,例; 2Mn2+ +5NaBiO3 +14H+ ===2MnO4- + 5Na+ + 5Bi3+ + 7H2O (HNO3介质) 在碱性溶液中,[Cr(OH)4]-可被H2O2氧化为CrO42- Cr3+ + 4OH- → [Cr(OH)4]- 2[Cr(OH)4]- + H2O2 + 2OH- → 2CrO42- + 8H20 (碱性介质) R酸与CrO42-生成有色沉淀的金属离子均有干扰 在酸性溶液中,CrO42-转变为Cr2O72-. Cr2O72-与H2O2反应生成深蓝色的CrO5.此可鉴定Cr3+ 在重铬酸盐溶液中,分别加入Ag+、Pb2+、Ba2+等。能生成相应的铬酸盐沉淀则: CrO72- + 2Ba2+ H+ + H2O →BaCrO4 + 2H+ Cr2O92-和MnO4-都具有强氧化性。 酸性溶液中CrO72-被还原为Cr3+. MnO4-在酸性、中性、强碱性溶液中的还原产物分别为Mn2+、MnO2沉淀和MnO42-。
实验十 钛钒铬锰
钛、钒、铬、锰 1. 实验目的 掌握钛、钒、铬、锰主要氧化态的化合物的重要性质及各氧化态之间相互转化的条件。练习沙浴加热操作。 2. 实验用品 仪器:试管、台秤、沙浴皿、蒸发皿 固体药品:二氧化钛、锌粒、偏钒酸铵、二氧化锰、亚硫酸钠、高锰酸钾液体药品:H2SO4(浓,1mol·L-1),H2O2(3%)、NaOH(40%,6mol·L-1,2mol·L-1,0.1mol·L-1),TiCl4、CuCl2(0.2mol·L-1)、HCl(浓,6mol·L-1,2mol·L-1,0.1mol·L-1)、NH4VO3(饱和)、K2SO4·Cr2(SO4)3·24H2O(0.2mol·L-1)、NH3·H2O(2mol·L-1)、K2Cr2O7(0.1mol·L-1)、FeSO4(0.5mol·L-1)、K2CrO4(0.1mol·L-1)、AgNO3(0.1mol·L-1)、BaCl2(0.1mol·L-1)、Pb(NO3)2(0.1mol·L-1)、MnSO4(0.2mol·L-1,0.5mol·L-1)、NH4Cl(2mol·L-1)、NaClO(稀)、H2S(饱和)、Na2S(0.1mol·L-1、0.5mol·L-1),KMnO4(0.1mol·L-1)、Na2SO3(0.1mol·L-1)。 材料:pH试纸、沸石 3. 实验内容 (1)钛的化合物的重要性质 1)二氧化钛的性质和过氧钛酸根的生成 在试管中加入米粒大小的二氧化钛粉末,然后加入2mL浓H2SO4,再加入几粒沸石,摇动试管加热至近沸(注意防止浓硫酸溅出),观察试管的变化。冷却静置后,取0.5mL溶液,滴入1滴3%的H2O2,观察现象。 另取少量二氧经钛固体,注入2mL 40%NaOH溶液,加热。静置后,取上层清液,小心滴入浓H2SO4至溶液呈酸性,滴入几滴3%H2O2,检验二氧化钛是否溶解。 2)钛(Ⅲ)化合物的生成和还原性 在盛有0.5mL硫酸氧钛的溶液(用液体四氯化钛和1mol·L-1(NH4)2SO4按1∶1的比例配成硫酸氧钛溶液)中,加入两个锌粒,观察颜色的变化,把溶液放置几分钟后,滴入几滴0.2mol·L-1CuCl2溶液,观察现象。由上述现象说明钛(Ⅲ)的还原性。 (2)钒的化合物的重要性质 1)取0.5g偏钒酸铵固体放入蒸发皿中,在沙浴上加热,并不断搅拌,观察并记录反应过程中固体颜色的变化,然后把产物分为四份。 在第一份固体中,加入1mL浓H2SO4振荡,放置。观察溶液颜色,固体是
铁钴镍元素性质
铁钴镍元素性质 浙江工业大学化材学院郝刚 一目的要求 1.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)、Ni(III)的氢氧化物和硫化物的生成与性质。 2.了解Fe2+的还原性和Fe3+的氧化性 3.了解Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II)和Ni(III)的配合物的生成和性质 4.了解Fe(II)、Fe(III)、Co(II)和Ni(II)等离子的鉴定方法 二基本操作 1、离心机的使用:先调零、开电源、调时间3-4min、调转速2000 rpm,结束后要调零 2、定性实验的试剂滴加练习巩固 3、通风橱的使用(饱和硫化氢、浓盐酸等) 三主要仪器和药品 1仪器:离心机,烧杯(200mL),试管,离心试管,试管夹,滴管 2药品:铜片,铁屑,(NH)2Fe(SO4)2·6H2O( 固),KCl(固) ,NH4Cl(固),HCl(2 mol?L-1,6 mol?L-1,浓),H2SO4(1mol?L-1),HAc(2mol?L-1),NaOH(2 mol?L-1,6mol?L-1),氨水(2mol?L-1,6mol?L-1,浓),K4[Fe(CN)6](0.1 mol?L-1), K3[Fe(CN)6](0.1mol?L-1),CoCl2(0.1mol?L-1),NiSO4(0.1mol?L-1),(NH)2Fe(SO4)2(0.1mol?L-1),KI(0.1 mol?L-1),FeCl3(0.1 mol?L-1),CuSO4(0.1mol?L-1),KSCN(0.1 mol?L-1,1mol?L-1),Na F(1 mol?L-1),溴水,H2O2(3%),CCl4,丙酮,丁二酮肟,碘化钾-淀粉试纸等。 四实验内容 1.铁、钴、镍的氢氧化物的生成和性质 (1)Fe(OH)2的生成和性质 制备除氧气的FeSO4溶液和NaOH溶液,再制备Fe(OH)2 Fe2+(浅绿)+2OH-=Fe(OH)2↓(白) Ps:较难!NaOH溶液滴管不可在液面上! Fe(OH)2加HCl溶液 Fe(OH)2(白↓)+ 2H+=Fe2+(浅绿)+ 2H2O Fe(OH)2加NaOH溶液 Fe(OH)2(白↓)+ OH-→无明显变化,说明不发生发应 Fe(OH)2在空气中静置 Fe(OH)2(白↓)+ O2 + 2 H2O =4 Fe(OH)3↓(棕红) (2)Co(OH)2的生成和性质 制备Co(OH)2(慢慢滴加) Co2+(粉红)+Cl-+ OH-=Co(OH)Cl ↓(蓝) Co(OH)Cl(蓝)+ OH-=Co(OH)2↓(粉红) 总反应:Co2+(粉红)+ 2OH-=Co(OH)2↓(粉红) Co(OH)2中加HCl溶液
无机化学实验二十四 铬、锰
实验二十四铬、锰 [实验目的] 了解铬、锰主要氧化态化合物的重要性质以及它们之间相互转化的条件。 [实验用品] 仪器:离心机、试管、离心试管、烧杯、酒精灯等 固体药品:MnO2、KMnO4、KOH*、KClO3* 液体药品:H2SO4(1mol·L-1,浓)、HCl(2mol·L-1,浓)、NaOH(2mol·L-1,6mol·L-1,40%)、HAc(2mol.L-1)、K2Cr2O7(0.1mol·L-1,饱和*)、K2CrO4(0.1mol·L-1)、KMnO4(0.01mol·L-1)、KI(0.1mol·L-1)、 NaNO2(0.1mol·L-1)、MnSO4(0.1mol·L-1)、NH4Cl(2mol.L-1)、Na2SO3(0.1mol·L-1)、 Na2S(0.1mol·L-1)、H2S(饱和)、BaCl2(0.1mol·L-1)、Pb(NO3)2(0.1mol·L-1)、 AgNO3(0.1mol·L-1)、3%H2O2、乙醇、 材料:木条、冰 [实验内容] 一、合物的重要性质 1.铬(VI)的氧化性 Cr2O72-(橙红色)离子转变为Cr3+(紫色)离子 在少量(5mL)重铬酸钾溶液中,加入少量你选择的还原剂,观察溶液颜色的变化(如果现象不明显,该怎么办?)写出反应方程式(保留溶液供下面实验3用)。 思考题: (1)转化反应须在何种介质(酸性或碱性)中进行?为什么?(H2SO4介质) (2)从电势值和还原剂被氧化后产物的颜色考虑,应选择哪些还原剂为宜?(Na2SO3、3%H2O2、Sn2+等)如果选择亚硝酸钠溶液,可以吗?(可以) 现象及解释:Cr2O72-(橙红色)离子转变为Cr3+(紫色)离子。 Cr2O72-+2H++4H2O2==2CrO5+5H2O 4CrO5+12H+==4Cr3++7O2↑+6H2O Cr2O72-+8H++3NO2-==2Cr3++3NO3-+4H2O 2.铬(VI)的缩合平衡 Cr2O72-(橙红色)离子与CrO42-(黄色)离子的相互转化。 思考题: Cr2O72-(橙红色)离子与CrO42-(黄色)离子在何种介质中可相互转化?
镍基合金
镍基合金管的性能、化学成分 以镍为基体,能在一些介质中耐腐蚀的合金,称为镍基耐蚀合金。此外,含镍大于30%,且含镍加铁大于50%的耐蚀合金,习惯上称为铁-镍基耐蚀合金(见不锈耐酸钢)。1905年美国生产的Ni-Cu合金(Monel合金Ni 70 Cu30)是最早的镍基耐蚀合金。1914年美国开始生产Ni-Cr-Mo-Cu型耐蚀合金(Illium R),1920年德国开始生产含Cr约15%、Mo约7%的Ni-Cr-Mo型耐蚀合金。70年代各国生产的耐蚀合金牌号已近50种。其中产量较大、使用较广的有Ni-Cu,Ni-Cr,Ni-Mo,Ni-Cr-Mo(W),Ni-Cr-Mo-Cu和Ni-Fe-Cr,Ni-Fe-Cr-Mo等合金系列,共十多种牌号。中国在50年代开始研制镍基和铁-镍基耐蚀合金,到70年代末,已有十多种牌号。 类别镍基耐蚀合金多具有奥氏体组织。在固溶和时效处理状态下,合金的奥氏体基体和晶界上还有金属间相和金属的碳氮化物存在,各种耐蚀合金按成分分类及其特性如下: Ni-Cu合金在还原性介质中耐蚀性优于镍,而在氧化性介质中耐蚀性又优于铜,它在无氧和氧化剂的条件下,是耐高温氟气、氟化氢和氢氟酸的最好的材料(见金属腐蚀)。 Ni-Cr合金主要在氧化性介质条件下使用。抗高温氧化和含硫、钒等气体的腐蚀,其耐蚀性随铬含量的增加而增强。这类合金也具有较好的耐氢氧化物(如NaOH、KOH)腐蚀和耐应力腐蚀的能力。 Ni-Mo合金主要在还原性介质腐蚀的条件下使用。它是耐盐酸腐蚀的最好的一种合金,但在有氧和氧化剂存在时,耐蚀性会显著下降。 Ni-Cr-Mo(W)合金兼有上述Ni-Cr合金、Ni-Mo合金的性能。主要在氧化-还原混合介质条件下使用。这类合金在高温氟化氢气中、在含氧和氧化剂的盐酸、氢氟酸溶液中以及在室温下的湿氯气中耐蚀性良好。 Ni-Cr-Mo-Cu合金具有既耐硝酸又耐硫酸腐蚀的能力,在一些氧化-还原性混合酸中也有很好的耐蚀性。 什么是超级不锈钢?镍基合金? 超级不锈钢、镍基合金是一种特种的不锈钢,首先在化学成分上与普通不锈钢304不同,是指含高镍,高铬,高钼的一种高合金不锈钢。其次在耐高温或者耐腐蚀的性能上,与304相比,具有更加优秀的耐高温或者耐腐蚀性能,是304不可取代的。另外,从不锈钢的分类上,特殊不锈钢的金相组织是一种稳定的奥氏体金相组织。 由于这种特种不锈钢是一种高合金的材料,所以在制造工艺上相当复杂,一般人们只能依靠传统工艺来制造这种特种不锈钢,如灌注,锻造,压延等等。 在许多的领域中,比如 1,海洋:海域环境的海洋构造物,海水淡化,海水养殖,海水热交换等。 2,环保领域:火力发电的烟气脱硫装置,废水处理等。 3,能源领域:原子能发电,煤炭的综合利用,海潮发电等。 4,石油化工领域:炼油,化学化工设备等。 5,食品领域:制盐,酱油酿造等 在以上的众多领域中,普通不锈钢304是无法胜任的,在这些特殊的领域中,特种不锈钢是不可缺少的,也是不可被替代的。近几年来,随着经济的快速发达,随着工业领域的层次的不断提高,越来越多的项目需要档次更高的不锈钢。。。。。特种不锈钢(超级不锈钢、镍基合金)。
d 区金属元素 铬、锰、铁、钴、镍 一、实验目的
d区金属元素(铬、锰、铁、钴、镍) 一、实验目的 1. 试验并掌握铬、锰主要氧化态化合物的重要性质及各氧化态之间相互转化的条件。 2. 试验并掌握二价铁、钴、镍的还原性和三价铁、钴、镍的氧化性。 3. 试验并掌握铁、钴、镍的配合物的生成及性质。 二、实验原理 位于周期表中第四周期的Sc~Ni称为第一过渡系元素,第一过渡系元素铬、锰、铁、钴、镍是最常见的重要元素。 铬为周期表中ⅥB族元素,最常见的是+3和+6氧化态的化合物。 +3价铬盐容易水解,其氢氧化物呈两性,碱性溶液中的 +3价氧化态铬以CrO2-形式存在,易被强氧化剂如Na2O2或H2O2氧化为黄色的铬酸盐。 2 CrO2- + 3 H2O2 + 2 OH-CrO42- + 4 H2O 常见+6价氧化态的铬化合物是铬酸盐和重铬酸盐,它们的水溶液中存在着下列平衡: 2 CrO42- + 2 H+Cr2O72- + H2O 除了加酸、加碱条件下可使上述平衡发生移动外,向Cr2O72-溶液中加入Ba2+、Ag+、Pb2+离子时,根据平衡移动规则,可得到铬酸盐沉淀。 2 Ba2+ + Cr2O72- + H2O BaCrO4↓(柠橙黄色) + 2 H+ 4 Ag+ + Cr2O72- + H2O Ag2CrO4↓(砖红色) + 2 H+ 2 Pb2+ + Cr2O72- + H2O PbCrO4↓(铬黄色) + 2 H+ 重铬酸盐是强氧化剂,易被还原成+3价铬(Cr3+溶液为绿色或蓝色)。 锰为周期表ⅦB族元素,最常见的是+2、+4、+7氧化态的化合物。 +2价态锰化合物在碱性介质中形成Mn(OH)2。Mn(OH)2为白色碱性氢氧化物,溶于酸及酸性盐溶液中,在空气中易被氧化,逐渐变成棕色MnO2的水合物[MnO(OH)2]。 4 Mn(OH)2 + O MnO(OH)2(褐色) + 2 H2O +2价态锰化合物在酸性介质中比较稳定,与强氧化剂(如NaBiO3、PbO2、S2O82-等)作用时,可生成紫红色MnO4-离子,这个反应常用来鉴别Mn2+。
无机化学实验第四版实验24铁钴镍
凡事贵在坚持 实验 24铁钴镍 一、实验目的 1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质; 2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。 二、实验内容(实验现象根据自己所观察到的为准) 1、Fe( Ⅱ )、 Co( Ⅱ )、 Ni( Ⅱ )的氢氧化物的生成和性质 项目 酸性 介质 Fe( Ⅱ ) 的氢氧 碱性化物 介质 实验步骤 0.5ml 氯水 +3d6mol/LH 2SO4,滴加 (NH4) 2 Fe(SO4)2 一试管加2ml 蒸馏水 ,3d6mol/LH 2SO4,煮沸, 加入少量的 (NH4) 2Fe(SO4)2晶体 一试管加3ml6mol/lNaOH溶液煮沸,冷却, 将NaOH 溶液用吸管加入到 (NH4) 2Fe(SO4)2 溶液底部 (此沉淀留到后面做Fe( Ⅲ )氧化性) 实验现象 黄色溶液 产生白色絮 状沉淀后 变为灰绿, 变成红褐色 解释或反应式 2Fe2++Cl 2=2Fe3+ +2Cl - Fe2++2OH ˉ=Fe(OH) 2↓ 4Fe(OH) 2+O 2+2H 2O=4Fe(OH) 3↓在 CoCl 2溶液中加入 Cl 2水无明显现象Co( Ⅱ )在酸性或中性环境中稳定CoCl 2溶液中加入—— 产生粉红色 Co2++2OH -=Co(OH) 2↓ Co( Ⅱ )的氢氧沉淀 NaOH 溶液,产生 化物沉淀慢慢变 的沉淀分两份一份置于空气中4Co(OH) 2+O 2+2H 2O=4Co(OH) 3↓ 棕黑 (此沉淀留到后面 做 Co( Ⅲ )氧化性 )一份加入 Cl 2水迅速变棕黑 - 2Co(OH) 2+Cl 2+2OH =2Co(OH) 3↓+ 在 NiSO 4溶液中加入 Cl 2水无明显现象Ni ( Ⅱ )在酸性或中性环境中稳定 Ni ( Ⅱ )的氢氧 NiSO 4溶液加入 —— 产生绿色沉 Ni 2++2OH -=Ni(OH) 2↓NaOH 溶液,产生淀 化物 沉淀分两份一份空气中放置无明显现象Ni(OH) 2几乎不会被空气氧化 (此沉淀留到后面 一份加 Cl 2水沉淀变棕色2Ni(OH) 2+ 做 Ni ( Ⅲ )氧化性 )Cl 2+2OH - =2Ni(OH) 3↓+2Cl -结论 Fe( Ⅱ )、 Co( Ⅱ )、 Ni ( Ⅱ )的氢氧化物都有还原性,其还原能力依Fe( Ⅱ )、 Co( Ⅱ )、 Ni ( Ⅱ )的顺 序减弱。 2、Fe(Ⅲ )、 Co(Ⅲ )、Ni( Ⅲ )的氢氧化物的生成和性质 项目实验步骤实验现象解释和 /或反应式 Fe( Ⅲ )的氢氧 沉淀 +浓 HCl无明显现象Fe(OH) 3+3H +=Fe 3++3H 2O FeCl 3溶液中加入 KI 溶液,并加入2Fe3++2I ˉ=2Fe2++I 2化物CCl 4层显紫色 CCl 4溶液碘单质溶于 CCl 4显紫色
实验八铬锰铁钴镍.doc
实验八、铬、锰、铁、钴、镍 Chromium, Manganese, Iron, Cobalt,Nickel 实验学时:3 实验类型:验证性 实验所属实验课程名称:大学基础化学实验-1 实验指导书名称:无机化学实验讲义 相关理论课程名称:大学基础化学-1 撰稿人:谢亚勃日期:2004.11.8 一、目的与任务: 本实验属验证性实验,是过渡元素教学过程中的一部分,对本科生进行这部分的理解和探索能力的培养方面有重要的作用。本实验将一部分课堂教学外的知识,放在实验课堂上进行研究。使学生在获得课堂知识的基础上,进一步探索元素及化合物的其它重要性质和反应,巩固和加深理解课堂上所学基本理论和基本知识;使学生受到观察实验现象,研究实验问题,总结实验结果及基本技能的训
练,培养学生具有观察问题和分析问题的能力、严谨的科学态度、实事求是的作风、勇于创新的精神。 二、内容、要求与安排方式: 1、实验项目内容通过过渡元素性质的验证,对混合液设计分离鉴定方案,并通过实验对实验元素的性质进行总结。 2、实验要求要求通过实验加深对重要过渡元素和其化合物性质的理解,掌握定性分析的原理和方法,掌握过渡元素和化合物性质的重要递变规律。 3、为了使实验达到教学目标,对学生的要求如下: (1)实验前要完成预习报告在阅读实验教材和参考资料的基础上,明确实验的目的和要求,弄清实验原理和方法,了解实验中的注意事项。预习报告简明扼要,切忌抄书,字迹清晰,实验方案思路清晰。 (2)实验过程要求认真按照实验内容和操作规程进行实验。如发现实验现象与理论不符,应独立思考,认真分
析查找原因,直到得出正确的结论。认真观察实验现象,记录实验数据。严格遵守实验室规则,爱护仪器设备,注意安全操作。 (3)实验记录要求在细心观察实验现象的基础上,将实验现象和数据记录预习报告上,不允许随手记在纸片或手上。 (4)实验报告要求实验报告是实验的总结,一般包括实验名称、实验目的、实验原理、实验现象、实验现象解释和讨论等几部分。 4、实验安排方式:本实验要求每一个学生独立完成,即1人/组。 三、场地与设备: 1、实验室名称:环化楼无机化学实验室,环化楼1407,使用面积100平方米 2、所用设备:pHS-3c酸度仪9台 3、消耗性器材:玻璃器
铬、锰及其化合物的性质(精)(可编辑修改word版)
2 7 4 2 7 B 4 3 2 2 7 4 4 2 7 铬、锰及其化合物的性质 一、实验目的 掌握铬、锰主要氧化态化合物的性质。 二、实验原理 1、铬及其化合物的性质 Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2 E A 0/V Cr O 2- 1.33 Cr 3+ -0.41 Cr 2+ -0.91 Cr E 0 /V CrO 2- -0.13 Cr(OH) -1.1 Cr(OH) -1.4 Cr 在酸性介质中,+2 氧化态具有强的还原性,+6 氧化态具有氧化性,Cr 3+ 的还原性都较弱,只有用强氧化剂才能将它们分别氧化为 Cr O 2-;在碱性介质中,+6 氧化态稳定(CrO 2-) 。 Cr 2O 3 和 Cr (OH )3 显两性。 OH - OH - Cr 3+ (×?é?£? r(OH)3£¨ ?òà?é?? [Cr(OH)4]£- H + + £¨ ?ìé?£? 铬(VI )最重要的化合物为 K 2Cr 2O 7,在水溶液中Cr O 2-和 CrO 2-存在下列平衡: 2 CrO 2- + 2 H + Cr O 2- + H 2O (??é?) £¨ 3èoì é?£? 在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为 CrO 42-。在酸性溶液中CrO 42-转变为 Cr 2O 72-。Cr 2O 72-与过氧化氢反应能生成深蓝色的 CrO 5,由此可以鉴定 Cr 3+。 2、Mn 价电子结构 3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2 +在酸性溶液中的稳定性大于在碱性溶液中: 酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化 Mn 2+ -0.74
镍钛合金是一种形状记忆合金
镍钛合金在医学上的应用 材料科学与工程学院 08级热处理1班 单珺 080102010005
一、镍钛合金的发展历史可分为3 个阶段: 1、1963 年~1986 年, 开展了初步的基础研究, 包括相变行为、晶体结构、显微组织、力学性能和冶炼加工制备技术等。20 世纪70 年代初, 美国Raychem 公司成功研制了NiTiFe 航空用液压管路接头和紧固件, 并应用于F14 战斗机中, 成为镍钛合金第一个成功的工业应用实例。、 2、1987 年~1994 年, 深入细致地研究了基础理论, 包括马氏体的三变体自协作形状恢复机制、线性超弹性和非线性超弹性的影响因素等 , 这个阶段是镍钛合金工程的鼎盛时期。 3、1995 年至今, 一些新的镍钛合金加工技术和基础理论问题不断出现, 如镍钛合金的表面改性技术、激光加工技术和脉动疲劳寿命测试等。 二、NiTi合金形状记忆效应的原理和特性 所谓"形状记忆效应"是指NiTi合金对它的金相几何形状有“记忆”本领,宏观而言,将一定形状的合金试样,低温塑形形变后,再将试样加热,试样又回复到它原来的形状,同时,产生巨大的回复力,例如横截面积为lcm2的合金棒,相变时产生850Okg的力。 记忆效应分三种:(1)单向记忆:低温金相受力变形,高温金相回到原状。C2)双向记忆:能记住高温与低温金相,随温度而发生顺、逆性变化。(3)全程记忆:机理不甚明了,可能是金相中的一种内应力场起了主要作用。形状记忆效应的应变量依合金的种类而各有所异,约5-20%之间(一般金属小于0.5%),NiTi合金为8%。 形状记忆合金具有“热弹性马氏体型”相变。NiTi合金为例,高温奥氏体相为体心立方有序晶体结构CaCl型B2晶格,低温马氏体相(M)为单斜畸变结构Bl9晶格,从B→M,存在一个对双程记忆效应起着重要作用的R相变。 在B2=R,R=M和R2=M的顺、逆相变中,母和子相中相邻原子位置不变,只是界面上原子发生协作位移-晶体切变。这种切变不但对记忆效应和超弹性起了重要作用,而且也使其耐疲劳性能优于一般金属材料。 具有记忆效应的合金已发现20余种,实用化潜力大的有镍基、铜基及铁基形状记忆合金。NliTi合金为近等原子比的NiTi金属间化合物。国产的医用NiTi合金,Mi含量为50-53%。相变温度可依临床而行相应的工艺处理;同时亦适当改变它的弹性模量。 三、镍钛合金的相变与性能 镍钛合金是一种形状记忆合金,形状记忆合金是能将自身的塑性变形在某一特定温度下自动恢复为原始形状的特种合金。它的伸缩率在20%以上,疲劳寿命达107次,阻尼特性比普通的弹簧高10倍,其耐腐蚀性优于目前最好的医用不锈钢,因此可以满足各类工程和医学的应用需求,是一种非常优秀的功能材料。 顾名思义,镍钛合金是由镍和钛组成二元合金,由于受到温度和机械压力的改变而存在两种不同的晶体结构相,即奥氏体相和马氏体相。镍钛合金冷却时的相变顺序为母相(奥氏体相)-R相-马氏体相。 R相是菱方形,奥氏体是温度较高(大于同样地:即奥氏体开始的温度)的时候,或者去处载荷(外力去除)时的状态,立方体,坚硬。形状比较稳定。而马氏
铬,锰及其化合物的相关性质的实验报告
1. 了解铬和锰的各种常见化合物的生成和性质。 2. 掌握铬和锰各种氧化态之间的转化条件。 3. 了解铬和锰化合物的氧化还原性及介质对氧化还原性产物的影响。 1. 铬 在酸性条件下,用锌还原Cr3+或Cr2O72-,均可得到天蓝色的Cr2+ 2Cr3+?+ Zn = 2Cr2+?+ Zn2+ Cr2O72-?+ 4Zn + 14H+?= 2Cr2+?+ 4Zn2+?+7H2O 灰绿色的Cr(OH)3呈两性: Cr(OH)3?+ 3H+?= Cr3+?+ 3H2O Cr(OH)3?+ OH-?= [Cr(OH)4]-(亮绿色)向含有Cr3+的溶液中加入Na2S并不生成Cr2S3,因为Cr2S3在水中完全水解: 2Cr3+?+ 3S2-?+ 6H2O = 2Cr(OH)3?+ 3H2S 在碱性溶液中,[Cr(OH)4]-具有较强的还原性,可被H2O2氧化为CrO42-: 2[Cr(OH)4]-?+ 3H2O2?+ 2OH-?= 2CrO42-?+
8H2O 但在酸性溶液中,Cr3+的还原性较弱,只有象K2S2O8或KMnO4等强氧化剂才能将Cr3+氧化为Cr2O72-:? 2Cr3+?+ 3S2O82-?+ 7H2O = Cr2O72-?+ 6SO42-?+ 14H+ 在酸性溶液中,Cr2O72-是强氧化剂,例如: K2Cr2O7 + 14HCl(浓)= 2CrCl3?+ 3Cl2?+2KCl + 7H2O 重铬酸盐的溶解度较铬酸盐的溶解度大,因此,向重铬酸盐溶液中加Ag+、Pb+、Ba2+等离子时,通常生成铬酸盐沉淀,例如: Cr2O72-?+ 4Ag+?+ H2O = 2Ag2CrO4(砖红色)+ 2H+ Cr2O72-?+ 2Ba2+?+ H2O = 2BaCrO4(黄色)+2H+ 在酸性溶液中,Cr2O72-与H2O2能生成深蓝色的加合物CrO5,但它不稳定,会很快分解为Cr3+和O2。若被萃取到乙醚或戊醇中则稳定得多。主要反应为: Cr2O72-?+ 4H2O2?+ 2H+?= 2CrO(O2)2(深蓝)+ 5H2O CrO(O2)2?+(C2H5)2O = CrO(O2)2?(C2H5)2O(深蓝)
钴铬合金的生物安全性
口腔材料钴铬合金的作用 由于口腔材料镍铬烤瓷牙风波在人们心中留下了阴影,所以很多人都转而将目光投向另一种“贱金属”烤瓷牙,钴铬合金烤瓷牙。那么这种钴铬合金的烤瓷牙有什么特点呢?它对人体是不是有害呢? 口腔材料钴铬合金的烤瓷牙其实是另一种贱金属烤瓷牙。我们知道,构成镍铬合金烤瓷牙金属支架的主要成分为镍77.95%、铬12.60%,由于镍金属相对于别的金属来说活性较高,存在金属的游离释放,产生牙龈的游离黑线,和轻微的毒性反应,钴铬合金则由性质较稳定的钴金属替代了镍金属,相比较而言,金属性质稳定的多,对人的不良刺激小一些。牙龈黑线出现的几率小一些。 口腔材料钴铬生物合金烤瓷牙的特点: 1. 口腔材料钴铬合金中钴为主要元素,抗腐蚀性极强,且具有很高的强度以及硬度,从而增加钢托的使用寿命; 不含贵金属的合金的腐蚀表现同贵金属合金的有根本不同。 2、保护牙体硬组织和牙髓。钴铬合金烤瓷牙有良好的边缘封闭效果。因为需做烤瓷牙的牙齿往往是变色龋坏多的牙齿,烤瓷冠制作完成后,整个真牙就被它围在中间,咀嚼时的力量作用在牙冠上,不会折裂或崩溃,而粘结瓷牙冠的粘结剂及瓷层,有良好的绝缘性,防止了外界刺激对牙髓的伤害。倘若边缘封闭不好,烤瓷冠和真牙之间不够密合,那么食物中的残渣就会渗入其中,细菌也会在里面繁殖,从而出现“根基”不牢而被迫拔牙的结果。 3、经济又能耐用,口感好,适应快,固位好,易于清洁。 4、可以搭配各种牙齿,恢复其美观及良好的咬合功能,使患者有更多的选择。 不过,口腔材料钴铬合金烤瓷牙它始终是一种廉价的材料,对人的不良刺激只是相对于普通的镍铬合金小一些,并不是可以完全防止不良刺激和牙龈黑线,还不是最理想的修复材料,在一些发达国家,人们大多是选择贵金属或全瓷(无金属内冠)的烤瓷牙,而在中国,由于消费能力的限制,非贵金属仍然有不小的市场。
整理 铁 钴 镍的性质
实验六铁、钴、镍的性质 一、实验目的 1、试验并掌握铁、钴、镍氢氧化物的生成和氧化还原性质; 2、试验并掌握铁、钴、镍配合物的生成及在离子鉴定中的作用。 二、实验原理 铁、钴、镍常见氧化值:+2和+3 另外 Fe还有+6 1、Fe2+、Co2+、Ni2+的还原性 (1)酸性介质 + 2Fe2+(浅绿)=2Fe3+(浅黄)+2Cl- Cl 2 (2)碱性介质 铁(II)、钴(II)、镍(II)的盐溶液中加入碱,均能得到相应的氢氧化物。Fe(OH) 易被空气中的氧气氧化,往往得不到白色的氢氧化亚铁,而是变成灰绿色,2 也能被空气中的氧气慢慢氧化。 最后成为红棕色的氢氧化铁。Co(OH) 2 2、Fe3+、Co3+、Ni3+的氧化性 由于Co3+和Ni3+都具有强氧化性,Co(OH) ,NiO(OH)与浓盐酸反应分别生成Co(II) 3 和Ni(II),并放出氯气。CoO(OH)和NiO(OH)通常由Co(II)和Ni(II)的盐在碱性
条件下用强氧化剂(Cl 2、Br 2 )氧化得到。 Fe3+易发生水解反应。Fe3+具有一定的氧化性,能与强还原剂反应生成Fe2+。 3、配合物的生成和Fe2+、Fe3+、Co2+、Ni2+的鉴定方法 (1)氨配合物 Fe2+和Fe3+难以形成稳定的氨配合物。在水溶液中加入氨时形成Fe(OH) 2和Fe(OH) 3 沉淀。将过量的氨水加入Co2+或Ni2+离子的水溶液中,即生成可溶性的氨合配离子 [Co(NH 3) 6 ]2+或[Ni(NH 3 ) 6 ]2+。不过[Co(NH 3 ) 6 ]2+不稳定,易氧化成[Co(NH 3 ) 6 ]3+。 (2)氰配合物 Fe3+,Co3+,Fe2+,Co2+,Ni2+都能与CN-形成配合物。使亚铁盐与KCN溶液作用得Fe(CN) 2沉淀,KCN过量时沉淀溶解。 FeSO 4+2KCN=Fe(CN) 2 +K 2 SO 4 Fe(CN) 2+4KCN=K 4 [Fe(CN) 6 ] 从溶液中析出来的黄色晶体是K 4[Fe(CN) 6 ]·3H 2 O,叫六氰合铁(II)酸钾或亚铁 氰化钾,俗称黄血盐。在黄血盐溶液中通入氯气(或用其它氧化剂),把Fe(II)氧 化成Fe(III),就得到六氰合铁(III)酸钾(或铁氰化钾) K 3[Fe(CN) 6 ]。 2 K 4[Fe(CN) 6 ]+C1 2 =2 K 3 [Fe(CN) 6 ]+2KCl 它的晶体为深红色,俗称赤血盐。赤血盐在碱性溶液中有氧化作用。
