锂电工作原理及放电图

剖析锂电池的工作原理
锂电池的充电
在各种充电电池里,锂电池的充电属于很简单的了,比镍镉、镍氢电池要简单太多了。
锂电池的充电方式是限压横流方式。
充电开始时,应先检测待充电电池的电压,如果电压低于3V,要先进行预充电,充电电流为设定电流的1/10,一般选0.05C左右。电压升到3V后,进入标准充电过程。标准充电过程为:以设定电流进行恒流充电,电池电压升到4.20V时,改为恒压充电,保持充电电压为4.20V。此时,充电电流逐渐下降,当电流下降至设定充电电流的1/10时,充电结束。
一般锂电池充电电流设定在0.2C至1C之间,电流越大,充电越快,同时电池发热也越大。而且,过大的电流充电,容量不够满,因为电池内部的电化学反应需要时间。就跟倒啤酒一样,倒太快的话会产生泡沫,反而不满。
术语解释:充放电电流一般用C作参照,C是对应电池容量的数值。电池容量一般用Ah、mAh表示,如M8的电池容量1200mAh,对应的C就是1200mA。0.2C就等于240mA。
下面是锂电池典型充电曲线图:
锂电池的放电
对电池来说,正常使用就是放电啦。
锂电池放电只需要注意很少的几点:第一,放电电流不能过大,过大的电流导致电池内部发热,有可能会造成永久性的损害。在手机上,这个倒是没有问题的,可以不考虑。第二,绝对不能过放电!锂电池最怕过放电,一旦放电电压低于2.7V,将可能导致电池报
废。好在手机电池内部都已经装了保护电路,电压还没低到损坏电池的程度,保护电路就会起作用,停止放电。
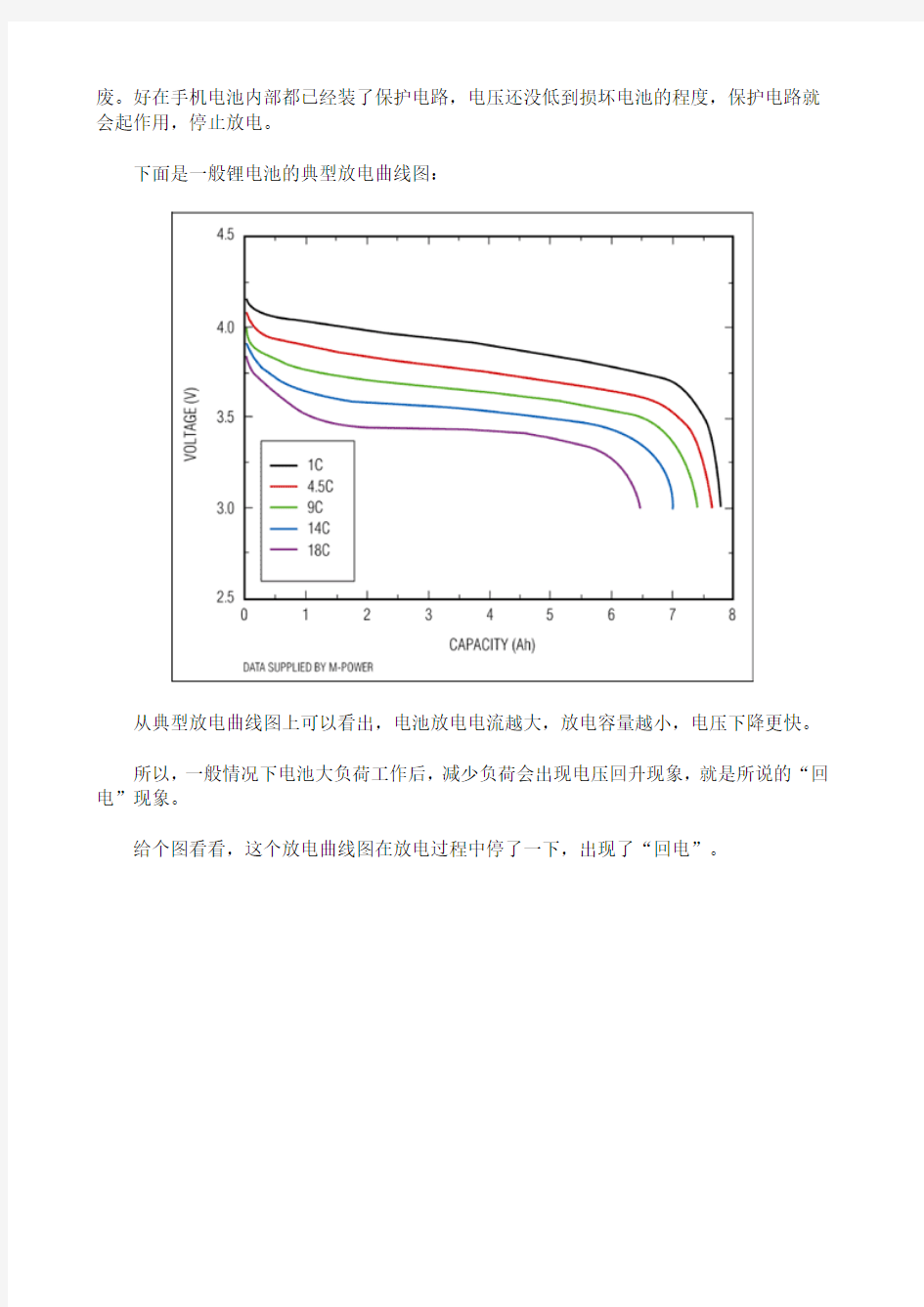
下面是一般锂电池的典型放电曲线图:
从典型放电曲线图上可以看出,电池放电电流越大,放电容量越小,电压下降更快。
所以,一般情况下电池大负荷工作后,减少负荷会出现电压回升现象,就是所说的“回电”现象。
给个图看看,这个放电曲线图在放电过程中停了一下,出现了“回电”。
锂电池的寿命
锂电池每一个“充电——放电”过程,称为一个充电循环。锂电池从工作开始,每个循环后的容量都会出现轻微下降,这是由电池的电极材料的性质决定的。
按照国家标准,当容量下降到额定容量的60%时,即认为电池寿命结束。通常锂电池寿命不小于500次循环,就是指500次充电循环后,容量不小于额定容量的60%。
提高锂电池寿命的方法
一般的充放电循环,是“充满——放空”。这样对电极材料来说负荷比较大。每次充电不要完全充满,放电不要完全放空,可以大大延长寿命。一般来说,5至10个浅放电周期等于1个满放电周期。另外,降低充电电压,也可以延长电池寿命。
其实,不要把电池看得太娇贵,锂电池的自然衰减还是很明显的,一块新电池,存放时间长了,容量一样下降。充满电存放的话,下降的更厉害。
有测试说,如果把充放电过程控制在80%的容量,循环寿命可超过2000次。
所以,不用每次把电池用完才充,也不要非得充到100%。另外,插电脑上传文件时,USB口充电功能没必要关闭,那一点时间的充电不会影响循环寿命,因为那样根本到不了一个循环。
电池在存放时,应该是充到一半的。
发两个图,对比一下,是BL5C电池的放电容量测试图,一个是三洋OEM的,一个是比亚迪OEM的。
先上三洋的:
比亚迪的:
上两张图,其中三洋的BL5C额定容量是970mAh,比亚迪的BL5CA额定容量是700。容量不一样,不用对比。
但看得出来,比亚迪的放电曲线不够平滑,放电结束时截止也太快。不知道现在比亚迪的质量是否和三洋的一样了。
锂电池循环充放电寿命问题
锂电池循环充放电寿命问题 锂电池寿命问题:循环充放电一次就是少一次寿命吗?回答这个问题前,我们先来说说锂电池循环寿命的测试条件。 循环就是使用,我们是在使用电池,关心的是使用的时间,为了衡量充电电池到底可以使用多长时间这样一个性能,就规定了循环次数的定义。实际的用户使用千变万化,因为条件不同的试验是没有可比性的,要有比较就必须规范循环寿命的定义。 锂电池充电器 1国标规定的锂电池循环寿命测试条件及要求:在环境温度20℃±5℃的条件下,以1C充电,当电池端电压达到充电限制电压4.2V时,改为恒压充电,直到充电电流小于或等于1/20C,停止充电,搁置0.5h~1h,然后以1C电流放电至终止电压2.75V,放电结束后,搁置0.5h~1h,再进行下一个充放电循环,直至连续两次放电时间小于36min,则认为寿命终止,循环次数必须大于300次。 2国标规定的解释: A.这个定义规定了循环寿命的测试是以深充深放方式进行的 B.规定了锂电池的循环寿命按照这个模式,经过≥300次循环后容量仍然有60%以上 然而,不同的循环制度得到的循环次数是截然不同的,比如以上其它的条件不变,仅仅把4.2V的恒压电压改为4.1V的恒压电压对同一个型号的电池进行循环寿命测试,这样这个电池就已经不是深充方式了,最后测试得到循环寿命次数可以提高近60%。那么如果把截止电压提高到3.9V进行测试,其循环次数应该可以增加数倍。3这个关于循环充放电一次就少一次寿命的说法,我们要注意的是,锂电池的充电周期的定义:
一个充电周期指的是锂电池的所有电量由满用到空,再由空充电到满的过程。而这并不等同于充电一次。另外大家在谈论循环次数的时候不能忽视循环的条件,抛开规则谈论循环次数是没有任何意义的,因为循环次数是检测电池寿命的手段,而不是目的!4▲误区:许多人喜欢把手机锂离子电池用到自动关机再充电,这个完全没有必要。 实际上,用户不可能按照国标测试模式对电池进行使用,没有一个手机会在2.75V 才关机,而其放电模式也不是大电流恒流放电,而是GSM的脉冲放电和平时的小电流放电混合的方式。 有另外一种关于循环寿命的衡量方法,就是时间。有专家提出一般民用的锂离子电池的寿命是2~3年,结合实际的情况,比如以60%的容量为寿命的终止,加上锂离子电池的时效作用,用时间来表述循环寿命我认为更为合理。 注意事项 对于锂离子电池,没有必要用到关机再充电,锂离子电池本来就适合用随时充电的方式进行使用,这也是他针对镍氢电池的最大优势之一,请大家善加利用这个特性。锂电池完全充放电一次(完全充放电并不等同于一次充放电),循环寿命才减少一次。 电池保养常识: 1 记忆效应镍氢充电电池上常见的现象。具体表现就是:如果长期不充满电就开始使用电池的话,电池的电量就会明显下降,就算以后想充满也充不满了。所以保养镍氢电池的重要方式就是:电必须用完了才能开始充电,充满了电了才允许投入使用。现在常用的锂电池的记忆效应是可以小到忽略不计的。2 完全充电,完全放电
锂离子电池原理
本文由艾克博士贡献 pdf文档可能在WAP端浏览体验不佳。建议您优先选择TXT,或下载源文件到本机查看。 锂离子电池的原理及应用 陈硕冰 徐林楠 傅虹桥 李为真 卢云杨 摘要:分析了锂离子电池的原理,简明分析了锂离子电池的基本结构和组成单元,分析了锂 离子电池正负极材料的晶体结构, 简单介绍了锂离子电池的应用范围和前景以及正确使用锂 离子电池的方法。 关键词:锂离子电池;原理;结构;应用 1 引言 无论是军用还是民用,都迫切需要重量轻、体积小、性能高的电源系统,当前各种化学 电源的研制、 开发和投入使用正在不断地满足这方面的要求。 我们知道一个化学电源的电动 + 势 E=φ —φ ,从这个式子中可以看出要获得高的电池电动势就必须使正极的相对电极电 势很正而负极的相对电极电势很负,从周期表上看,则应尽量选用活泼金属为负极,活泼非 金属为正极,正是基于这一点,锂电池的研制引起了人们很大的关注。锂离子电池是在锂金 属电池的基础上发展起来的。由于锂金属电池在充放电时出现锂枝晶,刺破隔膜造成短路, 出现爆炸等现象,其发展受到了一定限制,而锂离子电池则较好地解决了这些问题。锂离子 电池研究始于 20 世纪 80 年代,1991 年首先由日本索尼公司推出了批量民用产品。锂离子 电池目前有液态锂离子电池(LIB)和聚合物锂离子电池(PLB)两类。其中液态锂离子电 池按正极材料又可分为 LiCoO2、LiNiO2、LiMn2O4 等种类。由于锂离子电池具有比能量高、 体积小、重量轻、工作电压高、循环寿命高、基本无记忆效应、无污染、自放电小等优点, 受到市场欢迎并迅速占领市场,广泛用于移动通讯、笔记本电脑、移动 DVD、摄像机、数 码相机、蓝牙耳机等便携式电子产品,大容量锂离子电池已在电动汽车中开始试用,预计它 将成为 21 世纪电动汽车的主要动力电源之一,并将在人造卫星、航空航天和储能方面得到 广泛应用。 2 锂离子电池的原理 锂离子电池的电化学表达式为: (-)Cn|LiClO4-EC+DEC|LiMO2(+) 正极反应:LiMO2 Li1-xMO2+xLi++xe- 或 Li1+yMn2O4 Li1+y-xMn2O4+xLi++xe- 负极反应:nC+xLi++xe- LixCn 电池反应:LiMO2+nC Li1-xMO2+LixCn 或 Li1+yMn2O4+nC Li1+y-xMn2O4+LixCn 式中,M 为 Co,Ni,Fe,W 等;正极化合物有 LiCoO2,LiNiO2,LiMn2O4,LiFeO2,LiWO2 等; 负极化合物有 LixC6,TiS2,WO3,NbS2,V2O5 等。 锂离子电池实际上是一种锂离子浓差电池, 正负电极由两种不同的锂离子嵌入化合物组 + 成。充电时,Li 从正极脱嵌经过电解质嵌入负极,负极处于富锂态,正极处于贫锂态,同 时电子的补偿电荷从外电路供给到碳负极,保证负极的电荷平衡。放电时则相反,Li+ 从负 极脱嵌,经过电解质嵌入正极,正极处于富锂态。在正常充放电的情况下,锂离子在层状结 构的碳材料和层状结构氧化物的层间嵌入和脱出, 一般只引起层面间距变化, 不破坏晶体结 构,在充放电过程中,负极材料的化学结构基本不变。因此,从充放电反应的可逆性看,锂 离子电池反应是一种理想的可逆反应。 锂离子电池的工作电压与构成电极的锂离子嵌入化合物和锂离子浓度有关。 目前, 用作 锂离子电池的正极材料是过渡金属和锰离子嵌入化合物,负极材料是锂离子嵌入碳化合物, 常用的碳材料有石油焦和石墨等。 图1 锂离子电池的充放电 目前已商品化的锂离子电池正极是 LiCoO2,负极是层状石墨,电池的电化学表达式为 -1 (-)C6|1mol?L LiPF6-EC+DEC|LiCoO2(+) 电池的充放电反应为 LiCoO2+6C Li1-xCoO2+LixC6 正极材料 LiCoO2,LiNiO2,LiMn2O4 和负极材料碳的理论容量见表 1
锂电池的工作原理
锂离子电池的工作原理 锂离子电池的结构如图2.1和图2.2 所示,一般由正极、负极和高分子隔膜构成。 锂离子电池的正极材料必须有能够接纳锂离子的位置和扩散路径,目前应用性能较好的正极材料是具有高插入电位的层状结构的过渡金属氧化物和锂的化合物,如Li x CoO2,Li x NiO2以及尖晶石结构的LiMn2O4等,这些正极材料的插锂电位都可以达到4V以上。负极材料一般用锂碳层间化合物Li x C6,其电解质一般采用溶解有锂盐LiPF6、LiAsF6的有机溶液。典型的锂离子蓄电池体系由碳负极(焦炭、石墨)、正极氧化钴锂(Li x CoO2)和有机电解液三部分组成。 锂离子电池的电化学表达式: 正极反应: 负极反应: 电池反应: 式中:M=Co、Ni、Fe、W等。 图2.1 锂离子电池结构示意图图2.2 圆柱形锂离子电池结构图锂离子电池实际上是一个锂离子浓差电池,正负电极由两种不同的锂离子嵌入化合物构。充电时,Li+从正极脱嵌经过电解质嵌入负极,此时负极处于富锂态,正极处于贫锂态;放电时则相反,Li+从负极脱嵌,经过电解质嵌入正极,正极处于富锂态,负极处于贫锂态。锂离子电池的工作电压与构成电极的锂离子嵌入化合物本身及锂离子的浓度有关。因此,在充放电循环时,Li+分别在正负极上发生“嵌入-脱嵌”反应,Li+便在正负极之间来回移动,所以,人们又形象地把锂离子电池称为“摇椅电池”或“摇摆电池”。 锂离子蓄电池是在锂蓄电池的基础上发展起来的先进蓄电池,它基本解决了
困扰锂蓄电池发展的两个技术难题,即安全性差和充放电寿命短的问题。锂离子电池与锂电池在原理上的相同之处是:在两种电池中都采用了一种能使锂离子嵌入和脱嵌的金属氧化物或硫化物作为正极,采用一种有机溶剂—无机盐体系作为电解质。不同之处是:在锂离子电池中采用使锂离子嵌入和脱嵌的碳材料代替纯锂作负极。因此,这种电池的工作原理更加简单,在电池工作过程中,仅仅是锂离子从一个电极(脱嵌)后进入另一个电极(嵌入)的过程。具体来说,当电池充电时锂离子是从正极中脱嵌,在碳负极中嵌入,放电时反之。在充放电过程中没有晶形变化,故具有较好的安全性和较长的充放电寿命。 锂离子电池的主要性能 锂离子电池的额定电压为3.6V(少数的是3.7V)。充满电时的终止充电电压与电池阳极材料有关:石墨的4.2V;焦炭的4.1V。充电时要求终止充电电压的精度在±1%之内。锂离子电池的终止放电电压为2.4~2.7V(电池厂家给出工作电压范围或终止放电电压的参数略有不同)。高于终止充电电压及低于终止放电时会对电池有损害。 其使用有一定要求:充电温度:0℃~45℃;保存温度:-20℃~+60℃。锂离子电池不适合大电流充放电。一般充电电流不大于1C,放电电流不大于2C(C 是电池的容量,如C=950mAh,1C的充电率即充电电流为950mA)。充电、放电在20℃左右效果较好,在负温下不能充电,并且放电效果差[4],(在-20℃放电效果最差,不仅放电电压低,放电时间比20℃放电时的一半还少)。 锂离子电池的充放电特性 锂离子电池的标称电压为3.6V,充满电压为4.2V,对过充电和过放电都比较敏感。为了最大限度减少锂离子电池易受到的过充电、深放电以及短路的损害,单体锂离子电池的充电电压必须严格限制。其充放电特性如图2-3 锂离子电池的充电特性 锂电池在充电中具有如下的特性: 1.在充电前半段,电压是逐渐上升的; 2.在电压达到4.2V后,内阻变化,电压维持不变; 3.整个过程中,电量不断增加; 4.在接近充满时,充电电流会达到很小的值。 经过多年的研究,已经找到了较好的充电控制方法: 1.涓流充电达到放电终止电压 2. 7V ; 2.使用恒流进行充电,使电压基本达到4.2V。安全电流为小于0.8C; 3.恒流阶段基本能达到电量的80% ;
电池测试
二次电池性能主要包括哪些方面? 主要包括电压、内阻、容量、内压、自放电率、循环寿命、密封性能、安全性能、储存性能、外观等,其它还有过充、过放、可焊性、耐腐蚀性等。 手机电池块有哪些电性能指标怎么测量? 电池块的电性能指标很多这里只介绍最主要的几项电特性: A.电池块容量 该指标反映电池块所能储存的电能的多少是以毫安小时计,例如:1600mAH是意昧着电池以1600mA放电可以持续放电一小时. B.电池块寿命 该指标反映电池块反复充放电循环次数 C.电池块内阻 上面已提到电池块的内阻越小越好但不能是零 D.电池块充电上限保护性能 锂电池充电时,其电压上限有一额定值,在任何情况下,锂电池的电压不允许超过此额定值该额定值。由PCB板上所选用的IC来决定和保证。 E.电池块放电下限保护性能 锂电池块放电时,在任何情况下锂电池的电压不允许低于某一额定值该额定值,由PCB板上所选用的IC来决定和保证。 需要说明的是,在手机中一般锂电池块放电时,尚未到达下限保护值,手机就因电池电量不足而关机。 F.电池块短路保护特性 锂电池块外露的正负极片在被短路时,PCB板上的IC应立即加以判断,并作出反应关断MOSFET。当短路故障排除后,电池块又能立即输出电能,这些均有PCB上的IC来识别判断和执行。 电池的可靠性测试项目有哪些? 1. 循环寿命 2. 不同倍率放电特性 3. 不同温度放电特性 4. 充电特性 5. 自放电特性 6. 不同温度自放电特性 7. 存贮特性 8. 过放电特性 9. 不同温度内阻特性 10. 高温测试 11. 温度循环测试 12. 跌落测试 13. 振动测试 14. 容量分布测试 15. 内阻分布测试 16. 静态放电测试ESD 电池的安全性测试项目有哪些?
锂离子电池原理(基础篇)
锂离子电池原理及工艺流程 化学电源在实现能量的转换过程中,必须具有两个必要的条件: 一. 组成化学电源的两个电极上进行的氧化还原过程,必须分别在两个分开的区域进行,这一点区别于一般的氧化还原反应。 二. 两电极的活性物质进行氧化还原反应时所需电子必须由外线路传递,这一点区别于金属腐蚀过程的微电池反应。 为了满足以上的条件,任何一种化学电源均由以下四部分组成: 1、电极电池的核心部分,它是由活性物质和导电骨架所组成。活性物质是指正、负极中参加成流反应的物质,是化学电源产生电能的源泉,是决定化学电源基本特性的重要部分。对活性物质的要求是: 1)组成电池的电动势高; 2)电化学活性高,即自发进行反应的能力强; 3)重量比容量和体积比容量大; 4)在电解液中的化学稳定性高; 5)具有高的电子导电性; 6)资源丰富,价格便宜。 2、电解质电池的主要组成之一,在电池内部担负着传递正负极之间电荷的作用,所以势一些具有高离子导电性的物质。对电解质的要求是: 1)稳定性强,因为电解质长期保存在电池内部,所以必须具有稳定的化学性质,使储藏期间电解质与活性物质界面的电化学反应速率小,从而使电池的自放电容量损失减小;2)比电导高,溶液的欧姆压降小,使电池的放电特性得以改善。对于固体电解质,则要求它只具有离子导电性,而不具有电子导电性。 3、隔膜也叫隔离物。置于电池两极之间。隔膜的形状有薄膜、板材、棒材等。其作用是防止正负极活性物质直接接触,造成电池内部短路。对于隔膜的要求是: 1)在电解液中具有良好的化学稳定性和一定的机械强度,并能承受电极活性物质的氧化还原作用; 2)离子通过隔膜的能力要大,也就是说隔膜对电解质离子运动的阻力要小。这样,电池内阻就相应减小,电池在大电流放电时的能量损耗减小; 3)应是电子的良好绝缘体,并能阻挡从电极上脱落活性物质微粒和枝晶的生长; 4)材料来源丰富,价格低廉。常用的隔膜材料有棉纸、微孔橡胶、微孔塑料、玻璃纤维、水化纤维素、接枝膜、尼龙、石棉等。可根据化学电源不同系列的要求而选取。 一、原理 1.0 正极构造 LiCoO2(钴酸锂)+导电剂(乙炔黑)+粘合剂(PVDF)+集流体(铝箔)正极2.0 负极构造 石墨+导电剂(乙炔黑)+增稠剂(CMC)+粘结剂(SBR)+ 集流体(铜箔)负极3.0工作原理 3.1 充电过程 一个电源给电池充电,此时正极上的电子e从通过外部电路跑到负极上,正锂离子Li+从正极“跳进”电解液里,“爬过”隔膜上弯弯曲曲的小洞,“游泳”到达负极,与早就跑过来的电子结合在一起。 正极上发生的反应为 LiCoO2=充电=Li1-xCoO2+XLi++Xe(电子)
锂离子电池工作原理
锂离子电池工作原理 正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。 负极反应:放电时锂离子脱插,充电时锂离子插入。 电池总反应 以炭材料为负极,以含锂的化合物作正极的锂电池,在充放电过程中,没有金属锂存在,只有锂离子,这就是锂离子电池。当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。Li-ion Batteries就像一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅来回奔跑。所以Li-ion Batteries又叫摇椅式电池。 一般锂电池充电电流设定在0.2C至1C之间,电流越大,充电越快,同时电池发热也越大。而且,过大的电流充电,容量不够满,因为电池内部的电化学反应需要时间。就跟倒啤酒一样,倒太快的话会产生泡沫,反而不满。 正极 正极材料:可选正极材料很多,目前主流产品多采用锂铁磷酸盐。 正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。 充电时:LiFePO?→ Li1-xFePO? + xLi + xe
放电时:Li1-xFePO?+ xLi + xe →LiFePO? 负极 负极材料:多采用石墨。新的研究发现钛酸盐可能是更好的材料。 负极反应:放电时锂离子脱插,充电时锂离子插入。 充电时:xLi + xe + 6C →LixC6 放电时:LixC6 → xLi + xe + 6C 锂离子电池是一种二次电池(充电电池),它主要依靠锂离子在正极和负极之间移动来工作。在充放电过程中,Li+ 在两个电极之间往返嵌入和脱嵌:充电池时,Li+从正极脱嵌,经过电解质嵌入负极,负极处于富锂状态;放电时则相反。电池一般采用含有锂元素的材料作为电极,是现代高性能电池的代表。 组成部分 钢壳/铝壳/圆柱/软包装系列: (1)正极——活性物质一般为锰酸锂或者钴酸锂,镍钴锰酸锂材料,电动自行车则普遍用镍钴锰酸锂(俗称三元)或者三元+少量锰酸锂,纯的锰酸锂和磷酸铁锂则由于体积大、性能不好或成本高而逐渐淡出。导电集流体使用厚度10--20微米的电解铝箔。 (2)隔膜——一种经特殊成型的高分子薄膜,薄膜有微孔结构,可以让锂离子自由通过,而电子不能通过。 (3)负极——活性物质为石墨,或近似石墨结构的碳,导电集流体使用厚度7-15微米的电解铜箔。
锂离子电池工作原理
锂离子电池工作原理
正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。 负极反应:放电时锂离子脱插,充电时锂离子插入。 电池总反应 以炭材料为负极,以含锂的化合物作正极的锂电池,在充放电过程中,没有金属锂存在,只有锂离子,这就是锂离子电池。当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。Li-ion Batteries就像一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅来回奔跑。所以Li-ion Batteries又叫摇椅式电池。 一般锂电池充电电流设定在0.2C至1C之间,电流越大,充电越
快,同时电池发热也越大。而且,过大的电流充电,容量不够满,因为电池内部的电化学反应需要时间。就跟倒啤酒一样,倒太快的话会产生泡沫,反而不满。 正极 正极材料:可选正极材料很多,目前主流产品多采用锂铁磷酸盐。 正极反应:放电时锂离子嵌入,充电时锂离子脱嵌。 充电时:LiFePO?→ Li1-xFePO? + xLi + xe 放电时:Li1-xFePO?+ xLi + xe →LiFePO? 负极 负极材料:多采用石墨。新的研究发现钛酸盐可能是更好的材料。 负极反应:放电时锂离子脱插,充电时锂离子插入。 充电时:xLi + xe + 6C →LixC6 放电时:LixC6 → xLi + xe + 6C
锂离子电池性能测试
华南师范大学实验报告 学生姓名:蓝中舜学号:20120010027 专业:新能源材料与器件勷勤创新班年级、班级:12新能源 课程名称:化学电源实验 实验项目:锂离子电池性能测试 实验类型:验证设计综合实验时间:2014年5月5日-17日 实验指导老师:马国正组员:黄日权郭金海 一、实验目的 1.熟悉、掌握锂离子电池的结构及充放电原理。 2.熟悉、掌握锂离子正极材料的制备过程及工艺。 3.熟悉、掌握锂离子电池的封装工艺及模拟电池测试方法。 二、实验原理 锂离子电池是指正负极为Li+嵌入化合物的二次电池。正极通常采用锂过渡金属氧化物 Li x CoO2,Li x NiO2或Li x Mn2O4,负极采用锂-碳层间化合物Li x C6。电解质为溶有锂盐LiPF6,LiAsF6,LiClO4等的有机溶液。溶剂主要有碳酸乙烯酯(EC)、碳酸丙烯酯(PC)、碳酸二甲酯(DMC)和氯碳酸酯(CIMC)等。在充放电过程中,Li+在两极间往返嵌入和脱出,被形象的称之为“摇椅电池”。 锂离子电池充放电原理和结构示意图如下。 锂离子电池的化学表达式为: -)Cn|LiPF6-EC+DMC|LiM x O y(+ 其电池反应为: LiM x O y+nC Li1-x M x O y+Li x C n 本实验以高温固相法制备的尖晶石型LiMn2O4为正极材料,纯锂片为负极,制备扣式锂离子模拟电池,并对制备的扣式半电池进行充放电测试。 三、仪器与试剂 电化学工作站,蓝点测试系统、手套箱、电子天平、真空干燥箱、切片机、对辊机、鼓风干燥机 LiMn2O4、乙炔黑、PVDF、无水乙醇、电解液(1M LiPF6溶与体积比EC:DEC:EMC=1:1:1
磷酸铁锂电池地放电特性及寿命
磷酸铁锂电池(以下简称锂铁电池)作为铁电池的一种,一直受到业界朋友的广泛关注(也有人说锂铁电池其实就是锂离子电池的一种)。就铁电池而言,它可以分为高铁电池和锂铁电池,今天我们以型号为STL18650的锂铁电池为例,来具体说明一下锂铁的电池的放电特性及寿命。 STL18650的锂铁电池(容量为1100mAh)在不同的放电率时其放电特性如图2所示。最小的放电率为0.5C,最大的放电率为10C,五种不同的放电率形成一组放电曲线。由图1中可看出,不管哪一种放电率,其放电过程中电压是很平坦的(即放电电压平稳,基本保持不变),只有快到终止放电电压时,曲线才向下弯曲(放电量达到800mAh以后才出现向下弯曲)。在0.5~10C的放电率范围内,输出电压大部分在2.7~3.2V范围内变化。这说明该电池有很好的放电特性。 图1 STL18650的放电特性 容量为1000mAh的STL18650在不同的温度条件下(从-20~+40℃)的放电曲线如图2所示。如果在23℃时放电容量为100%,则在0℃时的放电容量降为78%,而在-20℃时降到65%,在+40℃放电时其放电容量略大于100%。 从图3中可看出,STL18650锂铁电池可以在-20℃下工作,但输出能量要降低35%左右。 图2 STL18650在多温度条件下的放电曲线 STL18650的充放电循环寿命曲线如图4所示。其充放电循环的条件是:以1C充电率充电,以2C放电率放电,历经570次充放电循环。从图3的特性曲线可看出,在经过570次充放电循环,其放电容量未变,说明该电池有很高的寿命。
图3 STL18650的充放电循环寿命曲线 过放电到零电压试验 采用STL18650(1100mAh)的锂铁动力电池做过放电到零电压试验。试验条件:用0.5C充电率将1100mAh的STL18650电池充满,然后用1.0C放电率放电到电池电压为0C。再将放到0V的电池分两组:一组存放7天,另一组存放30天;存放到期后再用0.5C充电率充满,然后用1.0C放电。最后比较两种零电压存放期不同的差别。 试验的结果是,零电压存放7天后电池无泄漏,性能良好,容量为100%;存放30天后,无泄漏、性能良好,容量为98%;存放30天后的电池再做3次充放电循环,容量又恢复到100%。 这试验说明该电池即使出现过放电(甚至到0V),并存放一定时间,电池也不泄漏、损坏。这是其他种类锂离子电池不具有的特性。
锂电池充电电路详解
锂电池充电电路图 锂电池是继镍镉、镍氢电池之后,可充电电池家族中的佼佼者.锂离子电池以其优良的特性,被广泛应用于: 手机、摄录像机、笔记本电脑、无绳电话、电动工具、遥控或电动玩具、照相机等便携式电子设备中。 一、锂电池与镍镉、镍氢可充电池: 锂离子电池的负极为石墨晶体,正极通常为二氧化锂。充电时锂离子由正极向负极运动而嵌入石墨层中。放电时,锂离子从石墨晶体内负极表面脱离移向正极。所以,在该电池充放电过程中锂总是以锂离子形态出现,而不是以金属锂的形态出现。因而这种电池叫做锂离子电池,简称锂电池。 锂电池具有:体积小、容量大、重量轻、无污染、单节电压高、自放电率低、电池循环次数多等优点,但价格较贵。镍镉电池因容量低,自放电严重,且对环境有污染,正逐步被淘汰。镍氢电池具有较高的性能价格比,且不污染环境,但单体电压只有1.2V,因而在使用范围上受到限制。 二、锂电池的特点: 1、具有更高的重量能量比、体积能量比; 2、电压高,单节锂电池电压为3.6V,等于3只镍镉或镍氢充电电池的串联电压; 3、自放电小可长时间存放,这是该电池最突出的优越性; 4、无记忆效应。锂电池不存在镍镉电池的所谓记忆效应,所以锂电池充电前无需放电; 5、寿命长。正常工作条件下,锂电池充/放电循环次数远大于500次; 6、可以快速充电。锂电池通常可以采用0.5~1倍容量的电流充电,使充电时间缩短至1~2小时; 7、可以随意并联使用; 8、由于电池中不含镉、铅、汞等重金属元素,对环境无污染,是当代最先进的绿色电池; 9、成本高。与其它可充电池相比,锂电池价格较贵。 三、锂电池的内部结构: 锂电池通常有两种外型:圆柱型和长方型。 电池内部采用螺旋绕制结构,用一种非常精细而渗透性很强的聚乙烯薄膜隔离材料在正、负极间间隔而成。正极包括由锂和二氧化钴组成的锂离子收集极及由铝薄膜组成的电流收集极。负极由片状碳材料组成的锂离子收集极和铜薄膜组成的电流收集极组成。电池内充有有机电解质溶液。另外还装有安全阀和PTC元件,以便电池在不正常状态及输出短路时保护电池不受损坏。 单节锂电池的电压为3.6V,容量也不可能无限大,因此,常常将单节锂电池进行串、并联处理,以满足不同场合的要求。字串5 四、锂电池的充放电要求; 1、锂电池的充电:根据锂电池的结构特性,最高充电终止电压应为4.2V,不能过充,否则会因正极的锂离子拿走太多,而使电池报废。其充放电要求较高,可采用专用的恒流、恒压充电器进行充电。通常恒流充电至4.2V/节后转入恒压充电,当恒压充电电流降至100mA 以内时,应停止充电。 充电电流(mA)=0.1~1.5倍电池容量(如1350mAh的电池,其充电电流可控制在135~2025mA之间)。常规充电电流可选择在0.5倍电池容量左右,充电时间约为2~3小时。 2、锂电池的放电:因锂电池的内部结构所致,放电时锂离子不能全部移向正极,必须保留一部分锂离子在负极,以保证在下次充电时锂离子能够畅通地嵌入通道。否则,电池寿命就相应缩短。为了保证石墨层中放电后留有部分锂离子,就要严格限制放电终止最低电压,也就是说锂电池不能过放电。放电终止电压通常为3.0V/节,最低不能低于2.5V/节。电池放
电池充放电原理,及如何选择电池充放电测试仪
锂离子脱嵌和充放电原理 从微观世界(原子级)来观察电池正负极的结构,各极活性物质的结晶结构为层叠状,这种结构使锂离子的嵌入(脱嵌)变得容易。锂离子在分子间作用力的作用下为固定状态。当对正负极施加电场时,锂离子只需要较低的能量就能发生迁移,进行嵌入。锂离子电池充放电的机制也可以用图1 来说明。图中方程式中的正极活性物质为锰酸锂。 图1 放电时电极周围的变化 图1 是放电时锂离子嵌入和迁移的示意图。在负极,碳层之间存在锂离子,负极比正极的能量高。外部存在负载时,负极的锂离子释放电子,向能量低的正极迁移。从负极脱嵌的锂离子,通过电解液和隔膜小孔向正极迁移,嵌入层状结构的正极活性物质中。同时,电子被接收,锂离子被固定而变得稳定。如果过放电,锂离子过多地聚集在正极,会使内阻增大,电池发热,导致急剧劣化。从图1 中可见,负载电流(电池容量)几乎是由可移动的锂离子数量决定的。电子从集流体活性物质中穿过,到达外部端子。正极的集流体为铝,负极的集流体为铜。这样做的理由是:在正负极各自的电势下,铝和铜是不会被锂离子
掺杂(渗透)的金属。 充电时电极周围的变化 图2 显示了充电时锂离子的嵌入和迁移过程。 图2 充电时,外部电压施加在外部端子上,强制产生与放电反应相反的反应。由此,正极的锂离子释放电子,在电场作用下通过电解液迁移到负极,嵌入负极的活性物质内部。同时,电子被接收,锂离子被负极活性物质固定。锂离子在电解液中快速迁移,在负极表面减速,在负极活性物质内部非常缓慢地扩散。这与汽车离开高速公路,进入普通公路,然后驶入自家附近街道的过程相似。充电时,锂离子在负极表面呈现拥堵状态。 充电时电池在劣化 作为电解液的有机溶剂在正极分解,在负极表面与锂离子发生反应,形成固体电解质界面膜(SEI)。因此,迁移的锂离子数量减少,导致电池容量下降。充电时,在负极表面刻意制造这个让化学反应容易发生的状态。这与后面讲到的电池劣化相关内容也有关联。另外,过充电使锂离子在负极过多聚集,内阻
锂离子电池充放电机理的探索
锂离子电池充放电机理的探索 及“锂亚原子”模型的建立 贵州航天电源科技有限公司张忠林杨玉光 摘要:锂离子电池的研究和发展一直都是以“摇椅理论”为指导,由于受该理论的影响,很多现象很难用传统的电化学理论进行解释。作者在生产实践中通过对一些现象的观察,并做了大量的试验和研究,提出“锂亚原子”的模型,并在此模型的基础上,对锂离子电池的充放电反应机理和一些现象用电化学理论进行了解释。 主题词:锂离子电池、反应机理、锂亚原子 一、前言 锂离子电池是在锂金属电池基础上发展起来的。由于锂金属电池在充放电时出现锂枝晶,刺破隔膜造成短路,出现爆炸等现象,这一问题长期困扰锂金属电池的发展,目前仍很难投入到民用市场。锂离子电池研究始于20世纪80年代,1991年首先由日本索尼公司推出了批量民用产品,由于其具有比能量高、体积小、重量轻、工作电压高、无记忆效应、无污染、自放电小等优点,受到市场欢迎,并迅速占领市场,广泛用于移动通讯、笔记本电脑、移动DVD、摄像机、数码相机、蓝牙耳机等便携式电子产品。目前主要产地集中在日本、中国和韩国,预计2004年全球需求量将达到10亿只。 由于锂离子电池从开始研究到现在才20多年时间,真正投入应用也只有十多年的时间,基础理论的研究还不是十分成熟,对锂离子电池的生产和发展很难起到全面指导作用,特别是对电池充放电反应机理的认识还存在很大分歧,有些现象用目前的理论和机理还很难解释。本文对锂离子电池充放电反应机理提出了一些看法,并对生产中存在的现象进行了解释,希望与锂电池同行共同探讨。二、基本原理 目前锂离子电池公认的基本原理为“摇椅理论”,该理论认为锂离子电池充放电反应机理不是通过传统氧化还原反应来实现电子转移,而是通过锂离子在层状物质的晶格中嵌入和脱出,发生能量变化。
锂电池保护板原理
锂电池保护板原理文件编码(008-TTIG-UTITD-GKBTT-PUUTI-WYTUI-8256)
锂电池保护板原理锂电池(可充型)之所以需要保护,是由它本身特性决定的。由于锂电池本身的材料决定了它不能被过充、过放、过流、短路及超高温充放电,因此锂电池锂电组件总会跟着一块精致的保护板和一片电流保险器出现。 锂电池的保护功能通常由保护电路板和PTC等电流器件协同完成,保护板是由电子电路组成,在-40℃至+85℃的环境下时刻准确的监视电芯的电压和充放回路的电流,及时控制电流回路的通断;PTC在高温环境下防止电池发生恶劣的损坏。 普通锂电池保护板通常包括控制IC、MOS开关、电阻、电容及辅助器件FUSE、PTC、NTC、ID、存储器等。其中控制IC,在一切正常的情况下控制MOS开关导通,使电芯与外电路导通,而当电芯电压或回路电流超过规定值时,它立刻控制MOS开关关断,保护电芯的安全。 在保护板正常的情况下,Vdd为高电平,Vss,VM为低电平,DO、CO为高电平,当Vdd,Vss,VM任何一项参数变换时,DO或CO端的电平将发生变化。 1、过充电检出电压:在通常状态下,Vdd逐渐提升至CO端由高电平变为低电平时VDD-VSS间电压。 2、过充电解除电压:在充电状态下,Vdd逐渐降低至CO端由低电平变为高电平时VDD-VSS间电压。 3、过放电检出电压:通常状态下,Vdd逐渐降低至D O端由高电平变为低电平时VDD- VSS间电压。 4、过放电解除电压:在过放电状态下,Vdd逐渐上升到DO端由低电平变为高电平时 VDD-VSS间电压。
5、过电流1检出电压:在通常状态下,VM逐渐升至DO由高电平变为低电平时VM-VSS间电压。 6、过电流2检出电压:在通常状态下,VM从OV起以1ms以上4ms以下的速度升到 DO端由高电平变为低电平时VM-VSS间电压。 7、负载短路检出电压:在通常状态下,VM以OV起以1μS以上50μS以下的速度升至DO端由高电平变为低电平时VM-VSS间电压。 8、充电器检出电压:在过放电状态下,VM以OV逐渐下降至DO由低电平变为变为高电平时VM-VSS间电压。 9、通常工作时消耗电流:在通常状态下,流以VDD端子的电流(IDD)即为通常工作时消耗电流。 10、过放电消耗电流:在放电状态下,流经VDD端子的电流(IDD)即为过流放电消耗电流。 1、通常状态:电池电压在过放电检出电压以上(以上),过充电检出电压以下(以下),VM端子的电压在充电器检出电压以上,在过电流/检出电压以下(OV)的情况下,IC通过监视连接在VDD-VSS间的电压差及VM-VSS间的电压差而控制MOS管,DO、CO端都为高电平,MOS管处导通状态,这时可以自由的充电和放电; 当电池被充电使电压超过设定值VC后,VD1翻转使Cout变为低电平,T1截止,充电停止,当电池电压回落至VCR时,Cout变为高电平,T1导通充电继续,VCR小于VC一个定值,以防止电流频繁跳变。 当电池电压因放电而降低至设定值VD()时, VD2翻转,以IC内部固定的短时间延时后,使Dout变为低电平,T2截止,放电停止。
锂离子电池存储与自放电的关系
自放电的分类:从自放电对电池的影响,可以将自放电分为两种:损失容量能够可逆得到补偿的自放电;损失容量无法可逆补偿的自放电。按照这两种分类,我们可以大约轮廓性的给出一些自放电的原因。自放电的原因: 1.造成可逆容量损失的原因:可逆容量损失的原因是发生了可逆放电反应,原理跟电池正常放电反应一致。不同点是正常放电电子路径为外电路、反应速度很快;自放电的电子路径是电解液、反应速度很慢。 2.造成不可逆容量损失的原因:当电池内部发生了不可逆反应时,所造成的容量损失即为不可逆容量损失的。所发生不可逆反应的类型主要包括:A:正极与电解液发生的不可逆反应(相对主要发生于锰酸锂、镍酸锂这两种易发生结构缺陷的材料,例如锰酸锂正极与电解液中锂离子的反应:LiyMn2O4+xLi++xe-→Liy+xMn2O4 等);B:负极材料与电解液发生的不可逆反应(化成时形成的SEI膜就是为了保护负极不受电解液的腐蚀,负极与电解液可能发生的反应为:LiyC6→Liy-xC6+xLi++xe等);C:电解液自身所带杂质引起的不可逆反应(例如溶剂中CO2可能发生的反应:2CO2+2e+2Li+→Li2CO3+CO;溶剂中O2发生的反应:1/2O2+2e+2Li+→Li2O )。类似的反应不可逆的消耗了电解液中的锂离子,进而损失了电池容量。D:制成时杂质造成的微短路所引起的不可逆反应。这一现象是造成个别电池自放电偏大的最主要原因。空气中的粉尘或者制成时极片、隔膜沾上的金属粉末都会造成内部微短路。生产时绝对的无尘是做不到的,当粉尘不足以达到刺穿隔膜进而使正负极短路接触时,其对电池的影响并不大;但是当粉尘严重到刺穿隔膜这个“度”时,对电池的影响就会非常明显。由于有是否刺穿隔膜这个“度”的存在,因此在测试大批电池自放电率时,经常会发现大部分电池的自放电率都集中在一个不大的范围内,而只有小部分电池的自放电明显偏高且分布离散,这些应该就是隔膜被刺穿的电池。最后需要说明的是,锂离子电池内部发生的副反应是非常复杂的,文武虽然查了些资料,但由于水平有限精力有限,暂时只能分析道这个程度,大家凑合着看吧。自放电的测试方法: 1.测量电池搁置一段时间后的容量损失:自放电研究的本初目的就是研究电池搁置后的容量损失。但是,以下原因造成测试容量损失在实施上困难重重:A.充电过程中的不可逆程度过大,即使充电后马上进行放电,放电容量/充电容量值都很难保证在100%±0.5%以内。如此大的误差,就要求测试之间的搁置时间必须非常长。而这很显然不符合日常生产的需求。B.测试容量时需要大量电力和人力物力,过程复杂且增加了成本。基于以上两个考虑,一般不会将“测量搁置后放电容量对比之前充电容量的损失”来作为电池的自放电标准。 2.测量一段时间内的K值:衡量自放电程度的一个非常重要的指标K值=△OCV/△t。K值常见单位为mV/d,当然这跟厂子自己的标准(或者厂子老大的个人喜好)、电池本身的性能、测量条件等有关。测量两次电压计算K值的方法更为简便且误差更小,因此K值是衡量电池自放电的常规性方法。以下文字可能会将K值与自放电混用,请大家注意。自放电及K值的影响因素: 1.正负极材料、电解液种类、隔膜厚度种类:由于自放电很大程度上是发生于材料之间,因此材料的性能对自放电有很大的影响。但是材料的各个具体参数(比如正负极的粒径、电解液的电导率、隔膜的孔隙率等)对自放电的影响到底有多大、有影响的原因是什么?这一问题不是研究的重点。一是问题本身太过复杂,二是对量产、搞研究皆没有太大意义。不过好在文武的同事曾经做过实验,发现三元电池的自放电率要高于钴酸锂电池。但是再多的,就不知道了(子曰:知之为知之,不知为不知,是智也)。 2.存储的时间:存储时间变长,一方面是使压降的绝对值增大(废话),另一方面则变相的减少了“仪器绝对误差/压降值”,从而使结果更为准确。文武通过实验发现,使用精度为0.1mV的仪器测试自放电,当测试时间超过14天时,才能够将问题电芯(什么是问题电芯将在下面的文字中回答)与正常电芯区分出来(当然文武那批电池K值很小,0.13mV/d左右)。 3.存储的条件:温度和湿度的增加,会增大自放电程度。这点很好理解且论坛里下载的文献中也见过这
锂电池的充放电次数及检测仪
一般决定锂电池使用寿命的是它的充电循环次数,所谓充电循环次数,是指锂电池从满电状态把电池电量放倒0,又充满的过程。无论是三元锂电池还是磷酸铁锂电池,如果采取浅放浅充的方式充放电,其使用寿命将会延长很多,三元锂电池的充电循环次数能很轻松地突破1000次。 往往说到锂电池循环次数这个问题,基本上都会和“充电周期”挂上关系,这两者其实可以说是同个意思,你可以说:电池循环次数是以周期来计算的,也可以反过来说锂电池充电周期是以循环次数来计算的,这两种说法都不为过。 什么是充电周期?一次充电周期指的是锂电池一次完整的充放电过程,也就是说当电池使用电量达到电池容量的100%,即完成了一个充电周期,但不一定通过一次充电就完成。这点是很多人的一个认知误区。 锂电池的寿命是500个充电周期。怎么才能算作是一个充放电周期呢?一个充电周期意味着锂电池的所有电量由满用到空,再由空充到满的过程,这并不等同于充一次电。所谓的500次,是指锂电池厂家在恒定的放电深度(80%)实现了625次左右的可充次数,达到了500个充电周期。再来个算式就更清楚了:625×80%=500.(忽略锂电池容量减少等因素)。 实际中,由于生活中的各种影响,特别是充电时的放电深度不是恒定的,所以,“500个充电周期”只能算作是参考。进口三元锂电池充放电次数可达到约3000次左右,国产的大概也就是800-1000次。
正常用锂电池充电放电次数高达到2000次、锂电池有三元锂电池、铁锂电池、聚合物锂电池,各有差距。正常用铅酸电池各充电放电次数高达500次、如平液电池、富液电池、胶体电池等各有不同。 目前的新能源汽车上使用的动力电池主要是三元锂电池、钴酸锂电池、磷酸铁锂电池这三种,无论是哪一种类型的电池,都存在着使用寿命,动力电池的寿命是按照循环使用次数来进行衡量的,充放电的次数越多,电池的使用寿命就会越少。对于动力电池电芯循环使用次数国家强制要求必须要在1000次以上,磷酸铁锂一般可以做到2000次,而三元锂电池一般也能1000次以上。 不同的电池有不同的循环使用寿命。通常三元锂动力电池的循环使用寿命在1500次到2000次左右。所以单纯的充电次数并不会影响到电池的寿命。动力电池的寿命只会根据循环次数来减少。充电次数并不能够直接决定动力锂电池的使用寿命,在一次充放电的循环中多次充电也只能算是电池损耗的一次循环使用。所以我们在使用电动汽车的时候,不需要担心充电次数多而影响到动力锂电池的使用寿命。 杭州固恒能源科技有限公司从事于新能源汽车后市场领域,是一家专注于动力电池的应用以及循环利用等方面的研发、生产、销售,并提供全套检测维护解决方案的企业。研发了一系列动力电池,机电,机电控制维保领域的相关产品,有效的降低了服务商的运营维护成本,延长了电池的使用寿命,我们致力于打造
锂离子电池保护原理
电 池管理单元及电池保护 基于阻抗跟踪技术的电池管理单元(BMU)会在整个电池使用周期内监控单元阻抗和电压失衡,并有可能检测电池的微小短路(micro-short),防止电池单元造成火灾乃至爆炸。对于锂离子电池包制造商来说,针对电池供电系统构建安全且可靠的产品是至关重要的。电池包中的电池管理电路可以监控锂离子电池的运行状态,包括了电池阻抗、温度、单元电压、充电和放电电流以及充电状态等,以为系统提供详细的剩余运转时间和电池健康状况信息,确保系统作出正确的决策。此外,为了改进电池的安全性能,即使只有一种故障发生,例如过电流、短路、单元和电池包的电压过高、温度过高等,系统也会关闭两个和锂离子电池串联的背靠背(back-to-back)保护MOSFET,将电池单元断开。 锂离子电池安全 过高的工作温度将加速电池的老化,并可能导致锂离子电池包的热失控(thermal run-away) 及爆炸。对于锂离子电池高度活性化的含能材料来说,这一点是备受关注的。大电流的过度充电及短路都有可能造成电池温度的快速上升。锂离子电池过度充电期间,活跃得金属锂沉积在电池的正极,其材料极大的增加了爆炸的危险性,因为锂将有可能与多种材料起反应而爆炸,包括了电解液及阴极材料。例如,锂/碳插层混合物(intercalated compound)与水发生反应,并释放出氢气,氢气有可能被反应放热所引燃。阴极材料,诸如LiCoO2,在温度超过175℃的热失控温度限(4.3V单元电压)时,也将开始与电解液发生反应。 锂离子电池使用很薄的微孔膜(micro-porous film)材料,例如聚烯烃,进行电池正负极的电子隔离,因为此类材料具有卓越的力学性能、化学稳定性以及可接受的价格。聚烯烃的熔点范围较低,为135℃至165℃,使得聚烯烃适用于作为热保险(fuse)材料。随着温度的升高并达到聚合体的熔点,材料的多孔性将失效,其目的是使得锂离子无法在电极之间流动,从而关断电池。同时,热敏陶瓷(PCT)设备以及安全排出口(safety vent)为锂离子电池提供了额外的保护。电池的外壳,一般作为负极接线端,通常为典型的镀镍金属板。在壳体密封的情况下,金属微粒将可能污染电池的内部。随着时间的推移,微粒有可能迁移至隔离器,并使得电池阳极与阴极之间的绝缘层老化。而阳极与阴极之间的微小短路将允许电子肆意的流动,并最终使电池失效。绝大多数情况下,此类失效等同于电池无法供电且功能完全终止。在少数情况下,电池有可能过热、熔断、着火乃至爆炸。这就是近期所报道的电池故障的主要根源,并使得众多的厂商不得不将其产品召回。 电 池管理单元(BMU)以及电池保护 电池材料的不断开发提升了热失控的上限温度。另一方面,虽然电池必须通过严格的UL安全测试,例如UL16?2,但提供正确的充电状态并很好的应对多种有可能出现的电子原件故障仍然是系统设计人员的职责所在。过电压、过电流、短路、过热状态以及外部分立元件的故障都有可能引起电池突变的失效。这就意味着需要采取多重的保护――在同一电池包内具有至少两个独立的保护电路或机制。同时,还希望具备用于检测电池内部微小短路的电子电路以避免电池故障。 图1展示了电池包内电池管理的单元方框图,其组成包括了电量计集成电路(IC)、模拟前端
