高中化学离子方程式大全及练习(绝对精品)

无机化学部分
非金属单质(F2 , Cl2 , O2 , S, N2 , P , C , Si)1.氧化性:
F2 + H 2 === 2HF
2F2 +2H 2O===4HF+O 2
占弊Cl£ +Hg--2HC1 占烬…—Pg 占烬=^PC15
3C12 +2Fe
占燃
-CuCl; Cl 2 +2FeCI 2 ===2FeCI 3 2CI2+2NaBr===2NaCI+Br2 CI2 +2NaI ===2NaCI+I2 CI2+SO2 +2H2O===H2SO4 +2HCI (2004 北京咼考)占燃20i +3Fe J,.Fe304—H^S
S + Fe 乙FeS S + 2Cu =£= Cu2S N 4- JR;?咼恳咼压-2NH3 催化剂
d ■ irx ail_
—血訓E
S + 02 J'_ so a S+6HNO 3(浓)===H 2SO4+6NO 2 t +2H 2O 3S+4 HNO 3(稀)===3SO 2+4NO t +2H 2O
4P + 50£山x …
占撚
(X2表示F2, CI2, Br2)占燃2C ■+ 少重)…2C0 C + 0"足量)J,co2 PX 3+X 2===PX 5 C+CO 2===2CO
(生成水煤气)a—■ I 曰
(制得粗硅)
啦(粉)+ 02 Si0£Si+2NaOH+H 2O===Na 2SQ3+2H 21 3.(碱中)歧化CI 2+H 2O===HCI+HCIO
(加酸抑制歧化,加碱或光照促进歧化)
CI2+2NaOH===NaCI+NaCIO+H 2O
2CI 2+2Ca(OH)2===CaCI 2+Ca(CIO)2+2H2O
金属单质(Na, Mg , Al, Fe )的还原性
4Na+O 2===2Na 2O
占琳
2Na£0 + J, ' 2Na£O2
占燃
2Na + 02Ng
2Na+S===Na 2S (爆炸)
2Na+2H 2O===2NaOH+H 21
Mg+H 2SO4===MgSO 4+H 21
2Mg + 02「2HlgO
2A1 + 3Cli =^= 2A1C13
4A1 + 302…2A12O3
2AI+6HCI===2AICI 3+3H 2 t
2AI+3H 2SO4===AI 2(SO4)3+3H2t
2AI+6H 2SO4(浓、热)===AI 2(SO4)3+3SO2t +6H2O
(AI,Fe在冷,浓的H2SO4,HNO 3中钝化)
AI+4HNO 3(稀)===AI(NO 3)3+NO t +2H 2O
2AI+2NaOH+2H 2O===2NaAIO 2+3H 21 2A1 +C“(h 二+
2Cr
言?■曰
4A1 + SMnOa ,m2AI2O3 + 3Mn
有,回
2A1 + F S203' m AlzOs + 2Fe
3Fe + 4H20 Cg)=^= Fe^04 + 4H时
Fe+2HCI===FeCI 2+H21
Fe+CuCI 2 ===FeCI 2+Cu
非金属氢化物(HF,HCI,H2O,H2S,NH3)
1?还原性:
4HC1 (浓)+ MnO? =^= MnClj + 3时+ 2H£0
16HCI+2KMnO==2KCI+2MnCl2+5CI 21 +8H2O (实验室常用
2H z S+SO===3SJ +2H z O
2H 述 + 02CJ> 量)2S + 2H20
2H2S 亠302 (足重)=—=2S0^ + 2H2O
2NH+3CI 2===N2+6HCI
8NH+3CI 2===N Z+6NHCI
4NH J+3Q(纯氧)===2N2+6H2O
2NHs + 3CuO 3Cu + N2+ 3HR
4NH3 + 5O24N0 + 6H20
△
4NHj+6NO===5N+6HaO(用氨清除NO)
2.酸性:
4HF+SiQ===SiF4+2HO (HF保存在塑料瓶的原因,此反
应广泛应用于测定矿样或钢样中SiO2的含量)
HS+CuC2===CuSj +2HCI
HS+FeCl2===(不反应)
3.碱性:
NH+HCI===NHCI
NH+HNO===NHNO
2NH+HSQ===(NH)2SO NH+NaCI+H2O+CG>==NaHC9Nh l CI
(此反应用于工业制备小苏打,苏打)
4.不稳定性:
2H2Q===2HO+Ot
非金属氧化物
1?低价态的还原性:
△
2SO2+O2+2H2O===2H 2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCI
2NO+O2===2NO2
2CO+O2===2CO2
CO + CuO Cu + CO^
CO + H20 同帰CO 2 + Hz 3C0 + Fe205=^= 2Fe +
3C0a
2.氧化性:
NO2+2KI+H 2O===NO+I 2 J +2KOH
(不能用淀粉.KI溶液鉴别溴蒸气和NO2)
2Mg + C02=^= 2fflg0 + C
(CO不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
3.与水的作用:
)SO2+H2O===H 2SO3
SO3+H2O===H 2SO4
3NO2+H2O===2HNO 3+NO
N2O5+H2O===2HNO 3
P2O5+H2O (冷)===2HPO3
P2O5+3H2O (热)===2H 3PO4
(P2O5极易吸水,可作气体干燥剂)
4.与碱性物质的作用:
SO2+(NH 4)2SO3+H2O= = = 2NH 4HSO3
(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用
H2SO4 处理:2NH4HSO3+H2SO4= = = (NH4)2SO4 + 2H2O
+ 2SO2生成的硫酸铵作化肥,SO2循环作原料气)
SO2+Ca(OH)2===CaSO3+H2O
(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)
SO3+Ca(OH)2===CaSO4+H2O
CO2+2NaOH(过量)===Na 2CO3+H2O
CO2(过量)+NaOH===NaHCO 3
CO2+Ca(OH)2(过量)===CaCO 3 J +H2O
2CO2(过量)+Ca(OH)2===Ca(HCO 3)2
CO2+2NaAIO 2+3H2O===2AI(OH) 3 J +Na2CO3
CO2+C6H5ONa+H2O===C6H5OH J +NaHCO3
S1O2 + C^O m CaSiOj
SiO2+2NaOH===Na 2SQ3+H2O (强碱缓慢腐蚀玻璃)声]
曰
5101+ CaCO3m CaSiO3+ CSf
5102+ Na2C03m NazSiOa + CO 汕
金属氧化物
1?低价态的还原性:
FeO+4HNO 3===Fe(NO 3)3+NO21 +2H2O
2。氧化性:
MgO , AI2O3几乎没有氧化性,很难被还原为Mg ,
Al.,一般通过电解制Mg和AI.
: (制还原铁粉)
Fe304 + 4H2血3Fe + 4H20
3?与水的作用:
Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O 21
4.与酸性物质的作用:
Na2O+CO 2===Na 2CO3
2Na2O2+2CO2===2Na 2CO3+O2
Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2
MgO+SO 3===MgSO 4
MgO+H 2SO4===MgSO 4+H 2O
Al2O3+3H2SO4===AI 2(SO4)3+3H2O
Al2O3+2NaOH===2NaAIO 2+H2O (Al 2O3 是两性氧化物)
FeO+2HCI===FeCI 2+3H2O
Fe2O3+6HCI===2FeCI 3+3H2O
Fe3O4+8HCI===FeCI 2+2FeCI 3+4H2O
含氧酸
3C12 +2P
C12 +PC13
占燃
=^^2FeCl3
Cla +2Na
S + Hi
N2 + 3Hg =
2.还原性
点燃
—FeS
1.氧化性:
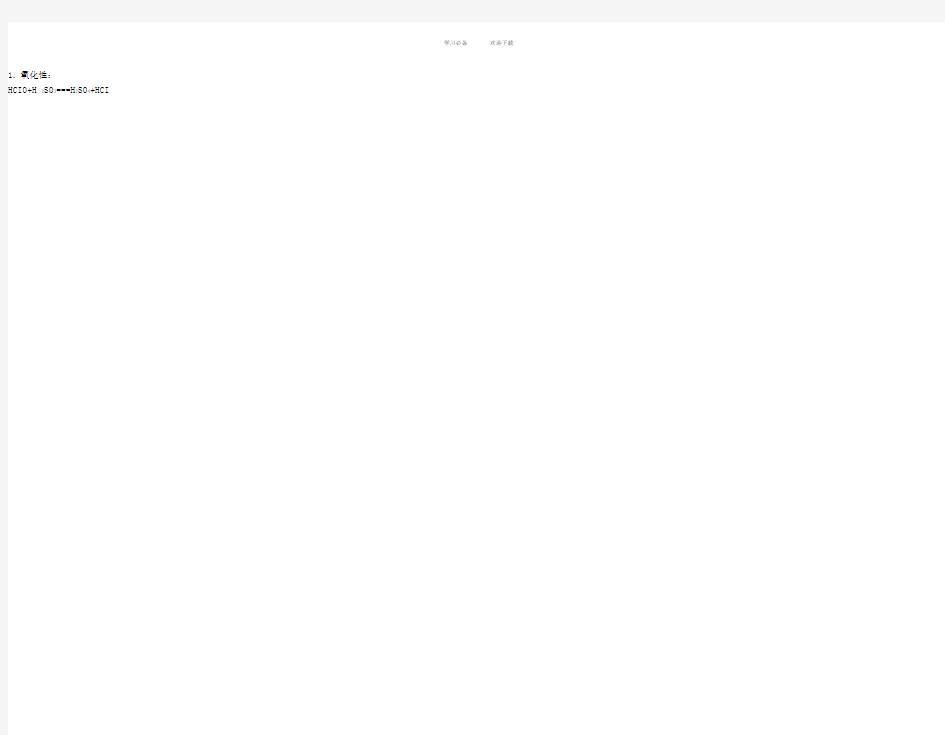
HCIO+H 2SO3===H2SO4+HCI
HCIO+H 2°2===HCI+H 2O+O2
(氧化性:HCIO>HCIO 2>HCIO 3>HCIO4, 但浓,热的HCIO4氧化性很强) 2H2SO4 CS) + c =£= coaf + 2SOat + 四刃H2SO4+Fe(AI)室温下钝化
A 6H?S04(^) + 2Fe Fe?(S04^3+ 3S0?f + 6H2O 2H2SO4 CS) + Cu CUSO4 + SOaf + 2H£0 H2SO4(浓)+2HBr===SO 2 f +B「2 f +2H2O H2SO4(稀)+Fe===FeSO4+H2 4HNO 3(浓)+C===CO 2 f +4NO2 f +2H2O 6HNO 3(浓)+S===H 2SO4+6NO 2 f +2H2O 5HNO 3(浓)+P===H 3PO4+5NO2 f +H2O 6HNO3 (浓、热)+Fe===Fe(NO 3)3+3NO2f +3出0 4HNO 3(稀)+Fe (不足)===Fe(NO 3)3+NO f +2H2O 8HNO
3(稀)+3Fe (过量)===3Fe(NO 3)2+2NO f +4H 2O 2?还原性:
H2SO3+X2+H2O===H 2SO4+2HX (X 表示Cl2,B「2,l2)
2H2SO3+O2===2H2SO4
H2SO3 + H2O2===H 2SO4+H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCI
3.酸性:
H2SO4(浓)+CaF2===CaSO4+2HF f
H2SO4(浓)+NaCI===NaHSO 4+HCI f
H2SO4(浓)+2NaCI===Na 2SO4+2HCI f
H2SO4(浓)+NaNO 3===NaHSO 4+HNO 3
2HNO 3+CaCO3===Ca(NO 3)2+H2O+CO2 f (用HNO3 和浓
H2SO4不能制H2S, HI , HBr, SO2等还原性气体)
4H3PO4+Ca3 ( PO4) 2===3Ca(H 2PO4)2 (重钙)
3.不稳定性:
2HCIO===2HCI+O 2f
4HN0a 4N02f 亠ST 十阳刃
碱
1.低价态的还原性:
4Fe ( OH) 2+O2+2H2O===4Fe(OH) 3
2.与酸性物质的作用:
2NaOH+SO2 (少量)===Na 2SO3+H2O
NaOH+SO 2 (足量)===NaHSO 3
2NaOH+SiO 2===Na2SiO3+H2O
2NaOH+AI 2O3===2NaAIO 2+H2O
NaOH+HCI===NaCI+H 2O NaOH+H 2S (足量)===NaHS+H 2O 2NaOH+H 2S (少量)===Na2S+2H2O 3NaOH+AICI
3===AI (OH ) 3 J +3NaCI NaOH+AI(OH) 3===NaAIO
2+2H2O NaOH+NH 4CI===NaCI+NH 3f +H2O Mg(OH)
2+2NH4CI===MgCI 2+2NH 3 ? H2O AI(OH) 3+NH4CI
(或NH3 ? H2O 不溶解) 3 .不稳定性:
△
Mg (OH) 2 MgO +
A
2A1 (OH) , - + 3H?0
A
2Fe(0H)3 Fe203 + 3H2O
匚U (OH)屯=== CuO + H^O
盐
1.氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCI 2+CuCI 2 (用于雕刻铜线路版)
2FeCl3+H 2S===2FeCI 2+2HCI+S J
2FeCl3+2KI===2FeCI 2+2KCI+I 2 J
FeCl2+Mg===Fe+MgCI 2
2.还原性:
2FeCl2+CI 2===2FeCI 3
3Na2S+8HNO 3(稀)===6NaNO 3+2NO f +3S J +4H2O
3Na2SO3+2HNO 3(稀)===3Na 2SO4+2NO f +H2O
2Na2SO3+O 2===2Na 2SO4
3.与碱性物质的作用:
MgCI 2+2NH3 ? H2O===Mg(OH) 2 J +NH4CI
AICI 3+3NH 3 ?
H2O===AI(OH) 3 J +3NH4CI
FeCl3+3NH 3 ?
H2O===Fe(OH) 3 J
+3NH4CI
4.与酸性物质的作用:
Na2CO3+HCI===NaHCO 3+NaCI
NaHCO 3+HCI===NaCI+H 2O+CO2 f
3Na2CO3+2AICI 3+3H2O==2AI(OH) 3 J +3CO2f +6NaCI
3Na2CO3+2FeCI 3+3H2O==2Fe(OH) 3 J +3CO2 f +6NaCI
3NaHCO 3+AICI
3===AI(OH) 3 J +3CO2
f + 3NaCI 3NaHCO
3+FeCl3===Fe(OH) 3 J
+3CO2f + 3NaCI
3Na?S+Al2(SO4)
3+SH20=2Al (OH)
3
I+3H2S t + 3Ma2S04
3NaAIO 2+AICI
3+6H2O===4AI(OH) 3
J + 3 NaCI
5.不稳定性:
Na2S2O3+H2SO4===Na2SO4+S J +SO2f +H2O
NEjCl =^= NH3t + HClf
A
NH4HCO? --- NH3f + HsOt + COif
CH-CH+ 班2 一B rCltCHBr
催化剂
n 匚H2=CHC1
△ —
Br2+ HBr
H2—
CH2
CH3
I 浓H2SO4
+ 3HONO2 - -
2C G鹿+ 15O2兰卷12CO2 + 6H20
2CH3CH2OH+2Na 2CH 3CH2ONa+H 2 f
△
C2H 5- -OH + H- -Br C2H 5Br + H2O
C2H5OH(液)+ 3O2(气)- 2CO2 (气)+ 3H2O (液)
催化剂
2CH3CH2OH + O2 2CH3CHO + 2H2O
△
浓H2SO4
C H---O.H +-H- -O —C H C H—O —C H+ H O
? CH3CH2OH
確化剂
\ CH3COOHH4 + 2AgJ + 3NH
3
+ H
2
CH3CHO + 2Ag (WsOH
A
△
CH3CHO + 2C U(OH)2CH3COOH + CU2O J + 2H2O
催化剂
2CH 3CHO + O2
OH
2CH3COOH
ONa
+H2O
OH
+ NaHCO3
CH3CH?S0H+ HOOCCHs ■= CH3CO ie OC2H S + 氐0
A
CH3COOC£H5 + H20 r.叫-=CHaCH^OH + CH3COOH
A
C17 H33C - O — CH2 O
I C17H33C O — CH
0 I
C17H33C _ O — CH 2
3H2
催化剂
加热,加压
J + 3HBr
2C U CNO3)3 2CuO + + 0汕A
2KC1O S=—2KC1 +
Na^COa + H2Of + CO时Ca(HC03)2 =^= CaCO3+ H20 +
A
CaCOg 匚aO + CO;f MgCO3=^= MgO + CO 汀
有机化学部分
占烬
CH4 + 202 ?C02 + 2H20匚田+ C12 ——?CH^Cl + HC1
CH3CI + Cl£—* CH^Cli + HC1
Ahl
匚H2CI2 + C12―* CHC13 + HC1 CHC13 + Cl2——?CC14 + HC1 CEi 同温* 2H£ + C
浓硫酸 e …… ,丄口a CH3CH2OH ------- *CHpCHg f + HjO 17012:
占烬
CH2=CH2 + 302 > 2CO2 + 2H2O CH2-CH2+ f CH2ErCH2Er
CH2=CH2+ ------ >CH3CH20H n CH2=CH2-催化剂a
CaC2 + 2H z0 —C2H2t + Ca(0H)a 占堺C2H2+ 502 > 4C02 + 2H2O
BrCH^CHBr + Br^ ―k CHBraCHBrz
催化叫CH2=CHCi
* fCH2-CH(Cl)^n
浓硝酸一_ + HO —NO2 NO2+ H2O 催化剂
+ Br 2
催化剂
------ *
△
Q CH 2
、/
C
CH3 H2 N。2+ 3H2O
Sa
:C2H5-OH + 丄J CH^CHif + NaBr + HQ
△―
!C2H5-0H + H-OH - 创視.CzHj-OH + HBr
惓化剂
+ NaOIH
ONa
广.+ H2O + CO2
OH
:」+ 3BQ
C17H35C_ O —CH 2
0 I
C17 H35C O —CH 0 I
C17 H35C- O — CH 2
C17H33C O- CH2 CH厂OH I0I
H SO4I
C17H33C O- CH + 3H2O 3C仃H35COOH + CH—OH
0 ' I
C17H33C O~ CH2 CH T
- OH
C17H33 C- O—C
H
2CH2- OH 0
C17H33C O- CH + 3NaOH — 3C仃H35COONa +CH—OH 0 I I
C17H33C- O— CH2 CH2- OH
高中化学58个考点精讲
2、离子反应方程式与离子共存
1.复习重点
(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
⑵定性中有定量,如“由水电离出的『或OH-
浓度为1 x 1O-10mol/L的溶液中,……”。
2.难点聚焦
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。女口CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+ 2H+= CO2T+ H2O、HS-+ H+= H2SI 等。
2、有沉淀生成。如Ba2+、Ca2+、Mg 2+等不能与
SO42-、CO32-等大量共存,
主要是由于Ba2++ CO32-= BaCO3 Ca2++ SO42- =CaSO4 J (微溶);
Mg2+、Al3+、C U2+、Fe2+、Fe3+等不能与OH-大量共存是因为
Cu2+ + 2OH- = Cu(OH) 2 J, Fe3+ + 3OH-= Fe (OH) 3 J 等;
SiO32-、AIO2、S2O3I等不能与H+大量共存是因为SiO32-+ 2H + = H2 SiO3 J AIO2-+ H + + 出0=
Al(OH) 3 J S2O32「+ 2H += SJ+ SO2 ?+ H2O
3、有弱电解质生成。
女口OH-、ClO-、F-、CH3COO-、HCOO-、PO43-、
HPO42-、H2PO4等与H+不能大量共存,
主要是由于OH-+ H += H2O、CH3COO-+ H += CH3COOH 等;
一些酸式弱酸根及NH4+不能与OH-大量共存是因为
HCO3-+ OH-=CO32-+ 出0、HPO42-+ OH-=
3 +
PO4 + H2O、NH4 + OH-=NH3 H2O 等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
女口:AIO2-、S2-、HS-、CO32-、HCO3-、SO32-、
HSO3 、ClO-、F-、CH 3COO-、HCOO-、PO43-、SQ32-、
C6H5O-等必须在碱性条件下才能在溶液中大量存在;
Mg2+、Al3+、Cu2+、Fe2+、Fe3+、NH4+等必须在酸性条件下才能在溶液中大量存在。
(二)、由于发生氧化还原反应,离子不能大量共存
1、一般情况下,具有较强还原性的离子不能与
具有较强氧化性的离子大量共存。如I-、、S2-、HS-
和Fe3+不能大量共存是由于2I-+ 2Fe3+=I2+ 2Fe2+、
2Fe3+ + S2-=SJ+ 2Fe2+、2Fe3+ + 3S2-=SJ+ 2Fe S J
2、在酸性或碱性的介质中由于发生氧化还原反
应而不能大量共存。如NO3-和I-在中性或碱性溶液
中可以共存,但在有大量H+存在情况下不能共存;
SO32-、S2O32-和S2-在碱性条件下可以共存,但在酸性条件
下由于发生2S2-+ SO32-+ 6H += 3SJ+ 3H 20、2S2-+
S2O32-+ 6H += 4SJ+ 3H2O 不能共存。CIO-与S2- 不论是在
酸性条件下还是在碱性条件下都不能大量共存。
(三)、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离
子而不能大量共存的情况。如Fe3+和SCN-、C6H5O-, 由于
Fe3++ SCN-—[Fe(SCN)]2+等络合反应的发生而
不能大量共存。
(四卜能水解的阳离子与能水解的阴离子一般不
能同时存在在同一溶液中,即离子间能发生双水解”
反应。例如:Al3+和HCO- Al 3+和CO32-, Al 3+和S 1,
Al3+和HS「,Al3+和AlO2-, Al3+和C6H5O-, Fe3+ 和AlO
2
-, Fe3+和HCO
3
-, Fe3+和CO
3
2-, NH
4^ AlO2
- 等。如3AlO
2
-+ Al3++ 6H2O=4Al(OH) 3 J等。特别注意:NH4+和
CO32-、”日4+和HCO3-、NH 4+和CH3COO- 在同一溶液中能大量
共存。
注意事项:1 .首先必须从化学基本概念和基本理论
出发,搞清楚离子反应的规律和离子共存"的条
件。在中学化学中要求掌握的离子反应规律主要是离子间
发生复分解反应和离子间发生氧化还原反应,以
及在一定条件下一些微粒(离子、分子)可形成络合离子
等。离子共存”的条件是根据上述三个方面统筹考虑、比
较、归纳整理而得出的。因此解决离子共
存”问题可从离子间的反应规律入手,逐条梳理。
2 ?审题时应注意题中给出的附加条件,如:
①酸性溶液(H + )、碱性溶液(OH「)、能在加入
铝粉后放出可燃性气体的溶液、由水电离出的H +或OH-
浓度为1X 10-10mol/L的溶液等。
②有色离子:MnO4:Fe3+, Fe2+, Cu2+ , Fe
(SCN)2+使溶液呈现一定的颜色。
③MnO4「、NO3「、6207"等在酸性条件下具有强氧化
性。
④注意题目要求“一定大量共存”、“可能大量共
存”还是“不能大量共存”等要求。
3.审题时还应特别注意以下几点:
(1)注意溶液的酸碱性对离子间发生氧化还原反
应的影响。如:Fe2+与NO3「能共存,但在强酸性条件下发
生3Fe2++NO 3 +4H +=3Fe3+ + NO f+ 2H2O 而不能大量共
存;「与NO3「能共存,但在强酸性条件下不能大量共
存;MnO 与C「在强酸性条件下也不能大量共存;S2「与
SO32「在碱性条件下可共存,但在酸性条件下不能大量共
存。
(2)弱酸的酸式根离子(如HCO3、HS O3、HS、
HPO42-、H2PO4)既不能与H +大量共存也不能与OH
大量共存。女口:HCO3 + OH = CO32+ H2O (HCO 3 遇
碱时进一步电离)
HCO3「+ H += CO2 f + H2O0
(3)注意挖掘题目中隐含的信息,排除干扰信
息,克服非智力因素失分。
离子方程式的书写正误是历年高考必出的试题,考查
离子方程式的目的主要是了解考生使用化学用语的准确程
度和熟练程度,具有一定的综合性。从命题的内容看,存
在着三种特点:
⑴所考查的化学反应均为中学化学教材中的基
本反应,错因大都属于化学式能否拆分、处理
不当、电荷未配平、产物不合理和漏掉部分反
应等。
(2)所涉及的化学反应类型以复分解反应、溶液中
的氧化还原反应为主。
⑶一些重要的离子反应方程式,在历年考卷中多次
重复。
4.离子方程式正
误判断规律(八“看”)
⑴看离子反应是否符合客观事实,不可主观臆造产
物及反应。
⑵看“ =” “=” “f” “J ”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3
不能写成CO32-* H +
⑷看是否漏掉离子反应。
⑸看电荷是否守衡。
⑹看反应物或产物的配比是否正确。
⑺看是否符合题设条件及要求。
⑻看物料是否守衡。
3.例题精讲
[例1]下列各组中的离子,能在溶液中大量共存的是:
A. K J Ag S NO3「、C「 B . Ba"、
Na+> CO3"、OH —
C. Mg2、Ba2、OH、NO3
D. H、
K 十、CO32—、SO42「
E. Al3*、Fe3S SO42「、C「
F. K + >
H十、NH4+、OH一解析:A组中:Ag ++ C「= AgCl J B
组中,
Ba2+ + CO32 = BaCO3 J
C 组中,Mg2*+ 2OH「= Mg(OH) 2 J
D 组中,
2H ++ CO32一= CO2 f + H2O
E组中,各种离子能在溶液中大量共存。
F组中,NH4+与OH「能生成难电离的弱电解
质NH3 ? H2O,甚至有气体逸出。
NH4+ + OH「= NH3 ? H2O 或NH4+ + OH「=
NH3 T + H2O
答案:E
[例2]在pH = 1的无色透明溶液中,不能大量共存的
离子组是:
A. Al3+> Ag S NO3「、「
B. Mg2
+、NH4+、NO3「、C「
C. NH4+> KJ S2「、Br「
D. Zn2
+、Na+> NO3「、SO4"
解析:题目给出两个重要条件:pH = 1(即酸性)和无
色透明,并要求找出不能大量共存的离子组。选项A 中
Ag +与「不能共存,生成黄色的AgI不溶于
HNO 3(H +和NO3「),Al3*、NO3「、J 都为无色,符合
题意。选项B、D中的各离子虽都是无色的,但能
共存于酸性溶液中,不符合题意。选项C中各离子
能够共存,且为无色,但S2「与H *不能大量共存,所以
C也符合题意。答案:A、C [例3]下
列各组离子,在强碱性溶液中可以大量共存的是:
A. K*、Na*、HSO3「、C「
B. Na
*、Ba2*、AIO2「、NO3「
C. NH4*、K*、C「、NO3一
D. K
+、Na S CIO「、S2「
解析:A 中HSO3「+ OHSO3“+ 出0 C 中
NH4 ++ OHNH3 ? H2O
D中CIO —具有强氧化性,S2「具有还原性,发生
氧化还原反应答案:B
[例4]下列各组离子在水溶液中能大量共存的是:
(1)1一、CIO 一、NO 3一、H + ⑵K +、
NH4+、HCO3一、OH 一
(3)SO32、SO42.CI一、OH —(4)Fe3 +、Cu2、SO42、Cl
(5)H +、K +、AIO 2—、HSO3—(6)Ca2+、
+ 2 — 2 —
Na、SO4 、CO3
A . (1)和(6)
B .⑶和(4) C. (2)和
(5)
D . (1)和(4)
解析:通常组合选择题需对题干及各项逐一分析,选出符合题意的组合,然后与各选项比较得出结论。但本题可用排除法,先判断出组合(1)由于次氯酸是弱酸,故CIO「与H +不能大量共存,发生反应:H ++CIO 一=HCIO,次氯酸有较强的氧化性以及硝酸(NO 3一、
H +)都能与「(具有还原性)发生氧化还原反应,因此该组不合题意,凡是含(1)的选项即A和D都不正确,可以排除。(2)中因发生:NH4*+ OHNH3 ? H2O, HCO3「+ OH _=CO32「+ H2O而不能大量共存,由此排除C,正确答案为B。其中⑶和⑷这两组离子在水溶液中能大量共存。本题涉及的组合(5)也不能大量共存,因为发生:H ++ AIO 2^ +出0= AI(OH) 3 ^, H + HSO3 = SO2T + H2O而不能大量共存。组合⑹ 中因Ca2++ CO32「= CaCO s J析出沉淀而不能大量共存。答案:B [例5]下列各组离子,能够在溶液中大量共存的是:
A. Na+、Al3+、NO3一、AIO 2一
B. Na +、Ca2+、HCO3一、HSO4—
C.Cu2+、K +、NO3一、OH 一
D. S2O32
一、Na +、H+、SO42—
E. Fe3+、Cl一、SCN 一、K+
F. Fe3 +、NH4+、Cl一、NO3—
G. Fe2+、Cl一、NO3—、H +H . Na +、Al3+、SO42一、HCO3—
解析:解本题的关键在于熟悉离子反应、盐类水解、氧化还原反应的规律以及某些特殊离子的存在条件是否由于其它离子的存在而遭破坏。下列各组离子, 因为发生下列反应不能大量共存。
A 组:AI3++ 3AIO2「+ 6H2O= 4AI(OH) 3 J
B 组:HCO 3一+ HSO4一= H2O + CO2 f + SO4"
C 组:Cu2 ++ 2OHCu(OH) 2 J
D 组:S2O32「+ 2H += SO2T+ SJ+ H2O
E 组:Fe3* + 3SCNFe(SCN) 3 G 组:3Fe2++ NO3「+ 4H += 3Fe3++ NO f + 2H2O
H 组:Al3 ++ 3HCO3一= AI(OH) 3 J + 3CO? f
F组:能大量共存答案:F
[例6]下列离子方程式正确的是
A . AICI 3溶液中加入过量氨水:
Al +3NH 3 H2O= AI(OH) 3 J +3NH 4 ;
B . C6H5ONa 溶液中通入少量CO2 : 2C6H5。
+CO2+H2O ■ 2C6H5OH+ CO 3;
C.FeBr2溶液中通入
少量CI2: 2Br-+ci2 =
Br2+2CI-;
D.Mg(HCO 3)2溶液中加入足量NaOH溶液:
Mg +2HCO3-+4OH -= Mg(OH) 2 J +2CO3 -+2出0. 解析:E
中不论CO2多少,均得HCOf;C中应先氧化Fe2+。答
案:A、D
[例7]下列离子方程式正确的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至
沉淀完全:
2H++SO42-+Ba2++2OH-=
BaSO4 J +2HO
B .碳酸钠与醋酸溶液反应:
CO3 +2CH 3COOH = CO2T +2CHCOO +H2O
C.将1?2mL氯化铁饱和溶液加入到20 mL 沸水
中:
Fe3++3H2O —'—:Fe(OH)3(胶体)+3H +
D .氢氧化铁与氢碘酸中和:Fe(OH)3+3H +=
3+
Fe +3H2O
解析:A应为H +SO4 -+Ba +OH-= BaSO q J +HO ;D 中氢
碘酸有还原性,要还原
+3 价的铁:2Fe(OH)3+6H +2I-= 2Fe +I2+6H2O 答案:
B、C
[例8]下列离子方程式正确的是
A.等物质的量浓度的Ba(OH)2溶液与明矶溶液以
体积比3比2混合
3Ba2+ + 6OH 一+ 2AI3+ + 3SO42「= 3BaSO4 J +
2AI(OH) 3 J
B . Fe(OH)2溶于稀硝酸中Fe(OH)2+ 3H+=
Fe2++ 3H2O
C. H218O 中投入Na2O2 固体2H218O+ 2O22
「= 4OH「+ 18O2f
D. CuCl2溶液中加入Na2S溶液Cu2++
+ 2H2O= C U(OH)2 J + H2ST
解析:B中硝酸有氧化性,要氧化+2价的铁:3Fe(OH)2 +
10H++ NO3「= 3Fe3++ NO f + 8H2O;
C 应为2H218O+ 2 Na2O2= 2 Na OH + 2 Na 18OH + O2 f;
D 应为Cu2++ S2「= Cu S J 答案:A
[例9]下列离子方程式的书写正确的是
A . FeS固体与稀HNO3溶液混合FeS+ 2H
=2Fe2 + H z Sf
B . NH4HSO4溶液中加入足量Ba(OH) 2溶液H ++
SO42「+ Ba2++ OH「= BaSO4 J + H2O
C. Ca(CIO)2溶液中通入足量的CO2气体Ca2
+ 2CIO + CO2 + H?0 = CaCO3 J + 2HCIO
D .等浓度等体积的Ca(H2PO4)2溶液与NaOH 溶液混
合Ca2++ H2PO4「+ OH「= CaHPO4J+ H2O 解析:A中硝酸有
氧化性,要氧化+2价的铁和-2价的硫;
+ + 2 — 2 + —
B 应为NH4 +H + SO4 + Ba + 2OH =
BaSO4 J +NH3 H2O + H2O; C 中CO2 足量应生成HCO3—。
答案:D
[例10]下列离子方程式书写正确的是
A .将少量SO2气体通入NaCIO 溶液中
SO2+2CIO —+H 2O=SO32—+2HCIO
B .向KHSO4溶液中加入Ba(OH) 2溶液至所得溶液
的pH=7 Ba2++2OH —+2H++SO42 —=BaSO4 J +2H2O
C.向Ca(HCO3)2溶液中滴入过量的NaOH溶液Ca +2
HCO3 +2OH =CaCO3 J +CO3 +2H2O
D .112mL(S.T.P) CI2通入10mL1mol/L 的FeBr?
溶液中2Fe2++4Br —+3Cl2=2Fe3++6CI —+2Br2
解析:A中SO32—要被HCIO氧化;D中Cl2少仅氧化Fe2+
答案:B、C
4.实战演练
一、选择题(每小题有一个或两个选项符合题意)
1.下列各组离子,在强碱性溶液中可以大量共存的
是
A .
I
-、AIO2、CI-、S2—B. Na+、
K+、NH 4+、Ba2+
C. Br-、S2-、Cl-、CO32一
D. SO3:2-、NO3-、SO42-、HCO3-
2.下列离子在溶液中因发生氧化还原反应而不能大量共
存的是
A .H3O+、NO3—、Fe2+、Na + B. Ag
+、NO3—、Cl—、K+
C . K +、Ba2 +、OH —、SO42 —D. Cu2+、NH4+、Br
—、OH—
3.若溶液中由水电离产生的
(OH —)=1 x 10—14mol L —
1,满足此条件的溶液中一定.可以大量共存的离子组是
3+ + ——+
A. Al Na NO 3 Cl
B. K
Na+ Cl—NO3—
+ + ——+
C. K Na Cl AIO 2
D. K
+ 2——
NH4 SO4 NO3
4.对某酸性溶液(可能含有
Br—, SO42—, H 2SO3,
NH4+)分别进行如下实验:①加热时放出的气体可以使品
红溶液褪色;②加碱调至碱性后,加热时放出的气体可
以使润湿的红色石蕊试纸变蓝;③加入氯水
时,溶液略显黄色,再加入BaCl2溶液时,产生的白
色沉淀不溶于稀硝酸,对于下列物质不能确认其在溶液中
是否存在的是
—2
A . Br
B . SO4
C. H2SO3
D. NH4+
5.在含有「且能使酚酞变红的无色溶液中,可大量
存在的离子组是
+ 亠2+ ——亠■一
A. Na、Cu 、Br、Cl B . AIO 2
一、K+、NH4+、Na+
C. K+、Na+、NO3一、H+
D. K+、
S2一、SO42一、OH 一
+ —12
6.某溶液由水电离出的
c(H )=10 moI/L,则此溶
液中可能大量共存的离子组是
A. HCO3—、CI—、NH4+、Mg2++
B. Na、
K+、N03—、Cl—
C. K+、Ba2+、
I
、NO3—2+
D. Ba 、
Na+、Cl—、SO42—
7.下列各组离子在溶液中不能大量共存,且加入过量
NaOH溶液或过量稀盐酸均能得到澄清溶液的是
A. Fe3+、CI 一、Na+、SO42一
B. Al 3+、
Na+、CO32一、NO3—
C. Ag、Na、SO4 、NO3
D. AIO 2
一、CO32一、K+、Na+
&某能使石蕊试液变红的溶液中,能大量存在的离
3+ + 2- - +
A . Al NH 4 S04 CI
B . Na 断:
2+ - —
Mg HCO 3 NO 3
溶 液 中 肯定存在 的 离 + + - - 2+ C . K Na AI0 Cl D . Fe K 有:
。
— - N03 Cl 溶 液 中 肯定不存在
的 离 9.在pH = 0的无色透明溶液中, 因发生氧化还原反
有:
。 应而不能大量共存的离子组是
溶 液中 还 不能确定是否存在 的离 A . Na 、K 、MnOQ Cl 一 B . C T : S 2 0:、 K 、
Na 。
子是
子
子 子
到有红棕色沉淀生成,且沉淀量不减少。由此可以推
C ? Na 、Cl -、CH 3COO - K
D ?
10 ?常温下测得某无色溶液中由水电离出的 亠 13 1
[H ]水T 研mol 「,又知该溶液中还有心 K 4 ?、有一瓶
澄清溶液Cl 其中可能含有:
NH 4+、K +
、Mg 2+
Al 3+、 Fe 2
CO 32
一,取该溶液进行下列实验:
⑴取部分溶液,向其中逐滴滴入 Ba (OH ) 2溶液
至
、NO 3「
、C 「、SO 4
2
「
Na 、Cl 一,那么该溶液中还一定存在的离子是 AlO 2 " ClO
- 2 + 2 M g 、SO 4 一 C . Fe 、Cu D Ba 、K
二、填空简答
1. 将 KI 、NaBr 、NaCl 、K 2S 、(NH 4) 2SO 3 的溶液 及氯水和碘水放入一烧杯中,若反应完毕后氯有剩余, 则溶液中含量最大的离子是 _________________ , 一定不存 在的离子是 _______________ 。
2. 有一无色透明的溶液可能含有H + Mg 2+ Ba 2*、 Cu"、 Ag +
C 「、 OH 「、 NO 3- 、 SO 42-、 SO 32-
、 HCO 3 「离子,该溶液与铝反应放出的气体只有 H 2,该溶液 存在的离子有两种组合情况。 ⑴第一种组合:其中一定含有 ________________ 离子, 一定不存在 ________________________ 离子。(水电离 出的H *、OH 「忽略不计,下同。) ⑵第二种组合:其中一定含有 ________________ 离子, —疋不存在 _________________________ 。 3. —种澄清透明的溶液中可能含有下列离子: K +、Fe 3+、Ba 2+、Al 3+ NH 4+、 C 「、 「、 NO 3「、 HCO 3 _、SO 32-、SO 42一现做以下实验: ⑴将溶液滴在蓝色石蕊试纸上,试纸呈红色 ⑵取少量溶液,加入用稀硝酸酸化的 BaCl 2溶液,产 生白
色沉淀 ⑶将⑵中的沉淀过滤。由滤液中加入硝酸银溶液,产 生白色沉淀
⑷另取溶液,逐滴加入氢氧化钠溶液至过量, 只观察
过量,有白色沉淀生成, 沉淀量与加入Ba (OH ) 2溶液量的关系如右图。 ⑵取(1)反应后过滤所得沉淀和滤液,在沉淀中加 入稀盐酸后,沉淀不减少。
将滤液分为两等份,一份加热,未产生刺激性气味的 气体;另一份加 HNO 3酸化
时有白色沉淀产生,继续加 HNO 3,沉淀又消失,再 加
AgNO 3没有变化。
根据以上事实确定: 该溶液中肯定存在的离子有 _________________________ ?
肯定不存在的离子有 __________________ , 不能确定的离子有 _________________。
5.某河道两旁有甲乙两厂。它们排放的工业废水中,
共含 K +
、Ag +
、Fe 3+
、Cl _、OH 「、
NO 3「六种离子。甲厂的废水明显呈碱性,故甲厂废 水中所
含的三种离子是 _____________ 、 _______ 、 _____ 。 乙厂的废水中含有另外三种离子。如果加一定量_(选 填:活性炭、硫酸亚铁、铁粉)。可以回收其中的金 属 (填写金属元素符号) 。另一一
种设想是将甲厂和乙厂的废水按适当的比例混合, 可
以使废水中的 ___________________ (填写离子符号)
转化为沉淀。经过滤后的废水主要 含 ,可用来浇灌农田。
一、选择题(每小题有一个或两个选项符合题意)
1 .下列反应的离子方程式不正确.的是 A .向烧碱溶液中滴加少量氯化铝溶液 A1 3+
+4
OH 一 = AlO 2^ +2H 2O
2+
B .物质的量相等的溴化亚铁跟氯气反应 2Fe
一 3+ 一
+2Br +2C12=2Fe +Br 2+4C1 2- — C .硫化钾晶体溶于水
S +2H 2O ===20H +H 2S
2—
+
D .向碳酸钠溶液中滴加过量的稀硫酸 CO 3 +2H
=C02f +H 2O
2. 下列反应的离子方程式书写正确的是
A . Fe 粉与稀硝酸的反应: Fe + 2H (稀)=Fe 2
+ H 2 f
B.CI 2与水的反应:Cl 2 + H 2O = 2H + + Cl - + ClO -
C . Na
与盐酸的反应:2Na + 2H + = 2Na +
+ H ?f
D .HAc 与 KOH 溶液的反应:HAc + OH - = Ac - + H 2O 3. 钢铁发生吸氧腐蚀时,正极上发生的电极反应是
+ 2+
A. 2H + 2e == H 2 B . Fe
+ 2e == Fe
C . 2H 2O + 02 + 4e == 40H -
D . Fe 3+ + e == Fe 2+
4. 下列离子方程式书写正确的是' A .向碳酸氢钠溶液中滴加少量氢氧化钡溶液 2HC0 孑 + Ba 2++ 20H 一 = BaCO
B. 向沸腾的20mL 水中滴入
D
白粉溶液中通入S
°2
4 4-3H 2O =
J
Ca 2
2CIO — SO 2 H 2O = CaSO 3』川 2HCIO 7.下列反应的离子方程式正确的是
A .将H 2S 气体通入FeCl 3溶液中:2Fe +S =2Fe +S
B. 将少量的NaHS {溶液跟Ba (OH ).溶液混合反 应:F f +SO^+BsT+OF^BaSOj +HO
C. 将少量的(NH ) 2
HPO 溶液加入过量的澄清石灰水中:
Ca (OH 》+2NH +
+HPO -
=2NH f +CaHPOJ +2H 2
O 2- - S +2H 2O=H 2S+2OH
于PO :—+ 2H 2(D .硫化钠溶于水:
8下列反应的离子方程式书写正确的是 A. 鸡蛋壳在醋酸中溶解有气泡产生: Ca 2
+ H 2O + CO 2T
B .偏铝酸钠溶液中加入过量盐酸: 3+ Al + 2H 2O
C .溴化亚铁溶液中通入少量
Cl 2: 3+
一
2Fe + 2Cl
D. CuSO 4溶液中加入少量 Ba (OH ) 2溶液:SO 42
一
+ Ba
2
=BaSO 4 J
9. (2001上海卷13.)下列反应的离子方程式错误的是
A .向碳酸氢钙溶液中加人过量氢氧化钠 Ca 2+
+
2HCO 3一 + 2OH 一 = CaCO 3 J + 2H 2O + CO 32
「
B. 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢 铵溶
液混合
Ba 2
+ 2OH + NH 4 + HCO 3
= BaCOsW
NH 3 ?出0+ H 2O
C. 氢氧化铝与足量盐酸反应 +
+ 3H 2O
D .过量C02通入氢氧化钠溶液中
mL 氯化铁饱和溶液 (OH ) 丁 I + 31T
C .向碳酸氢镁溶液中加入足量的氢氧化钡溶液 Mg 2 + 2HC0r + 20H-二 MgCO 3 J+CO : + 2H 2O
D .将少量的硝酸银溶液滴入到氨水中
Ag +2NH t ? H 20=〔Ag (NH 3) 2〕
5. 下列离子方程式正确的是 A . FeBr 2溶液中加入过量氯水 2Fe +2CI -
B.
铁粉和FeCl 3溶液反应
Fe + Fe" = 2Fe
C.
铁粉和过量的稀 HN0 3反应 Fe
+NO 3-+4H +
3+
.
Fe +N0 f +2H 2O
D. Mg (HCO 3)2溶液与过量 NaOH 溶液反应 Mg 2++2HCO 3-+2OH - = MgCO 3 J + CO 32-+2H 2O 6. 下列离子方程式正确的是 A .向Ba (OH
)2溶液中逐滴加入 好沉淀完全
CaCO 3 + 2H +
— +
AlO 2 + 4H
+2H.O
2+
2Fe +Cl 2
NH 4HSO 4溶液至刚 Cl 2 + 2Fe 2+
Al(OH) 3 + 3H +
= Al CO 2+ 2OH
Ba 2
2OH F NH 4 H
SO 42
_-BaSO 4 ■加NH 3 H 2(C0H ;"0H
20
10. 下列离子方程式书写正确的是 A .碳酸氢钙溶液中加
入过量的氢氧化钠溶液
B .用pt 电极电解饱和
MgCl2
溶液HC °3 + OH = CO, +
H20
B .氯化铁溶液中通入硫
3+ 2-
2+
.
2Fe +S = 2Fe + S J
C .次氯酸钙溶液中通人过量二氧化碳 —
+H 2O+CO 2 = CaCO3
J +2HClO
2CP 2H 2O 电解2OH 一 H CI 2
C .苯酚钠溶液跟
AlCl 3
溶液反应
化氢气体
2+ Ca + 2ClO
高中化学方程式大全非金属单质
高中化学方程式大全非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)1, 氧化性: F2 + H2 === 2HF F2 +Xe(过量)===XeF2 2F2(过量)+Xe===XeF4 nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O2 2F2 +2NaOH===2NaF+OF2 +H2O F2 +2NaCl===2NaF+Cl2 F2 +2NaBr===2NaF+Br2 F2+2NaI ===2NaF+I2 F2 +Cl2 (等体积)===2ClF 3F2 (过量)+Cl2===2ClF3 7F2(过量)+I2 ===2IF7 Cl2 +H2 ===2HCl 3Cl2 +2P===2PCl3 Cl2 +PCl3 ===PCl5 Cl2 +2Na===2NaCl 3Cl2 +2Fe===2FeCl3 Cl2 +2FeCl2 ===2FeCl3 Cl2+Cu===CuCl2 2Cl2+2NaBr===2NaCl+Br2 Cl2 +2NaI ===2NaCl+I2 5Cl2+I2+6H2O===2HIO3+10HCl Cl2 +Na2S===2NaCl+S Cl2 +H2S===2HCl+S Cl2+SO2 +2H2O===H2SO4 +2HCl Cl2 +H2O2 ===2HCl+O2 2O2 +3Fe===Fe3O4 O2+K===KO2 S+H2===H2S 2S+C===CS2 S+Fe===FeS S+2Cu===Cu2S 3S+2Al===Al2S3 S+Zn===ZnS N2+3H2===2NH3 N2+3Mg===Mg3N2 N2+3Ca===Ca3N2 N2+3Ba===Ba3N2 N2+6Na===2Na3N N2+6K===2K3N N2+6Rb===2Rb3N P2+6H2===4PH3
高中有机化学常用反应方程式汇总(免费)
光照 光照 光照 光照 高温 CaO △ 催化剂 加热、加压 催化剂 △ 催化剂 高中有機化學方程式匯總 1. CH 4 + Cl 2 CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 2 6. C 16H 34 C 8H 18 + C 8H 16 7. CH 3COONa + NaOH CH 4↑+ Na 2CO 3 8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br 9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 23 12. nCH 2 = CH 2 ] n 13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 2 17. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO 20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2O
NaOH H 2 O 醇 △ 催化剂 △ 浓硫酸 170℃ 浓硫酸 140℃ 催化剂 △ 24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr 28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr 29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O 30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑ 31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O 32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 3 37 38. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O 41CH 3O 42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑
高一必修一化学方程式及离子方程式总结
必修一化学方程式及离子方程式小结 1、硫酸根离子的检验:BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl SO42- + Ba2+ == BaSO4↓ 2、碳酸根离子的检验:CaCl2 + N a2CO3 = CaCO3↓ + 2NaCl CO32- + Ca2+== CaCO3↓ 3、碳酸钠与盐酸反应:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ CO32- + 2H+== CO2↑+ H2O 4、木炭还原氧化铜:2CuO + C 2Cu + CO2↑ 5、钠与非金属单质反应: 4Na+O2=2Na2O 2Na+O2 Na2O2 Cl2 +2Na 2NaCl 6、钠与水反应:2Na+2H2O=2NaOH+H2↑ 2Na + 2H2O == 2Na+ + 2OH-+ H2↑ 7、氧化钠的主要化学性质:2Na2O+O2 2Na2O2 Na2O+H2O=2NaOH Na2O+SO3=Na2SO4 Na2O+CO2=Na2CO3 Na2O+2HCl=2NaCl+H2O 8、过氧化钠的主要反应:2Na2O2+2H2O=4NaOH+O2↑;2Na2O2+2CO2=2Na2CO3+O2 Na2O2+H2SO4(冷、稀)=Na2SO4+H2O2
9、氯气的主要化学性质: Cl2 +H2 2HCl (或光照) 3Cl2 +2P 2PCl3 Cl2 +PCl3 PCl5 3Cl2 +2Fe 2FeCl3 Cl2 +2Na 2NaCl Cl2+Cu CuCl2 Cl2 +2FeCl2 =2FeCl3 Cl2 + 2Fe2+ == 2Fe3+ + 2Cl- 2Cl2+2NaBr=2NaCl+Br2 Cl2 + 2KI =2KCl + I2 Cl2 + 2I- == 2Cl - + I2 Cl2+H2O=HCl +HClO Cl2 + H2O == Cl- + H+ + HClO Cl2+SO2 +2H2O=H2SO4 +2HCl Cl2 + SO2 + 2H2O == 2Cl- + SO42- + 4H+ Cl2+2NaOH=NaCl+NaClO+H2O 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O Cl2 + 2OH- == Cl- + ClO- + H2O 10、铁及其化合物的主要化学性质:2Fe + 3Cl2 2FeCl3 3Fe + 2O2 Fe3O4 Fe + S FeS 3Fe+4H2O(g) Fe3O4+4H2 Fe+2HCl=FeCl2+H2↑ Fe+2H+ = Fe2+ + H2↑ Fe + CuSO4 = FeSO4 + Cu Fe + Cu2+ = Fe2+ + Cu 4Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3 2Fe(OH)3 Fe2O3+3H2O 2FeCl2 + Cl2=2FeCl3 2FeCl3+Fe=3FeCl2 2FeCl3+Cu=2FeCl2+CuCl2 FeCl3 + 3KSCN == Fe(SCN)3 + 3KCl
高中化学方程式总结整理
1 高中化学方程式 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4 (XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过 量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3 Cl2+PCl3PCl5 Cl 2+2Na2NaCl 3Cl2+2Fe2FeCl3 Cl2+CuCuCl2 Cl2+2FeCl2===2FeCl3 (在水溶液中:Cl2+2Fe2+===2Fe3++3Cl?) Cl2+2NaBr===2NaCl+Br2Cl2+2Br?=2Cl?+Br2
Cl2+2KI===2KCl+I2Cl2+2I?=2Cl?+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓ (水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3FeFe3O4 O2+K===KO2 S+H 2H2S 2S+CCS2S+ZnZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2CuCu 2S (只能由单质制取,不能由离子制取) 3S+2AlAl2S3 (只能由单质制取,不能由离子制取) N 2+3H2催化剂 高温高压2NH3 N2+3MgMg3N2 N2+3CaCa3N2 2 N 2+3BaBa3N2 N2+6Na2Na3N N2+6K2K3N N 2+6Rb2Rb3N N2+2Al2AlN P 4+6H24PH3P+3NaNa3P 2P+3ZnZn3P2 H 2+2Li2LiH 2、还原性
高中化学方程式大全(完整版)[1]2
第一章 卤素 第一节 氯气 1、NaCl 2Cl Na 22??→?+点燃 2、22CuCl Cl Cu ??→?+点燃 3、32FeCl 2Cl 3Fe 2??→?+点燃 4、HCl 2Cl H 22????→?+点燃(光照) 5、32PCl 2Cl 3P 2??→?+点燃 6、523PCl Cl PCl →+ 7、HClO HCl O H Cl 22+→+ 8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++?→? +?2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+??→?见光
第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 44 2(浓) 15、↑+?→? +?HCl SO Na NaCl NaHSO 424 16、↑+?→?+?HCl 2SO Na SO H NaCl 2424 2(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+ 18、33NaNO AgCl AgNO NaCl +↓→+ 19、33KNO AgCl AgNO KCl +↓→+ 20、↑++→+2223CO O H CaCl CaCO HCl 2 第三节 氧化还原反应 21、O H Cu H CuO 22+?→? +? 22、O H 2NO 4CO HNO 4C 2223+↑+↑→+ 23、O H 3NO NH NO Zn 4HNO 10Zn 4234233++?→?+?)((极稀) 24、4243324SO H 15PO H 6P Cu 5O H 24CuSO 15P 11++→++ 25、O H 3KCl Cl 3HCl 6KClO 223+↑→+(浓) 26、O H 3NO NH NO Mg 4HNO 10Mg 4234233++?→?+?)((极稀)
高中化学所有化学反应方程式
高中化学所有化学反应方程式 一、非金属单质(F2,Cl2,O2,S,N2,P,C,Si,H) 1、氧化性: F2+H2===2HF (阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2 (水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF (ClF属于类卤素:ClF+H2O==HF+HClO ) 3F2(过量)+Cl2===2ClF3 (ClF3+3H2O==3HF+HClO3 ) Cl2+H22HCl (将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6H Cl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓ Cl2+H2S===2HCl+S↓(水溶液中:Cl2+H2S=2H++2Cl–+S↓ Cl2+SO2+2H2O===H2SO4+2HCl Cl2+SO2+2H2O=4H++SO42–+2Cl– Cl2+H2O2===2HCl+O2Cl2+H2O2=2H++Cl–+O2 2O2+3Fe Fe3O4O2+K===KO2 S+H2H2S 2S+C CS2S+Zn ZnS S+Fe FeS (既能由单质制取,又能由离子制取) S+2Cu Cu2S (只能由单质制取,不能由离子制取) 3S+2Al Al2S3 (只能由单质制取,不能由离子制取)
高中化学方程式与离子方程式大全
高中化学方程式及离子方程式大全 1、向氢氧化钠溶液中通入少量CO2:2NaOH + CO2 ==== Na2CO3+ H2O 2、在标准状况下 2.24LCO2通入1mol/L 100mLNaOH溶液中:CO2+NaOH NaHCO3 3、烧碱溶液中通入过量二氧化硫:NaOH +SO2==NaHSO3 4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 5、氨水中通入少量二氧化碳:2NH3?H2O+CO2== (NH4)2 CO3+ H2O 6、用碳酸钠溶液吸收少量二氧化硫:Na2CO3+ SO2Na2SO3+ CO2↑ 7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc 9、苯酚钠溶液中通入少量二氧化碳:CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3 10、氯化铁溶液中通入碘化氢气体:2FeCl32Fe Cl2+ I2+2 H Cl 11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4 12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2 SO4+ 2HCl+H2SO4 13、氯气通入水中:Cl2+H2O HCl+HClO 14、氟气通入水中:2F2+2H2O 4HF+O2↑ 15、氯气通入冷的氢氧化钠溶液中:Cl2+2 NaOH══NaClO+NaCl+ H2O 16、FeBr2溶液中通入过量Cl2:2FeBr2+ 3Cl2══2FeCl3+2 Br2 17、FeBr2溶液与等物质的量Cl2反应:6FeBr2+ 6C124FeCl3+2FeBr3+ 3Br2 18、足量氯气通入碘化亚铁溶液中:3Cl2+2FeI22FeCl3+2I2 19、在FeI2溶液中滴入少量溴水:FeI2 +Br2FeBr2+ I2 20、氯化亚铁溶液中滴入溴水:6FeCl2 + 3Br2══4FeCl3+2 FeBr3 21、钠与水反应:2Na+2H2O 2NaOH +H2↑ 22、铝片投入氢氧化钠溶液:2Al+ 2NaOH +6H2O 2 Na [Al(OH)4]+3H2↑ 23、氯化铁溶液中加入铁粉:2FeCl3+ Fe 3 FeCl2 24、FeCl3溶液与Cu反应:2FeCl3+ Cu CuCl2+2FeCl2 25、硫氢化钠溶液与碘反应:NaHS+I2S↓+ HI+NaI 26、过氧化钠和水反应:2Na2O2+2H2O=4NaOH+O2↑ 27、铜与浓硝酸:Cu+4HNO3(浓)Cu(NO3)2+ 2NO2↑+ 2H2O
高中化学方程式总结
最新高中化学方程式汇编﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡无机化学反应方程式﹡﹡﹡﹡﹡﹡﹡﹡﹡﹡§1◆碱金属元素 4Na+O2===2Na2O 2Na2O+ O2Na2O2 4Na+2O22Na2O22Na+S===Na2S(爆炸) 2Na+2H2O===2NaOH+H2↑Na2O+H2O===2NaOH 2Na2O2+2H2O===4NaOH+O2↑ (此反应分两步:Na2O2+2H2O===2NaOH+H2O2;2H2O2===2H2O+O2.) Na2O+CO2===Na2CO32Na2O2+2CO2===2Na2CO3+O2 Na2CO3+HCl===NaHCO3+NaCl NaHCO3+HCl===NaCl+H2O+CO2↑ Na2CO3+2HCl===2NaCl+ H2O+ CO2↑ 2NaHCO3Na2CO3+ H2O+ CO2↑ 4Li+ O2 2 Li2O 2K+2H2O===2KOH+H2↑ NaHCO3 + NaOH== Na2CO3 + H2O Na2CO3+ H2O+ CO2 = 2NaHCO3 2NaOH+ CO2 (少量)== Na2CO3 + H2O NaOH+ CO2(多量)== NaHCO3 Na2CO3+ Ca(OH)2=Ca CO3↓+2 NaOH2NaOH+SO2(少量)===Na2SO3+H2O NaOH+SO2(足量)===NaHSO3NaOH+H2S(足量)===NaHS+H2O 2NaOH+H2S(少量)===Na2S+2H2O NaOH+HCl===NaCl+H2O CO2+Ca(OH)2(过量)===CaCO3↓+H2O 2CO2(过量)+Ca(OH)2===Ca(HCO3)2 Na2O+2HCl===2NaCl+H2O Na2O+SO3===Na2SO4 CaCO3CaO+CO2↑MgCO3MgO+CO2↑ 2Fe(OH)3Fe 2O3 + 3H2O Mg(OH)2Mg O+ H2O Cu(OH)2Cu O+ H2O 2Al(OH)3Al 2O3 + 3H2O CaCO3+H2O +CO2=Ca(HCO3)2 2NaOH + CuSO4 ==Cu(OH)2↓+ Na2SO4 3NaOH + FeCl3 ==== Fe(OH)3↓ + 3NaCl §2卤族元素 Cl2+Cu Cu Cl23Cl2+2Fe2FeCl3 Cl2+2 Na 2Na Cl Cl2 + H22HCl 3Cl2 +2 P 2PCl3 Cl2 + PCl3PCl5 Cl2+H2O==HCl+HClO Cl2+2NaOH===NaCl+NaClO+H2O 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O Cl2+2FeCl2===2FeCl3 Ca(ClO)2+H2O+ CO2(少量)== Ca CO3↓+2 HClO
高中常用化学方程式
无机化学 一、碱金属 ( Li 、 Na、 K、 Rb、 Cs ) 1. 钠放在空气中: 4Na+O2===2Na2O(金属钠表面很快变暗) 2. 钠在空气中燃烧:(淡黄色固体) 3. 钠与水反应: 2Na+2HO===2NaOH+H↑(浮、熔、游、响) 4. 钠与硫酸铜盐溶液反应: 2Na+CuSO4+2H2O===Na2SO4+Cu(OH)2↓+H2↑ 5. 氧化钠与水反应: Na2O+H2O===2NaOH 6. 氧化钠与二氧化碳反应: Na2O+CO2===Na2CO3 7. 过氧化钠与水反应: 2Na2O2+2H2O===4NaOH+O2↑ (过氧化钠即是氧化剂又是还原剂) 8. 过氧化钠与二氧化碳反应: 2Na2O2+2CO===2Na2CO3+O2 (常用于呼吸面具、潜水艇作供氧剂) 9. 过氧化钠与稀硫酸反应: 2Na2O2+2H2SO4===2NaSO4+2H2O+O2↑ 10. 盐酸中滴加纯碱溶液: Na2CO3+2HCl===2NaCl+HO+CO2↑ 11. 纯碱溶液中滴加少量稀盐酸: Na2CO3+HCl===NaHCO3+NaCl 12. 碳酸钠溶液与二氧化碳反应: Na2CO3+CO2+H2O===2NaHCO3 13. 小苏打固体受热分解: 14. 小苏打与氢氧化钠的反应: NaHCO3+ NaOH===Na2CO3+ H2O 15. 金属锂在空气中燃烧: 4Li+O 2===2Li 2O(仅生成氧化锂) 16. 小苏打溶液与稀盐酸反应: NaHCO3+HCl===NaCl+H2O+CO2↑ 17. 金属钠与硫粉混合爆炸: 2Na+S===NaS(不需要任何条件) 二、镁.铝.铁 1. 氧气作用: 2. 镁与氮气作用: 3. 金属镁能在二氧化碳中燃烧: (CO2不能用扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾) 4. 镁与稀硫酸的反应: Mg+H2SO4===MgSO4+H2↑ 5. 镁能与与沸水反应: 6. 氧化镁的反应: MgO+SO3===MgSO4 MgO+H2SO4===MgSO4+H2O 7. 氢氧化镁与氯化铵反应: Mg(OH)2+2NH4Cl===MgCl2+2NH3·H2O 8. 铝箔在空气中燃烧: 9. 铝箔在氯气中燃烧: 10. 铝与稀盐酸反应: 2Al+6HCl===2AlCl 3+3H2↑ 11. 铝与稀硫酸反应: 2Al+3H2SO4===Al 2(SO4) 3+3H2↑ 12. 铝与氢氧化钠溶液反应: 2Al+2NaOH+2HO===2NaAlO+3H2↑ 13. 铝热反应: 14. 氧化铝的两性:Al 2O3+3H2SO4===Al 2(SO4) 3+3H2O Al2O3+2NaOH===2NaAlO+H2O 15 氯化铝与过量的氨水:AlCl 3+3NH· H2O===Al(OH)3↓ +3NH4Cl 16 氢氧化铝的两性:Al(OH) 3+NaOH===NaAlO2+2H2O Al(OH)3+3HCl===AlCl3+3H2O 17 氢氧化铝的不稳定性: 3+ 18.Al与强碱的反应:AlCl 3+3NaOH===Al(OH)↓+3NaCl(碱不足) 19. 偏铝酸盐与二氧化碳的反应: 2NaAlO2+CO2+3H2O===2Al(OH)3↓+Na2CO3 20. 铁与水蒸汽的高温反应: 21. 铁与稀盐酸的反应: Fe+2HCl===FeCl2+H2↑ 22. 铁与氯化铜的反应: Fe+CuCl2===FeCl2+Cu 23. 铁与氯化铁的反应: 2FeCl 3+Fe===3FeCl2 24. 铁的氧化物与稀盐酸的反应: FeO+2HCl===FeCl2+3H2O Fe2O3+6HCl===2FeCl3+3H2O Fe 3O4+8HCl===FeCl 2+2FeCl 3+4H2O
高中化学离子方程式大全
高中化学方程式 1、向氢氧化钠溶液中通入少量CO2: 2NaOH + CO2 ==== Na2CO3+ H2O 离子方程式:CO2+ 2OH- CO32-+ H2O 2、在标准状况下过量CO2通入NaOH溶液中:CO2+NaOH NaHCO3 离子方程式:CO2+ OH- HCO3- 3、烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3 离子方程式:OH- +SO2 HSO3- 4、在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 离子方程式:CO2+ OH- HCO3- 5、氨水中通入少量二氧化碳: 2NH3?H2O+CO2== (NH4)2 CO3+ H2O 离子方程式:2NH3?H2O+CO2== 2NH4++2H2O 6、用碳酸钠溶液吸收少量二氧化硫: Na2CO3+ SO2 Na2SO3+ CO2↑ 离子方程式:CO32-+ SO2 SO32-+ CO2↑ 7、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 离子方程式:CO32-+ CO2 +H2O══HCO3- 8、在醋酸铅[Pb(Ac)2]溶液中通入H2S气体:Pb(Ac)2+H2S=PbS↓+2HAc 离子方程式:Pb(Ac)2+H2S=PbS↓+2HAc 9、苯酚钠溶液中通入少量二氧化碳: CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3 离子方程式:CO2+H2O+C6H5O-→C6H5OH+ HCO3- 10、氯化铁溶液中通入碘化氢气体: 2FeCl3+2 HI 2Fe Cl2+ I2+2 H Cl 离子方程式:2Fe3++2 H++2I- 2Fe 2++ I2+2 H+ 11、硫酸铁的酸性溶液中通入足量硫化氢:Fe2(SO4)3+ H2S==2 FeSO4+ S↓+ H2SO4离子方程式:2Fe3++ H2S== 2Fe 2++ S↓+2 H+ 12、少量SO2气体通入NaClO溶液中:2NaClO +2SO2+ 2H2O══Na2SO4+ 2HCl+H2SO4离子方程式:2ClO- +2SO2+ 2H2O══SO42-+ 2Cl-+2 H++SO42-13、氯气通入水中:Cl2+H2O HCl+HclO 离子方程式:Cl2+H2O H++Cl-+HClO 14、氟气通入水中:2F2+2H2O 4HF+O2↑ 离子方程式:2F2+2H2O 4HF+O2↑
所有重要的高中化学方程式汇总
所有重要的高中化学方 程式汇总 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
高中化学专题之二-----高中化学方程式 一、非金属单质(F2,C l2,O2,S,N2,P,C,S i,H) 1、氧化性: F2+H2===2HF(阴暗处爆炸) F2+Xe(过量)==XeF2 2F2(过量)+Xe==XeF4(XeF4是强氧化剂,能将Mn2+氧化为MnO4–) nF2+2M===2MFn(M表示大部分金属) 2F2+2H2O===4HF+O2(水是还原剂) 2F2+2NaOH===2NaF+OF2+H2O F2+2NaCl===2NaF+Cl2 F2+2NaBr===2NaF+Br2 F2+2NaI===2NaF+I2 7F2(过量)+I2===2IF7 F2+Cl2(等体积)===2ClF(ClF属于类卤素:ClF+H2O==HF+HClO) 3F2(过量)+Cl2===2ClF3(ClF3+3H2O==3HF+HClO3) Cl2+H22HCl(将H2在Cl2点燃;混合点燃、加热、光照发生爆炸) 3Cl2+2P2PCl3Cl2+PCl3PCl5Cl2+2Na2NaCl 3Cl2+2Fe2FeCl3Cl2+Cu CuCl2 Cl2+2FeCl2===2FeCl3(在水溶液中:Cl2+2Fe2+===2Fe3++3Cl-) Cl2+2NaBr===2NaCl+Br2Cl2+2Br-=2Cl-+Br2 Cl2+2KI===2KCl+I2Cl2+2I-=2Cl-+I2 3Cl2(过量)+2KI+3H2O===6HCl+KIO3 3Cl2+I–+3H2O=6H++6Cl–+IO3– 5Cl2+I2+6H2O===2HIO3+10HCl 5Cl2+I2+6H2O=10Cl–+IO3–+12H+ Cl2+Na2S===2NaCl+S↓Cl2+S2–=2Cl–+S↓
高中化学反应方程式大全(实用版)
高中化学反应方程式大全 一、非金属单质(F2 ,Cl2 、O2 、S、N2 、P 、 C 、Si) 1.氧化性: F2 + H2 === 2HF F2 + 2NaCl === 2NaF + Cl2 F2 + 2NaBr === 2NaF + Br2 F2 + 2NaI === 2NaF + I2 Cl2 + H2 === 2HCl Cl2 + 2FeCl2 === 2FeCl3 2Cl2 + 2NaBr === 2NaCl + Br2 Cl2 + 2NaI === 2NaCl + I2 Cl2 + Na2S === 2NaCl + S Cl2 + H2S === 2HCl + S S + H2 === H2S N2 + 3H2 === 2NH3 P2 + 6H2 === 4PH3 2.还原性 S + O2 === SO2 N2 + O2 === 2NO 4P + 5O2 === 2P2O5 C + 2Cl2 === CCl4 2C + O2(少量) === 2CO C + O2(足量) === CO2 C + CO2 === 2CO C + H2O === CO + H2(生成水煤气) 2C + SiO2 === Si + 2CO(制得粗硅) Si(粗) + 2Cl2 === SiCl4 (SiCl4 + 2H2 === Si(纯) + 4HCl) Si + C === SiC(金刚砂) Si + 2NaOH + H2O === Na2SiO3 + 2H2
3(碱中)歧化 Cl2 + H2O === HCl + HClO (加酸抑制歧化,加碱或光照促进歧化) Cl2 + 2NaOH === NaCl + NaClO + H2O 2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O 3C + CaO === CaC2 + CO 3C + SiO2 === SiC + 2CO 二、金属单质(Na,Mg,Al,Fe)的还原性 2Na + H2 === 2NaH 4Na + O2 === 2Na2O 2Na2O + O2 === 2Na2O2 2Na + O2 === Na2O2 2Na + S === Na2S(爆炸) 2Na + 2H2O === 2NaOH + H2 Mg + Cl2 === MgCl2 Mg + Br2 === MgBr2 2Mg + O2 === 2MgO Mg + S === MgS Mg + 2H2O === Mg(OH)2 + H2 2Mg + CO2 === 2MgO + C Mg + H2SO4 === MgSO4 + H2 2Al + 3Cl2 === 2AlCl3 4Al + 3O2 === 2Al2O3(钝化) 2Al + Fe2O3 === Al2O3 + 2Fe 2Al + 3FeO === Al2O3 + 3Fe 2Al + 6HCl === 2AlCl3 + 3H2 2Al + 3H2SO4 === Al2(SO4)3 + 3H2 2Al + 6H2SO4(浓) === Al2(SO4)3 + 3SO2 + 6H2O (Al、Fe在冷、浓的H2SO4、HNO3中钝化)
高中化学离子方程式书写汇总练习题
下列反应是离子反应的写出离子方程式, 如不是离子反应写出化学方程式 1、氯化钠溶液滴加硝酸银溶液 2、钠与水反应 3、钠与硫酸铜溶液 4、过氧化钠与水反应 5、碳酸氢盐溶液与强酸溶液混合 6、碳酸氢盐溶液与醋酸溶液混合 7、氢氧化钙溶液与碳酸氢镁反应 8、向碳酸氢钙溶液中加入过量的氢氧化钠 9、向碳酸氢钙溶液中加入少量的氢氧化钠 10、澄清石灰水与少量小苏打溶液混合 11、澄清石灰水通入少量CO2 12、澄清石灰水通入过量CO2 13、碳酸氢钠溶液与少量石灰水反应 14、碳酸氢钠溶液与过量石灰水反应 15、等物质的量氢氧化钡溶液与碳酸氢铵溶液混合 16、碳酸钠溶液与盐酸反应 17、向氢氧化钠溶液中通入少量的CO2 18、过量的CO2通入氢氧化钠溶液中 19、碳酸氢铵溶液中加入过量氢氧化钠溶液
20、碳酸钙与盐酸反应 21、碳酸钙与醋酸反应 22、澄清石灰水与稀盐酸反应 23、磷酸溶液与少量澄清石灰水 24、磷酸溶液与过量澄清石灰水 25、碳酸镁溶于强酸 26、硫酸镁溶液跟氢氧化钡溶液反应 27、硫酸溶液跟氢氧化钡溶液反应 28、硫酸氢钠溶液与氢氧化钡反应至中性 29、硫酸氢钠溶液与氢氧化钡反应至硫酸根完全沉淀 30、硫酸铝溶液中加入过量氢氧化钡溶液 31、氢氧化镁与稀硫酸反应 32、铝跟氢氧化钠溶液反应 33、物质的量之比为1:1NaAl合金置于水中 34、氧化铝溶于强碱溶液 35、氧化铝溶于强酸溶液 36、氢氧化铝与氢氧化钠溶液 37、氢氧化铝与盐酸溶液反应 38、硫酸铝溶液与碳酸氢钠溶液 39、硫酸铝溶液与碳酸钠溶液
40、氯化铝溶液中加入过量氨水 41、明矾溶液加热水解生成沉淀 42、氯化铝溶液与偏铝酸钠溶液 43、偏铝酸钠溶液中加入氯化铁溶液 44、偏铝酸钠溶液中加入少量盐酸 45、偏铝酸钠溶液中加入过量盐酸 46、偏铝酸钠溶液中加入氯化铵溶液 47、金属铁溶于盐酸中 48、铁粉与氯化铁溶液反应 49、铜与氯化铁溶液反应 50、硫化亚铁与盐酸反应 51、硫化钠与盐酸反应 52、硫化钠溶液中加入溴水 53、氯化亚铁溶液中通入氯气 54、向硫酸铁的酸性溶液中通入足量的H2S 55、氯化铁溶液中滴加少量硫化钠溶液 56、硫化钠溶液中滴加少量氯化铁溶液 57、氯化铁溶液中滴加少量碘化钾溶液 58、氯化铁溶液与氢氧化钠溶液反应 59、氯化铁溶液跟过量氨水反应 60、氯化铁溶液与硫氰化钾溶液
高中化学方程式归纳大全
高中化学方程式归纳大全 化学方程式是高中学习化学的基础,想要学好化学就要背好化学方程式。下面是给大家带来的高一化学方程式知识点,希望能帮助到大家! 高一化学方程式知识点总结1 必背化学方程式知识点 泡沫灭火器原理 Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 泡沫灭火器原理 MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体 CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属 Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理 Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理 WO3+3CO高温W+3CO2 冶炼金属原理
CH3COOH+NaOH=CH3COONa+H2O 2CH3OH+3O2点燃2CO2+4H2O C2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧 Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质 湿法炼铜、镀铜 Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色 Cu+Hg(NO3)2=Hg+ Cu (NO3)2 Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银 Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜 Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解 Na2O+2HCl=2NaCl+H2O 白色固体溶解 CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色 ZnO+2HCl=ZnCl2+ H2O 白色固体溶解 MgO+2HCl=MgCl2+ H2O 白色固体溶解
高中化学方程式大全(整理)
郑州四中高中化学方程式汇编2012-12-3 温州市第十五中学高三化学备课组Petros Xn. 无机化学部分 非金属单质(F 2 ,Cl 2 , O 2 , S, N 2 , P , C , Si ) 1. 氧化性: F 2 + H 2 === 2HF 2F 2 +2H 2O===4HF+O 2 Cl 2 +2FeCl 2 ===2FeCl 3 2Cl 2+2NaBr===2NaCl+Br 2 Cl 2 +2NaI ===2NaCl+I 2 Cl 2+SO 2 +2H 2O===H 2SO 4 +2HCl 2. 还原性 S+6HNO 3(浓)===H 2SO 4+6NO 2↑+2H 2O 3S+4 HNO 3(稀)===3SO 2+4NO ↑+2H 2O PX 3+X 2===PX 5 C+CO 2===2CO (生成水煤气) (制得粗硅) Si+2NaOH+H 2O===Na 2SiO 3+2H 2↑ 3.(碱中)歧化 Cl 2+H 2O===HCl+HClO (加酸抑制歧化,加碱或光照促进歧化) Cl 2+2NaOH===NaCl+NaClO+H 2O 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O 金属单质(Na ,Mg ,Al ,Fe )的还原性 4Na+O 2===2Na 2O 2Na+S===Na 2S (爆炸) 2Na+2H 2O===2NaOH+H 2↑ Mg+H 2SO 4===MgSO 4+H 2↑ 2Al+6HCl===2AlCl 3+3H 2↑ 2Al+3H 2SO 4===Al 2(SO 4)3+3H 2↑ 2Al+6H 2SO 4(浓、热)===Al 2(SO 4)3+3SO 2↑+6H 2O (Al,Fe 在冷,浓的H 2SO 4,HNO 3中钝化) Al+4HNO 3(稀)===Al(NO 3)3+NO ↑+2H 2O 2Al+2NaOH+2H 2O===2NaAlO 2+3H 2↑ Fe+2HCl===FeCl 2+H 2↑ Fe+CuCl 2===FeCl 2+Cu 非金属氢化物(HF,HCl,H2O,H2S,NH3) 1.还原性: 16HCl+2KMnO 4==2KCl+2MnCl 2+5Cl 2↑+8H 2O (实验室常用) 2H 2S+SO 2===3S ↓+2H 2O 2NH 3+3Cl 2===N 2+6HCl 8NH 3+3Cl 2===N 2+6NH 4Cl 4NH 3+3O 2(纯氧)===2N 2+6H 2O 4NH 3+6NO===5N 2+6H 2O(用氨清除NO) 2.酸性: 4HF+SiO 2===SiF 4+2H 2O (HF 保存在塑料瓶的原因,此反应广泛应用于测定矿样或钢样中SiO 2的含量) H 2S+CuCl 2===CuS ↓+2HCl H 2S+FeCl 2===(不反应) 3.碱性: NH 3+HCl===NH 4Cl NH 3+HNO 3===NH 4NO 3 2NH 3+H 2SO 4===(NH 4)2SO 4 NH 3+NaCl+H 2O+CO 2===NaHCO 3+NH 4Cl (此反应用于工业制备小苏打,苏打) 4.不稳定性: 2H 2O 2===2H 2O+O 2↑ 非金属氧化物 1.低价态的还原性: 2SO 2+O 2+2H 2O===2H 2SO 4 (这是SO 2在大气中缓慢发生的环境化学反应) SO 2+Cl 2+2H 2O===H 2SO 4+2HCl 2NO+O 2===2NO 2 2CO+O 2===2CO 2 2.氧化性: NO 2+2KI+H 2O===NO+I 2↓+2KOH (不能用淀粉KI 溶液鉴别溴蒸气和NO 2) (CO 2不能用于扑灭由Mg,Ca,Ba,Na,K 等燃烧的火灾) 3.与水的作用: SO 2+H 2O===H 2SO 3 SO 3+H 2O===H 2SO 4 3NO 2+H 2O===2HNO 3+NO N 2O 5+H 2O===2HNO 3 P 2O 5+H 2O (冷)===2HPO 3 P 2O 5+3H 2O (热)===2H 3PO 4 (P 2O 5极易吸水,可作气体干燥剂) 4.与碱性物质的作用: SO 2+(NH 4)2SO 3+H 2O===2NH 4HSO 3 (这是硫酸厂回收SO 2的反应.先用氨水吸收SO 2,再用 H 2SO 4处理: 2NH 4HSO 3+H 2SO 4=== (NH 4)2SO 4 + 2H 2O + 2SO 2 生成的硫酸铵作化肥,SO 2循环作原料气) SO 2+Ca(OH)2===CaSO 3+H 2O (不能用澄清石灰水鉴别SO 2和CO 2.可用品红鉴别) SO 3+Ca(OH)2===CaSO 4+H 2O CO 2+2NaOH(过量)===Na 2CO 3+H 2O CO 2(过量)+NaOH===NaHCO 3 CO 2+Ca(OH)2(过量)===CaCO 3↓+H 2O 2CO 2(过量)+Ca(OH)2===Ca(HCO 3)2 CO 2+2NaAlO 2+3H 2O===2Al(OH)3↓+Na 2CO 3 CO 2+C 6H 5ONa+H 2O===C 6H 5OH ↓+NaHCO 3 SiO 2+2NaOH===Na 2SiO 3+H 2O (强碱缓慢腐蚀玻璃) 金属氧化物 1.低价态的还原性: FeO+4HNO 3===Fe(NO 3)3+NO 2↑+2H 2O 2。氧化性: MgO ,Al 2O 3几乎没有氧化性,很难被还原为Mg ,Al.,一般通过电解制Mg 和Al. (制还原铁粉) 3.与水的作用: Na 2O+H 2O===2NaOH 2Na 2O 2+2H 2O===4NaOH+O 2↑ 4.与酸性物质的作用: Na 2O+CO 2===Na 2CO 3 2Na 2O 2+2CO 2===2Na 2CO 3+O 2 Na 2O 2+H 2SO 4(冷,稀)===Na 2SO 4+H 2O 2 MgO+SO 3===MgSO 4 MgO+H 2SO 4===MgSO 4+H 2O Al 2O 3+3H 2SO 4===Al 2(SO4)3+3H 2O Al 2O 3+2NaOH===2NaAlO 2+H 2O (Al 2O 3是两性氧化物) FeO+2HCl===FeCl 2+3H 2O Fe 2O 3+6HCl===2FeCl 3+3H 2O Fe 3O 4+8HCl===FeCl 2+2FeCl 3+4H 2O 含氧酸 1.氧化性: HClO+H 2SO 3===H 2SO 4+HCl (X 2表示F 2,Cl 2,Br 2)
