常见弱电解质电离平衡常数表
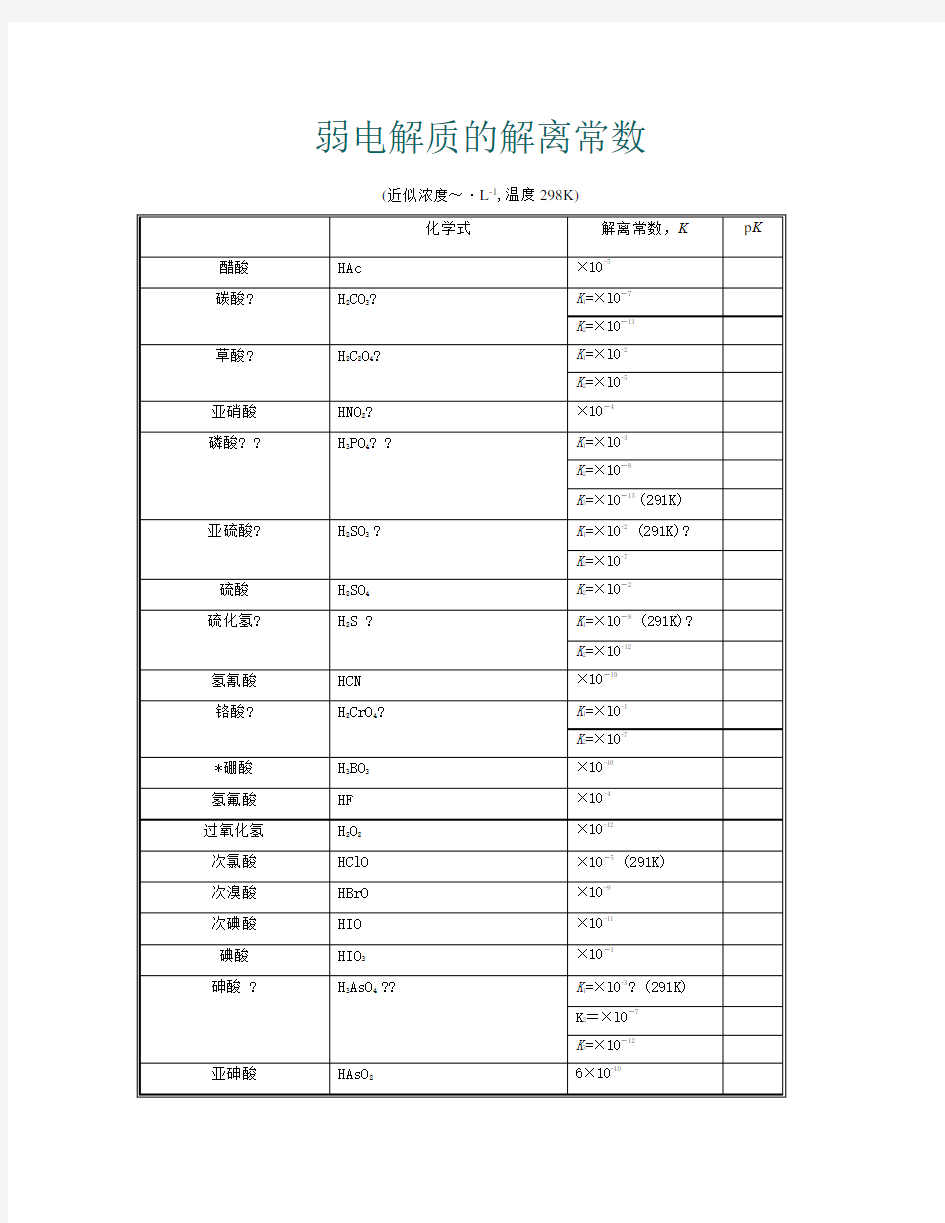

弱电解质的解离常数
(近似浓度~·L-1,温度298K)
化学式解离常数,K p K 醋酸HAc×10-5
碳酸?H2CO3?K1=×l0-7
K2=×10-11
草酸?H2C2O4?K1=×l0-2
K2=×l0-5
亚硝酸HNO2? ×10-4
磷酸??H3PO4??K1=×l0-3
K2=×10-8
K3=×l0-13 (291K)
亚硫酸?H2SO3 ?K1=×l0-2 (291K)?
K2=×l0-7
硫酸H2SO4K2=×l0-2
硫化氢?H2S ?K1=×l0-8 (291K)?
K2=×10-12
氢氰酸HCN×10-10
铬酸?H2CrO4?K1=×l0-1
K2=×10-7
*硼酸H3BO3×10-10
氢氟酸HF×10-4
过氧化氢H2O2×10-12
次氯酸HClO×10-5 (291K)
次溴酸HBrO×10-9
次碘酸HIO×10-11
碘酸HIO3×10-1
砷酸 ?H3AsO4 ??K1=×l0-3? (291K)
K2=×l0-7
K3=×10-12
亚砷酸HAsO26×10-10
铵离子NH4+×10-10
氨水NH3·H2O×10-5
联胺N2H4×10-7
羟氨NH2OH×10-9氢氧化铅Pb(OH)2×10-4
氢氧化锂LiOH×10-1
氢氧化铍?Be(OH)2×10-6
BeOH+×10-9氢氧化铝A1(OH)3×10-9
Al(OH)2+×10-10氢氧化锌Zn(OH)2×10-7
氢氧化镉Cd(OH)2×10-11
*乙二胺?H2NC2H4NH2?K1=×l0-5
K2=×l0-8 *六亚甲基四胺(CH2)6N4×10-9 *尿素CO(NH2)2×10-14
*质子化六亚甲基四胺(CH2)6N4H+×10-6
甲酸HCOOH ?×10-4 (293K)
氯乙酸ClCH2COOH×10-3
氨基乙酸NH2CH2COOH×10-10
*邻苯二甲酸C6H4(COOH)2K1=×10-3
K2=×10-6柠檬酸??(HOOCCH2)2C(OH)COOH? ??K1=×10-4
K2=×10-5 (293K)
K3=×10-7 ?-酒石酸?(CH(OH)COOH)2?K1=×10-3
K2=×10-5 *8-羟基喹啉?C9H6NOH?K1=8×l0-6
K2=1×10-9苯酚C6H5OH ?×10-10 (293K) *对氨基苯磺酸?H2NC6H4SO3H?K l=×l0-l
K2=×10-4
*乙二胺四乙酸(EDTA)? (CH2COOH)2NH+CH2CH2NH+(CH2COOH)2K5=×10-7
?
弱电解质的电离平衡及移动
弱电解质的电离平衡及移动 1.下列事实能说明亚硝酸是弱电解质的是() ①亚硝酸溶液中存在HNO2分子,呈酸性②用HNO2溶液做导电性实验,灯泡很暗③HNO2溶液不与Na2SO4溶液反应④0.1 mol·L-1HNO2溶液中,c(H+)=0.015 mol·L-1⑤相同浓度时,HNO2的导电能力比HCl弱 A.①②③B.②③④C.①④⑤D.①②④⑤ 2.在相同温度时,100 mL 0.01 mol?L-1的醋酸溶液与10 mL 0.1 mol?L-1的醋酸溶液相比较,下列数值或性质中,前者大于或强于后者的是() A.溶液的导电性B.醋酸的电离常数C.完全中和时所需NaOH的量D. H+的物质的量 3.常温下向0.1 mol·L-1CH3COOH溶液中加入少量的CH3COONa晶体时,会引起() A.溶液中的c(H+)减小 B.电离平衡左移,电离常数减小 C.溶液的导电能力减弱 D.溶液中的c(OH-)减小 4.在20 mL 0.1 mol·L-1的醋酸溶液中,能使溶液的c(H+)增大,而且使醋酸的电离平衡向逆反应方向移动,可加入的试剂是() A. 20 mL水B.浓盐酸C.冰醋酸D. NaOH溶液 5.能证明氟化氢是弱电解质的事实是() A.氟化氢在所有卤化氢中热稳定性最强 B.浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 C. 100 mL 0.1 mol·L-1氢氟酸中,c(H+)小于0.1 mol·L-1D.在氢氟酸中滴加含酚酞的NaOH溶液,红色褪去 6.用我们日常生活中的食用白醋(醋酸浓度约为1 mol·L-1)进行下列实验,能证明醋酸为弱电解质的是() A.白醋中滴入石蕊溶液呈红色 B.白醋溶液中存在分子 C.蛋壳浸泡在白醋中有气体放出 D.经检验白醋中c(H+)约为0.01 mol·L-1 7.甲酸的下列性质中,可以证明它是弱电解质的是() A. 1 mol·L-1的甲酸溶液的c(H+)约为0.01 mol·L-1 B.甲酸能与水以任意比例互溶 C.甲酸与盐酸都能与NaOH发生反应 D.甲酸溶液的导电能力比盐酸溶液的导电能力弱 8.下列叙述中,能证明某物质是弱电解质的是() A.熔融时不导电 B.水溶液的导电能力很差 C.不是离子化合物,而是共价化合物 D.溶液中已电离的离子和未电离的分子共存 9.甲酸(HCOOH)是一种一元弱酸,下列性质中可以证明它是弱电解质的是() A.常温下,1 mol·L-1甲酸溶液中的c(H+)约为1×10-2mol·L-1 B.甲酸能与碳酸钠反应放出二氧化碳 C. 10 mL 1 mol·L-1甲酸溶液恰好与10 mL 1 mol·L-1NaOH溶液完全反应 D.甲酸溶液与锌反应比强酸溶液缓慢 10.在25 ℃时,用蒸馏水稀释1 mol·L-1氨水至0.01 mol·L-1,随溶液的稀释,下列各项中始终保持增大趋势的是() A.c(OH ?) c(NH3·H2O)B.c(NH4+) c(OH?) C.c(NH3·H2O) c(NH4+) D.c(OH-) 11.0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化正确的是() ①电离程度增大②c(NH3·H2O)增大③NH4+数目增多④c(OH-)增大⑤导电性增强
弱电解质的电离平衡
弱电解质的电离平衡 考点一弱电解质的电离平衡 一.强、弱电解质 (1)定义与物质类别 (2)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离” ①强电解质:如H2SO4:H2SO4===2H++SO2-4。 ②弱电解质:a.一元弱酸,如CH3COOH: b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步的电离程度,如H2CO3: c.多元弱碱,分步电离,一步书写。如Fe(OH)3: ③酸式盐:a.强酸的酸式盐:NaHSO4在水溶液中:;熔融时: b.弱酸的酸式盐:“强中有弱”,如NaHCO3: (3)外界条件对电离平衡的影响 ①温度:温度升高,电离平衡移动,电离程度。 ②浓度:稀释溶液,电离平衡移动,电离程度。 ③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡移动,电离程度。 ④实例展示 + 稀释一弱电解质溶液时,所有粒子浓度都会减小吗? 练习: 1、一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如 图所示,请回答: (1)O点为什么不导电:_______________________。
(2)a 、b 、c 三点溶液的pH 由小到大的顺序是_______________。 (3)H + 的物质的量最大的是________(填“a”“b”或“c”)。 (4)若使c 点溶液中的c(CH 3COO - )增大,可以采取下列措施中的________(填字母序号)。 A .加热 B.加很稀的NaOH 溶液 C .加NaOH 固体 D.加水E .加CH 3COONa 固体 F .加入锌粒 要证明某电解质是弱电解质,关键在于一个“弱”字,即证明它只是部分电离或其溶液中存在电离平衡。以一元酸HA 为例,证明它是弱电解质的常用方法有: 3.25 ℃时,把0.2 mol·L - 1的醋酸加水稀释,则图中的纵轴y 表示的是( ) A .溶液中OH - 的物质的量浓度 B .溶液的导电能力 C .溶液中c (CH 3COO - ) c (CH 3COOH ) D .CH 3COOH 的电离程度
弱电解质的电离平衡知识点
一、弱电解质的电离 1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子的 化合物,叫电解质。 非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子的化合物。 概念理解: ①电解质、非电解质都是化合物,能导电的物质可能是溶液(混合物)、金属 (单质),但他们不属于电解质非电解质的研究对象,因此他们既不是电解质也不是非电解质; ②自身电离:SO2、NH3、CO2、等化合物能和水反应形成酸或碱,但发生电离 的并不是他们本身吗,因此属于非电解质; ③只能在水中发生电离的电解质有酸或者某些易溶于水高温下易分解的盐, 如液态氯化氢是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质; 只能在熔融状态下电离的电解质是活泼金属氧化物,如Na2O、CaO,他们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明; 既能在水溶液中又能在溶液中发生电离的物质是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BaSO 4。 ④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子; ⑤是电解质,但是要产生离子也要在溶液状态或者熔融状态,否则即便存在 离子也无法导电,比如NaCl,晶体状态不能导电。 ⑥电解质的强弱与导电性、溶解性无关。如如BaSO4不溶于水,但溶于水的 BaSO4全部电离,故BaSO4为强电解质。导电性与自由移动离子的浓度和带电荷数等有关。 强电解质:在水溶液里全部电离成离子的电解质。 弱电解质:在水溶液里只有一部分电离成离子的电解质。 2.常见的电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见分类:
基本物理常数
基本物理常数 是物理领域的一些普适常数,主要是指原子物理学中常用的一些常数。最基本的有真空中光速с,普朗克常数h、基本电荷e、电子静止质量m e和阿伏伽德罗常数N A 等。基本物理常数共有30多个,加上其组合量则有40~50个,它们之间有着深刻的联系,并不是彼此独立的。 基本物理常数的发现和测量,在物理学的发展中起了很大的作用。纵观近代物理学史可以看到,一些重大的物理现象的发现和物理理论的创立,常常同基本物理常数的发现或准确测定有着密切的联系。例如,电子的发现是通过对电子的荷质比e/m的测定获得的;M.普朗克建立量子论的同时,发现了普朗克常数;狭义相对论的出 发点之一就是真空中的光速不变;等等。由此可见,基本物理常数出现于许多不同的物理现象之中,每一种物理现象的规律都同一种确定的常数有关。 物理学发展到今天,形成了许多分支,如固体物理学、原子物理学、原子核物理学、粒子物理学、天体物理学等等,包括大至宇宙、小至基本粒子的广阔领域。但是物理学的这些分支都是用统一的物理理论结合在一起的,这些基本理论有经典电动力学、相对论(见狭义相对论、广义相对论)、统计力学(见统计物理学)、量子力学等。这些理论的定量预言的准确程度,依赖于在理论中出现的基本物理常数值的准确性。特别重要的是,仔细研究由物理学不同领域的实验所确定的这些常数值,能逐个考察物理学一些基本理论的一致性和正确性。由于应用了高稳定激光、约瑟夫森效应、X射线干涉术、量子霍耳效应等许多新方法,使基本物理常数测量的准确度有所提高,很多常数的测量准确度已达10-6量级,更高的可达10-8~10-10量级。常数的准确值增加一位,就会有可能发现物理学中前所未知的矛盾,或获得解决目前所存在的某个矛盾的线索。 基本物理常数的重要性还表现在定义计量单位从而建立计量基准的工作上。普朗克早在1906年就建议用基本常数来定义计量基本单位,由于当时常数的测量准确度还很低,这个愿望不能实现。60年代以来,随着常数值的准确度不断提高,上述建议就有了现实意义。如由于可同时准确测量高稳定激光波长λ和频率v,就能够通
初中物理基本单位、基本公式、基本常数大全
初中物理公式 物理量计算公式备注 速度v= s / t 1m / s = 3.6 Km / h 声速v= 340m / 光速C = 3×10^8 m /s 密度ρ= m / V 1 g / cm^3 = 103 Kg / m 合力 F = F1 - F2 (F1、F2在同一直线线上且方向相反) F = F1 + F2 (F1、F2在同一直线线上且方向相同 ) 压强 p = F / S 适用于固、液、气 p =ρg h 适用于竖直固体柱和液体 浮力①F浮= G – F ②漂浮、悬浮:F浮= G ③F浮= G排=ρ液g V排 物体浮沉条件 ①F浮>G(ρ液>ρ物)上浮至漂 浮 ②F浮=G(ρ液=ρ物)悬浮 ③F浮<G(ρ液<ρ物)下沉杠杆平衡条件F1 *L1 = F2 *L 2 杠杆平衡条件也叫杠杆原理 滑轮组 F = G / n ( 理想滑轮组) F =(G动+ G物)/ n (忽略轮轴间的摩擦) η=G/ nF(实际情况n:作用在动滑轮上绳子股数) 功W = F S = P t 1J = 1N?m = 1W?s 功率P = W / t = Fv 1KW = 10^3 W,1MW = 10^3KW 有用功W有用= G h(竖直提升)= F S(水平移动)= W总– W额=ηW总额外功W额= W总– W有= G动h(忽略轮轴间摩擦)= f L(斜面) 总功W总= W有用+ W额= F S = W有用/ η 机械效率η= W有用/ W总 热量Q=cm(t-t°) 电流I=U/R 电功W=UIt =Pt 电功率P=W/t=UI =I2R=U2/R 串联电路I=I1=I2 电流处处相等 U = U 1+ U 2 干路电压等于各支路电压之和 R=R1+R2 总电阻等于的电阻之和
常用物理常数表
常用物理常数表 光速 101099792458.2?=c cm sec -1 万有引力常数 81067259.6-?=G dyn cm -2 g -2 普朗克常数 27106260.6-?=h erg sec 271005457266.12/-?==πh η erg sec 玻尔兹曼常数 1610380662.1-?=k erg deg –1 里德堡常量 312.109737/2342==∞ch e m R e π cm -1 斯特藩—玻尔兹曼常数 51066956.5-?=σ erg cm -2 deg -4 sec -1 电子电量 101080325.4-?=e esu 1910602192.1-?= coulomb 电子质量 281010956.9-?=e m g 原子质量单位 2410660531.1-?=amu g 精细结构常数 0360.1372//12==e hc πα 第一玻尔轨道半径 82220105291775.04/-?==e m h a e π cm 经典电子半径 1322108179380.2/-?==c m e r e e cm 质子质量 2410672661.1-?=p m g 007276470.1= amu 中子质量 241067492.1-?=n m g 00866.1= amu 电子静止能量 5110034.02=c m e meV 常用天文常数表 地球质量 2710976.5?=⊕M g 地球赤道半径 164.6378=⊕R km 地球表面重力 665.980=⊕g cm sec -2 天文单位 810495979.1?=AU km 1光年 ly = 9.460×1012 km 1秒差距 pc= 3.084×1013 km=3.262ly 千秒差距 kpc=1000pc 地月距离 3.8×105 km 太阳到冥王星的平均距离 5.91×109km 最近的恒星(除太阳)的距离 4×1013km =1.31pc= 4.3ly
弱电解质的电离平衡教案(最全版)
五、教学策略设计: 纳一巩固训练。《弱电解质的电离平衡》 一、教材分析 (1)本章内容理论性强,知识点之间环环相扣、循序渐进,理论与实际、知识与技能并举,而本节内容既是化学平衡理论的延伸和拓展,又是水的电离与盐类水解的桥梁和纽带,是学生学好本章的前提和基础。 (2)本节内容有利于引导学生根据已有的知识和生活经验去探究和认识化学,激发学生探究和学习的兴趣,促进学生学习方式的多样化。 二、学情分析 (1)学生已学习了化学平衡和化学平衡移动原理,知道这一原理也适用于其它平衡体系。通过引导学生将化学平衡移动原理迁移到弱电解质的电离平衡中,可有效突破本节重难点。 (2)学生已初步掌握了通过自主学习、合作学习、探究学习主动获取知识,学生具有较强的好奇心和求知欲。 三、教学目标 1.知识与技能 (1)掌握弱电解质的电离平衡。 (2)理解外加物质、温度、电解质浓度对电离平衡的影响。 2.过程与方法 (1)应用可逆反应的相关知识,理解弱电解质在水溶液中的电离平衡状态。 (2)分析弱电解质的电离平衡,认识事物变化中内因和外因的辩证关系,学习从现象到本质的 思维方法。 3?情感态度与价值观 通过弱电解质电离平衡及平衡移动的学习,初步建立事物之间的联系和转化等辩证观点。 四、教学重难点:弱电解质的电离平衡及外界条件对电离平衡的影响。- 创设问题情境一问题探究(分组讨论、分组实验)一展示交流一精讲归 六、教学方法:实验探究法、类比迁移法等。 七、教学媒体:多媒体(PPT)、学生平板电脑等。 八、教学评价:教师评价和生生互评相结合。 九、教学过程 实施方案设计意图
如何证明盐酸是强酸,而醋酸是弱酸呢?这节课我们就用实验事 实来说明弱电解质的电离平衡。首先请学生完成实验来感受 CH 3C00H 和HCI 电离程度的差异。可选药品有: O.1mol/L CH 3C00H 、0.1moI/L HCI 、蒸馏水、镁条等。可选器材有: pH 传感器,电导率传感器等。 从宏观上让学生感知醋酸的电 离 是不完全的。让学生在愉快 的氛围中探索新知,切身感受 到化学学习的快乐、品尝到成 功的喜悦。培养学生严谨实验、 细致观察,探索问题真相,得 出正确结论的能力。 教师讲解醋酸部分电离的原因,分析醋酸达到电离平衡的过程, 引导学生回顾化学平衡的特征, 提出思考:如何证明醋酸电离平 衡的存在? 请学生设计实验证明醋酸电离平衡的存在。 可选药品有:O.1mol/L CH 3COOH 、CH 3C00Na 固体、冰醋酸、 蒸馏水等。可选器材有:pH 传感器等。 引导学生利用平衡移动的原 理,间接证明醋酸电离平衡的 存在,从微观上证明醋酸的电 离是可逆的,并为探究温度及 加水稀释对醋酸电 离平衡的影 响做好铺垫。 教师做演示实验,进一步探究温度及加水稀释对醋酸电离平衡的 影响,学生根据实验现象,自主得出相关结论: (1) 弱电解质电离吸热,升咼温度,平衡向电离方向移动; (2) 加水稀释,平衡向电离方向移动 --越稀越电离; 讨论交流得出外界条件对电离 平衡的影响。 总结: 一、 感受弱电解质和强电解质电离程度的差异: 在浓度等其他条件相同的情况下, (1) 溶液pH 值不同; (2) 与Mg 反应,产生氢气速率不同; (3) 溶液导电性(电导率)不同; 二、 证明弱电解质电离平衡的存在: (1) 浓度:稀释弱电解质,电离平衡正向移动,稀释促进电离; (2) 温度:电离吸热,升温电离平衡正向移动,升温促进电离; (3) 冋离子效应:加入与弱电解质电离出的离子相冋的离子, 电离平衡逆向移动; 课堂训练1、2 从个别到一般,总结归纳本节 的学习重点,便于学生系统理 解和形成知识网络。课堂训练 利于巩固和检验学生学习效 果。 弱电解质电离的拓展: 电离平衡是一种特殊的平衡,所有化学平衡的知识也适合于电离 平衡。 引导学生通过类比迁移的方法,思考下列问题: (1) 写出醋酸电离的平衡常数的计算式,即醋酸的电离常数; (2) 探讨温度对醋酸电离常数的影响; 适度拓展,引导学生在“电离 平衡”和“化学平衡”之间建 立联 系。利用已有的平衡常数 的概念, 采用类比迁移的方法 引导学生学 习电离平衡常数的 相关知识。 十、板书设计 弱电解质的电离平衡 1. 电离平衡:在一定条件下,当弱电解质电离成离子的速率和离子重新结合成分子的速率相等 时,电离过 程就达到了平衡状态,这叫做电离平衡。 2. 电离平衡的特征: “等”、“动”、“定”、“变”。
弱电解质的电离平衡考点归纳
弱电解质的电离平衡考点归纳弱电解质电离平衡是电解质理论的基础,也是中学化学基本理论中的重要组成部分,近几年高考命题中反复考查。在学生已经学过化学平衡理论并了解电解质在水溶液中发生电离和离子间发生反应等知识的基础上,进一步学习弱电解质的电离平衡。高考命题的热点主要有影响弱电解质电离平衡因素,通过图象分析弱电解质和强电解质,电离常数和电离度等,为了更好的学习这一部分内容,本文做了详细的总结和归纳,希望对同学们的学习有所启发,达到触类旁通的效果。 一、弱电解质电离平衡 1.电离平衡概念 一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态,简称电离平衡。 任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质在该条件下的电离程度最大。 2.电离平衡的特征 电解质的电离平衡属于化学平衡中的一种形式,具有以下一些特征:“逆”——弱电解质的电离是可逆的,存在电离平衡 “动”——电离平衡是动态平衡 “等”——v( =v(分子化)≠0 离子化) “定”——达到电离平衡状态时,溶液中分子和离子的浓度保持不变,是一个定值
“变”——电离平衡是相对的,外界条件改变时,平衡被破坏,发生移动形成新的平衡。 二、影响弱电解质电离平衡的因素(符合勒?夏特列原理) 1.内因:弱电解质本身的性质,是决定性因素。 2.外因 ①温度: 升高温度,由于电离过程吸热,平衡向电离方向移动,电离程度增大。 ②浓度: 加水稀释,使弱电解质的浓度减小,电离平衡向电离的方向移动,电离程度增大。 因为溶液浓度越小,离子相互碰撞结合成分子的机会越小,弱电解质的电离程度就越大;所以,稀释溶液会促进弱电解质的电离。 例如:在醋酸的电离平衡CH3COOH CH3COO-+H+ A 加水稀释,平衡向正向移动,电离程度变大,但c(CH3COOH)、c(H+)、c(CH3COO-)变小; B 加入少量冰醋酸,平衡向正向移动,c(CH3COOH)、c(H+)、c(CH3COO-)均增大但电离程度小; ③外加相关物质(同离子效应) 例如:0.1 mol/L的CH 3COOH溶液CH3COOH CH3COO-+ H+向其中加入CH3COONa固体,溶液中c(CH3COO-)增大,CH3COOH的电离平衡向左移动,电离程度减小,c(H+)减小,pH增大。 如下表所示: 电离程度n(H+) c(H+) 导电能力
高考化学弱电解质的电离平衡
第23讲弱电解质的电离平衡 基础题组 1.(2018陕西西安模拟)下列事实一定能证明HNO2是弱电解质的是() ①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④常温下0.1 mol·L-1 HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8 A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部 2.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是() A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B.氢硫酸的导电能力低于相同浓度的亚硫酸 C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D.氢硫酸的还原性强于亚硫酸
3.常温下1 mol·L-1的氨水加水稀释时,下列选项中随着加水量的增加而减小的是() A.c(OH-) B.NH3·H2O电离程度 C.n(H+) D.K W 4.室温下,关于pH=1的醋酸溶液,下列说法正确的是() A.溶液中c(H+)比pH=1的盐酸小 B.1 L该醋酸溶液与足量的Fe粉完全反应,生成0.05 mol H2 C.若将10 mL该醋酸溶液加水稀释至100 mL,溶液pH=2 D.与0.1 mol/L的NaOH溶液完全反应所需溶液体积:V(NaOH溶液)>V(醋酸溶液) 5.(2017湖南三市联考)常温下0.1 mol·L-1醋酸溶液的pH=a,下列措施能使溶液pH=(a+1)的是() A.将溶液稀释到原体积的10倍 B.加入适量的醋酸钠固体 C.加入等体积0.2 mol·L-1盐酸 D.升高溶液的温度 6.室温下,向0.01 mol·L-1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如下图所示。下列分析正确的是()
基本物理常数与计量基本单位
收稿日期:2002-12-27. 基金项目:湖北省教育厅2002年度重点项目(B 类). 作者简介:杨建平(1964-),女,副教授,主要从事物理学史的研究. 基本物理常数与计量基本单位 杨建平 (湖北民族学院物理系,湖北恩施445000) 摘要:基本物理常数的发现和测量,不仅在物理学的发展中起到了很大的作用,而且在计量学的发展上也起到 了重要的作用.设法把计量单位的定义与基本物理常数相联系,详细分析了长度单位、电压单位、电阻单位以 及质量单位与基本物理常数的关系.由于基本物理常数是不会变化的,因此这样定义的计量单位极为稳定,不 会随着时间而发生漂移. 关键词:基本物理常数;计量基准;单位制 中图分类号:04-34文献标识:A 文章编号:1008-8423(2003)02-0069-03 基本物理常数是指那些在物理学中起着基本而广泛作用的普适常数.如真空中的光速c 、普朗克常数1、基本电荷量e 、阿伏伽德罗常数N A 以及许多有关微观粒子的常数等等.基本物理常数的发现和测量,不仅在物理学的发展中起到了很大的作用,而且在计量学的发展上也起到了重要的作用.普朗克早在20世纪初就 建议用基本物理常数来定义物理量的基本单位,也就是计量基本单位.但由于当时的测量准确度还很低, 这个愿望未能实现.20世纪50年代以前,计量基准的量值一般是由实物基准所保存及复现的.这种实物基准一般是根据经典物理学的原理,用某种特别稳定的实物来实现,而且总是用工业界所能提供的最好的材料及工艺制成,以保证其稳定性. 实物基准及相应的计量量值传递检定系统给产业界提供了计量服务,确实在帮助产业界提升产品品质的工作中作出了贡献.但是,随着科技及工农业的发展,这样的传统计量量值传递检定系统开始反映出一些不足:实物基准一旦做成,总会有一些不易控制的物理、化学过程使它的特性发生缓慢的变化,因而它所保存的量值也会有所改变;最高等级的实物计量基准全世界只有一个或一套,一旦因为某种意外原因而损坏,就无法完全一模一样地复制出来,原来连续保存的单位量值也会因之中断;量值传递检定系统庞大复杂,从最高等级的实物基准到具体应用场所,量值要经过多次传递,准确度也必然会有所下降.为了解决这些问题,人们就要寻找那些不依赖于某一具体实物具体特性的计量基准,从而诞生了量子计量基准.量子计量基准基于量子物理学中阐明的微观粒子的运动规律,特别是微观粒子的态和能级的概念.按照量子物理学,宏观物体中的微观粒子如果处于相同的微观态,其能量有相同的确定值,也就是处于同一能级上.当粒子在不同能级之间发生量子跃迁时,将伴随着吸收或发射能量等于能级差!E 的电磁波能量子,即光子.而且,电磁波频率 !与!E 之间满足普朗克公式, 而比例系数为普朗克常数1.也就是说,电磁波的频率反映了能级差的数量.另一方面,宏观物体中基本粒子的能级结构与物体的宏观参数,如形状、体积、质量等并无明显关系.因此,即使物体的宏观参数随时间发生了缓慢变化,也不会影响物体中微观粒子的量子跃迁过程.这样,利用量子跃迁现象来复现计量单位,就可以从原则上消除各种宏观参数不稳定产生的影响,所复现的计量单位不再发生缓慢漂移,计量基准的稳定性和准确度可以达到空前的提高.而且量子跃迁复现计量单位不受时间、地点的限制.现在,把此类用量子现象复现量值的计量基准统称为量子计量基准,而量子计量基准中,又依赖于一些基本物理常数.20世纪80年代开始,随着基本物理常数准确度的不断提高,长度单位、电学量电压和电阻单第21卷第2期 2003年6月湖北民族学院学报(自然科学版)JournaI of Hubei Institute for NationaIities (NaturaI Science Edition )VoI.21No.2Jun.2003
弱电解质的电离平衡知识点
一、弱电解质得电离 1、定义:电解质:在水溶液中或熔化状态下自身能够电离出自由移动离子得化合物,叫电解质。 非电解质:在水溶液中且熔化状态下自身都不能电离出自由移动离子得化合物。 概念理解: ①电解质、非电解质都就是化合物,能导电得物质可能就是溶液(混合物)、金属(单质),但她们不属于电解质非电解质得研究对象,因此她们既不就是电解质也不就是非电解质; ②自身电离:SO2、NH3、CO2、等化合物能与水反应形成酸或碱,但发生电离得并不就是她们本身吗,因此属于非电解质; ③只能在水中发生电离得电解质有酸或者某些易溶于水高温下易分解得盐,如液态氯化氢就是化合物,只存在分子,没有发生电离,因此不能导电,又如NaHCO3在高温时即分解,不能通过熔融态证明其为电解质; 只能在熔融状态下电离得电解质就是活泼金属氧化物,如Na2O、CaO,她们在溶液中便不存在,要立刻反应生成键,因此不能通过溶液中产生离子证明; 既能在水溶液中又能在溶液中发生电离得物质就是某些高温难分解盐,绝大多数盐溶解在水中都能发生完全电离,某些盐熔融时也发生电离,如BaSO 4。 ④电离不需要通电等外界条件,在熔融或者水溶液中即能够产生离子; ⑤就是电解质,但就是要产生离子也要在溶液状态或者熔融状态,否则即便存在离子也无法导电,比如NaCl,晶体状态不能导电。 ⑥电解质得强弱与导电性、溶解性无关。如如BaSO4不溶于水,但溶于水得BaSO4全部电离,故BaSO4为强电解质。导电性与自由移动离子得浓度与带电荷数等有关。
强电解质:在水溶液里全部电离成离子得电解质。 弱电解质:在水溶液里只有一部分电离成离子得电解质。 2、常见得电解质为酸碱盐、活泼金属氧化物、水,其中强电解质与偌电解质常见 分类: 3、电离方程式得书写——“强等号,弱可逆,多元弱酸分步离” ①强电解质:如H2SO4:H2SO4===2H++SO2-4。 ②弱电解质 a.一元弱酸,如CH3COOH:CH3COOH CH3COO-+H+。 b.多元弱酸,分步电离,分步书写且第一步电离程度远远大于第二步得电离程度,如H2CO3:H2CO3H++HCO-3、HCO-3H++CO2-3。原因就是上一级电离出得H +就是下一级电离得产物,对下一级电离电离有抑制作用 c.多元弱碱,虽然分布电离,但就是书写时一步到位。如Fe(OH)3:Fe(OH)3Fe3++3OH-。 ③酸式盐 a.强酸得酸式盐
高中化学 弱电解质的电离平衡
弱电解质的电离平衡 1.25 ℃时不断将水滴入0.1 mol·L-1的氨水中,下列图像变化合理的是() 解析:选C A项,氨水的pH不可能小于7;B项,NH3·H2O的电离程度在稀释过程中始终增大;D项,温度不变,K b不变。 2.H2S水溶液中存在电离平衡H2S H++HS-和HS-H++S2-。下列说法正确的是() A.加水,平衡向右移动,溶液中H+浓度增大 B.通入过量SO2气体,平衡向左移动,溶液pH增大 C.滴加新制氯水,平衡向左移动,溶液pH减小 D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 解析:选C向H2S溶液中加水,平衡向右移动,但溶液体积增大,溶液中H+浓度减小,A错误。通入SO2,可发生反应:2H2S+SO2===3S↓+2H2O,SO2过量时,SO2与水反应生成的H2SO3酸性比氢硫酸强,因此溶液pH减小,B错误。滴加新制氯水,发生反应:H2S+Cl2===2HCl+S↓,H2S浓度减小,平衡向左移动,反应生成的盐酸为强酸,溶液酸性增强,pH 减小,C正确。加入少量CuSO4固体,发生反应:CuSO4+H2S===CuS↓+H2SO4,溶液中 S2-浓度减小,H+浓度增大,D错误。 3.相同温度下,根据三种酸的电离常数,下列判断正确的是() A.三种酸的强弱关系:HX>HY>HZ B.反应HZ+Y-===HY+Z-能够发生 C.相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大 D.相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX溶液的电离常数解析:选B表中电离常数大小关系:HZ>HY>HX,所以酸性强弱为HZ>HY>HX,可见A、C不正确。电离常数只与温度有关,与溶液浓度无关,D不正确。 4.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是() ①加少量烧碱溶液②升高温度③加少量冰醋酸④加水 A.①②B.①③
《弱电解质的电离平衡》单元测试题
《弱电解质的电离平衡》单元测试题 一、单选题(每小题2分,共48分) 1、下列物质是电解质的是() A、稀硫酸 B、氯化钠 C、酒精 D、铜 2、下列物质的水溶液能导电,但属于非电解质的是() A、CH3CH2COOH B、Cl2; C、NH4HCO3; D、SO2 3 4 A、该化合物水溶液不导电; B、该化合物饱和溶液导电能力较弱 C、该化合物在熔融时不导电; D、该化合物溶于水中发生电离,溶质离子浓度小于溶质分子浓度 5、关于强弱电解质的导电性的正确说法是() A、由离子浓度决定; B、导电性基本没有差别; C、强电解质溶液导电能力强,弱电解质溶液导电能力弱; D、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移动的离子数目多 6、某固体化合物A不导电,但熔化或溶于水都能完全电离,下列关于A的说法中正确的是() A、A为非电解质 B、A是强电解质 C、A是分子晶体 D、A为弱电解质 7、下列反应的离子方程式可用H++OH-=H2O表示的有() A、盐酸和氨水反应 B、稀硝酸和氢氧化钾溶液反应 C、碳酸氢钠溶液和氢氧化钠溶液反应 D、硫酸溶液和氢氧化钡溶液反应 8、把0.05molNaOH固体分别加入到下列100mL液体中,溶液导电性基本不变,该液体是() A、自来水 B、0.5mol/L盐酸 C、0.5mol/L醋酸 D、0.5mol/L氨水 9、下列说法正确的是() A、强酸、强碱都是强电解质; B、可溶性碱都是强电解质; C、不溶于水的化合物都是弱电解质或非电解质; D、能导电的物质都是电解质 10、下列说法正确的是() A、强电解质的稀溶液中不存在溶质分子; B、强电解质溶液一定比弱电解质溶液的导电性强; C、强电解质都是离子化合物,而弱电解质都是共价化合物; D、不同的弱电解质只要物质的量浓度相同,电离程度也相同; 11、下列关于弱电解质的说法中正确的是() A、弱电解质需要通电才能发生电离; COO-+H+CH3COOH; B、醋酸溶液达到电离平衡时,不存在CH C、H2SO4是共价化合物,所以它是弱电解质;NaOH是离子化合物,所以它是强电解质; D、弱电解质溶液中,既有溶质分子,又有溶质电离出来的离子; 12、一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成的氢气总量。可向盐酸中加入适量的() A、NaOH(固体); B、H2O; C、NH4NO3(溶液); D、NaCl(固体);
弱电解质的电离平衡练习题
弱电解质的电离平衡练习题 1.下列物质的水溶液能导电,但属于非电解质的是 A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.S02 2.下列物质是强电解质的是 A.CH3COOH B.SO3C.BaSO4D.石墨 3.某物质的水溶液能导电,且该物质属于非电解质,溶于水化学键被破坏的是A.液溴B.干冰C.蔗糖D.硫酸钡 4.下列关于电解质电离的叙述中,正确的是 A.碳酸钙在水中溶解度很小,其溶液的导电性很差,所以碳酸钙是弱电解质。 B.碳酸钙在水中溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质。 C.氯水和氨水的水溶液导电性都很好,所以它们是弱电解质 D.水难电离,纯水几乎不导电,所以水是弱电解质 5.下列叙述正确的是 A.强电解质溶液的导电能力一定比弱电解质溶液强 B.因醋酸是弱电解质,盐酸是强电解质,因而中和等体积、物质的量浓度的醋酸和盐酸时,盐酸消耗的NaOH比醋酸多。 C.NaHCO3溶于水,溶液中存在电离平衡。 D.物质的量浓度相同的磷酸钠溶液和磷酸溶液中C(PO43-)相同。 6.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是
A.中和时所需NaOH的量B.电离程度 C.H+的物质的量浓度D.CH3COOH的物质的量 7.甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10 mol/L的乙酸。经测定它们的pH 从大到小依次为a、乙酸、b。由此可知 A.a的浓度必小于乙酸的浓度B.a的浓度必大于乙酸的浓度 C.b的浓度必小于乙酸的浓度D.b的浓度必大于乙酸的浓度 8.在同一温度下,当弱电解质溶液a,强电解质溶液b,金属导体c的导电能力相同,若同时升高到相同温度,则它们的导电能力是 A.a>b>c B.a=b=c C.c>a>b D.b>c>a 9.某浓度的氨水中存在下列平衡:NH 3·H2O NH4+ + OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是 A.适当升高温度B.加入NH4Cl固体C.通入NH3 D.加入少量盐酸 10.已知HClO的酸性比H 2CO3弱,下列反应Cl2+H2O HCl + HClO达到平衡后,要使平衡体系中HClO的浓度增大,应采取的方法是 A.光照B.加入石灰石C.加入固体NaOH D.加水 11.将0.lmol·1L 醋酸溶液加水稀释,下列说法正确的是 A.溶液中c(H+)和c(OH-)都减小B.溶液中c(H+)增大 C.醋酸电离平衡向左移动D.溶液的pH增大
化学:弱电解质的电离平衡归纳总结
弱电解质的电离平衡 考查方式: 本章为历年高考考试中考点分布的重点区之一,主要的题型为选择题,偶有简答题,尚未出现过综合性的大题,涉及此内容的考点将基本不变,热点将常考常新,跨学科的综合性大题将有可能出现。从近几年高考命题规律来看,今后的高考试题中这部分内容出来的概率仍然很高,这是这部分内容在教材中的地位决定的,有关PH值的计算、离子共存、离子浓度大小的比较将仍是必考点。 命题规律: 1.弱电解质的电离平衡 电离平衡是化学平衡理论应用的X例,在化学中占有重要的地位在历年高考均受到重视,近五年的高考题也承继了这个传统。 考查的主要内容集中点 比较某些物质导电性强弱; 外界条件对弱电解质电离平衡的影响; 依据电离平衡移动理论,解释某些问题。 同浓度(或PH)强弱电解质的比较,如氢离子浓度大小,起始反应速率,中和碱的能力、稀释后的PH的变化等。 2.水的电离与溶液的PH 以水的电离和溶液pH 计算为考查内容的试题能有效地测试考生的判断、推理、运算等思维能力,仍将是将来考试的热点。 考试内容包括: (1).已知pH 的强酸、强碱混合,或已知浓度的强酸、强碱混合,计算溶液的pH (2).已知pH或c的强弱酸碱混合,分析溶液的酸碱性。 (3).已知混合溶液的pH,推断混合前的酸碱的各种可能,或已知溶液的pH及强酸、强碱的pH,求混合比例。 (4).中和滴定接近终点时,溶液pH计算。 (5).在新情景下,考查水电离平衡及K w。 3. 盐类水解 考查的内容有: 1.盐对水的电离程度的影响做定性判断或定量计算 2.盐溶液蒸干灼烧后产物的判断; 3.pH大小的比较; 4.离子浓度大小的比较等。 另外,判断离子共存、配制溶液、试剂贮存、化肥的混用、物质鉴别推断、某些盐的分离除杂等内容在高考中也涉及到盐的水解。其中命题的热点是离子浓度大小的比较。在高考试题中,特别是选择题,常常将盐类水解与弱电解质的电离、酸碱中和滴定、pH等知识融合在一起,具有一定的综合性。
弱电解质在水溶液中的电离平衡
【弱电解质在水溶液中的电离平衡】 【电离平衡概念】 一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态(属于化学平衡). 任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度. 【电离平衡的特征】 ①逆:弱电解质的电离过程是可逆的,存在电离平衡. ②等:弱电解质电离成离子的速率和离子结合成分子的速率相等. ③动:弱电解质电离成离子和离子结合成分子的速率相等,不等于零,是动态平衡. ④定:弱电解质在溶液中达到电离平衡时,溶液里离子的浓度、分子的浓度都不再改变. ⑤变:外界条件改变时,平衡被破坏,电离平衡发生移动. 【电离方程式的书写】 (1)强电解质用“=”,弱电解质用“?” (2)多元弱酸分步电离,多元弱碱一步到位. H2CO3≒H++HCO3-,HCO3-≒H++CO32-,以第一步电离为主. NH3?H2O≒NH4++OH- Fe(OH)3≒Fe3++3OH- (3)弱酸的酸式盐完全电离成阳离子和酸根阴离子,但酸根是部分电离.NaHCO3=Na++HCO3-,HCO3-≒H++CO32- (4)强酸的酸式盐如NaHSO4完全电离,但在熔融状态和水溶液里的电离是不相同的. 熔融状态时:NaHSO4=Na++HSO4-;溶于水时:NaHSO4=Na++H++SO42-.
【例2】室温下,对于pH和体积均相同的醋酸和盐酸两种溶液,分别采取下列措施,有关叙述正确的是() A.加适量的醋酸钠晶体后,两溶液的pH均增大 B.温度都升高20℃后,两溶液的pH均不变 C.加水稀释两倍后,两溶液的pH均减小 D.加足量的锌充分反应后,两溶液中产生的氢气一样多 【解析】盐酸是强酸,醋酸是弱酸,所以醋酸溶液中存在电离平衡,升高温度能促进弱电解质电离,pH相同的醋酸和盐酸,醋酸的浓度大于盐酸,不同的酸和相同金属反应,生成氢气的速率与溶液中离子浓度成正比. A.向盐酸中加入醋酸钠晶体,醋酸钠和盐酸反应生成醋酸,导致溶液的pH增大,向醋酸中加入醋酸钠,能抑制醋酸电离,导致其溶液的pH增大,故A正确; B.盐酸是强酸,不存在电离平衡,升高温度不影响盐酸的pH,醋酸是弱酸,其水溶液中存在电离平衡,升高温度,促进醋酸电离,导致醋酸溶液中氢离子浓度增大,所以醋酸的pH减小,故B错误; C.pH相同、体积相同的醋酸和盐酸两种溶液分别加水稀释后,溶液中氢离子浓度都减小,所以pH都增大,故C错误; D.pH相同、体积相同的醋酸和盐酸,醋酸的物质的量大于盐酸,且二者都是一元酸,所以分别与足量的锌反应,醋酸产生的氢气比盐酸多,故D错误; 故选A. 题型三:电离平衡常数的含义 【例3】部分弱酸的电离平衡常数如表,下列选项错误的是() A.2CN-+H2O+CO2→2HCN+CO32- B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑ C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 【解析】弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强的酸其物质的量浓度越小,弱酸根离子水解程度越小,结合强酸能和弱酸盐反应制取弱酸分析解答. 根据电离平衡常数知,酸性强弱顺序为:HCOOH>H2CO3>HCN>HCO3-, A.氢氰酸的酸性大于碳酸氢根离子而小于碳酸,所以发生CN-+H2O+CO2→HCN+HCO3-反应,故A错误; B.甲酸的酸性大于碳酸,所以2HCOOH+CO32-→2HCOO-+H2O+CO2↑能发生,故B正确;
弱电解质的电离知识点总结
弱电解质的电离 一、电解质、非电解质、 1、电解质:在水溶液里或熔融状态下能导电的化合物。 2、非电解质:在水溶液里和熔融状态下都不能导电的化合物。 ①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。 ②电解质必须是自身能直接电离出自由移动的离子的化合物。SO2、CO2 ③条件:水溶液或融化状态 对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。 ④难溶性化合物不一定就是弱电解质。 例如:BaSO4、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质。 ⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸是电解质溶液); 蔗糖、酒精为非电解质。 二、强电解质与弱电解质 1、强电解质:溶于水或熔融状态下几乎完全电离的电解质。 2、弱电解质:溶于水或熔融状态下只有部分电离的电解质。 ①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H2O、HF等都是弱电解质。 ②电解质的强弱与溶解度无关。如BaSO4、CaCO3等 ③电解质的强弱与溶液的导电能力没有必然联系。 说明离子化合物在熔融或溶于水时离子键被破坏,电离产生了自由移动的离子而导电;共价化合物只有在溶于水时才能导电.因此,可通过使一个化合物处于熔融状态时能否导电的实验来判定该化合物是共价化合物还是离子化合物。
3、电解质溶液的导电性和导电能力 ① 电解质不一定导电(如NaCl 晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质; ② 电解质溶液的导电性强弱决定于溶液离子浓度大小,浓度越大,导电性越强。离子电荷数越高,导电能力越强。 ③ 强电解质溶液导电性不一定比弱电解质强(浓度可不同);饱和强电解质溶液导电性不一定比弱电解质强 ④ 电解质的导电条件是水溶液或高温熔融液(熔液)。共价化合物只能在溶液中导电,离子化合物在熔液和溶液均可导电。(区别离子与共价化合物) 三、弱电解质的电离平衡 1、电离平衡概念 一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态(属于化学平衡)。 任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度。 2、电离平衡的特征 ①逆:弱电解质的电离过程是可逆的,存在电离平衡。 ②等:弱电解质电离成离子的速率和离子结合成分子的速率相等。 ③动:弱电解质电离成离子和离子结合成分子的速率相等,不等于零,是动态平衡。 ④定:弱电解质在溶液中达到电离平衡时,溶液里离子的浓度、分子的浓度都不再改变。 ⑤变:外界条件改变时,平衡被破坏,电离平衡发生移动。 3、影响电离平衡的因素(符合勒沙特列原理) (1)内因—电解质本身的性质,是决定性因素。 (2)外因 ①温度—由于弱电解质电离过程均要吸热,因此温度升高,电离度增大。 ②浓度—同一弱电解质,浓度越大,电离度越小。 在一定温度下,浓度越大,电离程度越小。因为溶液浓度越大,离子相互碰撞结合成分子的机会越大,弱电解质的电离程度就越小。因此,稀释溶液会促进弱电解质的电离。 导电性强弱 离子浓度 离子所带电荷 溶液浓度 电离程度
