九年级化学金属专题复习
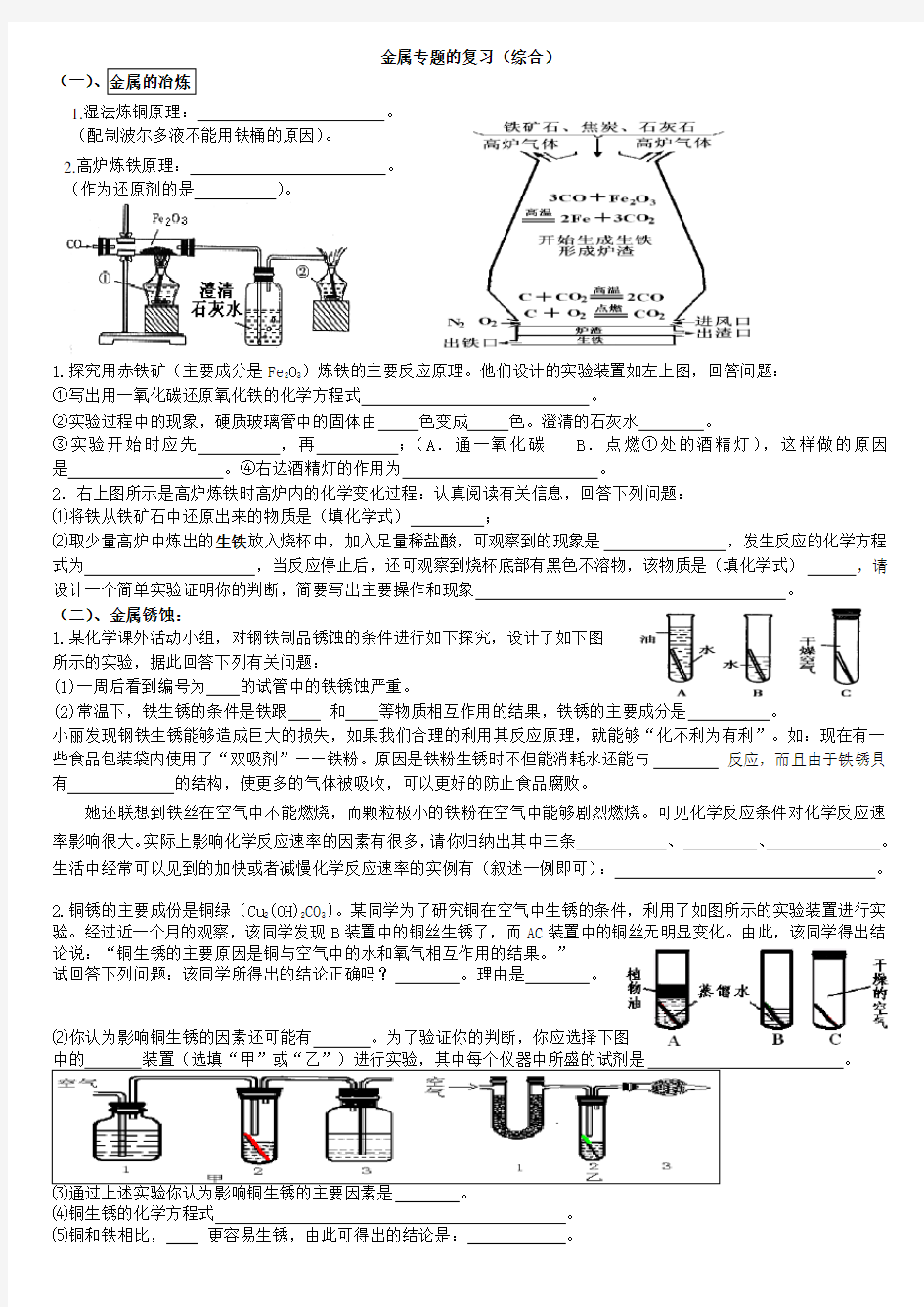

金属专题的复习(综合)
(一)
、
1.探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如左上图,回答问题:
①写出用一氧化碳还原氧化铁的化学方程式。
②实验过程中的现象,硬质玻璃管中的固体由色变成色。澄清的石灰水。
③实验开始时应先,再;(A.通一氧化碳B.点燃①处的酒精灯),这样做的原因是。④右边酒精灯的作用为。
2.右上图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题:
⑴将铁从铁矿石中还原出来的物质是(填化学式);
⑵取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象是,发生反应的化学方程式为,当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式),请设计一个简单实验证明你的判断,简要写出主要操作和现象。
(二)、金属锈蚀:
1.某化学课外活动小组,对钢铁制品锈蚀的条件进行如下探究,设计了如下图
所示的实验,据此回答下列有关问题:
(1)一周后看到编号为的试管中的铁锈蚀严重。
(2)常温下,铁生锈的条件是铁跟和等物质相互作用的结果,铁锈的主要成分是。
小丽发现钢铁生锈能够造成巨大的损失,如果我们合理的利用其反应原理,就能够“化不利为有利”。如:现在有一些食品包装袋内使用了“双吸剂”——铁粉。原因是铁粉生锈时不但能消耗水还能与反应,而且由于铁锈具有的结构,使更多的气体被吸收,可以更好的防止食品腐败。
她还联想到铁丝在空气中不能燃烧,而颗粒极小的铁粉在空气中能够剧烈燃烧。可见化学反应条件对化学反应速率影响很大。实际上影响化学反应速率的因素有很多,请你归纳出其中三条、、。生活中经常可以见到的加快或者减慢化学反应速率的实例有(叙述一例即可):。
2.铜锈的主要成份是铜绿〔Cu2(OH)2CO3〕。某同学为了研究铜在空气中生锈的条件,利用了如图所示的实验装置进行实验。经过近一个月的观察,该同学发现B装置中的铜丝生锈了,而AC装置中的铜丝无明显变化。由此,该同学得出结论说:“铜生锈的主要原因是铜与空气中的水和氧气相互作用的结果。”
试回答下列问题:该同学所得出的结论正确吗?。理由是。
⑵你认为影响铜生锈的因素还可能有。为了验证你的判断,你应选择下图
中的装置(选填“甲”或“乙”)进行实验,其中每个仪器中所盛的试剂是。
⑶通过上述实验你认为影响铜生锈的主要因素是。
⑷铜生锈的化学方程式。
⑸铜和铁相比,更容易生锈,由此可得出的结论是:。
金属的冶炼
1.湿法炼铜原理:。
(配制波尔多液不能用铁桶的原因)。
2.高炉炼铁原理:。
(作为还原剂的是)。
(三)、金属活动性顺序的判断、探究、运用
1.在容器中盛有相同质量分数的稀盐酸,将A 、B 、C 和锌四
种金属分别同时放入其中,小明将观察到的现象画了一幅卡通
画,每个卡通人物表示一种金属,周围的小黑点表示反应中生
成的气体。
(1)A 、B 、C 三种金属的活泼性由强到弱的顺序可能是
(2)B 是常见的金属,该金属和盐酸反应的化学方程式
为 。
( )2、有X 、Y 、Z 三种金属,能发生以下置换反应:①X+H 2SO 4== XSO 4+H 2↑ ②Y+HCl=不反应
③Z+ XSO 4==X+ ZSO 4则X 、Y 、Z 三种金属的活动性由强到弱的顺序可排列为
A.X 、Y 、Z B.Z 、X 、Y C.X 、Z 、Y D.Y 、Z 、X
( )3、X 、Y 、Z 三种金属中,只有Z 能与稀硫酸反应,当把Y 放入X 的盐溶液时,Y 表面有X 析出。则X 、Y 、Z 三种金属的活动性顺序为 A .X>Z>Y B .Y>X>Z C .Z>Y>X D .Y>Z>X
(四)、设计实验方案探究金属活动性顺序
金属活动性顺序为:K Ca Na Sn Pb (H ) Pt Au 。
1.某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且其形状、大小相同;所用盐酸的溶质质量分数、用量也相同)。下列判断中,错误的是
A .通过上述三个实验,不能判断出四种金属的活动性顺序
B .若增加一个铜锌活动性比较的实验,则可判断出四种金属的活动性顺序
C .通过实验①和③的反应剧烈程度,可以判断出铁和锌的金属活动性强弱
D .通过实验②的反应现象,可以判断出铜和银的金属活动性强弱
2.用两种不同的方法证明铁、铜两种金属的活动性顺序。
3.如果要证明铁、铜、银三种金属的金属活动性顺序,你能设计出更简单的方案吗?
实验步骤 实验现象 实验结论及化学方程式 取两支试管,分别倒入硫酸亚铁溶液和硝酸银溶液各2mL 。然后各插入一根洁净的铜丝。 ①硫酸亚铁溶液中铜丝表面 。 ②硝酸银溶液中的铜丝表面 ,溶液由无色变为 。 这三种金属活动性由强到弱的顺序为
化学方程式
【轻松闯关】
( )1.欲判断三种金属X 、Y 、Z 的活动性顺序,没有必要验证的结论是
A. Y 能从X 的盐溶液中置换出X 。
B.X 能置换出酸中的氢元素
C.Y 能置换出酸中的氢元素
D.Z 不能置换出酸中氢元素
( )2.只用一种试剂,一次性验证铜、锌、银三种金属的活动性强弱,该试剂是
A.硫酸铜溶液 B .硫酸锌溶液 C .硝酸银溶液 D .稀盐酸
( )3.要探究锌、铜、银三种金属的活动性顺序,可以选用下列哪组试剂进行实验:
A .Zn 、CuSO 4、Ag
B .Cu 、Ag 、ZnSO 4
C .Zn 、Cu 、H 2SO 4
D .ZnSO 4、Cu 、AgNO 3
( )4.化学兴趣小组为验证铁、铜、锌三种金属的活动性顺序,设计了四种实验方案,每种方案所需试剂如下.其中不可行的方案是
A .Fe 、ZnSO 4溶液、CuSO 4溶液
B .Cu 、FeSO 4溶液、Zn
C .Fe 、、ZnSO 4溶液、Cu
D .SO 4溶液、Fe 、Zn
分析: ⑴试管①的结论: ⑵试管②的结论: ⑶试管③的结论: ⑷对比试管①试管③后的结论:
金属活动性越来越弱
B C A
(五)、金属发生置换反应中金属和溶液的质量变化
()1.下列溶液分放入锌片,一段时间把锌片取出,溶液质量增加的是
A.氯化镁溶液B.盐酸C.硫酸亚铁溶液D.硝酸银溶液
()2.将一定量的镁条投入过量的稀盐酸中,表示反应过程中变化关系的曲线正确的是
()3.向足量稀硫酸中加入适量的锌粉,下列图像能正确表示其变化情况的是
Mg24
H2SO498
Al 18 H2
Zn 65 2
2HCl 73
Fe 56
①等质量的镁铝锌铁四种金属与足量的稀盐酸反应,产生氢气的质
量最多的金属是。产生氢气的质量最少的金属是。
②足量的等质量镁铝锌铁四种金属与等质量等质量分数的稀盐酸反
应产生等质量的氢气,消耗金属的质量关系是:
> > > 。
例题:等质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(已知M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如右图所示,下列叙述正确的是
A.M、N两种金属中较活泼的是N B.生成H2的质量M<N
C.相对原子质量较大的是N D.产生H2的速率N>M
【轻松闯关】
1.把相同体积、相同质量分数的稀盐酸,分别滴到等质量、颗粒大小相同的X、Y、Z三种较活泼金属中,生成H2的质量与反应时间的关系如右图所示。这三种金属的活动性顺序为;
假如X、Y、Z都是+2价金属,则相对原子质量由大到小的顺序为。
2.向一定量的铁粉中逐滴加入稀硫酸至过量,下图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示
A.消耗铁粉的质量
B.生成硫酸亚铁的质量
C.溶液的总质量 D生成氢气的质量
()3.等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量m(纵坐标)与反应时间t(横坐标)的关系图,合理的是
m Zn m m Fe m
Fe Fe Zn Zn
Zn Fe
A t
B t
C t
D t
D
C
B
A
氢
气
的
质
量
\g
O 反应时间/s
甲
乙
()4.某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见右图)。
分析图像得到的以下结论中,一定正确的是:
A.金属甲比金属乙活泼
B.金属甲比金属乙的相对原子质量大
C.金属乙比金属甲的反应速率大
D.金属乙比金属甲的化合价高
( )5.等质量的锌、铁、镁分别放入足量的盐酸中,放出H2的质量与消耗金属质量的关系,图像正确的是
【快乐提高】
()6.某课外兴趣小组的同学绘制四种实验操作的变化趋势图像,其中正确的是
A.图A表示将等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
B.图B表示向两份体积相同、溶质质量分数相同的稀盐酸中,分别加入足量的铁粉和镁粉
C.图C表示向等质量、等质量分数的稀硫酸中加入等质量的金属镁和铝
D.图D表示向等质量的金属镁和铝中分别加入足量且质量分数相等的稀硫酸
4.如下图所示,在甲、乙两支完全相同的试管中,装有足量的质量和溶质质量分数均相同的稀盐酸,在两支试管上方各罩一个完全相同的气球,两个气球中分别装有相同质量的金属A与B,现同时提起两只气球,使其中的金属迅速与稀盐酸接触反应。实验发现:开始时,甲气球迅速鼓起,而乙气球鼓起较慢。反应结束时,甲气球鼓起的体积比乙气球大。根据以上事实,可得出以下结论:
(1) ;(2) 。
(3)若在上述条件下,A、B两种金属与盐酸反应均生成+2价盐,据此还可以得到的结论是。
(七)、有关金属的天平问题(基本思路: )
例题:在天平的左右托盘上,各放一只盛有50g溶质质量分数为14.6%盐酸的烧杯,将天平调整平衡,然后在天平左右两盘上的烧杯中加入下列一定质量的物质,充分反应后,天平仍然平衡是( )
A.18g镁和18g铜 B.4g硝酸银和8.4g碳酸钙
C.18g锌和18g铁 D.4g氧化镁和8.4g碳酸镁
Zn+2HCl=ZnCl2+H2↑ Fe+2HCl=FeCl2+H2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ MgCO3+2HCl=MgCl2+H2O+CO2↑65 73 2 56 73 2 100 73 44 84 73 44 6.5g 7.3g 0.2g 5.6g 7.3g 0.2g 10g 7.3g 4.4g 8.4g 7.3g 4.4g
例题1:在天平左右两盘各放一只盛有100g溶质质量分数为7.3%盐酸的烧杯,天平平衡,在左盘加入1g锌粉、右盘同时加入1g铁粉,充分反应,则天平指针会()
A.指向左盘
B.指向右盘
C.指向中间(天平平衡)
D.无法确定
例题2:在天平左右两盘各放一只盛有100g溶质质量分数为7.3%盐酸的烧杯,天平平衡,在左盘加入5.6g锌粉、右盘同时加入5.6g铁粉,充分反应,则天平指针会()
A.指向左盘
B.指向右盘
C.指向中间(天平平衡)
D.无法确定
Mg Fe
例题3:在天平左右两盘各放一只盛有100g溶质质量分数为7.3%盐酸的烧杯,天平平衡,在左盘加入6.5g锌粉、右盘同时加入6.5g铁粉,充分反应,则天平指针会()
A.指向左盘
B.指向右盘
C.指向中间(天平平衡)
D.无法确定
例题4:在天平左右两盘各放一只盛有100g溶质质量分数为7.3%盐酸的烧杯,天平平衡,在左盘加入7g锌粉、右盘同时加入7g铁粉,充分反应,则天平指针会()
A.指向左盘
B.指向右盘
C.指向中间(天平平衡)
D.无法确定
【直击中考】
1.在托盘天平的两盘上各放一只质量相同的烧杯,分别注入100g7.3%的稀盐酸,天平平衡,向左盘烧杯中投入一定质量的碳酸钙,向右盘烧杯中投入一定量的镁粉,均恰好完全反应,天平指针发生偏转。则下列各项操作中,能使天平重新达到平衡的是
A.在左盘上放4g砝码
B. 在左盘上放6g砝码
C.移动游码至3.4g刻度 D. 移动游码至7.6g刻度
2.在已调平的托盘天平两边各放一个等质量的烧杯,向烧杯中各加入质量相等、质量分数也相等的稀硫酸,然后在左右两盘的烧杯中分别放入等质量的锌粒和铁粉。下列现象不可能
...观察到的是()
A.天平指针最终偏向放锌粒的烧杯一边 B.只有锌粒有剩余
C.天平指针开始偏向放铁粉的烧杯一边 D.只有铁粉有剩余
3.在已调整好零点的天平两边的托盘里,各放一质量相等的烧杯,烧杯中分别盛有同浓度等质量的稀盐酸,向左边烧杯中加入m克铝,右边烧杯加入m克镁。当反应停止后。
(1)若天平仍保持平衡,则
①反应物中什么物质一定没有剩余;②什么物质一定有剩余;
③什么物质可能剩余。
(2)若天平两端失去平衡,则天平一定偏向盛放物质的一边。
(3)上述金属足量,向天平两边分别放入等浓度等质量的稀盐酸和稀硫酸,则天平将如何。
4.在天平的左右两个托盘上,各放一质量相等的烧杯,其中盛有等质量、等质量分数的稀硫酸,天平平衡,如果分别将下列四组中的两种物质放入左右两个烧杯内,充分反应后,天平仍保持平衡的是
A.等质量的锌和铜
B.等质量的锌和铁(反应后烧杯内酸都有剩余)
C.等质量的锌和铁(反应后烧杯中两种金属均有剩余)
D.等质量的锌和铁(锌完全反应,铁有剩余,两烧杯内的酸均完全反应)
(八)、金属和盐溶液发生置换反应的顺序
例:将一定量的铁粉放入硝酸铜与硝酸银的混合溶液中充分反应后过滤,滤纸上的残留物是。滤液中含。练:将一定量的锌和铁的混合物加入一定量的硫酸铜溶液中充分反应后过滤,滤纸上的残留物是。滤液中含。
练习:
()1.在CuCl2、MgCl2的混合液种,加入过量的Zn,充分反应后过滤,滤纸上的物质是
A.Cu B.Cu和Zn C.Cu和Mg D.Mg和Zn
()2.某金属加工厂生产过程中的废液含有少量硝酸银硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤出的固体中加入少量稀盐酸,无气体产生。则下列有关说法中,正确的是A.滤出的固体中一定含有银和铜,一定不含铁B.滤出的固体中一定含有银,可能含有铜和铁C.滤液中一定有硝酸亚铁,可能有硝酸银和硝酸铜D.滤液中一定有硝酸亚铁,一定没有硝酸银和硝酸铜()3.AgNO3、Cu(NO3)2、Mg (NO3)2 的混合溶液中投入一些锌粉,充分反应后过滤,向滤出的固体中加入少量稀硫酸,有气泡产生,则滤出的固体中一定有
A.Ag、Cu、Mg B.Cu、Mg、Zn C.Ag、Cu、Zn D.Ag、Mg、Zn
()4.向FeS04、CuS04的混合溶液中投入一些锌粉,完全反应后得到固体沉淀。向滤出的沉淀中加入少量稀硫酸,有气泡产生。下列对固体沉淀成分的判断正确的是
①一定含有Zn②一定含有Fe③一定含有Cu ④可能含有Zn⑤可能含有Fe⑥可能含有Cu
A.①②③B.②③④C.④⑤⑥D.②④⑥
()5.AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中投入一些锌粉,完全反应后过滤,不可能存在的情况是A.滤纸上有Ag,滤液中有Ag+,Cu2+,Zn2+,Mg2+B.滤纸上有Ag,Cu,滤液中有Ag+,Zn2+,Mg2+C.滤纸上有Ag,Cu,Zn,滤液中有Zn2+,Mg2+D.滤纸上有Ag,Cu,Zn,Mg,滤液中有Zn2+,Mg2+
6.往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后,有金属析出,过滤、洗涤后往滤液中加入稀盐酸,有白色沉淀生成,则滤渣中一定存在的物质是,滤液中一定存在的物质是
(九)、含杂质的金属与酸的反应
( )1.往5.6g混有少量铜粉的铁粉中加入足量稀盐酸,产生氢气质量
A.大于0.2g B.等于0.2g C.小于0.2g D.无法确定
()2.现有一块质量为7克的锌的合金,当它跟足量盐酸反应后生成氢气0.2克,则该合金中含有的另一金属是A.Cu B.Fe C.Ca D.Mg
()3.含有少量杂质的铁56g,与过量盐酸反应后,放出的氢气多于2 g,则铁中含有的杂质是
A.锌B.硅和硫C.铝D.氧化铁
()4.等质量的锌和铁的样品分别跟足量盐酸反应,得到等质量的氢气,可能的情况是
A.纯铁、纯锌B.纯锌、含杂质的铁(杂质不与盐酸反应)
C.铁中混有锌、锌中混有铜D.纯铁、含杂质的锌(杂质不与盐酸反应)
5.化学与人们的生活关系密切相关。某校化学兴趣小组从摄影店收集到一些废弃的定影液[主要成分为Zn(NO3)2和
AgNO3],并对定影液进行处理,回收金属银和硝酸锌固体。
设计实验步骤如下:
根据题意回答下列问题:
(1)操作1和2的名称分别是、;
(2)固体A主要成分;Y为;(填化学式)
(3)加入适量的Ba(NO3)2的目的是。
(完整版)初中化学金属知识点总结
金属和金属材料复习教案 [考点梳理] 考点1 金属材料 1.金属材料包括纯金属(90多种)和合金(几千种)两类。 金属属于金属材料,但金属材料不一定是纯金属,也可能是合金。 2.金属制品是由金属材料制成的,铁、铜、铝及其合金是人类使用最多的金属材料。 考点2 金属材料的发展史 根据历史的学习,我们可以知道金属材料的发展过程。商朝,人们开始使用青铜器;春秋时期开始冶铁;战国时期开始炼钢;铜和铁一直是人类广泛应用的金属材料。在100多年前,又开始了铝的使用,因铝具有密度小和抗腐蚀等许多优良性能,铝的产量已超过了铜,位于第二位。 金属分类:重金属:如铜、锌、铅等 轻金属:如钠、镁、铝等; 黑色金属:通常指铁、锰、铬及它们的合金。Fe、Mn、Cr(铬) 有色金属:通常是指除黑色金属以外的其他金属。 考点3 金属的物理性质 1.共性:大多数金属都具有金属光泽,密度和硬度较大,熔沸点较高,具有良好的延展性和导电、导热性,在室温下除汞为液体,其余金属均为固体。 (1)常温下一般为固态(汞为液态),有金属光泽。 (2)大多数呈银白色(铜为紫红色,金为黄色) (3)有良好的导热性、导电性、延展性 2.一些金属的特性:铁、铝等大多数金属都呈银白色,铜呈紫红色,金呈黄色;常温下大多数金属都是固体,汞却是液体;各种金属的导电性、导热性、密度、熔点、硬度等差异较大;银的导电性和导热性最好,锇的密度最大,锂的密度最小,钨的熔点最高,汞的熔点最低,铬的硬度最大。 (1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素 (3)铁:目前世界年产量最多的金属(铁>铝>铜)(4)银:导电、导热性最好的金属(银>铜>金>铝)(5)铬:硬度最高的金属(6)钨:熔点最高的金属(7)汞:熔点最低的金属 (8)锇:密度最大的金属(9)锂:密度最小的金属 检测一:金属材料(包括和 ) 1、金属的物理性质
九年级化学金属习题及答案
人教版九年级化学下册 第八单元金属和金属材料同步练习(附:答案) 课题1金属材料 1.下列不属于 ...合金的是 A.焊锡B.黄铜C.生铁 D.石墨 2.在金属铝所列性质中,属于化学性质的是 A.导电性B.导热性C.延展性 D.还原性 3.以下各组物质中都属于纯净物的是 A.石灰水、水银?B. 钢、24K金?C. 蒸馏水、汽油 D. 大理石、金刚石5.人类使用材料的历史就是人类的进步史。下列物品的主要材质当时不是通过化学变化获取的是 A.马踏飞燕(青铜器)B.龙泉剑(铁器)C.金缕衣 D.塑料器具6.2010年上海世博会中国馆—“东方之冠”给人强烈的视觉冲 击,它的主体结构为四根巨型钢筋混凝上制成的核心筒。其中 钢属于 A.金属材料:B.合成材料 C.天然材料D.复合材料 7.2009年2月12日,我国外交部发言人就法国佳士得公司拍 卖圆明园兔首和鼠首两件文物,发表严正声明:中国对其拥有 不可置疑的所有权。这两件文物均为青铜器,青铜属于 A.金属材料? B.合成材料 C.无机非金属材料??D.复合材料 8.金属材料在人类活动中已得到越来越广泛的应用。下列性质属于金属共性的是( ) A.硬度很大、熔点很高 B.有良好的导电性、传热性 C.是银白色的固体 D.易与酸反应产生氢气 答案:DD C A C A A B 课题2金属的化学性质 1.“金银铜铁锡”俗称五金。在这五种金属中,金属活动性最强的是 A.铁B.金 C.银 D.铜 2.下列物质中,不能 ..在氧气中燃烧的是() A.金箔B.铁丝 C.木炭D.氢气 --
3.下列金属中,只能与硝酸银溶液反应,不能与稀硫酸反应的是( ) A.镁B.银C.铜D.铝 4.下列关于铁、铝、铜的说法正确的是 ?A.都是银白色的金属B.都能被磁铁吸引 C.都能与氧气反应? D.都能与硫酸锌溶液反应 5.废旧手机的某些部件含有Mg、Al、Cu、Ag等金属。为了回收重金属,将旧手机部件浸入足量稀盐酸中充分反应后,过滤,所得固体中含有的金属是 A.Cu、Ag B.Mg、Ag C.Al、Cu D.Mg、Al 6、在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是() A、Fe和Cu; B、Cu;C、Fe;D、Mg和Cu 7.下列物质中能与CuSO4溶液发生置换反应的是() A.Ag ? B.Fe?C.NaOH溶液? D.HCl溶液 8.将甲、乙两种金属片分别放入丙的硫酸盐溶液中,甲表面有金属丙析出,乙表面没有任何变化。据此判断,三种金属的活动性顺序是 A.甲>丙>乙B.丙>甲>乙 C.乙>甲>丙 D.甲>乙>丙 9.A、B、C、D是四种金属单质,A能从B的硝酸盐溶液中置换出B,但A不能与稀盐酸反应。相同条件下,C、D能与稀盐酸反应产生H2,且D比C反应剧烈。则四种金属的活动性由强到弱的顺序是 A.A、B、C、D B.B、A、C、D??C.D、C、A、B D.D、C、B、A 10.甲、乙、丙三种金属,分别投入稀盐酸中,只有甲能产生气体;将乙投入丙的硝酸盐溶液中,乙的表面有丙析出。则甲、乙、丙三种金属的活动性顺序为 A.甲>乙>丙B.乙>甲>丙C.丙>乙>甲 D.甲>丙>乙 11.将M、N两种金属片分别放入硫酸铜溶液中,M表面析出铜,N没有明显现象。据此判断,三种金属的金属活动性顺序是 A. N>Cu>M B. M>Cu>N? C. Cu> M >N? D. M > N> Cu 12.有A、B、C三种金属,如果把A和B分别放入稀盐酸中,A溶解并产生氢气,B不反应;如果把B放到C的硝酸盐溶液中,过一会,B表面有C析出。则A、B、C三种金属的活动 --
人教版九年级化学下册金属和金属材料
金属和金属材料 【知识梳理】 知识点1 常见的金属材料 1、金属的共同物理性质 有金属光泽、能导电、能导热、有延展性等。不同的金属物理性质也有很多差别,如:多数金属常温下呈固态,汞是液态:多数金属是银白色的(铁在粉末状时呈黑色),铜为紫红色,金为黄色;铁、钴、镍能被磁铁吸引,其他金属一般不能被吸引。 2、金属的物理性质与用途 金属的物理性质应用 具有金属光泽贵重金属如金、银、铂等可作装饰品 机械强度大加工成多种工具、如铁锤、剪刀等 延展性好制成车辆外壳、钢丝绳、铝箔纸 导电性好电极、电线、电缆 传热性好铁锅、铝壶等 3、金属材料包括纯金属和合金 (1)合金:是在中加热熔合某些金属或非金属,从而得到具有金属特性的混合物。合金的用途比纯金属更广,是因为合金与组成它的金属相比:硬度更大、熔点更低、因而性能更优越,加工更容易。 (2)常见的合金:生铁()、不锈钢()、黄铜()、青铜()、铝合金()等。 知识点2 常见金属的化学反应 1、大多数金属能与氧气反应,但反应的难易和剧烈程度不同 (1)镁在常温下,与空气中的氧气反应,表面形成氧化膜。点燃时在空气中剧烈燃烧,发出耀眼的强光,生成白色的氧化镁固体,同时放出大量的热。 化学方程式: (2)铝在空气中能与氧气迅速反应,其表面生成一层致密的氧化铝()薄膜,从而阻止铝进一步被氧化,因此,铝具有很好的抗腐蚀性能,常涂在铁器的表面用来保护铁。 化学方程式:
(3)细铁丝在空气中不能燃烧,在纯氧气中能剧烈燃烧,火星四射,生成黑色的四氧化三铁固体。 化学方程式: (4)铜在常温下不与氧气反应,加热时才反应,红色的铜变为黑色的氧化铜。 化学方程式: (5)金在高温下也不与氧气反应。金的化学性质非常稳定,在很高温度下也不能被氧化 2、金属与酸的反应(发生置换反应) (1)反应规律:金属 + 酸→盐+ 氢气 (2)反应条件: ①金属活动性顺序中氢前面的金属(如镁、铝、铁等)能与酸(一般指盐酸、稀硫酸)反应产生氢气,并且金属位置越靠前,与酸反应越剧烈;而氢后面的金属一般不与酸反应产生氢气。 ②酸必须是除硝酸、浓硫酸外的非氧化性酸(如盐酸、稀硫酸等)。 ③生成的盐应为可溶性盐。 金属 稀盐酸稀硫酸 现象化学方程式现象化学方程式 镁 铝 铁 铜 3、金属与盐发生置换反应 (1)反应规律:金属+ 盐→新金属+ 新盐 (2)反应条件: ①K、Ca、Na三种金属非常活泼,不能将其单质直接从其盐溶液中置换出来; ②金属活动性顺序前面的金属置换后面的金属; ③反应的盐必须是溶于水的。 简记: (3)规律:当一种金属和几种盐的混合溶液发生置换反应时,其中排在活动性顺序中最后的金属优先被置换,然后再依次置换出稍后的金属。活动性顺序中两金属间距越大,则上述反应越易发生。
初三化学知识点汇总:金属
初三化学知识点汇总:金属【一】金属材料 1、金属材料 纯金属〔90多种〕,合金〔几千种〕 2、金属的物理性质: 〔1〕常温下一般为固态〔汞为液态〕,有金属光泽。〔2〕大多数呈银白色〔铜为紫红色,金为黄色〕〔3〕有良好的导热性、导电性、延展性 3、金属之最: 〔1〕铝:地壳中含量最多的金属元素 〔2〕钙:人体中含量最多的金属元素 〔3〕铁:目前世界年产量最多的金属〔铁铜〕〔4〕银:导电、导热性最好的金属〔银金铝〕〔5〕铬:硬度最高的金属 〔6〕钨:熔点最高的金属 〔7〕汞:熔点最低的金属 〔8〕锇:密度最大的金属 〔9〕锂:密度最小的金属 4、金属分类: 黑色金属:通常指铁、锰、铬及它们的合金。 重金属:如铜、锌、铅等 有色金属
轻金属:如钠、镁、铝等; 有色金属:通常是指除黑色金属以外的其他金属。 5、合金:由一种金属跟其他一种或几种金属〔或金属与非金属〕一起熔合而成的具有金属特性的物质。 ★:一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好 注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的相容性,因此可用来制造人造骨等。 优点 〔1〕熔点高、密度小 〔2〕可塑性好、易于加工、机械性能好 〔3〕抗腐蚀性能好 【二】金属的化学性质 1、大多数金属可与氧气的反应 2、金属 + 酸盐 + H2 3、金属 + 盐另一金属 + 另一盐〔条件:前换后,盐可溶〕 Fe + CuSO4 == Cu + FeSO4 〔湿法冶金原理〕 【三】常见金属活动性顺序 KNa Al Fe Pb〔H〕Hg Pt Au 金属活动性由强逐渐减弱 在金属活动性顺序里: 〔1〕金属的位置越靠前,它的活动性就越强
九年级化学金属练习题附答案及部分解析
西岗中学周周清试卷班级: 姓名学号得分 可能用到的相对原子质量:H:1 O:16 C: 12 S:32 Cu: 64 Fe: 56 Ca: 40 一.选择题:(每小题2分,8小题,共16分) 1: 将铁片分别放入下列溶液中充分反应,反应后能使铁片质量增重的物质是: A. H2SO4 B. FeSO4 C. HCl D. CuSO4 2:.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是 A.Mn + H2SO4 = MnSO4 + H2↑ B.Mg + MnSO4 = MgSO4 + Mn C.Fe + MnSO4 = FeSO4 + Mn D.Mn + CuSO4 = MnSO4 + Cu 3:.在氯化铜和氯化镁的混合溶液中,加入过量的铁粉,充分反应后过滤,留在滤纸上的物质是() A、Fe和Cu; B、Cu; C、Fe; D、Mg和Cu 4:. 在天平的两个托盘上各放一只烧杯,烧杯中都盛有足量的盐酸,此时天平保持平衡。如果一边投入少许锌粒,另一边投入相同质量的铁粉,两者都完全溶解后,天平指针将:A.偏向放锌粒的烧杯一边 B.不发生偏转C.偏向放铁粉的烧杯一边 D.无法判断5:. X、Y、Z三种金属及其化合物间可发生如下化学反应:Y+ZCl2===Z+YCl2 X+ZCl2===Z+XCl2 Y+2HCl===YCl2+H2↑ X+HCl 不反应则X、Y、Z三种金属的活动性由强到弱的顺序是: A. Z>Y>X B. X>Y>Z C. Y>X>Z D. Y>Z>X 6:、下列除去杂质的方法中,错误的是() 33 程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是 ( ) A.溶液中一定含FeCl3,固体一定是铁和铜 B.溶液中一定含FeCl2,固体一定含铜 C.溶液中一定含FeCl2、CuCl2,固体一定含铜 D.溶液中一定含FeCl2,固体一定是铁
九年级化学下册 金属和金属材料重点人教版
金属和金属材料 第一节 金属材料 金属材料:金属材料包括纯金属以及它们的合金。 金属的物理性质 在常温下一般为固态(汞为液态),有金属光泽(大多数金属呈银白色,铜呈紫红色,金呈黄色); 导电性、导热性、熔点较高、有延展性、能够弯曲、硬度较大、密度较大。 金属之最 地壳中含量最多的金属元素——铝 人体中含量最多的金属元素——钙 目前世界年产量最多的金属——铁(铁>铝>铜) 导电、导热性最好的金属——银(银>铜>金>铝) 熔点最高的金属——钨 熔点最低的金属——汞 硬度最大的金属——铬 密度最大的金属——锇 密度最小的金属——锂 金属的分类 金属的应用 物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素。在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。 铜、铝——电线——导电性好、价格低廉 钨——灯丝——熔点高 铬——电镀——硬度大 铁——菜刀、镰刀、锤子等 汞——体温计液柱 银——保温瓶内胆 铝——―银粉‖、锡箔纸 合金:由两种或两种以上的金属或金属与非金属经一定方法所合成的具有金属特性的物质。 合金是混合物。金属氧化物不是合金。 目前已制得的纯金属只有90多种,而合金已达几千种。 合金的硬度一般比组成它的纯金属的硬度大,抗腐蚀性强。 合金的熔点一般比组成它的纯金属的熔点低。 钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体具有良好的―相容性‖,可用来造人造骨。 钛和钛合金的优点:① 熔点高、密度小; ② 可塑性好、易于加工、机械性能好; ③ 抗腐蚀性能好。 生铁和钢性能不同的原因:含碳量不同。 黑色金属:通常指铁、锰、铬及它们的合金。 有色金属:通常是指除黑色金属以外的其他金属。 重金属:如铜、锌、铅等 轻金属:如钠、镁、铝等
初三化学金属和金属材料练习题2.doc
周周清一(金属和金属材料练习) 1.下列化学方程式书写正确的是() A.2Fe+6HCl==2FeCl3+3H2 B. Fe+H2SO4==FeSO4+H2 t C. Fe+ CuSO4==FeSO4+Cu D. 4Fe+3O2==2Fe2O3 2.将适量的铁粉投入到盐酸屮,下列现象不会出现的是() A.溶液变成浅绿色 B.有无色气体产生 C.铁粉不断减少 D.有棕色沉淀生成 3.国外目前掀起购买“屮国铁锅热”,这主要是因为铁锅() A.传热快 B.价格便宜 C.不易腐蚀 D.被加工的食品屮含有铁元素 4.收藏家收藏清末铝制品,至今保存丁分完好,该艺术品不易锈蚀的主要原因是() A.铝不易发生化学反应 B.铝不易发生化学反应 C.铝易氧化,其表面的氧化膜具有保护内部作用 D.铝很难与酸发生反应 5.在LI常生活屮的金属炊具和医院屮的金属医疗器械的主要成份是() A.白铜合金 B.武徳合金 C.不锈钢 D.青铜 6.下列关于生铁和钢的描述屮,正确的是() A.生铁和钢都是混合物,其主要成份都是碳 B.生铁硬而有韧性,既可以铸又可锻 C.生铁与钢的性能由很大的并别,主要是由于生铁和钢屮的含碳最不同 D.钢是用铁矿石和焦炭作原料炼制而成的 7.垃圾时放错了位置的资源,该分类|叫收,生活屮废弃的铁锅,铝制易拉罐、铜导线等可以归为一类加以冋收,它们属于() A.氧化物 B.化合物 C.金属或合金 D.非金属 8.将铁放入下列溶液屮,溶液的质量会减少的是() A.盐酸溶液 B.硫酸溶液 C.硫酸亚铁溶液 D.硫酸铜溶液 9.新买的铝锅、铝壶用来烧开水,凡是水浸到的地方都会变黑,这现彖说明该水中含有() A.钾元素 B.钠元素 C.钙元索 D.铁元索 10.下列关于“合金”的叙述①合金屮至少含有两种金属;②合金屮元素以化合态的形式存在; ③合金屮一定含有金属;④合金一定为混合物;⑤合金依然具有金属特性,其屮正确的是() A.④ B.①②③ C.③④ D.③④⑤ 11?为适应火车提速,沪宁线上原有的短轨全部连接成超常轨,在连接过稈屮,工程技术人员点燃铝热剂(铝粉和氧化镁的混合物)能释放出大量的热量,生成熔融状态的铁可用来连接铁轨,反应的化学方程式为:Fe2O3+2Allf AI2O34-2Fe其屮还原剂是()
九年级化学第八章金属知识点总结
艰第八单元 金属和金属材料 第一节 金属材料 ● 金属材料:金属材料包括纯金属以及它们的合金。 ● 金属的物理性质 ? 在常温下一般为固态(汞为液态),有金属光泽(大多数金属呈银白色,铜呈紫红色,金呈黄色); ? 导电性、导热性、熔点较高、有延展性、能够弯曲、硬度较大、密度较大。 ● 金属之最 ? 地壳中含量最多的金属元素——铝 ? 人体中含量最多的金属元素——钙 ? 目前世界年产量最多的金属——铁(铁>铝>铜) ? 导电、导热性最好的金属——银(银>铜>金>铝) ? 熔点最高的金属——钨 ? 熔点最低的金属——汞 ? 硬度最大的金属——铬 ? 密度最大的金属——锇 ? 密度最小的金属——锂 ● 金属的分类 ● 金属的应用 物质的性质在很大程度上决定了物质的用途,但这不是唯一的决定因素。在考虑物质的用途时,还需要考虑价格、资源、是否美观、使用是否便利,以及废料是否易于回收和对环境的影响等多种因素。 ? 铜、铝——电线——导电性好、价格低廉 ? 钨——灯丝——熔点高 ? 铬——电镀——硬度大 ? 铁——菜刀、镰刀、锤子等 ? 汞——体温计液柱 ? 银——保温瓶内胆 ? 铝——“银粉”、锡箔纸 ● 合金:由两种或两种以上的金属或金属与非金属经一定方法所合成的具有金属特性的物质。 合金是混合物。金属氧化物不是合金。 ● 目前已制得的纯金属只有90多种,而合金已达几千种。 ● 合金的硬度一般比组成它的纯金属的硬度大,抗腐蚀性强。 ● 合金的熔点一般比组成它的纯金属的熔点低。 ● 黑色金属:通常指铁、锰、铬及它们的合金。 有色金属:通常是指除黑色金属以外的其他金属。 重金属:如铜、锌、铅等 轻金属:如钠、镁、铝等
人教版九年级化学下册金属与金属材料单元测试卷.docx
九年级上化学金属与金属材料单元测试卷 班级姓名 一、选择题 1.联合国卫生组织经过严密的科学分析,认为我国的铁锅是最理想的炊具,并向全世界大力推广,其主要原因是() A.价格便宜 B.熔点高 C.烹饪的食物中留有铁元素D.导热性好 2.下列各组物质恰好完全反应,所得溶液的颜色是无色的是() A.锌和稀硫酸B.铁和稀硫酸C.铁和硫酸铜D.铁和稀盐酸 3.下列有关金属的说法正确的是() A.铜的导电性是金属中最好的,故用于制作电线 B.铜、黄铜、锡、焊锡都属于纯净物中的单质 C.铝比铁金属活动性强,但铝制品比铁制品耐腐蚀 D.镀锌的“白铁皮”不易生锈,说明锌没有铁活泼 4.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是()A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu 5.“绿箱子环保计划﹣﹣废弃手机及配件回收联合行动”已在全国40个重点城市中开展了近两年.下列有关废弃手机的金属材料回收利用的说法中,错误的是() A.可以节约金属资源B.可以减少对环 境的污染 C.可以节约冶炼相关金属所消耗的能源D.回收废弃手机 中的金属材料没有任何价值 6.一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与 时间的关系如图所示,下列说法不正确的是() A.t1时,产生氢气的质量锌比铁大 B.t1时,产生氢气的速率锌比铁大 C.t2时,参加反应锌的质量与铁相同 D.t2时,锌、铁消耗的盐酸质量相同 7.某合金与铁的物理性质比较如下: 熔点密度硬度导电性 某合金2500℃ 3.00g/cm37.4 2.3 铁1535℃7.86g/cm3 4.5 17 根据以上信息,你认为该合金适合用作() A.导线 B.保险丝C.飞机外壳 D.炊具 8.将锌片分别插入下列溶液中,经过一段时间后取出,溶液的质量减轻的是()A.盐酸 B.CuSO4溶液C.AgNO3溶液D.稀硫酸 9.下列反应属于置换反应的是()
九年级下册化学知识点总结人教版
九年级下册化学知识点总结人教版 九年级下册化学知识点总结人教版篇一 一、金属材料 1、金属材料 纯金属(90多种) 合金(几千种) 2、金属的物理性质:(1)常温下一般为固态(汞为液态),有金属光泽。 (2)大多数呈银白色(铜为紫红色,金为黄色) (3)有良好的导热性、导电性、延展性 3、金属之最: (1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素(3)铁:目前世界年产量最多的金属(铁>铝>铜) (4)银:导电、导热性的金属(银>铜>金>铝) (5)铬:硬度的金属(6)钨:熔点的金属 (7)汞:熔点最低的金属(8)锇:密度的金属 (9)锂:密度最小的金属 4、金属分类: 黑色金属:通常指铁、锰、铬及它们的合金。 重金属:如铜、锌、铅等 有色金属
轻金属:如钠、镁、铝等; 有色金属:通常是指除黑色金属以外的其他金属。 5、合金:由一种金属跟其他一种或几种金属(或金属与非金属)一起熔合而成的具有金属特性的物质。 ★:一般说来,合金的熔点比各成分低,硬度比各成分大,抗腐蚀性能更好 合金铁的合金铜合金焊锡钛和钛合金形状记忆金属 生铁钢黄铜青铜: 成分含碳量 2%~4.3%含碳量 0.03%~2%铜锌 合金铜锡 合金铅锡 合金钛镍合金 备注不锈钢:含铬、镍的钢 具有抗腐蚀性能紫铜为纯铜熔点低 注:钛和钛合金:被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”, 因此可用来制造人造骨等。 (1)熔点高、密度小 (2)可塑性好、易于加工、机械性能好 (3)抗腐蚀性能好 二、金属的化学性质 1、大多数金属可与氧气的反应
2、金属+酸→盐+H2↑ 3、金属+盐→另一金属+另一盐(条件:“前换后,盐可溶”) Fe+CuSO4==Cu+FeSO4(“湿法冶金”原理) 三、常见金属活动性顺序: KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu 金属活动性由强逐渐减弱 在金属活动性顺序里: (1)金属的位置越靠前,它的活动性就越强 (2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸) (3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。(除K、Ca、Na) 四、金属资源的保护和利用 1、铁的冶炼 (1)原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来。 3CO+Fe2O3高温2Fe+3CO2 (2)原料:铁矿石、焦炭、石灰石、空气 常见的铁矿石有磁铁矿(主要成分是Fe3O4)、赤铁矿(主要成分是Fe2O3) 2、铁的锈蚀 (1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3?XH2O) (铜生铜绿的条件:铜与O2、水、CO2接触。铜绿的化学式:Cu2(OH)2CO3)(2)防止铁制品生锈的措施: ①保持铁制品表面的清洁、干燥
九年级化学《金属和金属材料》金属的化学性质知识点整理
金属的化学性质 一、本节学习指导 本节知识比较复杂,学习时一定要多思考,另外多做些练习题。金属的化学性质在生活中应用也很广泛,比如防止护栏被腐蚀、存放物品容器的选择等等,还可以帮助我们识别生活的骗局哦,比如识破“钛圈”广告宣传说可以治疗颈椎病。本节有配套免费学习视频。 二、知识要点 1、大多数金属可与氧气的反应 金属在空气中在氧气中 镁常温下逐渐变暗。点燃,剧烈燃烧,发出耀眼的白光, 生成白色的固体点燃,剧烈燃烧,发出耀眼的白光,生成白色的固体2Mg + O2点燃 2MgO 铝常温下表面变暗,生成一种致密的氧化膜点燃,剧烈燃烧,发出耀眼的白光,生成白色的固体4Al + 3O2点燃2Al2O3 铁持续加热变红点燃,剧烈燃烧,火星四射,生成黑色的固体 3Fe + 2O2点燃Fe3O4 铜加热,生成黑色物质;在潮 湿的空气中,生成铜绿而被 腐蚀 加热生成黑色物质2Cu + O2加热 2CuO 银金即使在高温时也不与氧气发生反应 注:①由于镁燃烧时发出耀眼的白光,所以可用镁做照明弹和烟花。 ②常温下在空气中铝表面生成一层致密的氧化物薄膜,从而阻止铝的进一步被氧化, 因此,铝具有较好的抗腐蚀能力。 ③大多数金属都能与氧气反应,但是反应难易和剧烈程度不同。Mg,Al常温下就能反应,而Fe、Cu在常温下却不和氧气反应。金在高温下也不会和氧气反应。 ④可以利用煅烧法来鉴定黄铜和黄金,过程中如果变黑则是黄铜,黑色物质是氧化铜。
2、金属 + 酸→盐 + H2↑【重点】 锌和稀硫酸Zn + H2SO4 = ZnSO4 + H2↑ 铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑ 镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑ 铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑ 锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑ 铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑ 镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑ 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑ 注:根据不同金属和同一种酸的反应剧烈程度可以判断金属的活动顺序,越剧烈说明此金属越活跃。 规律:等质量金属与相同足量酸完全反应所用时间越少,金属反应速度越快,金属越活泼。 3、金属 + 盐→另一金属 + 另一盐(条件:“前换后,盐可溶”)【重点】 (1)铁与硫酸铜反应:Fe+CuSO4==Cu+FeSO4 现象:铁条表面覆盖一层红色的物质,溶液由蓝色变成浅绿色。 (古代湿法制铜及“曾青得铁则化铜”指的是此反应) (2)铝片放入硫酸铜溶液中:3CuSO4+2Al==Al2(SO4)3+3Cu 现象:铝片表面覆盖一层红色的物质,溶液由蓝色变成无色。 (3)铜片放入硝酸银溶液中:2AgNO3+Cu==Cu(NO3)2+2Ag 现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。 (4)铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg 现象:铜片表面覆盖一层银白色的物质,溶液由无色变成蓝色。 注意:CuSO4溶液时蓝色,FeSO4是浅绿色。 4、置换反应【重点】 (1)有一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫置换反应。 (2)特征:反应物和生成物都是:单质+化合物====单质+化合物 (3)常见类型:
人教版初三化学下册金属和金属材料专题
金属和金属材料专题学案 知识目标: 1.认识金属材料及其作用 2.了解金属的物理特征,认识常见金属的化学性质 3.能利用金属的性质解释生活中的一些化学现象 4.了解金属腐蚀的简单方法及认识废弃金属对环境的影响 考点1 金属材料 1.金属材料:包括________以及它们_______。2.合金:(1)合金是在金属中加热熔合某些金属或非金属形成的具有____________的物质。硬度一般比各成分金属_____,熔点一般比各成分金属__ 。 考点2 金属的性质 1.金属的物理性质 常温下,它们都是固体(但________是液体);有金属光泽,大多数呈银白色(但________是紫红色,________为黄色);大多数金属具有良好的________性和________性等。 2.金属的一些化学性质(以Fe为例,写出代表的化学方程式) (1)___________________ (2)___________________ (3)___________________;(2)(3)的反应基本类型___________ 考点3 金属活动性顺序 常见金属的活动性顺序:______________________________________ 考点4 铁的冶炼 反应原理是:___________________ 考点5 铁的锈蚀与防护 1.铁生锈的条件:(1)__________; (2)_________。 2.防锈措施 (1)保持金属表面的________。如:菜刀用完后擦干挂起来。 (2)金属表面涂上一层________。如:刷漆、涂油、电镀等。 (3)改变铁的单一结构,制成合金。如:制成不锈钢。 基础训练: 1.(2015北京)下列材料属于合金的是() A.玻璃 B.合成橡胶 C.生铁 D.陶瓷 2.(2015扬州)下列金属活动性最强的是() A.Cu B.Zn C.Fe D.Mg 3.(2015厦门) 夏天防雷电,远离金属。这是因为金属具有 A.导电性 B.导热性 C.延展性 D.光泽 4.关于金属物品的使用正确的是() A.铝合金门窗变旧变暗后用砂纸或钢丝球打磨
最新九年级化学金属专题复习(综合)
金属专题的复习(综合) (一) 1.探究用赤铁矿(主要成分是Fe 2O 3)炼铁的主要反应原理。他们设计的实验装置如左上图,回答问题: ①写出用一氧化碳还原氧化铁的化学方程式 。 ②实验过程中的现象,硬质玻璃管中的固体由 色变成 色。澄清的石灰水 。 ③实验开始时应先 ,再 ;(A .通一氧化碳 B .点燃①处的酒精灯),这样做的原因是 。④右边酒精灯的作用为 。 2.右上图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题: ⑴将铁从铁矿石中还原出来的物质是(填化学式) ; ⑵取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象是 ,发生反应的化学方程式为 ,当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式) ,请设计一个简单实验证明你的判断,简要写出主要操作和现象 。 (二)、金属锈蚀: 1.某化学课外活动小组,对钢铁制品锈蚀的条件进行如下探究,设计了如下图 所示的实验,据此回答下列有关问题: (1)一周后看到编号为 的试管中的铁锈蚀严重。 (2)常温下,铁生锈的条件是铁跟 和 等物质相互作用的结果,铁锈的主要成分是 。 小丽发现钢铁生锈能够造成巨大的损失,如果我们合理的利用其反应原理,就能够“化不利为有利”。如:现在有一些食品包装袋内使用了“双吸剂”——铁粉。原因是铁粉生锈时不但能消耗水还能与 反应,而且由于铁锈具有 的结构,使更多的气体被吸收,可以更好的防止食品腐败。 她还联想到铁丝在空气中不能燃烧,而颗粒极小的铁粉在空气中能够剧烈燃烧。可见化学反应条件对化学反应速率影响很大。实际上影响化学反应速率的因素有很多,请你归纳出其中三条 、 、 。生活中经常可以见到的加快或者减慢化学反应速率的实例有(叙述一例即可): 。 2.铜锈的主要成份是铜绿〔Cu 2(OH)2CO 3〕。某同学为了研究铜在空气中生锈的条件,利用了如图所示的实验装置进行实验。经过近一个月的观察,该同学发现B 装置中的铜丝生锈了,而AC 装置中的铜丝无明显变化。由此,该同学得出结论说:“铜生锈的主要原因是铜与空气中的水和氧气相互作用的结果。” 试回答下列问题:该同学所得出的结论正确吗? 。理由是 。 ⑵你认为影响铜生锈的因素还可能有 。为了验证你的判断,你应选择下图 中的 装置(选填“甲”或“乙”)进行实验,其中每个仪器中所盛的试剂是 。 1.湿法炼铜原理: 。 (配制波尔多液不能用铁桶的原因)。 2.高炉炼铁原理: 。 (作为还原剂的是 )。
人教版九年级化学下册金属和金属材料知识点讲解
第八单元金属和金属材料课题1 金属材料 【知识点精讲】 知识点1:金属材料及其发展史 1.金属材料 金属材料 2.金属材料的发展史 青铜器时代铁器时代使用铝制品使用合金 【例1】下列生活用品用金属材料制作而成的是() A.陶瓷杯 B.不锈钢碗 C.塑料盆 D.玻璃茶壶 知识点2:金属的物理性质及其用途 1.金属的物理性质 (1)几种常见金属的物理性质见表1: 铁铝铜(又称紫铜) 物理性质 纯铁具有银白色金属光 泽,质软,有良好的延展性, 密度为7.86g/cm3,熔点为 1535 ℃,沸点为2750℃, 是电和热的良导体 铝具有银白色金属光泽,密度为2.7g/ cm3,熔点为660℃,沸点为2467℃,具 有良好的延展性、导电性和导热性 铜具有紫红色金属光泽,密度 为8.92g/cm3,熔点为1083℃,沸 点为2567℃,具有良好的延展 性、导电性和导热性 分析表1可知,金属有一些共同的物理性质,如图3所示。 有金属光泽能够导电有延展性,能拉成丝,能展成薄片能够导热 (2)金属的特性 金属除具有一些共同的物理性质外,不同的金属又有各自的特性。 ①颜色:大多数金属为银白色,而铜却呈紫红色,金呈黄色。 ②状态:常温下,大多数金属为固体,而汞却为液体。 ③导电性:银、铜、铝(由强到弱)是导电性很强的金属。 ④熔点:钨的熔点最高,汞的熔点最低。 ⑤硬度:铬的硬度最大,而钠、钾等较软,可以用小刀切割。 ⑥密度:锂、钠、钾等的密度比水的小,其他大多数金属的密度比水的大,其中密度最大 的金属是锇。 2.金属的用途 金属在生活、生产中有着非常广泛的用途,根据不同的用途选用不同性能的金属,如表2所示: 金属的物理性质应用 有金属光泽可做装饰品(如金、银首饰等) 导电性好电极、电线、电缆等 导热性好做炊具,如铁锅、铝壶等 延展性好制成车辆外壳、钢丝绳、铝箔 硬度大加工成多种工具,如铁锤、剪刀、机床底座等 由表2中的内容可知,物质的性质决定物质的用途,而物质的用途又反映了物质的性质。金属的性质在很大程度上决定了它们的用途,但这不是唯一的决定因素。在考虑物质的用途时,还要考虑价格、资源、制品是否美观、使用是否便利以及废料是否易于回收和对环境的影响等多种因素,例如,银的导电性强,但它在自然界中的含量少,价格昂贵,故不宜做导线。 巧记速记1.金属特性:黄金白银紫红铜,多数固体液体汞。2.金属共性:导电导热延展性,金属光泽在表面。
九年级化学金属与金属材料练习题.doc
秋初三化学第八单元试卷(试题内容:金属与金属材料) 题号心- ?总分 得分 温馨提示:1、《认真审题,?独立思考,名准确作答,?体验 成功!葵 2、相对原子质量:Fe—56, Cu—64, H—1, C—12, 0— 16o 一、选择题(本大题包括14小题,每小题2分,共 28分。每小题的4个选项中,只有1个选项符合题 意) 1、某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线, 当玻璃被击碎时,与金属线相连的警报系统就会立刻报警。“防盗玻璃”能报警,这利用了金属的【】 A.延展性 B.导电性 C.弹性 D.导热 性 2 、关于金属物品的使用正确的是.......................................... 【】 A.铝合金门窗变旧变暗后用砂纸或钢幺幺球打磨 B.铁桶中加入硫酸铜溶液和石灰乳配制杀菌剂波尔多液
C.铝壶内的水垢用质量分数为18%的热盐酸长时间浸泡 D.校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 3、下列对金属及金属资源的认识中,正确的是................................ 【】 A.废弃易拉罐无回收价值 B.赤铁矿的主要成分是Fez。, C.生铁是纯净的铁 D.用水冲洗自行车可防止生锈 4、垃圾时放错了位置的资源,该分类回收,生活中废弃的铁锅,铝 制易拉罐、铜导线等可以归为一类加以回收,它们属于【】 A.氧化物 B.化合物 C.金属或合金 D. 非金属 5、下表中列出了几种物质的熔点,据此判断以下说法正确的是................ 【】 A.铜写金可熔合成合金 B.在—216°C时,氧气是固态 C.铜掉入铁水中不会熔化 D.水银温度计可测量-
课题1 金属材料九年级化学下册(人教版)
课题1 金属材料 一、教学目标 1.通过日常生活中广泛使用金属材料等具体事例,认识金属材料与人类生活和社会发展的密切关系。 2.了解常见金属的物理性质,知道物质的性质在很大程度上决定了物质的用途,但同时还需考虑如价格、资源以及废料是否易于回收等其他因素。 3.认识在金属中加热熔合某些金属或非金属可以制得合金,知道生铁和钢等重要合金,以及合金比纯金属具有更广泛的用途。 二、教学重难点 重点:认识金属物理性质的相似性和差异性及性质与用途的关系。 难点:学习运用比较、分析、归纳等方法对获取的信息进行加工。 三、教学过程 【问题引入】我们知道做饭时食物变熟,需要能源提供的热量。从图片中你还可以看到哪些共同点?做饭时同样需要炊具。 【交流讨论】炊具一般是由金属材料制成的,说一说你身边的金属制品。 【图片展示】各种金属制品。 【过渡】我们身边的很多生活用品,如锅、壶、水龙头等很多都是用金属材料制成的。人类使用的金属材料包括纯金属以及它们的合金。你知道金属材料的发展历程是怎么的吗? 【讲解】在历史发展过程中,人类从石器时代进入青铜器时代,继而进入铁器时代。到了铁器时代,铁和钢的使用就比较广泛了。在100多年前,人们又发现和利用了铝。而铜、铁、铝是现代社会应用的最多的三种金属材料。 【交流讨论】金属材料的应用促进了社会的发展。而这些金属的广泛应用都与它们的性质有很大的联系。结合实际生活,及图片中金属的用途,说一说金属都有哪些物理性质。 【总结】金属一般具有以下性质: 1.金属一般是银白色的,有金属光泽。(金为黄色、铜为紫红色) 2.金属一般为固体。(汞是液体) 3.金属一般易导电、传热。
新人教版九年级下册化学[金属及金属的化学性质(提高) 知识点整理及重点题型梳理]
新人教版九年级下册初中化学 重难点突破 知识点梳理及重点题型巩固练习 金属及金属的化学性质(提高) 【学习目标】 1.知道常见金属的物理性质、特性及其应用;知道生铁和钢等重要合金。 2.掌握铁、铝等常见金属与氧气的反应;掌握常见金属与盐酸、稀硫酸的置换反应,以及与化合物的溶液的反应。 3.掌握金属的活动性顺序;能用金属的活动性顺序对有关的置换反应进行简单的判断。 【要点梳理】 要点一、金属材料 金属材料包括纯金属和它们的合金。 1.几种常见的金属 (1)常见的重要金属:铁铝铜锌钛锡金银等。 (2)金属有许多共同的性质,如:①金属光泽;②良好导电性、导热性;③良好的延性、展性;④韧性好、能弯曲。 2.常见金属的特性 (1)颜色:大多为银白色,铜呈紫红色、金呈黄色; (2)状态:常温下大多为固体,汞为液体; (3)密度差别很大:金为19.3g/cm3,铝为2.7 g/cm3; (4)导电性差异很大:银为100,铅仅为7.9; (5)熔点差别大:钨为3410℃,锡仅为232℃; (6)硬度差别大:铬为9,铅仅为1.5。 3.一些金属物理性质的比较
4.合金知识 (1)合金:是由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。合金是混合物,合金中至少含有一种金属。 (2)生铁(含碳量为2%~4.3%)和钢(含碳量为0.03%~2%)都是铁合金。因含碳量不同合金的性能不同,含碳量越大,硬度越大;含碳量越低,韧性越好。 (3)黄铜、青铜、焊锡、硬铝、18K黄金、18K白金、钛合金等也是常见的合金。 (4)合金的性能与组成合金的各成分的性能不同。合金的硬度比组成它们的纯金属的硬度大,合金的熔点比组成它们的纯金属的熔点低。 【要点诠释】 1.金属的用途要从不同金属的各自不同的性质以及价格、资源、美观、便利、回收等各方面考虑。如银的导电性比铜好,但电线一般用铜制而不用银制。因为铜的密度比银的密度小,价格比银低很多,资源比银丰富得多。 2.合金的硬度、强度、抗腐蚀性等一般都好于组成它们的纯金属。 要点二、金属活动性顺序(《金属的化学性质》三) 常见金属的活动性顺序如下: 【要点诠释】 1.在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。 2.在金属活动性顺序里,位于氢前面金属可以置换出盐酸、稀硫酸中的氢。且金属的位置越靠前,它与酸反应的速率就越大。 3.在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)。 要点三、置换反应 置换反应是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。如:Mg+2HCl=MgCl2+H2↑ Fe+H2SO4=FeSO4+ H2↑ Fe+CuSO4=FeSO4+Cu Cu+2AgNO3=2Ag+Cu(NO3)2 【要点诠释】 1.置换反应可以表示为:A+BC=AC+B
人教版九年级化学下册金属和金属材料专题练习
金属和金属材料专题练习 可能用到的相对原子质量:H-1 O-16 Mg-24 Al-27 S-32 Fe-56 Cu-64 Zn-65 一、选择题(每小题只有一个正确选项) 1.收藏家收藏的清末铝制品,至今保存十分完好,该艺术品不易生锈的主要原因是()。 A.铝不易被氧化 B.铝不易发生化学反应 C.铝表面致密的氧化膜阻止铝进一步被氧化 D.铝表面的氧化物易发生还原反应 2.某金属R能与硫酸铜溶液发生置换反应但不能跟氯化锌溶液发生反应。关于R、铜、锌的金属活动性由强到弱排列正确的是()。 A.Zn、R、Cu B.Zn、Cu、R C.R、Zn、Cu D.Cu、R、Zn 3.下列各种“铁”中,最容易生锈的是()。 A.表面喷有漆的铁 B.装液态氮气的铁容器 C.潮湿空气中的铁管 D.浸没在机油中的铁制零件 4.下列成语所描述的过程,从化学的角度理解正确的是()。 A.釜底抽薪:木柴燃烧必须达到着火点 B.真金不怕火炼:金的化学性质稳定 C.铁杵磨成针:主要发生了化学变化 D.百炼成钢:只发生了物理变化 5.下列事实不能说明锌比银活泼的是()。 A.Zn能与AgNO3溶液反应,置换出Ag B.Zn能与稀硫酸反应,Ag则不能 C.自然界没有以单质形式存在的Zn,而有以单质形式存在的Ag D.Zn的熔点为420℃,Ag的熔点为962℃ 6.有X、Y、Z三种金属,它们之间能够发生如下反应:Y+X(NO3)2==X+Y(NO3)2,X+Z(NO3)2==Z+X(NO3)2。则X、Y、Z三种金属的活动性由强到弱的顺序是()。 A.Z>Y=X B.X
(完整版)九年级化学金属专题训练
金属与盐溶液反应的先后次序(判断滤液和滤渣成分)问题: 例1:锌、铁、铜组成的混合物投入到硝酸银溶液中,谁先反应? 例2:锌投入到硝酸银和硝酸铜混合溶液中,谁先反应? 练习: 1、向硝酸银、硝酸铜、硝酸镁的混合溶液中加入一些铁粉,待完全反应后,再过滤。下列情况不可能的是( ) A、滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+; B、滤纸上有Ag、 Cu,滤液中有Ag+、Fe2+、Mg2+; C、滤纸上有Ag、 Cu,滤液中有Fe2+、Mg2+; D、滤纸上有Ag、 Cu、Fe,滤液中有Fe2+、Mg2+。 2、往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是() A、滤渣中一定有铁粉 B、滤渣中一定有铜粉 C、滤液中一定有Fe2+ D、滤液中一定有Ag+、Cu2+ 3、把一些Zn粉放入Fe(NO3)2和AgNO3的混合溶液中,完全反应后过滤,向滤渣中加入稀盐酸有气体产生。根据 以上现象得出的正确结论是() A、滤渣中一定有Zn、Fe、Ag B、滤渣中一定有Fe、Ag ,可能有Zn C、滤渣中一定有Zn、Fe,可能有Ag D、滤渣中一定有Ag,可能有Zn、Fe 4、向硫酸亚铁、硫酸铜的混合溶液中加入一些锌粉,充分反应后过滤,得到固体不溶物A和溶液。将A放入少量稀硫酸中,有气体产生。则A中一定含有,可能含有;溶液中一定含有的溶质是。 5、在硫酸铜溶液中加入一定量的锌和铁的混合物,充分反应后得到一些固体,过滤,向固体中加入少量稀盐酸,有气体放出。对上述固体的叙述正确的是() ①一定含有锌;②一定含有铁;③一定含有铜;④可能含有锌;⑤可能含有铁;⑥可能含有铜; A、③④⑤ B、②③④ C、①②③ D、①②⑥ 6、向氧化铜和铁粉的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,向滤液中插入一块铁片,只有气泡产生.则以下判断正确的是( ) A.不溶物中一定含有铁 B.滤液中一定含有硫酸铜C.不溶物可能含有氧化铜 D.滤液一定含有硫酸亚铁、硫 酸 7、某同学将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到固体和蓝色滤液,并对滤液的组成进行探究。 ⑴锌和硝酸银溶液反应的化学方程式是。 ⑵同学们对滤液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是: ①溶质为;②溶质为。 ⑶请你设计两种实验方案来验证以上猜想。 方案实验操作实验现象结论 方案一如果猜想成立 方案二如果猜想成立 金属与酸反应的图像问题: 练习1、将质量相等的A、B两种金属,同时分别放入两份质量分数相同且足量的稀 盐酸中,反应生成H2的质量与反应时间的关系如图所示。根据图中所提供的信息,写出 能从中得到的正确结论。(已知:A、B的生成物中均为+2价) (1)生成H2的质量:A B (2)相对原子质量:A B(3)反应速率:A B (4)在金属活动性顺序里,A、B均排在。 2、等质量的A、B、C三种金属跟足量的稀硫酸完全反应后都生成+2价的硫酸盐, 生成氢气的质量(m)与反应时间(t)的关系如图所示,则下列说法中正确的是() A、三种金属的活动性是A>B>C B、三种金属的相对原子质量是A<B<C C、反应消耗硫酸的质量相同 D、反应速度最慢的是C,最快是A 3、用质量相等的锌粉和铁粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应, 产生H2的质量和反应所用的时间关系如图所示。则下列说法中不正确的是() A、曲线a、b分别表示锌、铁的反应情况 B、盐酸均反应完,锌、铁有剩余
