原电池基础知识及同步练习附复习资料

原电池
【知识回顾】
【知识点1】原电池的构成和工作原理
1.定义:原电池——将化学能转化为电能的装置
2.构成:
①两个活泼性不同的两极
②电解质溶液:电极必与电解质溶液接触。
③形成闭合回路:电极相互接触或连接。
④能发生自发的氧化还原反应
3.工作原理:较活泼的金属失去电子,发生氧化反应,电子沿导线流向较不活泼的金属,在不活泼的金属上得到电子,发生还原反应。
【知识点2】电池正负极和正负极判断
正极:符号“+”,得到电子,发生
负极:符号“-”,失去电子,发生
①据组成原电池的两极材料判断
负极——较活泼的金属为,
正极——较不活泼的金属或能导电的非金属。
②据电流方向或电子流动方向判断
外电路:正极流向负极,电子:由负极流向正极。
③据电解质溶液里离子的定向移动方向判断
电解质溶液:阳离子移向正极,阴离子移向负极。
④据两极发生的反应判断
负极:氧化反应,正极:还原反应。
⑤据反应的现象判断
⑥据原电池总反应方程式判断
负极:失电子作还原剂,正极:得电子作氧化剂
⑦据向电极上通入的气体判断
燃料电池:负极:可燃性气体,正极:助燃性气体。
【知识点3】原电池的应用
1.加快氧化还原反应的速率
2.比较金属活动性强弱
3.用于金属的防护
4.设计电池
5.探究金属腐蚀的快慢规律
【考点1】:原电池的构成
1.在下图所示的装置中,能够发生原电池反应的是()
【考点2】原电池的工作原理
1.原电池的反应实质是。写出铜锌原电池(稀硫酸为介质)的电极反应:
负极,
正极。
2.关于原电池的说法中正确的是:
A.原电池中的电极一定要由两种不同的金属组成
B.流出电子的一极是正极
C.两极均发生氧化反应
D.原电池中的阳离子向正极移动3.将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是()
A、两烧杯中铜片表面均无气泡产生
B、甲中铜片是正极,乙中铜片是负极
C、两烧杯中溶液的pH均增大
D、产生气泡的速度甲比乙慢
4.右图所示的原电池装置,观察到由电流表指针有明显偏转,下列说法中不正确
...的是
A.原电池装置能将化学能转变为电能
B.原电池的反应本质是氧化还原反应
C.锌失去电子发生还原反应,电子沿导线流向铜
D.铜片表面产生大量气泡
5.下列关于原电池的说法不正确的是
A.①②装置都能将化学能转化为电能
B.②中的硫酸根离子向负极移动
C.②中的电子由Zn流向Cu
D.②中电流的方向是由正极到负极
7.下列说法不正确
...的是
A.原电池负极被氧化B.任何化学反应都能设计成原电池
C.原电池是一种将化学能转化为电能的装置
D.原电池要使氧化反应和还原反应分别在两个不同的区域进行并形成电流
8.下面是某同学设计的四种原电池,其中铁片上逐渐析出铜的是( ) 负极正极电解质溶液
(A) Fe Cu CuSO4
(B) Zn Fe CuSO4
(C) Fe Cu H2SO4
(D) Fe Cu FeCl3 【考点3】原电池的应用
1.有A、B、C、D四种金属。将A与B用导线连接起来浸入电解质溶液中,B不易腐蚀,将A、D分别投入等浓度的盐酸中,D比A反应剧烈,将铜浸入B的盐溶液中,无明显化,若将铜浸入C的盐溶液中,有金属C析出。据此判断这四种金属的活动性由强到弱的顺序是
A.D>C>A>B B.D>A>B>C
C.D>B>A>C D.B>A>D>C
2.实验室欲制氢气,所用稀盐酸和稀硫酸的浓度相同,反应速率最快的是( )
A.纯锌与稀硫酸反应B.纯锌和浓硫酸反应
C.纯锌与稀盐酸反应
D.粗锌(含铅、铜杂质)与稀硫酸反应
【考点4】原电池的设计
21.(5分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+=2Ag+Cu2+”设计一个化学电池,并回答下列问题:
(1)该电池的正极材料是___,负极材料是___,电解质溶液是_____。
(2)在外电路中,电子流动方向是_______。(3)电解质溶液中,阳离子向_______极移动。【课堂练习】
1.对于锌、铜和稀硫酸组成的原电池,下列有关说法不.
正确
..的是()
A.Zn是负极 B.负极上发生氧化反应
C.负极发生的反应是 Zn - 2e- == +2
Zn
D.正极发生的反应是+2
Cu+ 2e- == Cu
2.下列装置能够组成原电池,产生电流的是
3.下列叙述中,不正确
...的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片和银片连接后浸入AgNO3溶液中,结果在银片表面出现一层银
C.铜片、锌片和稀硫酸形成的原电池中,溶液中的H+ 向负极移动
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,放出气泡的速率加快
4.某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,可以实现上述反应的原电池是()
正极负极电解质溶液
A Cu Fe Fe2(SO4)3
B Sn Fe FeCl2
C Ag Fe CuSO4
D Fe Zn Fe2(SO4)3
5.有些化学反应的化学能能直接转化成电能
I.利用Fe + CuSO4 = FeSO4 + Cu反应,设计一个原电池:(1)在右框中画出装置图(标明电解质溶液、正、负极和电极材料)
(2)下列说法中,正确的是。(填字母)
A.电解质溶液中阳离子向负极移动
B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1 mol电子通过
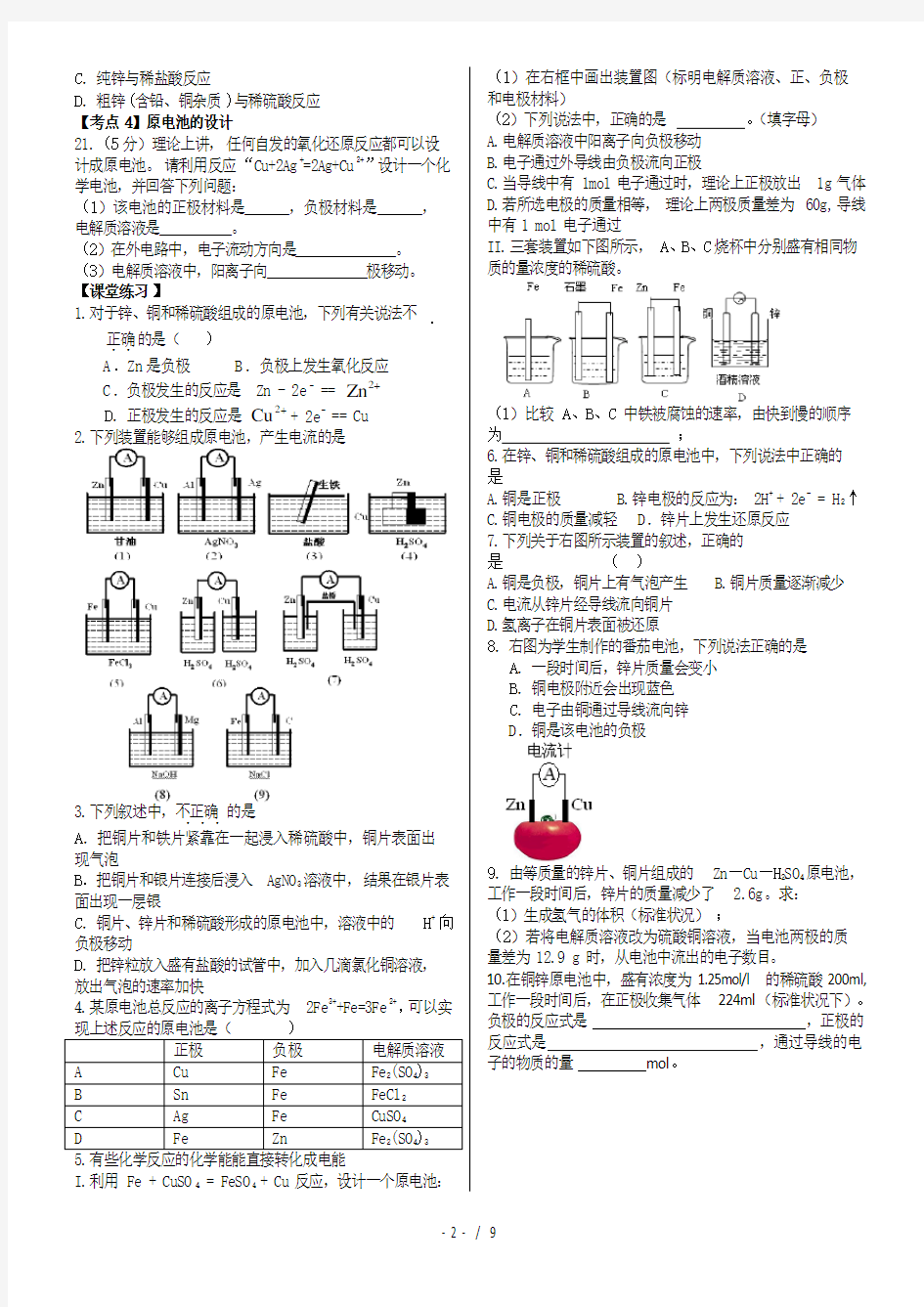
II.三套装置如下图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为;
6.在锌、铜和稀硫酸组成的原电池中,下列说法中正确的是
A.铜是正极
B.锌电极的反应为:2H+ + 2e- = H2↑
C.铜电极的质量减轻 D.锌片上发生还原反应
7.下列关于右图所示装置的叙述,正确的
是()
A.铜是负极,铜片上有气泡产生
B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
8.右图为学生制作的番茄电池,下列说法正确的是A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.铜是该电池的负极
9.由等质量的锌片、铜片组成的Zn—Cu—H2SO4原电池,工作一段时间后,锌片的质量减少了2.6g。求:
(1)生成氢气的体积(标准状况);
(2)若将电解质溶液改为硫酸铜溶液,当电池两极的质量差为12.9 g时,从电池中流出的电子数目。
10.在铜锌原电池中,盛有浓度为1.25mol/l 的稀硫酸200ml,工作一段时间后,在正极收集气体224ml(标准状况下)。负极的反应式是,正极的反应式是,通过导线的电子的物质的量mol。
原电池同步训练
一、选择题(本题包括10小题,每小题5分,共50分)
1.为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现电流计指针偏转.
下列关于以上实验设计及现象的分析,不.正确的是()
A.实验①、②说明锌能与稀硫酸反应而铜不能
B.实验③说明发生原电池反应时会加快化学反应速率
C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气
D.实验③、④说明该原电池中铜为正极、锌为负极
2.原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是() A.由Fe、Cu和FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-===Cu2+
B.由Al、Cu和稀硫酸组成的原电池中,负极反应式为:Cu-2e-===Cu2+
C.由Al、Mg和NaOH溶液组成的原电池中,负极反应式为:Al+4OH--3e-===AlO-2+2H2O
D.由Al、Cu和浓HNO3溶液组成的原电池中,负极反应式为:Al-3e-===Al3+
3.研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是() A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
4.世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最.下列有关叙述正确的是()
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
5.根据下图,可判断出下列离子方程式中错误的是()
A .2Ag(s)+Cd 2+
(aq)===2Ag +
(aq)+Cd(s) B .Co 2+
(aq)+Cd(s)===Co(s)+Cd 2+
(aq) C .2Ag +
(aq)+Cd(s)===2Ag(s)+Cd 2+
(aq) D .2Ag +
(aq)+Co(s)===2Ag(s)+Co 2+
(aq) 6.下列有关电化学知识的描述正确的是( )
A .CaO +H 2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B .某原电池反应为Cu +2AgNO 3===Cu(NO 3)2+2Ag ,装置中的盐桥中可以是装有含琼胶的KCl 饱和溶液
C .因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极
D .理论上说,任何能自发进行的氧化还原反应都可设计成原电池
7.(2011·汕头模拟)镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为
x Mg +Mo 3S 4垐垎?噲垐?放电充电
Mg x Mo 3S 4;在镁原电池放电时,下列说法错误的是( )
A .Mg 2+向正极迁移
B .正极反应为:Mo 3S 4+2x e -===Mo 3S 2x -
4
C .Mo 3S 4发生氧化反应
D .负极反应为:x Mg -2x e -===x Mg 2+
8结合图B -1判断,下列叙述正确的是( )
图B -1
A .Ⅰ和Ⅱ中正极均被保护
B .Ⅰ和Ⅱ中负极反应均是Fe -2e -===Fe 2+
C .Ⅰ和Ⅱ中正极反应均是O 2+2H 2O +4e -===4OH -
D .Ⅰ和Ⅱ中分别加入少量K 3[Fe(CN)6]溶液,均有蓝色沉淀
9.上海世博会期间,氢氧燃料电池车进入世博园,园区内实现了公共交通“二氧化碳零排放”.下列说法中正确的是( )
A .CH 4燃料电池车也能实现“二氧化碳零排放”
B .燃料电池正极发生氧化反应
C .通入氢气的一极为燃料电池的负极
D .氢氧燃料电池把H 2和O 2燃烧放出的热能转化为电能
10.高功率Ni/MH(M 表示储氢合金)电池已经用于混合动力汽车.总反应方程式如下:Ni(OH)2+M 垐垎?噲垐?放电充电
NiOOH
+MH ,下列叙述正确的是( )
A .放电时正极附近溶液的碱性增强
B .放电时负极反应为:M +H 2O +e -
===MH +OH -
C .充电时阳极反应为:NiOOH +H 2O +e -
===Ni(OH)2+OH -
D .放电时每转移1 mol 电子,正极有1 mol NiOOH 被氧化
11.研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH 为
电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A .水既是氧化剂又是溶剂
B .放电时正极上有氢气生成
C .放电时OH -
向正极移动 D .总反应为:2Li +2H 2O===2LiOH +H 2↑ 12.某小组为研究电化学原理,设计如图装置。下列叙述不正确...
的是( ) A .a 和b 不连接时,铁片上会有金属铜析出
B .a 和b 用导线连接时,铜片上发生的反应为:Cu 2++2e -
===Cu
C .无论a 和b 是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
D .a 和b 分别连接直流电源正、负极,电压足够大时,Cu 2+
向铜电极移动 13.根据右图,下列判断中正确的是( ) A .烧杯a 中的溶液pH 升高 B .烧杯b 中发生氧化反应
C .烧杯a 中发生的反应为2H ++2e -
===H 2
D .烧杯b 中发生的反应为2Cl --2e -
===Cl 2
14. 铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe +Ni 2O 3+3H 2O =Fe(OH)2+2Ni(OH)2 下列有关该电池的说法不正确...
的是( ) A .电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe
B .电池放电时,负极反应为Fe +2OH --2e -
=Fe(OH)2 C .电池充电过程中,阴极附近溶液的pH 降低
D .电池充电时,阳极反应为2Ni(OH)2+2OH --2e -
=Ni 2O 3+3H 2O
15.以KCl 和ZnCl 2混合液为电镀液在铁制品上镀锌,下列说法正确的是( ) A .未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 B .因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 C. 电镀时保持电流恒定,升高温度不改变电解反应速率 D .镀锌层破损后即对铁制品失去保护作用 二、非选择题(共50分)
16.[2011·山东卷] 科研、生产中常涉及钠、硫及其化合物。 (1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程
式为________________________。要清洗附着在试管壁上的硫,可用的
图1-15
试剂是________。
(2)如图1-15所示的为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na +x S =Na 2S x ,正极的电极反应式为________。M(由Na 2O 和Al 2O 3制得)的两个作用是________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)Na 2S 溶液中离子浓度由大到小的顺序为________________,向该溶液中加入少量固体CuSO 4,溶液pH________(填“增大”“减小”或“不变”)。Na 2S 溶液长期放置有硫析出,原因为________________________(用离子方程式表示)。 17.((1)氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列有关说法不.
正确的是________. A .太阳光催化分解水制氢气比电解水气氢气更为科学 B .氢氧燃料电池作为汽车动力更能保护环境
C .以稀H 2SO 4、KOH 为介质的氢氧燃料电池的负极电极反应式相同
D .以稀H 2SO 4、KOH 为介质的氢氧燃料电池的总反应式相同
(2)纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:3Zn
+2K 2FeO 4+8H 2O 垐垎?噲垐?放电充电
3Zn(OH)2+2Fe(OH)3+4KOH.
①该电池放电时负极反应式为_________________.
②放电时每转移3 mol 电子,正极有________ mol K 2FeO 4被还原.
(3)锰酸锂离子电池在混合动力车等大型蓄电池应用领域占据主导地位.电池反
应式为:Li 1-x MnO 4+Li x 垐垎?噲垐?放电充电
LiMnO 4,下列有关说法不.
正确的是________. A .放电时电池的正极反应式为:Li 1-x MnO 4+x Li ++x e -
===LiMnO 4 B .放电过程中,石墨没有得失电子
C .该电池也能在KOH 溶液的环境中正常工作
D .充电时电池上标有“-”的电极应与外接电源的负极相连
18.某兴趣小组同学利用氧化还原反应:2KMnO 4+10FeSO 4+8H 2SO 4===2MnSO 4+5Fe 2(SO 4)3+K 2SO 4+8H 2O 设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L -
1,盐桥中装有饱和K 2SO 4溶液.回答下列问题:
(1)发生氧化反应的烧杯是________(填“甲”或“乙”). (2)外电路的电流方向为:从________到________.(填“a”或“b”)
(3)电池工作时,盐桥中的SO 2-
4移向________(填“甲”或“乙”)烧杯.
(4)甲烧杯中发生的电极反应为______________________________________________.
19.(2011·东北高三联考)锌银电池比能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器.电解质溶液是KOH 溶液,电池总反应为Zn +Ag 2O===ZnO +2Ag.请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为____________.
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为 ZnO +C=====高温
Zn +CO ↑,此法为________. A .电解法 B .热还原法 C .热分解法 ②电极材料氧化银可回收利用得到银,其化学方程式为________________________.
(3)可用石墨作电极电解提纯氢氧化钾电解液.电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示. ①该电解池的阴极反应式为______________.
②除去杂质后的氢氧化钾溶液从出口________(填“A”或“B”)导出.
③在相同条件下,a 处与b 处产生的气体体积比为______________________.
20.[2011·四川卷] 开发氢能是实现社会可持续发展的需要。硫铁矿(FeS 2)燃烧产生的SO 2通过下列碘循环工艺过程既能制H 2SO 4,又能制H 2。
请回答下列问题:
(1)已知1 g FeS 2完全燃烧放出7.1 kJ 热量,FeS 2燃烧反应的热化学方程式为______________________。 (2)该循环工艺过程的总反应方程式为______________________。
(3)用化学平衡移动的原理分析,在HI 分解反应中使用膜反应器分离出H 2的目的是______________________。 (4)用吸收H 2后的稀土储氢合金作为电池负极材料(用MH 表示),NiO(OH)作为电池正极材料,KOH 溶液作为电解质溶液,可制得高容量,长寿命的镍氢电池。电池充放电时的总反应为:
NiO(OH)+MH
放电充电
Ni(OH)2+M
①电池放电时,负极的电极反应式为________________________。
②充电完成时,Ni(OH)2全部转化为NiO(OH)。若继续充电将在一个电极产生O 2,O 2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极的电极反应式为________________________。
原电池同步训练答案
一、选择题(本题包括10小题,每小题5分,共50分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C C B A A
D C A C A C D AB C C
323222
(2)x S+2e-===S2-x(或2Na++x S+2e-===Na2S x)
离子导电(导电或电解质)和隔离钠与硫 4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)减小
2S2-+O2+2H2O===2S↓+4OH-
【解析】(2)负极发生氧化反应:2Na-2e-=2Na+,正极发生还原反应:x S+2e-=S2-x。在铅蓄电池中,铅作负极,
当铅蓄电池消耗a g Pb时转移电子的物质的量为2a
207mol,而钠硫电池消耗a g Na时转移电子的物质的量为a
23mol,故钠硫电池的理论放电量是铅蓄电池的4.5倍。
(3)Na2S溶液中存在水解平衡:S2-+H2O HS-+OH-和HS-+H2O H2S+OH-,故溶液中离子浓度的大小顺序为c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。当加入CuSO4时,Cu2+与S2-结合成CuS沉淀,使上述两个平衡均向左移动,使溶液中c(OH-)减小,溶液pH减小。而Na2S溶液长期放置有硫析出,则是由于S2-被空气中的氧气氧化所致。
17.解析:(1)选项A,电解获得H2消耗较多的能量,而在催化剂作用下利用太阳能来分解H2O获得H2更为科学.选项B,氢氧燃料电池中生成物为H2O,对环境无污染.选项C,以稀H2SO4为介质的电池负极反应式为:H2-2e-===2H +,以KOH为介质的电池负极反应式为H2+2OH--2e-===2H2O..选项D,氢氧燃料电池的总反应式均为:2H2+O2===2H2O.
(2)①放电时,在碱性条件下,负极反应式为:Zn-2e-+2OH-===Zn(OH)2.
②根据电池总反应式可知,2 mol K2FeO4被还原时有6 mol电子转移,所以放电时每转移3 mol电子,有1 mol K2FeO4被还原.
(3)选项A,根据总反应式可知Li失去电子,电池负极反应式为:x Li-x e-===x Li+,由总反应式减去负极反应式可得放电时的正极反应式为Li1-x MnO4+x Li++x e-===LiMnO4.选项B,根据总反应式可判断石墨没有得失电子.选项C,Li能与KOH溶液中的H2O反应,导致电池无法正常工作.选项D,充电过程是放电的逆向过程,外界电源的负极提供的电子使原电池负极获得电子发生还原反应,所以标有“-”的电极应与外接电源的负极相连.答案:(1)C(2)①Zn-2e-+2OH-===Zn(OH)2②1(3)C
18.解析:根据氧化还原反应可知:甲烧杯中石墨作正极,发生还原反应,电极反应为:MnO4+8H++5e-===Mn2++4H2O;乙烧杯中石墨作负极,发生氧化反应,电极反应为Fe2+-e-===Fe3+,外电路电流方向从正极流向负极,即从a 到b.电池工作时,盐桥中的阴离子移向负极,阳离子移向正极,即SO2-4移向乙烧杯.
答案:(1)乙(2)a b(3)乙
(4)MnO -4+8H ++5e -===Mn 2+
+4H 2O
19.解析:(1)依据电池总反应式:Zn +Ag 2O===ZnO +2Ag ,锌为活泼金属,故锌为负极,电极反应式为:Zn -2e
-
+2OH -
===ZnO +H 2O ;Ag 2O 为正极;电池工作时,阳离子向正极移动.(2)①化学反应方程式为ZnO +C=====高温
Zn +CO ↑,说明碳还原氧化锌,故此法为热还原法,选B.②氧化银不稳定,受热会分解得到银,其化学方程式为2Ag 2O=====△
4Ag +O 2↑.
(3)①电解池的阴极是H +
放电,故电极反应式为2H +
+2e -
===H 2↑;②除去杂质后的氢氧化钾溶液从出口B 导出;③a 为电解池的阳极,放出的是氧气,b 为电解池的阴极,放出的是氢气,总反应方程式为:2H 2O=====电解
2H 2↑+ O 2↑,所以相同条件下a 处与b 处产生的气体体积比为1∶2. 答案:(1)Ag 2O 正极 Zn -2e -
+2OH -
===ZnO +H 2O (2)①B ②2Ag 2O=====△
4Ag +O 2↑ (3)①2H +
+2e -
===H 2↑ ②B ③1∶2
20. (1)4FeS 2(s)+11O 2(g)=====高温
2Fe 2O 3(s)+8SO 2(g);ΔH =-3408 kJ/mol
(2)2H 2O +SO 2===H 2SO 4+H 2
(3)减小H 2浓度,使HI 分解平衡正向移动,提高HI 的分解率
(4)①MH +OH --e -
===M +H 2O
②2H 2O +O 2+4e -===4OH -
【解析】 该工艺过程的原理是:①SO 2+I 2+2H 2O===H 2SO 4+2HI ,②2HI H 2+I 2。则总反应式为①+②,即2H 2O +SO 2===H 2SO 4+H 2。(4)①蓄电池放电时是原电池、充电时是电解池。只要记清原电池中“负氧化、正还原”,电解池中“阳氧化、阴还原”的规律,在写电极反应式时先弄清楚是原电池还是电解池,然后将给出的总反应拆成氧化反应和还原反应两个半反应按需选取即可。②中阴极的电极反应有两个,第一阶段是充电时的反应式,由①中的方法不难确定
为M +H 2O +e -===MH +OH -
,第二阶段为吸收氧气的电解反应式,由题意氧气在阴极被还原,结合该蓄电池中电解质
溶液显碱性可知氧气被还原为OH -,所以其电极方程式为:2H 2O +O 2+4e -===4OH -
。
材料科学基础简答题(doc 12页)
简答题 第一章材料结构的基本知识 1、说明结构转变的热力学条件与动力学条件的意义。 答:结构转变的热力学条件决定转变是否可行,是结构转变的推动力,是转变的必要条件;动力学条件决定转变速度的大小,反映转变过程中阻力的大小。 2、说明稳态结构与亚稳态结构之间的关系。 答:稳态结构与亚稳态结构之间的关系:两种状态都是物质存在的状态,材料得到的结构是稳态或亚稳态,取决于转交过程的推动力和阻力(即热力学条件和动力学条件),阻力小时得到稳态结构,阻力很大时则得到亚稳态结构。稳态结构能量最低,热力学上最稳定,亚稳态结构能量高,热力学上不稳定,但向稳定结构转变速度慢,能保持相对稳定甚至长期存在。但在一定条件下,亚稳态结构向稳态结构转变。 3、说明离子键、共价键、分子键和金属键的特点。 答:离子键、共价键、分子键和金属键都是指固体中原子(离子或分子)间结合方式或作用力。离子键是由电离能很小、易失去电子的金属原子与电子亲合能大的非金属原于相互作用时,产生电子得失而形成的离子固体的结合方式。 共价键是由相邻原子共有其价电子来获得稳态电子结构的结合方式。 分子键是由分子(或原子)中电荷的极化现象所产生的弱引力结合的结合方式。 当大量金属原子的价电子脱离所属原子而形成自由电子时,由金属的正离子与自由电子间的静电引力使金属原子结合起来的方式为金属键。 第二章材料的晶体结构 1、在一个立方晶胞中确定6个表面面心位置的坐标。6个面心构成一个正八面体,指出这个八面体各个表面的晶面指数、各个棱边和对角线的晶向指数。
解八面体中的晶面和晶向指数如图所示。图中A、B、C、D、E、F为立方晶胞中6个表面的面心,由它们构成的正八面体其表面和棱边两两互相平行。 ABF面平行CDE面,其晶面指数为; ABE面平行CDF面,其晶面指数为; ADF面平行BCE面,其晶面指数为; ADE面平行BCF面,其晶面指数为(111)。 棱边,,,,, ,其晶向指数分别为[110],,[011],,[101]。 对角线分别为,其晶向指数分别为[100],[010],[001] 图八面体中的晶面和晶向指数 2、标出图中ABCD面的晶面指数,并标出AB、BC、AC、BD线的晶向指数。 解:晶面指数: ABCD面在三个坐标轴上的截距分别为3/2a,3a,a, 截距倒数比为 ABCD面的晶面指数为(213) 晶向指数: AB的晶向指数:A、B两点的坐标为 A(0,0,1),B(0,1,2/3) (以a为单位) 则,化简即得AB的晶向指数 同理:BC、AC、BD线的晶向指数分别为,,。
法律基础知识试题及答案(打印版)
法律基础知识试题及答案 一、单项选择题(在每小题的四个备选答案中,选出一个正确答案,并将正确答案的序号填在 题中的括号内。每小题1分,共30分) 1.按照制定和实施法律的主体不同,可以把法律划分为( )。 A.根本法和普通法 B.一般法和特别法 C.国内法和国际法 D.实体法和程序法 2.我国依法治国的主体是( )。 A.党中央 B.国务院 C.广大人民群众 D.全国人民代表大会 3.外国人在我国领域内,( )适用我国法律。A.一律 B.一般 C.可以 D.不 4.法律( )是划分部门法的首要的、第一位标准。 A.调整的社会关系的种类 B.调整的方法 C.保障权利的途径 D.调整的机制 5.我国第一部社会主义类型的宪法是( )年制定的宪法。 A.1949 B.1950 C.1952 D.1954 6.( )是解决民族问题的基本政策,是一项符合我国国情的基本制度。 A.民族自治制度 B.区域自治制度 C.民族区域自治制度 D.民族平等制度 7.我国宪法规定,公民有受教育的( )。 A.权利 B.权力 C.义务 D.权利和义务 8.最高人民法院是我国的最高国家审判机关,( )地方各级人民法院和专门人民法院的审判工作。 A.领导 B.指导 C.监督 D.管理 9.行政法与行政法规的关系是( )。 A.行政法就是指行政法规 B.行政法是行政法规的渊源之一 C.行政法规是行政法的渊源之一 D.行政法与行政法规是效力不同的两种类别的规范性文件 10.私营企业是指企业资产属于私人所有,雇工达到( )人以上的营利性经济组织。 A.5 B.6 C.7 D.8 11.增值税属于( )。 A.流转税 B.财产税 C.所得税 D.营业税 12.我国森林法把每年( )定为全国统一的“植树节”。 A.3月5日 B.3月11日 C.3月12日 D.3月15日
材料科学基础期末试题
材料科学基础考题 I卷 一、名词解释(任选5题,每题4分,共20分) 单位位错;交滑移;滑移系;伪共晶;离异共晶;奥氏体;成分过冷答: 单位位错:柏氏矢量等于单位点阵矢量的位错称为单位位错。 交滑移:两个或多个滑移面沿着某个共同的滑移方向同时或交替滑移,称为交滑移。滑移系:一个滑移面和此面上的一个滑移方向合起来叫做一个滑移系。 伪共晶:在非平衡凝固条件下,某些亚共晶或过共晶成分的合金也能得全部的共晶组织,这种由非共晶成分的合金所得到的共晶组织称为伪共晶。 离异共晶:由于非平衡共晶体数量较少,通常共晶体中的a相依附于初生a相生长,将共晶体中另一相B推到最后凝固的晶界处,从而使共晶体两组成相相间的组织特征消失,这种两相分离的共晶体称为离异共晶。 奥氏体:碳原子溶于丫-Fe形成的固溶体。 成分过冷:在合金的凝固过程中,将界面前沿液体中的实际温度低于由溶质分布所决定的凝固温度时产生的过冷称为成分过冷。 二、选择题(每题2分,共20分) 1. 在体心立方结构中,柏氏矢量为a[110]的位错(A )分解为a/2[111]+a/2[l11]. (A)不能(B)能(C)可能 2. 原子扩散的驱动力是:(B ) (A)组元的浓度梯度(B)组元的化学势梯度(C)温度梯度 3?凝固的热力学条件为:(D ) (A)形核率(B)系统自由能增加 (C)能量守衡(D)过冷度 4?在TiO2中,当一部分Ti4+还原成Ti3+,为了平衡电荷就出现(A) (A)氧离子空位(B)钛离子空位(C)阳离子空位 5?在三元系浓度三角形中,凡成分位于( A )上的合金,它们含有另两个顶角所代表的两 组元含量相等。 (A)通过三角形顶角的中垂线 (B)通过三角形顶角的任一直线 (C)通过三角形顶角与对边成45°的直线 6?有效分配系数k e表示液相的混合程度,其值范围是(B ) (A)1vk e 百度文库专用 法律基础知识试题及答案 第一部分选择题(共50分) 一、单项选择题(本大题共30小题,每小题1分,共30分)在每小题列出的四个备选项中只有一个是符合题目要求的,请将其代码填写在题后的括号内。错选、多选或未选均无分。1按照规定的内容、法律地位和制定的程序不同,法律可以划分为根本法和普通法。其中,根本法又称 A宪法B民法 C刑法D行政法【】 2有关国家机关按照法定程序,对一定时期和范围的规范性法律文件进行审查并重新确定其法律效力的活动,称为 A法律编纂B法律制定 C法律整理D法律汇编【】 3对于违法犯罪行为的制裁和惩罚,体现了法律的 A评价作用B教育作用 C强制作用D指引作用【】 4下列选项中属于国务院职能范围的是 A修改宪法 B制定和修改基本法律 C批准省、自治区和直辖市的划分 D对国防、民政、文教、经济等各项工作的领导和管理【】 5《中华人民共和国宪法》规定,公民对国家工作人员的违法失职行为有权向国家机关提出申诉、控诉或者检举。这属于公民基本权利中的 A政治权利B监督权利 C社会经济权利D人身自由权利【】 6公民的下列违法行为中,属于违反了《中华人民共和国治安管理处罚条例》的是 A不遵守合同约定,长期拖欠房屋租金 B拒不赡养年迈、丧失劳动能力的父母 C故意损毁或者擅自移动路牌、交通标志 D为境外机构、人员非法提供国家秘密或情报【】 7根据《中华人民共和国行政处罚法》的规定,下列情况中,行为人不受行政处罚的是A受他人胁迫有违法行为的 B主动消除或减轻违法行为危害后果的 C配合行政机关查处违法行为有立功表现的 D违法行为轻微并及时纠正,没有造成危害后果的【】 原电池 编稿:宋杰审稿:张灿丽 【学习目标】 1、进一步了解原电池的工作原理; 2、能够写出原电池的电极反应式和原电池的总反应方程式。 【要点梳理】 要点一、原电池 1、概念:将化学能转化为电能的装置叫原电池。 【高清课堂:原电池#原电池的组成条件】 2、原电池的构成条件 ①两个活泼性不同的电极(材料可以是金属或导电的非金属),分别发生氧化和还原反应。 负极:活泼性强,失去电子发生氧化反应。 正极:活泼性弱,溶液中阳离子得到电子发生还原反应。 ②电解质溶液,电解质中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动形成内电路。 ③导线将两电极连接,形成闭合回路。 ④有能自发进行的氧化还原反应。 要点诠释:a.原电池中,电极材料可能与电解质反应,也可能与电解质不反应。如图: b.形成闭合回路的方式有多种,可以是用导线连接两个电极,也可以是两电极直接接触。如图: 要点二、原电池工作原理的实验探究 【高清课堂:原电池#原电池的工作原理】 1、实验设计 ①按照图示装置进行实验。请观察两个金属片插入溶液后电流表指针位置的变化、金属电极表面的变化以及溶液温度的变化,分析是否有电流产生。 ②按照下图组装实验装置,注意最后将盐桥插入两种电解质溶液中。请观察反应过程中电流表指针位置的变化,判断是否有电流产生,并观察电极表面以及溶液温度的变化情况。 要点诠释:盐桥的作用及优点 a.组成:将热的饱和KCl或NH4NO3琼胶溶液倒入U形管中(不能产生裂隙),即可得到盐桥。将冷却后的U形管浸泡在KCl饱和溶液或NH4NO3饱和溶液中备用。 b.作用:使两个半电池中的溶液连成一个通路。 c.优点:使原电池中的氧化剂和还原剂近乎完全隔离,并在不同区域之间实现了电子的定向移动,使原电池能持续、稳定地产生电流。 电流产生情况电极表面变化情况温度变化情况能量变化情况 (Ⅰ) 有电流产生锌片质量减小,同时铜片上有红色 物质析出,铜片质量增加溶液温度升高化学能转化为电能、 热能 (Ⅱ) 有电流产生锌片质量减小,铜片上有红色物质 析出,铜片质量增加 溶液温度不变化学能转化为电能 3、实验分析 ①对于图甲装置 Zn片:Zn-2e-=Zn2+ Cu片:Cu2++2e-=Cu 同时在Zn片上,Zn可直接与CuSO4溶液反应,生成Cu与ZnSO4,因此该装置中既有化学能转化为电能,同时也有化学能转化为热能。 ②对于图乙所示原电池 锌片:负极,Zn-2e-=Zn2+(氧化反应) 铜片:正极,Cu2++2e-=Cu(还原反应) 总化学方程式:Zn+Cu2+=Cu+Zn2+ 4、实验原理分析:(如图所示) 第一章原子排列 本章需掌握的内容: 材料的结合方式:共价键,离子键,金属键,范德瓦尔键,氢键;各种结合键的比较及工程材料结合键的特性; 晶体学基础:晶体的概念,晶体特性(晶体的棱角,均匀性,各向异性,对称性),晶体的应用 空间点阵:等同点,空间点阵,点阵平移矢量,初基胞,复杂晶胞,点阵参数。 晶系与布拉菲点阵:种晶系,14种布拉菲点阵的特点; 晶面、晶向指数:晶面指数的确定及晶面族,晶向指数的确定及晶向族,晶带及晶带定律六方晶系的四轴座标系的晶面、晶向指数确定。 典型纯金属的晶体结构:三种典型的金属晶体结构:fcc、bcc、hcp; 晶胞中原子数、原子半径,配位数与致密度,晶面间距、晶向夹角 晶体中原子堆垛方式,晶体结构中间隙。 了解其它金属的晶体结构:亚金属的晶体结构,镧系金属的晶体结构,同素异构性 了解其它类型的晶体结构:离子键晶体结构:MgO陶瓷及NaCl,共价键晶体结构:SiC陶瓷,As、Sb 非晶态结构:非晶体与晶体的区别,非晶态结构 分子相结构 1. 填空 1. fcc结构的密排方向是_______,密排面是______,密排面的堆垛顺序是_______致密度为___________配位数是________________晶胞中原子数为___________,把原子视为刚性球时,原子的半径是____________;bcc结构的密排方向是_______,密排面是_____________致密度为___________配位数是________________ 晶胞中原子数为___________,原子的半径是____________;hcp结构的密排方向是_______,密排面是______,密排面的堆垛顺序是_______,致密度为___________配位数是________________,晶胞中原子数为 ___________,原子的半径是____________。 2. bcc点阵晶面指数h+k+l=奇数时,其晶面间距公式是________________。 3. Al的点阵常数为0.4049nm,其结构原子体积是________________。 4. 在体心立方晶胞中,体心原子的坐标是_________________。 5. 在fcc晶胞中,八面体间隙中心的坐标是____________。 6. 空间点阵只可能有___________种,铝晶体属于_____________点阵。Al的晶体结构是__________________, -Fe的晶体结构是____________。Cu的晶体结构是_______________, 7点阵常数是指__________________________________________。 8图1是fcc结构的(-1,1,0 )面,其中AB和AC的晶向指数是__________,CD的晶向指数分别 是___________,AC所在晶面指数是--------------------。 原电池 【学习目标】 1、进一步了解原电池的工作原理; 2、能够写出原电池的电极反应式和原电池的总反应方程式。 【要点梳理】 要点一、原电池 1、概念:将化学能转化为电能的装置叫原电池。 2、原电池的构成条件 ①两个活泼性不同的电极(材料可以是金属或导电的非金属),分别发生氧化和还原反应。 负极:活泼性强,失去电子发生氧化反应。 正极:活泼性弱,溶液中阳离子得到电子发生还原反应。 ②电解质溶液,电解质中阴离子向负极方向移动,阳离子向正极方向移动,阴阳离子定向移动形成内电路。 ③导线将两电极连接,形成闭合回路。 ④有能自发进行的氧化还原反应。 要点诠释:a.原电池中,电极材料可能与电解质反应,也可能与电解质不反应。如图: b.形成闭合回路的方式有多种,可以是用导线连接两个电极,也可以是两电极直接接触。如图: 要点二、原电池工作原理的实验探究 1、实验设计 ①按照图示装置进行实验。请观察两个金属片插入溶液后电流表指针位置的变化、金属电极表面的变化以及溶液温度的变化,分析是否有电流产生。 ②按照下图组装实验装置,注意最后将盐桥插入两种电解质溶液中。请观察反应过程中电流表指针位置的变化,判断是否有电流产生,并观察电极表面以及溶液温度的变化情况。 要点诠释:盐桥的作用及优点 a.组成:将热的饱和KCl或NH4NO3琼胶溶液倒入U形管中(不能产生裂隙),即可得到盐桥。将冷却后的U形管浸泡在KCl饱和溶液或NH4NO3饱和溶液中备用。 b.作用:使两个半电池中的溶液连成一个通路。 c.优点:使原电池中的氧化剂和还原剂近乎完全隔离,并在不同区域之间实现了电子的定向移动,使原电池能持续、稳定地产生电流。 电流产生情况电极表面变化情况温度变化情况能量变化情况 (Ⅰ) 有电流产生锌片质量减小,同时铜片上有红色 物质析出,铜片质量增加溶液温度升高化学能转化为电能、 热能 (Ⅱ) 有电流产生锌片质量减小,铜片上有红色物质 析出,铜片质量增加 溶液温度不变化学能转化为电能 ①对于图甲装置 Zn片:Zn-2e-=Zn2+ Cu片:Cu2++2e-=Cu 同时在Zn片上,Zn可直接与CuSO4溶液反应,生成Cu与ZnSO4,因此该装置中既有化学能转化为电能,同时也有化学能转化为热能。 ②对于图乙所示原电池 锌片:负极,Zn-2e-=Zn2+(氧化反应) 铜片:正极,Cu2++2e-=Cu(还原反应) 总化学方程式:Zn+Cu2+=Cu+Zn2+ 4、实验原理分析:(如图所示) Test of Fundamentals of Materials Science 材料科学基础试题库 郑举功编 东华理工大学材料科学与工程系 一、填空题 0001.烧结过程的主要传质机制有_____、_____、_____ 、_____,当烧结分别进行四种传质时,颈部增长x/r 与时 间t 的关系分别是_____、_____、_____ 、_____。 0002.晶体的对称要素中点对称要素种类有_____、_____、_____ 、_____ ,含有平移操作的对称要素种类有_____ 、 _____ 。 0003.晶族、晶系、对称型、结晶学单形、几何单形、布拉菲格子、空间群的数目分别是_____、_____ 、_____ 、 _____ 、_____ 、_____ 。 0004.晶体有两种理想形态,分别是_____和_____。 0005.晶体是指内部质点排列的固体。 0006.以NaCl 晶胞中(001)面心的一个球(Cl- 离子)为例,属于这个球的八面体空隙数为,所以属于这个球的四面体空隙数为。 0007.与非晶体比较晶体具有自限性、、、、和稳定性。 0008. 一个立方晶系晶胞中,一晶面在晶轴X 、Y 、Z 上的截距分别为2a、1/2a 、2/3a,其晶面的晶面指数是。 0009.固体表面粗糙度直接影响液固湿润性,当真实接触角θ时,粗糙度越大,表面接触角,就越容易湿润;当θ,则粗糙度,越不利于湿润。 0010.硼酸盐玻璃中,随着Na2O(R2O)含量的增加,桥氧数,热膨胀系数逐渐下降。当Na2O 含量达到15%—16%时,桥氧又开始,热膨胀系数重新上升,这种反常现象就是硼反常现象。 2+进入到KCl 间隙中而形成0011.晶体结构中的点缺陷类型共分、和三种,CaCl2中Ca 点缺陷的反应式为。 0012.固体质点扩散的推动力是________。 0013.本征扩散是指__________,其扩散系数D=_________,其扩散活化能由________和_________ 组成。 0014.析晶过程分两个阶段,先______后______。 0015.晶体产生Frankel 缺陷时,晶体体积_________,晶体密度_________;而有Schtty 缺陷时,晶体体积_________, 晶体密度_________。一般说离子晶体中正、负离子半径相差不大时,_________是主要的;两种离子半径相差大 时,_________是主要的。 0016.少量CaCl2 在KCl 中形成固溶体后,实测密度值随Ca2+离子数/K+离子数比值增加而减少,由此可判断其 缺陷反应式为_________。 0017.Tg 是_________,它与玻璃形成过程的冷却速率有关,同组分熔体快冷时Tg 比慢冷时_________ ,淬冷玻璃比 慢冷玻璃的密度_________,热膨胀系数_________。 0018.同温度下,组成分别为:(1) 0.2Na2O-0.8SiO2 ;(2) 0.1Na2O-0.1CaO-0.8SiO2 ;(3) 0.2CaO-0.8SiO2 的 三种熔体,其粘度大小的顺序为_________。 0019.三T 图中三个T 代表_________, _________,和_________。 0020.粘滞活化能越_________ ,粘度越_________ 。硅酸盐熔体或玻璃的电导主要决定于_________ 。 0021.0.2Na2O-0.8SiO2 组成的熔体,若保持Na2O 含量不变,用CaO 置换部分SiO2 后,电导_________。 0022.在Na2O-SiO2 熔体中加入Al2O3(Na2O/Al2O3<1), 熔体粘度_________。 0023.组成Na2O . 1/2Al2O3 . 2SiO2 的玻璃中氧多面体平均非桥氧数为_________。 0024.在等大球体的最紧密堆积中,六方最紧密堆积与六方格子相对应,立方最紧密堆积与_______ 相对应。0025.在硅酸盐晶体中,硅氧四面体之间如果相连,只能是_________方式相连。 2 法律基础知识试题及答案 一、单项选择题(在每小题的四个备选答案中,选出一个正确答案,并将正确答案的序 号填在题中的括号内。每小题1分,共30分) 1. 按照制定和实施法律的主体不同,可以把法律划分为(C)。 A. 根本法和普通法 B. 一般法和特别法 C.国内法和国际法 D.实体法和程序法 2. 我国依法治国的主体是(C )。 A. 党中央 B.国务院 C.广大人民群众 D.全国人民代表大会 3. 外国人在我国领域内,(B )适用我国法律。 A.一律 B. 一般 C.可以 D.不能 4. 法律(A)是划分部门法的首要的、第一位标准。 A.调整的社会关系的种类 B.调整的方法 C.保障权利的途径 D.调整的机制 5. 我国第一部社会主义类型的宪法是(D )年制定的宪法。 A.1949 B.1950 C.1952 D.1954 6. (C )是解决民族问题的基本政策,是一项符合我国国情的基本制度。 A.民族自治制度 B.区域自治制度 C.民族区域自治制度 D.民族平等制度 7. 我国宪法规定,公民有受教育的(D )。 A.权利 B.权力 C.义务 D.权利和义务 8. 最高人民法院是我国的最高国家审判机关,(C )地方各级人民法院和专门人民法院 的审判工作。 A.领导 B.指导 C.监督 D.管理 9. 行政法与行政法规的关系是(C )。 A. 行政法就是指行政法规 B. 行政法是行政法规的渊源之一 C. 行政法规是行政法的渊源之一 D. 行政法与行政法规是效力不同的两种类别的规范性文件 10. 私营企业是指企业资产属于私人所有,雇工达到(D)人以上的营利性经济组织。 A.5 B.6 C.7 D.8 11. 增值税属于(A )。 A.流转税 B.财产税 C.所得税 D.营业税 12. 我国森林法把每年(C)定为全国统一的“植树节”。 A.3月5日 B.3月11日 C.3月12日 D.3月15日 13. 刘迪,6岁,在北京幼儿园学习绘画数年,1989年夏天,某机构组织儿童绘画展, 刘迪的画被选中参展,并获得一等奖,得奖金1000元。此时刘迪父母已离异,其母张某为 刘迪的监护人,刘迪之父每月给刘迪100元抚养费。1000元奖金应归(D)所有。 A.刘母 B.刘父 C.幼儿园 D.刘迪 14. 财产所有权中最核心的是 D )。 A.占有权 B.使用权 C.用益权 D.处分权 15. 两个或两个以上的申请人在同一种商品上以相同或相似的商标在同一天申请注册 的,商标局应当依照我国商标法的规定公告(A)的商标。 A.使用在先 B.申请在先 C.申请在先并且使用在先 D.设计在先 16. 我国继承法规定,继承人对于被继承人生前的合法债务(D)。 A.应当负责全额偿还 B.可以负责全额偿还 C.可以不负责偿还 D.应当在遗产的实际价值范围内负责清偿 17. 根据我国刑法规定,单位(B)。 A. 可以成为所有犯罪的主体 B. 只能成为法律明文规定可由单位构成的犯罪的主体 C. 不能成为任何犯罪的主体 D. 能否成为犯罪的主体由法院根据具体情况确定 18. 我国刑法规定,对于中止犯,没有造成损害的,应当免除处罚;造成损害的, (B)处罚。A.可以免除B.应当减轻C.可以减轻D.应当从轻 19. 我国刑法规定,法定最高刑为无期徒刑、死刑的,经过20年就不再追诉;如果20 年以后必须追诉的,须报请(B)批准。 A.全国人大常委会 B.最高人民检察院 C.最高人民法院 D.中共中央政法委 20. 中学生某甲,1983年4月5日生。1998年3月28日,他故意把一同学打成重伤,某甲对于他的这一行为,(A)。 A.应负刑事责任,但应当从轻或减轻处罚 B.应负刑事责任,但可以从轻或减轻处罚 化学能与电能的转化—原电池专题 1、概念:把化学能直接转化为电能的装置叫做原电池。 2、原电池的工作原理:通过氧化还原反应(有电子的转移)把化学能转变为电能。 3、构成原电池的条件:(1)电极为导体且活泼性不同;(2)两个电极接触(导线连接或直接接触);(3)两个相互连接的电极插入电解质溶液构成闭合回路。 【例题分析】 例1、在如图所示的8个装置中,属于原电池的是() A.①④ B.③④⑤C.④⑧D.②④⑥⑦ 4、电极名称及发生的反应: 负极:较活泼的金属作负极,负极发生氧化反应, 电极反应式:较活泼金属-ne-=金属阳离子 负极现象:负极溶解,负极质量减少。 正极:较不活泼的金属或石墨作正极,正极发生还原反应, 电极反应式:溶液中阳离子+ne-=单质 正极的现象:一般有气体放出或正极质量增加。 5、原电池正负极的判断方法: ①依据原电池两极的材料: 较活泼的金属作负极(K、Ca、Na太活泼,不能作电极); 较不活泼金属或可导电非金属(石墨)、氧化物(MnO2)等作正极。 ②根据电流方向或电子流向:(外电路)的电流由正极流向负极;电子则由负极经外电路 流向原电池的正极。 ③根据内电路离子的迁移方向:阳离子流向原电池正极,阴离子流向原电池负极。 ④根据原电池中的反应类型: 负极:失电子,发生氧化反应,现象通常是电极本身消耗,质量减小。 正极:得电子,发生还原反应,现象是常伴随金属的析出或H2的放出。 6、原电池电极反应的书写方法: (i)原电池反应所依托的化学反应原理是氧化还原反应,负极反应是氧化反应,正极反应是还原反应。因此书写电极反应的方法归纳如下: ①写出总反应方程式。②把总反应根据电子得失情况,分成氧化反应、还原反应。 ③氧化反应在负极发生,还原反应在正极发生,反应物和生成物对号入座,注意酸碱 介质和水等参与反应。 (ii)原电池的总反应式一般把正极和负极反应式相加而得。 A1(fcc)密排面:(100)密排方向:【110】h+k+l全基或全偶衍射 A2(bcc)密排面:(110)密排方向:【111】h+k+l为偶数衍射 A3(hcp)密牌面:(001)密排方向:【100】 2dsinθ=λ 性质、结构成分(研究对象)、合成/制备=效用 1.如何理解点缺陷是一种热力学平衡缺陷? 随着点缺陷数量增加,熵增加导致自由能下降,但是同时内能增加导致自由能增加,所以有一个平衡浓度,此时有最低的自由能值。 2.何谓位错的应变能。何谓位错的线张力,其估算值为多少。 位错在晶体中引起畸变,使晶体产生畸变能,称之为位错的应变能或位错的能量。 线张力的定义为:位错线增加一个单位长度时,引起晶体能量的增加。 通常用Gb2/2作为位错线张力的估算值。 请问影响合金相结构的因素主要有哪几个。 原子尺寸、晶体结构、电负性、电子浓度。 3.请简要说明:(1)刃型位错周围的原子处于怎样的应力状态(为切应力还是正应力,为拉应力还是压应力);(2)若有间隙原子存在,则间隙原子更容易存在于位错周围的哪些位置(可以以图示的方式说明)。 (1)刃型位错不仅有正应力同时还有切应力。所有的应力与沿位错线的方向无关,应力场与半原子面左右对称,包含半原子面的晶体受压应力,不包含半原子面的晶体受拉应力。 (2)对正刃型位错,滑移面上方的晶胞体积小于正常晶胞,吸引比基体原子小的置换式溶质原子或空位;滑移面下方的晶胞体积大于正常晶胞,吸引间隙原子和比基体原子大的置换式溶质原子。 4.铁素体钢在拉伸过程中很易出现屈服现象,请问:(1)产生屈服的原因?(2)如何可以消除屈服平台? 由于碳氮间隙原子钉扎位错,在塑性变形开始阶段需使位错脱离钉扎,从而产生屈服延伸现象;当有足够多的可动位错存在时,或者使间隙原子极少,或者经过预变形后在一段时间内再拉伸。 5.如何提高(或降低)材料的弹性?举例说明,并解释。 选择弹性模量小的材料、或者减小材料的截面积、或者提高材料的屈服强度都可以提高弹性。 6.何谓加工硬化、固溶强化、第二相强化、细晶强化,说明它们与位错的关系 加工硬化:晶体经过变形后,强度、硬度上升,塑性、韧性下降的现象称为加工硬化。随着变形的进行,晶体内位错数目增加,位错产生交互作用,使位错可动性下降,强度上升。 固溶强化:由于溶质原子的存在,导致晶体强度、硬度增加,塑性、韧性下降的现象叫固溶强化。由于溶质原子的存在阻碍或定扎了位错的运动,导致强度的升高。 第二相强化:由于第二相的存在,导致晶体强度、硬度上升,塑性、韧性下降的现象叫第二相强化。由于第二相的存在,导致位错移动困难,从而使强度上升。 细晶强化:由于晶粒细化导致晶体强度、硬度上升,塑性、韧性不下降的现象叫细晶强化。 由于晶粒细化,使晶界数目增加,导致位错开动或运动容易受阻,使强度上升;又由于晶粒细化,使变形更均匀,使应力集中更小,所以,细晶强化在提高强度的同时,并不降低塑性和韧性。 7.说明金属在塑性变形后,其组织和性能将发生怎样的变化 金属塑性变形后,组织变化包括晶粒和亚结构的变化,其中,晶粒被拉长,形成 法律基础知识试题及答案(4)第一部分选择题(共50 分) 一、单项选择题(本大题共30小题,每小题1 分,共30分)在每小题列出的四个备选项中只有一个是符合题目要求的,请将其选出并将“答题卡”的相应代码涂黑。未涂、错涂或多涂均无分。 1 下列选项中属于我国社会主义法的渊源的是【C】 A 民法 B 刑法 C 宪法 D 行政法 2 法律规范由行为模式和法律后果两个部分构成。《中华人民共和国刑法》规定:故意伤人致人死亡或者以特别残忍的手段致人重伤造成严重残疾的,处十年以上有期徒刑、无期徒刑或者死刑。这一规定中的法律后果是【D】 A 故意伤人致人死亡 B 严禁故意伤人致人死亡 C 以特别残忍的手段致人重伤造成严重残疾 D 处十年以上有期徒刑、无期徒刑或者死刑 3 我国的政体是【C 】 A 民主集中制 B 政治协商制度 C 人民代表大会制度 D 人民民主专政制度 4 根据我国宪法和选举法的规定,下列关于我国选举制度基本原则的表述中错误的是【D】 A 秘密投票的原则 B 选举权的平等性原则 C 直接选举和间接选举并用的原则 D 代表不受选民和原选举单位监督的原则 5 我国行使监督宪法实施职权的机关是【C】 A 最高人民法院 B 最高人民检察院 C 全国人民代表大会及其常务委员会 D 地方各级人民代表大会及其常务委员会 6 公民甲驾驶车辆闯了红灯,交警对其处以200 元罚款。交警的行为属于【B】 A 抽象行政行为 B 羁束行政行为 C 被动行政行为 D 非要式行政行为 7 法律规定,只有符合法律要求的形式,并按照法定程序收集、提供和运用的证据,才可作为定案证据。这体现的是诉讼证据的【C】 A 客观性特征 B 关联性特征 C 合法性特征 D 排他性特征 8 《中华人民共和国公司法》规定,有限责任公司的权力机构是【B】 A 经理 B 股东会 C 董事会 D 监事会 9 某商场经营者拒绝答复消费者就商品性能提出的询问,该商场经营者侵犯了消费者的【D】 A 自主选择权 B 公平交易权 C 人格尊严受尊重权 D 商品真实情况知悉权 10 在我国社会主义法律体系中,社会保障法是指【B】 A 调整行政关系的法律规范的总称 B 调整关于社会保障和社会福利关系的法律规范的总称 C 调整婚姻家庭包括人身关系和由此产生的财产关系的法律规范的总称 D 调整保护人类生存环境和自然资源,防治污染和其他公害方面关系的法律规范的总称 11 民事活动必须遵守国家法律和政策,尊重社会公德,不得损害社会公共利益,破坏国家经济计划,扰乱社会经济秩序。这是民法基本原则中【D】 A 公平原则的要求 B 平等原则的要求 C 等价有偿原则的要求 D 禁止滥用民事权利原则的要求 高中化学原电池和电解池 一原电池; 原电池的形成条件 原电池的工作原理原电池反应属于放热的氧化还原反应,实现化学能向电能的转化。 从能量转化角度看,原电池是将化学能转化为电能的装置;从化学反应角度看,原电池的原理是氧化还原反应中的还原剂失去的电子经导线传递给氧化剂,使氧化还原反应分别在两个电极上进行。 原电池的构成条件有三个: (1)电极材料由两种金属活动性不同的金属或由金属与其他导电的材料(非金属或某些氧化物等)组成。 (2)两电极必须浸泡在电解质溶液中。 (3)两电极之间有导线连接,形成闭合回路。 只要具备以上三个条件就可构成原电池。而化学电源因为要求可以提供持续而稳定的电流,所以除了必须具备原电池的三个构成条件之外,还要求有自发进行的氧化还原反应。也就是说,化学电源必须是原电池,但原电池不一定都能做化学电池。 形成前提:总反应为自发的氧化还原反应 GAGGAGAGGAFFFFAFAF 电极的构成: a.活泼性不同的金属—锌铜原电池,锌作负极,铜作正极; b.金属和非金属(非金属必须能导电)—锌锰干电池,锌作负极,石墨作正极; c.金属与化合物—铅蓄电池,铅板作负极,二氧化铅作正极; d.惰性电极—氢氧燃料电池,电极均为铂。 电解液的选择:电解液一般要能与负极材料发生自发的氧化还原反应。 原电池正负极判断: 负极发生氧化反应,失去电子;正极发生还原反应,得到电子。 电子由负极流向正极,电流由正极流向负极。溶液中,阳离子移向正极,阴离子移向负极 电极反应方程式的书写 负极:活泼金属失电子,看阳离子能否在电解液中大量存在。如果金属阳离子不能与电解液中的离子共存,则进行进一步的反应。例:甲烷燃料电池中,电解液为KOH,负极甲烷失8个电子生成CO2和H2O,但CO2不能与OH-共存,要进一步反应生成碳酸根。 正极:①当负极材料能与电解液直接反应时,溶液中 的阳离子得电子。例:锌铜原电池中,电解液为HCl,正 GAGGAGAGGAFFFFAFAF 一、单项选择题(请在每小题的4个备选答案中,选出一个最佳答案, 共10小题;每小题2分,共20分) 1、材料按照使用性能,可分为结构材料和 。 A. 高分子材料; B. 功能材料; C. 金属材料; D. 复合材料。 2、在下列结合键中,不属于一次键的是: A. 离子键; B. 金属键; C. 氢键; D. 共价键。 3、材料的许多性能均与结合键有关,如大多数金属均具有较高的密度是由于: A. 金属元素具有较高的相对原子质量; B. 金属键具有方向性; C. 金属键没有方向性; D.A 和C 。 3、下述晶面指数中,不属于同一晶面族的是: A. (110); B. (101); C. (011- );D. (100)。 4、 面心立方晶体中,一个晶胞中的原子数目为: A. 2; B. 4; C. 6; D. 14。 5、 体心立方结构晶体的配位数是: A. 8; B.12; C. 4; D. 16。 6、面心立方结构晶体的原子密排面是: A. {111}; B. {110}; C. (100); D. [111]。 7、立方晶体中(110)和(211)面同属于 晶带 A. [110]; B. [100]; C. [211]; D. [--111]。 6、体心立方结构中原子的最密排晶向族是: A. <100>; B. [111]; C. <111>; D. (111)。 6、如果某一晶体中若干晶面属于某一晶带,则: A. 这些晶面必定是同族晶面; B. 这些晶面必定相互平行; C. 这些晶面上原子排列相同; D. 这些晶面之间的交线相互平行。 7、金属的典型晶体结构有面心立方、体心立方和密排六方三种,它们的晶胞中原子数分别为:A. 4, 2, 6; B. 6, 2, 4; C. 4, 4, 6; D. 2, 4, 6 7、在晶体中形成空位的同时又产生间隙原子,这样的缺陷称为: A. 肖脱基缺陷; B. 弗兰克缺陷; C. 线缺陷; D. 面缺陷 7、两平行螺旋位错,当柏氏矢量同向时,其相互作用力: 2020法律基础知识试题及答案 一、单项选择题 1.我国社会主义法律渊源中有() A.经济法B.刑法C.民法D.行政法规 2.按照规定的内容不同,法律可以划分为() A.一般法和特殊法B.实体法和程序法 C.国际法和国内法D.成文法和习惯法 3.在普通法法系国家的法律分类中,一般有()的划分。A.公法与私法B.联邦法与联邦成员法 C.宪法与普通法D.普通法与衡平法 4.在民法法系的国家的法律分类中,一般有()的划分。 A.特别法与一般法B.成文法与习惯法 C.公法与私法D.联邦法与联邦成员法 5.法的历史类型的划分是按照法律的() A.适用范围B.制定和实施的主体 C.制定和表现的形式D.阶级本质和借以建立的经济基础6.划分法系是按照法律的() A.表现形式B.历史传统C.规定内容D.阶级本质7.法律主要体现的是()的意志。 A.全民的B.统治阶级C.党D.整个社会 8.法律是以()为基础的。 A.意志B.政治C.国家D.经济关系 9.我国提出依法治国的基本方略是在() A.1982年宪法B.1978年党的十一届三中全会C.党的十四大D.党的十五大 10.我国依法治国的主体是() A.党中央B.广大人民群众C.国务院D.全国人大 11.我国依法治国的标准是() A.宪法和法律B.社会道德C.社会习惯D.风俗和礼仪 12.在我国的司法机关包括有() A.人民法院B.自治区人民政府C.监察部D.人民代表大会 13.在我国的执法机关中包括有() A.审判机关B.检察机关C.各级人民政府D.各级人民代表大会 14.我国专门的法律监督机关是() A.党的纪律检查委员会B.监察机关C.检察机关D.审计机关 15.关于法律溯及力,我国刑法规定() A.从旧原则B.从新原则 C.从轻原则D.从旧兼从轻原则 16.我国公民在我国领域内,()适用我国法律。 A.可以B.可以不C.有的D.一律 17.外国人在我国领域内,()适用我国法律。 A.全部B.一律不C.除法律有特别规定外,都D.有的要 18.我国公民在我国领域外,()适用我国法律。 高一化学原电池基础知识练习题 学校:___________ 题号一二总分 得分 注意事项:注意事项: 2、请将答案正确填写在答题卡上 第1卷 评卷人得分 一、单选题 ,具有广泛的应用前景.下列物质均可用作燃料电池的燃料,其中最环保的是( ) A.甲醇 B.天然气 C.液化石油气 D.氢气 2.下列说法中不正确的是( ) A.化学电池是将化学能转变成电能的装置 B.化学电池的种类包括一次电池、二次电池和燃料电池等 C.化学电池供能稳定可靠,可以制成各种形状和大小,使用方便,易于维护 D.废旧电池可以随意丢弃 3.下列装置可以构成原电池的是( ) A. B. C. D. 4.下列装置中,电流表指针能发生偏转的是() A. B. C. D. 5.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl —KCl 混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为4224PbSO +2LiCl+Ca =CaCl +Li SO +Pb 下列有关说法正确的是( ) A.正极反应式:--2Ca+2Cl -2e =CaCl B.放电过程中,+Li 向负极移动 C.每转移0.1mol 电子,理论上生成20.7g Pb D.常温时,在正负极间接上电流表或检流计,指针不偏转 6.如图,在盛有稀H 2SO 4的烧杯中放入用导线连接的电极X 、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) A.外电路的电流方向为:X→外电路→Y B.若两电极分别为Fe 和碳棒,则X 为碳棒,Y 为Fe C.X 极上发生的是还原反应,Y 极上发生的是氧化反应 D.若两电极都是金属,则它们的活动性顺序为X>Y 7.某原电池的电池反应为32+Fe 2Fe 3Fe +=,与此电池反应不符的原电池是( ) A.铜片、铁片、3FeCl 溶液组成的原电池 材料科学基础简答题考研常考题型汇总 1.原子间的结合键共有几种?各自的特点如何?【11年真题】 答:(1)金属键:基本特点是电子的共有化,无饱和性、无方向性,因而每个原子有可能同更多的原子结合,并趋于形成低能量的密堆结构。当金属受力变形而改变原子之间的相互位置时不至于破坏金属键,这就使得金属具有良好的延展性,又由于自由电子的存在,金属一般都具有良好的导电性和导热性能。 (2)离子键:正负离子相互吸引,结合牢固,无方向性、无饱和性。因此,七熔点和硬度均较高。离子晶体中很难产生自由运动的电子,因此他们都是良好的电绝缘体。 (3)共价键:有方向性和饱和性。共价键的结合极为牢固,故共价键晶体具有结构稳定、熔点高、质硬脆等特点。共价结合的材料一般是绝缘体,其导电能力较差。 (4)范德瓦尔斯力:范德瓦尔斯力是借助微弱的、瞬时的电偶极矩的感应作用,将原来稳定的原子结构的原子或分子结合为一体的键合。它没有方向性和饱和性,其结合不如化学键牢固。 (5)氢键:氢键是一种极性分子键,氢键具有方向性和饱和性,其键能介于化学键和范德瓦耳斯力之间。 2.说明间隙固溶体与间隙化合物有什么异同。 答:相同点:二者一般都是由过渡族金属与原子半径较小的C、N、H、O、B等非金属元素所组成。 不同点:(1)晶体结构不同。间隙固溶体属于固溶体相,保持溶剂的晶格类 型;间隙化合物属于金属化合物相,形成不同于其组元的新点阵。 (2)间隙固溶体用α、β、γ表示;间隙化合物用化学分子式MX、M2X 等表示。 间隙固溶体的强度、硬度较低,塑性、韧性好;间隙化合物的强度、熔点较高,塑性、韧性差。 3.为什么只有置换固溶体的两个组元之间才能无限互溶,而间隙固溶体则不能? 答:因为形成固溶体时,溶质原子的溶入会使溶剂结构产生点阵畸变,从而使体系能量升高。溶质与溶剂原子尺寸相差较大,点阵畸变的程度也越大,则畸变能越高,结构的稳定性越低,溶解度越小。一般来说,间隙固溶体中溶质原子引起的点阵畸变较大,故不能无限互溶,只能有限熔解。 4.试述硅酸盐的结构和特点? 答:(1)硅酸盐结构的基本单元是[SiO4]四面体。Si原子位于O原子的四面体间隙内,Si、O之间的结合不仅有离子键还有共价键 (2)每一个氧最多被两个[SiO]四面体共有 (3)[Si]四面体可以孤立存在,也可以共顶点互相连接。 (4)Si-O-Si形成一折线。 分类:含有有限硅氧团的硅酸盐、岛状、链状、层状、骨架状硅酸盐。 5.为什么外界温度的急剧变化可以使许多陶瓷件开裂破碎? 答:由于大多数陶瓷由晶相和玻璃相构成,这两种相的热膨胀系数相差很大,高温很快冷却时,每种相的收缩程度不同,多造成的内应力足以使陶瓷器件开裂或破碎。 6.陶瓷材料中主要结合键是什么?从结合键的角度解释陶瓷材料所具有的特殊法律基础知识试题及答案一
知识讲解_原电池_基础
材料科学基础试题
2知识讲解_原电池_基础
材料科学基础试题库答案
法律基础知识试题及答案
2018年人教版化学必修二原电池知识点与经典练习
上大材料科学基础简答题
法律基础知识试题及答案
高中化学原电池和电解池基础知识
材料科学基础试题库
2020年法律基础知识试题及答案
高一化学原电池基础知识练习题(附答案)
《材料科学基础》考研—简答题常考题型汇总
