(完整版)弱电解质的电离知识点总结.doc

弱电解质的电离
一、电解质、非电解质、
1、电解质:在水溶液里或熔融状态下能导电的化合物。
2、非电解质:在水溶液里和熔融状态下都不能导电的化合物。
①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。
②电解质必须是自身能直接电离出自由移动的离子的化合物。SO2、 CO2
③条件:水溶液或融化状态
对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。
④难溶性化合物不一定就是弱电解质。
、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质。
⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸是电解质溶液);蔗糖、
酒精为非电解质。
二、强电解质与弱电解质
1、强电解质:溶于水或熔融状态下几乎完全电离的电解质。
2、弱电解质:溶于水或熔融状态下只有部分电离的电解质。
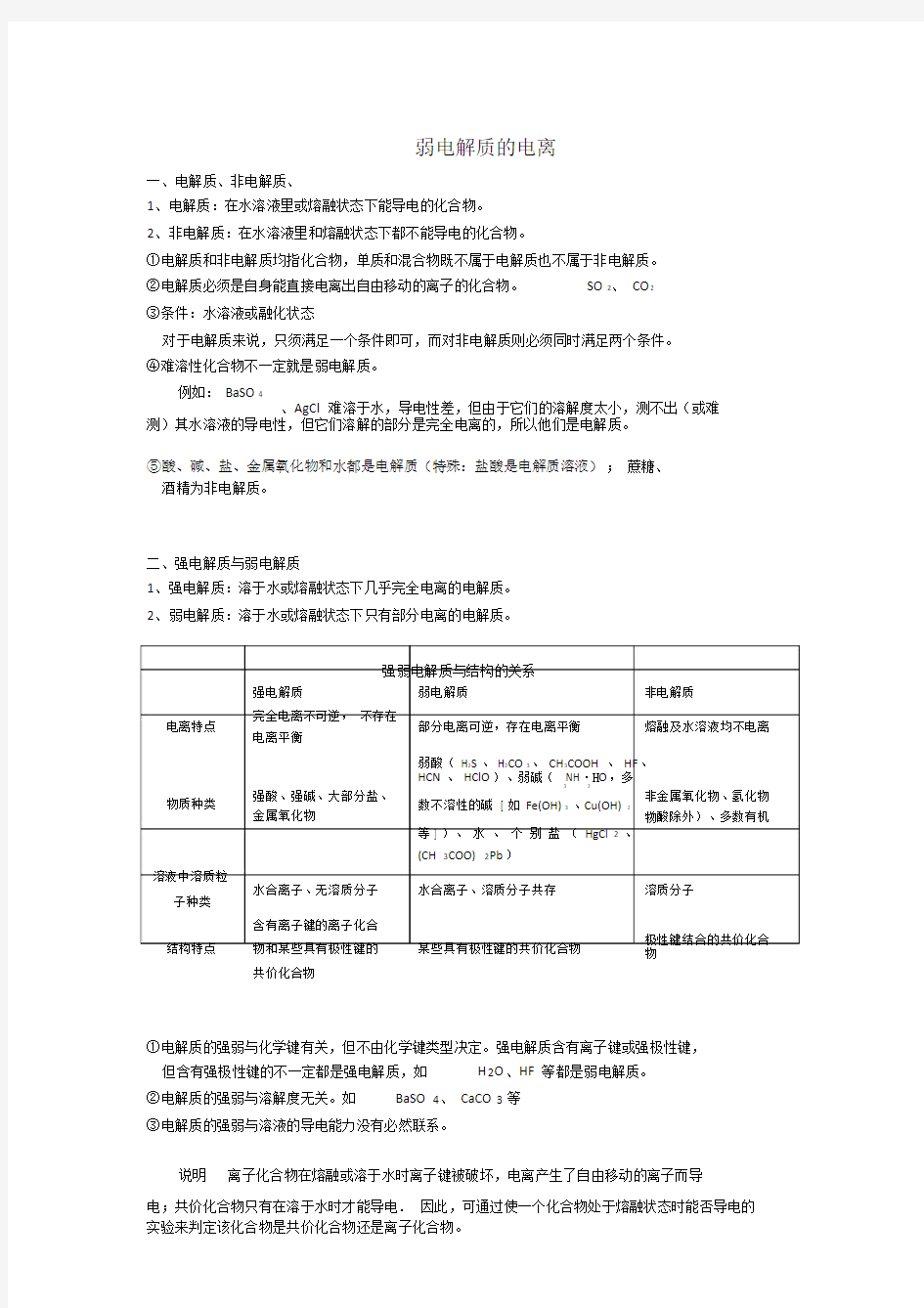
强弱电解质与结构的关系
强电解质弱电解质非电解质
电离特点完全电离不可逆,不存在
部分电离可逆,存在电离平衡熔融及水溶液均不电离电离平衡
弱酸( H2S、 H2CO3、 CH3COOH、 HF、
HCN、 HClO)、弱碱( NH·H O,多
3 2
物质种类强酸、强碱、大部分盐、非金属氧化物、氢化物金属氧化物
数不溶性的碱 [ 如 Fe(OH)3、Cu(OH)2
(酸除外)、多数有机
物;
等 ] )、水、个别盐〔 HgCl 2、
(CH 3COO) 2Pb〕
溶液中溶质粒
水合离子、无溶质分子水合离子、溶质分子共存溶质分子子种类
含有离子键的离子化合
极性键结合的共价化合结构特点物和某些具有极性键的某些具有极性键的共价化合物物
共价化合物
①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键,
但含有强极性键的不一定都是强电解质,如H2O、HF 等都是弱电解质。
②电解质的强弱与溶解度无关。如BaSO4、 CaCO3等
③电解质的强弱与溶液的导电能力没有必然联系。
说明离子化合物在熔融或溶于水时离子键被破坏,电离产生了自由移动的离子而导
电;共价化合物只有在溶于水时才能导电.因此,可通过使一个化合物处于熔融状态时能否导电的实验来判定该化合物是共价化合物还是离子化合物。
例如: BaSO4
1
3、电解质溶液的导电性和导电能力
溶液浓度
电离程度
离子浓度
导电性强弱
离子所带电荷
①电解质不一定导电( 如 NaCl 晶体、无水醋酸 ) ,导电物质不一定是电解质( 如石墨 ) ,非电
解质不导电,但不导电的物质不一定是非电解质;
② 电解质溶液的导电性强弱决定于溶液离子浓度大小,浓度越大,导电性越强。离子电荷
数越高,导电能力越强。
③ 强电解质溶液导电性不一定比弱电解质强(浓度可不同);饱和强电解质溶液导电性不一
定比弱电解质强
④ 电解质的导电条件是水溶液或高温熔融液(熔液)。共价化合物只能在溶液中导电,离子
化合物在熔液和溶液均可导电。( 区别离子与共价化合物)
三、弱电解质的电离平衡
1、电离平衡概念
一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶
液中各分子和离子的浓度都保持不变的状态叫电离平衡状态(属于化学平衡)。
任何弱电解质在水溶液中都存在电离平衡,达到平衡时,弱电解质具有该条件下的最大电离程度。
2、电离平衡的特征
①逆:弱电解质的电离过程是可逆的,存在电离平衡。
②等:弱电解质电离成离子的速率和离子结合成分子的速率相等。
③动:弱电解质电离成离子和离子结合成分子的速率相等,不等于零,是动态平衡。
④定:弱电解质在溶液中达到电离平衡时,溶液里离子的浓度、分子的浓度都不再改变。
⑤变:外界条件改变时,平衡被破坏,电离平衡发生移动。
3、影响电离平衡的因素(符合勒沙特列原理)
(1)内因—电解质本身的性质,是决定性因素。
(2)外因
①温度—由于弱电解质电离过程均要吸热,因此温度升高,电离度增大。
②浓度—同一弱电解质,浓度越大,电离度越小。
在一定温度下,浓度越大,电离程度越小。因为溶液浓度越大,离子相互碰撞结合成分子
的机会越大,弱电解质的电离程度就越小。因此,稀释溶液会促进弱电解质的电离。
2
例如:在醋酸的电离平衡CH 3COOH CH 3COO -+H+
A 加水稀释,平衡向右移动,电离程度变大,但c(CH 3COOH) 、 c(H + )、 c(CH 3COO- )变小;B加入少量冰醋酸,平衡向右移动, c(CH 3COOH) 、c(H + )、c(CH 3COO- )增大但电离程度小;③外加物质
若加入的物质电离出一种与原电解质所含离子相同的离子,则会抑制原电解质的电离,
使电离平衡向生成分子的方向移动;若加入的物质能与弱电解质电离出的离子反应,则会促进原电解质的电离,使电离平衡向着电离的方向移动。
以电离平衡CH 3COOH CH 3COO -+H +为例,各种因素对平衡的影响可归纳为下表:
项目平衡移
c(H +) n(H + ) c(Ac -) c(OH -) + )/ 导电能力电离程度动方向
c(H
c(HAc)
加水稀释向右减小增多减小增多增多减弱增大加冰醋酸向右增大增多增多减小减小增强减小升高温度向右增大增多增多增多增多增强增大加 NaOH(s) 向右减小减少增多增多增多增强增大
H SO (浓) 向左增大增多减少减少增多增强减小
2 4
加醋酸铵 (s) 向左减小减少增多增多减小增强减小加金属 Mg 向右减小减少增多增多增多增强增大加 CaCO3 (s) 向右减小减少增多增多增多增强增大
四、电离方程式的书写
(1)强电解质用 =,弱电解质用
(2)多元弱酸分步电离,多元弱碱一步到位。
H2CO3 H ++HCO 3-, HCO
3
-
H ++CO 32-,以第一步电离为
主。
NH 3· H2O NH 4+ + OH- Fe( OH)3 Fe3+ + 3OH -
(3)弱酸的酸式盐完全电离成阳离子和酸根阴离子,但酸根是部分电离。
NaHCO 3=Na++HCO 3-, HCO 3-H ++CO 32-
(4)强酸的酸式盐如 NaHSO 4完全电离,但在熔融状态和水溶液里的电离是不相同的。熔融状态时: NaHSO4=Na+ +HSO 4-溶于水时: NaHSO 4=Na+ +H+ +SO42-
五、电离平衡常数(相当化学平衡常数)
在一定温度下,当弱电解质的电离达到平衡状态时,溶液中电离产生的各种离子浓度的
乘积与溶液中未电离的弱电解质分子浓度的比值是一个常数,这个常数叫做电离平衡常数,
简称电离常数,通常用K a表示弱酸的电离常数。
AB ? A++B K电离-
c(A ) c(B )
-
c(AB)
(1) K 的意义: K 值越大,则电离程度越大,电解质(即酸碱性)越强;K 值越小,电离程度越小,离子结合成分子就越容易,电解质(即酸碱性)越弱。表达式中各组分的
3
浓度均为平衡浓度。
(2) K 的影响因素: K
的大小与溶液的浓度无关,只随温度的变化而变化.温度不变, K
值不变;温度不同,
K 值也不同。
(3)多元弱酸的 K :多元弱酸的电离是分步电离的,每步电离平衡常数,通常用 K 1、 K 2、
K 3 分别表示,但第一步电离是主要的。如:磷酸的三个 K 值, K 1> K 2> K 3 ,磷酸的电离
只写第一步。说明:
①一元弱酸、一元弱碱的电离常数表达式:
CH 3COOH
-
+
CH 3COO + H
c(H ) c(CH 3COO )
一定温度下 CH 3 COOH 的电离常数为:
Ka
c(CH 3COOH )
NH 3·H 2O
+
-
NH 4 +OH
c(NH 4 ) c(OH )
一定温度下 NH 3· H 2O 的电离常数为:
Kb
H 2O)
c(NH 3
②多元弱酸的电离特点及电离常数表达式:
A 分步电离:是几元酸就分几步电离.每步电离只能产生一个 +
,每一步电离都有其相应
H 的电离常数。
B 电离程度逐渐减小,且 K 1 > K 2> K 3,故多元弱酸溶液中平衡时的
+
主要来源于第一步。
H 所以, 在比较多元弱酸的酸性强弱时,
只需比较其
K1 即可。例如 25℃时, H 3 PO 4 的电离;
H PO
H PO -
+
4 4 + H
3
2
2 4 - HPO 42
-
+
H PO
+ H
2
-
PO 4 3
-
+
HPO 4 + H
K 1
c( H 2 PO 4 ) c( H
)
7.5 10 3
c (H 3PO 4)
c( HPO 42
) c(H )
6.2 10 8
K 2
c(H 2PO 4 )
K
c(PO 43
) c (H )
2.61 10 13
3
c( HPO 42
)
多元弱酸溶液中的
+
+
)的总和, 在每步的电离常数表达式中
c(H )是各步电离产生的 c(H 的 c(H +
)是指溶液中 H +
的总浓度而不是该步电离产生的
c(H +
)。
六、电离度 电离度(
)(相当转化率,与温度、浓度均有关)
电离度(
) =
己电离的电解质的分子 数
溶液中原有电解质的总 100%
分子数
A 内因:电解质的本性。
B 外因:温度和溶液的浓度等。(1)浓度的影响:
醋酸稀释时电离度变化的数据:
浓度 (mol/L) 0.2 0.1 0.001 电离度 (%)
0.948
1.32
12.4
可见,电离度随浓度的降低而增大。 (因浓度越稀, 离子互相碰撞而结合成分子的机会越
少,电离度就越大。 )
4
章节知识结构图
5
初中数学平均数的中考知识点总结
初中数学平均数的中考知识点总结 关于初中数学平均数的中考知识点总结 初中数学平均数的中考知识点总结 平均数 定义 平均数是用总数除以份数。平均数容易受到极端数据的影响。 简介 平均数项目分类算术平均数 算术平均数是指在一组数据中所有数据之和再除以数据的个数。它是反映数据集中趋势的一项指标。 把n个数的总和除以n,所得的商叫做这n个数的平均数 几何平均数 geometricmean n个观察值连乘积的n次方根就是几何平均数。根据资料的条件不同,几何平均数分为加权和不加权之分。 公式:x=(x1*x2*......*xn)^(1/n) 调和平均数 harmonicmean 调和平均数是平均数的一种。但统计调和平均数,与数学调和平均数不同。在数学中调和平均数与算术平均数都是独立的自成体系的。计算结果两者不相同且前者恒小于后者。因而数学调和平均数定义为:数值倒数的平均数的倒数。但统计加权调和平均数则与之
不同,它是加权算术平均数的变形,附属于算术平均数,不能单独 成立体系。且计算结果与加权算术平均数完全相等。主要是用来解 决在无法掌握总体单位数(频数)的情况下,只有每组的变量值和相 应的标志总量,而需要求得平均数的情况下使用的一种数据方法。 公式:n/(1/A1+1/A2+...+1/An) 加权平均数 Weightedaverage 加权平均数是不同比重数据的平均数,加权平均数就是把原始数据按照合理的比例来计算,若n个数中,x1出现f1次,x2出现f2次,…,xk出现fk次,那么 (x1f1+x2f2+...xkfk)÷(f1+f2+...+fk)叫做x1,x2, …,xk的加权平均数。f1,f2,…,fk是x1,x2, …,xk的权。 公式:(x1f1+x2f2+...xkfk)/n,其中f1+f2+...+fk=n,f1,f2,…,fk叫做权。 说明:1)“权”的英文是weight,表示数据的重要 程度。即数据的权能反映数据的相对“重要程度”。 2)平均数是加权平均数的一种特殊情况,即各项的权相等时,加权平均数就是算术平均数。 平方平均数 quadraticmean 平方平均数 公式:M=[(a^2+b^2+c^2+…n^2)/n]^(1/2)。 温馨提示:上面的内容是初中数学平均数知识点总结,聪明的大家肯定熟记于心了吧。 初中数学知识点总结:平面直角坐标系
六年级(下册)科学重要知识点整理
六年级下册科学重要知识点整理 六年级下册科学重要知识点整理 判断。 1.一个细菌又称一个菌落。(×) 2.光线从空气进入凸透镜时会产生折射而弯曲。(√) 3.晶体的形状是很有规则的,都可以用肉眼直接看到。(×) 4.一个凸透镜的放大倍数是有限的。(√) 5.把橘皮、馒头等放在温暖干燥的环境中就可以进行霉菌培养。(×) 6.利用酵母菌发面后,体积可以达到原来的4-5倍。(√) 7.电池、医用针管等有毒有害垃圾要做深埋处理,才不会有危害。(√) 8.用不同的方法重新使用已用过的东西,可以减少垃圾数量。(√) 9.填埋场在填满垃圾后,可以在上面建公园、种庄稼。(×) 10.垃圾其实是放错了地方的财富。(√) 11.光年就是光走一年的距离,是用来计量恒星距 离的单位。(√)
12.不同的人观察同一棵树后,所描述的内容可能会不一样。(√) 13人们要想获取真实的资料,必须自己亲自去动手 获取,没必要与会交流。(×)电磁现象是丹麦科学家奥斯特最先发现了。(√) 15.太阳系是宇宙中最大的天体系统。(×) 16.正在使电灯发光的电线旁边没有磁场。(×) 17.将垃圾深埋以后,再也不会污染环境了。(×) 18.空气,土壤,海洋一旦被污染就再也无法治理了。(×) 19.我们平时发面用的酵母菌对人体是有害的。(×) 20.放大镜放大的倍数越高,所看到的视野就越大。(×) 21.自然界中很多物体都是晶体,晶体的形状都是 很有规则的。(√) 22.锅盖做成圆顶形主要是为了锅的容量大一点。(×) 23.用放大镜可以观察到手上的细菌。(×) 24.物体的细菌结构必须制成玻片标本在显微镜下 才能观察清楚。(√) 25.我们在记录信息的时候,要如实记录,但不需
弱电解质的电离知识点总结
弱电解质的电离 一、电解质、非电解质、 1、电解质:在水溶液里或熔融状态下能导电的化合物。 2、非电解质:在水溶液里和熔融状态下都不能导电的化合物。 ①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。 ②电解质必须是自身能直接电离出自由移动的离子的化合物。SO2、CO2 ③条件:水溶液或融化状态 对于电解质来说,只须满足一个条件即可,而对非电解质则必须同时满足两个条件。 ④难溶性化合物不一定就是弱电解质。 例如:BaSO4、AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质。 ⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸是电解质溶液); 蔗糖、酒精为非电解质。 二、强电解质与弱电解质 1、强电解质:溶于水或熔融状态下几乎完全电离的电解质。 2、弱电解质:溶于水或熔融状态下只有部分电离的电解质。 强弱电解质与结构的关系
①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键,但含有强极性键的不一定都是强电解质,如H 2O 、HF 等都是弱电解质。 ②电解质的强弱与溶解度无关。如BaSO 4、CaCO 3等 ③电解质的强弱与溶液的导电能力没有必然联系。 说明 离子化合物在熔融或溶于水时离子键被破坏,电离产生了自由移动的离子而导电;共价化合物只有在溶于水时才能导电.因此,可通过使一个化合物处于熔融状态时能否导电的实验来判定该化合物是共价化合物还是离子化合物。 3、电解质溶液的导电性和导电能力 ① 电解质不一定导电(如NaCl 晶体、无水醋酸),导电物质不一定是电解质(如石墨),非电解质不导电,但不导电的物质不一定是非电解质; ② 电解质溶液的导电性强弱决定于溶液离子浓度大小,浓度越大,导电性越强。离子电荷数越高,导电能力越强。 ③ 强电解质溶液导电性不一定比弱电解质强(浓度可不同);饱和强电解质溶液导电性不一定比弱电解质强 ④ 电解质的导电条件是水溶液或高温熔融液(熔液)。共价化合物只能在溶液中导电,离子化合物在熔液和溶液均可导电。(区别离子与共价化合物) 三、弱电解质的电离平衡 1、电离平衡概念 一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态(属于化学平衡)。 导电性强弱 离子浓度 离子所带电荷 溶液浓度 电离程度
小学三年级奥数 平均数 知识点与习题
第9讲平均数 把一个(总)数平均分成几个相等的数,相等的数的数值就叫做这个(总)数的平均数。例如,24平均分成四个数:6,6,6,6,数6就叫做24分成四份的平均数。又如,24平均分成六个数:4,4,4,4,4,4,数4就叫做24分成六份的平均数。 由此可见,平均数是相对于“总数”和分成的“份数”而言的。知道了被均分的“总数”和均分的“份数”,就可以求出平均数: 总数÷份数=平均数。 “平均数”这个数学概念在我们的日常生活和工作中经常用到。例如,某次考试全班同学的“平均成绩”,几件货物的“平均重量”,某辆汽车行驶某段路程的“平均速度”等等,都是我们经常碰到的求平均数的问题。根据求平均数的一般公式可以得到它们的计算方法: 全班同学的总成绩÷全班同学人数=平均成绩, 几件货物的总重量÷货物件数=平均重量, 一辆汽车行驶的路程÷所用的时间=平均速度。 我们在上一讲的例2中,已经接触到求平均数的应用题,下面再举一些例子来说明有关平均数应用问题的解法。 例1一小组六个同学在某次数学考试中,分别为98分、87分、93分、86分、88分、94分。他们的平均成绩是多少? 解:总成绩=98+87+93+86+88+94=546(分)。 这个小组有6个同学,平均成绩是 546÷6=91(分)。 答:平均成绩是91分。 例2把40千克苹果和80千克梨装在6个筐内(可以混装),使每个筐装的重量一样。每筐应装多少千克? 解:苹果和梨的总重量为 40+80=120(千克)。 因要装成6筐,所以,每筐平均应装 120÷6=20(千克)。 答:每筐应装20千克。 例3小明家先后买了两批小猪,养到今年10月。第一批的3头每头重66千克,第二批的5头每头重42千克。小明家养的猪平均多重? 解:两批猪的总重量为 66×3+42×5=408(千克)。 两批猪的头数为3+5=8(头),故平均每头猪重 408÷8=51(千克)。 答:平均每头猪重51千克。 注意,在上例中不能这样来求每头猪的平均重量: (66+42)÷2=54(千克)。 上式求出的是两批猪的“平均重量的平均数”,而不是(3+5=)8头猪的平均重量。这是刚接触平均数的同学最容易犯的错误! 例4一个学生为了培养自己的数学解题能力,除了认真读一些书外,还规定自己每周(一周为7天)平均每天做4道数学竞赛训练题。星期一至星期三每天做3
2020年历年浙江中考真题汇编精选题-声和光(试卷和答案)解析版
2020年历年浙江中考真题汇编精选题-声和光(试卷和答案)解析版 一、选择题 1.(2018?宁波)甘肃鸣沙山月牙泉是国家级重点风景名胜区,被称为天下沙漠第一泉。下列叙述正确的是() A.月牙泉风景区的植被是一个种群 B.湖中的倒影是由于光的折射形成的 C.鸣沙山昼夜温差较大是因为水的比热容较大 D.月牙泉地形的形成是地球内力和外力共同作用的结果 【答案】D 2.(2018?舟山)下列是观察对岸的树木在水中倒影的光路图,正确的是()A.B.C.D. 【答案】B 【解析】【分析】首先确定光的传播方向,然后根据倒影属平面镜成像现象,其原理是光的反射,对各个图进行分析。 【解答】解: 树木在水中倒影,是因为来自岸上树木的光线斜射到水面上发生反射,反射光线进入眼睛,所以才能观察到对岸的树木在水中的倒影,故B正确, ACD、图中光线来自水中,且光是直线传播或发生光的折射,故ACD错误。 故选:B。 【点评】本题考查平面镜成像特点及光的反射原理,要会应用平面镜成像的特点分析解决实际问题。 3.(2018?台州)如图是验证“平面镜成像特点”的实验装置,其中A为玻璃板前点燃的蜡烛,B为玻璃板后未点燃的蜡烛。有关本实验的说法错误的是() A.玻璃板应该与桌面垂直 B.实验宜在较暗的环境中进行
C.眼睛应从B一侧观察成像情况 D.蜡烛燃烧较长时间后像物不再重合 【答案】C 【解析】【分析】解答此题从以下知识点入手: ①实验中玻璃板如果不垂直于桌面,后面的蜡烛无法与前面蜡烛的像完全重合; ②眼睛在A的一侧观察。 ③物体射出的光线对人眼刺激越强,人眼感觉物体越亮,物体经过平面镜反射,反射光线进入人眼的光线越多,人眼感到物体的像越亮。在比较亮的环境中,很多物体射出光都对眼睛有刺激,干扰人的视线; ④平面镜成像特点之一:物像等大。 【解答】解:A、实验时玻璃板如果不竖直,不论怎样移动后面的蜡烛都不可能与前面蜡烛的像完全重合,就无法验证像的位置和大小,所以玻璃板应与水平桌面垂直放置。故A正确; B、在比较明亮的环境中,很多物体都在射出光线,干扰人的视线,在较黑暗的环境中,蜡烛是最亮的,蜡烛射向平面镜的光线最多,反射光线最多,进入人眼的光线最多,感觉蜡烛的像最亮。所以在比较黑暗的环境中进行实验,故B正确; C、寻找蜡烛A的像的位置时,眼睛应在蜡烛A一侧观察,在蜡烛B的一侧不能看到蜡烛A的像;故C错误; D、平面镜所成的像,物像等大,蜡烛燃烧较长时间后像物不再重合,故D正确。 故选:C。 【点评】此题以选择题的形式考查平面镜成像实验中需要注意的事项,这既是平时经常强调的地方,又是中考中经常涉及到的地方,要求深入理解,熟练掌握。 4.(2019?宁波)如图所示,在“用‘凸透镜’观察周围的景物”活动中,小科将印有绿色环 保标志“”的纸固定在墙上,再将一只装有水的圆柱形玻璃杯移到标志的正前方,然后改变玻璃杯与标志之间的距离。小科站立时透过玻璃杯和水观察。下列图像中,不可能看到的是() A.B.C.D. 【答案】C 【解析】【考点】凸透镜成像的规律 【解析】【分析】物体通过凸透镜可以成实像,实像都是倒立的,但分放大、等大和缩小;也可以成虚像,虚像都是正立、放大的,据此判断。 【解答】圆柱形的装满水的玻璃杯相当于一个凸透镜。 A.当标志在凸透镜的一倍焦距以内时,成正立、放大的虚像,故A不合题意; B.当标志在凸透镜的一倍焦距和二倍焦距之间时,成倒立、放大的实像,故B不合题意; C.标志通过凸透镜成的实像与物体相比,上下和左右都相反,而这个只有左右相反,故C 符合题意; D.当标志在凸透镜的二倍焦距以外时,成倒立、缩小的实像,故D不合题意。 故选C 5.(2017?温州)眼睛让我们看见多彩世界。下列属于爱护眼睛、保护视力的做法是( )
弱电解质的电离知识点#精选.
第三章第一节弱电解质的电离 一、电解质、非电解质、 1、电解质:在水溶液里或熔融状态下能导电的化合物。 实例:酸、碱、盐、活泼金属氧化物、水。 2、非电解质:在水溶液里和熔融状态下都不能导电的化合物。 实例:大多数有机物、酸性氧化物、氨气等。 ①电解质和非电解质均指化合物,单质和混合物既不属于电解质也不属于非电解质。 ②电解质必须是自身能直接电离出自由移动的离子的化合物。如:SO2、CO2则不是。 ③条件:水溶液或融化状态:对于电解质来说,只须满足一个条件即可,而对非电解质则 必须同时满足两个条件。 ④难溶性化合物不一定就是弱电解质。例如:BaSO4、AgCl 难溶于水,导电性差,但由 于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质。 ⑤酸、碱、盐、金属氧化物和水都是电解质(特殊:盐酸是电解质溶液)。 蔗糖、酒精为非电解质。 练习1:下列物质中属于电解质的是( ) ①NaCl溶液②NaOH ③H2SO4 ④Cu ⑤CH3COOH ⑥NH3·H2O ⑦CO2 ⑧乙醇⑨水 二、强电解质与弱电解质 1、强电解质:溶于水或熔融状态下几乎完全电离的电解质。 2、弱电解质:溶于水或熔融状态下只有部分电离的电解质。 ①电解质的强弱与化学键有关,但不由化学键类型决定。强电解质含有离子键或强极性键, 但含有强极性键的不一定都是强电解质,如H2O、HF等都是弱电解质。 ②电解质的强弱与溶解度无关。如BaSO4、CaCO3等
③ 电解质的强弱与溶液的导电能力没有必然联系。 说明 离子化合物在熔融或溶于水时离子键被破坏,电离产生了自由移动的离子而导电;共价化合物只有在溶于水时才能导电.因此,可通过使一个化合物处于熔融状态时能否导电的实验来判定该化合物是共价化合物还是离子化合物。 电解质的强弱与其水溶液的导电能力有何关系? 3、电解质溶液的导电性和导电能力 ① 电解质不一定导电(如NaCl 晶体、无水醋酸),导电物质不一定是电解质(如石墨),非 电解质不导电,但不导电的物质不一定是非电解质; ② 电解质溶液的导电性强弱决定于溶液离子浓度大小,浓度越大,导电性越强。离子电 荷数越高,导电能力越强。 ③ 强电解质溶液导电性不一定比弱电解质强(浓度可不同);饱和强电解质溶液导电性不 一定比弱电解质强 ④ 电解质的导电条件是水溶液或高温熔融液(熔液)。共价化合物只能在溶液中导电,离 子化合物在熔液和溶液均可导电。(区别离子与共价化合物) 注意: 强弱电解质≠溶液的导电能力强弱 强弱电解质≠物质的溶解性大小 三、电离方程式的书写 (1)强电解质用=,弱电解质用 (2)多元弱酸分步电离,多元弱碱一步到位。 H 2CO 3 H ++HCO 3-,HCO 3- H ++CO 32-,以第一步电离为主。 NH 3·H 2O NH 4+ + OH - Fe (OH )3 Fe 3+ + 3OH - (3)弱酸的酸式盐完全电离成阳离子和酸根阴离子,但酸根是部分电离。 NaHCO 3=Na ++HCO 3-,HCO 3- H ++CO 32- (4)强酸的酸式盐如NaHSO 4完全电离,但在熔融状态和水溶液里的电离是不相同的。 熔融状态时:-4 4HSO Na NaHSO +=+ 溶于水时:NaHSO 4=Na ++H ++SO 42- 1.先判断强、弱电解质,决定符号 2.多元弱酸分步电离,电离能力逐渐降低 3.多元弱碱也是分步电离,但书写电离方程式时写总式 4.Al(OH)3有酸式和碱式电离 5.多元弱酸的酸式盐的电离方程式 练习1:写出下列物质的电离方程式:⑴NH 3·H 2O ; ⑵HClO ;⑶H 2SO 3; ⑷Fe(OH)3; (5)Al(OH)3; (6)NaHCO 3 ;(7) NaHSO 4 (8)Ba(OH)2 练习2:有物质的量浓度相同、体积相等的三种酸:a 、盐酸 b 、硫酸 c 、醋酸,同时加入足量的锌,则开始反应时速率________。(用<、=、> 表示) 三、弱电解质的电离平衡 1、电离平衡概念:一定条件(温度、浓度)下,分子电离成离子的速率和离子结合成分子的速率相等,溶液中各分子和离子的浓度都保持不变的状态叫电离平衡状态(属于化学平衡) 导电性强弱 离子浓度 离子所带电荷 溶液浓度 电离程度
2016全国计算机等级二级MS_office高级应用考试基础知识总结
选择题汇总 1.在冯诺依曼体系结构的计算机中引进了两个重要的概念:采用二进制和存储程序 2.1946年诞生了世界上第一台电子计算机:ENIAC 3.计算机最早的应用领域是:数值计算 4.英文缩写CAD的中文意思是:计算机辅助设计 5.办公自动化OA是计算机的一项应用,按计算机的分类,它属于:数据处理 6.电子商务的本质是:商务活动 7.国际通用的ASCII 码的码长是:7 8.在计算机中,20GB的硬盘可以存放的汉子数是:10*1024*1024 KB 9.计算机中所有信息的存储都采用:二进制 10.大写字母B的ASCII码值是:66 11.汉子在计算机内部的存储、处理、和传输都使用汉子的:机内码 12.存储24*24点阵的一个汉子信息,需要的字节数是:72 13.组成中央处理器的主要部件是:运算器和控制器 14.操作系统对磁盘进行读/写的物理单位是:扇区 15.计算机能够直接进行识别和处理的语言是:机器语言 16.将高级语言源程序翻译成目标程序,完成这种翻译过程的程序是:编译程序 17.多媒体处理的是:数字信号 18.所有计算机的字长都是固定不变的,都是8位 19.计算机病毒是指“能够侵入计算机并在计算机系统中潜伏和传播、破坏系统正常工作的一种具有繁殖能力的”: 特殊程序 20.将发送端数字脉冲信号转换成模拟信号的过程称为:调制 21.实现局域网与广域网互联的主要设备是:路由器 22.Internet 中完成从域名到IP地址或者从IP地址到域名转换服务的是:DNS
23.IE浏览器收藏夹的作用是:收集感兴趣的页面地址 24.关于电子邮件:发件人必须有自己的E-MAIL账户/必须知道收件人的E-MAIL账户/可以使用OUTLOOK管理联系人的信息 25.计算机发展的四个阶段: 1)1946-1959,电子管 2)1959-1964 晶体管 3)1964-1972 中小规模集成电路 4)1972至今大规模、超大规模集成电路26.计算机的特点: 1)高速精确的运算能力2)准确的逻辑判断能力3)强大的存储能力 4)自动功能 5)网络与通信能力 27.计算机网络功能的重要意义:改变了人类交流的方式和信息获取的途径 29.网格计算的三要素:任务管理、任务调度、资源管理 30.云计算的构成包括:硬件、软件和服务 31.云计算的特点:超大规模、分布式、虚拟化、高可靠性、通用性、高可扩展性、按需服务、价廉 32.电子计算机的发展方向:巨型化、微型化、网络化、智能化 33.计算机中最重要的核心部件:芯片 34.电子商务是应用现代信息技术在互联网络上进行的商务活动,电子商务是现代信息技术和现代商业技术的结合体 35.信息技术包含三个层次:信息基础技术、信息系统技术、信息应用技术 36.现代信息技术的发展趋势:数字化、多媒体化、高速度、网络化、宽频带、智能化 37.计算机中数据的最小单位是位,存储容量的基本单位是字节,8个二进制位称为1个字节 1Byte=8bit 39.计算机由输入、存储、运算、控制和输出五个部分组成 40.运算器(ALU)是计算机处理数据形成信息的加工厂,主要功能是对二进制数码进行算术运算和逻辑运算控制器是计算机的心脏,指挥全机各个部件自动、协调地工作 控制区和运算器是计算机的核心部件,合称为中央处理器
2020年八年级物理上册第一章机械运动知识点总结新版新人教版
八年级物理下册知识点总结: 第一篇 基础知识篇 初中物理主要学习物质、运动和相互作用、能量三大主题,在教材中主要体现为声学、光学、力学、热学、电学等板块的内容。这些内容主要达到的要求是: 1.认识物质的形态和变化、物质的属性、物质的结构与物体的尺度,了解新材料及其应用等内容,关注能源利用与环境保护等问题。 2.了解自然界多种多样的运动形式,认识机械运动和力、声和光、电和磁等内容,了解相互作用规律及其在生产、生活中的应用。 3.认识机械能、内能、电磁能、能量的转化和转移、能量守恒等内容,了解新能源的开发与应用,关注能源利用与可持续发展等问题。 4.了解物理学及其相关技术发展的大致历程,知道物理学不仅含有物理知识,而且还含有科学研究的过程与方法、科学态度与科学精神。 5.有初步的实验操作技能,会用简单的实验仪器,能测量一些基本的物理量,具有安全意识,知道简单的数据记录和处理方法,会用简单图表等描述实验结果,会写简单的实验报告。 第一章机械运动 知识网络构建 ?????????????????????????????????????????????????????????????????测量工具长度单位及换算 测量方法测量工具长度和时间的测量时间单位及换算测量方法概念误差减小误差的方法选定参照物研究物体运动与否的方法运动和静止是相对的定义:物体位置随时间的变化机械运动定义定义匀速直线运动公式速度单位直线运动分类意义机械运动定义变速直线运动平均速度曲线运动s v t ?????????????????????????????????????????????????????????????????????????????????????????????? 原理:=平均速度的测量工具:刻度尺、停表实验过程
Office知识点的总结(word文档物超所值)
三大办公软件Word、Excel、PPT知识点归纳
第一部分 Word文档知识点 第一章 Word文档的编辑与排版功能 一、Word2016操作界面: 由“文件”按钮、快速访问工具栏、标题栏、功能区(选项卡和命令组)、标尺、共享、页面区域、滚动条、状态栏等组成。 Word2016的默认后缀名是:.docx 二、word的基本操作: 1.文件的基本操作 1)不同输入法之间的切换:Ctrl+Shift键; 2)CapsLook=大、小写字母切换 3)NumLook=控制数字小键盘打开与关闭 2.输入日期和时间; 1)插入当前日期:Alt+Shift+D;2019/12/18 星期三 2)插入当前时间:Alt+Shift+T;19时31分 3.选定文本的作用:选定文本后,才能编辑和修改文本。 4.输入文档时,直接按“Enter”键可对文档内容进行换段;按“Shift+Enter”组 合键可对内容进行换行,并出现一个手动换行符“↓”。 5.选定文本的方法; 1)选择整个文档:在文档左侧页边距外侧的空白页面上,连续点击鼠标左键三次。 2)选择整个段落:在段落的左侧页边距外侧的空白页面上,连续点击鼠标左键两次。 3)选择一行:在一行的左侧页边距外侧的空白页面上,单击鼠标左键。 4)可以使光标插入点快速移到第一页页头的组合键是Ctrl+home。
5)选择文档中竖块文本的方法,可以按住Alt键选择。 6)小区域选择:按住鼠标左键,从开始位置拖动到结束位置,松开鼠标左键。 三、文本和段落的基本格式 设置文字格式的操作有设置字体、字号、字形、下划线、边框、底纹、颜色等; 设置段落格式的操作有设置对齐、缩进、行间距、段间距以及边框和底纹等; 设置页面格式的操作有设置纸张、页边距、页眉和页脚、页边框等。 1、字体的安装: 1)选中字体文件,鼠标右键“安装”; 2)开始/控制面板/字体 2、段落文本的对齐方式包括:左对齐Ctrl+L、居中Ctrl+E、右对齐Ctrl+R、两端对齐Ctrl+J、分散对齐Ctrl+Shift+J(调整字符宽度) 3、按组合键【Ctrl+D】打开“字体”对话框,设置文本格式。 4、在文档中插入的分页符,为什么有的时候看不到? 分页符属于编辑标记,如果看不到文档中的分页符,那么它可能处在隐藏状态。此时, 单击“开始”选项卡,在“段落”组中单击“显示/隐藏编辑标记”按钮 5、要删除文档中重复的文字/空行/空格可以通过“查找和替换”来实现。 查找替换空行,“^p”代表一行。 6、制表位的作用:方便光标快速定位。 1)制表位的类型: 默认制表位(两个字符):一般用在正文段落中,按Tab键使用;即首行缩进2个字符 手动设置制表位:一般用在特定的排版,可以快速定位在页面制定位置; 2)通过标尺设置制表位 左对齐式制表位;居中式制表位;右对齐式制表位;小数点式制表位 ;竖线对齐式制表位(不定位文本,只在位置上显示插入的竖线); 7、插入_页面_分页【或执行“Ctrl+Enter”】
初中《概率》知识点归纳
初中《概率》知识点归纳 初中《概率》知识点归纳 1、科学记数法:把一个数字写成的形式的记数方法。 2、统计图:形象地表示收集到的数据的图。 3、扇形统计图:用圆和扇形表示总体和部分的关系,扇形大小反映部分占总体的百分比的大小;在扇形统计图中,每个部分占总体的百分比等于该部分对应的扇形圆心角与360°的比。 4、条形统计图:清楚地表示出每个项目的具体数目。 5、折线统计图:清楚地反映事物的变化情况。 6、确定事件包括:肯定会发生的必然事件和一定不会发生的不可能事件。 7、不确定事件:可能发生也可能不发生的事件;不确定事件发生的可能性大小不同;不确定。 8、事件的概率:可用事件结果除以所以可能结果求得理论概率。 9、有效数字:对于一个近似数,从左边第一个不是0的数字起,到精确到的数位为止的数字。 10、游戏双方公平:双方获胜的可能性相同。 11、算数平均数:简称“平均数”,最常用,受极端值得影响较大;加权平均数12、中位数:数据按大小排列,处
于中间位置的数,计算简单,受极端值得影响较小。 13、众数:一组数据中出现次数最多的数据,受极端值得影响较小,跟其他数据关系不大。 中学数学概率知识点归纳2 14、平均数、众数、中位数都是数据的代表,刻画了一组数据的“平均水平”。 15、普查:为了一定目的对考察对象进行全面调查;考察对象全体叫总体,每个考察对象叫个体。 16、抽样调查:从总体中抽取部分个体进行调查;从总体中抽出的一部分个体叫样本(有代表性)。 17、随机调查:按机会均等的原则进行调查,总体中每个个体被调查的概率相同。 18、频数:每次对象出现的次数。 19、频率:每次对象出现的次数与总次数的比值 20、级差:一组数据中最大数据与最小数据的差,刻画数据的离散程度 21、方差:各个数据与平均数之差的平方的平均数,刻画数据的离散程度 22、方差计算公式 23、标准方差:方差的算数平方根刻画数据的离散程度。 24、一组数据的级差、方差、标准方差越小,这组数据就越稳定。
Word知识点总结.doc
2. 刺进横线的几种办法 (5) 3. 在 WORD 中,窗体的运用 (5) 4. WORD 中,能够在页眉页脚中设置页面左边的相关装饰物 (5) 5. WORD 中表格内数据的核算 (5) 6. WORD 中,分栏时能够钩选“分隔线”选项 (5) 7. WORD 中,已刺进“ (5) 8. 有关“试卷排版”中的一些技巧 (6) 9. 有关“ Math Type 5.2 数学公式修正器”的介绍 (6) 10. 在 WODE 中,铲除页眉里那条横线的办法 (6) 11. 在 WODE 中,将布景图片设置成水印的办法 (6) 12. 在 WODE 中,躲藏答案的办法 (6) 13. 在 WODE 中,把艺术字打散的办法 (6) 14. 字符输入办法 (6) 15. 符号的输入的办法 (7) 16. 改写 (7) 17. 便利键 1 (7) 18. 便利键 2 (7) 19. “重复”与“康复”的差异 (7) 20. 主动更正 (8) 21. 便利键 3 (8) 22. 阶段对齐办法 (8) 23. 设置制表位 (8) 24. 纵横混排 (9) 25. 兼并字符(最多 6 个汉字) (9) 26. 双行兼并 (9) 27. 在 WORD 中,能够刺进的图片文件格局有 (9) 28. 图形暗影效果 (9) 29. 比照 (10)
31. 表格的修正 (10) (1)手动拖动改动行高或列 宽: (10) (2)标题行重复。 (10) (3) 使用“自动调整”命令调整行高或列宽。 (10) ○1 右键表格的便利办法中(主动调整)○2 “表格和边框”工具栏 (11) 32. 表格的排序与核算 (11) ○1 排序 (11) ○2 核 算 ............................................................................................... (11) (1)单元格参数与单元格的值 (11) (2)用公式命令计算。 (12) 33. 将文本转化为表格 (12) 34. 款式在排版中的运用 (12) (1)检查款 式。 .................................................................................................. (12) (2)替换款 式。 .................................................................................................. (12) (3)仿制款 式 .................................................................................................... (12) (4)从头套用款 式 .................................................................................................... (13) (5)加载模板。 (13) (6)文档模板 (14) 35. 宏的妙用 (14) 1.宏的基础常识 (14) (1)宏的举例阐 明 ............................................................................................... .. 14 (2)宏的界 说 ............................................................................................... (15)
关于初中数学平均数的中考知识点总结初中数学中考知识点
关于初中数学平均数的中考知识点总结初中数 学中考知识点 初中数学平均数的中考知识点总结 平均数的学习从小学就开始了,接下来让我们来学习初中数学平均数的知识点吧。 平均数定义 平均数是用总数除以份数。平均数容易受到极端数据的影响。 简介 平均数是指在一组数据中所有数据之和再除以这组数据的个数。平均数是统计中的一个重要概念。小学数学里所讲的平均数一般是指算术平均数,也就是一组数据的和除以这组数据的个数所得的商。在统计中算术平均数常用于表示统计对象的一般水平,它是描述数据集中程度的一个统计量。既可以用它来反映一组数据的一般情况、和平均水平,也可以用它进行不同组数据的比较,以看出组与组之间的差别。用平均数表示一组数据的情况,有直观、简明的特点,所以在日常生活中经常用到,如平均速度、平均身高、平均产量、平均成绩等等。 平均数项目分类算术平均数
算术平均数是指在一组数据中所有数据之和再除以数据的个数。它是反映数据集中趋势的一项指标。 把n个数的总和除以n,所得的商叫做这n个数的平均数 几何平均数 geometric mean n个观察值连乘积的n次方根就是几何平均数。根据资料的条不同,几何平均数分为加权和不加权之分。 公式:x=(x1*x2*......*xn)^(1/n)调和平均数harmonic mean 调和平均数是平均数的一种。但统计调和平均数,与数学调和平均数不同。在数学中调和平均数与算术平均数都是独立的自成体系的。计算结果两者不相同且前者恒小于后者。因而数学调和平均数定义为:数值倒数的平均数的倒数。但统计加权调和平均数则与之不同,它是加权算术平均数的变形,附属于算术平均数,不能单独成立体系。且计算结果与加权算术平均数完全相等。主要是用来解决在无法掌握总体单位数(频数)的情况下,只有每组的变量值和相应的标志总量,而需要求得平均数的情况下使用的一种数据方法。 公式:n/(1/A1+1/A2+...+1/An)加权平均数Weighted average 加权平均数是不同比重数据的平均数,加权平均数就是把原始数据按照合理的比例来计算,若 n个数中,x1出现f1次,x2
声和光知识点总结
声和光知识点总结 1、声音的发生和传播 (1)声音就是由于物体的振动而产生的.一切正在发声的物体才是声源.物体只要振动,就一定会发出声音,但人耳不一定都能听得到,人听到的声音频率约为20-20000HZ.(人发声频率约为85-1100HZ) (2)声源振动发出的声音,需要有介质来传播.介质可以是各种固体、液体和气体.真空中不能传声. (3)声音在不同介质中的传播速度一般不相同.通常情况下,在气体中声速最小,在固体中声速最大(空气中约为340m/s,水中约为1500m/s,钢铁中约为5200m/s)另外,在空气中,温度越高,声速越大. (4)回声:声音在空气中传播时,若遇到高大障碍物,会被障碍物反射回来形成回声.人耳要能区分清楚原声与回声,其间隔时间必须在0.1秒以上,所以,人耳到障碍物的距离应大于17m时,才能听到回声. 2、乐音的三个特征 (1)音调:声音的高低叫音调.它是由发声体振动的频率决定的。发声体振动的越快,频率越大,音调则越高;反之,音调越低。例如,1、2、3、4、5、6、7、ⅰ,音调越来越高。注意:鼓皮绷得越紧,音调越高。小提琴的弦丝越短、越细、绷得越紧,音调越高。吹笛的空气柱越短,音调越高。 (2)响度:人耳感觉到的声音的强弱叫响度. 响度与发声体的振幅有关,振幅越大,响度越大,反之则越小.另外,响度还与距离发声体的远近有关,距离越远,响度越小.人耳刚刚能听到的声音为0 dB. (3)音色:是由发声体本身材料、结构所决定的,它是声音的品质.根据音色,能区分乐器或其它声源。 3、噪声 从物理学角度看,乐音的波形是有规律的,噪音的波形是杂乱无章的. 从环保角度看,凡是妨碍人们学习、工作、生活和其它正常活动的声音都属于噪声.表示声音的强弱用的分贝(dB)为单位。安静舒适为40—50 dB;90 dB以上会对听力造成损伤。 减弱噪声主要途径:在声源产生处控制(改变、减少或停止声源的振动),在传播过程中阻断(隔声、吸声和消声),在人耳朵处减弱(戴护耳器)。 4、人耳听不到的声音 超声波;频率高于20000Hz的声波,具有方向性好、穿透能力强、易于获得较集中的声能等特点。 次声波;频率低于20Hz的声波,一定强度对人体会造成严重危害.可用来预报地震,台风和监测核爆炸. 5、传递能量与信息 声波是一种疏密相间的波(纵波),能传递信息。一个人说话声沙哑了,说明他生病了;医生运用“B”超探测人体内部疾病的信息;利用超声波回声定位制成声呐测距;利用超声波
Word与Excel知识点总结
Word知识点总结 1、页面设置(包括纸张大小、纸张方向、页边距、分栏等) 设置页面格式的方法:选择菜单“文件-页面设置) 2、字体设置(包括字体、大小、颜色、下划线、斜体、粗体、阴文、阳文等) 进行字体设置有两种方法, 方法一:选择文字,选择菜单“格式—字体” 方法二:选择文字,在文字上单击鼠标右键在弹出的快捷菜单中选择“字体”。 3、段落设置(包括行间距、首行缩进、段后间距、段前间距等) 方法一:选择需要设置的段落,选择菜单“格式—段落”、 方法二:选择需要设置的段落,在选择的段落上单击鼠标右键在弹出的快捷菜单中选择“段落”。 4、插入文本框及文本框格式设置(边框颜色、填充颜色\底纹、版式、大小等) 插入:将光标定位到需要插入的位置,选择菜单“插入—文本框—横排|竖排”,(不要再给出的画布上绘制,在画布旁的位置绘制) 文本框格式设置:在文本框边框上单击鼠标右键(注意不要在其他地方单击),在弹出的快捷菜单中选择“设置文本框格式” 5、插入图片及图片格式设置(大小、边框、版式等) 插入:选择菜单“插入—图片” 图片格式设置:在图片上单击鼠标右键,在弹出的快捷菜单中选择“设置图片格式”。 6、插入艺术字及艺术字格式设置(填充颜色、边框颜色、大小、版式等) 插入:选择菜单“插入—图片--艺术字” 艺术字格式设置:在艺术字上单击鼠标右键,在弹出的快捷菜单中选择“设置艺术字格式”。 7、插入表格及表格格式设置(边框与底纹、单元格对齐方式、表格对齐方式、文字环绕方式、行高、列宽等、合并单元格、添加删除行或列)
插入表格:选择菜单“表格—插入—表格” 表格属性:在表格的任意单元格上单击鼠标右键,在弹出的快捷菜单中选择“表格属性” 插入表格:选择菜单“表格—插入—表格” 8、插入页码 选择菜单“插入—页码” 9、首字下沉 将光标定位到需要首字下沉的段落,选择菜单“格式—首字下沉”。 10、分栏 选择菜单“格式—分栏“ 11、条件格式 选择需要进行条件格式设置的单元格区域--选择菜单“格式--条件格式”--设置条件与格式。 12、边框与底纹 选择需要进行设置边框与底纹的对象--选择菜单“边框与底纹” 13、查找、替换 选择菜单“编辑-替换” 14、项目编号
高一化学《离子反应》知识点归纳总结+典例解析
离子反应 【学习目标】 1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。 2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。 3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。 【要点梳理】 要点一、电解质与非电解质 (1)电解质、非电解质均应是化合物。金属属于单质,故既不是电解质,也不是非电解质。 (2)电解质导电必须有外界条件:水溶液或熔融状态。 (3)电解质应是一定条件下本身电离而导电的化合物;CO2、SO2、SO3、NH3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。 (4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。溶于水不能导电的物质可能是电解质,如BaSO4难溶于水,但其溶于水的部分是完全电离的,属于电解质。 要点二、强电解质与弱电解质 1
电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能力没有必然联系。 ①BaSO4、CaCO3等虽然在水中溶解度很小,溶液的导电性很差,但是由于都是离子化合物,溶于水的部分是全部电离的,是强电解质。 ②浓氨水的导电性比极稀NaOH溶液强,但NH3·H2O属于弱电解质。 2.电离方程式的书写方法: (1)要求左边书写电解质的化学式,右边写电解质电离出的离子的化学式,不同离子间用加号相连。强电解质用“==”,弱电解质用“”。 如:H2SO4==2H++SO42-;NaHSO4==Na++H++SO42—;Ca(HCO3)2==Ca2++2HCO3— CH3COOHCH3COO- + H+;NH3·H2ONH4+ +OH- ;H2OH++ OH- (2)电离过程中,元素或原子团的化合价不变。离子所带电荷数等于它在化合物中显示的化合价。 (3)检查电离方程式书写是否正确时,不仅要检查质量是否守恒(即电离前后原子的种类是否相同和个数是否相等),而且要检查电荷是否守恒(即电离后的阴、阳离子所带负、正电荷总数是否相等)。 (4)多元弱酸分步电离,且第一步电离程度远远大于第二步,如碳酸电离方程式: H2CO3H++HCO3―;HCO3―H++CO32― (5)多元弱碱电离方程式一步写出,如氢氧化铁电离方程式:Fe(OH)3Fe3++3OH― 3.酸、碱、盐的定义 (1)酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。 HCl = H+ + Cl- H2SO4 = 2H+ + SO42- HNO3 = H+ + NO3- (2)碱:电离时生成的阴离子全部是氢氧根离子的的化合物叫做碱。 NaOH = Na+ + OH- Ba(OH)2 = Ba2+ + 2OH- KOH = K+ + OH- (3)电离时生成金属阳离子(或铵根离子)和酸根阴离子的化合物叫做盐。 NH4NO3 = NH4+ + NO3- MgCl2 = Mg2+ + 2Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- 要点三、离子反应 1.定义:由于电解质溶于水后电离成为离子,所以,电解质在溶液中的反应实质上是离子之间的反应,像这样,有离子参加的反应,就叫做离子反应。 2.本质:反应物中的某些离子的浓度减小。 3.发生条件: ①生成难溶(或微溶)的物质,如Al(OH)3、BaSO4、Ag2SO4、CaSO4、Ca(OH)2等。 ②生成难电离的物质,如弱酸、弱碱、水等。 ③生成挥发性的物质,如CO2、SO2、NH3等。 ④发生氧化还原反应:如Zn与硫酸铜溶液:Zn+Cu2+=Zn2+ +Cu 要点四、离子方程式 1.概念:用实际参加反应的离子符号表示离子反应的式子。 2.书写离子方程式的四个步骤(以碳酸钙和盐酸的反应为例): “一写”:首先以客观事实为依据写出反应的化学方程式: CaCO3+2HCl==CaCl2+CO2↑+H2O “二改”(或拆):把易溶于水且易电离的物质改写成离子形式(最关键的一步): CaCO3+2H++2Cl―==Ca2++2Cl―+CO2↑+H2O 注意: (1)书写离子方程式时,反应物或生成物中易溶的强电解质(强酸、强碱和可溶性盐)必须写成阴、阳离子的形式。难溶的强电解质、弱电解质、非电解质和单质则必须保留化学式。 (2)对于微溶性的强电解质:①在反应物中视情况而定。如澄清石灰水中Ca(OH)2以Ca2+、OH―存在,可以拆成离子的形式;石灰乳中主要以不溶的Ca(OH)2固体形式存在,不能拆成离子形式。②在生成物中,一般不能拆,以化学式形式表示。 (3)可溶性多元弱酸酸式盐的酸式根一律保留酸式根形式。如在水溶液中HCO3―写成H++CO32―是不对的。 “三删”:删去方程式两边未参加反应的离子:
