1-2元素性质实验-实验报告
元素实验报告
实验18主族元素化合物的性质
实验目的
1. 熟练掌握试管操作。
2. 学习离心分离操作。
3. 学习主族元素一些化合物的化学性质。
二、实验内容
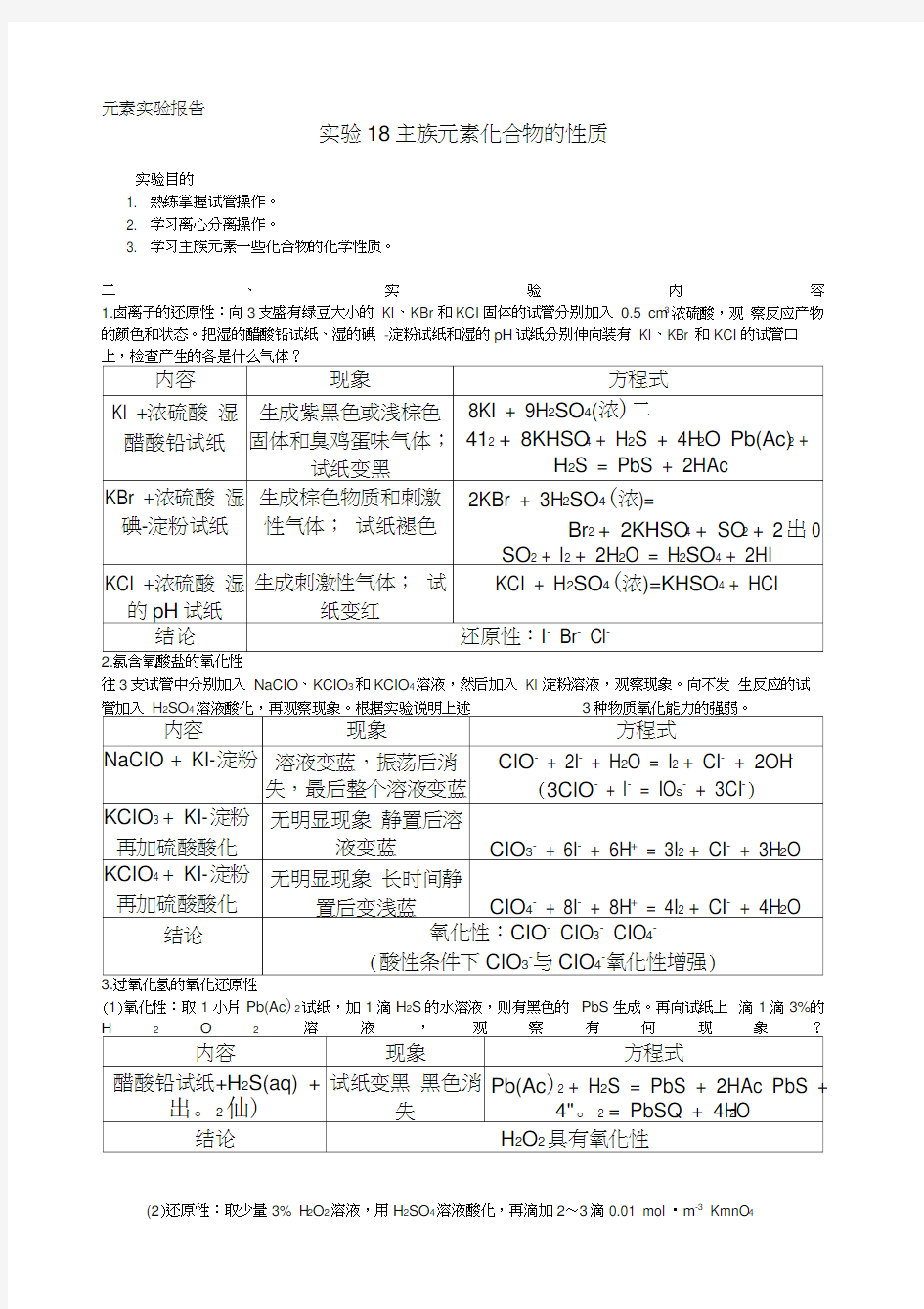
1.卤离子的还原性:向3支盛有绿豆大小的KI、KBr和KCI固体的试管分别加入0.5 cm3浓硫酸,观察反应产物的颜色和状态。把湿的醋酸铅试纸、湿的碘-淀粉试纸和湿的pH试纸分别伸向装有KI、KBr 和KCI的试管口
往3支试管中分别加入NaCIO、KCIO3和KCIO4溶液,然后加入KI淀粉溶液,观察现象。向不发生反应的试24
(1)氧化性:取1小片Pb(Ac)2试纸,加1滴H2S的水溶液,则有黑色的PbS生成。再向试纸上滴1滴3%的
(2)还原性:取少量3% H2O2溶液,用H2SO4溶液酸化,再滴加2?3滴0.01 mol ?m-3 KmnO4
7.磷酸根、焦磷酸根和偏磷酸根的鉴别
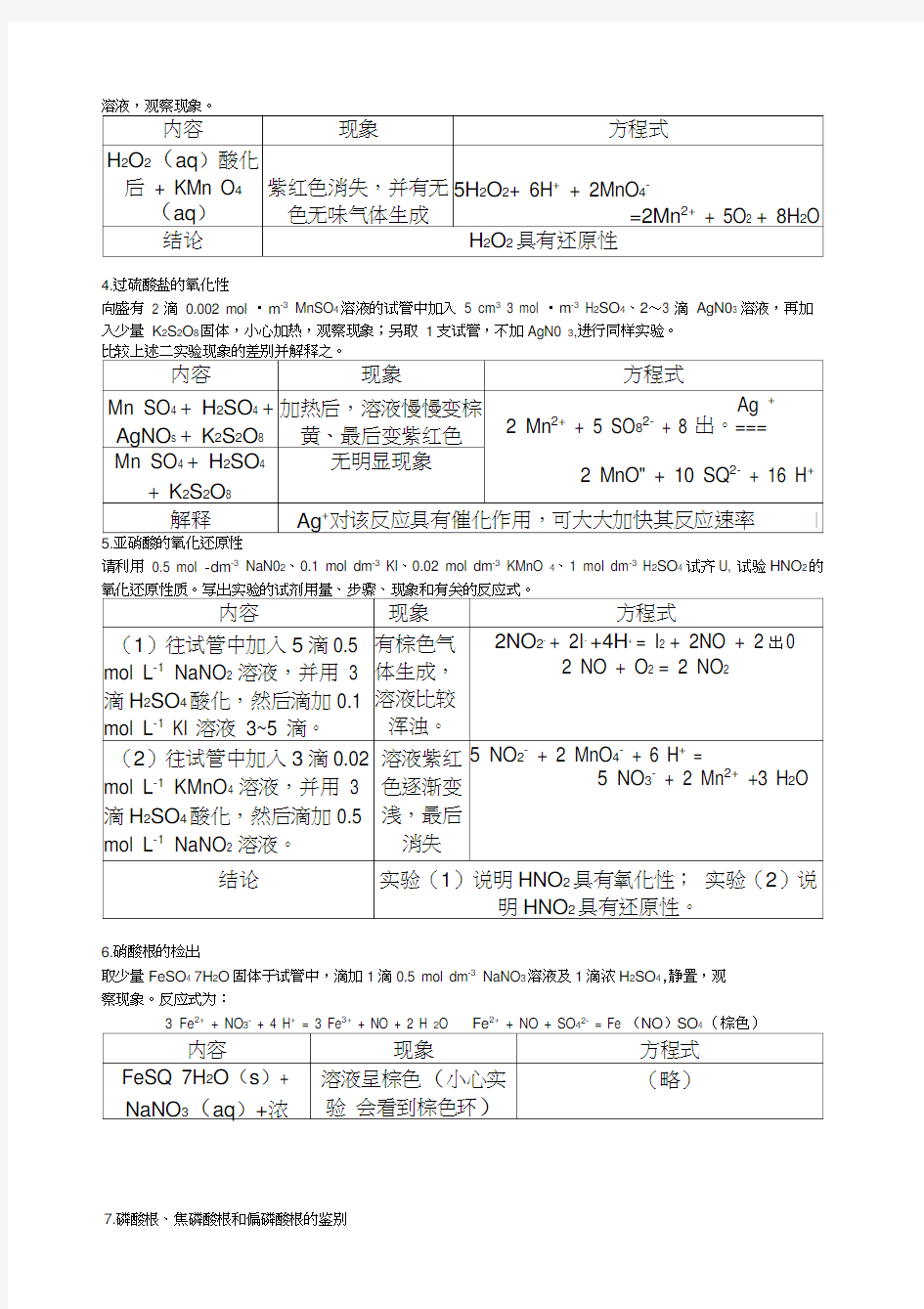
4.过硫酸盐的氧化性
向盛有 2 滴 0.002 mol ?m -3 MnSO 4溶液的试管中加入 5 cm 3 3 mol ?m -3 H 2SO 4、2?3 滴 AgN03 溶液,再加入少量 K 2S 2O 8固体,小心加热,观察现象;另取 1支试管,不加AgN0 3,进行同样实验。
请利用 0.5 mol -dm -3 NaN02、0.1 mol dm -3 KI 、0.02 mol dm -3 KMnO 4、1 mol dm -3 H 2SO 4 试齐U, 试验HNO 2的
6.硝酸根的检出
取少量FeSO 4 7H 2O 固体于试管中,滴加1滴0.5 mol dm -3 NaNO 3溶液及1滴浓H 2SO 4,静置,观 察现象。反应式为:
2+3-+3+22+42- 4
(1)
分别向 o.1 mol d m -3 Na 2HPO 4、W4P 2O 7和 NaP03溶液中滴加 0.1 mol d m -3 AgNO s 溶液,观
察发生的现象。生成的沉淀溶于 2 mol dm -3 HNO 3溶液吗? (2) 以2 mol dm -3 HAc 溶液酸化磷酸盐溶液、焦磷酸盐溶液和偏磷酸盐溶液,再分别加入蛋白溶 液,各发生什么现象?
43-274-3-
PO 43-、P 2O 74-和PO 3-的鉴别方法:
*现有 0.1 mol dm -3 的 SnCI 2、Pb(NO 3)2、
SbCl 3 和 Bi(NO 3)3, 2 mol dm -3 NaOH 、6 mol dm -3 NaOH 和40%的NaOH 试剂。请制备少量氢氧化物沉淀,并试验这些氢氧化物的酸碱性。写出实验步骤、现象、 试剂用量,并列
9. Sn 、Pb 、Bi 不同价态离子的氧化还原性
-3-3
⑵Pb (IV)的氧化性:往试管中加入少量PbO 2(s),并加入3 moldm -3H 2SO 4酸化,再加入1滴0.1
-34(3) Bi (III)的还原性和Bi (V)的氧化性:在试管中加入少量 Bi(NO 3)3溶液,再加6 mol dm -3 NaOH 溶液和氯水,水
浴加热,观察现象。离心分离去上清液,再加浓 HCI ,观察现象,并鉴别放出气体产物。
实验19过渡金属元素化合物的性质
一、目的要求
1. 试验ds、d区某些元素化合物的性质。
2. 试验ds、d区元素配合物的生成和性质。
3. 试验d区某些配合物在金属离子鉴定中的应用。
二、实验内容
1. Cu2+、Ag+、Zn2+的氨合物
分别往CuS04、AgN0 3、ZnS04溶液中滴加2 mol d m-3的氨水,观察沉淀的生成与溶解。请设计
实验确定CuSO4与氨水反应生成的配合物的组成。
配合物组成:
在洗净的试管中加入少量AgNO3溶液,滴加2 mol dm-3氨水至生成的沉淀刚好溶解。往溶液中加入少量10%葡萄
3. Cu+化合物及其性质
取0.5?1 cm3 0.1 mol dm-3 CuSO4溶液,加入过量的6 mol dm-3 NaOH溶液使Cu(OH) 2沉淀完全溶解。滴加数滴10%葡萄糖溶液,摇匀,水浴微热,观察现象。当绛蓝色溶液刚刚褪色时,立即取出试管离心分离,并尽量吸干上清液。往沉淀中加入0.5?1 cm3 3 mol dm-3 H2SO4,水浴微热并用小玻璃
棒不断搅拌沉淀,观察实验现象。
(1) Fe 2+、Co 2+、Ni 2+ 的还原性:在(NH 4)2Fe(SO 4)2、C0CI 2、NiS04 溶液中分别加入 6 mol ?m -3 NaOH , 观察现象。将沉淀放置一段时间后,观察有何变化?再将 Co 2+、Ni 2+生成的沉淀各分成2份,分别加入
2+2+
(2)锰化合物的氧化还原性
2+4
(b ) Mn(IV)的氧化还原性和 Mn(VI)的性质
(i )在少许 MnO 2固体中加入2 cm 3浓HCI ,观察深棕红色液体的生成。把此溶液微热,颜色有 何变化?检验有无 2(ii )取少量MnO 2固体,加入约10滴40% NaOH 溶液和约20滴0.01 mol dm -3 KMnO 4,搅拌 微热后静止片刻,离心分离。观察上清液 Mn(VI)的特征颜色。取出上清液,加入 3 mol dm -3 H 2SO 4酸
化,观察溶液颜色的变化和沉淀的析出。此现象说明 Mn(VI)的什么性质?
234(1)钴氨配合物的生成和性质: 往0.1 mol ?m -3 C0CI 2溶液中逐滴加入2 mol dm -3氨水,振荡试管, 观察沉淀的产
生和溶解。把溶液放置一段时间, C O (NH 3)62+
部分会被氧化成C O (NH 3)63+
,观察溶液颜色
4然后往溶液中加入 2 mol dm -3 NaOH ,观察有何变化?反应式为: 2 Ni 2+ + SO 42- + 2 NH 3 H 2O = Ni 2 (OH) 2 (SO 4)
+ 2 NH 4+
Ni 2 (OH) 2 (SO 4) + 2 NH 4+ + 10 NH 3 = 2 Ni (NH 3)62+ + 2 H 2O
6.配合物的应用一一金属离子的鉴定
2+2(2) Ni 2+的鉴定:向NiSO 4溶液加入2 mol dm -3氨水使介质呈弱碱性,再加入 1滴1%丁二酮肟 溶液,观察现象。反应式为:
CH 3C=NOH
CH 3C=NOH
