人教版化学必修1教案-第三章(精华版)

第三章金属及其化合物
课程标准
根据生产、生活中的应用实例或通过实验探索,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。让学生充分体验科学探究的艰辛和喜悦,感受化学世界的奇妙。培养学生敢于质疑,勤于思索,逐步形成独立思考的能力,善于与人合作,具有团队精神。
第一节金属的化学性质
(第一课时)
教学目标
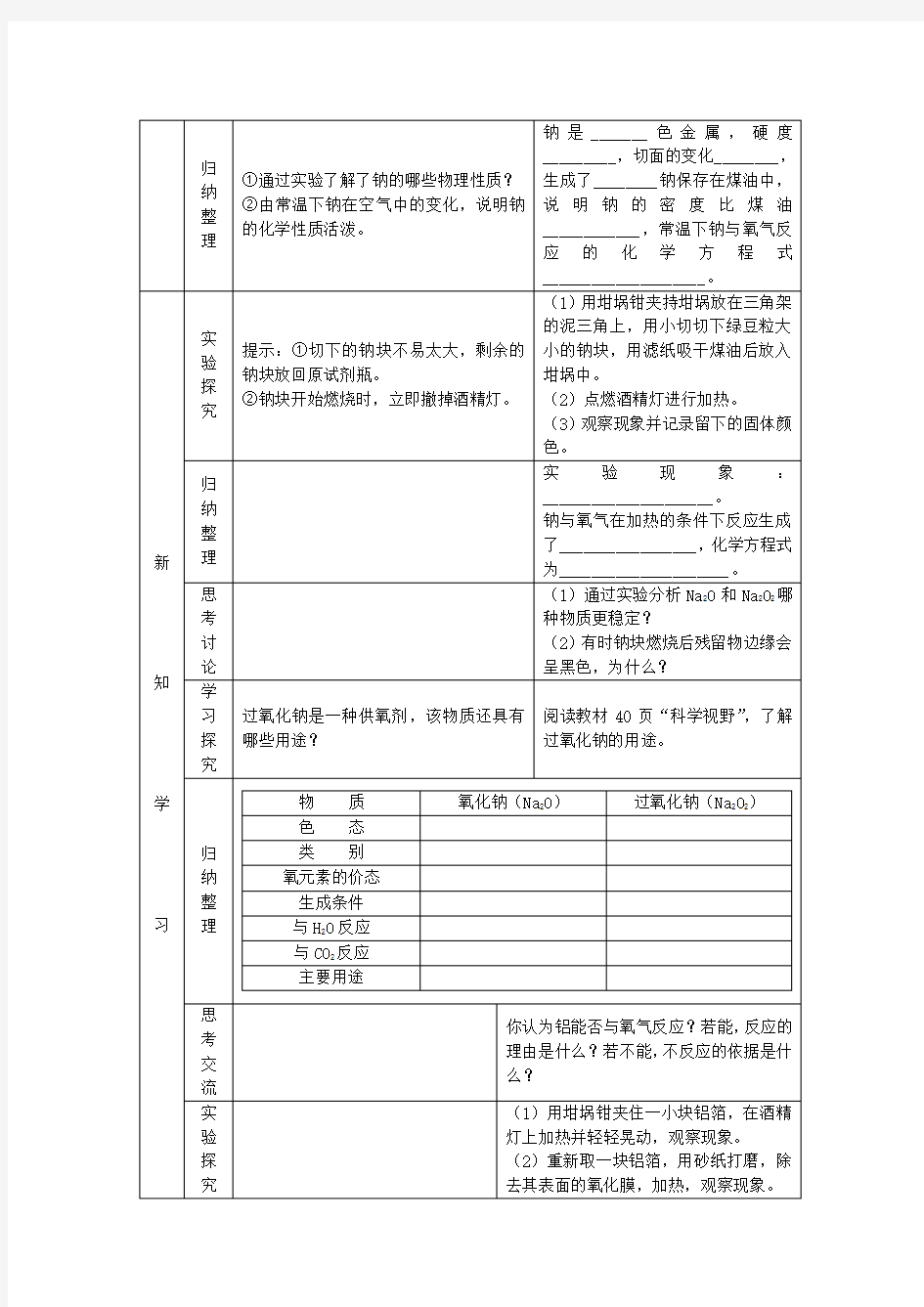
1.认识钠、铝、铁与氧气的反应,掌握金属钠、铝、铁的主要化学性质。
2.通过钠在空气中缓慢氧化和钠加热时氧化的实验,培养学生的观察能力,对比能力,分析能力。
3.激发学生学习化学的兴趣,体验科学探究的艰辛和喜悦。
教学重点、难点
重点:钠的氧化反应
难点:氧化钠与氧化钠稳定性的比较
教学过程
()1.以下说法错误的是
A、钠在常温下就容易被氧化
B、钠受热后能够着火燃烧
C、钠在空气中缓慢氧化能自燃
D、钠在氧气中燃烧更为激烈
()2.关于Na2O与Na2O2的叙述正确的是
A、都是白色固体
B、都是碱性氧化物
C、都和水反应形成强碱溶液
D、都是强氧化剂()3.当钠着火时,应选用灭火的是
A、煤油
B、水
C、沙土
D、泡沫灭火器
()4.下列物质放置在空气中,因发生氧化还原反应而变质的是
A、Na
B、NaCl
C、NaOH
D、Na2O2
()5.2.3g纯净金属钠在干燥空气中被氧化后得到3.5g固体,由此可判断其氧化物是
A、只有Na2O
B、只有Na2O2
C、Na2O和Na2O2
D、无法确定
()6.钠离子的性质是
A、有强还原性
B、有弱氧化性
C、有碱性
D、比钠原子稳定
第一节金属的化学性质
(第二课时)
教学目标
1.了解金属钠与水的反应,会解释钠与水反应的各种现象。
2.设计铁与水蒸气反应的实验装置,了解铁与水蒸气的反应。
3.掌握有关实验基础知识和基本技能,学习实验研究的方法,能设计并完成一些化学实验。
教学重点、难点
重点:钠与水的反应
难点:钠与水的反应,铁与水蒸气的反应教学过程
归纳整理金属活动顺序中氢前面的金属在一定条件下都可能跟水反应而置换出H2,而氢后面的金属不可能跟水反应产生H2。
板书设计二、金属与水的反应
1、钠与水的反应
现象:浮、游、球、响、红
产生上述各种现象的原因:
化学方程式:2Na+2H2O=2NaOH+H2↑
离子方程式:2Na+2H2O=2Na+ +2OH-+H2↑2、铁与水的反应
现象:
化学方程式:3Fe+4H2O(g)=Fe3O4+4H2↑
巩固练习
1、在进行钠和水的反应实验中,有如下操作和实验现象,请根据钠的性质解释说明。
(1)刚用小刀切开的金属钠断面呈_______色,在空气中放置几分钟后发生的变化为______________。
(2)切下来的金属钠块要用滤纸擦净后方可放入水中实验,这是因为____________________。
(3)金属钠块必须用_______夹取,而不能用手拿取,理由是_________________________________。
(4)金属钠块投入水中后,钠很快熔成一个闪亮的小球并浮于水面上,这是因为__________________。
(5)钠小球在水面上迅速游动,这是因为_____________________________________,反应容器的上方弥漫着“白色物”,它的主要成分是___________________________________。
(6)如果水中在未加钠之前已滴入酚酞试溶,反应后溶液由无色变为_____________________色,理由是____________________________。
2、红热的铁能与水蒸气反应,有氢气生成,根据下图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集,检验生成氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式_____________________________。
(2)干燥管C内盛放的药品是_______或______。干燥管的________(m或n)端与g导管相连接。
(3)在D处画出用简单方法用试管来收集氢气的装置图(所需其他仪器自己选择)。
(4)怎样用简单的方法检验收集到的气体是氢气,简述实验操作步骤和现象___________________。
第一节金属的化学性质
第三课时
教学目标
1.认识铝既能与盐酸反应,又能与氢氧化钠溶液反应。
2.通过比较归纳,使学生了解金属的一般化学性质和特性,从而对金属的化学性质有一个整体的认识。
教学重点、难点
重点:铝与NaOH溶液的反应
难点:铝与NaOH溶液的反应
教学过程
课堂巩固练习
1、下列物质中不能与NaOH溶液反应的是()
A. Na
B. Fe
C. Al
D. Cu
2、在铝和NaOH溶液的反应中,作为还原剂的是()
A.水
B.铝
C.氢氧化钠
D.氢氧化钠和水
3、用铝箔包装0.1mol金属钠,用针扎一些小孔,放入水中,完全反应后,用排水取气法收集产生的气体,则收集到气体的为()
A.O2和H2的混合气体
B.0.05molH2
C.大于0.05molH2
D.小于0.05molH2气体
4、铝与氢氧化钠溶液反应的离子方程式正确的是()
A、2Al+2Na++2OH-+2H2O=2NaAlO2+3H2↑
B、Al+OH-+H2O=AlO2-+3H2↑
C、2Al+2OH-+2H2O=2AlO2-+3H2↑
D、Al+2OH-+H2O=AlO2-+2H2↑
5、铝具有较强的抗腐蚀性能,主要是因为()
A、与氧气在常温下不反应
B、铝性质不活泼
C、铝表面形成一层氧化膜
D、铝耐酸耐碱
第二节几种重要的金属化合物
(第一课时)
教学目标:
1.认识金属氧化物的主要性质;认识铁的氢氧化物的性质及制法。
2.尝试用分类方法学习物质的性质。
3.通过实验教学培养学生的观察能力和实验操作技能。
教学重点、难点:
重点:1.金属氧化物的化学性质
2.Fe(OH)2、Fe(OH)3的性质及转化
难点:Al2O3的两性
课堂巩固训练:
1.用足量的CO还原32.0g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60g 沉淀,则该氧化物是()
A.FeO B.Fe2O3 C.CuO D.Cu2O
2.将氢气通过10g氧化铜粉末加热片刻,冷却后剩余固体的质量为8 .4g,那么下列计算正确的是()
A.有1.6g水生成 B.有8.4g铜生成
C.有80%的氧化铜被还原 D.实验时所消耗的氢气不足0.2g
3.下列说法正确的是()
A.金属氧化物一定是碱性氧化物 B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物 D.酸性氧化物一定是非金属氧化物
4.为了使Fe(OH)2氧化成Fe(OH)3而又不引入杂质,应向悬浊液中加入( )
A.氯水 B.HNO3 C.H2O2 D.Na2O2
5.根据你的了解,某种不溶于水的金属氧化物,如果要判断它是酸性氧化物、碱性氧化物还是两性氧化物,方法是。
第三节几种重要的金属化合物
(第二课时)
教学目标:
1.认识Al(OH)3的两性,认识Na2CO3、NaHCO3的性质及转化。
2.充分体会实验在化学学习中的作用,学会科学的探究方法。
3.培养学生观察图画、阅读资料的能力。
教学重点、难点:
重点:1.Al(OH)3的两性;
2.Na2CO3、NaHCO3的性质及转化
难点:Al(OH)3的两性
巩固训练:
1.不能只用NaOH溶液除去括号中杂质的是()
A.Mg(Al2O3) B.MgCl2(AlCl3) C.Fe(Al) D.Fe2O3(Al2O3)2.实验室制备Al(OH)3最好用()
A.Al2O3和稀盐酸 B.Al2O3和水 C.Al2(SO4)3和KOH D.AlCl3和氨水
3.实验室中,要使AlCl3溶液中的Al3+离子全部沉淀出来,适宜用的试剂是()A.NaOH溶液 B.Ba(OH)2溶液 C.盐酸 D.氨水
4.在200mL氯化镁和氯化铝的混合液中,Mg2+的物质的量浓度为0.2mol/L,Cl-的物质的量浓度为1.3 mol/L。要使Mg2+全部转化为沉淀分离出来,至少需要加入4 mol/L NaOH溶液的体积为()
A.40mL B.72mL C.80mL D.128mL
5.下列说法中不正确的是()
A.Na2CO3比NaHCO3易溶于水
B.N a2CO3比NaHCO3稳定
C.N a2CO3和NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与盐酸反应得CO2的物质的量之比为2︰1
第四节几种重要的金属化合物
(第三课时)
教学目标:
1.认识三价铁的氧化性及Fe2+、Fe3+的检验、转化,认识焰色反应及应用。
2.学会通过实验、图片、资料学习化学的方法。
3.通过铝盐、铁盐的净水作用、焰色反应的应用,体会化学与生活的密切联系,培养学习化学的兴趣。
教学重点、难点:
重点:1.三价铁的氧化性
2.Fe2+、Fe3+的转化
3.Fe2+、Fe3+的检验
难点:Fe2+、Fe3+的转化
