二烯烃的共轭效应

第五章 二烯烃的共轭效应
§1、二烯烃
一、二烯烃的分类和命名:
二烯烃和炔烃是同分异构体,通式C n H 2n-2 (一) 分类:根据二个烯键在分子中的相对位置分:
累积式的二烯烃
???ü?yà??úí?ò?Cé? ±??t??
C=C=C
CH 2=C=CH 2
共轭式二烯烃
C=C-C=C
CH 2=CH-CH=CH 2
?t?????ü±?ò???μ¥?ü???a
1£?3???t??
孤立式的二烯烃
C=C-(CH 2
)n-C=C
n > 1
?t?????ü±??t??ò?é?μ¥?ü???a
其中:孤立式的二烯烃的性质和单烯烃相似。 每个双键各行其势,相互影响很小。 累积式的二烯烃数量少且实际应用也不多。 共轭式二烯烃在理论和实际应用上都很重要。
所以,我们讨论的是共轭二烯烃,它具有新的,特殊的性质。
(二) 命名:和烯烃相似,主要是分别指出烯键的数目和位置就行
2-?×?ù-1£?3-???t?? 1£?3£?5-?oèy??
| | ???? êy??
CH 2=C CH=CH 2
CH 3
CH 2=CH-CH=CH-CH=CH 2
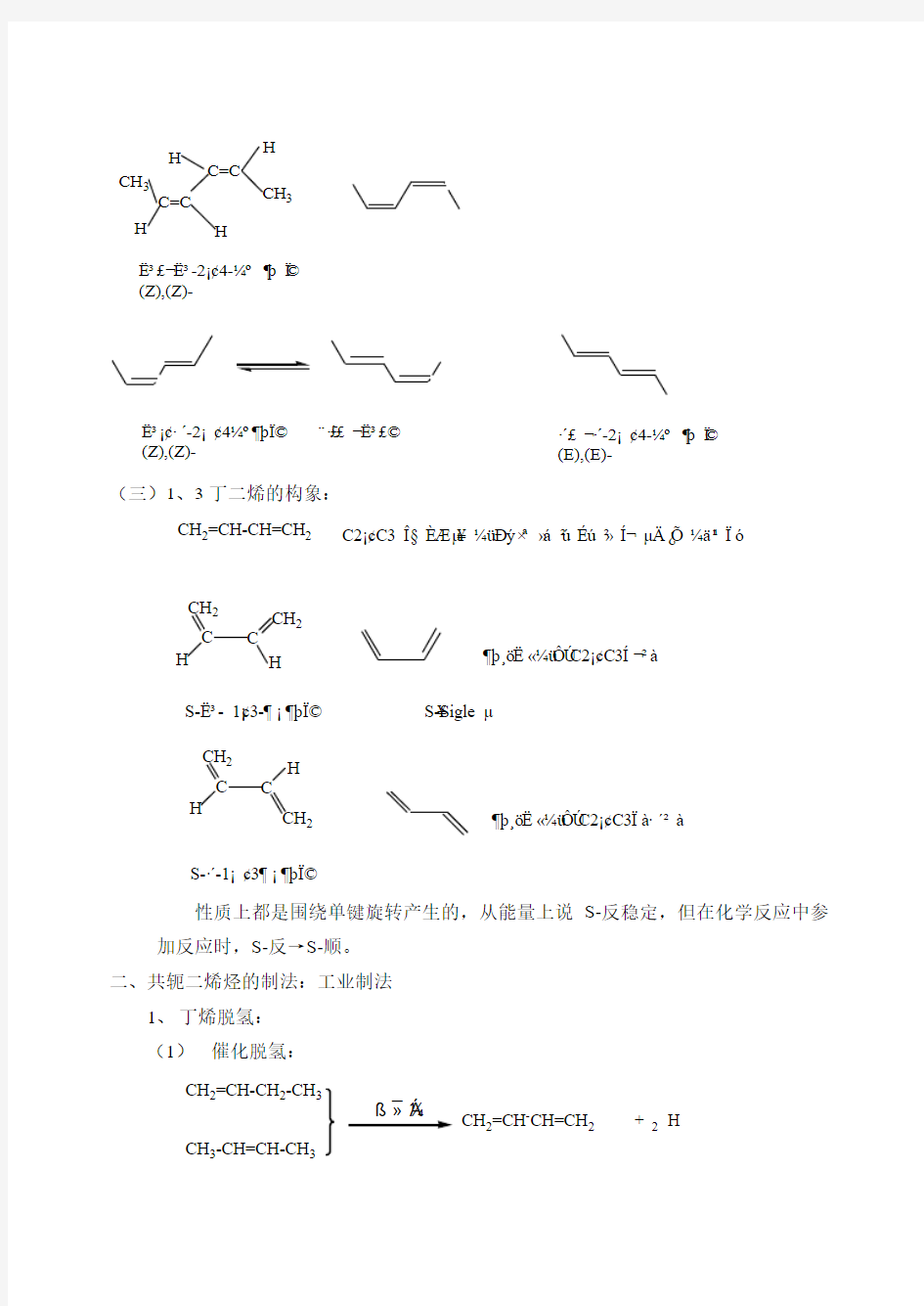
对多烯烃,每个烯键都可能有顺反构型问题,二个烯键有二个顺反问题,组合起来就有三个顺顺,顺反,反反三种异构体
?3£??3-2?¢4-?o ?t ??(Z),(Z)-
C=C
CH 3H
C=C
CH 3
H H
H
?3?¢·′-2?¢4?o?t?? £¨·′£??3£?(Z),(Z)-
·′£?·′-2?¢4-?o ?t ??(E),(E)-
(三)1、3丁二烯的构象:
CH 2=CH-CH=CH 2
C2?¢C3 ?§ è? μ¥ ?ü Dy ×a ?á 2ú éú 2? í? μ? ?? ?? 11 ?ó
C
C
CH 2CH 2H
?t?????ü?úC2?¢C3í?2à
S-?3- 1?¢3-???t?? S-Sigle μ¥C
C CH 2CH 2
H
H
S-·′-1?¢3???t??
?t?????ü?úC2?¢C3?à·′2à
性质上都是围绕单键旋转产生的,从能量上说S-反稳定,但在化学反应中参加反应时,S-反→S-顺。 二、共轭二烯烃的制法:工业制法
1、 丁烯脱氢: (1) 催化脱氢:
CH 2=CH-CH 2-CH 3CH 3-CH=CH-CH 3
′??ˉ?á
CH 2=CH -CH=CH 2 + H 2
(2) 氧化脱氢:
CH 2=CH-CH 2-CH 3
CH 3-CH=CH-CH 3
′??ˉ?
á+ 1/2 O 2
CH 2=CH -CH=CH 2 + H 2O
2、 丁烷脱氢:
CH 3CH 2CH 2CH 3
CH 2=CHCH 2CH 3 + H 2 CH
3CH=CHCH 3 + H 223Cr 2O 3
3、 由乙炔制备:
HCHO + HC CH + HCHO
HOCH 2C CCH 2OH
KOH H 2
HOCH 2CH 2CH 2CH 2OH Al 2O 32CH 2=CHCH=CH 2
4、2-甲基-1、3-丁二烯的制法:
Al 2O 3C=O CH 3CH 3
+ HC
CH
KOH
C
CH 3CH 3
C
CH
OH
42
C
CH 3CH 3
CH
CH2
OH
2CH 2=CCH=CH 2
3
三. 共轭二烯烃的性质:具有烯烃的性质,此外也有烯烃所没有的特性 1. 1、4加成:
CH 2=CHCH=CH 2 + Br 2
2CHCH=CH 2Br Br
CH 2CH=CHCH 2Br
Br
一般1、2加成和1、4加成同时发生,试剂不仅可以加到一个双键上,而且也可以加到共轭体系的两端C 原子上,二者的比例决定于反应条件,也就是与溶剂、温度有关。
1、2 1、4 温度-80 80% 20% -40 20% 80% 溶剂CHCl 3/40 70% 环己烷/-150C 62%
2.D-A 反应。狄耳斯-阿尔德反应(Diel—Alder)1、3—丁二烯和丁二烯酸酐作用。
?·?o??-4?¢5-?t?á?
?
O
O
+
O
O
O ±?£
?5
h
°× 90%
反应特征:(1)一部分共轭体系,丁二烯,共轭体系的二双链打开,在C2、C3形
成双链,二烯体。
(2) 另一部分是含不饱和双链的体系,叫亲二烯体 (3)
生成的都是环状化合物 (
4) 顺式加成
+
+
COOH
COOH
COOH COOH
????ì? ?×????ì?
ày è?£
o
用途:由链状化合物生成环状化合物的重要方法 3.聚合反应和合成橡胶: (1)分类:
CH 2
CH CH=CH 2n
1?¢2-?ó 3é ?? o? ??
C=C
CH 2CH 2H
H
*
*
n
?3 1?¢4-?ó 3é ?? ?
?C=C
CH 2CH 2H
H
*
n ·′ 1?¢4-?ó 3é ?? ?
?1?¢4-?ó3é??o?1?¢2-?ó3é??o
?
共聚反应:丁苯橡胶 (2)聚合反应: 合成橡胶:
CH 2CH=C-CH 2
n
C=C
CH 2CH 2H
H
n
C=C
CH 2CH 2H
H
n
nCH 2=CHCH=CH 2
nCH 2=CCH=CH 2
CH3
?3???e?o
?3-1£?4-??òì?ì?t???e?o
nCH 2=CH -CH=CH 2 + n CH=CH 2
ROOR'
...CH 2CH=CHCH 2CHCH 2......
??±??e?o
Cl
nCH 2=CHC=CH 2
Cl
?è???e?o
氯丁橡胶单体的制备: 反应历程:
CH 2=CHC=CH 2
CH CH 2=CHC
d d +
-+ H
Cl
CH 2Cl
天然橡胶:分散性较大的异戊二烯的高分子量聚合物的混合体。
来源:橡树 ?e ?
o?éá
óCH 2=CHC=CH 2
CH 3
2-?×?ù-1,3- ?? ?t ?
?
结构:线性高分子化合物 ↓
体型(网络型)高分子
可塑性
延展性
§2 电子离域和共轭效应
一、二烯烃的结构:
(一)累积式二烯烃: CH 2=C=CH
2
p p
s s C 3H 4 ±? ?t ??
?á 11 £o
缺图
所以,它有二个相互垂直的Π键[模型]
性质:性质很活泼,双链可以一个个打开发生加成反应 (1) 水化反应:
CH 2=C=CH 2 + H 2O
CH 2=C
CH 3
OH
CH 3
C
O
CH 3H
+
(2) 异构化:(H 的重排)
(CH 3)KOH , ′
?(CH 3)2CHC
CH
(二) 共轭二烯烃的结构
共轭二烯烃在结构和性质上都表现出一系列特性。 1、 结构: CH 2
CH
CH
CH 2
s s s C 4H 6?? ?? C ?- ×ó ?? ê? SP 2 ?ó ?ˉ
分子中:3个C -C σ SP 2
- SP 2
6个C -H σ SP 2
-S (1)丁二烯的所有原子共平面 键角-120度
(2)C 2、C3的σ键键长为0.148nm ,小于一般单键0.154nm (3)氢化热值:单烯烃氢化热大约为125.5KJ/mol
丁二烯实测值为238KJ/mol ,低了13 KJ/mol 说明丁二烯分子稳定,分子内能低了 2、用MO 说明丁二烯化学键的形成:
丁二烯分子,共四个C 原子,所以丁二烯分子中有四个P 轨道,所以可以组成四个π电子分子轨道
y y
y
y 1
2
3
4
μ
í?
?
E
特点:Ψ1无结点,Ψ2、Ψ3、Ψ4分别有1、2、3个结点,在节点处电子云密度很小,对成键不起作用,分子轨道能量越高,在基态时四个电子填充两个MO ,Ψ1、Ψ2。 看Ψ1:π键四个电子不是在C1、C2、C 3、C4之间而是在连接四个Cl 的分子轨道中运
动;即四个π电子是包括四个C 原子的二个分子轨道中,这轨道叫做离域轨道,键叫离域键,所以C2、C 3之间也有部分π键
看Ψ2:C1、C2 和C 3、C4间键又加强了,C2、C 3间键减弱,所以,结果是虽然所有 的键都具有π键的性质,但C2- C 3键所具有的π键性质小些。 VB 法不能解释共轭现象,因为C2、C 3重叠后,和旁的不能再重叠了。
二、共轭效应
共轭就是离域、共用,轭:连起来的意思。
1、概念:由于键的离域,电子云分布发生变化,对性质产生影响。这种效应叫~。
2、共轭体系的类型:
π、π共轭:CH2=CH-CH=CH2 π键和π键链接起来
这个π键不一定非是C=C、C=N、N=N……
P-π共轭:π键和P轨道连接起来,有重叠,有覆盖
:p
3
4
Cl 2S22P5
ó?óú3é?ü
类似的含有未共用电子对的O、N
、Cl都可以发生P-π共轭,条件是P轨道和π键的P轨道平行。
p
3
4
+
CH2CH CH2:
CH2CH CH2:
CH2CH CH3
:
-
p
3
3
p
3
2
σ-π超共轭:σ键和π键连起来
CH
CH3-CH=CH-CH3±èCH3-CH=CH2?è?¨
σ-P超共轭:σ键和P轨道连起来了
(CH3)C
3CH3
+
这里必须是α-H原子发生共轭,这种效应对分子性质的影响比较小,所以叫超共轭,又叫次级共轭,共轭作用的大小,看α-H数目。
所以-CH3 > -CH2R > -CHR2 > -CR2
这样就可以解释各种稳定性问题。例:
(CH 3)3C > (CH 3)2CH > CH 3CH 2 > CH 3
(CH 3)3C > (CH 3)2CH > CH 3CH 2 > CH 3+
+++
也可以解释1、4-,1、2-,加成问题:
这种加成和单烯烃亲电加成反应一样,Br σ+
先加到双键上,从π键上取得电子,从新杂化形成SP 3
σ键,这时有两种可能:
CH
CH 2
CH
CH2+
Br
Br
CH
CH 2
CH
CH2CH CH 2
CH
CH2+
+
p -p 12é
?óDò???H μ?3?12é
?
超共轭分子能量没有共轭降的低,所以主选可能(1)动态共轭效应,又因为共轭体系极性是交替存在的,所以Br -
可以进攻C 2,也可以进攻C 4,这样就分别有了1、4-和1、2-加成
CH
CH 2
CH
CH 2+Br
CH CH 2
CH
CH2CH
CH 2CH
CH212 é? ?ó 3
éBr
-Br
1、4-,1、2-加成二者比例不同,这是由于速度控制和平衡控制产生的。 速度控制产物:低温条件下,由活化能较低的途径决定的产物。 平衡控制产物:由达到平衡时稳定的产物决定。
所以速度控制产物就是温度较低时,由活化能小而快速生成的产物。平衡控制产物就是温度较高时,方向为最稳定的物压。 所以1、4-,1、2-产物比较
CH 2CH 3+
CH
CH
CH 2CH 3+CH
CH
1?¢2-2ú??μ?1y?éì?
1?¢4-2ú??μ?1y?éì?
CH 2
CH 3
+
CH
CH
CH 2
CH 3+CH
CH
>
所以,1、2-产物为速度控制产物
(2)产物稳定性的比较
CH 2
CH 3CH
CH
Br
Br
CH 2CH 3CH
CH
>
所以,1、4-产物为平衡控制产物
说明:势能图,过渡态,中间体。
过渡态:是反应物到产物的中间过滤状态,是推测出来的。 中间体:基元反应产物,实际存在,稳定的可分离得到。 三、离域体系的共轭论表述法:
共轭论是离域体系的另一种表示方法,它和共轭效应是一致的,它是用来补足经典结构式表达上的局限性的,例:
CH 2CH CH 2
CH CH 2
CH
CH 2
CH
苯可以写成二种经典结构式
经典结构式它无法描述电子离域的情况,双键和单键均不是原来纯粹的含义。苯可以写成两种经典结构式。所以,经典结构式和复杂离域体系表达式上有距离。所以,1931年Rauling 提出共振论,显然和价键理论有关,所以共振论是价键理论的延伸和发展,它的基础是经典的结构式。 (一) 共振论的基本概念:
1、 正则结构(极限结构,共振结构),可能的经典结构。
2、 共振杂化体(真实结构),所有极限结构的叠加,即所有可能的经典结构的共
振,共振于可能的经典结构之间的。 表示方法:例:
这种极限结构指的是离域的限度,所以可能写出的极限结构式越多,电子离域的可能性越大,体系的能量越低,越稳定。但必须注意共振杂化体是单一物质,只有一个结构、能量问题:任何一个单独的极限结构所含有的能量必定高于共振杂化体(即真实化合物的能量)。
3、 共振能:实际化合物与最低能量的极限结构之间的能量差,又叫离域能,共轭
能
例: 苯与环己烯ΔE=150KJ/mol ,即为苯的共振能
(二) 书写正则结构基本原则:
1、 必须符合经典结构式的规则。例:C 四价,外层电子不超过八个。
2、 各种极限结构之间仅仅是电子排列上的不同,但原子核位置不能动,即不可写
成不同化合物,C 原字位置也不能改动。
例:CH 2
CH 3
+
CH
CH CH 2CH 3+
CH
CH
3、 每个极限结构式必须保持相同数目的电子(对)数 例
:
CH 2
CH 2
CH
CH
CH 2
CH 2
+
CH
CH CH 2CH 2+
CH
CH --
4、 极限结构式的贡献:
(1) 共价键多的极限结构式比少的稳定。
(2) 没有电荷分离的比有电荷分离的贡献大,不遵守电负性原则的电荷分离,极
限结构更不稳定,贡献更小。
(3) 键角和键长变形太大的极限结构,贡献更小,可不写。 (三)共振论的应用与局限:
应用: 解释共轭多烯的键长平均化;解释自由基,C +稳定性。 局限:解释不了不具有芳香性的物质的性质。
二烯烃,共轭体系
一二烯烃 分子中含有不止一个双键的开链烃,按照双键数目的多少,分别叫做二烯烃,三烯烃.....至多烯烃等。其中以二烯烃最为重要。而根据二烯烃中双键位置的不同,又可以分为三类:a 累积二烯烃:两个双键连接在同一个碳原子上。 B 共轭二烯烃:两个双键之间,有一个单键相隔。 C 隔离二烯烃:两个双键之间,有两个或以上的单键相隔。 在这里主要介绍共轭二烯烃的性质。 1共轭二烯烃的结构以及共轭效应: 1,3—丁二烯是最简单的共轭二烯烃,下面就以它为例来说明共轭二烯烃的结构。 在丁二烯分子中,四个碳原子和六个氢原子都处在同一个平面上。其每一个碳原子都是sp2杂化,它们以sp2杂化轨道与相邻的碳原子相互交盖形成碳碳单键,与氢原子的1S轨道形成碳氢单键。分子中一共形成了三个碳碳单键和六个碳氢单键,sp2杂化碳原子的三个σ键指向三角形的三个顶点,三个σ键相互之间的夹角都接近120°。由于每一个碳原子的σ键都排列在一个平面上,所以就形成了分子中所有σ键都在一个平面的结构,此外,每一个碳原子都有一个未参与杂化的p轨道,它们都和丁二烯分子所在的平面垂直,因此这四个p轨道互相平行,在四个碳原子之间都有电子云交盖,从而电子也并不固定在两个原子之间,从而发生离域。也就是说四个电子在四个原子轨道形成的共轭体系中流动,并不固定在某一位置。 2 共轭二烯烃的性质 A 1,2—加成和1,4—加成 共轭二烯烃和卤素,氢卤酸等都容易发生亲电加成,但可产生两种加成产物,如下所示: (1,2—加成产物和1,4—加成产物的键线式) 1,2—加成产物是一分子试剂在同一个双键的两个碳原子上的加成,而1,4—加成产物则是一分子试剂加载共轭双键的两端碳原子上,同时原来的双键变为单键,而双键之间的单间变为双键。1,3—丁二烯之所以有这两种加成方式,与其共轭结构有密切关系。下面以溴化氢与丁二烯的加成来说明这一原理。 丁二烯与溴化氢的加成第一步也是H+的进攻,加成反应可能发生在C(1) 或者C(2)上,然后生成相应的碳正离子(I)和(II)
《二烯烃和共轭体系》习题及答案
《二烯烃和共轭体系》习题及答案 (一)用系统命名法命名下列化合物: CH 2CHCH C(CH 3)2(1)(2)CH 3CH C C(CH 3)2(3)H 2C CHCH CHC CH 2 CH 3 (4) C C HC H 3C H CH 2 【解答】(1)4-甲基-1,3-戊二烯 (2)2-甲基-2,3-戊二烯 (3)2-甲基-1,3,5-己三烯 (4)顺 (或3Z )-1,3-戊二烯 (二)下列化合物有无顺反异构现象?若有,写出其顺反异构体并用Z, E-标记法命名。 (1)2-甲基-1, 3-丁二烯 (2)1, 3-戊二烯 (3)3, 5-辛二烯 (4)1, 3, 5-己三烯 (5)2, 3-戊二烯 【解答】(1)和(5)无顺反异构;(2)有;(3E)-1,3-戊二烯,(3Z)-1,3-戊二烯; (3)(3Z, 5Z)-3,5-辛二烯,(3E, 5E)-3,5-辛二烯,(3Z, 5E)-3,5-辛二烯; (4)有, (3E)- 1,3,5-己三烯,(3Z)- 1,3,5-己三烯 (三)完成下列反应式: HO 2CCH CHCO 2H (1) (2) HC HC (3) CO 2CH 3 CO 2CH 3 H H (4) CO 2CH 3 H H H 3CO 2C (5) (6) (7) (8) +RMgX + + CHO (A) Br 2 (B) + CH 2Cl (B)
(9) (10) 【解答】 COOH COOH (1 ) (2 ) (3 ) 3 3 3 3(4 ) (5 ) ,(6) ,(7)(A ) (B ) (8)(A ) (B ) (9) ,(10) (四)给出下列化合物或离子的极限结构式,并指出哪个贡献大。 (1) ,(2),(3),(4) (5),(6) 【解答】(1) ,第一个贡献大。 CH 3 CH 3 hv H 3H 333O CHO Br Br CH 2Cl HO 2CCH 2CHCH 2CH 2COOH CH 2Cl H CH 3 H 3 H CH 3CH 3 H 3C H 3C H + (CH 3)2C=CH-C(CH 3)2CH 2=CH-CH 3--
共轭二烯烃与合成橡胶
共轭二烯烃与合成橡胶 人工合成橡胶的关键首先是了解它的化学组成,弄清其分子构造,否则人工合成时将无从下手。最早在这方面作出贡献的是英国化学家法拉第等人。1826年,他们通过元素分析得知,天然橡胶成分与异戊二烯(每个分子中含有5个碳原子和8个氢原子的一种无色带刺激气味的液体)有某种联系。后来,又经过许多化学家的研究,才彻底弄清了橡胶的结构和组成“异戊二烯”。 CH 3 H 2C CH 2H CH 3CH 2H cis-1,4-polyisoprene trans-1,4-polyisoprene 天然橡胶杜仲胶 然而有人发现了杜仲胶。杜仲,单科、单属,落叶乔木,是世界上珍惜的孑遗植物. 我国杜仲森林资源总量占全世界95%,种植面积 400万亩,可种植范围远远超过了三叶橡胶树。杜仲胶主要存在于杜仲叶、皮和种子当中,其中叶含胶2-4% ,皮含胶8 -10%,籽含胶10-15%。杜仲胶和天然橡胶的化学组成完全一样,但是二者的性状却迥然不同,原因是二者的分子链的构型不同,天然橡胶是顺式-1,4-聚异戊二烯,为无规线团结构,常温下为优良的高弹性体。杜仲胶为反式-1,4-聚异戊二烯,分子结构微观有序,以折叠链的形式出现,易于堆集而结晶,常温为一种结晶性硬质塑料。由此可知要想获取高弹性的橡胶制品,异戊二烯尽量进行顺式1,4加成为宜。 1889年,F.霍夫曼开始研究异戊二烯的合成和制取合成橡胶的方法。1906年拜耳公司提出对发明者颁发2万马克的重奖以资鼓励。1909年霍夫曼等人将30 g 异戊二烯于200℃温度下加热8天,发现形成了橡胶状物资,从而获得了世界上第一个合成橡胶专利。1910年,霍夫曼建立了中试装置着手制取异戊橡胶。此时,天然橡胶市场价格已上涨到每磅3美元的高价,对合成橡胶研究的时机十分有利,但因单体的生产十分困难,无法扩大生产能力而作罢,中试也再未能继续扩大。但霍夫曼毕竟开创了人工化学合成天然橡胶的先河,被誉为合成橡胶的先驱者。2009年,德国隆重地举行了合成橡胶诞生百年纪念大会。 CH 3H 2C CH 2H 3C 甲基橡胶Cl H 2C CH 2H 氯丁橡胶H H 2C CH 2H 顺丁橡胶 1910年L.康达科夫还找到了同天然橡胶(异戊二烯即甲基丁二烯)类似物2,3-二甲基丁二烯,并采用醇钾取得了又一种橡胶状物,被称之为甲基橡胶。1913年,美国库里派德与埃尔路,从丙硐衍生的频哪醇中制取2,3-二甲基丁二烯的技
《有机化学》(第四版)第四章 二烯烃和共轭体系(习题答案)
第四章 二烯烃和共轭体系 思考题 习题4.1 下列化合物有无顺反异构体?若有,写出其构型式并命名。(P119) (1) 1,3-戊二烯 CH 2=CH CH=CHCH 3 解:有2个顺反异构体! C=C CH 3 H CH 2=CH H C=C H CH 3 CH 2=CH H (Z)- 1,3-戊二烯 (E)- 1,3-戊二烯 (2) 2,4,6-辛三烯 CH 3CH=CH CH=CH CH=CHCH 3 解:有6个顺反异构体! C=C C=C H C=C H H CH 3H H CH 3 H C=C C=C H C=C H CH 3H H H CH 3 H C=C C=C H C=C H CH 3H CH 3H H H (Z,Z,Z)- 2,4,6-辛三烯 (Z,Z,E)- 2,4,6-辛三烯 (E,Z,E)- 2,4,6-辛三烯 C=C C=C C=C H H H H CH 3 CH 3 H H C=C C=C C=C H H CH 3H H H H CH 3C=C C=C C=C H H CH 3H H CH 3 H H (E,E,E)- 2,4,6-辛三烯 (E,E,Z)- 2,4,6-辛三烯 (Z,E,Z)- 2,4,6- 辛三烯 习题4.2 下列各组化合物或碳正离子或自由基哪个较稳定?为什么?(P126) (1) 3-甲基-2,5-庚二烯 和 5-甲基-2,4-庚二烯√ CH 3CH=CCH 2CH=CHCH 3 CH 3 CH 3CH=CHCH=CCH 2CH 3 CH 3 π-π共轭 无π-π共轭 有 (2) (CH 3)2C=CHCH 2CH 3CH=CHCH 2CH 2=CHCH 2、和
二烯烃的共轭效应
二烯烃的共轭效应 §1、二烯烃 一、二烯烃的分类和命名: 二烯烃和炔烃是同分异构体,通式C n H 2n-2 (一) 分类:根据二个烯键在分子中的相对位置分: 累积式的二烯烃 双双双双双双双C 双 双双双 C=C=C CH 2=C=CH 2 共轭式二烯烃 C=C-C=C CH 2=CH-CH=CH 2 双双双双双双双双双双双 1双3双双双 孤立式的二烯烃 C=C-(CH 2)n-C=C n > 1 双双双双双双双双双双双双双 其中:孤立式的二烯烃的性质和单烯烃相似。 每个双键各行其势,相互影响很小。 累积式的二烯烃数量少且实际应用也不多。 共轭式二烯烃在理论和实际应用上都很重要。 所以,我们讨论的是共轭二烯烃,它具有新的,特殊的性质。 (二) 命名:和烯烃相似,主要是分别指出烯键的数目和位置就行 2-双双-1双3-双双双 1双3双5-双三双 | | 双双 双双 CH 2=C CH=CH 2 CH 3 CH 2=CH-CH=CH-CH=CH 2 对多烯烃,每个烯键都可能有顺反构型问题,二个烯键有二个顺反问题,组合起来就有三个顺顺,顺反,反反三种异构体
双双双-2双4-双 双 双(Z),(Z)- C=C CH 3H C=C CH 3 H H H 双双双-2双4双双双 双双双双双(Z),(Z)- 双双双-2双4-双 双 双(E),(E)- (三)1、3丁二烯的构象: CH 2=CH-CH=CH 2 C2双C3 双 双 双 双 双 双 双 双 双 双 双 双 双 双 双 双 C C CH 2CH 2H 双双双双双C2双C3双双 S-双- 1双3-双双双 S-Sigle 双C C CH 2CH 2 H H S-双-1双3双双双双双双双双C2双C3双双双 性质上都是围绕单键旋转产生的,从能量上说S-反稳定,但在化学反应中参加反应时,S-反→S -顺。 二、共轭二烯烃的制法:工业制法 1、 丁烯脱氢: (1) 催化脱氢: CH 2=CH-CH 2-CH 3 CH 3-CH=CH-CH 3 CH 2=CH -CH=CH 2 + H 2
大学-二烯烃和共轭体系习题加答案
大学-二烯烃和共轭体系习题 (一) 用系统命名法命名下列化合物: (1) (2) 4-甲基-1,3-戊二烯 2-甲基-2,3-戊二烯 (3) (4) 2-甲基-1,3,5-己三烯 (3Z)-1,3-戊二烯 (二) 下列化合物有无顺反异构现象:若有,写出其顺反异构体并用Z,E-命名法命名。 解:(1) 无; (2) 有;(3E)-1,3-戊二烯, (3Z)-1,3-戊二烯; (3) 有;(3Z,5Z)-3,5-辛二烯, (3Z,5E) -3,5-辛二烯,(3E,5E) -3,5-辛二烯; (4) 有;(3E)-1,3,5-己三烯, (3Z)-1,3,5-己三烯; (5) 无 (三) 完成下列反应式: 解:红色括号中为各小题所要求填充的内容。 (1) (2) (3) (4) CH 2=CHCH=C(CH 3)2CH 3CH=C=C(CH 3)2CH 2=CHCH=CHC=CH 3 CH 3 C=C CH=CH 2 CH 3 H H (1)2-甲基-1,3-丁二烯(2)1,3-戊二烯(3)3,5-辛二烯(4)1,3,5-己三烯(5)2,3-戊二烯+ HOOCCH=CHCOOH CH CH + 3 3 H +COOCH 3COOCH 3H H 3 3 H H + H COOCH 3H CH 3OOC
(5) (6) (7) (8) (9) (10) (四) 给出下列化合物或离子的极限结构式,并指出哪个贡献最大? (2) (3) (4) (5) (6) 解: (1) 贡献最大(非电荷分离) (2) 结构相似,二者贡献一样大 (3) 结构相似,二者贡献一样大 + RMgX MgX + RH + 3 CHO + CH 2Cl + CH 2Cl KMnO + HOOCCH 2CHCH 2CH 2COOH CH 2Cl (A)(B) CH 3 3 3 3 CH CH 33 CH 3 H CH 3CH 3 CH 3 (1)CH 3C N (CH 3)2C=CH C(CH 3)2CH 2=CH CH 2CH 2 C CH 3 CH 3 C CH=CH 2CH 3C N CH 3C N CH 3C N (CH 3)2C=CH C(CH 3)2 (CH 3)2C CH=C(CH 3)2CH 2=CH CH 2 CH 2 CH=CH 2
共轭二烯烃的结构和共轭效应
3.2.2 共轭二烯烃的结构和共轭效应Structures and Conjugative Effects of Conjugated Dienes (1)共轭二烯烃的结构。在共轭二烯烃中,最简单的是1,3-丁二烯,下面 我们就以它为例来说明共轭二烯烃的结构。 根据近代物理方法测定,1,3-丁二烯中碳碳双键的键长是0.135nm,碳碳单 键的键长是0.148 nm,也就是说,它的双键比乙烯的双键(0.134 nm)长,而单键 却比乙烷的单键(0.154 nm)短。这说明1,3-丁二烯的单、双键较为特殊,键长趋 于平均化。 杂化轨道理论认为,在1,3-丁二烯中,4个sp2杂化轨道的碳原子处在同一 平面上(图3.6),每个碳原子上未杂化的p轨道相互平行,且都垂直于这个平面。 这样,在分子中不仅C1、C2和C3、C4间各有一个π键,C2、C3间的p 轨道从 侧面也有一定程度的重叠(图3.6),使4个p电子扩展到四个碳原子的范围内运 动,每两个碳原子之间都有π键的性质,组成一个大π键,这种共轭体系 称为π-π共轭体系。在共轭体系中,π电子Array不再局限于成键两个原子之间,而要扩展 它的运动范围,这种现象称为电子离域。 电子离域范围愈大,体系的能量愈低,分 图3.6 1,3-丁二烯分子中π键所在平面与纸面垂直子就愈稳定。 共轭体系的各原子必须在同一平面上,每一个碳原子都有一个未杂化且垂直于该平面的p轨道,这是形成共轭体系的必要条件。 按照分子轨道理论,4个p电子可以组成4个分子轨道,两个成键轨道(ψ1、ψ2)、 两个反键轨道(ψ3、ψ4),如图3.7。
图3.7 1,3-丁二烯的原子轨道和π分子轨道图形 从图中可以看出,ψ1在键轴上没有节面,而ψ2、ψ3、ψ4各有1个、2个、3个节面。节面上电子云密度等于零,节面数目越多能量越高。ψ4有3个节面,所有碳原子之间都不起成键作用,是能量最高的强反键;ψ3有2个节面,能量比只有1个节面的ψ2高,ψ3为弱反键;ψ2为弱成键分子轨道;ψ1没有节面,所有碳原子之间都起成键作用,是能量最低的成键轨道。在基态时,4个p 电子都在ψ1和ψ2,而ψ3和ψ4则全空着。另一方面,分子轨道ψ1和ψ2叠加,不但使C 1和C 2、C 3和C 4之间的电子密度增加,而且也部分地增大了C 2和C 3之间电子密度,使之与一般的σ键不同,而且有部分双键的性质。 (2)共轭效应。 ① π-π共轭效应。在1,3-丁二烯的结构中,我们知道4个π电子已经不是局限在2个碳原子之间,而是在4个碳原子的分子轨道中运动,从而便得分子中电子云密度的分布有所改变,内能变小,分子更加稳定,键长趋于平均化,这样产生的效应称为共轭效应。象1,3-丁二烯一类的分子,共轭效应是由于单、双键交替排列所引起的称为π-π共轭效应。共轭效应的特点是: a. 共平面性:共轭体系中所有的原子都在同一个平面上; b. 键长趋于平均化; c. 共轭体系能量显著降低,稳定性明显增加。例如1,3-戊二烯和1,4-戊二烯氢化 都得到戊烷,但测得的氢化热不同: CH 2=CH-CH=CH 2-CH 3 + H 2 CH 3CH 2CH 2CH 2CH 3 ΔH =-226.4 kJ ·mol -1 CH 2=CH-CH 2-CH=CH 2 + H 2 CH 3CH 2CH 2CH 2CH 3 ΔH =-254.4 kJ ·mol -1 由此可见:共轭的1,3-戊二烯比非共轭的1,4-戊二烯的能量低28kJ ·mol -1,这个数值称为离域能或共轭能。离域能愈大,分子愈稳定。 d. 共轭效应能沿共轭链传递且无逐渐消失的现象。 ② p -π共轭效应和超共轭效应。p -π共轭效应是由于π键与相邻的p 轨道相互重叠而产生的。氯乙烯是一个最简单的例子。在氯乙烯分子中,所有的原子都在同一个平面,氯原子未公用电子对之一占据的p 轨道与π键的p 轨道相互平行重叠,形成p -π共轭体系。如图3.8所示。在此共轭体系中,碳原子上的p 轨道只有一个电子,而氯原子的p 轨道中有2个电子,共轭链上电子云密度平均化的结果是氯原子中参加共轭的一对p 电子要向π键转移。 p-π共轭效应 诱导效应 2 CH CH 2 CH Cl H
不饱和烃,共轭二烯烃
不饱和烃,共轭二烯烃章节选择题 1.下列化合物中碳原子杂化轨道为sp2的有:() A. CH3CH3 B. CH2=CH2 C. C6H6 D. CH≡CH 2.环己烯加氢变为环己烷是哪一种反应? ( ) A. 吸热反应 B. 放热反应 C. 热效应很小 D. 不可能发生 3.下列化合物氢化热最低的是?( ) A. 1,3-戊二烯 B. 1,4-戊二烯 C. 1,3-丁二烯 4.CH3CH2C≡CH与CH3CH=CHCH3可用哪种试剂鉴别? ( ) A. 硝酸银的氨溶液 B. Br2的CCl4溶液 C. 三氯化铁溶液 D. 酸性KMnO4溶液
5. 下列化合物中的碳为SP杂化的是:( )。 A. 乙烷 B. 乙烯 C. 乙炔 D. 苯 6.下列烯烃中最不稳定的是(). A. 2,3-二甲基-2-丁烯 B. 2-甲基-2-戊烯 C. 反-2-丁烯 D. 顺-2-丁烯 7.下列烯烃中最稳定的是(). A. 2,3-二甲基-2-丁烯 B. 2-甲基-2-戊烯 C. 反-2-丁烯 D. 顺-2-丁烯 8. 下列化合物与溴加成反应时速度最快的是()。 A. (CH3)2CH=CH2 B. CH2=CH2 C. CH2=CH-CH2Cl D. CH2=CH-F 9.烯烃亲电加成是通过()历程来进行的。 A. 碳正离子 B. 自由基 C. 溴翁离子 D. 碳负离子
10.下列烯烃氢化热(KJ/mol )最低的是( )。 A. CH 2CH 3CH 2CH B. H C CH 3CH 3 H C C. H C CH 3 CH 3H C D. CH C (CH 3)2CH 3 11.下列化合物与Br 2/CCl 4加成反应速度最快的是( )。 A. CH 3CH=CH 2 B. CH 2=CHCH 2COOH C. CH 2=CHCOOH D. (CH 3)2C=CHCH 3 12. 下列化合物与溴加成反应时速度最慢的是( )。 A. (CH 3)2CH=CH 2 B. CH 2=CH 2 C. CH 2=CH-CH 2Cl D. CH 2=CH-F 13. 下列化合物常温、常压是液体的是( ) A. 丁烷 B. 丁烯 C. 丁醇 D. 异丁烷 答案:C
