乳酸菌的培养检测方案

品质管理检测项目
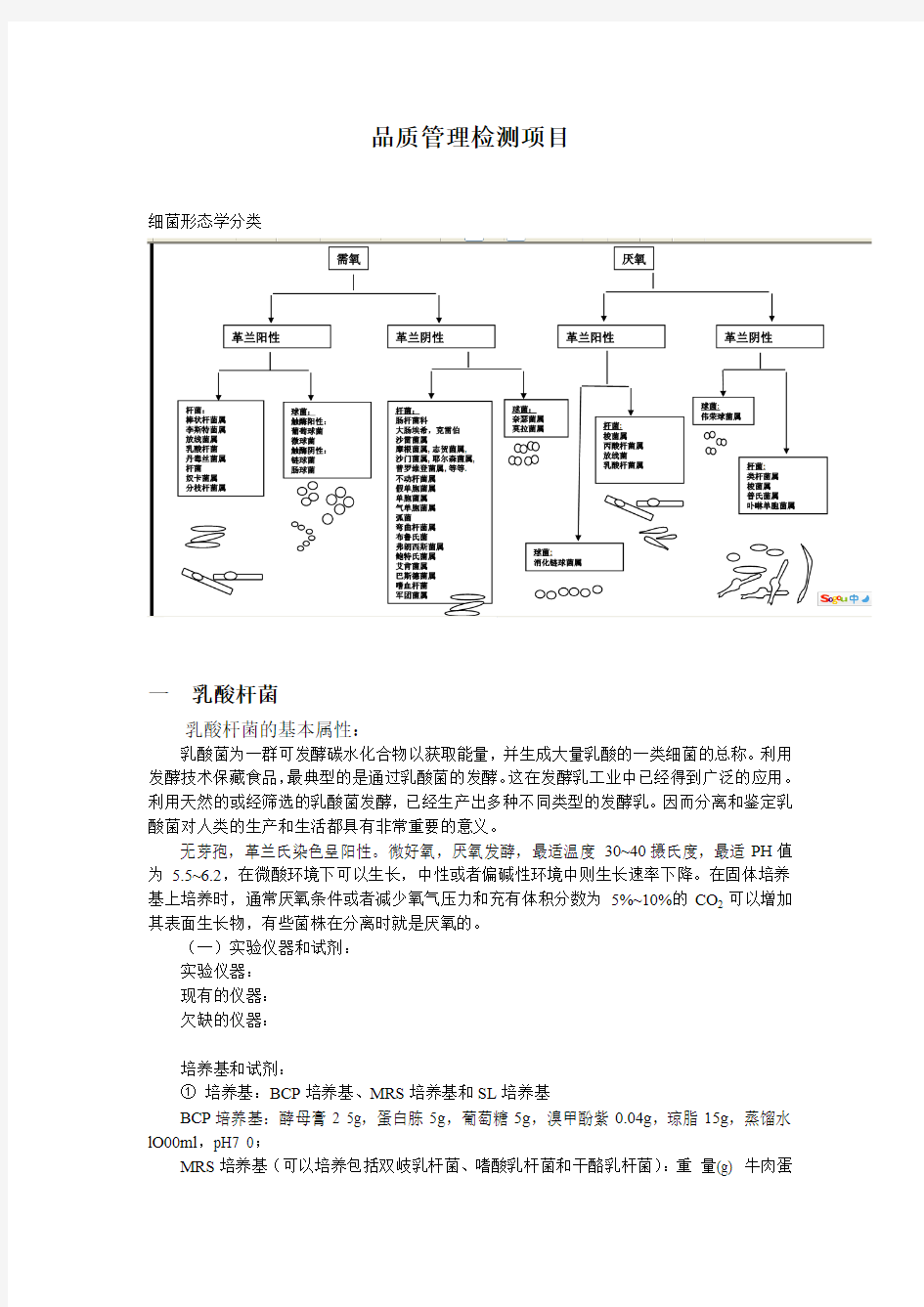
细菌形态学分类
一乳酸杆菌
乳酸杆菌的基本属性:
乳酸菌为一群可发酵碳水化合物以获取能量,并生成大量乳酸的一类细菌的总称。利用发酵技术保藏食品,最典型的是通过乳酸菌的发酵。这在发酵乳工业中已经得到广泛的应用。利用天然的或经筛选的乳酸菌发酵,已经生产出多种不同类型的发酵乳。因而分离和鉴定乳酸菌对人类的生产和生活都具有非常重要的意义。
无芽孢,革兰氏染色呈阳性。微好氧,厌氧发酵,最适温度30~40摄氏度,最适PH值为5.5~6.2,在微酸环境下可以生长,中性或者偏碱性环境中则生长速率下降。在固体培养基上培养时,通常厌氧条件或者减少氧气压力和充有体积分数为5%~10%的CO2可以增加其表面生长物,有些菌株在分离时就是厌氧的。
(一)实验仪器和试剂:
实验仪器:
现有的仪器:
欠缺的仪器:
培养基和试剂:
①培养基:BCP培养基、MRS培养基和SL培养基
BCP培养基:酵母膏2 5g,蛋白胨5g,葡萄糖5g,溴甲酚紫0.04g,琼脂15g,蒸馏水lO00ml,pH7 0;
MRS培养基(可以培养包括双岐乳杆菌、嗜酸乳杆菌和干酪乳杆菌):重量(g) 牛肉蛋
白粉10 ,鱼肉汁10 ,酵母浸出汁粉5 ,葡萄糖20 ,醋酸钠5 ,柠檬酸二铵 2 ,吐温80 0.1 ,硫酸镁0.58 ,硫酸锰0.28 ,蒸溜水1 000ml ,备注:用高压锅在121℃灭菌15min,调节pH6.2~6.4 。
乳酸杆菌选择性琼脂SL:酪蛋白水解物10g;酵母提取物5g;柠檬酸二铵2g;乙酸钠(CH3COONa?3H2O)25g;MgSO4?7H2O 0.58g;琼脂15g;葡萄糖20g;吐温80 1.0ml;磷酸氢二钾6g;FeSO4?7H2O 0.03g;MnSO4?4H2O 0.15g。以上用量为1000ml培养基的用量。溶解琼脂在500ml的沸水中,溶解其他组分在500ml的水中,用冰醋酸调pH=5.4,并混合已融化的琼脂,进一步煮沸5分钟,倾倒平板或此热的培养基适量分装入灭菌的试管,这样无需进一步灭菌,避免重复融化和冷却。
乳酸杆菌在液体培养基中的生长状况
背景资料:
培养基有MRS培养基、RS MA培养基、番茄汁琼脂培养基。当乳酸杆菌是待分离区系的优势菌时,常用MRS培养基对其进行分离。一些常见的食品污染菌如金黄色葡萄球菌、大肠杆菌等在MRS培养基上生长较差或几乎不生长,从而减少了杂菌的污染,降低了分离难度。目前MRS培养基已经成为国标上公认的用于乳酸杆菌分离较好的培养基。常用于从乳酸杆菌发酵制品中分离菌种以及菌种分离后的传代培养。
番茄汁琼脂培养基,这是一种传统的用于分离乳酸杆菌的培养基,此种培养基由于含有一定量的番茄汁,为乳酸杆菌的生长提供必要的营养,使得乳酸杆菌在此环境下更容易生长。但由于配置过程中需要制备新鲜番茄汁,所以操作起来较为费时费力,目前已逐渐被MRS 等培养基所代替。
某些选择性培养基可用于从菌群复杂的基质(例如肠道) 内进行乳酸杆菌的分离。APT( All Purpose Tween) 培养基通常用于从肉制品中分离乳酸杆菌,改良的Rogosa SL( Rogosa Sodium Lactate Modified ) 完全选择性培养基则常用于胃肠内容物中乳酸杆菌的分离。Briggs琼脂培养基和s L( Sodium Lactate) 培养基常用于酸奶中乳酸杆菌分离。
(二)检测内容、流程、方式:
内容:1 通过对水体当中的的乳酸杆菌的筛选培养,最后计数得到相应水体当中的乳酸杆菌的数量。方法为:逐级稀释法。2 乳酸杆菌的定性
流程:
①采集:每个采集点各自采集10ml的池塘水,经过过滤杂质(固体),冷冻运送等环节送到实验室内部。
②稀释平板测数法
1、样品稀释液的制备
准确称取待测样品10g,放入装有90mL无菌水并放有小玻璃珠的250mL三角瓶中,用手或置摇床上振荡20min,使微生物细胞分散,静置20~30s,即成10-1稀释液;再用1mL 无菌吸管,吸取10-1稀释液1mL,移入装有9mL无菌水的试管中,吹吸3次,让菌液混合均匀,即成10-2稀释液;再换一支无菌吸管,吸取10-2稀释液1mL,移入装有9mL无菌水的试管中,也吹吸3次,即成10-3稀释液;以此类推,连续稀释,制成10-4、10-5、10-6、10-7、10-8、10-9等一系列稀释菌液。
用稀释平板计数时,待测菌稀释度的选择应根据样品确定。样品中所含待测菌的数量多时,稀释度应高,反之则低。通常测定细菌菌剂含菌数时,采用10-7、10-8、10-9稀释度,测定土壤细菌数量时,采用10-4、10-5、10-6稀释度,测定放线菌数量时,采用10-3、10-
4、10-5稀释度,测定真菌数量时,采用10-2、10-3、10-4稀释度。
2、平板接种培养
平板接种培养有混合平板培养法和涂抹平板培养法两种方法。
⑴混合平板培养法
将无菌平板编上10-7、10-8、10-9号码,每一号码设置三个重复,用无菌吸管按无菌操作要求吸取1×10-9稀释液各1mL放入编号10-9的3个平板中,同法吸取10-8稀释液各1mL放入编号1×10-8的3个平板中,再吸取1×10-7稀释液各1mL放入编号1×10-7的3个平板中,由低浓度向高浓度时,吸管可不必更换。然后在9个平板中分别倒入已熔化并冷却至45~50℃的细菌培养基,轻轻转动平板,使菌液与培养基混合均匀,冷凝后倒置,在30℃下培养。至菌落长出后即可计数。
⑵涂抹平板计数法
涂抹平板计数法与混合法基本相同,所不同的是先将培养基熔化后趁热倒入无菌平板中,待凝固后编号,然后用无菌吸管吸取0.1mL菌液对号接种在不同稀释度编号的琼脂平板上,每个编号设三个重复。再用无菌刮铲将菌液在平板上涂抹均匀,每个稀释度用一个灭菌刮铲,更换稀释度时需将刮铲灼烧灭菌。在由低浓度向高浓度涂抹时,也可以不更换刮铲。将涂抹好的平板平放于桌上20~30min,使菌液渗透入培养基内,然后将平板倒转,保温培养,至菌落长出后即可计数。
⑶划线法(不采用,因为需要对乳酸菌和大肠杆菌进行筛选培养):
用灭菌接种环沾取10-1稀释液1环于已凝固的平板上进行划线(图示)。划线可按以下两种方式进行,一种为交叉划线法,是在平板的一边做第一次“Z”字形划线。转动培养皿70°角,将接种环在火上烧过并冷却后,通过第一次划线部分,做第二次“Z”字形划线。同法进行第三次、第四次划线。另一种为边疆划线法,是从平板边缘的一点开始,连续作紧密的波浪式划线,直至平板中央。转动培养皿180°,再从平板另一边(不烧接种环)同样划线至平板中央。划线法实质上属于一种“由点到线”的稀释法,较适用于含菌比较单一的材料的纯化,对于土壤这类微生物高度混杂的样品则较少使用。
以上各种分离法,都应按无菌操作进行。所用的培养基若在倒平板前,按50μg/m L 的量加入用乙醇溶解的制霉菌素或放线菌酮(起抑制霉菌的作用),效果会更好。
3、培养(16个小时即可)
将上述接种过土壤悬液的平板倒置,于28~30℃培养,至长出菌落为止(24~36h)。
4、挑菌纯化
在平板上选择分离较好的有代表性的单菌落接种斜面,同时作涂片检查,若发现不纯,应挑取此菌落做进一步划线分离,或制成菌悬液再做稀释分离,直至获得纯培养体。
5、计数
选取混菌法和涂抹法中每皿菌落数30~300的平板,分别按“稀释平板测数法”中的“混合平板测数法”和“涂抹平板测数法”中的公式计数。这样求得的是每克原始土样中的活菌数,若要折算为每克干土的含菌数,还应将此数值除以干土在土样中所占的质量分数(烘干土的质量/原土样的质量)。
(四)数据的收集整理:数据库模板的建立
二大肠杆菌
(一)大肠杆菌的基本属性:
(二)仪器和试剂:
仪器:
试剂:
液态培养基:配制每升培养基,应该在950 ml去离子水中加入: 胰化蛋白胨10g,酵母提取物5g ,NaCl 10g 。摇动容器直至溶质溶解.用5mol/LNaOH调pH至7.0.用去离子水定容至1L.在15psi高压下蒸汽灭菌20min。
固态培养基:LB固体培养基1L和液体一样,加15g琼脂粉,一定要在温度降下之前加好抗生素,并且倒好板。LB固体培养基倒板
1.配制:100mlLB培养基加入1.5g琼脂粉。
2.抗生素的加入:高压灭菌后,将融化的LB固体培养基置与55℃的水浴中,待培养基温度降到55℃时(手可触摸)加入抗生素,以免温度过高导致抗生素失效,并充分摇匀。
3.倒板:一般10ml倒1个板子。培养基倒入培养皿后,打开盖子,在紫外下照10-15分钟。
4.保存:用封口胶封边,并倒置放于4℃保存,一个月内使用。
(1)普通培养基:固体培养基是在液体培养基中加1.5%琼脂制成,先配液体培养基,然后加入1.5%琼脂,高压灭菌20min,取出后再无菌状态下铺平板
(2)选择性培养基:将消毒好的固体培养基置室温下冷却50℃时加抗生素或其他必加成分,摇匀后倒入灭菌皿中厚度2-3mm, 室温固化。(抗生素用三蒸水溶解后,用无菌滤头过滤到无菌瓶中, 氨苄青霉素终浓度50μl/ml)新制备的固体培养基较湿,铺上的液体不易吸收,可在室温下放2-3天,或37℃放半小时,然后4℃保存备用。
(3)LB培养基中所用抗生素终浓度:氨苄青霉素-50μl/ml;氯霉素-20μl/ml;庆大霉素
-15μl/ml;卡那霉素-30μl/ml;春日霉素-1000μl/ml;壮观霉素-100μl/ml;链霉素-30μl/ml;四环素-12μl/ml。
(三)培养检测方法:
乳品中大肠杆菌检测国标GB/T4789.38-2008的具体步骤及达标的标准:
第一法大肠杆菌MPN 计数
操作步骤
6.1、样品的稀释
6.1.1、固体和半固体样品:以无菌操作取259 样品,置盛有225 mL 磷酸盐缓冲液的无菌均质杯内,8000r / min ~1000r/ min 均质1 min~2 min ,制成l:10 样品匀液,或置盛有225 mL 磷酸盐缓冲液的无菌均质袋中,用拍击式均质器拍打1 min~2 min 制成1:10 的样品匀液。
6.1.2、液体样品:以无菌吸管吸取样品25 mL 置盛有225 mL 磷酸盐缓冲液的无菌锥形瓶(瓶内预置适当数量的玻璃珠)中,充分振摇,制成1:10 的样品匀液。
6.1.3、样品匀液的pH 值应在6.5~
7.5 之间,必要时分别用1mol/L 氢氧化钠(NaOH)或1mol/L 盐酸(HCI)调节。
6.1.4、用1mL 无菌吸管或微量移液器吸取1:10 样品匀液1mL ,沿管壁徐徐注人盛有9 mL 磷酸盐缓冲液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管或吸头反复吹打,使其棍合均匀,制成1:100 的样品匀液。
6.1.5、根据对样品污染状况的估计,按上述操作,依次制成10 倍递增系列样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15 min 。
6.2、初发酵试验
每个样品,选择3 个适宜的连续稀释度的样品匀液(液体样品可以选择原液)。每个稀释度接种3 管月桂基磺酸盐胰蛋白陈(LST )肉汤,每管接种1 mL(如接种量超过1 mL ,则用双料LST 肉汤)。36℃±1℃培养24h±2h ,观察小倒管内是否有气泡产生,如未产气则继续培养至48h±2h 。记录在24h~48h 内产气的LST 肉汤管数。如所有LST 肉汤管均未产气,即可报告大肠杆菌MPN 结果;如有产气者,则进行复发酵试验。
6.3、复发酵试验用接种环分别从所有培养48h±2h 内发酵产气的LST 肉汤管中取培养物1 环,移种于已提前预温至45 ℃的EC 肉汤管中,放人带盖的44.5℃ ±2 ℃水浴箱内。水浴的水面应高于肉汤培养基液面,培养24h±2h ,检查小倒管内是否有气泡产生,如未产气则继续培养至48h ±2h 。记录在24h 和48h 内产气的EC 肉汤管数。如所有EC 肉汤管均未产气,即可报告大肠杆菌MPN 结果;如有产气者,则进行EMB 平板分离培养。
6.4、伊红美蓝平板分离培养轻轻振摇各产气管,用接种环取培养物划线分别接种于EMB 平板,36 ℃ ±1 ℃培养18h~24h 。检验平板上有无具黑色中心有光泽或无光泽的典型菌落。
6.5、营养琼脂斜面或平板培养从每个平板上挑5 个典型菌落,如无典型菌落则挑取可疑菌落。用接种针接触菌落中心部位,移种到营养琼脂斜面或平板上,36 ℃ ±1 ℃,培养18h~24h 。取培养物进行革兰氏染色和生化试验。
6.6 、生化试验
6.6.1、靛基质试验:将培养物接种蛋白陈水,36 ℃±1℃培养24h±2h 后,加Kovacs 靛基质试剂0.2 mL~0.3 mL ,上层出现红色为靛基质阳性反应。
6.6.2 、MR -VP 试验:将培养物接种MR -VP 培养基,36 ℃ ±1 ℃培养48h±2h 。移取培养物1mL至13 mm×100mm 试管中,加5 % α-蔡酚乙醇溶液0.6mL、40 %氢氧化钾溶液0.2mL 和少许肌酸结晶,振摇试管后静置2h ,如出现伊红色,为VP 试验阳性。将MR 一VP 培养液的剩余部分再培养48h 后滴加5 滴甲基红指示剂。培养物变红色,为甲基红试验阳性,若变黄色则为阴性反应。
6.6.3、柠檬酸盐利用试验:将培养物接种Koser 氏柠檬酸盐肉汤,36℃±1 ℃培养96h±2h,记录有无细菌生长。
6.7、大肠杆菌MPN 计数的报告大肠杆菌为革兰氏阴性无芽胞杆菌,发酵乳糖、产酸、产气,IMViC 生化试验为++- -或-+- -。只要有 1 个菌落鉴定为大肠杆菌,其所代表的
LST 肉汤管即为大肠杆菌阳性。依据LST 肉汤阳性管数查MPN 表,报告每克(或毫升)样品中大肠杆菌MPN 值。
第二法大肠杆菌VRB - - MUG 平板计数法
8、样品稀释按6.1 进行。
9、检验选取2 个~3 个适宜的连续稀释度的样品匀液,每个稀释度分别取1 mL 注人两个无菌平皿。另取1 mL 稀释液注人一个无菌平皿中,作空白对照。将45 ℃±0.5 ℃的VRB 琼脂10 mL~15 mL 倾注于每个平皿中。小心旋转平皿,将培养基与样品匀液充分混匀。待琼脂凝固后,再加3 mL~4mL VRB-MUG 琼脂覆盖平板表层。凝固后翻转平板,36 ℃±1 ℃培养18h~24h 。选择菌落数为10~100 的平板,暗室中360 nm~366 nm 波长紫外灯照射下,计数平板上发浅蓝色荧光的菌落。检验时用已知MUG 阳性菌株(如大肠杆菌ATCC 25922 )和产气肠杆菌(如A TCC 13048 )做阳性和阴性对照。
10、大肠杆菌平板计数的报告两个平板上发荧光菌落数的平均数乘以稀释倍数,报告每克(或毫升)样品中大肠杆菌数,以CFU/g ( CFU /mL )表示。
第三法大肠杆菌PetrifilmTM 测试片计数法
12、样品稀释按6.1 进行。
13、检验
13.1、接种和培养
选取2 个~3 个适宜的连续稀释度的样品匀液,每个稀释度接种两张测试片。将测试片置于平坦实验台面,。揭开上层膜,用吸管吸取样品匀液1ml匀液垂直滴加在测试片的中央,将上层膜缓慢盖下,避免气泡产生和上层膜直接落下,将压板(平面底朝下)放置在上层膜中央处,轻轻地压下,使样品匀液均匀覆盖于圆形的培养膜表面,切勿扭转压板。拿起压板,静置至少1 min 以使培养基凝固。将测试片的透明面朝上置于培养箱内,堆叠片数不超过20 片,36℃±1 ℃培养。肉、家禽和水产品,培养时间为24h±2h;其他食品,培养时间为48h±2h 。
13.2、判读
可肉眼观察计数,或用菌落计数器、放大镜、PetrifilmTM 自动判读仪计数。蓝色有气泡的菌落确认为大肠杆菌,不论蓝色的深浅,部分蓝色的带气泡菌落也判定为大肠杆菌。圆形培养膜边缘及边缘以外的菌落不计数。当测试片出现大量气泡、不明显的小菌落,培养区呈蓝色时,需要进一步稀释样品匀液,重新检验。
14 大肠杆菌测试片计数的报告选择菌落数在15~150 之间的稀释度,两张测试片菌落平均数乘以稀释倍数,即为每克(或毫升)样品中大肠杆菌数,以CFU/g ( CFU/mL )表示。
如果所有稀释度测试片上的菌落数都小于15 ,计数最低稀释度测试片上的平均菌落数乘以稀释倍数报告;如果所有稀释度的测试片上均无菌落生长,以“小于1 乘以最低稀释倍数”报告;如果所有稀释度的菌落数都大于150 ,计数最高稀释度测试片上的平均菌落数乘以稀释倍数报告。计数菌落数大于150 个的测试片时,可计数一个或两个具有代表性的方格内的菌落数,换算成单个方格内的菌落数后乘以20 ,即为测试片上估算的菌落数(圆形生长面积为20 cm " )。
(四)数据库模板的建立:
三一般细菌
(一)一般细菌的基本属性:
(二)仪器和试剂:
(三)培养检测方法:
(四)数据库模板的建立:四寄生虫
建筑节能检测方法综述
建筑节能现场检测方法 田斌守 摘要本文综述了几种建筑物围护结构传热系数现场检测方法的原理、操作方法、适用条件,指出各种方法的优缺点及注意事项。 关键词建筑节能检测热流计法热箱法控温箱-热流计法非稳态法当今飞速发展的国民经济活动必然导致前所未有的资源能源消耗速度。而许多资源能源是不可再生的,为了人类的可持续发展,节约能源刻不容缓。据介绍,我国目前单位建筑面积采暖能耗相当于气候条件相近的发达国家的2~3倍,而建筑能耗也占全国能耗总量的27.5%。随着人民生活水平的不断提高、城市化进程的加快以及住房体制改革的深化,建筑能耗在我国增长趋势很大,很可能是我国今后能耗的一个主要增长点。为建设节约型社会,促进经济社会可持续发展,国家发展委员会发布了“节能中长期专项规划”,建筑节能作为三大重点领域中的一项,受到高度重视。建设部也相继发布了一系列建筑节能标准,其中包括若干强制性条款,目前正在建设领域逐步实施。 建筑节能工作从流程上可分为设计审查、现场检测、竣工验收三个大的阶段。对节能建筑的评价,从建设前期对施工图纸审查计算阶段、向现场检测和竣工验收转移是大势所趋。建筑节能现场检测也是落实建筑节能政策的重要保证手段。目前,全国范围内建筑节能检测都执行JGJ132-2001《采暖居住建筑节能检验标准》,它是最具权威性的检测方法,它的发布实施,为建筑节能政策的执行提供了一个科学的依据,使得建筑节能由传统的间接计算、目测定性评判到现在的直接测量,从此这项工作进入了由定性到定量、由间接到直接、由感性判断到科学检测的新阶段。 根据我们对建筑节能影响因素和现场检测的可实施性的分析,我们认为能够在实验室检测的宜在实验室检测(如门窗等作为产品在工程使用前后它的性状不会发生改变),除此之外,只有围护结构是在建造过程中形成的,对它的检测只能在现场进行。因此建筑节能现场检测最主要的项目是围护结构的传热系数,这也是最重要的项目。如何准确测量墙体传热系数是建筑节能现场检测验收的关键。目前对建筑节能现场检测的、围护结构(一般测外墙和屋顶、架空地板)的
MTT法测定乳酸菌活菌数的研究
62 MTT法测定乳酸菌活菌数的研究 黄立坤,杜鹏2,霍贵成* 乳品科学教育部重点实验室(东北农业大学) (哈尔滨 150030) 摘要建立一种快速、稳定、灵敏并可反映细菌活性的细菌计数方法。以乳酸菌中的保加利亚乳杆菌和嗜热链球菌为研究对象,探讨MTT法用于细菌计数的可行性及测量细菌数量的范围、反应时间、MTT 的用量、是否加入溶解剂等实验条件。结果:保加利亚乳杆菌在(1.0×105~2.18×107) cfu/mL内测出的OD 570值与细菌浓度呈良好的正相关,反应时间1.5 h,MTT添加量20 μL,测量前用DMSO溶解;嗜热链球菌在(2.0×105~5.12×107) cfu/mL范围内测出的OD 570值与细菌浓度呈良好的正相关,反应时间2.0 h,MTT添加量20 μL,可不添加溶解剂直接测量。MTT比色分析法可用于检测乳酸菌活菌数量。关键词MTT;保加利亚乳杆菌;嗜热链球菌;活菌计数 Inquiring into the Method of Counting Live Germ with MTT Abstract To establish a rapid, steady and sensitive bacteria-counting method that could reflect the bacteria’s activity. Lactabacillus delbrueckii ssp. bulgaricus and St reptococcus thermophilus were employed to discuss the feasibility of application of MTT method to bacteria-counting and determine the conditions of the assay, including linear range, reaction time, MTT dosage and whether solvent is added etc.. Results: The optical density at 570 nm is positively related to the concentration of L.delbrueckii ssp. bulgaricus when the number of the bacteria is in the range of (1.0×105~2.18×107) cfu/mL, and reacting time is 1.5 h, MTT dosage is 20 μL, and DMSO is used as solvent before assay; For St.thermophilus , the optical density at 570 nm is positively related to the concentration of the bacteria when the number of the bacteria is in the range of (2.0×105~5.12×107) cfu/mL, and reacting time is 2.0 h, MTT dosage is 20 μL and solvent is not added.. Conclusion: MTT colorimetry could be used to measure the viability of lactic acid bacteria. Keywords MTT colorimetry ;lactobacillus bulgaricus ;Streptococcus thermophilus ;live germ counting 基金项目:国家科技基础条件平台项目(2005DKA21204-08)资助。* 通讯作者 活菌计数在科研生产中有着广泛的应用,用于细菌计数的常规方法有平板稀释计数法(SPC),自动菌数测定仪法,浊度法,菌体干重法等。SPC法为经典方法,但方法繁琐,耗时长,不能及时反映菌体生长情况,不适合于做大批量的实验;后几种方法不能区分细胞的死活,且测定结果受培养基、代谢产物的影响较大[1]。试验用MTT快速活菌计数法,以克服上述缺点,且工作量小,操作简单,快速,重复性好,能区分死活菌等。 MTT是一种噻唑盐,化学名3-(4,5-二甲基-2-噻唑)-2,5-二苯基溴化四唑,结构式如图1。MTT法基本原理是活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT的四唑环还原为难溶性的蓝紫色结晶物甲臜(Fonmazan),而死细胞无此作用[2]。形成的甲臜颗粒沉积于细胞内或细胞周围,在一定细胞浓度范围内,其生成量与细胞数目和/或细胞活性呈正相关,用二甲亚砜(DMSO)溶解所生成的甲臜,通过检测光密度值变化,可间接反映细胞生长及增殖活性[3]。1 材料与方法 1.1 材料 图1 MTT的分子结构式 1.1.1 菌种 保加利亚乳杆菌(L . delbrukki subsp. bulgaricus ,L.b )1.8501菌株和嗜热链球菌(S .thermophilus ,S.t )3.8501菌株,均为乳品科学教育部重点实验室(KLDS )提供。1.1.2 试剂及溶液 (1)试剂:MTT,二甲亚砜(DMSO)。 (2)MTT溶液配制:称取100 mg MTT (Amresco 分装)于小烧杯中。加20 m L P B S (0.0l m o l /L ,pH=7.2),使其充分溶解,用0.22 μm微孔过滤器除菌,分装于1.5 mL的EP管中,4℃避光保存。两周内使用,时间过长,溶液中易进微生物起反应,改变MTT溶液的浓度。
腐乳中乳酸菌的分离与鉴定_王夫杰
腐乳中乳酸菌的分离与鉴定 王夫杰1,鲁绯1*,渠岩2,张建1,黄持都1 (1.北京市食品酿造研究所,北京 100050;2.中国农业大学食品科学与营养工程学院,北京 100083) 摘要:文章主要对青方、白方和红方腐乳中的乳酸菌进行了分离鉴定。从青方和白方腐乳中分别分离到乳酸菌7株和5株,红方中没有分离到乳酸菌。鉴定结果表明,白方中4株为鼠李糖乳杆菌,1株清酒乳杆菌;青方中有1株为植物乳杆菌,1株干酪乳杆菌,3株鼠李糖乳杆菌,2株清酒乳杆菌。最后,对不同菌株的耐盐性和耐酒精性进行了测试。 关键词:腐乳;乳酸菌;分离;鉴定 中图分类号:T S264.25 文献标识码:B 文章编号:1000-9973(2010)07-0098-04 Separation an d identification of lactic acid bacteria isolated from Su fu WANG Fu jie1,LU Fei1*,QU Yan2,ZH ANG Jian1,H UANG Chi du1 (1.Beijing Foo d Brew ing Institute,Beijing100050,China; 2.Fo od Science and Nutr itional Engineering Co lleg e of China A gricultural U niv ersity,Beijing100083,China) Abstract:The lactic acid bacteria in gr ey Sufu、w hite Sufu and red Sufu w er e separated and identify. Seven str ains w ere isolated from gr ey Sufu,five strains w ere iso lated fr om w hite Sufu,no o ne w as i solated fr om red Sufu.The identification show ed that four str ains w ere Lactobacillus rhamnose and one w as Lactobacillus sake in white Sufu.In grey Sufu,three str ains w ere Lacto bacillus rham nose, tw o strains were Lactobacillus sake,the tw o other w ere Lactobacillus plantar um and Lactobacillus ca sei respectiv ely.At last,the salt and alco ho l tolerance of different strains w er e tested. Key words:Sufu;lactic acid bacteria;separ ation;identificatio n 乳酸菌的应用历史非常悠久,4000年前古人已有酸奶饮用的历史。随着现代微生物学的发展,食品级乳酸菌的优良特性已引起食品微生物界的关注,乳酸菌已广泛应用于乳制品、肉制品、果蔬制品、软饮料等食品。乳酸菌在酿造工业中的应用受到越来越多的关注。 腐乳是中国独创的调味品,在世界发酵食品中独树一帜,它既可单独食用,也可用来烹调风味独特的菜肴,被称为 中国奶酪 。商品腐乳中含有高水平的适度耐盐菌,其主导耐盐微生物是耐盐乳酸菌,它在腐乳的腌制和后酵过程中起着非常重要的作用,一定数量的乳酸菌在后酵过程中对腐乳风味物质的形成具有积极意义[1-5]。 乳酸菌是潜在地加快腐乳成熟和改进风味的协同菌株。研究表明,从特定食品中分离出的乳酸菌是该食品进行乳酸发酵的最佳出发菌株,因为它们比其它来源的乳酸菌具有更强的竞争力[6-8]。本文对青方、白方和红方腐乳中的乳酸菌进行了分离纯化和鉴定,旨在揭示腐乳中乳酸菌的群系分布特征,对腐乳发酵中风味乳酸菌的研究和开发提供依据,对乳酸菌应用于腐乳生产、改善腐乳风味的研究提供基础。 1 材料与方法 1.1 样品 收稿日期:2010-03-27 *通讯作者 基金项目:北京市优秀人才培养资助(20081D010*******);北京市自然科学基金(6093022)作者简介:王夫杰(1980-),女,硕士,研究方向为生物技术与发酵工程; 鲁绯,女,副教授,食品科学与工程博士。 98
食品中乳酸菌地检测
1 围 本标准规定了含乳酸菌食品中乳酸菌(lactic acid bacteria)的检验方法。 本标准适用于含活性乳酸菌的食品中乳酸菌的检验。 2 规性引用文件 本标准中引用的文件对于本标准的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本标准。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。 3 术语和定义 3.1 乳酸菌 lactic acid bacteria 一类可发酵糖主要产生大量乳酸的细菌的通称。本标准中乳酸菌主要为乳杆菌属(Lactob acillus)、双歧杆菌属(Bifidobacterium)和链球菌属(Streptococcus)。 4 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 4.1 恒温培养箱:36 ℃±1 ℃。 4.2 冰箱:2 ℃~5 ℃。 4.3 均质器及无菌均质袋、均质杯或灭菌乳钵。 4.4 天平:感量0.1 g。 4.5 无菌试管:18 mm×180 mm、15 mm×100 mm。 4.6 无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)或微量移液器及吸头。 4.7 无菌锥形瓶:500 mL、250 mL。 5 培养基和试剂 5.1 MRS(Man Rogosa Sharpe)培养基及莫匹罗星锂盐(Li-Mupirocin)改良MRS培养基:见附录A中A.1。 5.2 MC培养基(Modified Chalmers 培养基):见附录A中A.2。 5.3 0.5%蔗糖发酵管:见附录A中A.3。 5.4 0.5%纤维二糖发酵管:见附录A中A.3。 5.5 0.5%麦芽糖发酵管:见附录A中A.3。 5.6 0.5%甘露醇发酵管:见附录A中A.3。 5.7 0.5%水苷发酵管:见附录A中A.3。 5.8 0.5%山梨醇发酵管:见附录A中A.3。
乳酸菌之检验
食品微生物之檢驗方法-乳酸菌之檢驗 101年6月7日署授食字第1011902050號公告 1. 適用範圍:本方法適用於食品中乳酸菌之檢驗。 2. 檢驗方法:檢體經系列稀釋後,以選擇性培養基培養及計數之方法。 2.1. 工作環境:工作平台須寬敞、潔淨、光線良好,操作平台光度為100呎燭光以上,密閉室內換氣良好, 儘可能沒有灰塵及流動空氣。每15分鐘落菌數不得超過15 C FU/培養皿。 2.2. 器具及材料 2.2.1. 乾熱滅菌器。 2.2.2. 高壓滅菌釜。 2.2. 3. 冰箱:能維持5 ± 3℃者。 2.2.4. 培養箱:能維持內部溫度溫差± 1.0℃以內者。 2.2.5. 水浴:能維持水溫溫差± 1.0℃以內者。 2.2.6. 攪拌均質器(Blender)或鐵胃(Stomacher):能適用於無菌操作者。 2.2.7. 天平:可稱量到2000 g ,靈敏度為0.1 g ;可稱量到120 g ,靈敏度為5 mg。 2.2.8. 旋渦混合器(Vortex mixer)。 2.2.9. 酸鹼度測定儀(pH meter)。 2.2.10. 菌落計數器:適用於菌落之計算者。 2.2.11. 厭氧缸(Anaerobic jar)或厭氧培養箱:適用於厭氧培養者。 2.2.12. 吸管輔助器(Pipette aid)。 2.2.1 3. 吸管(Pipette):已滅菌。 1 m L吸管應有0.01 m L之刻度; 5 m L及10 m L吸管應有0.1 m L 刻度。 2.2.14. 培養皿:已滅菌,內徑約90 mm ,深度約15 mm ,底皿之內外面應平坦,無氣泡、刮痕或其他 缺點。 2.2.15. 稀釋用容器:無菌袋或有1000 mL、500 mL、99 m L及90 m L標記附蓋(栓)之可滅菌廣口瓶。
水中油类测定分析方法的综述
水中油类测定分析方法的综述 李海州 (浙江海洋学院海洋与技术学院,浙江舟山316004) [摘要]:本文对国内外学者有关水中油类的测定方法做了比较系统的综述。对几种水中油类的常用方法,重量法、紫外分光光度法、荧光分光光度法、红外分光光度法和非分散红外光度法做了简要介绍,并对其优劣进行了评价。另外,介绍了测定水中油类含量存在的难点、发展趋势和技术改进等。 关键词:水;油类;测定分析 油类是指任何类型的(矿物油、植物油等)及其炼制品(汽油、柴油、机油、煤油等)、油泥和油渣[1]。油类主要有漂浮油、分散油、乳化油、溶解油和油类附着在固体悬浮物表面而形成油膜---固体物5种形式。全世界每年至少有500—1000吨油类通过各种途径进入水体,由于漂浮于水体表面的油将会影响空气和水体表面氧的交换,而分散于水体中以及吸附于悬浮颗粒上或以乳化状态存在于水体的油易被微生物氧化分解,并将消耗水中的溶解氧,从而使水质恶化;油膜还能附着于鱼鳃上,使鱼类窒息而死;当鱼类产卵期,在含有油类污染物质废水中孵化的鱼苗,多数为畸形,生命力低下,易于死亡;含有油类污染物的废水进入水体后,造成的危害很为严重,不仅影响水生生
物的生长,降低水体的自我净化能力,而且影响水体附近的环境,因此,油类是水体环境中的主要污染物之一,在水质监测中,也是一项重要的监测项目。要消除油类对环境的污染和危害,首先就必须能够准确的测定水中油类的含量。 然而,水中油类含量测定又是比较复杂的,因为水中的油类成分是相当复杂的,此外不同地区、不同行业水体中油类污染的成分也不同,无法有用单一的油标准进行对照,无法准确测定,所以水体中油类物质含量的测定问题是环境分析化学一个古老、重要而又困难的问题。目前水体中油类测定常用的方法有重量法、紫外分光光度法、荧光分光光度法、非分散红外光度和国家最新颁布的国家标准方法红外分光光度法等[2],本文简要介绍以上几种方法的原理和优劣,及人们对水体中油类监测分析方法的创新和改进。 1.重量法 重量法是用有机萃取剂(石油醚或正己烷)提取酸化了的样品中的油类,将溶剂蒸发掉后,称重后计算油类含量。重量法应用范围不受油品的限制,可测定含油量较高的污水,不需要特殊的仪器和试剂,测定结果的准确度较高、重复性较好。缺点是损失了沸点低于提取剂的油类成分,方法操作复杂,灵敏度低,分析时间长,并要耗费大量的提取剂,而且方法的精密度随操作条件和熟练程度不同差异很大。因此,水体中动植物油含量较高的,采用该方法较适合,可以得到比较准确的结果;工业废水、石油开采及炼制行业中含油量较高,此方
食品中乳酸菌的检测
1 范围 本标准规定了含乳酸菌食品中乳酸菌(lactic acid bacteria)得检验方法。 本标准适用于含活性乳酸菌得食品中乳酸菌得检验。 2 规范性引用文件 本标准中引用得文件对于本标准得应用就是必不可少得。凡就是注日期得引用文件,仅所注日期得版本适用于本标准。凡就是不注日期得引用文件,其最新版本(包括所有得修改单)适用于本标准。 3 术语与定义 3、1 乳酸菌lactic acid bacteria 一类可发酵糖主要产生大量乳酸得细菌得通称。本标准中乳酸菌主要为乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)与链球菌属(Streptococcus)。 4 设备与材料 除微生物实验室常规灭菌及培养设备外,其她设备与材料如下: 4、1 恒温培养箱:36 ℃±1 ℃。 4、2 冰箱:2 ℃~5 ℃。 4、3 均质器及无菌均质袋、均质杯或灭菌乳钵。 4、4 天平:感量0、1 g。 4、5 无菌试管:18 mm×180 mm、15 mm×100 mm。 4、6 无菌吸管:1 mL(具0、01 mL刻度)、10 mL(具0、1 mL刻度)或微量移液器及吸头。 4、7 无菌锥形瓶:500 mL、250 mL。 5 培养基与试剂 5、1 MRS(Man Rogosa Sharpe)培养基及莫匹罗星锂盐(Li-Mupirocin)改良MRS培养基:见附录A中A、1。 5、2 MC培养基(Modified Chalmers 培养基):见附录A中A、2。 5、3 0、5%蔗糖发酵管:见附录A中A、3。 5、4 0、5%纤维二糖发酵管:见附录A中A、3。 5、5 0、5%麦芽糖发酵管:见附录A中A、3。 5、6 0、5%甘露醇发酵管:见附录A中A、3。 5、7 0、5%水杨苷发酵管:见附录A中A、3。 。3、A中A见附录:山梨醇发酵管5%、08 、5. 5、9 0、5%乳糖发酵管:见附录A中A、3。 5、10 七叶苷发酵管:见附录A中A、4 5、11 革兰氏染色液:见附录A中A、5。 5、12莫匹罗星锂盐(Li-Mupirocin):化学纯。 5、13 半胱氨酸盐酸盐(Cysteine Hydrochloride):纯度>99%。 6 检验程序 乳酸菌检验程序见图1。
乳酸菌菌种分离筛选方法
乳酸菌菌种的分离筛选方法 乳酸细菌是一类能利用发酵糖产生大量乳酸的细菌通称。为兼性厌氧菌,杆状或球状,革兰氏阳性菌,无芽孢,不运动。营养要求高,需要提供丰富的肽类氨基酸维生素。在琼脂表面或内层形成较小的白色或淡黄色的菌落。 通常用作为有益微生物的菌种有乳酸乳杆菌、干酪乳杆菌、植物乳杆菌、嗜酸乳杆菌、粪肠球菌、乳酸片球菌、双歧杆菌、屎肠球菌、戊糖片球菌等。 乳杆菌常用MRS琼脂作半选择培养基。当乳杆菌仅是复杂区系中的部分菌类 时,SL培养基常用作为选择性培养基。对于芽孢乳杆菌常用GYP培养基,链球菌有TYC培养基、MS培养基。M17培养基被用作乳球菌的分离培养基。 嗜酸乳杆菌属于乳杆菌属的一个种。其特性为:杆菌,两端圆,不运动,无 鞭毛。粪肠球菌为革兰氏阳性,圆形或椭圆形。 乳酸片球菌细胞呈球状,直径0.6~1.0μm,在直角两个平面交替形成四联状, 一般细胞成对生,单生者罕见,不成链状排列。革兰氏阳性,不运动,兼性厌氧。在MRS培养基上菌落小,呈白色。沿洋菜穿刺线的生长物呈丝状。 乳酸菌在一般琼脂培养基上形成微小菌落,不易观察,所以分离时先富集培养并选择合适的培养基。分离培养基一般添加西红柿、酵母膏、吐温-80等物质,也常常加入醋酸盐,因醋酸盐能抑制部分细菌生长,对乳酸菌无害。 培养基中添加碳酸钙,乳酸溶解培养基中的碳酸钙形成透明圈,作为分离鉴别的依据,通过对生成的乳酸量进行性能鉴定。 乳酸菌生长繁殖时需要多种氨基酸,维生素及微氧,一般菌落比较小。分离培养基一般可添加西红柿酵母膏油酸吐温等物质,均具有促进生长作用。也常常 添加醋酸盐抑制有些细菌的生长,对乳酸菌无害。 一.筛选方法: 1.溶钙圈法: 利用一些产酸类细菌在含CaCO3的培养基上产生CaCO3溶解圈,从而筛选出这些产酸类细菌,可用于乳酸菌的筛选。 其中培养基中加入CaCO3的作用是:①鉴别能产生酸的细菌;②中和产生的酸, 以维持培养基的PH。 筛选过程:样品预处理→梯度稀释至10-6→选择合适的稀释度涂布→37℃培养
目标检测方法简要综述
龙源期刊网 https://www.360docs.net/doc/8d4669990.html, 目标检测方法简要综述 作者:栗佩康袁芳芳李航涛 来源:《科技风》2020年第18期 摘要:目标检测是计算机视觉领域中的重要问题,是人脸识别、车辆检测、路网提取等领域的理论基础。随着深度学习的快速发展,与基于滑窗以手工提取特征做分类的传统目标检测算法相比,基于深度学习的目标检测算法无论在检测精度上还是在时间复杂度上都大大超过了传统算法,本文将简单介绍目标检测算法的发展历程。 关键词:目标检测;机器学习;深度神经网络 目标检测的目的可分为检测图像中感兴趣目标的位置和对感兴趣目标进行分类。目标检测比低阶的分类任务复杂,同时也是高阶图像分割任的重要基础;目标检测也是人脸识别、车辆检测、路网检测等应用领域的理论基础。 传统的目标检测算法是基于滑窗遍历进行区域选择,然后使用HOG、SIFT等特征对滑窗内的图像块进行特征提取,最后使用SVM、AdaBoost等分类器对已提取特征进行分类。手工构建特征较为复杂,检测精度提升有限,基于滑窗的算法计算复杂度较高,此类方法的发展停滞,本文不再展开。近年来,基于深度学习的目标检测算法成为主流,分为两阶段和单阶段两类:两阶段算法先在图像中选取候选区域,然后对候选区域进行目标分类与位置精修;单阶段算法是基于全局做回归分类,直接产生目标物体的位置及类别。单阶段算法更具实时性,但检测精度有损失,下面介绍这两类目标检测算法。 1 基于候选区域的两阶段目标检测方法 率先将深度学习引入目标检测的是Girshick[1]于2014年提出的区域卷积神经网络目标检测模型(R-CNN)。首先使用区域选择性搜索算法在图像上提取约2000个候选区域,然后使用卷积神经网络对各候选区域进行特征提取,接着使用SVM对候选区域进行分类并利用NMS 回归目标位置。与传统算法相比,R-CNN的检测精度有很大提升,但缺点是:由于全连接层的限制,输入CNN的图像为固定尺寸,且每个图像块输入CNN单独处理,无特征提取共享,重复计算;选择性搜索算法仍有冗余,耗费时间等。 基于R-CNN只能接受固定尺寸图像输入和无卷积特征共享,He[2]于2014年参考金字塔匹配理论在CNN中加入SPP-Net结构。该结构复用第五卷积层的特征响应图,将任意尺寸的候选区域转为固定长度的特征向量,最后一个卷积层后接入的为SPP层。该方法只对原图做一
乳酸菌的分离与初步鉴定
学院:漓江学院年级专业:09生物技术 组员:吴汉川200913007005 杨隆荷200913007006 李翠200913007007 王志远200913007008 乳酸菌的分离及初步鉴定 一、实验目的 1了解和掌握放线菌的菌种特性和分离方法 2初步掌握军中筛选方法设计 3掌握平菌种的选育 二、实验原理 乳酸菌是指以糖为原料,属于真细菌纲真细菌目中的乳酸细菌科。乳酸细菌科根据细胞呈球状或呈杆状,又分成乳酸杆菌族和链球菌族。 在BCG 牛乳培养基琼脂平板上,乳酸菌菌落大约1-3 mm,圆形隆起,表面光 的溶滑或稍粗糙,呈乳白色、灰白色或暗黄色;在产酸菌落周围还能产生CaCO 3 解圈。乳酸菌革兰氏染色呈阳性,涂片镜检细胞杆状或链球状。 乳酸杆菌呈杆状,成单杆、双杆或长丝状;乳酸杆菌,呈球状,成对或短链或长链状。乳酸菌革兰氏染色后呈蓝紫色。 平板涂布法平板涂布法是将样品经稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单个细胞生长繁殖而形成肉眼可见的菌落,即一个但菌落代表原样品中的一个单细胞。 生理盐水:称取9g氯化钠,溶解在少量蒸馏水中,稀释到1000毫升。 四、实验器材与试剂 含乳酸菌的酸奶、结晶紫、卢哥氏碘液、95%乙醇、蕃红溶液、灭菌CaCO3粉末、NaCl; BCG牛乳培养基:(A)溶液:脱脂乳粉100g,水500mL,加入1.6%溴甲酚绿(B.C.G)乙醇溶液1mL,80℃灭菌20min。(B)溶液:酵母膏10g,水500mL,琼脂20g, pH6.8, 121℃湿热灭菌20min。以无菌操作趁热将(A)、(B)溶液混合均匀后倒平板。 1000ml烧瓶一个, 无菌培养皿9个, 500ml容量三角瓶2个,25ml无菌移液管1只,20ml无菌试管7只,1ml无菌移液管6只,培养基分装器一个,玻棒2根, 无菌涂布器3只,酒精灯一盏,接种环一个,天平,牛角匙,漏斗,漏斗架,载玻片,盖玻片,pH试纸若干,液体石蜡,棉塞,吸管,牛皮纸,线绳、标签等。 五、实验步骤 1.菌悬液的配制 取1洁净三角瓶,盛以225ml生理盐水;7只洁净试管,各盛9ml的生理盐水;加塞包扎于在103kPa 121℃高压蒸汽灭菌20Min,得到无菌生理盐水。
乳酸菌的提取和鉴定
酸奶中乳酸菌的筛选试验 一、实验目的:熟悉从酸奶中分离和纯化乳酸菌的一般方法 二、实验原理: 市场销售的酸奶主要含乳酸菌,乳酸菌的主要作用是把牛奶中乳糖发酵成乳酸,此外酸奶中还含有其他球菌,利用它产酸等性质可以分离乳酸菌,分离培养基一般添加蛋白胨、酵母膏提供氮源、维生素、生长因子;葡萄糖为可发酵糖类;磷酸氢二钾为酸碱缓冲剂;柠檬酸铵、硫酸镁、硫酸锰、亚硫酸铁、吐温-80和乙酸钠为培养各种乳酸菌提供生长因子,其成分还能抑制某些杂菌;琼脂是培养基的凝固剂。、也常常加入醋酸盐,因醋酸盐能抑制部分细菌生长,对乳酸菌无害。培养基中添加碳酸钙,乳酸溶解培养基中的碳酸钙形成透明圈,作为分离鉴别的依据。 .筛选方法:.溶钙圈法:利用一些产酸类细菌在含CaCO3 的培养基上产生CaCO3 溶解圈,从而筛选出这些产酸类细菌,可用于乳酸菌的筛选。其中培养基中加入CaCO3 的作用是:①鉴别能产生酸的细菌;②中和产生的酸,以维持培养基的PH、更利于乳酸菌的生长和分离 三、实验药品及仪器 牛肉膏、蛋白胨、酵母膏、葡萄糖、乳糖、吐温-80、柠檬酸二铵、CaCO3 、K2HPO4 NaAc·3H2O、MgSO4·7H2O、MnSO4·H2O、琼脂、结晶紫染色液、碘液、95%乙醇、石蜡、蒸馏水。 仪器:超净工作台、电子显微镜、接种环、恒温培养箱、接
种环、培养皿、涂布环、高压锅、试管、微波炉、电子天平、离心机 四培养基类型 ①改良MRS 培养基(乳酸菌分离培养基):牛肉膏10g,蛋白胨10g,酵母膏5g,葡萄糖20g,吐温-80 1.0ml(它是一种很好的乳化剂和分散剂也就是说它的作用就是是培养基的营养成分更加的均匀就是对营养成分的再一次优化),K 2HPO4 2g,NaAc·3H2O 5g,柠檬酸二铵2g,MgSO4·7H2O 0.58g,MnSO4·H2O 0.25g,补蒸馏水至1000ml(固体培养基中加琼脂 1.5%-2%),调pH 至6.4±0.2,121℃高压灭菌15min ②改良MC 培养基(乳酸菌选择培养基):牛肉膏5g,蛋白胨5g,酵母膏5g,葡萄糖20g,乳糖20g,CaCO3 10g,琼脂20g,中性红0.05g(指示剂),最终pH6.5±0.2,补蒸馏水至1000ml,121℃高压灭菌15min。 配制方法:1把除CaCO3以外的成分称量溶解后.调PH至6.2~6.4; 2.称取20g CaCO3加入到100mL蒸馏水中,制成CaCO3乳浊液; 3.将培养基和CaCO3乳浊液分开灭菌; 4.倒平板前,待培养基融化冷却后,平板上加入一定量的CaCO3乳浊液,晾干了以后再接种。 五、实验流程 1、吸取酸奶1ml 2、10 倍梯度稀释平板涂布(改良MC Medium) 3、厌氧培养(28℃培养48h)待形成菌落 4、挑取溶钙圈较大的单菌落→ 观察、记录菌落形态与特征 5、Improved MC Medium 划线分离纯化 6、选取溶钙圈较大的单菌落进行G+染色 7、革兰氏阳性菌(G+菌)→ 记录菌株细胞形态
乳酸菌耐药性的研究(综述)
乳酸菌耐药性的研究(综述) 摘要乳酸菌是一种革兰阳性菌,其主要的发酵产物主要是乳酸。目前还没有对乳酸菌耐药性展开完全而系统的研究。大多数研究都是针对条件致病性肠球菌的,而乳酸杆菌和乳酸球菌则较少. 关键词乳酸菌;耐药性;转移 乳酸菌是一种革兰阳性菌,其主要的发酵产物主要是乳酸。根据乳酸菌种系进化过程中形成的不同生化指标可以分为:低GC含量的一群,例如,肠球菌属,乳酸杆菌属,乳酸球菌属明串珠菌属,足球菌属和链球菌属,以及高GC含量的双歧杆菌属乳酸菌是存在于人类和其他动物体内(肠道、鼻腔和阴道黏膜)以及环境中(以植物为主)的非常重要的一类微生物。乳酸菌已经作为益生菌广泛应用于食品以及药品领域中,例如发酵酸奶,乳饮料,肠道微生态制剂等。传统的乳酸菌种具有很长的使用历史,但随着人类生活水平的不断提高和食物种类的增多,乳酸菌应用所带来的安全问题也引起人们的注意,尤其是某些菌株对抗生素的耐药现象更是潜在的危险因素。 一般情况下,耐药性的传播主要发生在临床相关的菌株中。但也已经有体内实验证明,在肠道正常菌之间和肠道正常菌与致病菌之间也存在着耐药基因转移现象。食物链就是耐药基因在肠内传播的主要途径,尤其是发酵乳品和发酵肉食品。如果它们在使用前未经过加热处理,就可能使得其中的菌株进入人类的胃肠道,与肠道的正常菌群或者肠道的过路菌接触,并传播耐药性基因,使得原本敏感的菌表现出耐药的表型。许多研究者都指出,,商用乳酸菌菌株如果不经过严格的安全性检测,很有可能会扮演耐药性基因贮存宿主的角色。虽然大部分与食品有关的乳酸菌都已经获得GRAS(相对安全认证),但是它们仍存在着潜在的安全隐患,作为耐药性基因的贮存宿主,它们的耐药性基因可能会转移到人类肠道中的其他正常菌群或者致病菌中,但目前这些都只是猜测并未经过证实。 1抗生素耐药性的出现与耐药机制 自从50年前人们开始利用抗生素来治疗细菌性疾病以来,随着大量的新品种抗生素相继问世以及在治疗过程中的滥用现象,耐药性问题也逐渐的显现出来,使人们在治疗与防治感染性疾病时面临新的考验。 细菌产生耐药性的机制主要包括四个方面:(1)通过改变细胞膜的渗透性来改变药物的渗透能力。(2)通过产生抗生素的钝化酶(例如B-内酰胺酶,葡萄糖苷乙酰基转移酶,核苷酸转移酶和磷酸基转移酶),抑制抗生素的作用。(3)通过激活抗生素的转运系统(如在细胞膜上ATP依赖的转运系统),将抗生素转移到胞外。(4)通过目标修饰(例如23S rR A的甲基化修饰,拓扑异构酶的氨基酸顺序突变),改变抗生素作用的靶点。 细菌耐药性一般可以大致分为两种:一是固有性耐药,二是获得性耐药。固有性耐药一般不会发生转移。获得性耐药大多是由于抗生素的选择性压力所产生的,既可以是由自身基因突变产生耐药基因,也可以是从外界获得耐药基因。这种耐药性具有在细菌间水平转移的可能性。某些耐药基因是可以转移的,转移方式可以分为垂直转移和水平转移。垂直的基因转移方式是指通过具有耐药性的菌株克隆繁殖进行传播。这种方式较为普遍,但是危害性并不高。水平的基因转移是耐药性基因扩散的主要方式,包括三种机制:(1)天然转移,它包括从细胞外介质中吸收游离的DNA并整合到基因组中。(2)接合,是一种通过性菌毛的DNA(主
酸乳中乳酸菌的测定
实验乳及乳制品中乳酸菌的测定 一、目的 1、解酸乳中乳酸菌分离原理 2、学习并掌握酸乳中乳酸菌菌数的检测方法。 二、原理 活性酸奶需要控制各种乳酸菌的比例,有些国家将乳酸菌的活菌数含量作为区分产品品种和质量的依据。由于乳酸菌对营养有复杂的要求,生长需要碳水化合物、氨基酸、肽类、脂肪酸、酯类、核酸衍生物、维生素和矿物质等,一般的肉汤培养基难以满足其要求。测定乳酸菌时必须尽量将试样中所有活的乳酸菌检测出来。要提高检出率,关键是选用特定良好的培养基。采用稀释平板菌落计数法,检测酸奶中的各种乳酸菌可获得满意的结果。 三、材料 1、培养基 改良MC培养基(MRS培养基,改良CHALMERS培养基,M17培养基)。 2、仪器和器具 无菌移液管(25ml,1ml),无菌水(225ml带玻璃珠三角瓶,9ml试管),无菌培养皿,旋涡均匀器,恒温培养箱。 四、流程 酸奶→稀释→制平板→培养→检查计数 五、方法 1、样品稀释 先将酸奶样品搅拌均匀,用无菌移液管吸取样品25ml加入盛有225ml无菌水的三角瓶中,在旋涡均匀器上充分振摇,务必使样品均匀分散,即为10-1的样品稀释液,然后根据对样品含菌量的估计,将样品稀释至适当的稀释度。 2、制平板 选用2~3个适合的稀释度,培养皿贴上相应的标签,分别吸取不同稀释度的稀释液1ml 置于平皿内,每个稀释度作2个重复。然后用溶化冷却至45℃左右的MC培养基倒平皿,迅速转动平皿使之混合均匀,冷却成平板。 3、培养和计数 将平皿倒置于37℃恒温箱内培养72h,观察长出的细小菌落,计菌落数目,按常规方法选择30~300个菌落平皿进行计算。 六、结果 1、指示剂显色反应 乳酸菌的菌落很小,1~3mm,圆形隆起,表面光滑或稍粗糙,呈乳白色、灰白色或暗黄色。由于产酸菌落周围能使CaCO3产生溶解圈,酸碱指示剂呈酸性显色反应。 2、镜检形态 必要时,可挑取不同形态菌落制片镜检确定是乳杆菌或乳链球菌。保加利亚乳杆
乳酸菌得分离、纯化与鉴定
乳酸菌得分离、纯化与鉴定 第一部分:乳酸菌得分离、纯化 一、实验器材: 1、实验药品新鲜乳酸饮料(市售)、脱脂奶粉、蔗糖、1、6%溴甲酚绿乙醇溶液(溴甲酚绿、无水乙醇)、酵母膏、琼脂、革兰氏染液(结晶紫染液、卢戈氏碘液、95%乙醇、沙黄)、75%乙醇、香柏油、1mol/L NaOH、1mol/L HCl、碳酸钙; 0、4gNaOH固体、4、2ml浓HCL(分析纯) 、20gCaCO3固体、酵母膏20g 、琼脂30g 香柏油、脱脂奶粉100g 、蔗糖10g; 2、仪器与设备高压蒸汽灭菌锅、光学显微镜、培养箱、pH试纸、酸乳瓶、培养皿(φ9或φ12)、试管、300ml三角瓶(带玻珠)、移液管、天平、500ml锥形瓶、250ml锥形瓶、250ml烧杯。 二、实验步骤: 1、培养基配制(BCG牛乳培养基): (A)溶液:取脱脂乳粉100g,水500ml,加入1、6%溴甲酚氯乙醇溶液1ml,混合均匀后分装入三角瓶于高压蒸汽灭菌锅80℃灭菌20 min;(1、6%溴甲苯酚绿(BCG)乙醇溶液用1、6g溴甲酚绿加入20ml无水乙醇中,再加水至100ml制成) (B)溶液:酵母膏10g,水500ml,CaCO3 10g,琼脂20g,加热溶解,用精密pH试纸调节pH到6、8,分装入三角瓶后在103kPa 121℃高压蒸汽灭菌20Min。 以无菌操作趁热将(A)(B)溶液均匀混合。 2、药品配制 2、1 结晶紫:结晶紫乙醇饱与液(结晶紫2g溶于20ml 95%乙醇中)20ml,1%草酸氨水溶液80ml。将两液混匀,放置24小时后过滤即可。 2、2 卢哥氏碘液:碘1g,碘化钾2g,蒸馏水300ml。先将碘化钾溶于少量蒸馏水中,然后加入碘使之完全溶解,再加入蒸馏水300ml即成。 2、3 蕃红溶液:番红2、5g,95%乙醇100ml,溶解后存于密闭得棕色瓶中。用时取20ml与80ml蒸馏水混匀即可。 2、4 0、1%得吕氏美蓝染液:A液:美蓝0、3g,95%乙醇300ml;B液:0、01% KOH 100ml。混合A与B液即成,按1:100稀释即可。 2、4 生理盐水:称取9g氯化钠,溶解在少量蒸馏水中,稀释到1000毫升。 3、菌悬液得配制
乳酸菌镜检方法及显微镜使用方法
乳酸菌精简方法及显微镜使用方法 第一部分:乳酸菌镜检可以采用革兰氏染色方法。 第二部分:使用显微镜的油镜进行镜检, 下面是具体的染色方法和镜检方法,请参考。 第一部分:乳酸菌革兰氏染色方法 1目的 在乳酸菌发放之前,利用标准的革兰氏染色法对即将发放的乳酸菌悬液或乳酸菌样品进行检测,观察乳酸菌乳酸菌在显微镜下的形态。 2原理 通过结晶紫初染和碘液媒染后,在细胞壁内形成了不溶于水的结晶紫与碘的复合物,革兰氏阳性菌由于其细胞壁较厚、肽聚糖网层次较多且交联致密,故遇乙醇脱色处理时,因失水反而使网孔缩小,再加上它不含类脂,故乙醇处理不会出现缝隙,因此能把结晶紫与碘复合物牢牢留在壁内,使其仍呈紫色;而革兰氏阴性菌因其细胞壁薄、外膜层类脂含量高、肽聚糖层薄且交联度差,在遇脱色剂后,以类脂为主的外膜迅速溶解,薄而松散的肽聚糖网不能阻挡结晶紫与碘复合物的溶出,因此通过乙醇脱色后仍呈无色,再经沙黄等红色染料复染,就使革兰氏阴性菌呈红色。 3 实验用品准备: 灭菌玻片、10-100ul移液器、10-100ul灭菌移液吸头、100ul-1000ul移液器、100ul-1000ul移液吸头、接种环、酒精灯、打火机、革兰氏染色液、吸水纸、显微镜、香柏油、
擦镜纸、计时器 4 操作: 1 涂片:取灭过菌的载玻片于实验台上,用移液枪吸取10ul待检 样品滴在载玻片的中央,用烧红冷却后的接种环将液滴 涂布成一均匀的薄层,涂布面不宜过大。 2 干燥:将标本面向上,手持载玻片一端的两侧,小心地在酒精灯 上高处微微加热,使水分蒸发,但切勿紧靠火焰或加热 时间过长,以防标本烤枯而变形。 3 固定:固定常常利用高温,手持载玻片的一端,标本向上,在酒 精灯火焰处尽快的来回通过2-3次,共约2-3秒种,并 不时以载玻片背面加热触及皮肤,不觉过烫为宜(不超 过60℃),放置待冷后,进行染色。 4 初染:在涂片薄膜上滴加草酸铵结晶紫1-2滴,使染色液覆盖涂 片,染色约1min。 5 水洗:斜置载玻片,在自来水龙头下用小股水流冲洗,直至洗下 的水呈无色为止。 6 媒染:用100-1000ul移液枪吸取约300ul碘液滴在涂片薄膜上, 使染色液覆盖涂片,染色约1min。 7 水洗:斜置载玻片,在自来水龙头下用小股水流冲洗,直至洗下 的水呈无色为止。 8 脱色:斜置载玻片,滴加95%乙醇脱色,至流出的乙醇不现紫色 为止,大约需时20-30S,随即水洗。 9 复染:在涂片薄膜上滴加沙黄染液1-2滴,使染色液覆盖涂片, 染色约1min。 10 水洗:斜置载玻片,在自来水龙头下用小股水流冲洗,直至洗 下的水呈无色为止。 11 干燥、观察:用吸水纸吸掉水滴,待标本片干后置显微镜下, 用低倍镜观察,发现目的物后滴一滴浸油在玻片上,用 油镜观察细菌的形态及颜色,紫色的是革兰氏阳性菌, 红色的是革兰氏阴性菌。 5清场 实验结束后,将显微镜油镜上的残留的香柏油用擦镜纸轻轻擦去,将载物台移至最底处,将灯光调到最暗并将其关闭电源,拔下电
建筑节能检测方法综述
建筑节能检测方法综述 The Standardization Office was revised on the afternoon of December 13, 2020
建筑节能现场检测方法 田斌守 摘要本文综述了几种建筑物围护结构传热系数现场检测方法的原理、操作方法、适用条件,指出各种方法的优缺点及注意事项。 关键词建筑节能检测热流计法热箱法控温箱-热流计法非稳态法当今飞速发展的国民经济活动必然导致前所未有的资源能源消耗速度。而许多资源能源是不可再生的,为了人类的可持续发展,节约能源刻不容缓。据介绍,我国目前单位建筑面积采暖能耗相当于气候条件相近的发达国家的2~3倍,而建筑能耗也占全国能耗总量的%。随着人民生活水平的不断提高、城市化进程的加快以及住房体制改革的深化,建筑能耗在我国增长趋势很大,很可能是我国今后能耗的一个主要增长点。为建设节约型社会,促进经济社会可持续发展,国家发展委员会发布了“节能中长期专项规划”,建筑节能作为三大重点领域中的一项,受到高度重视。建设部也相继发布了一系列建筑节能标准,其中包括若干强制性条款,目前正在建设领域逐步实施。 建筑节能工作从流程上可分为设计审查、现场检测、竣工验收三个大的阶段。对节能建筑的评价,从建设前期对施工图纸审查计算阶段、向现场检测和竣工验收转移是大势所趋。建筑节能现场检测也是落实建筑节能政策的重要保证手段。目前,全国范围内建筑节能检测都执行JGJ132-2001《采暖居住建筑节能检验标准》,它是最具权威性的检测方法,它的发布实施,为建筑节能政策的执行提供了一个科学的依据,使得建筑节能由传统的间接计算、目测定性评判到现在的直接测量,从此这项工作进入了由定性到定量、由间接到直接、由感性判断到科学检测的新阶段。 根据我们对建筑节能影响因素和现场检测的可实施性的分析,我们认为能够在实验室检测的宜在实验室检测(如门窗等作为产品在工程使用前后它的性状不会发生改变),除此之外,只有围护结构是在建造过程中形成的,对它的检测只能在现场进行。因此建筑节能现场检测最主要的项目是围护结构的传热系数,这也是最重要的项目。如何准确测量墙体传热系数是建筑节能现场检测验收的关键。目前对建筑节能现场检测的、围护结构(一般测外墙和屋顶、架
