高一化学必修一钠及其重要化合物

第三章 金属及其化合物 第一节 钠及其重要化合物
一、钠 1、物理性质
银白色金属光泽,质软(可用小刀切割),密度比水小比煤油大(保存在煤油中),熔沸点低,具有良好的导热性和导电性。 2、化学性质
(1)与非金属反应:如O 2、Cl 2、S 等。 ①钠与氧气反应
常温下生成Na 2O (白色),化学方程式为: 4Na+O 2=2Na 2O
燃烧时生成Na 2O 2(黄色),化学方程式为: 2Na+O 2 Na 2O 2 ②钠与氯气反应
化学方程式为:2Na+Cl 2 2NaCl ③钠与硫反应
化学方程式为: 2Na+S Na 2S (2)与水、酸反应(反应顺序:先酸后水)
①钠与水、酸反应的实质上均是和H +
反应,离子方程式分别为: 2Na+2H 2O=2Na +
+2OH —
+H 2↑、2Na +2H +
=2Na +
+H 2↑ ②钠与水反应(加酚酞)的实验现象和解释
(3)Na 与盐溶液的反应(反应顺序:先与水反应,再考虑NaOH 是否与盐反应) ①钠投入到NH 4Cl 溶液中,有H 2和NH 3逸出,化学方程式为: 2Na+2NH 4Cl=2NaCl+2NH 3↑+H 2↑
②投入到CuSO 4溶液中,有气体放出和蓝色沉淀生成,化学方程式: 2Na+2H 2O=2NaOH+H 2↑ 、 CuSO 4+2NaOH =Na 2SO 4+Cu(OH)2↓ 思考:金属钠露置在空气中的变化过程是怎样的?
点燃
点燃
加热
切开金属钠,呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3·10H2O)→最后成白色粉末(Na2CO3·10H2O风化为Na2CO3)。
3、钠的保存、制取及用途
⑴金属钠的保存及取用
少量金属钠可保存在煤油里,大量的金属钠则存入在铁筒中用石蜡密封。取用时一般先用镊子把钠从煤油中夹出来,并用滤纸把表面的煤油吸干,然后用小刀切下绿豆大小的一块再做有关实验。
电解
⑵钠的制取:2NaCl(熔融) 2Na+Cl2↑
⑶用途:钠是一种强还原剂,工业上用它还原金属钛、锆、铌等;另外钠和钾的合金在常温下呈液态,是原子反应堆的导热剂;钠也可用于制高压钠灯。
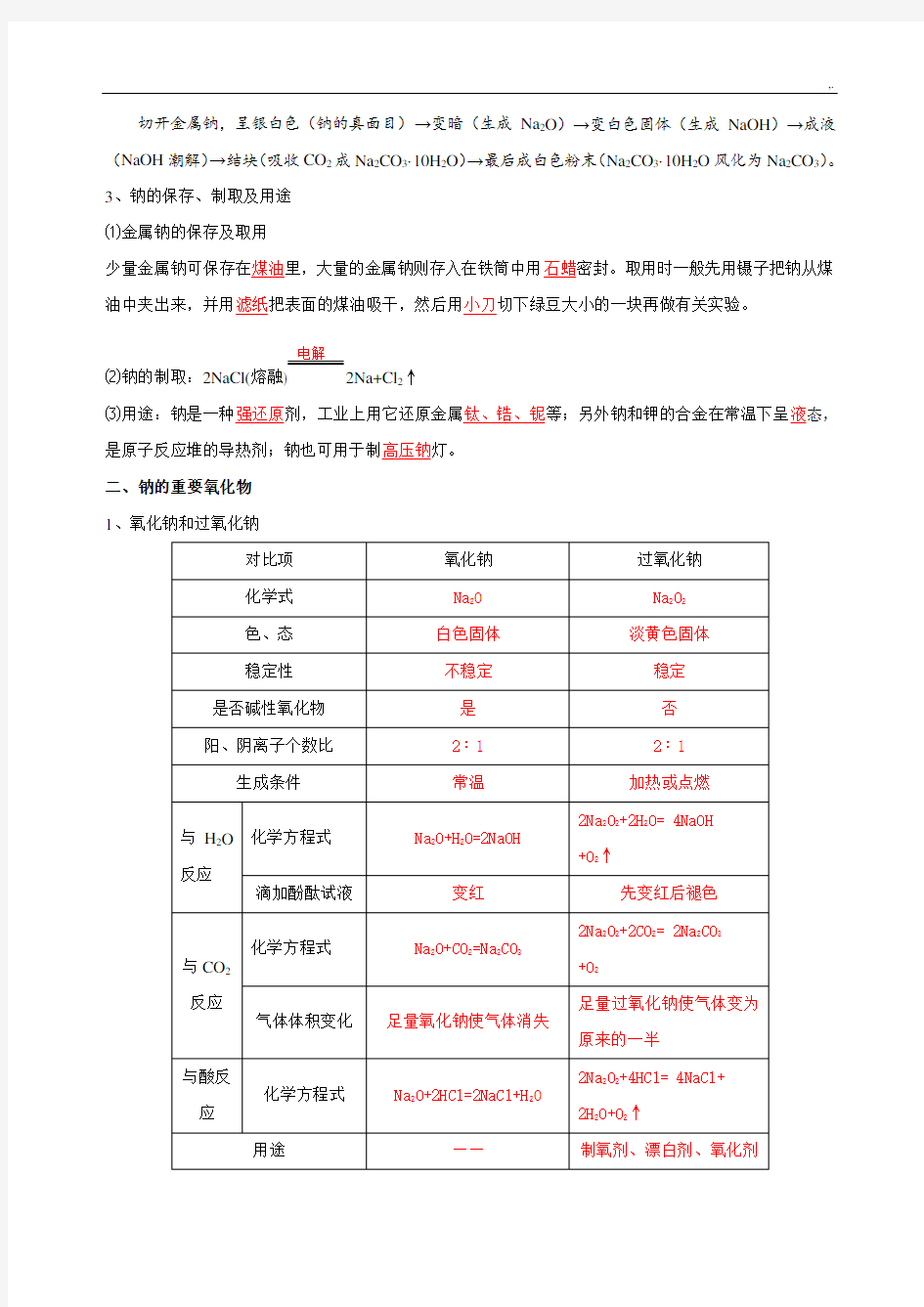
二、钠的重要氧化物
1、氧化钠和过氧化钠
转化关系2Na
2O+O22Na2O2
保存隔绝空气
一、过氧化钠的强氧化性
⑴Na2O2与SO2反应:Na2O2+SO2=Na2SO4。
⑵Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀。
⑶Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊。
⑷Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42-。
⑸Na2O2投入品红溶液中,因其有氧化性,所以有漂白性,可使品红溶液褪色。其漂白原理与HClO、NaClO、O3等相同。
二、有关Na2O2与CO2、H2O反应的重要关系
⑴物质的量关系
无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2∶1,解决此类可借助物质的量守恒关系。
⑵电子转移关系
当Na2O2与CO2、H2O反应时,每产生1molO2转移2mole-。
⑶先后顺序关系
一定量的Na2O2与一定量的CO2、H2O(g)混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O(g)发生反应。
⑷气体体积关系
若CO2、H2O(g)混合气体(或单一气体)通过足量Na2O2,气体体积的减少量等于原混合气体体积的1/2且等于生成氧气的体积。
⑸固体质量关系
当Wg通式符合(CO)m H n(m、n为整数)的物质在O2中充分燃烧,将其产物通过足量的Na2O2固体,反应完毕,固体增重Wg。常见符合符合(CO)m H n的物质如:CO、H2、CH3OH、CH3COOH、HCOOCH3、C6H12O6等。
【答案】C
【答案】(1)验纯收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“噗”声,表明H2纯净。
(2)较多的钠与水反应会放出大量的热,可能使试管内的H2、O2混和气爆炸。
(3)钠比水轻,比苯重,落在苯水交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速率
1B 2C 3A 4A 5A 6B 7D 8B 9D 10A 11D 12A
13 .
14.(1)A、NaOH B、NaHCO3C、Na2O2
(2)NaOH + NaHCO3 = Na2CO3 + H2O
(3)CO32- + CO2 + H2O =2HCO3—
15.(1)①2Na2O2+2H2O = 4NaOH+O2↑
②用玻璃片在水面下盖住集气瓶口,将玻璃片与集气瓶一起移出水面,将盖有玻璃片的集气瓶正放在桌上。
(2)①经计算,烧瓶中c(OH—)约为1 mol/L;因为c(OH-)在1.0×10-4 mol/L~2.5 mol/L时酚酞呈红色,因此红色迅速褪去不是由于溶液中c(OH—)过大造成的。
②取烧瓶中的溶液于试管中,加入少量二氧化锰,有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2存在。
③取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关16(1)放出大量的热(1分)2Na2O2+2H2O 4NaOH+O2↑(1分)
(2)将带火星的木条放在P口处,木条复燃(1分)
将Q口插入到盛水的烧杯中,有气泡产生(1分)
(3)MnO2(1分)使带火星的木条复燃(1分)
(4)①B(1分)防止倒吸(1分)②500mL2分
【例1】(2007·全国Ⅱ理综)在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL 浓度为0.5mol/L 的HCl 溶液中和,则生成物的成分是( ) A .Na 2O
B .Na 2O 2
C .Na 2O 和Na 2O 2
D .Na 2O 2和NaO 2
【例2】(08年昆明模拟)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成氢气的反应:①Zn 和盐酸 ②Na 和水③Al 和NaOH 溶液 ④Na 和无水乙醇。为方便制取和点燃上述四个反应生成的氢气,他们设计了如下图所示装置。 试回答下列问题:
(1)点燃氢气之前必须先进行 。
方法是
。
(2)实验小组在点燃用上述装置制得的氢气时,①③④实验获得成功,②却失败了。他们分析后认为失败的原因有a :Na 与H 2O 的反应速率太快;b :Na 的用量太少;c :装置存在缺陷。针对b 失败的原因,有的同学提出可以增加钠的用量,但有同学认为这样做太危险,原因是 。
(3)针对原因a 、c ,实验小组查阅资料得知钠、苯、水的密度分别为0.97g ·cm -3、0.88g ·cm -3、1.00g ·cm -3。他们改进了实验装置后重做实验②。改进后的实验装置如下图所示。 改进后的实验,氢气的生成速率明显减慢。原因是
。
。
【检测评价】
1.下列关于金属元素特征的叙述正确的是 A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素在化合物中一定显正价 C.金属元素在不同化合物中的化合价均不同 D.金属单质在常温下均是固体
2.有许多氧化物在一定条件下都能与Na 2O 2反应,且反应极有规律。如2Na 2O 2+2CO 2= 2Na 2CO 3+O 2,2Na 2O 2+2SO 3= 2Na 2SO 4+O 2。据此,你认为下列反应方程式中正确的是( ) A .2Na 2O 2+2SO 2= 2Na 2SO 3+O 2 B .Na 2O 2+2NO 2= 2Na 2NO 2+O 2 C .2Na 2O 2+2Mn 2O 7= 2NaMnO 4+O 2 D .2Na 2O 2+2N 2O 5= 2NaNO 2+O 2
3.观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下
—有孔试管 —广口瓶 ——铜丝网隔板
①②③④
列现象:银白色→变灰暗→变白色→出现液滴→白色固体,下列说法正确的是()A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
4.(08枣庄市调研)下列说法中,正确的是()
①食盐灼烧时火焰呈黄色与久置的浓硝酸呈黄色原理不相同
②固体氢氧化钠存放在带塑料塞的广口瓶中
③熔点:钾>钠>钠钾合金
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡后溶液呈蓝色
⑤向含有Na+、SO42-、HCO3-、CO32-的溶液中加入过量的Na2O2固体,Na+和CO32-的物质的量不变
⑥1mol Na2O2与足量的水反应,转移的电子数为2mol。
⑦取用金属钠时,应将剩下的大块钠放回原瓶,实验结束,余下的钠屑应用乙醇处理
A.①②⑦B.①②③⑥C.①②⑥⑦D.①②④⑤
5.1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()
A.Na2CO3
B.Na2O2Na2CO3
C.NaOH Na2CO3
D.Na2O2NaOH Na2CO3
6.在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14将该气体与 2.24L氧气(标准状况)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为( )
A.等于6.72g B.小于6.72g C.大于6.72g D.无法计算
7.氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O →NaOH +NH3 ,NaH+H2O →NaOH +H2.有关它们的叙述
①离子半径:Na+>N3->H+;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是()A.②③④⑤B.①③⑤C.②④D.③
8.某研究性学习小组设计如下实验方案测定氧化钠中过氧化钠的含量。实验步骤:①取一定质量的样品放入烧杯中,加入足量稀盐酸,搅拌使之充分反应;②将反应后的溶液倒入蒸发皿中蒸发至恒重,冷
却、称重。若在蒸发过程中,局部温度过高,造成液滴飞溅,则实验结果会()A.偏低B.偏高C.无影响D.无法判断
9.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( ) 选项陈述Ⅰ陈述Ⅱ判断
A
碳酸钠溶液可用于
治疗胃病Na2CO3可与盐酸反
应
Ⅰ对,Ⅱ对,有
B
向Na2O2的水溶液
中滴入酚酞变红色Na2O2与水反应生成
氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原
性高压钠灯发出透雾
性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可用于航
天员的供氧Na2O2能和CO2和
H2O反应生成O2
Ⅰ对,Ⅱ对,有
10.一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来温度。下列叙述中,
不合理
...的是()
A.NaOH溶液浓度增大,并放出H2 B.溶液中NaOH的质量分数不变,有H2放出
C.总溶液的质量减小,有H2放出D.钠浮于液面,到处游动,发出咝咝的响声
11.绿色化学是化学实验追求的目标。《化学教育》2006年第11期刊载了创新设计“钠在空气中燃烧实
验”装置。下列对于该创新实验的描述错误
..的是()
A.防止钠燃烧时烧裂试管
B.解决了钠在空气中燃烧产生浓烟造成污染
C.观察到黄色火焰和生成淡黄色固体
D.钠先反应放热,然后钠受热熔化
12.等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为()
A.3:4:1 B.3:3:2 C.6:7:3 D.6:9:0
13.为了探究“二氧化碳是否有水存在时才能和过氧化钠反应”,
某课题研究小组的同学们设计了如下图的实验装置,分别进行
了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试
管II中装入Na2O2,在通人CO2之前,关闭K1和K2。在试管I
内装入试剂X 后,打开K1和K2,通人CO2,几分钟后将带火星的木条插入试管III的液面上,观
察到木条不复燃,且II中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管I内装入试剂Y,其他操作同实验甲。观察到木条复燃,且II中的淡黄色变为白色。
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是_________________________________。(2)在实验甲中,试剂X是__________________;在实验乙中,试剂Y是__________________。(3)根据上述两个实验现象,得到的结论是___________________________________________。
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用__________(填编号,多选扣分)。
A. 大理石
B. 小苏打
C. 烧碱
D. 盐酸
E. 稀硫酸
F. 稀硝酸
(5)CO2和Na2O2的反应机理可用示踪原子分析加以证明,请完成下列反应方程式:Na2O2+C l8O2+H218O →
14 已知A、B、C是三种常见的固体化合物,焰色反应均显黄色,其中A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。另A、B、C、D之间含有如下的转化关系:(部分物质未写出)
(1)写出物质的化学式:
A 、
B 、
C 。
(2)写出A、B按物质的量之比为1:1在密闭容器中加热发生反应的化学方程式:
。
(3)写出溶质E与足量CO2反应的离子方程式:。
15. 利用下图所示装置制取氧气并进行相关的实验探究。
(1)将3.9 g过氧化钠放入烧瓶中,加入100 mLH2O,然后用排水法收集气体。
①过氧化钠跟水反应的化学方程式为________________________________。
②集气瓶充满气体后,怎样从水槽中取出集气瓶?简述操作方法。
__________________________________________________。
(2)已知:酚酞在c(OH-)为1.0×10-4 mol/L~2.5 mol/L时呈红色,且0.5 min内不会褪色;H2O2具有氧化性和漂白性。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
①有人认为,“红色迅速褪去”是由于溶液中c(OH—)过大造成的,试通过估算并对比数据加以说明。______________________________________________________________________________。
②还有人认为,“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能有H2O2存在,请简述实验操作。________________________________________________________________。
③补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关。请简述实验操作。
_______________________________________________________________________。
16.用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来。
(1)由上述实验现象所得到的有过氧化钠跟水反应的结论是:
第一,为氧气生成,
第二,。
Na2O2跟水反应的化学方程式是
。
(2)某研究性学习小组拟用右图所示装置(气密性良好)进行
实验,以证明上述结论。
用以验证第一条结论的实验操作及现象是:
。
用以验证第二条结论的实验操作及现象是:
。
(3)实验(2)向试管中加水至固体完全溶解且不再有气泡生成后,取出度管,向试管中滴入酚酞试液,发现溶液先变红后退色,为探究其原因,该小组同学从查阅有关资料中得知:Na2O2与水反应可生成H2O2,H2O2具有强氮化性的漂白性。
请设计一个简单的实验,验证Na2O2跟足量水充分反应后的溶液中有H2O2存在。(只要求写出实验所用的试剂及观察到的现象)
试剂:;
现象:。
(4)该小组同学提出用定量的方法探究Na2O2跟水反应后的溶液中是否含有H2O2,其实验方法为:称取2.6gNa2O2固体,使之与足量的水反应,测量产生O2的体积并与理论值比较,即可得出结论:
①测量气体体积时,必须持试管和量筒内的气体都冷却至
室温时进行,应选用如图装置中的(忽略导管在量筒中所
占的体积)(填序),
理由是。
②若在标准状况下测量气体的体积,应选用的量筒的大小规格为(选填
“100mL”、“200mL”、“500mL”或“1000mL”)
