中考化学质量守恒定律单元单元测试题(A卷)及解析
中考化学质量守恒定律单元单元测试题(A卷)及解析
一、初中化学质量守恒定律选择题
1.“神舟七号“太空舱利用NiFe2O4将航天员呼出的CO2转化为O2,而NiFe2O4的质量和化学性质在化学反应前后都不发生变化。该过程中NiFe2O4是()
A.生成物B.反应物C.催化剂D.氧化剂
2.在一个密闭容器内,有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量见下表
物质A B C D
反应前的质量(g)461114
反应后的质量(g)待测15084
依据上表判断,下列说法正确的是()
A.该反应是化合反应B.待测值为22
C.生成A和B的质量比为22:9D.D物质是该反应的反应物
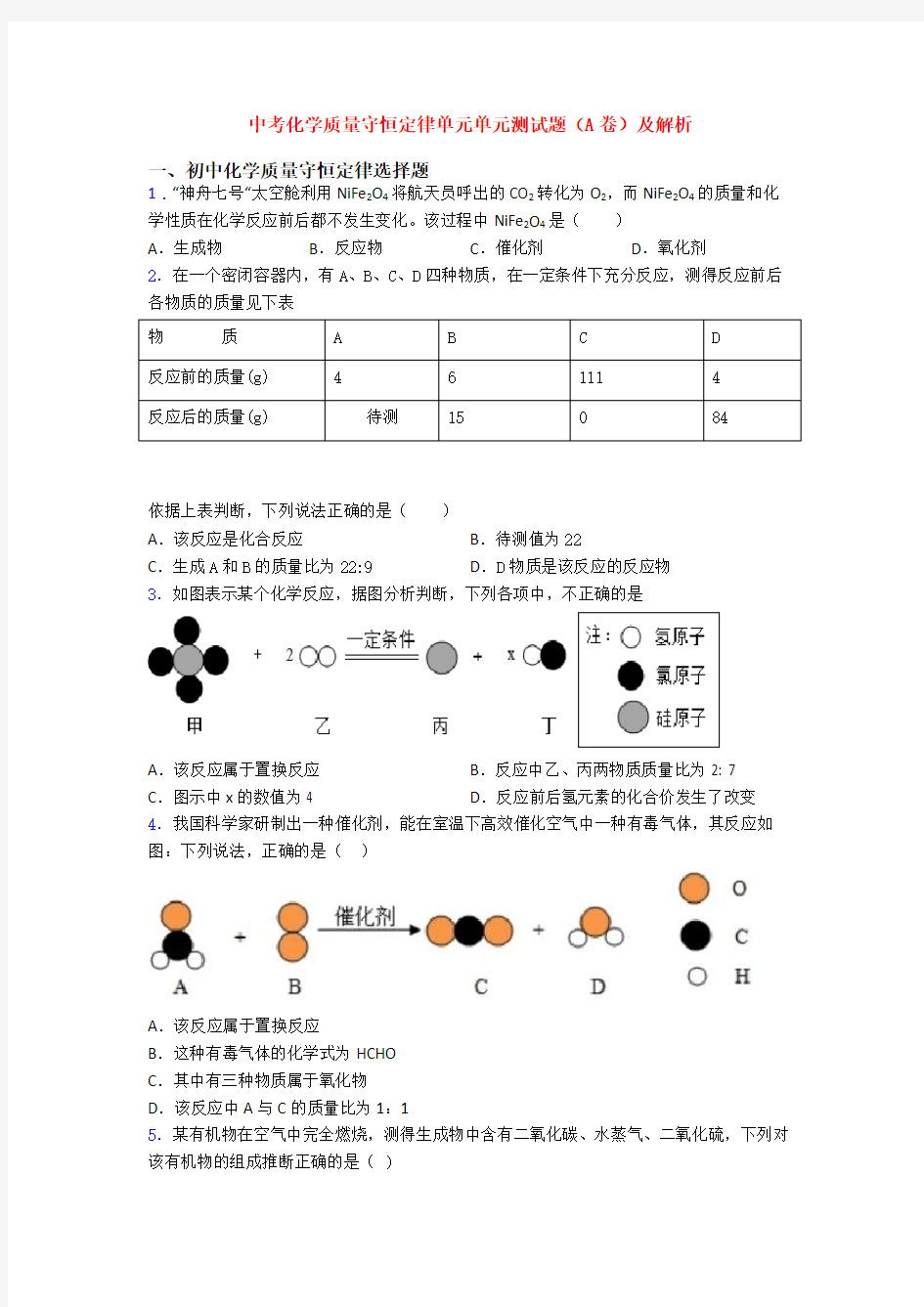
3.如图表示某个化学反应,据图分析判断,下列各项中,不正确的是
A.该反应属于置换反应B.反应中乙、丙两物质质量比为2: 7
C.图示中x的数值为4 D.反应前后氢元素的化合价发生了改变4.我国科学家研制出一种催化剂,能在室温下高效催化空气中一种有毒气体,其反应如图:下列说法,正确的是()
A.该反应属于置换反应
B.这种有毒气体的化学式为HCHO
C.其中有三种物质属于氧化物
D.该反应中A与C的质量比为1:1
5.某有机物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物的组成推断正确的是()
A.一定含碳、氢、硫元素B.一定含有碳、氢、氧元素
C.只含碳、氢元素D.一定含碳、氢、氧元素,可能含有硫元素6.将一定量xFeSO4?y(NH4)2SO4?6H2O晶体加入到过量NaOH溶液中,加热生成
NH30.85g(假如生成NH3的全部逸出),过滤、洗涤、灼烧,得Fe2O3固体2.0g.则x,y 的关系正确的是()
A.x:y=1:1 B.x:y=1:2 C.x:y=1:4 D.x:y=2:1
7.科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下图,有关该反应的说法正确的是()
A.该反应属于化合反应B.反应前碳元素的化合价为+2 价
C.生成物的化学式可用 C2H2O 表示D.参加反应的两物质的质量比为 1:1
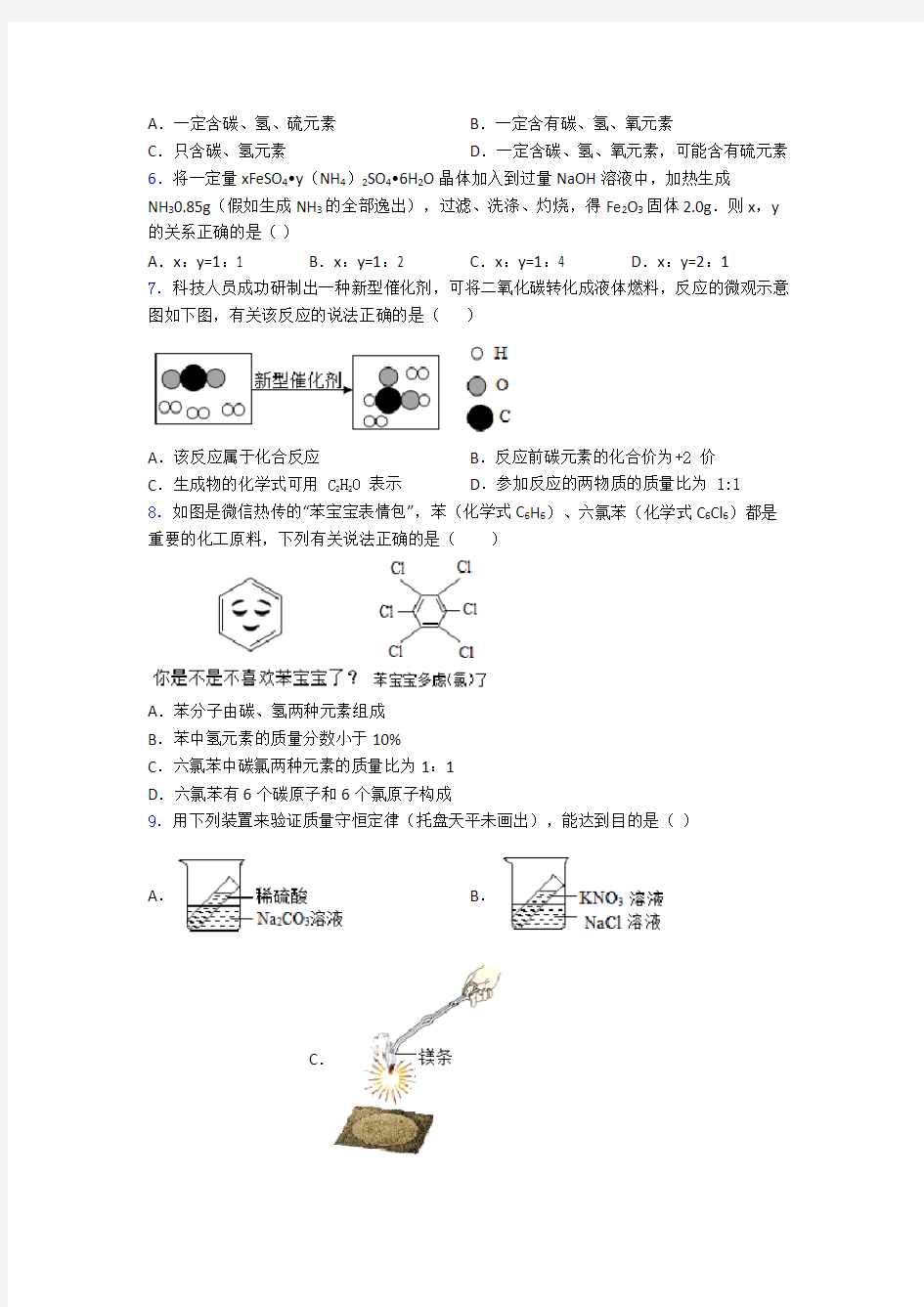
8.如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是()
A.苯分子由碳、氢两种元素组成
B.苯中氢元素的质量分数小于10%
C.六氯苯中碳氯两种元素的质量比为1:1
D.六氯苯有6个碳原子和6个氯原子构成
9.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的是()
A.B.
C.
D.
10.在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是()
物质甲乙丙丁
反应前质量/g100.3 4.8 2.8
反应后质量/g 3.2待测8 6.4
A.待测值为0.6
B.此反应可表示为:丙+丁→甲
C.反应中甲和丁变化的质量比为1:2
D.甲一定是化合物
11.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:
物质甲乙丙丁
反应前的质量(g)561820
反应后的质量(g)1002X
下列说法不正确的是()
A.x为64B.参加反应的乙的质量为18g
C.参加反应的甲物质的质量为46g D.丙物质一定作催化剂
12.下列化学用语的使用及其表示的意义,正确的是
A.2H2 2个氢气B.4H 4个氢元素
C.Ca+2—个钙离子D.2CO2两个二氧化碳分子
13.下列化学用语及结构正确的是()
A.3个铁离子:3Fe2+B.氦气:He2
C.4个氢原子:4H D.氯离子的结构示意图:
14.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是()
物质a b c d
反应前的质量(g)8.4 3.2 4.0 2.8
反应后的质量(g)X 1.68.8 2.8
A.反应中a和b的质量比为2:1
B.d一定是催化剂
C.上表中X=3.2
D.该反应是分解反应
15.观察图片,结合已学知识,判断下列说法正确的是()
A.反应前的物质都是化合物
B.反应后的粒子一定是水分子
C.反应前后原子数目一定发生变化
D.反应前后分子种类一定发生变化
16.在密闭容器中有甲、乙、丙、丁四种物质、在一定条件下反应,测得反应前及反应过程中的两个时刻各物质的质量分数如下图所示。图中a、b、c、d分别表示相应物质的质量分数。下列数据正确的是
A.a=56%B.b=6%C.c=17%D.d=8%
17.过氧乙酸(C2H4O3)是常见的消毒剂。下列有关过氧乙酸的说法正确的是
A.分子中含O3分子 B.氢、氧原子的个数比为4:3
C.分子中有9种元素 D.碳的质量分数为24%
18.在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的 2 倍。则下列说法不正确的是()
甲的质量/g乙的质量/g丙的质量/g丁的质量/g
反应前6410116
t 时刻48a未测未测
反应后054b0
A.乙和丙为生成物
B.a 等于 21
C.b 等于 37
D.该反应方程式中甲与丁的化学计量数之比为 1:2
19.软玉也称“中国玉”,以新疆“和田玉”为代表,生成“和田玉”矿床的反应方程式是
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,则R的化学式为()A.CaCO3B.Ca(OH)2C.Mg(OH)2D.MgCO3
20.根据下列粒子结构示意图,判断下列说法正确的是
A.表示四种不同的元素B.丁表示的是阴离子
C.甲、丙元素具有相似的化学性质D.乙元素在化合物通常中显+1 价
21.一定条件下,甲、乙混合后发生化学反应,测得反应前后各物质的质量变化如下表所示。下列说法中,不正确的是()
物质甲乙丙丁
反应前的质量/g50200
反应后的质量/g23X243
A.x的值等于2 B.甲一定是化合物
C.该反应是化合反应D.反应时丙和丁的质量比为8:1
22.维生素C,可能是我们平时最熟悉的维生素,当我们出现口腔溃疡的时候,可能就是由于缺少它引起的。其实,维生素C的作用远不止祛除口腔溃疡,我们若是睡觉之前适量的补充一些维生素C,或许能收获许多好处。维生素C的结构简式如图所示,下列有关叙述错误的是()
A.维生素C的化学式为:C6H8O6
B.维生素C的一个分子中含有20个原子核
C.维生素 C属于有机高分子化合物
D.维生素C中碳、氢、氧三种原子质量比为9:1:12
23.合成尿素的化学方程式为:CO2+2X 一定条件
CO(NH2)2+H2O,X的化学式为()
A.NH3B.N2H4C.HNO3D.NH3?H2O
24.在一个密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下,下列说法正确的是
物质A B C D
反应前质量461114
反应后质量待测15084
A.该密闭容器中发生的化学变化属于化合反应
B.密闭容器中发生的化学变化属于分解反应
C.该反应中四种物质(参加反应或生成)的质量比为
D.反应后密闭容器中的质量为
25.A、B、C三种物质各15g,它们化合时只能生成30g新物质D.若增加10gA,则反应停止后,原反应物中只剩余C.根据上述条件推断,下列说法正确的是()
A.第一次反应停止后,B剩余9g
B.第二次反应后,D的质量为60g
C.反应中A和B的质量比是3:2
D.反应中A和C的质量比是5:2
26.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化如图,下列说法中不正确的是( )
A.该反应为分解反应
B.丙可能为该反应的催化剂
C.反应中甲物质和乙物质的质量比为3∶1
D.乙一定是化合物
27.将一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得各物质的质量如表:
物质a b c d
反应前的质量/g 6.414.0 3.2 1.0
反应一段时间后的质量/g 10.0 7.2 x 1.0
下列有关说法正确的是( ) A .a 和b 是反应物 B .x=3.2
C .该反应属于分解反应
D .d 一定是催化剂
28.如图表示某化学反应的微观过程,下列有关说法正确的是( )
A .该反应属于化合反应
B .反应物甲的质量等于生成物丁的质量
C .甲和丙均为有机物
D .甲的化学式为C 2H 2
29.FeS 2常用于在接触法制硫酸过程中产生SO 2,其化学方程式为4FeS 2+11O 22X+8SO 2,则X 的化学式为
A .FeO
B .Fe 3O 4
C .Fe 2O 3
D .FeSO 4
30.托盘天平两边放两个等质量的烧杯、内装浓度和质量都相同的稀盐酸,若左杯中投入一块生石灰,向右边杯中投入一块石灰石,且两块固体质量相等,则反应后天平的指针将( ) A .偏向左边 B .偏向右边 C .仍指零处 D .无法确定
【参考答案】***试卷处理标记,请不要删除
一、初中化学质量守恒定律选择题 1.C 【解析】 【分析】
在化学反应里能改变反应物化学反应速率(提高或降低)而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质叫催化剂。 【详解】
利用24NiFe O 将航天员呼出的2CO 转化为2O ,而24NiFe O 的质量和化学性质在化学反应
前后都不发生变化,则24NiFe O 为催化剂,故选C 。 2.C 【解析】
由表中数据分析可知,反应前后,B 的质量增加了9g ,是生成物,生成B 的质量为9g ;C 的质量减少,是反应物,减少的质量是111g ;同理可以确定D 是生成物,生成D 的质量为80g ;由质量守恒定律,A 应是生成物,且生成的质量为111g-9g-80g=22g ,反应后丁的质量为4g+22g=26g 。A 、由以上分析可知该反应是一种物质反应生成三种物质,所以属于分解反应,错误;B 、反应后密闭容器中A 的质量为26g ,错误;C 、生成A 和B 的质量比=22g: 9g= 22:9,正确;D 、D 物质是该反应的生成物,错误。 故选C 。
点睛:本题考查了质量守恒定律的应用,解题的关键是分析表中数据,灵活运用质量守恒定律,在化学反应中质量增加的是生成物,质量减少的是反应物。 3.B 【解析】 【分析】
由化学反应的微观模型图可知,该反应是在一定条件下氢气与四氯化硅(SiCl 4)反应生成
了硅和氯化氢气体,反应的化学方程式为:42SiCl +2H Si+4HCl 一定条件
,由方程式可知: 【详解】
A 、该反应是一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应,故A 正确;
B 、反应中乙、丙两物质质量比就是氢气和硅的质量比为:(2×1×2):28=1:7,故B 不正确;
C 、由方程式可知,图示中x 的数值为4,故C 正确;
D 、由方程式可知,氢元素的化合价由0价变成了+1价,故D 正确。故选B 。 4.B 【解析】 【分析】
根据图中的微粒模拟图,可推测其反应的化学方程式为:2222CH O+O CO +H O 催化剂
CH 2O+O 2CO 2+H 2O 。 【详解】
A 、置换反应是指由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,该反应的生成物是两种化合物,错误;
B 、根据O 2、CO 2、H 2O 都无毒,可推测这种有毒气体的化学式为HCHO ,正确;
C 、四种物质中,只有CO 2、H 2O 两种物质属于氧化物,其余物质不是氧化物,错误;
D 、根据化学方程式可知,该反应中A 与C 的质量比=30:44,错误。 故选B 。 5.A
【解析】
【分析】
【详解】
物质+氧气 = 二氧化碳+水蒸气+二氧化硫,根据元素守恒,物质中一定含有碳、氢、硫元素,可能含氧元素,故选A。
6.A
【解析】
【分析】
【详解】
据质量守恒定律可以知道,晶体中的氮元素和氨气中的氮元素的质量相等,而晶体中的铁元素的质量和生成的氧化铁中的铁元素的质量相等,即:
56x:(14×2)y=(2.0g××100%):(0.85g××100%)
解得:x:y=1:1,故选A.
7.A
【解析】
【分析】
【详解】
A.由图可知,该反应是多变一的反应,故该反应属于化合反应,正确;
B.反应前碳元素的化合价为+4价,故错误;
C.生成物的化学式可用CH2O2表示,故错误;
D.参加反应的两物质的质量比为44:2=22:1,故错误。本题选A。
8.B
【解析】
【分析】
【详解】
A、苯是由苯分子构成的,苯是由碳元素与氢元素组成的,说法错误;故不符合题意;
B、苯中氢元素的质量分数为
16
100%7.7%<10%
16+126
?
?≈
??
,说法正确;故符合题
意;
C、由六氯苯的化学式C6Cl6。可知,其中碳元素和氯元素的质量比为:(12×6):(35.5×6)=12:35.5,说法错误;故不符合题意;
D、一个六氯苯分子由6个碳原子和6个氯原子构成,说法错误;故不符合题意;
故选B
【点睛】
本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。
9.D
【解析】
试题分析:A、生成物中有气体生成,装置也不是密闭容器,不能验证;B、两种物质不反应,不能验证;C、镁带在空气中燃烧,反应后固体质量会明显增大,因为有氧气参加,另外该装置也不是在密闭容器中进行,不能验证;D、铁与硫酸铜反应生成铜与硫酸亚铁,反应物中没有气体参加生成物中也没有气体生成,装置可不密闭,可以验证。故选D。
考点:质量守恒定律及其应用
10.D
【解析】
【分析】
反应后质量增加的属于生成物,反应后质量减少的属于反应物,反应后质量不变可能属于催化剂。
【详解】
由表中数据分析可知,在反应前后,甲的质量减少了10g﹣3.2g=6.8g,是反应物,参加反应的甲的质量为6.8g;同理可以确定丙是生成物,生成的丙的质量为8g﹣4.8g=3.2g;丁是生成物,生成的丁的质量为6.4g﹣2.8g=3.6g;根据质量守恒定律,乙的质量不变,可能作该反应的催化剂,也可能没有参加反应,待测的数值为0.3g。A、根据以上分析可知待测值为0.3,错误;B、根据以上分析可知该反应的反应物为甲,生成物是丙和丁,此反应可表示为:甲→丙+丁,错误;C、根据以上分析可知反应中甲和丁变化的质量比为6.8g:3.4g=2:1,错误;D、该反应的反应物为甲,生成物是丙和丁,属于分解反应,甲是分解反应的反应物,一定是化合物,正确。故选D。
【点睛】
解题的关键是分析表中数据(反应后质量增加的属于生成物、质量减少的属于反应物),灵活运用质量守恒定律。
11.D
【解析】
根据质量守恒定律可知:反应前各物质的质量总和=反应后生成各物质的质量总和,所以X=56+18+2+0-10-0-2=64;根据反应中反应物质量会减少,生成物质量会增加,可以判断反应物为:甲、乙,而生成物为丁,丙质量不变,可能做催化剂
A、X=56+18+2+0-10-0-2=64,正确;
B、参加反应的乙的质量为18g,正确;
C、参加反应的甲物质的质量为56g-10g-46g,正确;
D、丙质量不变,可能做催化剂,错误。
12.D
【解析】
【详解】
A、由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2H2可表示2个氢分子,故选项说法错误。
B、由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故4H可表示4个氢原子,故选项说法错误。
C、离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,
数字在前,正负符号在后,带1个电荷时,1要省略。一个钙离子可表示为Ca2+,故选项说法错误。
D、由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其分子符号前加上相应的数字,则2CO2可表示两个二氧化碳分子,故选项说法正确。
故选:D。
13.C
【解析】
【详解】
A、铁离子带有3个单位的正电荷,故A选项错误;
B、氦气直接由原子构成,故化学式为He,故B选项错误;
C、4个氢原子表示为4H,故C选项正确;
D、氯离子的结构示意图中最外层的电子数是8,故D选项错误。故选C。
14.A
【解析】
【详解】
A、X=8.4+3.2+4.0﹣1.6﹣8.8=5.2,反应中a和b的质量比为:(8.4﹣5.2):(3.2﹣
1.6)=2:1,该选项说法正确;
B、d反应前后质量不变,可能是催化剂,也可能既不是催化剂也不是反应物和生成物,该选项说法不正确;
C、X=5.2,该选项说法不正确;
D、反应后a、b质量减小,都是反应物,c质量增大,是生成物,该反应是化合反应,该选项说法不正确。
故选:A。
15.D
【解析】
【分析】
化合物是由不同种元素组成的纯净物,化合物的分子由不同种原子构成。
【详解】
A、反应中)与都是由不同种原子构成的分子,属于化合物的分子,因此为化合物;而表示由同种原子构成的分子,为单质分子,所以为单质;故A不正确;
B、虽然中原子的个数比是2:1,但反应物的分子是和,即化合物和单质的反应,类似于一氧化碳和氧气反应产生二氧化碳,因此反应后的微粒不一定是水分子,故B不正确;
C、反应前的三个分子中共含有2个原子和4个原子共6个原子,反应后的二个生成物的分子中含2个原子和4个原子共6个原子,反应前后原子种类、数目都不变;故C不正确;
D、反应前的分子是和,反应后的分子是,所以反应前后分子种类一定发生变化,故D正确。故选D。
【点睛】
由同种元素组成的纯净物是单质,由不同元素组成纯净物是化合物。 16.A 【解析】
对比图1、图2和图3得,反应后甲和乙质量减少了,丙质量增加了,丁反应前后质量没有变化,则甲+乙丁丙。A 、甲由70→42,减少了28,图2应减少14,a =70%-14%=56%;B 、乙由14%→11%,减少了3%,图3应减少6%,b =14%-6%=8%;C 、丙由6%→40%,增加了34,图2应增加17,c =6%+17%=23%;D 、对比图1和图3得,丁反应前后质量分数没有改变,d =10%。故选A 。 17.B
【解析】A .分子是由原子构成的,过氧乙酸分子中含有氧原子,不是O 3分子,错误;B .由化学式可知,过氧乙酸(C 2H 4O 3)中氢、氧原子的个数比为4:3,正确;C .分子是由原子构成的,不是由元素组成的,错误;D .过氧乙酸(C 2H 4O 3)中碳元素的质量分数=×100% =31.6%,错误。故选B 。
点睛:结合新信息,灵活运用化学式的意义是解题的关键。
18.D 【解析】 【详解】
A 、b =64+10+1+16﹣54=37,根据题目提供信息可知,甲、丁是反应物,乙、丙是生成物,故A 正确;
B 、设t 时刻生成乙的质量为x
++64g 54g-10g 64g-48g x
→甲丁乙丙 64g 64g-48g
=54g-10g x
x =11g
a =10g+11g =21g ,故B 正确;
C 、根据A 中计算结果可知b =37,故C 正确;
D 、设丁的相对分子质量为m ,则甲的相对分子质量为2m ,该反应的化学方程式可表示为:
a +
b
c +
d 26416am bm g g
→甲丁乙丙 2am 64g
=bm 16g
a :
b =2:1,故D 错误。 故选:D 。 19.A 【解析】 【分析】
根据质量守恒定律,反应前后元素种类及原子个数均不变。
【详解】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式
5CaMg(CO3)2+8SiO2+H2O=Ca2Mg5(Si4O11)2(OH)2+7CO2↑+3R,反应前钙、镁、碳、氧、硅原子个数分别为5、5、10、47、8,反应后的生成物中钙、镁、碳、氧、硅原子个数分别为2、5、7、38、8,根据反应前后原子种类、数目不变,则3R分子中含有3个钙原子、3个碳原子和9个氧原子,则每个R分子由1个钙原子、1个碳原子和3个氧原子构成,则物质X的化学式为CaCO3。
故选:A。
【点睛】
本题难度不大,掌握质量守恒定律,根据化学反应前后原子种类、原子个数均不变解答即可。
20.D
【解析】
【详解】
A. 质子数决定元素的种类,故上图共表示三种不同的元素,选项错误;
B. 丁表示的微粒质子数大于核外电子数,带正电,是阳离子,选项错误;
C. 具有稳定结构的原子彼此化学性质相似,不是稳定结构的原子,最外层电子数相同的化学性质相似,甲、丙不具有相似的化学性质,选项错误;
D. 乙元素的原子最外层电子数为1,反应易失去一个电子,形成带一个单位正电荷的阳离子,在化合物通常中显+1 价,选项正确。
故选D。
【点睛】
在原子结构示意图中,小圆圈表示原子核,圆圈内的数字为质子数;弧线表示电子层,弧线上的数字为该层上的电子数。
21.C
【解析】
【分析】
根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则50+2=23+x+24+3,x=2。
【详解】
A、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则50+2=23+x+24+3,x=2,故A正确;
B、由表格数据可知,甲的质量减少,甲是反应物,乙的质量反应前后没变,乙是催化剂或没参加反应,丙丁的质量增加,则丙丁是生成物,则甲是化合物,故B正确;
C、甲的质量减少,甲是反应物,乙的质量反应前后没变,乙是催化剂或没参加反应,丙丁的质量增加,则丙丁是生成物,反应是甲生成丙丁的反应,为分解反应,故C不正确;
D、反应时丙和丁的质量比为24:3=8:1,故D正确。故选C。
【点睛】
反应中减少的我反应物,增加的为生成物。 22.C 【解析】 【详解】
A .由分子结构简式可知,维生素C 的化学式为:C 6H 8O 6,叙述正确,故不符合题意;
B .由化学式可知,每个维生素
C 分子中含有20个原子,每个原子有一个原子,所以维生素C 的一个分子中含有20个原子核,叙述正确,故不符合题意;
C .有机高分子化合物的相对分子质量大到几万、甚至几十万,而维生素C (化学式C 6H 8O 6)的相对分子质量为6×12+8×1+6×16=176,所以不属于有机高分子化合物,叙述错误,故符合题意;
D .维生素C 中碳、氢、氧三种元素质量比为(12×6):(1×8):(16×6)=9:1:12,叙述正确,故不符合题意。故选C 。 23.A 【解析】 【分析】
由质量守恒定律:反应前后,原子种类、数目均不变。 【详解】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式
2222CO +2X
CO(NH )+H O 一定条件
,反应前碳、氢、氧、氮原子个数分别为1、0、
2、0,反应后的生成物中碳、氢、氧、氮原子个数分别为1、6、2、2,根据反应前后原子种类、数目不变,则2X 分子中含有2个氮原子和6个氢原子,则每个X 分子由1个氮原子和3个氢原子构成,则物质X 的化学式为3NH 。故选A 。 24.B 【解析】 【分析】
根据化学反应前后物质的总重量不变,可得:(4+6+111+4)g=(待测+15+0+84)g ,故待测=26g 。根据各物质反应前后质量的增减,即反应后质量增加的为生成物,反应后质量减少的为反应物,可知A 、B 、D 是生成物,C 是反应物,故该反应为C→A+B+D 是分解反应。 【详解】
A 、该反应为C→A+B+D 是分解反应,故选项错误;
B 、该反应为C→A+B+D 是分解反应,故选项正确;
C 、该反应中四种物质(参加反应或生成)的质量比为(26-4)g :(15-6)g :111g :(84-4)g=22:9:111:80,故选项错误;
D 、反应后密闭容器中的质量为26克,故选项错误。故选B 。 25.D 【解析】 【详解】
由题意可知,第一次A全部反应,B、C有剩余;若增加10gA,25gA时,与15gB也会恰好反应,只剩余C;
设:第一次反应停止后,参加反应的B的质量为x,第二次反应后,D的质量为y
A+B+C→D
15g x 30g
25g 15g y
x=9g,因此剩余B是6g;y=50g
根据质量守恒定律:第一次参加反应的C的质量=30g﹣15g﹣9g=6g,因此反应中A和C的质量比=15g:6g=5:2故选D
26.C
【解析】
【分析】
由反应前后各物质的质量变化可知甲的质量增加了2g,即甲是生成物;乙的质量减少了6g,属反应物;丁的质量增加了4g,属生成物。根据质量守恒定律化学反应前后物质的总质量不变,那么丙可能没有参与反应,也可能是该反应的催化剂,该反应的表达式为:乙→甲+丁。
【详解】
A、由反应的表达式乙→甲+丁可知该反应为分解反应,选项A正确;
B、丙的质量不变,故丙可能没有参与反应,也可能是该反应的催化剂,选项B正确;
C、反应中甲物质和乙物质的质量比为:2g∶6g=1∶3,选项C错误;
D、因为该反应是分解反应,分解反应的反应物一定是化合物,乙是该反应的反应物,所以乙一定是化合物,选项D正确。故选C。
27.C
【解析】
反应后质量增多的物质是生成物,质量减少的物质是反应物。增多的质量是生成的质量,减少的质量是参加反应的质量。a质量增多,是生成物,生成的质量为:10.0g-
6.4g=3.6g,b质量减少,是反应物,参加反应的质量为:14.0g-
7.2g=6.8g,d的质量不变,可能作催化剂,6.8g>3.6g,根据质量守恒定律,c是生成物,生成的质量为:6.8g-
3.6g=3.2g,该反应是:b=a+c。A. b是反应物,错误;B. x=3.2+3.2=6.4,错误;C. 该反应属于分解反应,正确;D. d可能是催化剂,错误。故选C。
点睛:首先根据反应前后的差量判断出物质是反应物还是生成物,然后根据质量守恒定律,确定出待测质量的物质是反应物还是生成物,问题即可迎刃而解。
28.D
【解析】
【分析】
【详解】
A、该反应中生成物为两种,而化合反应的生成物为一种,选项说法错误;
B、依据质量守恒定律可得,参加反应的甲和乙的质量总和=生成的丙和丁的质量总和,选
项说法错误;
C、丙为二氧化碳,具有无机物的性质,属于无机物,选项说法错误;
D、因为化学变化前后元素种类不变,原子个数也没有增减,反应后碳氢氧的原子个数分别为:4、2和10,已知反应前有10个氧原子,故2甲中一共有4个碳原子、2个氢原子。故甲的化学式为C2H2,选项说法正确,故选D。
29.C
【解析】
由反应的化学方程式4FeS2+11O22X+8SO2,反应前铁、硫、氧原子个数分别为
4、8、22,反应后的生成物中铁、硫、氧原子个数分别为0、8、16,根据反应前后原子种类、数目不变,则2X分子中含有4个铁原子和6个氧原子,则每个X分子由2个铁原子和3个氧原子构成,则物质X的化学式为Fe2O3。故选C。
30.A
【解析】
【详解】
生石灰即氧化钙,虽与盐酸反应,但无气体生成;石灰石主要成分是碳酸钙,与盐酸反应会产生二氧化碳气体,两固体质量相等,由于石灰石一侧产生气体,故质量减小,天平指针偏向另一侧。选A。
