不合格产品处置记录表(模板)
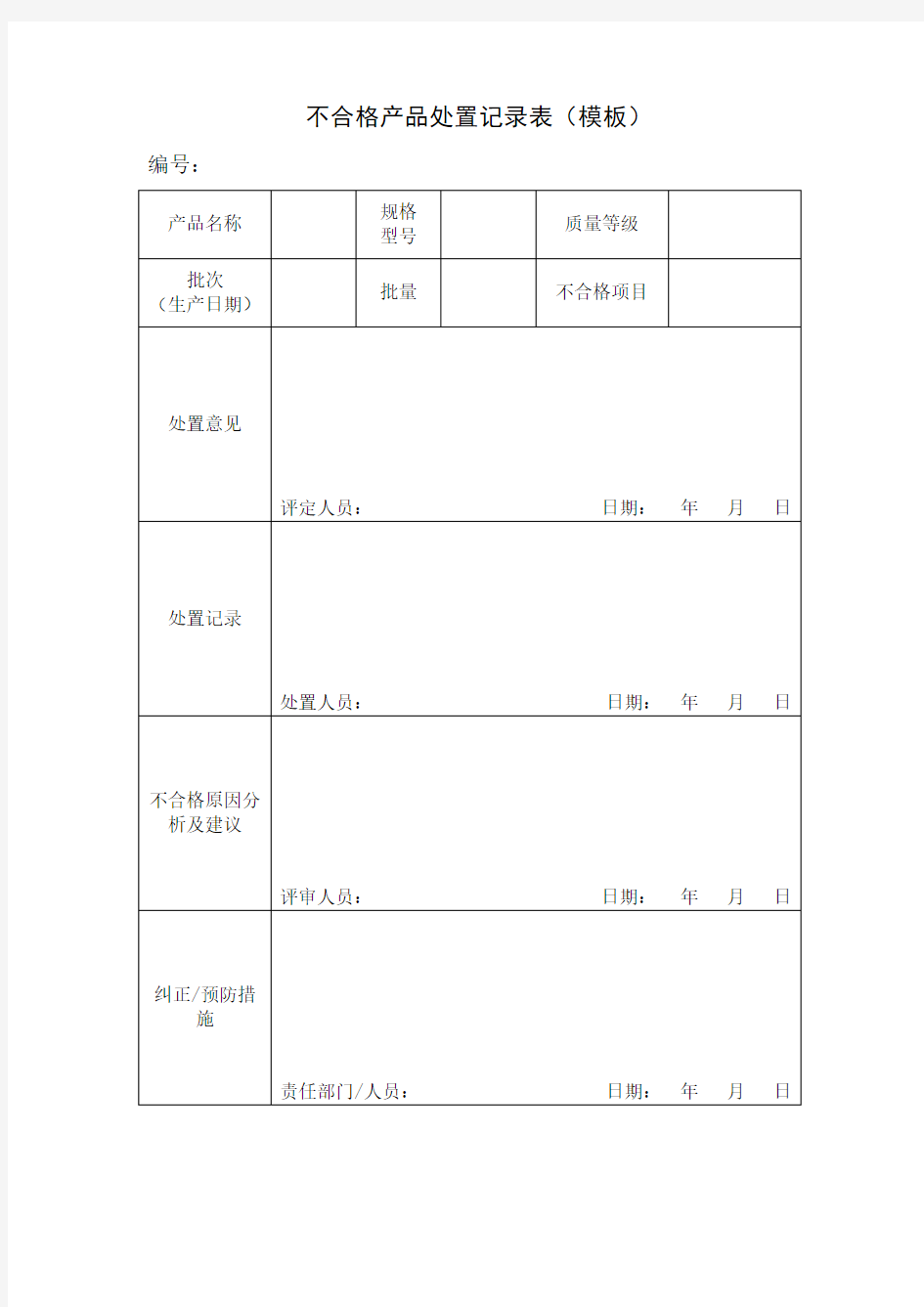

不合格产品处置记录表(模板)编号:
产品名称规格
型号
质量等级
批次
(生产日期)
批量不合格项目
处置意见
评定人员:日期:年月日处置记录
处置人员:日期:年月日
不合格原因分
析及建议
评审人员:日期:年月日
纠正/预防措
施
责任部门/人员:日期:年月日
表13
不合格药品销毁的管理规定
湖北百惠医药有限公司 不合格药品销毁的管理规定 文件名称不合格药品销毁的管理规定页数 1 文件编号HBBH-QM-016-2013 版本号第三版 起草人:高建民审核人:何水平批准人:刘翠华 日期:2013年5月5日日期:2013年5月25日执行日期:2013年6月1日 变更记录时间:变更原因: 一、目的:为了明确报损药品销毁工作的申请和监督管理,制定本制度。 二、依据:《药品管理法》、《药品经营质量管理规范》(卫生部令第90号)、《药品流通管理办法》等法律法规。 三、范围:药品保管员、养护员、质量管理员工作适用本制度。 四、责任:质量管理机构负责对不合格药品实行有效控制管理。 五、内容: 1、销毁申请:经质量管理部门同意,财务部审核,领导批准后不合格药品,要定期清理,集中销毁。在集中销毁之前,质量管理部要监督仓储部门填报《不合格药品报损审批表》并附《报损药品清单》。 2、销毁周期:每年进行一次报损药品的集中销毁工作。、 3、销毁监控:药品在出库销毁之前,必须在质量管理部门的监控下,对账清点药品实物,防止不合格药品流失导致安全事故等不良后果。销毁处理在药品监督管理部门的监督下,考虑防止污染环境,远离市区及人口居住区和风、水上游;采取捣碎、焚毁、深埋等不留后患的有效措施进行销毁。质管部必须从出库到销毁结束全称监控。 4、销毁记录:报损药品销毁的过程中,质量管理部必须监督各环节准确记录并签字。审核、批准的原件交财务部做核销凭据,质量管理部将复印件和全称记录文件资料在事后三日内整理存档,长期保存。 5、销毁的药品要进行登记,记录内容为:药品名称、规格、批号、销毁数量、销毁原因、经手人、销毁时间、地点、方式等。 6、在进行药品销毁时,至少有2人在场,及时在销毁登记表上坐记录并签字。 7、对特殊药品的销毁,要上报药品监督管理部门,并由药品监督管理部门监督销毁。
不合格药品、药品销毁管理制度
惠康药房质量管理制度文件名称:不合格药品、药品销毁管理制度编号:SZHKQM0142013 起草人:审阅人:批准人:起草日期:2013.7.31 批准日期:2013.10.02 执行日期:2012.10.03 版本号:04 变更记录:变更日期:发至部门:购进、营业、养护、质管。目的:严格不合格药品的控制管理,严防不合格药品购进、陈列、售出,确保消费者用药安全。依据:《药品经营质量管理规范》及其实施细则。一、质量管理员负责对不合格药品实行有效管理。二、质量不合格药品不得采购、陈列和销售。凡与法定质量标准及有关规定不符的药品,均属不合格药品,包括:1、药品的内在质量不符合国家法定质量标准及有关规定的;2、药品的外观质量不符合国家法定质量标准及有关规定的;3、药品包装、标签、说明书,批号,有效期等不符合国家有关规定的;4、质量证明文件不合格的药品5、来源不符合规定的药品。6、药监部门发文要求停止使用的药品7、对药品的内在质量有怀疑而不能确定其质量状况时,应抽样送市药品检验所检验。三、在药品购进验收时发现不合格药品,验收员应在验收记录中说明,填写《药品拒收报告单》,
同时药品移入不合格药品区,并报质量管理人员进行复核;经质量管理人员确认为不合格的药品,视合同是否允许退货情况按相应手续进行。1、在养护检查中,发现质量可疑药品,养护员应将药品移入待验区或挂上黄色的“质量可疑”标志,填写《不合格(可疑)药品确认、报告表》,并向质量管理员报告,经复核确认为不合格的药品,应将其存放在红色标志的不合格品区,并通知将该批号药品撤离柜台,不得继续销售;如复核确认不属于不合格药品,应将药品移回合格区或去除“质量可疑”标志。2、已确认的不合格药品如购销合同规定可以退货的情形(假劣药品不得退货),将药品移入退货区,按退货手续办理,不能退货的品种进入按报损程序处理。3、在调配过程中由于操作失误(如将药品掉落地面造成药品污染等情况)产生不合格药 - 28 - 品,可简化程序,将药品移入不合格药品区,填写《不合格 药品报损审批表》,报质量负责人处理。4、售后使用过程中出 现质量问题的药品,由质量管理人员依据顾客意见及具体情况 协商处理。四、质量管理员在检查中发现不合格药品,应出具 不合格药品通知单,及时通知营业员立即停止销售,同时将不 合格药品存入于不合格区,挂红色标识。五、上级药品监督管 理部门检查、抽验发现不合格品,应立即停止销售,同时将不
不合格药品药品销毁管理制度
惠康药房质量管理制度 目的:严格不合格药品的控制管理,严防不合格药品购进、陈列、售出,确保消费者用药安全。 依据:《药品经营质量管理规范》及其实施细则。 一、质量管理员负责对不合格药品实行有效管理。 二、质量不合格药品不得采购、陈列和销售。凡与法定质量标准及有关规定不符的药 品,均属不合格药品,包括: 1、药品的内在质量不符合国家法定质量标准及有关规定的; 2、药品的外观质量不符合国家法定质量标准及有关规定的; 3、药品包装、标签、说明书,批号,有效期等不符合国家有关规定的; 4、质量证明文件不合格的药品 5、来源不符合规定的药品。 6、药监部门发文要求停止使用的药品 7、对药品的内在质量有怀疑而不能确定其质量状况时,应抽样送市药品检验所检 验。 三、在药品购进验收时发现不合格药品,验收员应在验收记录中说明,填写《药品拒 收报告单》,同时药品移入不合格药品区,并报质量管理人员进行复核;经质量管理人员确认为不合格的药品,视合同是否允许退货情况按相应手续进行。 1、在养护检查中,发现质量可疑药品,养护员应将药品移入待验区或挂上黄色的
“质量可疑”标志,填写《不合格(可疑)药品确认、报告表》,并向质量管理员报告,经复核确认为不合格的药品,应将其存放在红色标志的不合格品区,并通知将该批号药品撤离柜台,不得继续销售;如复核确认不属于不合格药品,应将药品移回合格区或去除“质量可疑”标志。 2、已确认的不合格药品如购销合同规定可以退货的情形(假劣药品不得退货),将药品移入退货区,按退货手续办理,不能退货的品种进入按报损程序处理。 3、在调配过程中由于操作失误(如将药品掉落地面造成药品污染等情况)产生不合格药品,可简化程序,将药品移入不合格药品区,填写《不合格药品报损审批表》,报质量负责人处理。 4、售后使用过程中出现质量问题的药品,由质量管理人员依据顾客意见及具体情况协商处理。 四、质量管理员在检查中发现不合格药品,应出具不合格药品通知单,及时通知营业员立即停止销售,同时将不合格药品存入于不合格区,挂红色标识。 五、上级药品监督管理部门检查、抽验发现不合格品,应立即停止销售,同时将不合格药品存放于不合格区,挂红色标识,做好记录,等待处理。 六、对于假药、劣药和出现严重质量事故的药品,必须立即停止购进和销售,就地封存,并向市食品药品监督管理局报告 七、不合格药品应按规定进行报损和销毁。 1、不合格药品的报损、销毁由质量管理员统一负责,其他各岗位不得擅自处理、 销毁不合格药品。 2、凡属报废药品,填写《不合格药品报损审批表》,经质量负责人签署意见,报企 业负责人核准,按规定进行销毁。一般不合格药品的销毁经批准后应有质量管理人员监督销毁;假劣药品应就地封存,并报送市食品药品监督管理局处理或备案。销毁工作应有记录,销毁的地点应远离水源、住宅等。销毁方式可采取破碎深埋,燃烧等方式。假劣药品销毁事先报告市食品药品监督管理局核准,由药监执法人员到场监督销毁,或上交药监部门统一销毁。 八、对质量不合格的药品,应查清原因,分清责任,及时制定与采取纠正、预防措施。 九、明知为不合格药品仍然继续购进、签验收合格、陈列销售的,应按药房有关规定予以处理,造成严重后果的,报上级药品监督管理部门直至依法予以处罚。
过期药品销毁制度讲解学习
过期药品销毁制度
过期药品销毁制度 目的:明确报废药品销毁工作的申报和监督管理办法。 范围:确认报废的药品。 责任:药库。 内容:1.销毁申报经过财务部核准后,已作报废确认的不合格药品和已作报损的破损药品及其包装,要定期清理和集中销毁。在集中销毁之前,药剂科要监督仓储管理部门填报《药品销毁申报表》并附《报废药品明细表》。 2.销毁周期为了及时清理库房不造成废品堆积、占用场地,每年至少进行一次报废药品的集中销毁工作。在此期间,药监局有统一行动要求时,按统一部署执行。 3.销毁监控药品在出库销毁之前,必须在质管部的监控下对账请点药品实物,防止不合格药品流失导致安全事故等不良后果;销毁处理一定要在有安全保卫部门监督下,考虑防止环境污染,远离市区及人口居住区和风、水上游;采取捣碎、焚毁、深埋等不留后患的有效措施进行销毁。药剂科必须从出库到销毁结束全程监控。 4.销毁记录上述报废药品销毁的过程中,药剂科必须监督各环节准确记录并签字。审核、报批的原件交财务部作核销凭据;药剂科负责以复印件和全程记录文件资料,在事后三日内整理存档,保存期不少于 3 年。
药品报损、销毁制度 一、凡出现破损、变色、发霉、虫蛀、过期失效等质量问题的药品,一律按不合格药品处理。 二、原包装缺损的药品,应由供货商负责调换补货。 1、发生在各药房的原包装破损的药品,由药房凭残损包装向药库索补。药库将残损包装集中后统一向供货商索补。 2、原包装短缺的药品,不管是发生在药房或药库,均需二人以上证明,经药剂科主任签字后向供货商索补。 三、破损、霉变、过期失效药品,药库及各药房汇总填写报废单,报废单须写明药品名称、规格、单价、金额及报损总金额,报损原因等,经质量管理小组查验签字,报药剂科主任审核签字,上报主管院长审批。 四、待批报废药品,应单独集中存放,并有明确标示。 五、经审批报废后的药品,一律集中存放,待药品质量与监督管理小组组织统一销毁。 六、报废药品应严格管理,及时监督销毁。防止流入社会,危害人民群众健康。七、对已过期或其它原因不能继续使用的药品,由保管员、会计填写药品销毁单,科主任同意后上报医院相关部门及院长同意后方可销毁。 八、销毁的药品要进行登记,详细记录下药品名称、规格、批号、销毁数量、销毁原因、经手人、销毁时间、地点、方式、监督人等内容。
不合格药品、销毁管理制度
不合格药品、销毁管理制度 1、质量管理部是企业对不合格药品实行有效控制管理的机构。 2、质量不合格药品不得采购入库和销售,凡与法定质量标准及有关规定不符的药品,均属不合格药品,包括: 2.1国家、省、市药品监督管理部门的药品质量公告或有关通知 和省、市、药品检验机构出具的检验报告书,判定的不合格药品。 2.2药品外观、包装、标签及说明书不符合国家有关规定的药品。 2.3符合《药品管理法》有关假、劣药品规定的。 2.4过期、失效、霉烂变质及有其他质量问题的药品。 3、不合格药品存放不合格品区。 4、在药品入库验收过程中发现质量可疑药品,填写复验单,报告质管部,确认为不合格药品的,由专人存放于不合格药品区。 5、对发现的假劣药品,不得作销售或退换货处理,应及时报告药监主管部门。 6、质管部在检查药品的过程中发现不合格药品,应出具药品停售通知单,及时通知仓储部门和销售部门,立即停止出库和销售;必要时追回已销售的不合格品,并将不合格药品移放于不合格药品区。 7、药品养护过程或出库复核过程中,发现质量可疑药品,挂黄牌,在计算机系统锁定药品,通知质量管理部处理。确定为不合格的,通知保管人员将不合格药品移至不合格药品区。 8、上级药监部门抽查、检验判定为不合格品时,或上级药监、药检
部门公告、发文、通知查处发现的不合格品时,企业应立即停止销售。同时,按销售记录追回销出的不合格药品。并将不合格药品移入不合格药品区,等待处理。 9、药品在收货、验收、入库、储存养护、出库复核、运输过程中,因破损而导致液体、气体、粉末泄漏时,应立即采取隔离、密封、专区存放等方式,进行处理并报告质量管理部,防止对储存环境和其他药品造成污染。 10、不合格药品应按规定进行报废和销毁 10.1 不合格药品的报废由保管人员提出申请,填报《不合格药品报废审批 表》,经质量管理验收员验收、业务副总审批同意后,保管人员库存调整仓库确认。 10.2 报废药品的销毁由保管人员提出申请,填报《报废药品销 毁审批表》,经质管部经理、企业负责人审批同意后,到当地药监部门审批同意后方可销毁。 10.3报废药品销毁时,应在质量管理部及其他相关部门的监督下 进行,并填写《报废药品销毁记录》,销毁假劣药品时,应在药品监督管理部门监督下进行。 11、对质量不合格的药品,应查明原因,分清责任,及时采取预防措施。 12、认真、及时、规范地做好不合格药品的处理、报损和销毁记录。
模板安装检验批质量验收记录GB50204-2015新
01020301□□ 单位(子单位)工程名称分部(子分部) 工程名称 地基与基础分 部-基础子分部 分项工程名称 筏形与箱形基 础分项 施工单位项目负责人检验批容量 分包单位 分包单位 项目负责人 检验批部位 施工依据 《混凝土结构施工规范》GB 50666-2011 验收依据 《混凝土结构工程施工质量验收规范》 GB50204-2015 验收项目 设计要求及 规范规定 最小/实际 抽样数量 检查记录 检查 结果 主控项目1 模板和支架材料的外观、规格 和尺寸 第4.2.1条/ 2 模板及支架的安装质量第4.2.2条/ 3 后浇带处的模板及支架设置第4.2.3条/ 4 支架竖杆和竖向模板安装在 土层上的要求 第4.2.4条/ 一般项目1 模板安装的质量要求第4.2.5条/ 2 隔离剂的品种和涂刷方法、避 免隔离剂沾污、造成污染 第4.2.6条/ 3 模板起拱高度第4.2.7条/ 4 多层连续支模的要求第4.2.8条/ 5 预 埋 件 和 预 留 孔 洞 的 安 装 允 许 偏 差 预埋中心线 位置mm 3 / 预埋管、预留孔中心线位 置mm 3 / 插筋 中心线位置mm 5 / 外露长度mm +10,0 / 预埋 螺栓 中心线位置mm 2 / 外露长度mm +10,0 / 预留洞 中心线位置mm 10 / 尺寸mm +10,0 / 6 模 板 安 装 允 许 偏 差 轴线位置 5 / 底模上表面标高mm ±5/ 模板内 部尺寸 mm 基础±10/ 柱、墙、梁±5/ 楼梯相邻踏步 高差 5 / 柱、墙垂 直度mm 层高≤6m 8 / 层高>6m 10 / 相邻两板表面高低差mm 2 / 表面平整度mm 5 /
不合格产品处理制度
不合格产品控制制度 一目的 对工作的不合格和不合格品进行识别和控制,以防止不合格品的流出所造成的影响,避免工作上的疏忽造成重大的损失。 二适用范围 本程序适用于本公司原材料验收、产品生产过程和使用现场不合格品及成品检验不合格的控制 三职责 3.1 本程序由生产科管理 3.2 评审职责 本公司授权检验人员负责本厂内不合格品的评审 现场不合格品的评审由本公司委派的人员负责 3.3 处置职责 检验人员作出不合格品的处置决定。若不能处置,则上报生产科处置生产人员根据处置决定及时进行处理 3.4 工作程序 原料、成品检验和试验中发现不合格品进行标识、评审,确定不合格品的范围和性质;决定并实施不合格品处置方案,并根据不合格品的严重程度和范围,通知公司领导,生产科有关负责人 四评审、记录 4.1.1 原料检验过程中发现的不合格品由收购检验人员根据合同规定的相应技术标准和补充要求作出评审,做好记录,不合格原料不予
收购。 4.1.2经原料质检员检验且判定为不合格的进货物料,原料质检员应在不合格物料的“原材料进货检验单”上标识不合格,仓库保管员对其标示、隔离存放 4.1.3产品生产过程中不合格品判定由生产技术人员根据标准作出评审,做好质量记录,并通知生产科。 4.1.4对标有本厂标识的成品进行调查、评审、记录,并写出书面报告交材料科。 4.2 标识、隔离 4.2.1原料收购检验时发现的不合格品,一律拒收。储存过程中发现的不合格品,由仓库保管员作出如下标识:不合格品应设立红色标志另行隔离堆放。 4.2.2生产过程中产生的不合格品,由该岗位人员根据技术规程规定作出相应标识,有条件时,应与合格品隔离。 4.2.3对不合格品粘贴“不合格”识别标记,并填写“不合格品通知单”及注明不合格原因 4.2.4不合格品的隔离方法。对不合格品要有明显的标记,存放在工厂指定的隔离区,避免与合格品混淆或被误用,并要有相应的隔离记录 4.2.5不符合规定检验标准的产品,不允许包装入库 4.3 处置 4.3.1检验人员对不合格品评审有作出处置决定,由相关人员进行
不合格的医疗器械销毁记录使用表.docx
不合格医疗器械销毁记录表 日 产品名称规格 生产厂家供货单位生产批号数量报销、销毁原因 处理处理质检员质量管理 期型号结果时间签字人员复核
一次性医疗器械使用销毁制度 一、医院使用的一次性无菌医疗器械,应从具有【医疗器械生产企业许可证】或【医疗器械经营企业许可 证】的企业购进,一次性无菌医疗器械必须符合质量和在有效期内使用,不得从非正规渠道采购,不得使用失效或不合格产品。 二、所购进的医疗器械应建立采购、验收和保管制度,内容包括生产企业名、品名、型号产品名称、规 格、数量价格、生产批号、灭菌日期及有效期等。 三、使用单位(科室)必须建立(一次性使用医疗器械登记本),应有领用数量,已使用数量、结余数帐目相 符。 四、使用后的一次性医疗器械应立即毁形,使其不再具有重复使用功能,对毁形后的器械立即放入备好 的消毒液中浸泡30 分钟以上,在 2 天内同两人以上进行焚烧或深埋处理,并认真如实作好记录。 五、科室购(领)用的一次性使用医疗器械,只限于科室临床使用,不得转卖或提供给他人流入社会。 六、凡未按照本制度执行的一经查出,将按照【一次性使用医疗器械监督管理条例】的有关规定进行处 罚。
上海徐汇区卫生院 医院药品报废及销毁制度 一、医院药品、医疗器械发生损坏、失效、过期、变质、变形等一种情况时,由使用科室上报,经药品、医疗器械管理委员会确认 后可以报废,按规定进行销毁。 二、为了防止不合格药品、医疗器械流失,有关部门要及时对报废药品、医疗器械进行清理、销毁。 三、报废药品是指 :1. 经药品、医疗器械管理委员会确认其质量问题及其他原因不能销售和不能退货的药品; 2. 经医药监督管理部门抽检认定为不合格的药品。 四、报废医疗器械是指: 1. 设备达到甚至超过其使用寿命,因结构陈旧,性能已不能达到低限技术指标,且无维修、改造价值,自 然淘汰的器械。 2. 因自然原因、人为因素导致损坏且无法修复的器械。 3. 因行业指南认定其无使用价值的强制淘汰的器械。 五、报废药品、医疗器械应专库(区)储。 1. 报废特殊药品器械必须在原库划定区域内加锁储存,并要有明显标志。 2. 报废药品、医疗器械、要专人专帐管理,帐卡登记准确,保证帐货相符。 3. 报废药品、医疗器械要及时做无害化销毁处理,不得长期积存。 六、报废药品的销毁1、小批量报废药品的销毁:(1)金额不超过 5000 元的报废药品。销毁前由保管员填写“报废药品销毁表”,库房会计清点品种和数量,由药品、医疗器械管理委员会审批同意签字后,可按规定进行销毁。(2)销毁时要由业务院长,医务科长, 药剂科主任,保管负责人共同监督下进行。(3)销毁后,业务院长,医务科长,药剂科主任,库房会计,保管负责人共同在销毁表上签 字,凭销毁表销帐、归档。2、大批量报废药品的销毁:( 1)金额超过(含) 5000 元以上的报废药品,由业务院长审批后,填报“报 废药品销毁表”,于销毁前报药食监局报备。(2)上级单位无异意,按前述小批量报废药品程序办理。3、凡属药品监督管理部门通知或
不合格药品处理操作规程
一、目的:通过制定实施不合格药品质量管理操作规程,有效控制不合格药品的处理过程,以保证经营药品的质量符合规定的要求。 二、职责:质量管理部、业务部负责对不合格药品的确认、报告、报损、销毁全过程实施控制性管理。 三、范围:适用于不合格药品处理的全过程。 四、主要内容: 1.不合格药品的定义: 凡不符合国家有关法律、法规,不符合药品质量标准,包装不符合规定以及药监部门明文规定禁止销售的药品均属不合格药品。有以下情形的,按不合格品处理: 《药品管理法》规定的假药、劣药。 质量证明文件不合格的药品。 包装、标签、说明书内容不符合规定的药品。 包装破损、被污染,影响销售和使用的药品。 批号、有效期不符合规定的药品。 各级药品监督管理部门公告的抽检不合格的。 各级药品监督管理部门发文通知禁止销售的。 质量管理部抽样送检确认不合格的。 2.不合格药品的处理: 购进验收时发现不合格药品的: 2.1.1验收员进行验收时,填写《药品采购入库质量验收记录单》后,根据拒收数量自动生成《药品拒收报告单》报质量管理部。质量管理人员依据《药品拒收报告单》所反映的情况,依据国家有关法规及企业内部有关规定,对验收过程中质量有疑问的药品进行复核,确认为
不合格药品的予以审核,通知采购员填写《到货拒收单》,及时通知供货方,并按购销合同或质量保证协议的有关规定进行处理,并通知保管员将货物放到退货区,同时若确认为不合格品的药品应存放于不合格品库(区); 2.1.2验收员进行验收时,填写《药品采购入库质量验收记录单》后,如填写了不合格品数量,则通知质量管理人员进行处理判定,质量管理员根据实际情况,并依据判定标准,做出相应的处理意见,在系统内参照生成《不合格品处理审批单》,并经过质管部负责人、质量负责人二级审批后,将确认为不合格品的药品存放于不合格品库(区),做好标识,等待处理,处理意见一般分为三种,直接报损,入库报损,先暂存后退货。 2.1.3处理意见为直接报损:质管员填制《不合格品记录单》,之后保管员填制《不合格品报损审批表》,经业务部经理、质量管理部经理、财务部经理、质量负责人签署审批通过后,质量管理部出具《不合格药品报废销毁审批表》,指导相关人员按法律法规要求将不合格药品进行处理,并及时在系统中维护《不合格药品报废销毁记录》,登记《药品销毁记录》,系统自动生成《不合格药品台账》。 2.1.4处理意见为入库报损:业务部根据《不合格品处理审批单》的结果,办理入库业务,后按照的处理规程执行 2.1.5处理意见为先暂存后退货:业务部根据《不合格品处理审批单》的结果,办理入库业务,后按照《销售退回操作规程》执行。 2.1.6在销后退回验收时有发现可疑或不合格药品的,应按照所规定的处理规程处理。 在库内检查、养护过程、出库复核时发现不合格药品的: 2.2.1保管员、养护员或复核员在工作发现药品质量可疑或不合格药品时,应立即在计算机系统内填写《药品停售通知单》,禁止系统药品销售,并报质量管理部复查; 2.2.2质管员对可疑药品进行复查,将复查的结果及时维护进计算机系统《在库品质量复检记录单》,复查药品合格,应及时在计算机系统内填写《药品恢复销售通知单》,恢复药品销售,通知相关人员。如复查药品发现不合格的,应立即出具《不合格品处理审批单》,审批同意后,同时通知将确认为不合格品的药品应存放于不合格品库(区),做好标识,等待处理。如直接报损的,按照执行。如需退货的,则按照《销售退回购进退出操作规程》执行。
门店不合格药品、药品销毁管理制度(正式)
编订:__________________ 单位:__________________ 时间:__________________ 门店不合格药品、药品销毁管理制度(正式) Standardize The Management Mechanism To Make The Personnel In The Organization Operate According To The Established Standards And Reach The Expected Level. Word格式 / 完整 / 可编辑
文件编号:KG-AO-4642-16 门店不合格药品、药品销毁管理制 度(正式) 使用备注:本文档可用在日常工作场景,通过对管理机制、管理原则、管理方法以及管理机构进行设置固定的规范,从而使得组织内人员按照既定标准、规范的要求进行操作,使日常工作或活动达到预期的水平。下载后就可自由编辑。 1、目的:做好不合格药品管理,确保所有销售药品质量。 2、依据:《药品管理法》、《药品经营质量管理规范》及相关法律法规。 3、适用范围:门店不合格药品过程管理。 4、责任:质管科和门店质量管理员。 5、定义: 5.1不合格药品:指药品质量(包括外观质量、包装质量和内在质量)不符合国家设定标准和有关管理规定的药品。 6、内容: 6.1、不合格药品包括: 6.1.1、门店验收员在进货验收时发现的外观质量
及包装质量不符合法定质量标准的药品; 6.1.2、门店养护员在养护检查中发现的外观质量及包装质量不符合法定质量标准的药品; 6.1.3、过期、失效、霉烂、变质及有其他质量问题的药品; 6.1.4、各级药品监督部门抽检验不合格的药品; 6.1.5、药品监督管理部门禁止销售的药品。 6.2、各环节不合格药品处理程序: 6.2.1、来货验收时发现质量有疑问的药品应拒收,由门店质管员填写“药品拒收报告单”办理退货手续; 6.2.2、门店养护员、营业员在检查养护、销售、售后退回环节发现有质量问题的药品,应立即放置“停售牌”,并在计算机软件系统中锁定,填写“药品质量确认报告单”,(此表一式二联,一联存根,一联报质管科),报门店质管员处理,经质管员确认无质量问题的药品,应撤掉“停售牌”,并解除锁定,恢复销售。确认为不合格的药品转入不合格品区,记录“不合格药品台帐”;
模板安装检验批质量验收记录
模板安装检验批质量验收记录 注:本表内容的填写需依据《现场验收检验批检查原始记录》。本检验批质量验收的规范依据见本页背面。
填写说明 一、填写依据 1 《混凝土结构工程施工质量验收规范》GB50204-2015。 2 《建筑工程施工质量验收统一标准》GB50300-2013。 二、检验批划分 混凝土结构工程采用的材料、构配件、器具及半成品应按进场批次进行检验。属于同一工程项目且同期施工的多个单位工程,对同一厂家生产的同批材料、构配件、器具及半成品,可统一划分检验批进行验收。 如:模板安装,可根据柱、梁、板、墙,按楼层或结构伸缩缝进行划分。 三、GB50204-2015规范摘要 主控项目 4.2.1 模板及支架用材料的技术指标应符合国家现行有关标准的规定。进场时应抽样检验模板和支架材料的外观、规格和尺寸。 检查数量:按国家现行相关标准的规定确定。 检验方法:检查质量证明文件,观察,尺量。 4.2.2 现浇混凝土结构模板及支架的安装质量,应符合国家现行有关标准的规定和施工方案的要求。 检查数量:按国家现行相关标准的规定确定。 检验方法:按国家现行有关标准的规定执行。 4.2.3 后浇带处的模板及支架应独立设置。 检查数量:全数检查。 检验方法:观察。 4.2.4 支架竖杆和竖向模板安装在土层上时,应符合下列规定: 1 土层应坚实、平整,其承载力或密实度应符合施工方案要求; 2 应有防水、排水措施;对冻胀性土,应有预防冻融措施; 3 支架竖杆下应有底座或垫板。 检查数量:全数检查。 检验方法:观察;检查土层密实度检测报告、土层承载力验算或现场检测报告。 一般项目 4.2.5 模板安装质量应符合下列规定: 1 模板的接缝应严密; 2 模板内不应有杂物、积水或冰雪等; 3 模板与混凝土的接触面应平整、清洁; 4 用作模板的地坪、胎膜等应平整、清洁,不应有影响构件质量的下沉、裂缝、起砂或起鼓; 5 对清水混凝土及装饰混凝土构件,应使用能达到设计效果的模板。 检查数量:全数检查。 检验方法:观察。 4.2.6 脱模剂的品种和涂刷方法应符合施工方案的要求。脱模剂不得影响结构性能及装饰施工;不得沾污钢筋、预应力筋、预埋件和混凝土接槎处;不得对环境造成污染。 检查数量:全数检查。 检验方法:检查质量证明文件;观察。 4.2.7 模板的起拱应符合现行国家标准《混凝土结构工程施工规范》GB50666的规定,并应符合设计及施工方案的要求。 检查数量:在同一检验批内,对梁,跨度大于18m时应全数检查,跨度不大于18m时应抽查构件数量的10%,且不应少于3件;对板,应按有代表性的自然间抽查10%,且不应少于3间;对大空间结构,板可按纵、横轴线划分检查面,抽查10%,且不应少于3面。 检验方法:水准仪或尺量。 4.2.8 现浇混凝土结构多层连续支模应符合施工方案的规定。上下层模板支架的竖杆宜对准。竖杆下垫板的设置应符合施工方案的要求。 检查数量:全数检查。
不合格药品、药品销毁的管理规定
不合格药品药品的销毁管理规定 目的:建立一个不合格药品、药品销毁的管理制度,规范不合格药品的处理流程,杜绝不合格药品流入市场,确保人民用药安全。 依据:《中华人民共和国药品管理法》、2013版《药品经营质量管理规范》等。 适用范围:公司在收货、验收入库、在库养护、出库复核和销售过程中发现的不合格药品及其处理规定。 内容 一、本制度规定的范围为“质量可疑的药品”和“不合格药品”的管理 1. 质量可疑药品:指在管理过程中发现可能存在质量问题但尚未经质量管理部门确认的药品。 2. 不合格药品的定义:经质量管理部相关人员的确认为不符合质量标准,不能进行销售的“质量可疑药品”。 3. 存在质量问题的药品:指不合格药品,破损药品。 二、不合格药品的来源及范围: 1.国家或省、市各级药品监督管理部门发布的通知或质量公报中确认为不合格的药品。 2.在收货、验收、储存、养护、出库复核、售后退回药品中发现的质量可疑药品,在经质量管理部门确认后转为不合格药品。 3.不合格药品的范围: 3.1 内外包装、标签、说明书严重破损、污染、渗漏、封条损坏等情形的药品。 3.2 批号、生产日期、有效期严重模糊、脱落至无法辨认的药品。 3.3超过有效期的药品。 3.4 药品内在质量发生改变如:发霉、粘连、破碎、吸湿、变色、变味等情况的药品, 3.5 依据法定药品检验机构出具的质检报告书,确定为不合格药品。 3.6 符合《中华人民共和国药品管理法》中有关假、劣药品定义范畴的药品。 三、不合格药品的发现及处理 (一)、不合格药品的发现 1.公司质量管理部应随时收集国家有关部门下发的通知或质量公报中有关不合格药品的信息,对本公司经营的药品进行查核,发现不合格药品时要及时通知仓库停止销售,移入不合格药品库,放置不合格标志,等待处理。 2在验收、储存、养护、出库复核、售后退回药品中发现的质量可疑药品,相关人员对质量可疑药品应当立即采取停售措施,放置停售标志,并在计算机系统中锁定,同时报告质量管理部门处理。 3.对质量可疑药品应当采取以下措施:存放于标志明显的专用场所,并有效隔离,立即标黄色待处理标志并通知质量管理部门,不得销售;质量管理部门在微机中锁定疑问药品,进行查询、确认手续。 4.确定为不合格药品的,一律存入不合格品库,不得乱堆乱放,同时停止销售,并挂红色标志,等待处理。 (二)、不合格药品的处理 1.采购收货和验收环节发现质量可疑药品,经质管部确认为不合格药品,由采购部联系供货商处理,不得入库(假药、特殊管理药品除外),并且有相应的手续及记录。 2.其他环节发生的不合格药品,仓储部通知采购部联系供货单位,可以退货的尽快退货,并且做好出库和退货记录;不能退货的,由质量管理部门监督销毁,并做好记录,(包括报损审批手续、销毁记录。) 3.怀疑为假药的,应当及时报告药品监督管理部门并在其监督下进行处理。 4.属于特殊管理的药品,及时报告药品监督管理部门,按照国家有关规定处理; 5.质量管理部门负责查明药品不合格原因,采取预防措施,防止再次发生。 四、不合格药品的销毁有限公司质量管理体系文件 1.不能退货的药品按以下方法处理: 1.1 公司有权可以销毁的药品,各部门应填写“不合格药品报损审批表”,分别报质量管理部和财务室签署意见后再报总经理审批。 1.2 经审批同意需要进行销毁的药品,必须填写相应的“不合格药品销毁记录”,由质量管理部组织监督清点、封存,并在年底当众销毁。 1.3 假药、特殊管理药品需及时报告当地药品监督管理部门,并且在当地药品监督管理部门人员的监督下进行处理,并填写相应的记录。 2.质量管理部应建立有不合格药品的档案,将不合格药品的报告、确认、报损、销毁记录存档,作为药品质量分析的重要依据。并填写“不合格药品处理情况汇总分析”,查明不合格药品发生的原因和责任人,报质量管理领导小组处理并制定预防措施。
不合格药品药品销毁管理制度
不合格药品药品销毁管理制度 文件名称:不合格药品、药品销毁管理制度 起草人:门店质量负责人审核人:公司质量负责人编号:晓李药房-QM-16-2019批准人:公司法定代表人执行日期:2019.04.15版本号:N0.3起草日期:2019.04.06-10审核日期:2019.04.11-13批准日期:2019.04.14起草原因:根据《药品经营质量管理规范》(国家食药监管总局令第13号)要求 1、目的:对不合格药品实行控制性管理,防止购进不合格药品和将不合格药品销售给顾客。 2、依据:新《药品经营质量管理规范》及现场检查指导原则的规定制定本制度。 3、适用范围:门店进货验收、销售过程中发现的不合格药品的管理。 4、责任:质量管理人员、验收员、养护员、药品采购人员、营业员对本制度的实施负责。 5、内容: 5.1不合格药品主要包括以下几个方面: 5.1.1《药品管理法》第四十八、四十九条规定的假药、劣药。 5.1.2质量证明文件不合格的药品。 5.1.3包装、标签、说明书内容不符合规定的药品。 5.1.4包装破损、被污染,影响销售和使用的药品。 5.1.5批号、有效期不符合规定的药品。 5.1.6来源不符合规定的药品。 5.1.7药监部门发文要求停止使用的药品。 5.2对于不合格药品,不得购进和销售。
5.3对药品的内在质量有怀疑而不能确定其质量状况时,应抽样送当地食品药品检验所检验。 5.4在药品购进验收时发现不合格药品,验收员应在验收记录中说明,填写《药品拒收报告单》,同时药品移入不合格药品区,并报质量管理人员进行复核;经质量管理人员确认为不合格的药品,视合同是否允许退货情况按相应手续进行。 5.5售后使用过程中出现质量问题的药品,由质量管理人员依据顾客意见及具体情况协商处理。 5.6对于假药、劣药和出现严重质量事故的药品,必须立即停止购进和销售,就地封存,并向当地食品药品监督管理部门报告。 5.7不合格药品的销毁必须退回公司统一销毁;假劣药品应就地封存,并报送当地食品药品监督管理部门处理或备案。销毁工作应有记录,销毁地点应远离水源、住宅等。销毁方式可采取破碎深埋,燃烧等方式。 5.8质量管理人员对不合格药品的处理情况应做好记录及归档。 5.9不合格药品的处理应有完善的手续和记录。有关记录保存5年。
不合格药品处理操作规程全新
不合格药品处理操作规程 一、目的 规范不合格药品处理全过程。 二、依据 《药品经营质量管理规范》(国家食品药品监督管理总局令第28号)。 三、适用范围 适用于不合格药品的报告、确认、处置、报损、销毁等工作的管理。 四、内容 1、不合格药品是指不符合药品质量标准规定,以及不符合药品监督管理法规规定要求的药品。包括定性、定量、微生物检测不符合有关规定或者外观性状、包装、标签、说明书等不符合有关规定的药品。药品经营过程中,不合格药品的主要包括以下几种形式。 (1)药品包装形式不符合标准。表现为药品包装、标签、说明书内容或形式不符合法律规定,存在错误行为。 ①药品的包装、标签、说明书标示的药品批准文号、生产企业系伪造、冒用的,未标明或者更改生产批号、有效期的,或者标明的适应症或者功能主治超出规定范围的,属于假劣药品范围。 ②药品标签、说明书的内容、格式、颜色、标识等缺失或者形式不规范,药品标签印有误导使用和不适当宣传产品的文字和标识的,药品商品名称字体以单字面积计大于通用名称字体的二分之一的,说明书或标签中使用未经注册的商标的,以及特殊管理药品、外用药品、非
处方药专有标识缺失或者不符合规定的。 ③药品包装夹带介绍或者宣传产品、企业的文字、音像及其他资料。 ④最小销售包装缺失药品使用说明书的。 (2)药品包装质量不符合标准。表现为药品包装质量存在制造缺陷或者因外界因素影响发生物理、化学及生物学特性的变化,存在可能使药品内在质量变异的风险,或者存在安全隐患的。 ①因包装的材质、生产工艺问题,导致药品包装变形、软化、破损、受潮、被污染,以及封口松动、内容物渗漏或挥发等。 ②在流通过程中的不合理因素导致包装变形、软化、破损、受潮、被污染,以及封口松动、内容物渗漏或挥发等。 ③外包装发生变形、软化、破损等异常,但经检查确认最小包装完好、外观性状无异常的药品,按合格药品管理。 (3)药品内在质量不符合标准。表现为药品存在制造缺陷或不符合法定检验标准,可能影响疗效或存在安全隐患。 ①在质量检查中发现的外观性状不符合标准,如色泽异常、裂片、漏粉、粘连、结块、分层、风化潮解、软化变形、异物异臭、混浊沉淀等。 ②经检验存在任何不符合国家药品标准的项目。包括成份、含量、性状不符合标准,其他检验项目如崩解时限、装量差异、粒度、PH值、澄明度、灰分、农药残留、重金属等规定不符合标准。此类不合格属于假劣药范围。 ③虽然经法定标准检验合格,但是有事实认定存在质量隐患问题的药品。包括非法添加其他
过期药品销毁制度
过期药品销毁制度 目得:明确报废药品销毁工作得申报与监督管理办法。 范围:确认报废得药品。 责任:药库。 内容:1、销毁申报经过财务部核准后,已作报废确认得不合格药品与已作报损得破损药品及其包装,要定期清理与集中销毁。在集中销毁之前,药剂科要监督仓储管理部门填报《药品销毁申报表》并附《报废药品明细表》。 2.销毁周期为了及时清理库房不造成废品堆积、占用场地,每年至少进行一次报废药品得集中销毁工作。在此期间,药监局有统一行动要求时,按统一部署执行。3、销毁监控药品在出库销毁之前,必须在质管部得监控下对账请点药品实物,防止不合格药品流失导致安全事故等不良后果;销毁处理一定要在有安全保卫部门监督下,考虑防止环境污染,远离市区及人口居住区与风、水上游;采取捣碎、焚毁、深埋等不留后患得有效措施进行销毁。药剂科必须从出库到销毁结束全程监控。 4.销毁记录上述报废药品销毁得过程中,药剂科必须监督各环节准确记录并签字。审核、报批得原件交财务部作核销凭据;药剂科负责以复印件与全程记录文件资料,在事后三日内整理存档,保存期不少于3 年。 药品报损、销毁制度 一、凡出现破损、变色、发霉、虫蛀、过期失效等质量问题得药品,
一律按不合格药品处理。 二、原包装缺损得药品,应由供货商负责调换补货。1、发生在各药房得原包装破损得药品,由药房凭残损包装向药库索补。药库将残损包装集中后统一向供货商索补。2、原包装短缺得药品,不管就是发生在药房或药库,均需二人以上证明,经药剂科主任签字后向供货商索补。 三、破损、霉变、过期失效药品,药库及各药房汇总填写报废单,报废单须写明药品名称、规格、单价、金额及报损总金额,报损原因等,经质量管理小组查验签字,报药剂科主任审核签字,上报主管院长审批。 四、待批报废药品,应单独集中存放,并有明确标示。 五、经审批报废后得药品,一律集中存放,待药品质量与监督管理小组组织统一销毁。 六、报废药品应严格管理,及时监督销毁。防止流入社会,危害人民群众健康。七、对已过期或其它原因不能继续使用得药品,由保管员、会计填写药品销毁单,科主任同意后上报医院相关部门及院长同意后方可销毁。 八、销毁得药品要进行登记,详细记录下药品名称、规格、批号、销毁数量、销毁原因、经手人、销毁时间、地点、方式、监督人等内容。 九、在进行药品销毁时,必须至少有两人在场,及时在药品销毁登记本做记录并有两人签字。
GB50204-2015模板安装检验批质量验收记录
模板安装检验批质量验收记录 单位(子单位)工程名称溢流坝、廊道加 固及附属 分部(子分部) 工程名称 主体工程/混凝土 结构 分项工程名称模板 施工单位河南省水利第二 工程局 项目负责人检验批容量 分包单位/ 分包单位 项目负责人 / 检验批部位 右岸桥头堡一层 梁板 施工执行标准名称及编号《混凝土结构工程施工质量验收规范》GB50204-2015 验收项目设计要求及 规范规定 最小/实际 抽样数量 位检查记录 检查 结果 主控项目1 模板和支架材料质量第4.2.1条/ 合格证2份,材料进场检验记录2 份,进场检验合格 √2 现浇混凝土模板及支架的安装 质量 第4.2.2条/ 全数检查,安装牢固、稳定,符合 模板施工方案要求 √3 后浇带处的模板及支架独立设 置 第4.2.3条/ 共2处,全数检查,后浇带模板及 支架独立设置 √4 支架竖杆和竖向模板安装要求第4.2.4条/ / / 一般项目1 模板安装的一般要求第4.2.5条/ 共57处,全数检查,模板接缝严密, 模内无杂物 √2 脱模剂的品种和涂刷方法质量第4.2.6条/ 共57处,全数检查,脱模剂涂刷符 合要求,合格证1份 √3 模板起拱高度第4.2.7条/ 抽查3间板,3件梁,模板起拱符合 要求 √4 现浇混凝土结构多层连续支 模、支架的竖杆、垫板要求 第4.2.8条/ 共57处,全数检查,模板支设符合 施工方案,上下层竖杆基本对准, 且设垫板 √5 固定在模板上的预埋件和预留第4.2.9条/ 抽查3间,预留孔洞模板固定牢固√ 6 预埋 件和 预留 孔洞 的安 装允 许偏 差 预埋中心线位置 3 / / / 预埋管、预留孔中心线 3 / / / 插筋 中心线位置 5 / / / 外露长度+10,0 / / / 预埋 螺栓 中心线位置 2 / / / 外露长度+10,0 / / / 预留洞 中心线位置10 / 抽查3处,合格3处100% 尺寸+10,0 / 抽查3处,合格3处100% 7 模板 安装 允许 偏差 轴线位置 5 / 抽查3处,合格3处100% 底模上表面标高±5 / 抽查6处,合格6处100% 模板 内部 尺寸 基础±10 / / / 柱、墙、梁±5 / 抽查3处,合格3处100% 楼梯相邻踏步±5 / 共2处,全数检查,合格2处100% 垂直 度 柱、墙层高≤6m 8 / / 柱、墙层高>6m 10 / / 相邻两板表面高低差mm 2 / 抽查3处,合格3处100% 表面平整度mm 5 / 抽查6处,合格6处100% 施工、分包单位检查结果 专业工长: 项目专业质量检查员: 年月日监理单位验收结论专业监理工程师: 年月日
不合格品处理管理规程
1.目的:为了避免不符合标准的物料和产品造成的污染、混淆和误用,建立不合格品处理管理规程,确保对不合格品及时作出处理,保证产品质量。 2.范围:适用于进厂原辅料、包装材料、生产过程中的待包装产品、中间产品及成品中不合格品、拒收、退回或召回的不合格品的管理。 3.责任:质量保证部、检验中心、生产部、合成车间、仓库。 4.内容 每批物料、中间产品、待包装产品和成品(包括退库后需再销售成品或召回的成品),如果出现超限或偏差情况,在放行前,需要通过超限调查、偏差及不符合调查和质量风险分析,由质量受权人最后做出处理决定。 被隔离的不合格品,挂上明显的红色不合格标识,存放在不合格隔离区内,任何人都不得随意挪动,或改变状态标识。 4.1不合格品的来源 4.1.1 不合格物料来源:不合格物料包括不合格原料、辅料、包装材料等。 4.1.1.1物料收货时的异常; 4.1.1.2检验过程中的异常和OOS; 4.1.1.3贮存过程中的异常、受潮和破损; 4.1.1.4物料转移过程中的异常。 4.1.1.5在生产使用过程中发现的; 4.1.1.6超过有效期或贮存期; 4.1.1.7确定不再使用的旧版包装材料。 4.1.2 不合格产品来源:包括不合格的中间产品、待包装产品、成品等。 4.1.2.1生产过程中经检验不合格的; 4.1.2.2生产质量监控过程中经自检或由质量保证部确认不合格的; 4.1.2.3中间产品或待包装产品,超贮存期出现质量问题或到贮存期经复检不合格的; 4.1.2.4成品召回、退货经验收或检验不合格的; 4.1.2.5成品超过有效期的; 4.1.2.6其他情形的不合格。 4.2 不合格品处理流程图:
