苏教版高一化学必修一专题一全套教案新课标

专题1 化学家眼中的物质世界
第一单元丰富多彩的化学物质
课时1 物质的分类和转化
〔学习目标〕
1.能根据物质的组成和性质对常见物质进行分类,并了解比较和分类对化学研
究的作用。
2.掌握单质、氧化物、酸、碱、盐之间的转化关系,并了解通过化学反应实现
物质转化的重要意义。
〔知识梳理〕
1.世界上的物质极其繁多,为了简明有序地掌握其性质及变化规律,常采用的方法之一是,同一类物质在组成和某些性质方面往往具有一定的性。
2.对于若干种同样的物质,若分类的依据不同,则得到的分类结果。对物质进行分类的常见依据有。
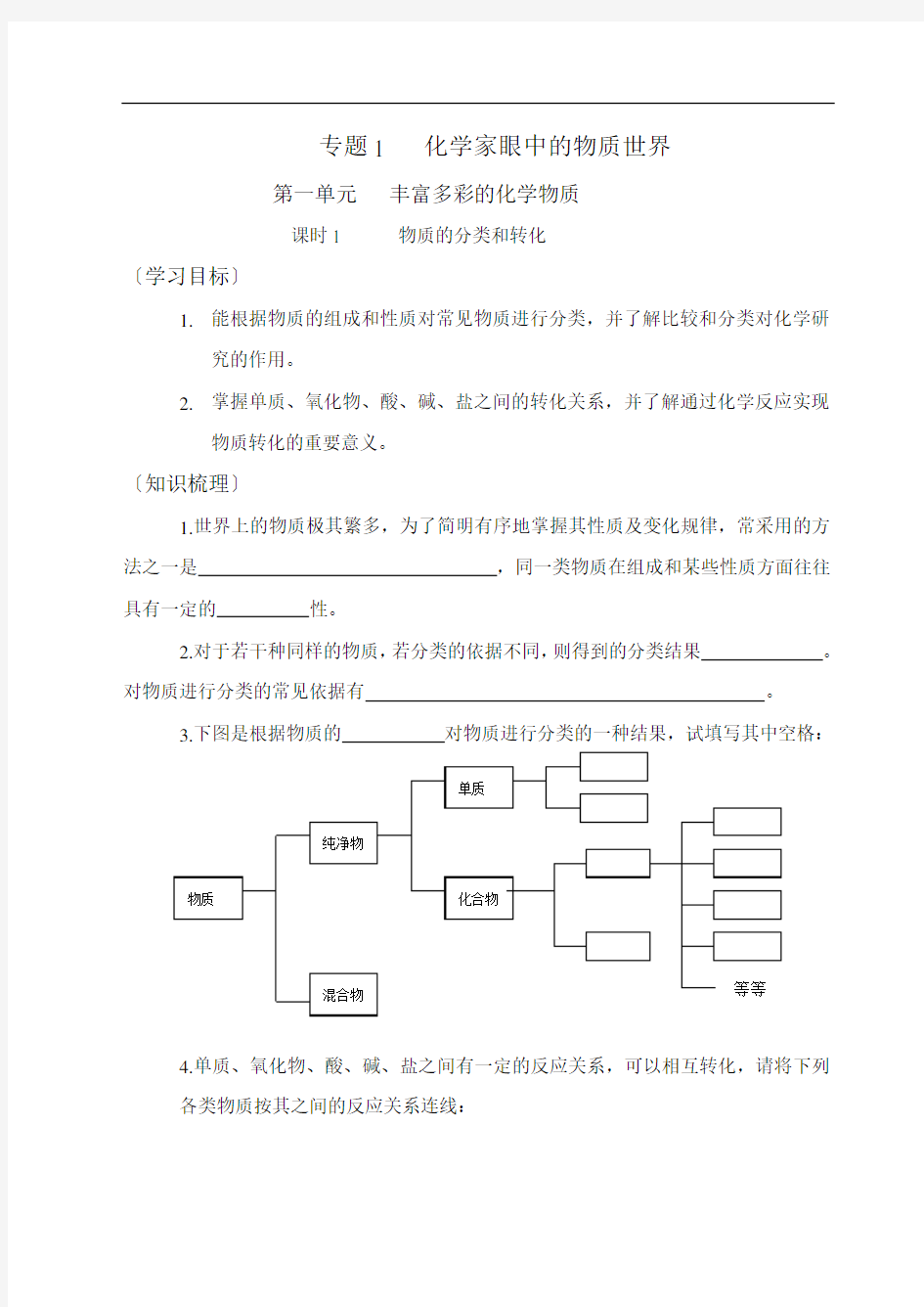
3.下图是根据物质的对物质进行分类的一种结果,试填写其中空格:
4.单质、氧化物、酸、碱、盐之间有一定的反应关系,可以相互转化,请将下列
各类物质按其之间的反应关系连线:
[例题解析]
例1.现有下列五种物质:锌粒、硫酸锌、氢氧化锌、氧化锌、硫酸,试关于它们回
答下列问题:(1)根据它们组成或性质的不同,把它们分成两大类。(2)写出它们之间转
化的化学方程式。
解析:(1)对所给物质进行分类,首先应根据它们在组成、性质、状态等方面的不
同,明确分类的依据,然后再针对不同的依据得出不同的分类结果。从组成上看,镁条
是只含一种元素的纯净物,为单质;另四种物质都是含两种或两种以上元素的纯净物,
为化合物。从状态上看,硫酸为液体,另四种物质为固体。从性质上看,硫酸镁和硫酸
都是易溶物,另三种物质为难溶物,等等
(2)单质、氧化物、酸、碱、盐之间有一定的转化规律,可先明确上述物质所属物质
类型,再根据此类型物质所具有的性质,写出相应的化学方程式(注意复分解反应发生
的条件)。
如:锌属于活泼金属,可与酸(或盐)反应生成相应的盐,据此可写出反应式:
Zn + H 2SO 4 == ZnSO 4 + H 2↑ , 依此类推,有:2 Zn + O 2 == 2 ZnO ,
Zn(OH)2 + H 2SO 4 == ZnSO 4 + 2H 2O , ZnO + H 2SO 4 == ZnSO 4 + H 2O Zn(OH)2 △= ZnO + H 2O , ZnO + H 2 △
= Zn + H 2O 〔基础训练〕
1. 下列物质中都含有氢元素,按照已学知识判断其中属于酸的是( )
A.NH 3
B.CH 4
C.NaHCO 3
D.HClO 3
2. 同种类型的物质往往具有某些相同的性质。下列性质中不属于酸通性的是( )
A.与活泼金属反应生成盐和氢气
B.与碱反应生成盐和水
C.使紫色石蕊试液变蓝色
D.与氯化钡溶液反应生成白色沉淀
3. 盐是一类常见物质,下列物质可直接反应生成盐的组合是()
①金属②碱性氧化物③碱④非金属⑤酸性氧化物⑥酸
A.只有①②③
B.只有①④⑥
C.只有②⑤⑥
D.全部
4.某加碘食盐包装袋上标有“忌高温蒸炒”,由此判断下列说法中正确的是()
A.此食盐是纯净物
B.食盐中加入了碘单质
C.所加含碘物质受热易分解
D.加碘食盐难溶与水
5.下列化学反应中,属于置换反应的是()
A. NaOH + HCl == NaCl + H2O D.H2CO3 == H2O + CO2
加热点燃
C. H2+CuO == Cu + H2O B.2CO + O2 == 2CO2
6.现有下列物质:①碳酸钠②氧化钠③二氧化硅④铁⑤氧气⑥氢氧化钙⑦硫酸
请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于单质的是,属于氧化物的是,属于酸的是,属于碱的是,属于盐的是。
(2)按溶解性分类,属于易溶物的是,属于难溶物的是属于微溶物的是。
(3)按常温状态分类,属于固态的是,属于液态的是,属于气态的是。
7.在一氧化碳、碳单质、氢气、二氧化碳四种物质中,哪种物质具有不同于其它三种物
质的特点(任写两种,并说明依据)
8.试以氢氧化钠为例,说明碱具有哪些通性,并写出相应的化学方程式。
9.从铁、盐酸、氧气、水、硝酸银溶液五种物质中选出1种或2种为反应物,按下列反
应类型各写1个化学方程式:
(1)化合反应;
(2)分解反应;
(3)置换反应;
(4)复分解反应。
10.有钠、氢、氧、硫四种元素,试关于它们填写下列空白:
(1)用其中的一种或几种元素写出符合下列要求的化学式:
单质,氧化物,酸,碱,盐。
(2)写出上述物质间相互发生反应的化学方程式:
单质与酸;
酸与氧化物;
碱与氧化物;
酸与碱;
单质与单质。
(3)又知潜水艇中需要配备氧气再生装置,利用过氧化钠(O2)与二氧化碳反应生成
碳酸钠和氧气,该反应的化学方程式为。〔能力拓展〕
1.在盛有氢氧化钠溶液的试剂瓶口,常看到有白色固体生成,该白色固体是()
A.氢氧化钠
B.氧化钠
C.碳酸钠
D.碳酸氢钠
2.经测定一瓶气体中只含C和H两种元素,通常情况下这瓶气体不可能是()
A.一种化合物
B.一种单质和一种化合物的混合物
C.两种化合物
D.两种单质
3.下图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:(1)标签上钙含量中,钙是指;
(2)为了检验此盐中是否含有碳酸钙,在家庭厨房里可选用的物质是;
(3)为了测定此盐的钙元素含量,取10克此盐溶于Array水,加入足量盐酸,生成0.132克二氧化碳。请
计算此加钙食盐中钙元素的质量分数。
4.A是废铁屑表面上红色固体的主要成分,B、C、F都是单质,D、F都是无色无味的气
试写出下列各物质的化学式:A. B. C. D. E. F.
5.美国和日本正在研究用亚硫酸钠(Na2SO3)吸收法作为治理二氧化硫污染的一种新方
法。第一步是用亚硫酸钠溶液吸收二氧化硫生成亚硫酸氢钠;第二步是加热溶液,使之重新生成亚硫酸钠,同时得到含高浓度二氧化硫的副产品。试写出上述两步反应的化学方程式:
第一步:;
第二步:。
6.日常生活中使用的牙膏里面都含有一定量的摩擦剂,试回答下列相关问题:
(1)根据你的推测,摩擦剂应具备下列性质中的哪几条?。
①易溶于水②难溶于水③坚硬④柔软⑤颗粒较大⑥颗粒较小
你认为摩擦剂另外还应具备哪些性质和特点?
(2)据调查,两面针儿童牙膏、珍珠王防臭牙膏和中华透明牙膏中所使用的摩擦剂依次是氢氧化铝、碳酸钙和二氧化硅,它们所属的物质类别依次是、、。
(3)作牙膏摩擦剂的粉末状碳酸钙可以用石灰石来制备。张华同学为工厂设计了一种
制备碳酸钙的生产方案,其流程图为:
① 高温
请你写出上述方案中有关反应的化学方程式:
① ②
③ 。
(4)请你也用石灰石为原料,设计另一种制备碳酸钙的生产方案(其它试剂任选),
画出生产的流程图:
你设计的方案与张华的方案比较,优点是 ,缺点是 。
(5)检验牙膏中的摩擦剂是否为碳酸钙的实验方法是 。
7.某化学兴趣小组对一批铁样品(含有不溶于水也不溶于酸的杂质)进行分析。甲、乙、
丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应,
实验数据如下表:
(1)请认真分析数据,判断哪位同学取用的稀硫酸与铁样品恰好完全反应?并说明根据。
(2)计算样品中铁的质量分数。
课时2.物质的量
〔学习目标〕
1.了解物质的量及其单位摩尔。
2.学会物质的量、摩尔质量、质量之间的简单计算。
〔知识梳理〕
1.物质的量是一种基本物理量,它以物质所含基本粒子的多少来衡量物质的多少。通过它可以把物质的质量与其所含的等微观粒子的数量联系起来。物质的量的单位是,简称,符号为。
2. 国际上规定,质量为kg 12C原子所含碳原子数为1摩尔,这个数称
为常数,常用表示,其近似值为。
3.某种物质的质量称为该物质的摩尔质量,用符号表示,单位为,数值上等于。
4.现有一定量某种物质,若其分子数为N, 物质的量为n,则N与n的关系是(用代数式表示)。若其质量为m,物质的量为n,摩尔质量为M,则三者之间的关系是(用代数式表示)。
5.化学方程式中的化学计量数可以代表分子或原子数,也可以代表物质的物质的量,
2H2O可以读作_________________________________________。若如此,则2H2+O2 点燃
==
〔例题解析〕
例1. 现有硫酸铝和硫酸锌两种盐,试关于它们回答下列问题:
(1)0.5摩尔硫酸铝中所含铝离子的个数是多少?
(2)1摩尔硫酸铝的质量和硫酸铝的摩尔质量各是多少?
(3)在一定量硫酸铝和硫酸锌组成的混合物中,SO42-的物质的量共2 mol,若铝离子和锌离子的物质的量之比为2:3,则此混合物中硫酸锌的质量为多少?
解析:(1)物质的化学式可直观地显示出所含各离子的个数关系,可首先写出硫酸铝的化学式Al2(SO4)3,这样可一目了然地看出1摩尔Al2(SO4)3中含2摩尔Al3+,进而求
出0.5摩尔硫酸铝中Al 3+的物质的量和其个数: N(Al 3+
)=0.5 mol ×2×6.02×1023 mol -1=6.02×1023 .
(2)1摩尔硫酸铝的质量和硫酸铝的摩尔质量在数值上都等于硫酸铝的式量342,但
单位不同,前者是质量单位为g ,后者是物质的量单位为g/mol .
(3)由Al 2(SO 4)3和ZnSO 4的化学式可知,当Al 3+和Zn 2+
物质的量之比为2∶3时,表明Al 2(SO 4)3和ZnSO 4物质的量之比为1∶3 , Al 2(SO 4)3中的SO 42-
和ZnSO 4中的SO 42-之比为1∶1,即混合物总共2摩尔SO 42-
中有1摩尔来自ZnSO 4,故ZnSO 4的物质的量为1摩尔,质量为160克。
例2. 将5.6g 铁投入足量硫酸铜溶液中充分反应,求所生成硫酸亚铁的物质的量和
所生成铜的质量。
解析:这道题目是关于化学反应的计算,已知反应物的量求生成物的量.可首先写出
反应的化学方程式,然后根据化学方程式所反映出的量的关系进行计算。与初中不同的
是,若求某物质的质量,其基准值可设为质量;若求某物质的物质的量,其基准值可设为物质
的量,从而直接列比例计算。 同时要注意,反应中各物质之间的单位要左右呼应,同一
种物质的单位要上下相同。
Fe + CuSO 4 == FeSO 4 + Cu
56 g 1 mol 64 g
5.6 g n(FeSO 4) m(Cu)
56g / 5.6g = 1mol / n(FeSO 4)
n(FeSO 4) = 5.6 g × 1mol / 56g = 0.1mol
56g / 5.6g = 64g / m(Cu)
m(Cu) = 5.6g × 64g / 56g = 6.4g
[基础训练]
1.下列说法中正确的是( )
A.物质的量是一种基本物理量
B.摩尔是一种基本物理量
C.摩尔是物质的量的单位
D.摩尔是数的一种很大的单位
2.下列有关摩尔使用的说法中不正确的是()
A.1摩尔氧原子
B.1摩尔氧分子
C.1摩尔氧气
D.1摩尔氧
3.下列叙述正确的是( )
A.1 mol H2SO4的质量为98 g·mol-1B.H2SO4的摩尔质量为98 g
C.9.8 g H2SO4含有N A个H2SO4分子D.6.02×1023个H2SO4分子的质量为9.8 g
4.下列说法或表示法中正确的是()
A.质量为53克的碳酸钠,其物质的量为0.5摩尔
B.等质量的氢气和氧气比较,氢气所含的分子数较少
C.与1.8克水含有相同氢原子数的硫酸的物质的量为98克
D. 对于水而言,36克等于2摩尔
5.在0.25摩尔硫酸钠中,含有的氧原子个数为()
A. 1
B. 0.25
C.6.02×1023
D.5×1023
6.质量相等的下列物质中,含分子数最多的是()
A. CH4
B. O2
C. NH3
D. CO2
7.对于同质量的二氧化硫和三氧化硫来说,下列关系中正确的是()
A.含氧原子的个数比为2∶3 B.含硫元素的质量比为5∶4
C.含氧元素的质量比为6∶5
D.含硫原子的个数比为1∶1
8.填写下列表格:
9. 等物质的量O2和臭氧(O3),所含的分子数之比为,所含的氧原子数之比
为,其分子量之比为,其质量之比为。
若O2和O3质量相等,则其分子数之比为,氧原子数之比为。
〔能力拓展〕
1. 0.1摩尔某固体单质与氯气完全化合后质量增加了7.1克,则此固体单质可能是()
A .钠 B. 镁 C. 铝 D. 铁
2. 用N A表示阿伏加德罗常数,下列说法正确的是()
A. 24克镁单质变为镁离子时,失去的电子数为N A
B. 18克水所含的电子数为N A
C. 8克氦气所含分子数为N A
D. 3.2克氧气所含氧原子数为0.2N A
3. 若1克水中含有m个氢原子,则阿伏加德罗常数用含m的代数式可表示为()
A. m/9
B. 9m
C. 2m
D. 18m
4.某盐的溶液中含有Na+、Mg2+、Cl-、SO42-四种离子,若Na+为0.2 mol, Mg2+为
0.4 mol, Cl-为0.4 mol, 则SO42-物质的量为( )
A. 0.1 mol
B. 0.3mol
C. 0.5mol
D. 0.15mol
5.一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl,0.2mol K2SO4,0.1 molZn SO4
配方二:0.1 mol KCl,0.3 mol K2SO4,0.1 molZnCl2
对于两种营养液的成分,下列说法中正确的是()
A. 只有n (K+)相同
B. 只有n (Cl-)相同
C. 完全相同
D. 各离子的物质的量完全不同
6. 15.6 g Na2X含Na+ 0.4mol,则Na2X的摩尔质量为,X的相对原子质量
为。
7.将4 g NaOH溶于g水中,可使溶液中H2O与Na+的物质的量之比为20:1,此溶液中溶质的质量分数为。
8. 已知16克A和20克B恰好完全反应生成0.04摩尔C和31.67克D,则C的摩尔质量为。
9. 在化学反应X + 2Y = R + 2M 中,已知R和M的摩尔质量之比为22∶9,当1.6克X
与Y恰好完全反应后,生成4.4克R,同时生成M的质量为克,Y与M的质量之比为,解答此题时使用到的化学定律是。
课时3.物质的聚集状态
[学习目标]
1.知道固态物质、液态物质和气态物质的一些常见特性。
2.了解影响物质体积的因素。
3.了解气体摩尔体积的概念及标准状况下气体的摩尔体积。
〔知识梳理〕
1.许许多多的分子等微观粒子聚集在一起形成宏观物质的时候,聚集状态主要有、、三种。影响物质聚集状态的外界因素有和。
2.对于不同状态的物质,其微观结构、微粒运动方式和物质的宏观性质是不同的,试填写下表:
3.在温度和压强一定时,从微粒角度来看,物质的体积主要由、
和三者决定。
4.对于一定量的固体或液体而言,它们的组成微粒之间距离很,故它们的体积主要决定于;而不同物质是不同的,所以1摩尔不同固体或液体的体积各不相同。
对于气态物质而言,其构成微粒之间的距离比微粒本身很多,故气态物质的体积主要决定于,而在同温同压下,任何气体分子之间的距离都相同,所以,在同温同压下,1摩尔任何气体的体积都相同。
5. 称为气体摩尔体积,用符号表示,常用单位为。
6.标准状况是指温度为压强为。在标准状况下,气体摩尔体积约为。温度或压强时,气体摩尔体积会增大。
〔例题解析〕
例1.下列说法中正确的是()
A.任何一个水分子,其本身都是固体。
B.逐渐加热升温,碳酸氢铵也可体现出三态变化
C.面包是固体,但在受压时体积缩小,故可以说固体易被压缩
D.在水蒸气、液态水和冰中,水分子都在不停的运动
解析: 物质的固、液、气三态是大量分子聚集时所表现出的一种状态。故单个分子不能说聚集状态,A错。碳酸氢铵受热时,在熔化之前就已分解,故无法体现本身的三态变化,B错。面包不是单一的固体,它里面包含了大量的气体,受压时体积缩小是其中的气体被压缩排出所致,而不是固体本身被压缩,C错。在水的三种状态中,其分子都在不停运动,只是运动的方式、速率不同,故D对。
例2. 设N A表示阿伏加德罗常数,下列物质中物质的量为1摩尔的是()
A.通常状况下22.4 L氯气
B.18毫升水
C. N A个H2分子
D.标准状况下22.4 L H2O
解析:物质的量是联系宏观与微观的桥梁,它们之间的关系如下:(1)N A个微粒为1 mol,(2)标准状况下22.4 L的任何气体约为1 mol,(3)1 mol物质的质量,以克为单位时,数值上与物质的相对分子质量相等。A中不是标准状况,错。B中18毫升水不一定是18克水,故不一定是1 mol。D中水不是气体,故不成立。只有C正确。
〔基础训练〕
1.下列说法中正确的是()
A.水被冷却到00C以下时变成冰,是因为水分子从液体变成了固体
B.所有物质在温度变化时都能表现出三态变化
C.不降低温度,只增大压强,也可能使物质从气体变成液体
D.物体能够热胀冷缩是因为构成物体的微粒能够热胀冷缩
2.下列变化中,能使构成物质的微粒之间的距离变大的是()
A. 升温
B.降温
C.加压
D.减压
3.现有下列各项关于不同状态的物质属性的描述:①构成微粒间有较小空隙,②构成微粒可以自由移动,③没有固定形状,④不易被压缩。某物质具备下列哪种组合的属性能够判断该物质为液体()
A.①和④
B.②和③
C.①和③
D.②和④
4.现有下列四种因素:①温度和压强②所含微粒数③微粒本身大小④微粒间的距
离,其中对气体物质体积有显著影响的是()
A.只②③④
B.只②④
C.只①③④
D. ①②③④全部
5. 下列因素中,决定固体物质或液体物质体积的主要因素是()对气体物质的体积
无明显影响的是()
A.温度和压强
B.所含微粒数目
C.微粒本身大小
D.微粒之间的距离
6. 下列说法中不能成立的是()
A. 1 mol某种物质的质量称为该物质的摩尔质量
B. 1 mol某种物质的体积称为该物质的摩尔体积
C.固体和液体的摩尔体积各不相同
D. 气体摩尔体积都约为22.4 L/ mol
7. 固体可以分为两类,一类是,如,规则的几何外形和固定熔点;另一类是,如,规则的几何外形和固定熔点。
8. 下列物质中,常温下属于晶体的, 没有固定熔点和规则几何外型的是
。
A. 铝
B.氯化钾
C.氢氧化钠
D.干冰
E.塑料
F.玻璃
G.铁矿石
H.硫酸
J.石蜡。
9. 试从微观结构上分析为什么气态物质容易被压缩,而固态和液态物质不易被压缩?
10. 试简述1摩尔固体或液体的体积为何各不相同?
在同温同压下,1摩尔不同气体的体积为何都大约相同?
〔能力拓展〕
1.下列说法中不正确的是()
A.在同温同压下,1摩尔固体或液体的体积各不相同
B.在同温同压下,不同气体的摩尔体积都大致相同
C.气体摩尔体积约为22.4 L/ mol
D.只有在标准状况下,气体摩尔体积才约为22.4 L/ mol
2.下列判断中正确的是()
A.在标准状况下,1 mol单质溴的体积约为22.4 L
B.在标准状况下,氧气的气体摩尔体积约为22.4 L
C.常温常压下,1 mol氢气的体积为22.4L
D.常温常压下,1 mol氧气的质量为32克
3.等物质的量的氢气和氦气在同温同压下具有相等的()
A.原子数
B.体积
C.质子数
D.质量
4. 标准状况下,下列物质体积最大的是()
A. 2克氢气
B. 20克二氧化硫
C. 23克钠
D. 160克溴
5. 在标准状况下,将1克氦气,11克二氧化碳和4克氧气混合,所得混合气的体积约为
()
A. 28L
B. 11.2L
C. 16.8L
D. 14.0L
6.篮球队正在室温为250C的室内体育馆进行比赛。室外温度为-40C。如果将篮球放在
室外运动场上,该篮球可能会发生怎样的变化?
7. 森林是大自然的清洁器,一亩森林一昼夜可吸收62千克二氧化碳气体,呼出49千克
氧气,即在标准状况下吸收L 二氧化碳,呼出L的氧气。
课时4物质的聚集状态
[学习目标]
1.有关气体摩尔体积的计算。
2.有关阿佛加德罗定律的应用
[知识梳理]
1.试在图中箭头上标明完成有关换算所需采用的方法
气体分子数
气体物质的量标况下气体体积
气体质量
2.气体特性可推知:在同温同压下,同体积的气体含有相同的分子数,这个规律被称为阿伏加德罗定律,由此可知:在同温同压下,气体的分子量越大,则气体的密度,即气体的密度与其分子量成比。
已知空气的平均分子量为29,试判断氨气的密度将比同温同压下空气的密度,收集时可用向排空气法。。
3.在气体的温度(K)、压强(P)、体积(V)、物质的量(n)四个物理量中:
若两种气体有三个物理量相同,则另一个量;
若两种气体有两个物理量相同,则另两个量,如:若温度和压强相同,则其体积与其物质的量成比;
若物质的量和温度相同,则其体积和压强成比;
若物质的量和压强相同,则体积和绝对温度成比。
(试把上述第3条中的“两种”改为“一种”,“相同”改为“一定”,再思考作答)[例题解析]
例1. 把200 g 9.8%的稀硫酸与足量锌粒反应,求(1)能生成氢气多少克。(2)这些气体中所含分子个数为多少?(3)若欲用500mL集气瓶来收集这些氢气,则需准备几个集气瓶(设实验在标准状况下进行)?
解析:第(1)步是已知反应物的量求生成物的量,属于化学方程式的计算,先写出
化学方程式,然后按初中所学方法进行计算即可求得氢气质量。
第(2)步和第(3)步是在已求得氢气质量的基础上,再求其分子个数和标况体积,
此三种量之间的转换,皆以物质的量为中心,可先求得其物质的量,再转换成要求的量。
(1)H 2SO 4 + Zn ═ ZnSO 4 + H 2↑
98 2
200×9.8% m
98 2
200 g ×9.8% m , m = 0.4g (2)n(H 2)= = 0.2mol,
N(H 2) = 0.2mol ×6.02×1023 /mol = 1.204×1023
(3)V (H 2)=0.2mol ×22.4L/mol = 4.48 L, 需集气瓶数: ≈ 9 [基础训练]
1.下列说法中正确的是( )
A.在常压下,把一定量气体从100C 升温到200C ,气体体积将增大1倍
B.化学反应中1mol 金属镁变成镁离子(Mg 2+)时失去电子数为2N A
C.标准状况下,22.4L 水中含有N A 个水分子
D.标准状况下,18克水中所含的分子数为N A
2.在下列条件下,两种气体的分子数一定相等的是( )
A.同质量、不同密度的N 2和C 2H 4
B.同温度、同体积的O 2和N 2
C.同体积、同密度的CO 和CH 4
D.同压强、同体积的N 2和O 2
3.两个容积相同的容器,一个盛有一氧化氮,另一个盛有氮气和氧气,在同温、同压下
两容器内的气体一定具有相同的( )
A.原子总数
B.质子总数
C.分子总数
D.质量
4.用N A 表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有N A 个氦原子的氦气在标准状况下的体积约为11.2L
═ 0.4g
2g/mol 4.48L
0.5L
B. 25℃,1.01×105 Pa, 64g SO2中含有的原子数为3N A
C. 在常温常压下,11.2L Cl2含有的分子数为0.5N A
D. 标准状况下,11.2LH2O 含有的分子数为0.5N A
5.相同状况下,下列气体所占体积最大的是()
A. 80g SO3
B. 16g O2
C. 32g H2S
D. 3g H2
6.下列各物质所含原子数目,按由大到小顺序排列的是()
①0.5mol NH3②标准状况下22.4LHe ③4℃时的9mL水④0.2mol H3PO4
A.①④②③
B.④③②①
C.②③④①
D.①④③②
7.下列说法正确的是()
A.气体摩尔体积就是22.4L/mol
B.非标准状况下,1mol任何气体的体积不可能为22.4L
C.标准状况下22.4L任何气体都含有约6.02×1023个分子
D.1molH2和O2的混合气体在标准状况下的体积约22.4L
8.在相同状况下,某气体质量与相同体积的空气的质量比值为0.966,则该气体密度比空
气,其分子的相对分子质量为,该气体在标准状况下的密度为。
[能力拓展]
1. 448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为()
A.64g
B.64
C.64g·mol-1
D.32g·mol-1
2. 在标准状况下,100mL某气体的质量为0.125g,则该气体可能是下列物质中的()
A.氨气
B.氮气
C.二氧化碳
D.一氧化碳
3.在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,则
该化合物的化学式为()
A.XY3
B.XY
C.X3Y
D.X2Y3
4.某混合气体由N2和CH4组成,测得该混合气体在标准状况下的密度为0.82lg/L,则混
合气体中N2和CH4的体积比为()
A. 1∶1
B. 1∶4
C. 1 ∶2
D. 2∶1
5.同温同压下,某集气瓶充满O2时为116g,充满CO2时为122g,充满气体A时为114g,则A 的式量为()
A.60
B.32
C.44
D.28
6.将20.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),
该混合物的组成可能是()
A.钙和锌
B.镁和铜
C.铝和镁
D.锌和铁
7.同温同压下的氧气和氢气,若体积相同时,两种气体的质量比为,其密
度比为;若质量相等时,两种气体的体积比;。
8.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积约是.
9. 在标准状况下,8.96 L甲烷和一氧化碳的混合气体的质量为7.6g,则混合气体的平均
相对分子质量为;混合气体中甲烷的体积分数为,一氧化碳的质量为。
10.现有CH4和O2两种气体,它们的相对分子质量之比为,若各取1g,
则它们的物质的量依次是,它们的物质的量之比为。由此可见,当两种气体的质量相同时,它们的分子数和相对分子质量成比。11. 已知金属钠投入水中能发生下列反应:2Na + 2H2O = 2NaOH + H2↑。若2.3g钠
投入足量水中,求生成NaOH 的物质的量和所生成的H2在标准状况下的体积。
12. 标准状况下CO2和CO的混合气体15g,体积为10.08L,则此混合气体中CO2和CO
的物质的量各是多少?
课时5物质的分散系
[学习目标]
1. 了解分散系的含义和常见类型。
2. 知道胶体是一种常见的分散系,并了解胶体的重要性质及应用
3. 了解电解质和非电解质的概念,知道酸、碱、盐是电解质,并会书写强酸、强碱和盐的电离方程式。
[知识梳理]
1、叫分散系。它分为、、三种。在溶液中是分散
质,是分散剂。具体如,其中是分散质,是分散剂。
2. 鸡蛋清溶液、淀粉溶液都属于胶体,它们的分散质粒子直径范围是。
3. 试关于分散系填写下表:
4. 将饱和FeCl3溶液逐滴滴入沸水中,液体将变为色,得到的是,反应的化学方程式为。
5. 丁达尔现象是指:,常用于鉴别。
知识简介
*电泳胶体粒子可以选择性地吸附某一种电性的离子而使胶粒带上某种电荷,在通电时向异性电极定向移动,这种现象称为电泳。氢氧化铁胶粒带正电荷,通电时向负极移动。
* 聚沉当向胶体中加入浓电解质溶液时,胶粒会聚集成较大颗粒而形成沉淀,这个现象称为聚沉。聚沉常用的方法有加入电解质、加热、加相反电荷的胶体、搅拌等。
*滤纸和半透膜滤纸有微孔,溶质微粒和胶体粒子可以通过,悬浊液粒子不能通过;半透膜(如鸡蛋壳内膜、动物膀胱等)上有更小的孔,只能让溶质粒子(单个分子或离子)通过,胶粒不能通过。
* 渗析利用半透膜除去胶体中的杂质分子或离子的操作叫做渗析。
6. 在能的叫电解质。
在都不能的叫非电解质。
酸、碱、盐都(是,不是)电解质。
[例题解析]
例1.现有氯化铁溶液,氢氧化铁悬浊液和氢氧化铁胶体三种颜色接近的混合物,(1)试述怎样鉴别它们?(2)若有三者的混合物,怎样分离它们?
解析:(1)三者尽管颜色接近,但只有氢氧化铁悬浊液是混浊的,可首先鉴别出来;剩余两者中,只有氢氧化铁胶体能发生丁达尔现象,剩下的就是氯化铁溶液。
(2)三者中只有氢氧化铁悬浊液颗粒不能透过滤纸,可首先分离出来;余下的
二者中只有氢氧化铁胶粒不能透过半透膜,可随后分离出来;剩下的就是氯化铁溶液。
(答案略)
例2. 判断下列物质中不属于电解质的是()
A. 硝酸钾
B. 盐酸
C. 三氧化硫
D. 氢氧化钡
解析:判断一种物质是否电解质,一方面要看是否符合定义中的三个条件,另一方面要看导电是不是其本身电离所致。盐酸是混合物,不符合定义,故B不是。三氧化硫虽然表面上符合定义中的三个条件,但导电并不是其本身电离所致,而是它与水反应生成的硫酸电离所致,故其不是电解质。A和D从表面到本质都符合电解质的定义,故A
高一化学必修一专题四_硫、氮和可持续发展复习提纲
专题四硫、氮和可持续发展 一、含硫化合物的性质和应用: 1、SO2的性质及其应用: (1)物理性质:通常为无色、有毒气体,具有刺激性气味,密度比空气大,易溶于水(常温常压下一体积水能溶解40体积SO2),易液化(沸点为-10℃)。是严重的大气污染物。 备注:大气污染物通常包括:SO2、CO、氮的氧化物、烃、固体颗粒物(飘尘)等。 (2)化学性质: ①SO2是酸性氧化物: ②还原性:SO2中S为+4价,可与强氧化剂(如氧气等)反应生成+6价的S: 1)SO2 + O2 <==== > 2SO3 催化剂 加热 2)能使溴水褪色:SO2 + Br2 + 2H2O ===H2SO4 +2HBr 3)与H2O2反应:SO2 + H2O2 === H2SO4 4)SO2在水溶液中能被KMnO4(H+)、Cl2、Fe3+、HNO3等氧化,归纳如下(都在通常条件下进行): SO2H2SO4 ③氧化性:SO2中S为+4价,可以降低,表现出氧化性,但氧化性很弱: SO2 + 2H2S ===3S↓+ 2H2O ④漂白性:SO2可与某些有色物质反应,生成不稳定的无色物质,加热时这些无色物质又会发生分解,从而恢复原来的颜色,即漂白作用是可逆的。常用于实验室对SO2 气体的检验 备注:漂白原理类型:①吸附型:活性炭漂白——活性炭吸附色素(包括胶体)②强氧化型:HClO、O3、H2、Na2O2 等强氧 化剂漂白——将有色物质氧化,不可逆③化合型:SO2 漂白 ——与有色物质化合,可逆 (3)酸雨——硫酸型酸雨: 1)硫酸型酸雨的形成: PH值小于5.6的雨水叫酸雨。含硫酸的酸雨称硫酸型酸雨;含硝酸的酸雨称硝酸型酸雨。 硫酸型酸雨的形成途径: ①空气中的二氧化硫,在光照、烟尘中的金属氧化物等作用下,和氧气生成三氧化硫,溶于水后形成硫酸: SO2 + O 2 <==== > 2SO3 SO3 + H2O === H2SO4 催化剂 加热 ②空气中的二氧化硫直接溶于水并生成亚硫酸,亚硫酸具有较强的还原性,在空气中的氧气作用下生成硫酸: SO2 + H2O H2SO3 2H2SO3 + O2 == 2H2SO4 第 1 页共8 页
高一化学必修一知识点(带重点符号)--新版
高一化学必修一必背的知识点 第一章从实验学化学 一.化学方法 1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。 (3)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (4)钠、磷等失火宜用沙土扑盖。 (5)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。 二.混合物的分离和提纯 提纯的方 法 分离的物质应注意的事项应用举例 过滤固液混合的分离一贴、二低、三靠如粗盐的提纯 蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的 位置,如石油的蒸馏中冷凝管中 水的流向 如石油的蒸馏 萃取利用溶质在互不相溶的溶剂里的溶 解度不同,用一种溶剂把溶质从它 与另一种溶剂所组成的溶液中提取 出来的方法选择的萃取剂应符合下列要求: 和原溶液中的溶剂互不相溶;对 溶质的溶解度要远大于原溶剂 用四氯化碳萃 取溴水里的溴、 碘 分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽 与漏斗上的水孔,使漏斗内外空 气相通。打开活塞,使下层液体 慢慢流出,及时关闭活塞,上层 液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液 蒸发和结晶用来分离和提纯几种可溶性固体的 混合物 加热蒸发皿使溶液蒸发时,要用 玻璃棒不断搅动溶液;当蒸发皿 中出现较多的固体时,即停止加 热 分离NaCl和 KNO3混合物
人教版高一化学必修一知识点总结
第一章从实验学化学 2.化学计量之间的转化关系 (1)理解物质的量及其单位摩尔、摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度等概念。 (2)以物质的量为核心的计算n= M m = NA N =Vm V =C B ×V (3)有关溶液稀释(稀释前后溶质守恒):C (浓)·V (浓)==C (稀)·V (稀) (4)溶质质量分数(W )与溶质的物质的量浓度(c )的转化:(注意其中的单位换算) 阿伏加德罗定律:同温同压下, 相同体积的任何气体都含有相同的分子数 3.一定物质的量浓度溶液的配制及误差分析 (1)容量瓶是配制一定物质的量浓度溶液的仪器,其常用规格有50 mL 、100 mL 、250 mL 、500 mL 、1000 mL 等,使用时一定要注意其规格,如500 mL 容量瓶。并且使用前一定要检查其是否漏水。 (3)误差分析 由公式知,凡是溶质的物质的量减少或使溶液体积增大的操作,都会使c 偏低,反之偏高。 第二章 化学物质及其变化 1.根据不同标准可以将化学变化进行分类: ①根据反应前后物质种类的多少以及反应物和生成物的类别可以将化学反应分为:化合反应、分解反应、置换反应、复分解反应。 ②根据反应中是否有离子参加将化学反应分为离子反应和非离子反应。 ③根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应。 2.电解质和离子反应 (1)电解质的相关概念 ①电解质和非电解质:电解质是在水溶液里或熔融状态下能够导电的化合物;非电解质是在水溶液里和熔融状态下都不能够导电的化合物。 ②电离:电离是指电解质在水溶液中产生自由移动的离子的过程。 ③酸、碱、盐是常见的电解质 酸是指在水溶液中电离时产生的阳离子全部为H+的电解质;碱是指在水溶液中电离时产生的阴离子全部为OH-的电解质;盐电离时产生的离子为金属离子和酸根离子或铵根离子。 (2)离子反应:有离子参加的一类反应称为离子反应。 ①复分解反应实质上是两种电解质在溶液中相互交换离子的反应。 ②发生复分解反应的条件是有沉淀生成、有气体生成和有水生成。只要具备这三个条件中的一个,复分解反应就可以发生。 ③在溶液中参加反应的离子间发生电子转移的离子反应又属于氧化还原反应。 (3)离子方程式: 离子方程式是用实际参加反应的离子符号来表示反应的式子。 离子方程式更能显示反应的实质。通常一个离子方程式不仅能表示某一个具体的化学反应,而且能表示同一类型的离子反应。 离子方程式的书写一般依照“写、拆、删、查”四个步骤。一个正确的离子方程式必须能够反映化学变化的客观事实,遵循质量守恒和电荷守恒,如果是氧化还原反应的离子方程式,反应中得、失电子的总数还必须相等。 (4)离子方程式正误判断: 3.氧化还原反应 升 失 氧 还,降 得 还 氧 (1)氧化还原反应的本质和特征 氧化还原反应是有电子转移(电子得失或共用电子对偏移)的化学反应,它的基本特征是反应前后某些元素的化合价发生变化。 (2)氧化剂和还原剂 反应中,得到电子(或电子对偏向),所含元素化合价降低的反应物是氧化剂;失去电子(或电子对偏离),所含元素化合价升高的反应物是还原剂。氧化剂发生还原反应,生成还原产物;还原剂发生氧化反应,生成氧化产物。 氧化还原反应中物质的变化关系可用下式表示: (3)氧化还原反应中得失电子总数必定相等,化合价升高、降低的总数也必定相等。 4.分散系、胶体的性质 (1)分散系:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。当分散剂是水或其他液体时,按照分散质粒子的大小,可以把分散系分为溶液、胶体和浊液。 (2)胶体和胶体的特性 ①分散质粒子大小在1nm~100nm 之间的分散系称为胶体。胶体稳定性介于溶液和浊液之间,属于介稳体系。
高一化学_必修1_苏教版_专题_知识点重点难点总结笔记(完整版)
苏教版化学必修1 专题知识点 物质的分类及转化 物质的分类(可按组成、状态、性能等来分类) 物质的转化(反应)类型 四种基本反应类型:化合反应,分解反应,置换反应,复分解反应 氧化还原反应和四种基本反应类型的关系 氧化还原反应 1.氧化还原反应:有电子转移的反应 2. 氧化还原反应实质:电子发生转移 判断依据:元素化合价发生变化 氧化还原反应中概念及其相互关系如下: 失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)氧化还原反应中电子转移的表示方法 双线桥法表示电子转移的方向和数目 注意:a.“e-”表示电子。 b.双线桥法表示时箭头从反应物指向生成物,箭头起止为同一种元素, 应标出“得”与“失”及得失电子的总数。 c.失去电子的反应物是还原剂,得到电子的反应物是氧化剂 d.被氧化得到的产物是氧化产物,被还原得到的产物是还原产物 氧化性、还原性强弱的判断 (1)通过氧化还原反应比较:氧化剂+ 还原剂→ 氧化产物+还原产物氧化性:氧化剂> 氧化产物
还原性:还原剂> 还原产物 (2)从元素化合价考虑: 最高价态——只有氧化性,如Fe3+、H2SO4、KMnO4等; 中间价态——既具有氧化性又有还原性,如Fe2+、S、Cl2等; 最低价态——只有还原性,如金属单质、Cl-、S2-等。 (3)根据其活泼性判断: ①根据金属活泼性: 对应单质的还原性逐渐减弱 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 对应的阳离子氧化性逐渐增强 ②根据非金属活泼性: 对应单质的氧化性逐渐减弱 Cl2Br2I2S 对应的阴离子还原性逐渐增强 (4) 根据反应条件进行判断: 不同氧化剂氧化同一还原剂,所需反应条件越低,表明氧化剂的氧化剂越强;不同还原剂还原同一氧化剂,所需反应条件越低,表明还原剂的还原性越强。 如:2KMnO4 + 16HCl (浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O MnO2 + 4HCl(浓) =△= MnCl2 + Cl2↑ + 2H2O 前者常温下反应,后者微热条件下反应,故物质氧化性:KMnO4 > MnO2 (5) 通过与同一物质反应的产物比较: 如:2Fe + 3Cl2 = 2FeCl3Fe + S = FeS 可得氧化性Cl2 > S 离子反应 (1)电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。 注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。 (2)离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。 复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。 离子方程式书写方法: 写:写出反应的化学方程式 拆:把易溶于水、易电离的物质拆写成离子形式 删:将不参加反应的离子从方程式两端删去 查:查方程式两端原子个数和电荷数是否相等 (3)离子共存问题 所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。 1、溶液的颜色如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-
(完整版)苏教版高中语文必修一_知识点整理最新
苏教版高中语文必修一知识整理 第一专题知识整理 一、字词 1、读准下列加点的字。 沁(qìn)园春橘(jú)子百舸(gě)争流怅寥廓(liáo)(kuò) 嵘(zhēng)(róng)挥斥方遒(qiú)浪遏(è)飞舟开天辟(pì)地吝啬(lìn)(sè)嬉(xī)游澄(chéng)清召(zhào)唤凄(qī)厉不驯(xùn)明澈(chè)灰烬(jìn)脊(jǐ)骨不屈不挠(náo)摇曳(yè)睫(jié)毛瞳(tóng)孔曙(shǔ)光轻蔑(miè)惆怅(chóu)(chàng)给(jǐ)予 叮咛(níng)迂(yū)回眺(tiào)望撩(liáo)起喧(xuān)响坐标轴(zhóu)噼噼(pī)啪(pā)啪絮絮(xù)叨(dāo)叨狂妄(wàng)自信迷惘(wǎng )炫(xuàn)耀晨曦(xī)沉湎(miǎn)面面相觑(qù)宠(chǒng)爱溺(nì)爱怪癖(pǐ) 粘(nián)着你粘(zhān)贴抹煞(shā)摭(zhí)拾诧(chà)异横(hèng)蛮祈祷(qí)(dǎo)磕(kē)绊(bàn)颤(chàn)抖冰雹(báo)夭(yāo)折碾(niǎn)成引吭(háng)试啼自艾(yì)自怜焦灼(zhuó)干瘪(biě) 入不敷(fū)出藐(miǎo)视刻薄(bó)薄(báo)片啮噬(niè)(shì)吮(shǔn)吸恪(kè)守赐(cì)予钦(qīn)佩 教诲(huì)兢兢(jīng)刹(chà)那犄(jī)角擂(léi)鼓纤(xiān)巧瞠(chēng)目结舌商榷(què)忐忑(tǎn)(tè) 雏(chú)形斟酌(zhēn)(zhuó)甄(zhēn)别思忖(cǔn)妥帖(tiē)2、正确书写下列加点的字。 沁园春怅寥廓瞳孔遒曙光轻蔑沉湎晨曦摭拾急躁惆怅怙恶不悛翱翔磕绊淘汰蒙蔽恪守啮噬 斟酌甄别商榷思忖妥帖瞠目结舌犄角面面相觑干瘪残骸 3、解释下列词语的意思。 漫江:满江。百舸:大船。怅寥廓:由深思而激昂慷慨的心绪。 挥斥方遒:强劲有力。激扬文字:激浊扬清,抨击恶浊的,褒扬善良的。 粪土:名词用作动词,视……如粪土。到中流击水:江心水深流急的地方。
高中化学必修一知识点总结汇总
必修1全册基本容梳理 第一章从实验学化学 一、化学实验安全 1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)烫伤宜找医生处理。 (3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。 (4)浓碱撒在实验台上,先用稀醋酸(或硼酸)中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (5)钠、磷等失火宜用沙土扑盖。 (6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。 (7)若水银温度计破裂,应在汞珠上撒上硫粉。 二.混合物的分离和提纯 分离和提纯的方法 过滤用于固液混合的分离一贴、二低、三靠。如粗盐的提纯 蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCl和KNO3混合物
蒸馏提纯或分离沸点不同的液体混合物。 防止液体暴沸,应在底部加一些沸石或碎瓷 片。水冷凝管中进水应下进上出。 萃取利用溶质在互不相溶的溶剂里的溶解 度不同,用一种溶剂把溶质从它与另一种溶 剂所组成的溶液中提取出来的方法选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂如用四氯化碳或萃取碘水里的碘。 分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取碘水里的碘后再分液 三、离子检验 (1)Cl-离子的检验: 待测溶液+AgNO3生成白色沉淀+少量稀HNO3沉淀不溶解:则证明有Cl-(2)SO42-的检验: 待测溶液+稀HCl无明显现象+BaCl2溶液生成白色沉淀:则证明含有SO42-四.除杂 注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。 例:粗盐提纯加入试剂顺序氯化钡(除去硫酸盐)→氢氧化钠(除去氯化镁)→碳酸钠(除去氯化钙、氯化钡)→过滤→盐酸(中和氢氧化钠、碳酸钠)五、物质的量的单位――摩尔
高一化学必修一知识点总结
必修1全册基本内容梳理 从实验学化学 一、化学实验安全 1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)烫伤宜找医生处理。 (3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。 (4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (5)钠、磷等失火宜用沙土扑盖。 (6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。 二.混合物的分离和提纯 分离和提纯的方法分离的物质应注意的事项应用举例 过滤用于固液混合的分离一贴、二低、三靠如粗盐的提纯 蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的位臵,如石油的蒸馏中冷凝管中水的流向如石油的蒸馏 萃取利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂用四氯化碳萃取溴水里的溴、碘 分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液 蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCl和KNO3混合物三、离子检验 离子所加试剂现象离子方程式 Cl- AgNO3、稀HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓ SO42- 稀HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓ 四.除杂 注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。 五、物质的量的单位――摩尔 1.物质的量(n)是表示含有一定数目粒子的集体的物理量。 2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。 3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。 4.物质的量=物质所含微粒数目/阿伏加德罗常数 n =N/NA
苏教版高中化学必修一知识点(全)
苏教版化学必修1知识点总结 专题一化学家眼中的物质世界 第一单元丰富多彩的化学物质 1.物质的分类及转化 1.1物质的分类(可按组成、状态、性能等来分类) (碱性氧化物) (酸性氧化物) 1.2物质的转化(反应)类型 四种基本反应类型化合反应,分解反应,置换反应,复分解反应 氧化还原反应和四种基本反应类型的关系 氧化还原反应 1.氧化还原反应:有电子转移的反应-------升失氧还 氧化还原反应中电子转移的表示方法 双线桥法表示电子转移的方向和数目 氧化性、还原性强弱的判断 (1)通过氧化还原反应比较:氧化剂 + 还原剂→氧化产物 + 还原产物 氧化性:氧化剂 > 氧化产物 还原性:还原剂 > 还原产物 (2)从元素化合价考虑: 最高价态——只有氧化性,如Fe3+、H2SO4、KMnO4等; 中间价态——既具有氧化性又有还原性,如Fe2+、S、Cl2等;
同位素:质子数相同、质量数(中子数)不同的原子 核素:具有一定质子数和种子数的原子 质子数相同、中子数不同的核素之间互称为同位素。 专题二从海水中获得的化学物质 第一单元氯、溴、碘及其化合物 1.氯气的生产原理 (1)工业制法——氯碱工业 2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑ 正极负极 (2)实验室制法 反应原理:MnO2+4HCl (浓) =△= MnCl2+2H2O+Cl2↑ 反应仪器:圆底烧瓶、分液漏斗 除杂:HCl气体(用饱和食盐水除)、水蒸气(用浓硫酸除) 收集方法:向上排空气法、排饱和食盐水法 尾气处理:NaOH溶液 氯气的性质 物理性质:黄绿色刺激性气味有毒密度比空气大可溶于水 化学性质:1. Cl2与金属反应(一般将金属氧化成高价态) 2. Cl2与非金属反应 现象:发出苍白色火焰,生成大量白雾 3. Cl2与碱的反应 Cl2+2NaOH=NaCl+NaClO+H2O 84消毒液成分为NaClO 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O CaCl2、Ca(ClO)2为漂白粉的成分,其中Ca(ClO)2为有效成分 氯水Cl2+H2O == HCl+HClO 成分分子:H2O、Cl2、HClO 离子:H+、Cl-、ClO-、OH- 氯水的性质 1. 酸性 2. 氧化性 3. 漂白性 4. 不稳定性 Cl-的检验:试剂:AgNO3溶液和稀硝酸现象:产生白色沉淀(不溶于稀硝酸) 结论:溶液中有Cl 次氯酸的性质 1.酸性 2.氧化性 3.漂白性 4.不稳定性: 氯气的用途:来水的消毒、农药的生产、药物的合成等 卤族单质的物理性质 1.状态:气态(Cl2)→液态(Br2)→固态(I2) 2.颜色:黄绿色(Cl2)→深红棕色(Br2)→紫黑色(I2),颜色由浅到深
高一化学必修一知识点总结
高中化学必修一知识点总结与习题 必修1全册基本内容梳理 第一章:从实验学化学 一、化学实验安全 1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)烫伤宜找医生处理。?(3)浓酸撒在实验台上,先用Na2CO3(或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。?(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (5)钠、磷等失火宜用沙土扑盖。 三、离子检验?离子所加试剂现象离子方程式?Cl-AgNO3、稀HNO3产生白色沉淀Cl-+Ag+=AgCl↓ SO42-稀HCl、BaCl2白色沉淀SO42-+ Ba2+= BaSO4↓?四.除杂 注意事项:为了使杂质除尽,加入的试剂不能是“适量”,而应是“过量”;但过量的试剂必须在后续操作中便于除去。
五、物质的量的单位――摩尔?1.物质的量(n)是表示含有一定数目粒子的集体的物理量。?2.摩尔(mol): 把含有6.02×1023个粒子的任何粒子集体计量为1摩尔。3?.阿伏加德罗常数:把6.02×1023mol-1叫作阿伏加德罗常数。 4.物质的量=物质所含微粒数目/阿伏加德罗常数n =N/NA5?.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol或g.mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量. 6.物质的量=物质的质量/摩尔质量(n = m/M)?六、气体摩尔体积?1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol?2.物质的量=气体的体积/气体摩尔体积n=V/Vm 3.标准状况下,Vm =22.4 L/mol?七、物质的量在化学实验中的应用?1.物质的量浓度. (1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B 的物质的浓度。(2)单位:mol/L(3)物质的量浓度=溶质的物质的量/溶液的体积CB= n B/V 2.一定物质的量浓度的配制?(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.?(2)主要操作 a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.注意事项:A 选用与欲配制溶液体积相同的容量瓶. B 使用前必须检查是否漏水. C 不能在容量瓶内直接溶解. D 溶解完的溶液等冷却至室温时再转移. E定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止. 3.溶液稀释:C(浓溶液)?V(浓溶液)=C(稀溶液)?V(稀溶液) 第二章:化学物质及其变化 一、物质的分类?把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。 溶液、胶体、浊液三种分散系的比较 分散质粒子大小/nm外观特征能否通过滤纸有否丁达尔效应实例?溶液小于 1 均匀、透明、稳定能没有NaCl、蔗糖溶液?胶体在1—100之间均匀、有的透明、较稳定能有Fe(OH)3胶体?浊液大于100不均匀、不透明、不稳定不能没有泥水 二、物质的化学变化 1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。?(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:?A、化合反应(A+B=AB)B、分解反应(AB=A+B)?C、置换反应(A+BC=AC+B)?D、复分解反应(AB+C D=AD+CB)?(2)根据反应中是否有离子参加可将反应分为:?A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。 B、分子反应(非离子反应)?(3)根据反应中是否有电子转移可将反应分为:?A、氧化还原反应:反应中有电子转移(得失或偏移)的反应 实质:有电子转移(得失或偏移) 特征:反应前后元素的化合价有变化 B、非氧化还原反应?2、离子反应?(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,
苏教版-语文-高一-江苏赣榆海头中学苏教版语文必修一教案专题三奥德赛节选
奥德赛 教学目标:培养学生阅读欣赏诗歌的能力 1、了解《奥德赛》的有关知识 2、体会奥德赛执著回归的情怀 3.分析人物形象 教学方法:文本研习法 教学过程设计 一、作者作品简介 1、作者:相传盲诗人荷马,经常带着竖琴在各地吟唱特洛亚战争英雄事迹 的歌。广征博采,巧制精编,荟前人之长,避众家之短,以大诗人的情 怀,大艺术家的功力,创作了《伊利亚特》和《奥德赛》两部瑰美的诗 篇。 2、背景:奥德修斯在攻下伊利昂城后,就带着他的伙伴,乘船向它的故乡 出发。但回乡的旅程很不顺利:独幕巨人吃掉了他的同伴,神女克尔刻 把他的同伴用巫术变成猪,又要把他留在海岛上;他又到了环绕大地的 瀛海边缘,看到许多过去的鬼魂;躲过女妖的迷惑人的歌声,躲过怪物 卡律布狄斯和斯库拉,最后女神卡吕普索在留了奥德修斯好几年之后, 同意让他回去。本文就是从这里开始的。 二、整体感知 节选部分几乎由对话组成,从神女接受旨意为奥德修斯放行写起,继而写忧郁的,“消磨着生命”奥德修斯听完女神的陈述后由不信到相信的过程,又写神女为奥德修斯饯行及奥德修斯德坚定的归家信念,表达了作者对奥德修斯执著回归信念的赞美之情。 三、课文分析 ㈠课文的段意划分 参考答案: 第一节写高贵的神女为奥德修斯放行。 本来神女要留下英雄的奥德修斯结为百年,,但执著的奥德修斯眷念着自己的国家和妻子,坚决不同意留下。宙斯命令信使赫尔墨斯代表他的旨意命令女神为奥德修斯放行,因此他“不得不听从宙斯的难以违抗的旨意”。这是前三行交待的内容。 然后对奥德修斯进行描绘:“坐在辽阔的海岸边”,“两眼泪流不断”,“怀念归返”,“神女有情他无意”等等,刻画了一个思归心切的英雄形象。“消磨着美好的生命”“折磨自己的心灵”反映了奥德修斯欲走不能,无可奈何,但又坚守自己信念的内心。这是4至11行的主要内容。 12行至本节的结束,是女神宣布放行的消息。 第二节是奥德修斯对放行的怀疑的质问。 “心惊颤”表现了奥德修斯复杂的心理,消息来得太突然,没有任何思想准备;是真的放行,还是真有企图?但归家的信念迫使他说出了“有翼飞翔的话语”,大胆的对女神的话质疑。“我无意顺从你的心愿”显示了奥的修斯的机智,接着
人教版高一化学必修一知识点超全总结
化学必修1知识点 第一章从实验学化学一、常见物质的分离、提纯和鉴别 混合物的物理分离方法
i、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl和KNO3混合物。
ii、蒸馏蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体的分离,叫分馏。 操作时要注意: ①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。 ②温度计水银球的位置应与支管底口下缘位于同一水平线上。 ③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3。 ④冷凝管中冷却水从下口进,从上口出。 ⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。 常见物质除杂方法
①常见气体的检验
②几种重要阳离子的检验 (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。 (2)K+用焰色反应来检验时,它的火焰呈浅紫色(通过钴玻片)。 (3)Ba2+能使用稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。(4)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。 (5)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2] (6)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。 (7)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,
2019高一化学必修一知识点总结
2019高一化学必修一知识点总结 1 元素周期表、元素周期律 一、元素周期表 ★熟记等式:原子序数=核电荷数=质子数=核外电子数(马上点标题下蓝字"高中化学"注重可获取更多学习方法、干货!) 1、元素周期表的编排原则: ①按照原子序数递增的顺序从左到右排列; ②将电子层数相同的元素排成一个横行——周期; ③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族 2、如何精确表示元素在周期表中的位置: 周期序数=电子层数;主族序数=最外层电子数 口诀:三短三长一不全;七主七副零八族 熟记:三个短周期,第一和第七主族和零族的元素符号和名称 3、元素金属性和非金属性判断依据: ①元素金属性强弱的判断依据: 单质跟水或酸起反应置换出氢的难易; 元素价氧化物的水化物——氢氧化物的碱性强弱;置换反应。 ②元素非金属性强弱的判断依据: 单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;
价氧化物对应的水化物的酸性强弱;置换反应。 4、核素:具有一定数目的质子和一定数目的中子的一种原子。 ①质量数==质子数+中子数:A == Z + N ②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。(同一元素的各种同位素物理性质不同,化学性质相同) 二、元素周期律 1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素) ②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素) ③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向 2、元素的化合价与最外层电子数的关系:正价等于最外层电子数(氟氧元素无正价) 负化合价数= 8—最外层电子数(金属元素无负化合价) 3、同主族、同周期元素的结构、性质递变规律: 同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引水平减弱,失电子水平增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。 同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多 原子半径——→逐渐减小,得电子水平——→逐渐增强,失电子水平——→逐渐减弱
(完整版)高一化学必修一知识点汇总
高一化学必修一知识点汇总 第一章 一、物质的量: 1、“物质的量”是国际单位制中的基本的物理量之一,用n 表示 2、意义:把一定数目的微观粒子与宏观可称量的物质联系起来,它表示的是物质中所含粒子的多少-分子、原子、离子、质子、电子。 3.注意:“物质的量”是一个物理量的全称,是一个专有名词,不能当成物质的数量或质量来理解,不得随意增减。 二、摩尔——物质的量的单位 1、摩尔是“物质的量”的单位。 1摩尔:含有与0.012Kg 12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。它表示的是物质中微粒的个数与阿伏加德罗常数的比值。 =粒子数目物质的量阿伏加德罗常数 A N N n = 2、阿伏加德罗常数(N A ) 单位:mol -1(/ mol ) 数值:0.012kg 12C 中所含12C 原子的个数(kg kg 2610993.1012.0-?) 近似值:6.02×1023mol -1 (6.02×1023/ mol ) 3、适用范围:只适用于微观粒子,不能应用于宏观物质。(分子、原子、离子、质子、中子、电子),在使用时必须标明微观粒子的种类,如1molH 、1molH+。不能用摩尔数代替物质的量。 三、摩尔质量 如何由物体质量求出微观粒子个数呢? 物质质量?→?? 物质的量?? ?→??A N 粒子个数 单个粒子质量很难称量,但大量粒子总质量可称量。(分子质量约10-26~10-25 kg ,若有阿伏加德罗常数个粒子总质量约为10-3~10-2kg ,即1g ~10g ) 1、摩尔质量:单位物质的量的物质所具有的质量。 即每摩尔粒子所具有的质量,用M 表示 m M n ==物质质量摩尔质量粒子物质的量 2、单位:()()mol kg mol kg mol g mol g //,11--??或 3、摩尔质量的数值,等于该粒子的相对质量。 即:H 2O 分子量为18,H 2O 的摩尔质量为18g/mol 4、相关计算 例题1. 1 mol 水分子中含有约 个水分子(6.02×1023) 0.5mol O 2中含有约 个O 2分子(3.01×1023) 2 mol H +中含有约 个H +(1.204×1024) 2. 在反应X+2Y=R+2M 中,已知R 和M 的摩尔质量之比为22:9,当1.6克X 与Y 完全反应后,生成4.4克R ,则在此反应中Y 和M 的质量之比为( ) A 、16:9 B 、23:9 C 、32:9 D 、46:9 3. 下列说法中不正确的是: A 、摩尔是基本物理量之一 B 、1mol 氯分子的质量是71g C 、0.5mol 硫酸的质量是49g D 、0.006kg 碳原子的物质的量是0.5mol 4. 下列说法正确的是:
高一化学必修一专题四测试
高一化学必修一专题四测试 可能用到的相对原子质量:H:2 C:12 N:14 O:16 Na:23 Mg:24 Al:27 Cl: 35.5 K:39 Ca:40 Cu:64 Zn:65 一.选择题(本题包括20小题,每小题2分,共40分,每题只有一个答案) 1.下列有关酸雨的说法正确的是() A、酸雨就是指PH<7的雨水 B、酸雨是因为雨水中含有CO2 C、工业上大量燃烧含有硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因 D、酸雨没有危害,所以不必担心,也不必想办法治理 2.银耳本身为淡黄色,某地出产一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密封状态良好的塑料棚内,在棚的一端支一口锅,锅内放入硫磺,加热使硫磺熔化并燃烧,两天左右。雪耳就制成了,这种雪耳炖不烂,且对人有害。制作雪耳利用的是() A、硫的还原性 B、SO2的漂白性 C、硫的漂白性 D、SO2的还原性 3.区别SO2与CO2可用的方法是() A、品红溶液 B、澄清石灰水 C、紫色石蕊试液 D、BaCl2溶液 4、将SO2通到显红色的酚酞试剂中,发现红色消失,主要是因为SO2( ) A.有漂白性 B.有还原性 C.是酸性氧化物 D.有氧化性 5.下列反应中,硫酸既表现出强氧化性,又表现也酸性的是() A、稀硫酸与锌粒反应生成气体 B、浓硫酸使铁、铝钝化 C、浓硫酸与铜反应产生SO2 D、浓硫酸和木炭 6、常温下不能溶于浓HNO3或浓硫酸的金属是( ) A.Ag B.Zn C.Cu D.Fe 7.下列气体中都能能浓硫酸干燥的一组是() A、NH3 HCl SO2 B、SO2 H2S CO2 C、N2 SO2 Cl2 D、SO2 NH3 CO2
苏教版高中语文必修一教案:第4专题《江南的冬景》Word版含答案
江南的冬景 ●教学目标 1.对丰富的自然美有独特的审美感悟,热爱自然,提升审美品位。 2.能从文章中找出表现景物特征的语句,分析其语言风格。 3.学会观察自然景物的特点,尝试用恰当的形式描写出来。 ●重点、难点 重点: 1.欣赏体验江南冬景明朗悠闲的情调并体会其写作技巧。 2.学习捕捉对自然万物独特的审美感悟,并用美的形式把它们表达出来。 难点:具体分析文章将审美情趣、语言风格和景物特征相融合的特点。 ●设计思想 本文体现了郁达夫散文“行文如行云流水,自然有致,笔随意转,舒卷自如”的特点,在学习时,主要采用文本研读的方式,通过美读、问题讨论来理解、体会。 文章多用诗句来渲染凸显江南冬景之美,当注意情境教学法的运用;诗句往往简洁洗练,意象丰富,希望通过引导学生运用想象对诗句进行稀释还原的方式,将学习的意境、笔法在自己的写作中实践起来。 ●教学资源 1.资料辑录: 郁达夫(1896~1945)现代作家。原名郁文,浙江富阳人。1913年赴日本留学,广泛涉猎了中外文学和哲学著作。饱受屈辱和歧视的异国生活,激发了他的爱国热忱,也使他忧伤、愤世。他从研究经济学转而走上文学创作的道路,1921年参与发起成立创造社,出版了新文学最早的白话短篇小说集《沉沦》,以其“惊人的取材、大胆的描写”而震动了文坛。1945年日本投降后被日本宪兵在苏门答腊秘密杀害。作品有:《沉沦》《屐痕处处》《风沉醉的晚上》《迟桂花》《出奔》等。 2.《江南的冬景》教学PPT ●教学设计
●课堂反馈 1.下列加点字的注音有错误 ..的一项是() A. 煮茗.(míng)蛰.(zhé)居曝.(pù)背亘.古(gèn) B. 赭.(zhě)色间.(jiàn)或给.与(j?)涮.(xuàn)羊肉 C. 乌桕.(jiù)恣.(zì)意谛.(dì)听剥.(bāo)花生 D. 槎桠 ..(chá yā)正.月(zhēng)月晕.(yùn)绿.(lù)林豪客 2. 下列字形全都正确 ..的一项是() A. 暖坑萝卜莫名其妙相应成趣 B. 绿荫轮廓得失具亡窗临远阜 C. 蛰居屋檐乌蓬小船恍然大悟 D. 逍遥恣意曝背谈天直截了当 3. 选词填空 (1)但对于江南的冬景,总觉得有可以抵得过北方夏夜的一种特殊情调,说得摩登些,便是一种的情调。(A.明媚 B.明净 C.明朗) (2)则青天碧落之下,你不但不感到岁时的,而且还可以饱觉着一种莫名其妙的 含蓄在那里的生气。(A.萧条 B.肃杀 c.凄凉)
人教版高一化学必修一知识点超全总结
化学必修1知识点 第一章从实验学化学 一、常见物质的分离、提纯和鉴别 i、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。加热蒸发皿使溶液蒸发时、要用玻璃棒不断搅动溶液,防止由于局部温度过高,造成液滴飞溅。当蒸发皿中出现较多的固体时,即停止加热,例如用结晶的方法分离NaCl 和KNO3混合物。 ii、蒸馏蒸馏是提纯或分离沸点不同的液体混合物的方法。用蒸馏原理进行多种混合液体的分离,叫分馏。 操作时要注意: ①在蒸馏烧瓶中放少量碎瓷片,防止液体暴沸。 ②温度计水银球的位置应与支管底口下缘位于同一水平线上。 ③蒸馏烧瓶中所盛放液体不能超过其容积的2/3,也不能少于l/3。 ④冷凝管中冷却水从下口进,从上口出。 ⑤加热温度不能超过混合物中沸点最高物质的沸点,例如用分馏的方法进行石油的分馏。
常见物质除杂方法 ②几种重要阳离子的检验 (l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(4)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。(5)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2](6)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。 (7)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。 (8)Fe3+能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。(9)Cu2+蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。 ③几种重要的阴离子的检验 (1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。 (2)Cl-能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。 (3)Br-能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。 (4)I-能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。(5)SO42-能与含Ba2+溶液反应,生成白色BaSO4沉淀,不溶于硝酸。 (6)SO32-浓溶液能与强酸反应,产生无色有刺激性气味的SO2气体,该气体能使品红溶液褪色。能与BaCl2溶液反应,生成白色BaSO3沉淀,该沉淀溶于盐酸,生成无色有刺激性气味的SO2气体。 (7)S2-能与Pb(NO3)2溶液反应,生成黑色的PbS沉淀。 (8)CO32-能与BaCl2溶液反应,生成白色的BaCO3沉淀,该沉淀溶于硝酸(或盐酸),生成无色无味、能使澄清石灰水变浑浊的CO2气体。 二、常见事故的处理 三、化学计量 ①物质的量 定义:表示一定数目微粒的集合体符号n 单位摩尔符号 mol 阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。用NA表示。约为6.02x1023 N 公式:n= NA ②摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的分子量 m 公式:n= M ③物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离 V 公式:n= Vm 标准状况下,1mol任何气体的体积都约为22.4L ④阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同的分子数 ⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量。符号CB 单位:mol/l
