高中化学定律公式

高中化学定律和公式
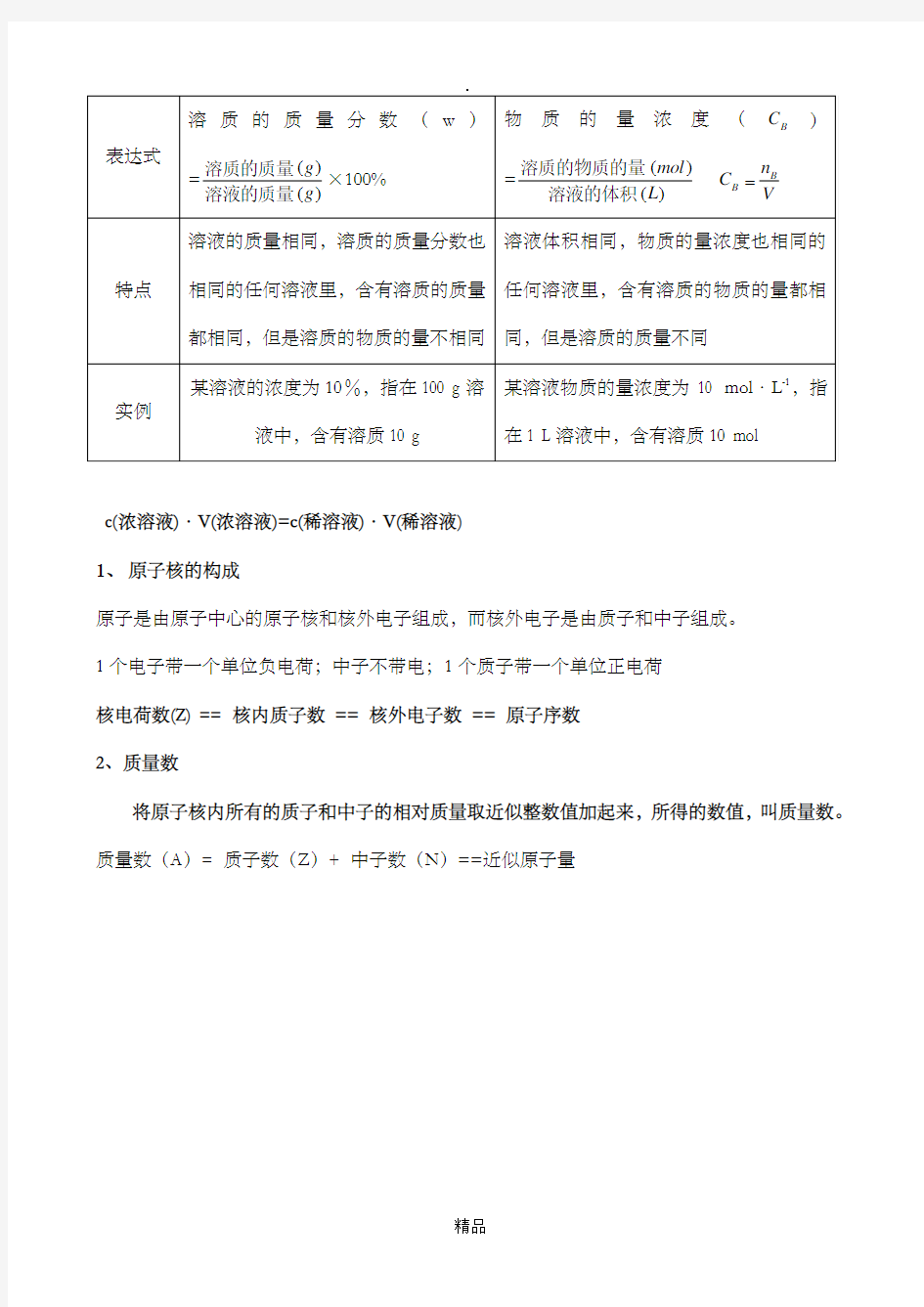
一、物质的量的单位——摩尔
物质的量实际上表示含有一定数目粒子的集体。它的符号是n 。 我们把含有6.02×10
23
个粒子的任何粒子集体计量为1摩尔,摩尔简称摩,符号mol 。
物质的量(n )、粒子个数(N )和阿伏加德罗常数(A N )三者之间的关系用符号表示:n=A
N N (1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号M 。 物质的量(n )、物质的质量(m)和摩尔质量(M )三者间的关系: 3.物质的量(mol )=
1
()()g g mol 物质的质量摩尔质量 符号表示:n=M
m
在相同条件下(同温、同压)物质的量相同的气体,具有相同的体积。在标准状况下(0 ℃、101 kPa)1 mol 任何气体的体积都约是22.4 L 。 1.气体摩尔体积
单位物质的量的气体所占的体积叫气体摩尔体积。符号为m V m V
V n
=
(V 为标准状况下气体的体积,n 为气体的物质的量) 单位:L/mol 或(L·mol -1) m 3/mol 或(m 3·mol -1) 定义:以单位体积溶液里所含溶质B 的物质的量来表示的溶液组成的物理量,叫做溶质B 的物质的量浓度。用符号B C 表示,单位mol·L -1(或mol/L )。表达式:B
B n C
=
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
1、原子核的构成
原子是由原子中心的原子核和核外电子组成,而核外电子是由质子和中子组成。
1个电子带一个单位负电荷;中子不带电;1个质子带一个单位正电荷
核电荷数(Z) == 核内质子数== 核外电子数== 原子序数
2、质量数
将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量
X
A
Z ——元素符号
质量数——核电荷数——(核内质子数)表示原子组成的一种方法
a ——代表质量数;
b ——代表质子数既核
电荷数;
c ——代表离子的所带电荷数;
d ——代表化合价
e ——代表原子个数
请看下列表示
a b
+d
X
c+e
3、 阳离子 a W
m+
:核电荷数=质子数>核外电子数,核外电子数=a -m
阴离子 b Y n-
:核电荷数=质子数<核外电子数,核外电子数=b +n
元素主要化合价变化规律性
-4→-1→0
二、电子式
在元素符号的周围用小黑点(或×)来表示原子最外层电子的式子叫电子式。如Na 、Mg 、Cl 、O 的电子式我们可分别表示为: 1、表示原子
Na × ×Mg × ?Cl ?O ? 习惯上,写的时候要求对称。
电子式同样可以用来表示阴阳离子,例如 2、表示简单离子:
阳离子:Na + Mg 2+ Al 3+
阴离子: [∶S ∶]2- [∶Cl ∶]- [∶O ∶]2-
①.电子式最外层电子数用?(或×)表示;
②.阴离子的电子式不但要画出最外层电子数,还应用[ ]括起来,并在右上角标出“n-”电荷字样;
③.阳离子不要画出最外层电子数,只需标出所带的电荷数。 3、表示离子化合物 NaF MgO KCl Na +
[∶F ∶]- Mg 2+
[∶O ∶]2- K +[∶Cl ∶]-
对于象MgCl 2、Na 2O 之类的化合物应该用电子式来表示
书写离子化合物的电子式时,相同离子不能合并,且一般对称排列.
4、.表示离子化合物的形成过程
‥ ‥ ∶ ‥
‥
‥ ‥
‥ ‥ ‥
‥ ‥ ‥ ‥ ‥ ‥ ‥
①反应物要用原子的电子式表示,而不是用分子式或分子的电子式表示; 5、共价键的表示方法:
1、在化学反应中,反应物的总能量与生成物的总能量间的能量差 1、∑E(反应物)>∑E(生成物)——放出能量
2、∑ E (反应物)<∑E(生成物)—— 吸收能量
放热反应:放出热的化学反应
化学反应 吸热反应:吸收热的化学反应 吸放热与能量关系
一、原电池的定义:将化学能转化为电能的装置. 1、原电池的工作原理
正极:铜片上: 2H +
+2e- =H 2↑ (还原反应) 负极:锌片上: Zn-2e-=Zn
2+
(氧化反应)
氧化还原反应:Zn+2H +
=Zn 2+
+H 2↑ 该电极反应就是Zn + 2H +
= Zn 2+
+ H 2↑
一、化学反应的速率
1、定义:单位时间内反应物的浓度减少或生成物浓度的增加来表示
2、单位:mol/L·s mol/L·min
3、表达式:v(A)==
t
A c ??)
( △c(A)表示物质A 浓度的变化 ,△t 表示时间
(2) 对于反应mA(g) + nB(g)
pC(g) + qD(g)
来说,则有
q
V
p
V
n
V
m
V
D
C
B
A=
=
=
一氯甲烷(气态)
二氯甲烷(液态)
三氯甲烷(液态)
四氯甲烷(液态)
取代
思考:
左边这
些反应
是
置换反
应吗?
烷烃燃烧的通式
C n H2n+2 +
2
1
n3+O
2
n CO2 + (n+1) H2O
3、加聚反应
2)石油的炼制:
分馏---利用原油中各成分沸点不同,将复杂的混合物分离成较简单更有用的混合物的过程。裂化---在一定条件下,把分子量大、沸点高的烃断裂为分子量小、沸点低的烃的过程。
规律:生成等量的烷烃与烯烃,目的:提高汽油的产量。
高分子化合物及其特征。乙烯为单体,重复结构单元-CH2-CH2-称为链节,n为聚合度-表示高分子化合物中所含链节的数目。
一、反应热焓变
1、定义:恒压条件下,反应的热效应等于焓变
2、符号:△H
3、单位:kJ/mol 或kJmol -
4、反应热表示方法:△H为“+”或△H>0 时为吸热反应;△H为“一”或△H<0 时为放热反应。
5、△H 计算的三种表达式:
(1) △H == 化学键断裂所吸收的总能量—化学键生成所释放的总能量 (2) △H == 生成的总能量 –反应物的总能量 (3) △H = 反应物的键能之和– 生成物的键能之和
中和热的定义是在稀溶液中,酸跟碱发生中和反应而生成 1 mol H 2O 时的反应热叫中和热。 【实验】实验2-3:在50mL 烧杯中加入0.50mol/L 的盐酸,测其温度。另用量筒量取50mL 0.55mol/L NaOH 溶液,测其温度,并缓缓地倾入烧杯中,边加边用玻璃棒搅拌。观察反应中溶液温度的变化过程,并作好记录。
其中:c =4.18J/(g·℃),m 为酸碱溶液的质量和,△t=t 2-t 1,t 1是盐酸温度与NaOH 溶液温度的平均值,n 为生成水的物质的量。 一、盖斯定律
1、 盖斯定律:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。 第一节 化学反应速率
1、化学反应速率的表示方法:用单位时间内反应物浓度的减少或生成物的浓度增加来表示。 V t
c ?=? 单位是:mol/(L·s)或 mol/(L·min)或 mol/(L·h)。V 表示反应速率,C
表示反应物或生成物浓度,
△C 表示其浓度变化(取其绝对值)t 表示时间,△t 表示时间变化
2.对于在一个容器中的一般反应 aA + bB = cC + dD 来说有: V A :V B :V C :V D = △C A :△C B :△C C :△C D = a :b :c :d 。在同一个反应中,各物质的反应速率之比等于方程式中的系数比。
一、可逆反应与不可逆反应 溶解平衡的建立
开始时v (溶解)>v (结晶) 平衡时v (溶解)=v (结晶)
结论:溶解平衡是一种动态平衡
▲勒沙特列原理:如果改变影响平衡的一个条件(如浓度、压强、温度)平衡就向能够减弱这种改变的方向移动。
平衡常数实际上是平衡混合物中各生成物浓度的化学计量数次方的乘积除以反应物浓度的化
学计量数次方的乘积。即浓度商 ()()()()
q m n D k
A B ==P c c C c Q c c 2. 表达式对于任意反应m A (g)+n B (g) p C (g)+q D (g)
()()()()
q m
n D k A B =P c C c c c
(1)在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1g/mL 。水的物质的量浓度55.6 mol/L 。(由来设水为1L ,其质量约为1000g ,物质的量=1000/18=55.56mol ,浓度=55.56/1=55.56mol/L )。 某指定反应物的转化率 =
指定反应物的起始浓度
指定反应物的平衡浓度
指定反应物的起始浓度-×100%
1、物质浓度的变化关系
反应物:平衡浓度 = 起始浓度—转化浓度 生成物:平衡浓度 =起始浓度+转化浓度 各物质的转化浓度之比等于它们在化学方程式中物质的化学计量数之比。
2、反应物的转化率
转化率 =%100*)
()(体积或浓度反应物起始的物质的量体积或浓度反应物转化的物质的量
3、产品的产率 产率 =
%100* 物质的量
理论上可得到的产物的的物质的量
实际生产产物
4、计算模式:
aA(g) + bB(g)
cC(g) + dD(g)
起始量 m n 0 0 变化量 ax bx cx dx 平衡量 m-ax n-bx cx dx 一 、弱电解质的电离
水是极弱的电解质,发生微弱的(自偶)电离。 1、H 2O + H 2O
H 3O + + OH - 简写: H 2O
H ++ OH -
2、 H 2O 的电离常数K 电离= -2C(H )C(OH )C(H O)
c (H +)· c (OH -)=K 电离·C(H 2O)
3、常数K 电离与常数C(H 2O)的积作为一新的常数,叫做水的离子积常数,简称水的离子
积,记作 w K 即 w K = c (H +)· c (OH -) 25℃ w K = c (H +)· c (OH -
)= 1.0×10
-
14
。
影响因素:温度越高,Kw 越大,水的电离度越大。对于中性水,尽管Kw,电离度增大,但仍是中性水, 二、溶液的酸碱性 1、溶液的酸碱性
稀溶液中25℃: Kw = c (H +)·c (OH -)=1×10-14 常温下:中性溶液:c (H +)=c (OH -)=1×10-7mol/L
酸性溶液:c (H +)> c (OH -), c (H +)>1×10-7mol/L
碱性溶液:c (H +)< c (OH -), c (H +)<1×10-7mol/L 1、定义:pH=-lg[c(H +)]
溶液的pH 指的是用C(H +)的负常用对数来表示溶液的酸碱性强弱,即pH=-lg[c(H +)],要注意的是,当溶液中C(H +)或C(OH ―)大于1 mol 时,不用pH 来表示溶液的酸碱性。广泛pH 的范围为0-14
中性溶液,c(H +)=c(OH -)=10-7mol/L pH=7 酸性溶液,c(H +)>c(OH -) pH<7 碱性溶液,c(H +)
2、盐类水解的实质:是酸碱中和反应的逆反应 酸 + 碱 盐 + 水
二、电解质溶液中的守恒关系
1、电荷守恒:电解质溶液中的阴离子的负电荷总数等于阳离子的正电荷总数,
电荷守恒的重要应用是依据电荷守恒列出等式,比较或计算离子的物质的量或物质的量浓度。 如在只含有A +、M -、H +、OH ―四种离子的溶液中c(A +)+c(H +)=c(M -)+c(OH ―),若c(H +)>c(OH ―),则必然有c(A +)<c(M -)。
【注意】书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。
2、物料守恒:就电解质溶液而言,物料守恒是指电解质发生变化(反应或电离)前某元素的原子
中和
水解
(或离子)的物质的量等于电解质变化后溶液中所有含该元素的原子(或离子)的物质的量之和。
(1)实质上,物料守恒属于原子个数守恒和质量守恒。注意:(物料守恒式没有H+和OH―)。在NaHS溶液中存在着HS―的水解和电离及水的电离。
HS―+H2O H2S+OH―HS―H++S2―H2O H++OH―
(2)从物料守恒的角度分析,有如下等式:c(HS―)+C(S2―)+c(H2S)=c(Na+);从电荷守恒的角度分析,有如下等式:c(HS―)+2(S2―)+c(OH―)=c(Na+)+c(H+);将以上两式相加,有:c(S2―)+c(OH―)=c(H2S)+c(H+):得出的式子被称为质子守恒。
1、难溶电解质溶解平衡的概念:在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)。化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全
2、表达式:如:AgCl (s) Cl-(aq)+Ag+(aq)
4、溶度积(平衡常数)——K sp
(1) 对于沉淀溶解平衡:(平衡时)M m A n(s) mM n+(aq)+nA m—(aq)K sp =[ c (M n+) ]m·[c(A m— )]n在一定温度下,K sp是一个常数,称为溶度积常数,简称溶度积。
4、溶度积(平衡常数)——K sp
(1) 对于沉淀溶解平衡:(平衡时)M m A n(s) mM n+(aq)+nA m—(aq)K sp =[ c (M n+) ]m·[c(A m— )]n在一定温度下,K sp是一个常数,称为溶度积常数,简称溶度积。
如有侵权请联系告知删除,感谢你们的配合!
高级中学数学公式定理汇总
高中数学公式结论大全 1. ,. 2.. 3. 4.集合的子集个数共有个;真子集有个;非空子集有个;非空的真子集有 个. 5.二次函数的解析式的三种形式 (1)一般式; (2)顶点式;当已知抛物线的顶点坐标时,设为此式 (3)零点式;当已知抛物线与轴的交点坐标为时,设为此式 4切线式:。当已知抛物线与直线相切且切点的横坐标为时,设为此式 6.解连不等式常有以下转化形式 . 7.方程在内有且只有一个实根,等价于或。 8.闭区间上的二次函数的最值 二次函数在闭区间上的最值只能在处及区间的两端点处取得,具体如下:
(1)当a>0时,若,则; ,,. (2)当a<0时,若,则, 若,则,. 9.一元二次方程=0的实根分布 1方程在区间内有根的充要条件为或; 2方程在区间内有根的充要条件为 或或; 3方程在区间内有根的充要条件为或 . 10.定区间上含参数的不等式恒成立(或有解)的条件依据 (1)在给定区间的子区间形如,,不同上含参数的不等式(为参数)恒成立的充要条件是。 (2)在给定区间的子区间上含参数的不等式(为参数)恒成立的充要条件是 。
(3) 在给定区间 的子区间上含参数的不等式(为参数)的有解充要条件是 。 (4) 在给定区间 的子区间上含参数的不等式(为参数)有解的充要条件是 。 对于参数及函数.若恒成立,则;若恒成立,则;若有解,则 ;若 有解,则 ;若 有解,则 . 若函数无最大值或最小值的情况,可以仿此推出相应结论 11.真值表 12.常见结论的否定形式 原结论 反设词 原结论 反设词 是 不是 至少有一个 一个也没有 都是 不都是 至多有一个 至少有两个 大于 不大于 至少有个 至多有个 小于 不小于 至多有个 至少有 个 对所有,成立 存在某,不成立 或 且 对任何,不成立 存在某,成立 且 或 p q 非p p或q p且q 真 真 假 真 真 真 假 假 真 假 假 真 真 真 假 假 假 真 假 假
高中化学定律公式
高中化学定律和公式 一、物质的量的单位——摩尔 物质的量实际上表示含有一定数目粒子的集体。它的符号是n 。 我们把含有×1023个粒子的任何粒子集体计量为1摩尔,摩尔简称摩,符号mol 。 物质的量(n )、粒子个数(N )和阿伏加德罗常数(A N )三者之间的关系用符号表示:n= A N N (1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号M 。 物质的量(n )、物质的质量(m)和摩尔质量(M )三者间的关系: 3.物质的量(mol )= 1()()g g mol 物质的质量摩尔质量 符号表示:n=M m 在相同条件下(同温、同压)物质的量相同的气体,具有相同的体积。在标准状况下(0 ℃、101 kPa)1 mol 任何气体的体积都约是 L 。 1.气体摩尔体积 单位物质的量的气体所占的体积叫气体摩尔体积。符号为m V m V V n (V 为标准状况下气体的体积,n 为气体的物质的量) 单位:L/mol 或(L·mol -1) m 3/mol 或(m 3·mol -1)
定义:以单位体积溶液里所含溶质B 的物质的量来表示的溶液组成的物理量,叫做溶质B 的物质的量浓度。用符号B C 表示,单位mol·L -1(或mol/L )。表达式:B B n C V =
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 1、 原子核的构成 原子是由原子中心的原子核和核外电子组成,而核外电子是由质子和中子组成。 1个电子带一个单位负电荷;中子不带电;1个质子带一个单位正电荷 核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数 2、质量数 将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。 质量数(A )= 质子数(Z )+ 中子数(N )==近似原子量 X A Z ——元素符号 质量数——核电荷数——(核内质子数)表示原子组成的一种方法 a ——代表质量数; b ——代表质子数既核 电荷数; c ——代表离子的所带电荷数; d ——代表化合价 e ——代表原子个数 请看下列表示 a b +d X c+e 3、 阳离子 aW m+ :核电荷数=质子数>核外电子数,核外电子数=a -m 阴离子 b Y n-:核电荷数=质子数<核外电子数,核外电子数=b +n
高中化学常用基本公式整理汇总
高中化学常用基本公式汇总 1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO2 2.一氧化碳与氧气的反应2CO+O2==== 2CO2 3.二氧化碳与碳的反应CO2+C==== 2CO 4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑ 5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑ 6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑ 7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O 8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH 9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O 碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O 10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑ 11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑ 12.碳酸钙加热的反应CaCO3==== CaO+CO2↑ 13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2 二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O 14.氮气与氧气的反应N2+O2==== 2NO 15.一氧化氮与氧气的反应2NO+O2==== 2NO2 16.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO 17.氮气与氢气的反应N2+3H2========= 2NH3
最新高中化学常用计算公式讲解学习
学习资料 精品文档 高中化学常用计算公式 1.有关物质的量(mol )的计算公式 (1)物质的量(mol )=(g) (g /mol) 物质的质量物质的摩尔质量 (2)物质的量(mol )=() (/mol)?23微粒数个6.0210个 (3)气体物质的量(mol )=(L) 22.4(L /mol)标准状况下气体的体积 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L ) 2.有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL )=(g) (mL)溶液质量溶液体积 ②溶质的质量分数=(g) 100%()(g)?+溶质质量溶质质量溶剂质量 ③物质的量浓度(mol/L )=(mol) (L)溶质物质的量溶液体积 (2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数=(mol/L)1L (g /mol) (mL)(g /mL)???物质的量浓度溶质的摩尔质量1000溶液密度 ②物质的量浓度=mL (g /mL)(g /mol)1L ???1000溶液密度溶质的质量分数 溶质摩尔质量 3.平均摩尔质量或平均式量的计算公式 (1)已知混合物的总质量m (混)和总物质的量n (混):m() n()M =混混 说明:这种求混合物平均摩尔质量的方法,不仅适用于气体,而且对固体或液体也同样适用。 (2)已知标准状况下,混合气体的密度ρ(混):22.4()M ρ=g 混 注意:该方法只适用于处于标准状况下(0℃,1.01×105 Pa )的混合气体。 4.化学平衡计算公式 对于可逆反应:mA(g)nB(g)pC(g)qD(g)++?
高中数学《立体几何》重要公式、定理
高中数学《立体几何》重要公式、定理 1.证明直线与平面的平行的思考途径 (1)转化为直线与平面无公共点; (2)转化为线线平行; (3)转化为面面平行. 2.证明直线与直线的平行的思考途径 (1)转化为判定共面二直线无交点; (2)转化为二直线同与第三条直线平行; (3)转化为线面平行; (4)转化为线面垂直; (5)转化为面面平行. 3.证明直线与直线的垂直的思考途径 (1)转化为相交垂直; (2)转化为线面垂直; (3)转化为线与另一线的射影垂直; (4)转化为线与形成射影的斜线垂直. 4.证明直线与平面垂直的思考途径 (1)转化为该直线与平面内任一直线垂直; (2)转化为该直线与平面内相交二直线垂直; (3)转化为该直线与平面的一条垂线平行; (4)转化为该直线垂直于另一个平行平面; (5)转化为该直线与两个垂直平面的交线垂直. 5.证明平面与平面平行的思考途径 (1)转化为判定二平面无公共点; (2)转化为线面平行; (3)转化为线面垂直. 6.证明平面与平面的垂直的思考途径 (1)转化为判断二面角是直二面角; (2)转化为线面垂直. 7.空间向量的加法与数乘向量运算的运算律 (1)加法交换律:a +b=b +a . (2)加法结合律:(a +b)+c=a +(b +c). (3)数乘分配律:λ(a +b)=λa +λb . 8.共线向量定理 对空间任意两个向量a 、b(b ≠0 ),a ∥b ?存在实数λ使a=λb . P A B 、、三点共线?||AP AB ?AP t AB =?(1)OP t OA tOB =-+. ||AB CD ?AB 、CD 共线且AB CD 、不共线?AB tCD =且AB CD 、不共线. 9.共面向量定理 向量p 与两个不共线的向量a 、b 共面的?存在实数对,x y ,使p ax by =+. 推论 空间一点P 位于平面MAB 内的?存在有序实数对,x y ,使MP xMA yMB =+, 或对空间任一定点O ,有序实数对,x y ,使OP OM xMA yMB =++. 10.平面向量加法的平行四边形法则向空间的推广 始点相同且不在同一个平面内的三个向量之和,等于以这三个向量为棱的平行六面体的以公共始点为始点的对角 线所表示的向量. 11.对空间任一点O 和不共线的三点A 、B 、C ,满足OP xOA yOB zOC =++(x y z k ++=),则当1k =时,对于空间任一点O ,总有P 、A 、B 、C 四点共面;当1 k ≠
【强烈推荐】高一化学所有计算公式
高一化学所有计算公式 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl 2、碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl 3、碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ 4、木炭还原氧化铜: 2CuO + C 高温2Cu + CO2↑ 5、铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu 6、氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl 7、钠在空气中燃烧:2Na + O2 △Na2O2 钠与氧气反应:4Na + O2 = 2Na2O 8、过氧化钠与水反应:2Na2O2 + 2H2O = 4NaOH + O2↑ 9、过氧化钠与二氧化碳反应:2Na2O2 + 2CO2 = 2Na2CO3 + O2 10、钠与水反应:2Na + 2H2O = 2NaOH + H2↑ 11、铁与水蒸气反应:3Fe + 4H2O(g) = F3O4 + 4H2↑ 12、铝与氢氧化钠溶液反应:2Al + 2N aOH + 2H2O = 2NaAlO2 + 3H2↑ 13、氧化钙与水反应:CaO + H2O = Ca(OH)2 14、氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O 15、氧化铝与盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O 16、氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O 17、氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl 18、硫酸亚铁与氢氧化钠溶液反应:FeSO4 + 2NaOH = Fe(OH)2↓+ Na2SO4 19、氢氧化亚铁被氧化成氢氧化铁:4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
高中数学公式大全由易到难
乘法与因式分解 a^2-b^2=(a+b)(a-b) a^3+b^3=(a+b)(a^2-ab+b^2) ? a^3-b^3=(a-b(a^2+ab+b^2) 三角不等式|a+b|≤|a|+|b| |a-b|≤|a|+|b| |a|≤b<=>-b≤a≤b |a-b|≥|a|-|b| -|a|≤a≤|a| 一元二次方程的解-b+√(b^2-4ac)/2a -b-√(b^2-4ac)/2a 根与系数的关系X1+X2=-b/a X1*X2=c/a 注:韦达定理 判别式 b^2-4ac=0 注:方程有两个相等的实根 b^2-4ac>0 注:方程有两个不等的实根 b^2-4ac<0 注:方程没有实根,有共轭复数根 三角函数公式 两角和公式 sin(A+B)=sinAcosB+cosAsinB sin(A-B)=sinAcosB-sinBcosA cos(A+B)=cosAcosB-sinAsinB cos(A-B)=cosAcosB+sinAsinB tan(A+B)=(tanA+tanB)/(1-tanAtanB) tan(A-B)=(tanA-tanB)/(1+tanAtanB) cot(A+B)=(cotAcotB-1)/(cotB+cotA) cot(A-B)=(cotAcotB+1)/(cotB-cotA) 倍角公式 tan2A=2tanA/[1-(tanA)^2] cos2a=(cosa)^2-(sina)^2=2(cosa)^2 -1=1-2(sina)^2 半角公式 sin(A/2)=√((1-cosA)/2) sin(A/2)=-√((1-cosA)/2) cos(A/2)=√((1+cosA)/2) cos(A/2)=-√((1+cosA)/2) tan(A/2)=√((1-cosA)/((1+cosA)) tan(A/2)=-√((1-cosA)/((1+cosA)) cot(A/2)=√((1+cosA)/((1-cosA)) cot(A/2)=-√((1+cosA)/((1-cosA)) 和差化积 2sinAcosB=sin(A+B)+sin(A-B) 2cosAsinB=sin(A+B)-sin(A-B) ) 2cosAcosB=cos(A+B)-sin(A-B) -2sinAsinB=cos(A+B)-cos(A-B)
重点高中化学定律公式
高中化学定律和公式 、物质的量的单位——摩尔 物质的量实际上表示含有一定数目粒子的集体。它的符号是 n 23 我们把含有 6.02 ×10 个粒子的任何粒子集体计 量为 物质的量( n )、粒子个数( N )和阿伏加德罗常数( N A )三者之间的关系 用符号表示: 1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号 M 物质的量( n )、物质的质量 (m )和摩尔质量( M )三者间的关系 : 在相同条件下 (同温、同压)物质的量相同的气体,具有相同的体积。在标准状况下 (0 ℃、101kPa )1mol 任何气体的体积都约是 22.4L 。 1. 气体摩尔体积 单位物质的量的气体所占的体积叫气体摩尔体积。符号为 V m V m V (V 为标准状况下气体的体积, n -1 3 3 -1 n 为气体的物质的量 )单位: L/mol 或(L ·mol -1)m 3/mol 或(m 3· mol -1) 定义: 以单位体积溶液里所含溶质 B 的物质的量来表示的溶液组成的物理量,叫做溶质 B 的 物质 的量浓度。用符号 C B 表示,单位 mol · L -1(或 mol/L )。C B n B 1 摩尔,摩尔简称摩,符号 mol N n= N A 3.物质的量( mol )= 摩尔物质质量 的质(g 量·m (g ol )-1)符号表示 n= m
c(浓溶液)· V(浓溶液)=c(稀溶液)·V(稀溶液) 1、原子核的构成 原子是由原子中心的原子核和核外电子组成,而核外电子是由质子和中子组成。 1 个电子带一个单位负电荷;中子不带电;1 个质子带一个单位正电荷 核电荷数(Z)== 核内质子数==核外电子数==原子序数 2、质量数 将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数质量数(A)=质子数(Z)+中子数(N)==近似原子量 m+ 3、阳离子a W :核电荷数=质子数>核外电子数,核外电子数=a-m n- 阴离子b Y :核电荷数=质子数<核外电子数,核外电子数=b+n 元素主要化合价变化规律性 二、电子式 在元素符号的周围用小黑点(或×)来表示原子最外层电子的式子叫电子式。如Na、Mg、
化学计算公式
化学计算 (一)有关化学式的计算 1.通过化学式,根据组成物质的各元素的原子量,直接计算分子量。 2.已知标准状况下气体的密度,求气体的式量:M=22.4ρ。 3.根据相对密度求式量:M=M ˊD 。??? ? ?? '=ρρD 4.混合物的平均分子量: ++?==%%)(Bb A M a M M 混合物物质的量总数 克物质的总质量 5.相对原子质量: 原子的相对原子质量=121126?原子的质量一个一个原子的质量 C A 1、A 2表示同位素相对原子质量,a 1%、a 2%表示原子的摩尔分数 ①元素近似相对原子质量: ++=%%2211a A a A A (二) 溶液计算 1、V N N MV m V n c A === 1000C M ρω= 2、稀释过程中溶质不变:C 1V 1=C 2V 2。 3、同溶质的稀溶液相互混合:C 混=2 1221V V V C CV ++ (忽略混合时溶液体积变化不计) 4、溶质的质量分数。 ①%100%100%?+=?=剂质质液质 m m m m m a ②(饱和溶液,S 代表溶质该条件下的溶解度) ③混合:m 1a 1%+m 2a 2%=(m 1+m 2)a%混%100100%?+=S S a ④稀释:m 1a 1%=m 2a 2% 5、有关pH 值的计算:酸算H +,碱算OH — Ⅰ. pH= —lg[H +] C(H +)=10-pH Ⅱ. K W =[H +][OH —]=10-14(25℃时)
图中的公式:1. A N n N = 2. m n M = 3. m V n V = 4. n n V = ×M ×NA 质 量 物质的量 微 粒 m ÷M n ÷NA N × ÷ 22.4 L/ mol 22.4 L/ mol 气体的体积 (标准状况下)
高中数学定理公式大全
抛物线:y = ax *+ bx + c 就是y等于ax 的平方加上bx再加上c a > 0时开口向上 a < 0时开口向下 c = 0时抛物线经过原点 b = 0时抛物线对称轴为y轴 还有顶点式y = a(x+h)* + k 就是y等于a乘以(x+h)的平方+k -h是顶点坐标的x k是顶点坐标的y 一般用于求最大值与最小值 抛物线标准方程:y^2=2px 它表示抛物线的焦点在x的正半轴上,焦点坐标为(p/2,0) 准线方程为x=-p/2 由于抛物线的焦点可在任意半轴,故共有标准方程y^2=2px y^2=-2px x^2=2py x^2=-2py 圆:体积=4/3(pi)(r^3) 面积=(pi)(r^2) 周长=2(pi)r 圆的标准方程(x-a)2+(y-b)2=r2 注:(a,b)是圆心坐标 圆的一般方程x2+y2+Dx+Ey+F=0 注:D2+E2-4F>0 (一)椭圆周长计算公式 椭圆周长公式:L=2πb+4(a-b) 椭圆周长定理:椭圆的周长等于该椭圆短半轴长为半径的圆周长(2πb)加上四倍的该椭圆长半轴长(a)与短半轴长(b)的差。 (二)椭圆面积计算公式 椭圆面积公式:S=πab 椭圆面积定理:椭圆的面积等于圆周率(π)乘该椭圆长半轴长(a)与短半轴长(b)的乘积。 以上椭圆周长、面积公式中虽然没有出现椭圆周率T,但这两个公式都是通过椭圆周率T 推导演变而来。常数为体,公式为用。 椭圆形物体体积计算公式椭圆的长半径*短半径*PAI*高 三角函数: 两角和公式 sin(A+B)=sinAcosB+cosAsinB sin(A-B)=sinAcosB-sinBcosA cos(A+B)=cosAcosB-sinAsinB cos(A-B)=cosAcosB+sinAsinB tan(A+B)=(tanA+tanB)/(1-tanAtanB) tan(A-B)=(tanA-tanB)/(1+tanAtanB) cot(A+B)=(cotAcotB-1)/(cotB+cotA) cot(A-B)=(cotAcotB+1)/(cotB-cotA) 倍角公式 tan2A=2tanA/(1-tan2A) cot2A=(cot2A-1)/2cota
高中化学定律公式
高中化学定律公式Revised on November 25, 2020
高中化学定律和公式 一、物质的量的单位——摩尔 物质的量实际上表示含有一定数目粒子的集体。它的符号是n 。 我们把含有×1023 个粒子的任何粒子集体计量为1摩尔,摩尔简称摩,符号mol 。 物质的量(n )、粒子个数(N )和阿伏加德罗常数(A N )三者之间的关系用符号表示:n= A N N (1)定义:单位物质的量的物质所具有的质量叫做摩尔质量。符号M 。 物质的量(n )、物质的质量(m)和摩尔质量(M )三者间的关系: 3.物质的量(mol )= 1 ()()g g mol 物质的质量摩尔质量 符号表示:n=M m 在相同条件下(同温、同压)物质的量相同的气体,具有相同的体积。在标准状况下(0 ℃、101 kPa)1 mol 任何气体的体积都约是 L 。 1.气体摩尔体积 单位物质的量的气体所占的体积叫气体摩尔体积。符号为m V m V V n = (V 为标准状况下气体的体积,n 为气体的物质的量) 单位:L/mol 或(L·mol -1 ) m 3 /mol 或(m 3 ·mol -1 ) 定义:以单位体积溶液里所含溶质B 的物质的量来表示的溶液组成的物理量,叫做溶质B 的物质的量浓度。用符号B C 表示,单位mol·L -1(或mol/L )。表达式:B B n C =
c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 1、原子核的构成 原子是由原子中心的原子核和核外电子组成,而核外电子是由质子和中子组成。 1个电子带一个单位负电荷;中子不带电;1个质子带一个单位正电荷 核电荷数(Z) == 核内质子数 == 核外电子数 == 原子序数 2、质量数 将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,叫质量数。 质量数(A)= 质子数(Z)+ 中子数(N)==近似原子量 3、阳离子a W m+:核电荷数=质子数>核外电子数,核外电子数=a-m 阴离子b Y n- :核电荷数=质子数<核外电子数,核外电子数=b+n
高中化学必背公式
●高一至高三化学方程式总结 ●碳与氧气(不足)的反应2C+O2==== 2CO ●碳与氧气(充足)的反应C+O2==== CO2 ● 2.一氧化碳与氧气的反应2CO+O2==== 2CO2 ● 3.二氧化碳与碳的反应CO2+C==== 2CO ● 4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑ ● 5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑ ● 6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑ ●7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O ●8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH ●9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O ●碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓ +Na2CO3+2H2O ●10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑ ●11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑ ●12.碳酸钙加热的反应CaCO3==== CaO+CO2↑ ●13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2 ●二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O ●14.氮气与氧气的反应N2+O2==== 2NO ●15.一氧化氮与氧气的反应2NO+O2==== 2NO2 ●16.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO ●17.氮气与氢气的反应N2+3H2========= 2NH3 ●18.氨气与水的反应NH3+H2O==== NH3?H2O ●19.氨气与盐酸的反应NH3+HCl==== NH4Cl ●20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO4 ●21.氨气与强酸的离子的反应NH3+H+==== NH4+ ●22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O ●23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O ●24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑ ●25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O ●26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O ●27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O ●28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O ●29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O ●30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O ●31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O ●32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O ●33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O ●34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O ●35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O ●36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO2 ●37.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO3 ●38.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO3 ●39.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O
高中化学公式大全
高中化学常用公式总结 1. 有关物质的量(mol )的计算公式 (1)物质的量(mol )()= 物质的质量物质的摩尔质量() g g mol / (2)物质的量(mol )() = ?微粒数(个) 个6021023 ./mol (3)气体物质的量(mol )= 标准状况下气体的体积() .(/) L L mol 224 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L ) 2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL )= 溶液质量溶液体积()() g mL ②溶质的质量分数()= ?+溶质质量溶质质量溶剂质量(g g ) () 100% ③物质的量浓度(mol/L )= 溶质物质的量溶液体积() () mol L (2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数= ????物质的量浓度溶质的摩尔质量溶液密度(mol /L)1(L)(g /mol) 1000(mL)(g /mL) 100% ②物质的量浓度= ???1000(mL)(g /mL)(g /mol)1(L) 溶液密度溶质的质量分数 溶质摩尔质量 (3)溶液的稀释与浓缩(各种物理量的单位必须一致): ①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变) ②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c (浓)·V (浓)=c (稀)·V (稀)] (4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性) 3. 有关溶解度的计算公式(溶质为不含结晶水的固体) (1)基本公式: ① 溶解度饱和溶液中溶质的质量溶剂质量(g)100(g) (g) (g) =
高中化学常用计算公式
1. 有关物质的量(mol )的计算公式 (1)物质的量(mol 即n= M m ;M 数值上等于该物质的相对分子(或原子)质量 (2)物质的量(mol )= )(个微粒数(个)mol /1002.623 ? 即n=A N N N A 为常数6.02×1023,应谨记 (3)气体物质的量(mol 即n= m g V V 标, V m 为常数22.4L ·mol -1,应谨记 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )即n B =C B V aq (5)物质的量(mol )=)反应热的绝对值()量(反应中放出或吸收的热mol KJ KJ / 即n=H Q ? 2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL 即ρ = aq V m 液 ②溶质的质量分数=%100) g g ?+溶剂质量)((溶质质量)溶质质量(=) ) g g 溶液质量(溶质质量(×100% 即w= 100%?液质m m =剂质质m m m +×100% ③物质的量浓度(mol/L 即C B=aq B V n (2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数100%(g/mL) 1000(mL)(g/mol) 1(L)(mol/L)????= 溶液密度溶质的摩尔质量物质的量浓度 即C B = B M ρω 1000 ρ单位:g/ml (3)溶液的稀释与浓缩(各种物理量的单位必须一致): 原则:稀释或浓缩前后溶质的质量或物质的量不变! ①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数 即浓m 稀稀浓ωωm =
(完整)高中化学常用公式总结,推荐文档.docx
高中化学常用公式总结1.有关物质的量( mol )的计算公式 物质的质量g ( 1)物质的量( mol ) 物质的摩尔质量(g / mol) ( 2)物质的量( mol ) 微粒数(个) 6 021023 个 / mol . 标准状况下气体的体积( L ) ( 3)气体物质的量(mol ) 22.4( L / mol ) ( 4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L ) 2.有关溶液的计算公式 (1)基本公式 溶液质量 ( g) ①溶液密度(g/mL ) 溶液体积 (mL) 溶质质量 (g) ②溶质的质量分数100% 溶质质量溶剂质量 ( g) 溶质物质的量 ( mol ) ③物质的量浓度(mol/L ) 溶液体积 ( L) ( 2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: 物质的量浓度(mol / L) 1(L)溶质的摩尔质量(g / mol) ①溶质的质量分数100% 1000(mL) 溶液密度 (g / mL) 1000(mL) 溶液密度 (g / mL)溶质的质量分数 ②物质的量浓度 溶质摩尔质量(g / mol) 1(L) (3)溶液的稀释与浓缩(各种物理量的单位必须一致):①浓溶液的质量×浓溶液溶质的质量分 数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不 变) ②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c(浓)· V (浓) =c(稀)·V (稀)] (4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性) 3.有关溶解度的计算公式(溶质为不含结晶水的固体) (1)基本公式: 溶解度 (g)饱和溶液中溶质的质量 (g) ① 溶剂质量 (g) 100(g) 溶解度 (g)饱和溶液中溶质的质量 (g) ② 饱和溶液的质量 (g) 100(g) 溶解度 (g) ( 2)相同温度下,溶解度( S)与饱和溶液中溶质的质量分数(w% )的关系:
(完整word)高中化学常用计算公式
1. 有关物质的量(mol )的计算公式 (1)物质的量(mol )()= 物质的质量物质的摩尔质量() g g mol / 即n= M m ;M 数值上等于该物质的相对分子(或原子)质量 (2)物质的量(mol )= )(个微粒数(个)mol /1002.623 ? 即n=A N N N A 为常数6.02×1023,应谨记 (3)气体物质的量(mol )= 标准状况下气体的体积() .(/) L L mol 224 即n= m g V V 标, V m 为常数22.4L ·mol -1,应谨记 (4)溶质的物质的量(mol )=物质的量浓度(mol/L )×溶液体积(L )即n B =C B V aq (5)物质的量(mol )=)反应热的绝对值()量(反应中放出或吸收的热mol KJ KJ / 即n=H Q ? 2. 有关溶液的计算公式 (1)基本公式 ①溶液密度(g/mL )= 溶液质量溶液体积()() g mL 即ρ = aq V m 液 ②溶质的质量分数=%100) g g ?+溶剂质量)((溶质质量)溶质质量(=) ) g g 溶液质量(溶质质量(×100% 即w= 100%?液质m m =剂质质m m m +×100% ③物质的量浓度(mol/L )=溶质物质的量溶液体积()()mol L 即C B=aq B V n (2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系: ①溶质的质量分数100%(g/mL) 1000(mL)(g/mol) 1(L)(mol/L)????= 溶液密度溶质的摩尔质量物质的量浓度 ②物质的量浓度=???1000(mL)(g /mL)(g /mol)1(L) 溶液密度溶质的质量分数 溶质摩尔质量 即C B = B M ρω 1000 ρ单位:g/ml (3)溶液的稀释与浓缩(各种物理量的单位必须一致): 原则:稀释或浓缩前后溶质的质量或物质的量不变! ①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数 即浓m 稀稀浓ωωm =
高中数学公式定理定律大全
高中数学公式大全 (最全面,最详细) 高中数学公式大全 抛物线: y = ax *+ bx + c 就是 y 等于 ax 的平方加上 bx 再加上 c a > 0 时开口向上 a < 0 时开口向下 c = 0 时抛物线经过原点 b = 0 时抛物线对称轴为 y 轴 还有顶点式 y = a ( x+h) * + k 就是 y 等于 a 乘以( x+h)的平方 +k -h 是顶点坐标的 x k 是顶点坐标的 y 一般用于求最大值与最小值抛物线标准方程 :y^2=2px 它表示抛物线的焦点在 x 的正半轴上 , 焦点坐标为 (p/2,0) 方程为 x=-p/2 由于抛物线的焦点可在任意半轴 , 故共有标准方程 准线y^2=2px y^2=-2px x^2=2py x^2=-2py 圆:体积 =4/3(pi )(r^3) 面积=(pi)(r^2) 周长=2(pi)r
圆的标准方程 (x-a)2+(y-b)2=r2 注:(a,b )是圆心坐标圆的一般方程 x2+y2+Dx+Ey+F=0 注: D2+E2-4F>0 (一)椭圆周长计算公式 椭圆周长公式: L=2πb+4(a -b) 椭圆周长定理:椭圆的周长等于该椭圆短半轴长为半径的圆周长 (2πb)加上四倍的该椭圆长半轴长( a)与短半轴长( b)的差。 (二)椭圆面积计算公式 椭圆面积公式: S=πab 椭圆面积定理:椭圆的面积等于圆周率(π)乘该椭圆长半轴长 ( a)与短半轴长( b)的乘积。 以上椭圆周长、面积公式中虽然没有出现椭圆周率 T,但这两个 公式都是通过椭圆周率 T 推导演变而来。常数为体,公式为用。 椭圆形物体体积计算公式椭圆的长半径*短半径*PAI* 高 三角函数: 两角和公式 sin(A+B)=sinAcosB+cosAsinB sin(A-B)=sinAcosB-sinBcosA cos(A+B)=cosAcosB-sinAsinB cos(A-
高中化学必修一知识点及公式总结
高中化学必修一知识点总结 必修1全册基本内容梳理 从实验学化学 一、化学实验安全 1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。 (2)烫伤宜找医生处理。 (3)浓酸撒在实验台上,先用Na2CO3 (或NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀NaHCO3溶液淋洗,然后请医生处理。(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。 (5)钠、磷等失火宜用沙土扑盖。 (6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。二.混合物的分离和提纯 分离和提纯的方法分离的物质应注意的事项应用举例 过滤用于固液混合的分离一贴、二低、三靠如粗盐的提纯 蒸馏提纯或分离沸点不同的液体混合物防止液体暴沸,温度计水银球的位置,如石油的蒸馏中冷凝管中水的流向如石油的蒸馏
萃取利用溶质在互不相溶的溶剂里的溶解度不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来的方法选择的萃取剂应符合下列要求:和原溶液中的溶剂互不相溶;对溶质的溶解度要远大于原溶剂用四氯化碳萃取溴水里的溴、碘 分液分离互不相溶的液体打开上端活塞或使活塞上的凹槽与漏斗 上的水孔,使漏斗内外空气相通。打开活塞,使下层液体慢慢流出,及时关闭活塞,上层液体由上端倒出如用四氯化碳萃取溴水里的溴、碘后再分液 蒸发和结晶用来分离和提纯几种可溶性固体的混合物加热蒸发皿 使溶液蒸发时,要用玻璃棒不断搅动溶液;当蒸发皿中出现较多的固体时,即停止加热分离NaCl和KNO3混合物 三、离子检验 离子所加试剂现象离子方程式 Cl-AgNO3、稀HNO3 产生白色沉淀Cl-+Ag+=AgCl↓ SO42- 稀HCl、BaCl2 白色沉淀SO42-+Ba2+=BaSO4↓ 四.除杂 注意事项:为了使杂质除尽,加入的试剂不能是―适量‖,而应是―过量‖;但过量的试剂必须在后续操作中便于除去。 五、物质的量的单位――摩尔 1.物质的量(n)是表示含有一定数目粒子的集体的物理量。 2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
常用计算公式
常用计算公式: (1)相对原子质量 (2)设某化合物化学式为 ①它的相对分子质量=A的相对原子质量×m+B的相对原子质量×n ②A元素与B元素的质量比=A的相对原子质量×m:B的相对原子质量×n ③A元素的质量分数 (3)混合物中含某物质的质量分数(纯度) (4)标准状况下气体密度(g/L) (5)纯度 (6)溶质的质量分数
(7)溶液的稀释与浓缩 (8)相对溶质不同质量分数的两种溶液混合 (9)溶液中溶质的质量 =溶液的质量×溶液中溶质的质量分数 =溶液的体积×溶液的密度 二. 化学方程式: (1)镁带在空气中燃烧 (2)碱式碳酸铜受热分解 (3)磷在空气中燃烧 (4)木炭在氧气中充分燃烧 (5)硫在氧气中燃烧
(6)铁在氧气中燃烧 (7)氯酸钾与二氧化锰共热 (8)高锰酸钾受热分解 (9)氧化汞受热分解 (10)电解水 (11)锌与稀硫酸反应 (12)镁与稀硫酸反应 (13)铁与稀硫酸反应 (14)锌与盐酸反应
(15)镁与盐酸反应 (16)铁与盐酸反应 (17)氢气在空气中燃烧 (18)氢气还原氧化铜 (19)木炭在空气不足时不充分燃烧 (20)木炭还原氧化铜 (21)木炭与二氧化碳反应 (22)二氧化碳与水反应 (23)二氧化碳与石灰水反应
(24)碳酸分解的反应 (25)煅烧石灰石的反应 (26)实验室制取二氧化碳的反应 (27)泡沫灭火器的原理 (28)一氧化碳在空气中燃烧 (29)一氧化碳还原氧化铜 (30)一氧化碳还原氧化铁 (31)甲烷在空气中燃烧 (32)乙醇在空气中燃烧
(33)甲醇在空气中燃烧 (34)铁与硫酸铜反应 (35)氧化铁与盐酸反应 (36)氢氧化铜与盐酸反应 (37)硝酸银与盐酸反应 (38)氧化铁与硫酸反应 (39)氢氧化铜与硫酸反应 (40)氯化钡与硫酸反应 (41)氧化锌与硝酸反应
高中数学课本中的定理公式结论的证明
数学课本中的定理、公式、结论的证明 数学必修一 第一章 集合(无) 第二章 函数(无) 第三章 指数函数和对数函数 1.对数的运算性质: 如果 a > 0 , a 1, M > 0 ,N > 0, 那么 (1)log ()log log a a a MN M N =+; (2)log log -log a a a M M N N =; (3)log log ()n a a M n M n R =∈. 根据指数幂的运算性质证明对数的运算性质 证明:(性质1)设log a M p =,log a N q =,由对数的定义可得 p M a =,q N a =, ∴p q p q MN a a a +=?=, ∴log ()a MN =p q +, 即证得log log log a a a MN M N =+. 证明:(性质2)设log a M p =,log a N q =, 由对数的定义可得 p M a =,q N a =, ∴ q p q p a a a N M -==, ∴q p N M a -=log , 即证得log log -log a a a M M N N =. 证明(性质3)设log a M p =,由对数的定义可得 p M a =, ∴n np M a =, ∴log n a M np =, 即证得log log n a a M n M =.
第四章函数应用(无) 数学必修二 第一章立体几何初步 直线与平面、平面与平面平行、垂直的判定定理与性质定理的证明. 1、直线与平面平行的判定定理 若平面外一条直线与此平面内一条直线平行,则该直线与此平面平行. 2、平面与平面平行的判定定理 如果一个平面内有两条相交直线都平行于另一个平面,那么这两个平面平行.
