新人教版新教材高中化学必修第一册第二章第一节《钠及其化合物》教学设计(教案)

第二章第一节钠及其化合物
第1课时活泼的金属单质——钠
【学习目标】
1.通过实验探究,掌握钠的物理性质和化学性质,正确书写有关的化学方程式及离子方程式并能用氧化还原反应的知识进行分析,认识钠是一种活泼的金属。
2.通过对钠的有关性质实验的观察、分析、讨论,慢慢学会如何较为全面地观察和分析实验现象,并用规范的语言描述实验现象。
3.通过化学实验激发学习化学的兴趣,并感受到实验是认识物质性质的重要方法。
【学习重点】从钠的原子结构特征和性质实验认识钠的化学性质
【学习难点】对实验现象的观察和分析
【学法指导】
1.利用学习元素化合物的知识体系:结构决定性质,性质决定用途等
2.具体通过化学实验现象去认识钠的物理和化学性质,同时理解性的记住化学方程式,并用前一章的氧化还原反应知识分析化学方程式得出钠的强还原性,学习中还要注意规范学生的化学用语、文字表述等。
【学习过程】
五千年前人类进入青铜时代,三千年前进入铁器时代,20世纪铝合金成为仅次于铁的金属材料。金属在人类社会发展,改善人类生活方面起重要作用。人类已经发现的一百多种元素中,大约4/5是金属元素。多数金属的化学性质比较活泼,因此,地球上绝大多数金属的元素是以化合态形式存在。地壳中含量最多的金属元素是Al,最多的非金属元素是O。不同的金属的化学活动性相差很大。今天我们要学习的是活泼的金属单质——钠。
一、钠的原子结构及存在
实验步骤实验现象实验结论
(1)用镊子夹取存放在煤油中较大块的金属钠,用滤纸吸干表面的煤油,放在玻璃片上,观察钠的表面。钠很软,刚切开时,
其断面呈银白色,切
口处在空气中很快变
钠是一种硬度小、熔点
低的银白色的金属,具
有金属光泽,常温下极
(2)用小刀从中间切开,观察钠的颜色、
光泽,感受钠的硬度。
(3)观察完毕,将钠块全部放回原试剂
.....
瓶中。
...
暗易被氧化
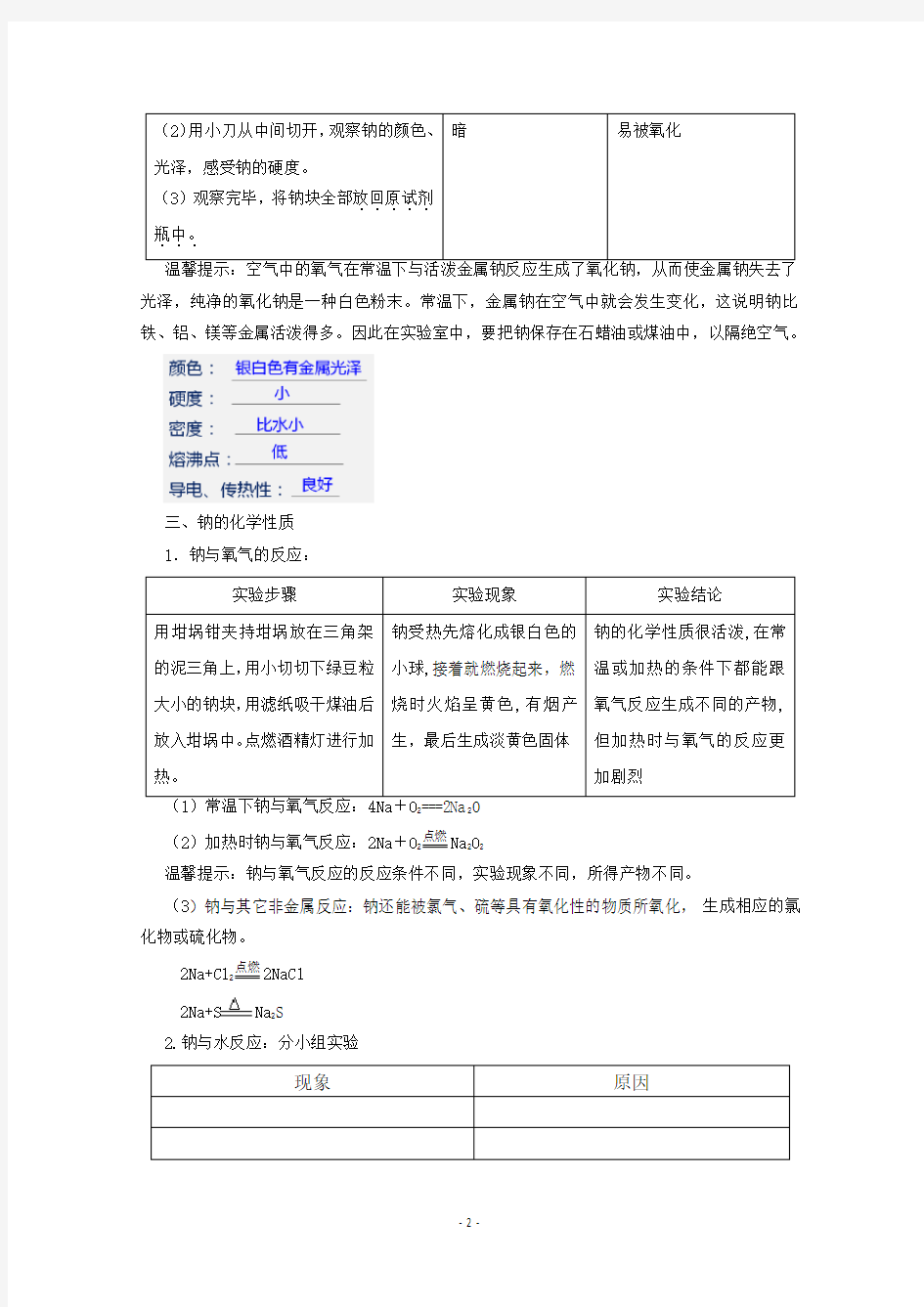
温馨提示:空气中的氧气在常温下与活泼金属钠反应生成了氧化钠,从而使金属钠失去了光泽,纯净的氧化钠是一种白色粉末。常温下,金属钠在空气中就会发生变化,这说明钠比铁、铝、镁等金属活泼得多。因此在实验室中,要把钠保存在石蜡油或煤油中,以隔绝空气。
三、钠的化学性质
1.钠与氧气的反应:
实验步骤实验现象实验结论
用坩埚钳夹持坩埚放在三角架
的泥三角上,用小切切下绿豆粒
大小的钠块,用滤纸吸干煤油后
放入坩埚中。点燃酒精灯进行加
热。
钠受热先熔化成银白色的
小球,接着就燃烧起来,燃
烧时火焰呈黄色,有烟产
生,最后生成淡黄色固体
钠的化学性质很活泼,在常
温或加热的条件下都能跟
氧气反应生成不同的产物,
但加热时与氧气的反应更
加剧烈
22
(2)加热时钠与氧气反应:2Na+O2点燃Na2O2
温馨提示:钠与氧气反应的反应条件不同,实验现象不同,所得产物不同。
(3)钠与其它非金属反应:钠还能被氯气、硫等具有氧化性的物质所氧化,生成相应的氯化物或硫化物。
2Na+Cl2点燃2NaCl
2Na+S Na2S
2.钠与水反应:分小组实验
现象原因
近;④剩余的钠放入原试剂瓶。
写出该反应的化学方程式并写出离子方程式,标电子转移,指出该反应中还原剂、还原产物:
总结:钠的性质简单记忆法
银白轻低软,传导热和电;
遇氧产物变,遇氯生白烟;
浮熔游响红,遇水记五点;
遇酸酸优先,遇盐水在前。
【练习与反馈】1-4题(见PPT)
【作业布置】
1.完成实验探究报告单。
2.思维作业:画出你心中的《金属钠的性质》思维导图或写一篇关于钠的诗歌、散文、随笔。
3.完成《课时作业7》。
第二章第一节钠及其化合物
第2课时
课题钠及化合物(第2课时)单元 2 学科化学年级
学习
目标
知识与技能
1.掌握氧化钠、过氧化钠的特点。
2.掌握碳酸钠、碳酸氢钠的特点。
3.了解碳酸钠、碳酸氢钠的用途。
过程与方法
引导学生自主学习,引导学生学习钠的化合物,掌握钠的化合物的相关特点,了解碳酸钠、碳酸氢钠的用途。
情感、态度与价值观
1.培养学生严谨求实、勇于探索的化学态度.
2.对知识进行分类的方法是简单易行的科学方法.
重点 1.掌握氧化钠、过氧化钠的特点。
2.掌握碳酸钠、碳酸氢钠的特点。
难点掌握氧化钠、过氧化钠、碳酸钠、碳酸氢钠的特点。
教学过程
教学环节教师活动学生活动设计意图
导入新课教师:上节课我们一起学习了单质钠的相关性质和
用途。钠是其中含量较高的元素,也是典型的金属
元素。可以和氧气、水、酸、盐反应,生成相应的
化合物。
教师提问:那么钠的化合物有哪些?它们又有哪些
性质呢?
教师:回忆前面做过的实验,把钠放在氧气中,会
产生氧化钠:
4Na + O2——2Na2O
加热钠,会产生过氧化钠:
2Na + O2——Na2O2
教师提问:氧化钠和过氧化钠的颜色和状态各有什
么特点?
教师:引出本节课学习内容
老师引导学生
思考。
在老师的带领
下,回顾上节
课的内容,并
引出这节课的
问题。
图文并茂,能够
较快地让学生进
入本节课堂学
习。
简单的思维训练
能够让学生不害
怕对本节课知识
点学习,感悟本
节课的知识点。
讲授新课教师利用多媒体设备向学生投影出下面
【新课讲解】氧化钠是白色的固体,过氧化钠是淡黄色固体。(展示图片)
【思考讨论】教师:氧化钠与水反应和氧化钙与水反应类似,你能写出氧化钠与水反应的化学方程式吗?
回答:氧化钙和水反应:CaO + H2O ——Ca(OH)2 氧化钠和水反应:Na2O + H2O ——2NaOH
总结:由此可知:氧化钠和水反应会产生氢氧化钠!【思考讨论】教师:氧化钠和过氧化钠都属于氧化物。氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成什么物质呢?(展示图片)
【思考讨论】教师:将1~2mL水滴入盛有1~2g 过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。(边讲解边演示该操作)
回答:带火星的木条熄灭了,说明有二氧化碳气体产生。
【思考讨论】教师:用手轻轻触摸试管外壁,有什么感觉?用pH试纸检验溶液的酸碱性。(边讲解边演示该操作)。和老师一起观
察图片。
老师和同学一
起讨论,思考
问题。
观察实验现
象。
观察实验现
象。
通过观察,加深
同学们的印象。
通过讨论,帮助
同学对知识点的
掌握。
通过老师口述和
实验展示,帮助
同学们掌握知识
点,并加深对知
识点的印象。
通过老师口述和
实验展示,帮助
同学们掌握知识
点,并加深对知
识点的印象。
回答:感觉到外壁发烫,说明反应放热了,pH测出
的酸碱性呈碱性,说明有碱性物质产生。
【思考讨论】根据实验现象和提示,写出反应式。
过氧化钠与水反应生成氢氧化钠和氧气:
2Na2O2 + 2H2O ——4NaOH + O2↑
过氧化钠与二氧化碳反应生成碳酸钠和氧气:
2Na2O2 + 2CO2——2Na2CO3 + O2
总结:因此,过氧化钠可在呼吸面具或潜水艇中作
为氧气的来源。
【新课讲解】氧化钠和过氧化钠:
【思考讨论】教师:的化合物除了氧化钠和过氧化
钠,还有碳酸钠和碳酸氢钠。他们分别有什么性质
呢?(展示图片)
【思考讨论】教师:在两支试管中分别加入少量
Na2CO3和NaHCO3(各约1g)。观察Na2CO3和NaHCO3
的外观并进行描述。(边讲解边演示该操作)。
总结:Na2CO3是白色粉末,NaHCO3是白色细小晶
体。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
老师和同学一
起讨论,思考
问题。
观察实验现
象。
加深对知识点的
印象。
通过讨论,帮助
同学对知识点的
掌握。
通过老师口述和
实验展示,帮助
【思考讨论】教师:向两支试管中分别滴入几滴水,
震荡,观察现象,将温度计分别插入其中,温度计
示数有何变化?(边讲解边演示该操作)。
总结:Na2CO3碳酸钠结块变成晶体,并且温度计示
数升高;NaHCO3能溶解,并且温度计示数降低。
说明Na2CO3与水发生了放热反应。说明Na2CO3与
水发生了吸热反应。
【思考讨论】教师:继续向两支试管加入5mL水,
用力振荡,有何现象?再分别加入1~2滴酚酞溶
液,有何现象?(边讲解边演示该操作)。
总结:Na2CO3和NaHCO3都溶解了,滴入酚酞后溶
液变红。这说明Na2CO3溶液和NaHCO3溶液呈碱性。
【新课讲解】由上述现象得出结论:碳酸钠是白色
粉末,碳酸氢钠是细小的白色晶体。实验表明,向
碳酸钠中加入少量水后,碳酸钠结块变成晶体,并
伴随着放热现象。向碳酸氢钠中加入少量水后,碳
酸氢钠能溶解,并伴随吸热现象。碳酸钠和碳酸氢
钠的溶液均显碱性,可用作食用碱或工业用碱。
碳酸钠粉末遇水生成含有结晶水的碳酸钠晶
体——水合碳酸钠(Na2CO3.xH2O)。碳酸钠晶体在干
燥空气里逐渐失去结晶水变成碳酸钠粉末。
【思考讨论】教师:分别加热Na2CO3和NaHCO3,
观察现象,比较Na2CO3和NaHCO3的热稳定性。(边
讲解边演示该操作)
同学们观看图
片和文字描
述。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
观察实验现
象。
同学们掌握知识
点,并加深对知
识点的印象。
通过老师口述和
实验展示,帮助
同学们掌握知识
点,并加深对知
识点的印象。
加深对知识点的
印象。
通过老师口述和
实验展示,帮助
同学们掌握知识
点,并加深对知
识点的印象。
总结:Na2CO3很稳定,受热不易发生分解和NaHCO3不稳定,受热容易分解。
【新课讲解】碳酸钠和碳酸氢钠:
【新课讲解】碳酸钠的用途
【新课讲解】碳酸氢钠的用途
【思维启迪】侯德榜和侯氏制碱法
【课堂达标】
1、关于氧化钠和过氧化钠的叙述正确的是()。
A.都是白色的固体
B.都是碱性氧化物
C.都能和水反应形成强碱溶液
D.都是强氧化剂记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
学生自行思
考,完成课堂
练习。
加深对知识点的
印象。
加深对知识点的
印象。
通过对习题的解
答,加深对知识
点的巩固。
第二章第一节钠及其化合物
第3课时
第3课时
课题钠及化合物(第3课时)单元 2 学科化学年级
学习目标知识与技能
4.学习焰色反应的相关概念。
5.学习通过焰色反应检验不同离子的方法。
6.了解一些金属的焰色反应。
过程与方法
引导学生自主学习,引导学生学习焰色反应的相关概念,学习通过焰色反应检验不同离子的方法,了解一些金属的焰色反应。
课堂小结钠的化合物包括:氧化钠、过氧化钠、碳酸钠、碳酸氢钠等。
氧化钠:白色固体,碱性氧化物,在常温下与氧气
反应得到,可以与水和二氧化碳反应。
过氧化钠:淡黄色固体,过氧化物,燃烧或加热时
与氧气反应得到,可以与水和二氧化碳反应。
碳酸钠:又名:纯碱、苏打,白色粉末,稳定性强,
受热不易分解,可以与酸反应,常用于纺织、制皂、
造纸、制玻璃。
碳酸氢钠:又名:小苏打,细小的白色晶体,稳定
性差,受热易分解,可以与酸反应,常用于制药和
烘焙蛋糕。学生和老师一
起快速回顾本
次课的学习内
容。
通过对课堂学习
知识的总结,帮
助同学们加深印
象。
板书学生在笔记本
上对板书进行
誊写。方便学生课后回顾。
情感、态度与价值观
3.培养学生严谨求实、勇于探索的化学态度.
4.对知识进行分类的方法是简单易行的科学方法.
重点 3.学习焰色反应的相关概念。
4.学习通过焰色反应检验不同离子的方法。
难点学习焰色反应的相关概念,学习通过焰色反应检验不同离子的方法,了解一些金属的焰色反应。
教学过程
教学环节教师活动学生活动设计意图
导入新课教师:还记得上次课里,我们做实验将金属钠进行燃烧时,观察到的火焰的颜色吗?(展示图片)
回答:金属钠燃烧的火焰是黄色的。
教师提问:所有金属燃烧的颜色都是黄色吗?
回答:大多数金属或他们的化合物在灼烧时都会使
火焰呈现出特有的特征颜色。这些颜色各有不同。
教师:引出本节课学习内容在老师的带领
下,回顾上节
课的内容。
在老师的带领
下思考问题并
引出这节课的
问题。
回顾已学习的内
容,能够较快地
让学生进入本节
课堂学习。
简单的思维训练
能够让学生不害
怕对本节课知识
点学习,感悟本
节课的知识点。
讲授新课教师利用多媒体设备向学生投影出下面
【新课讲解】观察铂丝燃烧的颜色
教师:第一步:把焊在玻璃棒上的铂丝放在酒精灯外焰(最好用煤气灯)上灼烧,至与原来的火焰颜色相同时为止。
第二步:将铂丝用盐酸洗净后,在外焰上灼烧至与原来的火焰颜色相同时,再蘸取碳酸钾溶液做仔细观察老师
的演示。
通过观察,加深
同学们的印象。
相同的实验,此时要透过蓝色钴玻璃观察火焰的颜色。
(展示图片并现场演示过程)
【思考讨论】教师:①为什么在酒精灯外焰上灼烧?
回答:因为外焰温度高。
总结:酒精灯的火焰分为外焰、内焰、焰心三层,其中外焰温度最高,焰心的温度低。(展示图片)
【思考讨论】教师:②为什么最好使用煤油灯?回答:因为煤气灯的火焰颜色浅、温度高。
总结:煤油灯为电灯普及之前的主要照明工具,以煤油作为燃料。多为玻璃质材,外形如细腰大肚的葫芦,上面是个形如张嘴蛤蟆的灯头,灯头一侧有个可把灯芯调进调出的旋钮,以控制灯的亮度。(展示图片)
【思考讨论】教师:③为什么要透过蓝色钴玻璃观察火焰的颜色?
回答:为了防止酒精灯火焰的颜色影响观察。老师和同学一
起讨论,思考
问题。
老师和同学一
起讨论,思考
问题。
老师和同学一
起讨论,思考
问题。
通过讨论,帮助
同学对知识点的
掌握。
通过讨论,帮助
同学对知识点的
掌握。
通过讨论,帮助
同学对知识点的
掌握。
总结:蓝色钴玻璃是一种特殊的观火玻璃,主要用
于化学实验室钾的焰色反应观火。(展示图片)
【思考讨论】教师:④第一步为什么灼烧至与原
来的火焰颜色相同时为止?
回答:与原火焰颜色相同是为了更好地观察钠盐的
颜色,防止铂丝上残留的其他物质对实验的干扰。
【思考讨论】教师:⑤第二步为什么把铂丝在外
焰上灼烧至没有颜色时?
回答:铂丝在用过以后,上面会残留一些遗留的物
质,如果不灼烧至无色,会影响被检测物质的焰色,因
此要灼烧至无色。
【新课讲解】观察铂丝燃烧的颜色:
①洗:用盐酸洗去铂丝表面的杂质
②烧:将铂丝在酒精灯火焰上灼烧至与酒精灯颜
色一致
③蘸:蘸取试样
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
【新课讲解】教师:根据火焰呈现的特征颜色,可
以判试样所含的金属元素,化学上把这样的定性分
析操作称为焰色试验。(展示图片)
【思维启迪】一些金属的焰色:
【思考讨论】教师:焰色反应使金属发出不同颜色
老师和同学一
起讨论,思考
问题。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
老师和同学一
起讨论,思考
问题。
通过讨论,帮助
同学对知识点的
掌握。
加深对知识点的
印象。方便课后
回顾。
通过讨论,帮助
同学对知识点的
掌握。
的光,那么焰色反应是化学反应还是物理反应,燃烧过程有新物质产生吗?
回答:焰色反应是物理变化。它并未生成新物质,
焰色反应是物质原子内部电子能级的改变,通俗的说是原子中的电子能量的变化,不涉及物质结构和化学性质的改变。
【新课讲解】教师:节日燃放的五彩缤纷的烟花,就是锂、钠、钾、锶、钡等金属化合物所呈现的各种艳丽色彩。(展示图片)。
【思维启迪】焰色反应检验钠离子
方法一(镊子-棉花-酒精法):用镊子取一小团棉花(脱脂棉)吸少许酒精(95%乙醇),把棉花上的酒精挤干,用该棉花沾一些氯化钠或无水碳酸钠粉末(研细),点燃。
方法二(铁丝法):①取一条细铁丝,一端用砂纸擦净,再在酒精灯外焰上灼烧至无黄色火焰,②用该端铁丝沾一下水,再沾一些氯化钠或无水碳酸钠粉末,③点燃一盏新的酒精灯(灯头灯芯干净、酒精纯),④把沾有钠盐粉末的铁丝放在外焰尖上灼烧,这时外焰尖上有一个小的黄色火焰,那就是钠焰。
【思维启迪】焰色反应检验钾离子
方法一(烧杯-酒精法):取一小药匙无水碳酸钾粉末(充分研细)放在一倒置的小烧杯上,滴加5~6滴酒精,点燃,可看到明显的浅紫色火焰,如果隔一钴玻璃片观察,则更明显看到紫色火焰。
方法二(蒸发皿-酒精法):取一药匙无水碳酸钾粉末放在一个蒸发皿内,加入1毫升酒精,点同学们观看图
片和文字描
述。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
记录笔记,在
书中相应部位
进行誊写,养
成良好的学习
习惯。
加深对知识点的
印象。
加深对知识点的
印象。方便课后
回顾。
加深对知识点的
印象。方便课后
回顾。
④烧:在火焰上灼烧
⑤观:观察火焰颜色(若检验钾要透过钴玻璃观察)
焰色试验的概念:根据火焰呈现的特征颜色,可以判试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
焰色试验的用途:可以利用焰色试验辨别不同的离子。
一些金属的焰色反应:钠-黄色;钾-紫色;铷-紫色;锶-洋红色;钡-黄绿色;钙-砖红色;铜-绿色。
利用焰色反应可以制作五彩斑斓的烟花。
板书学生在笔记本
上对板书进行
誊写。方便学生课后回顾。
