高中化学实验题专项训练

实验题专项训练
1.对下列实验事实的解释不正确
...的是( )
现象解释或结论
A SO2使酸性高锰酸钾溶液褪色SO2表现漂白性
B 浓硝酸在光照条件下变黄浓硝酸不稳定,生成有色物质且能溶于浓硝酸
C向饱和Na2CO3中通入足量CO2,溶液变浑浊析出了NaHCO3
D 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加
几滴淀粉溶液,溶液变蓝色。
Fe3+的氧化性比I2的强
2.下列根据实验操作和现象所得出的结论正确的是( )
选项实验操作实验现象结论
A将气体X通入品红溶液中红色褪去X一定是SO2
B向无色溶液中加硝酸酸化的BaCl2溶液有白色沉淀原溶液中一定含SO
C向Na2SiO3溶液中通入适量CO2气体出现白色沉淀H2CO3的酸性比H2SiO3强
D 向某溶液中先加氯水再加KSCN溶液溶液呈血红色原溶液中一定含Fe2+3.利用下列装置和操作不能达到实验目的的是( )
A.从含碘CCl4溶液中提取碘和回收CCl4溶剂
B.萃取操作过程
中的放气
C.定量测定化学
反应速率
D.比较KMnO4、Cl2、
S的氧化性
5.分液漏斗中液体为甲、锥形瓶内物质为乙、试剂瓶中液体为丙,利用烧杯内液体吸收尾气。用图中装置进行实验,其实验目的或现象都正确的是
6.下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是:
选项操作现象解释或结论
A 测定等浓度的Na2CO3和Na2SO3溶液的pH Na2CO3溶液的pH较
大
非金属性C<S
B 向盛有2ml 0.1mol/L AgNO3溶液的试管
中滴加一定量0.1mol/L NaCl溶液,再向其
中滴加一定量0.1mol/L KI溶液
先有白色沉淀生成,后
又产生黄色沉淀
Ksp(AgCl)>
Ksp(AgI)
C 室温下,取相同大小、形状和质量的Cu粒分别
投入0.1mol/L的稀硝酸和10.0mol/L的浓
硝酸中
Cu粒与浓硝酸反应比
与稀硝酸反应剧烈
探究浓度对化学
反应速率的影响
D 用石墨做电极电解Mg(NO3)2、Cu(NO3)2的混合
溶液
阴极上先析出铜金属活动性:M
g>Cu
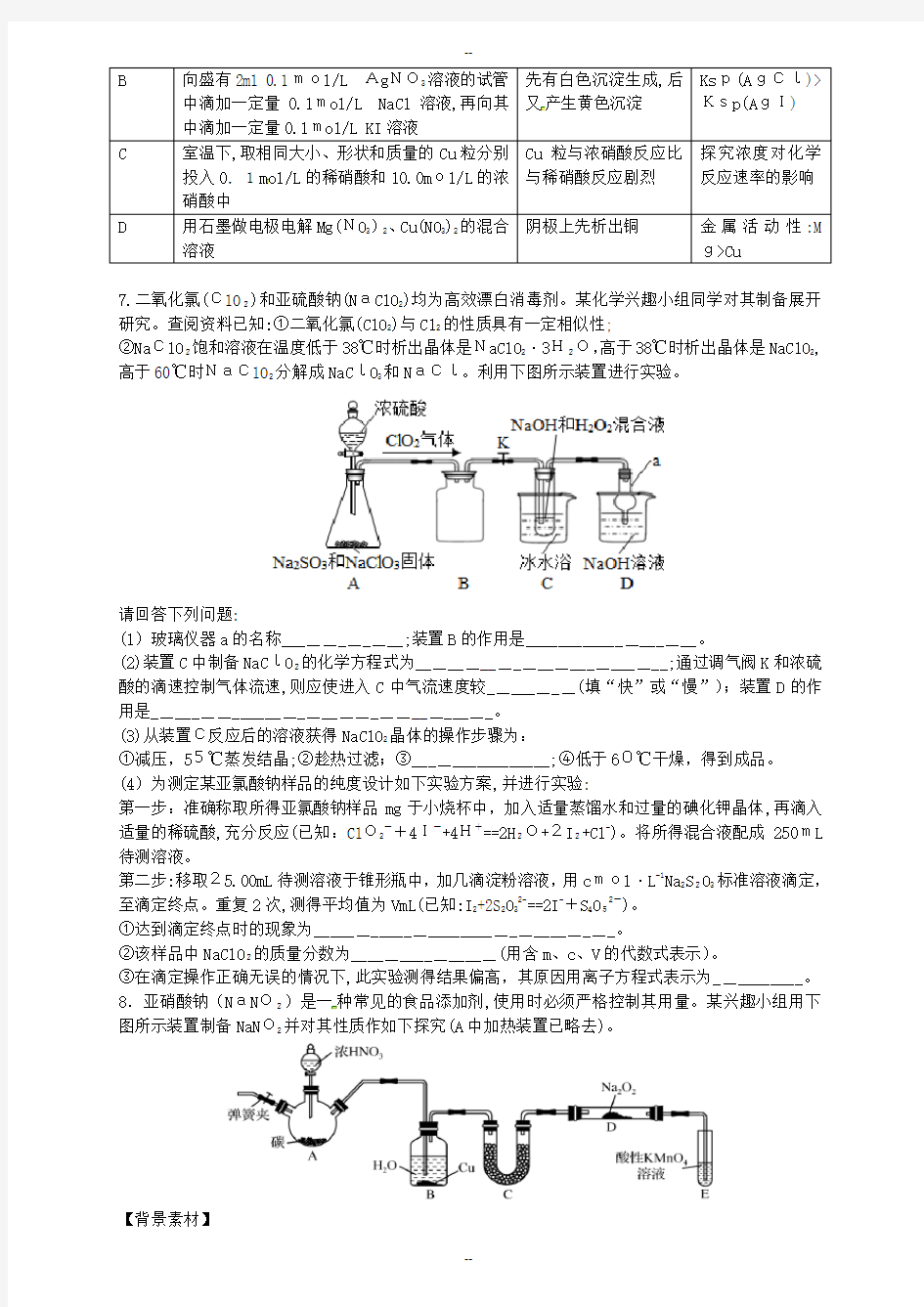
7.二氧化氯(ClO2)和亚硫酸钠(NaClO2)均为高效漂白消毒剂。某化学兴趣小组同学对其制备展开研究。查阅资料已知:①二氧化氯(ClO2)与Cl2的性质具有一定相似性;
②NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。
请回答下列问题:
(1)玻璃仪器a的名称___________;装置B的作用是___________________。
(2)装置C中制备NaClO2的化学方程式为______________________
__;通过调气阀K和浓硫酸的滴速控制气体流速,则应使进入C中气流速度较________(填“快”或“慢”);装置D的作用是_______________________________。
(3)从装置C反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③________________;④低于60℃干燥,得到成品。
(4)为测定某亚氯酸钠样品的纯度设计如下实验方案,并进行实验:
第一步:准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+==2H2O+2I2+Cl-)。将所得混合液配成250mL 待测溶液。
第二步:移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准溶液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:I2+2S2O32-==2I-+S4O52-)。
①达到滴定终点时的现象为_______________________________。
②该样品中NaClO2的质量分数为_______________(用含m、c、V的代数式表示)。
③在滴定操作正确无误的情况下,此实验测得结果偏高,其原因用离子方程式表示为__________。8.亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去)。
【背景素材】
①2NO+Na2O2===2NaNO2;
②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
③在酸性条件下NaNO2能把I-氧化为I2;S2O32-能把I2还原为I-。
【制备NaNO2】
(1)装置A三颈烧瓶中发生反应的化学方程式为。
(2) B装置的目的是①,②。
(3)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号)。
A. P2O5 B.碱石灰C. 无水CaCl2D. 生石灰
(4) E装置发生反应的离子方程式是。
【测定NaNO2纯度】
(5) 本小题可供选择的试剂有:
A.稀硫酸B.c1mol·L-1KI溶液 C.淀粉溶液D.c2mol·L-1Na2S2O3溶液E.c3mol·L-1酸性KMnO4溶液
①利用NaNO2的还原性来测定其纯度,可选择的试剂是 (填序号)。
②利用NaNO2的氧化性来测定其纯度的步骤是:准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解 (请补充完整实验步骤)。
9.研究硫元素及其化合物的性质具有重要意义。
I.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO345℃)
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________;装置III中溶液逐渐褪色,证明二氧化硫具有___________性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/LNaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
A.硫化钠溶液B.氨水C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(填序号)。
a.KSCN溶液和氯水b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为
__________。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可
能含有H2和CO2气体,产生CO2的理由是_______________(用化
学方程式表示)
10.某学习小组根据SO2的性质进行如下相关实验研究。
【制备SO2】按照如图装置制备SO2。
(1)A试管中可观察到的现象是 ;SO2具有漂白性,试再举出两种漂白原理互不相同的物质。
(2)若A试管中只加浓硫酸,加热过程中,导管b出口处的气体遇见潮湿的空气会有少量“酸雾”产生。推测b处出现酸雾的主要化学反应方程式为。
(3)SO2尾气可以用浓氨水吸收。实验室制备NH3的化学方程式为__________;下列装置中宜用于NH3制备浓氨水的是 (填序号)。
【SO2浓度检测】
(4)学生用ME3 - SO2型电化学传感器测量试管B中SO2气体浓度,工作原理如右图。电极Ⅱ的反应式为 ;当通入VmL气体时,测得SO2浓度为amol/L。此时电解液中生成的n(H+)为;电化学传感器灵敏度受温度影响。若高于工作温度时,测得SO
2,浓度可能偏低,其原因可能是。
11.硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。Ⅱ.[制备产品]实验装置如图所示(省略夹持装置):
烧瓶C中发生反应如下:Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq)(I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(II) S(s)+Na2SO3(aq)Na2S2O3(aq)(III)
实验步骤:①待Na2S和Na2CO3完全消耗后,结束反应。②向C中烧瓶加入Na2S和Na2CO3混合溶液。③检查装置气密性,按图示加入试剂。④向A中烧瓶滴加浓H2SO4。⑤过滤C中混合物,滤液经蒸发、结晶、过滤、洗涤、干燥,得到产品。
(1)E中的试剂是____________(选填下列字母编号)。
A.稀H2SO4 B.NaOH溶液 C.饱和NaHSO3溶液
(2)正确的操作顺序是
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________ ,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是___________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过____________方法提纯。
12.分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等。
(1) 某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如下:
①该实验能确认存在的阳离子是。
②该实验检测出样本中有NO3-,根据是(用化学方程式解释) 。
③根据该实验能否确定样本中含有SO32-,(填“能”或“否”) ,若要确定SO32-,所需的实验药品可以是。
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm =103 nm)的颗粒物。下列说法不正确
...的是
(填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1 ~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2。
①CaSO4可以调节水泥的硬化时间。尾气中SO2与石灰乳反应生成CaSO4的化学方程式为。
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的
化学方程式。
参考答案
1.A 2.C 3.C 5.A 6.D 7.
(1)球形干燥管;安全瓶,可以防止倒吸;
(2)2NaO H+2C lO2+H 2O2=2NaCl O2+2H 2O+O 2;慢;吸收未反应的ClO2,防止逸出污染空气;
(3)用38-60℃的温水洗涤;
(4)①滴入最后一滴Na 2S 2O 3标准液由蓝色变为无色且半分钟内不变色; ②
%100226.0 m
cV
;③4H ++4I -+O2=2I 2+2H 2O。 8.
(1)C+4H NO3(浓)
CO 2↑+4NO 2↑+2H2O(2分)
(2)①将NO 2转化为N O、(2分)②铜与稀硝酸反应生成N O(2分)
(3)BD (2分)(4)3M nO 4-+4H ++5NO=3Mn2++5NO 3-+2H2O(2分)
(5)①E ②加入过量的c 1mol·L -1
K I溶液、淀粉溶液,然后滴加稀硫酸,充分反应后,
用c2mo l·L-1
Na 2S2O 3溶液滴定至溶液由蓝色恰好变为无色,且半分钟内不变色,读数,重复以上操作2~3次 9.
(1)使SO 3凝结成固体与SO 2分离(1分);还原性(2分) (2)2SO 2+3NaOH =Na 2SO 3 +N aHSO 3+H2O(2分) (3)ABD(3分) (4)c(2分)
(5)57.1%(2分)(6)C+2H2SO4(浓)
CO 2↑+2SO 2↑+2H2O(2分)
10.
(1)铜片逐渐溶解,有无色气体逸出,试管底部出现灰白色固体;活性炭、HCl O(H 2O 2、Na 2O 2等)
(2)SO 2+H 2O=H2SO 3 (3)2N H4Cl +C a(O H)2
△
CaCl 2+2H 2O +2NH 3↑ ac
(4)O 2+2H 2O +4e -
=4OH -
2Va×10-3
mol
温度升高,吸附在电极上的SO 2减少,导致测得结果偏低。(2分,其它合理也可) 11.
Ⅱ.(1)B;(2)③②④①⑤;(3)C
Ⅲ.(1)过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl
(2)先向A 中烧瓶滴加浓H 2SO 4,产生的气体将装置中空气排尽后,再向C 中烧瓶加入Na2S 和Na 2CO 3混合溶液; (3)重结晶; 12.
(1)①Na +、NH 4+、K +
②3Cu+8HNO 3=3C u(NO 3)2+2NO↑+4H 2O (1分)2NO+O2=2NO 2(1分) ③否;酸性高锰酸钾溶液(各1分,共2分) (2)b c(2分,漏选1分/错选不得分)
(3)①2SO 2+O 2+2Ca (OH)2=2C aSO 4+2H 2O(2分)
②NO+NO2+Ca(OH)2=Ca(NO2)2+H2O(2分)
