临床研究病例报告表格模板

欢迎共阅XXXXXXXXXXXXXXX
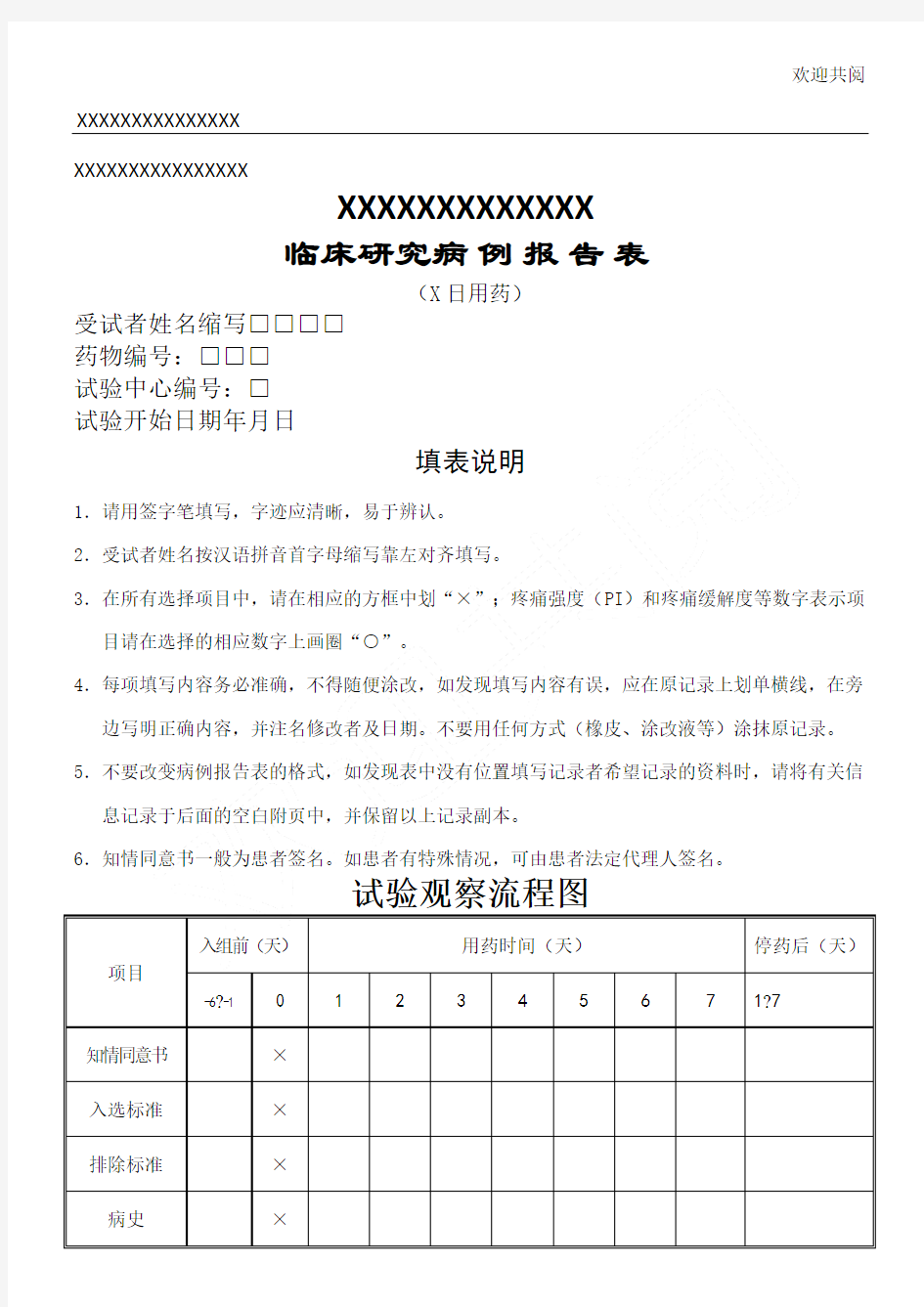
XXXXXXXXXXXXXXXX
XXXXXXXXXXXXX
临床研究病例报告表
(X日用药)
受试者姓名缩写□□□□
药物编号:□□□
1.受试者应为:
?年龄:18-70岁癌症患者(一般情况尚好,可适当放宽)
?性别不限
?预计生存期2个月以上的住院患者
?疼痛强度为中到重度,评分≥4
?并符合一下条件之一(请在符合的项目上画圈)
1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2;
2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2
?
?
?
2
?
?
?
?
?
?
?
?
?
?
?
?
?
?
如以上任何一个答案为“是”,此受试者不能参加
结论:该患者是否符合上述要求,同意入组是
□
□
□
□
□
□
□
□
否
□
□
□
□
□
□
□
□
医生签名:______日期____年___月___日
病历简况
1.1检查日期:年月日
.2受试者病历号:
2.1出生日期:年月
.2性别:□1.男□2.女
.3临床诊断:
分期1.T□2.N□3.M□
.4现接受的抗癌治疗:
□1.放疗间歇期□2.化疗间歇期□3.中医药□4.手术□5.无□6.其他(请注明).50疼痛强度:□1.轻(评分)□2.中(评分)□3.重(评分)
.51疼痛性质:□1.急性疼痛□2.慢性持续性疼痛
□3.
□5.
.52
□8.
.53
.60
□2.
□3.
□4.
□5.
□6.
□7.
□8.
.61
.62
.63用药时间:□1.近四周内□2.近三天□3.其他
.64其它与镇痛有关合并用药,如有,请详述:
3.0既往史
.1药物过敏史□1.无□2.有.2脑部疾患□1.无□2.有
.3心脏疾患□1.无□2.有.4哮喘□1.无□2.有
.5胆道疾患□1.无□2.有.6习惯性便秘□1.无□2.有
.7肾脏疾患□1.无□2.有.8糖尿病□1.无□2.有
如有,请描述:1.
2.
4.0体格检查
.11.T._℃2.P次/分3.R次/分
4.SBPmmHg
5.DBPmmHg
6.身高cm
7.体重Kg
.2皮肤粘膜
□1.无□2.苍白□3.黄染□4.紫绀□5.皮疹.3浅表淋巴结
□1.无肿大□2.有肿大
.4双侧瞳孔
心电图检查
3.前4天为剂量滴定时间,后3天病人用药量应已固定。
试验期间一般情况观察记录表
用药后辅助检查结果
用药后检验报告粘贴单
研究完成情况总结
附页
病例报告表样板
碳水化合物交换份法在糖尿病饮食干预中的应用研究 多中心随机对照临床试验 病例报告表 (Case Report Form,CRF □ 01 医院 □ 02 医院 □ 03 医院 □ 04 医院 受试者姓名(拼音缩写):□□□口 研究者签名:______________________________ 浙江医院 申办者:
注意事项 1 ?本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按 方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。 3.每页页眉均应填写,其中中心代码填 1 ,2,3,4 等;入组顺序号由各医院按受试者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红ZHHO 李书名LSMI 欧阳小惠OYXH 4.血糖因故未查或漏查,应填写ND。 5?填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“ 0”如①□。
入组选择表 请回答以下问题 纳入标准 是 否 无关 1.2014年6月-2016年6月收治内分泌科被诊断为2型 □ □ □ 糖尿病患者; 2.年龄在18?80岁之间; □ □ □ 3.确诊2型糖尿病1年以上 □ □ □ 4.受试者自愿参加研究并己签署知情同意书 □ □ □ 5.神志清,可自行进行饮食控制; □ □ □ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准 是 否 无关 1.预计住院时间不满3天 □ □ □ 2.近期接受过大手术或任何一项超过 2小时的手术 □ □ □ 3.正在接受糖皮质激素治疗者 □ □ □ 4.正在接受肠内或肠外营养 □ □ □ 5.肝、肾功能障碍及其他禁忌症 □ □ □ 6.糖尿病酮症酸中毒 □ □ □ 7.妊娠期女性 □ □ □ 8.不愿意接受饮食管理或无法签署知情同意书者 □ □ □ 上述问题任一回答是“是”时,该病例不能纳入研究 知情同意书 疾病情况及血糖记录 疾病情况 血糖记录
临床研究病例报告表
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日
填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图 -6 -117
入组筛选表 1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗 ?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □
临床研究病例报告表
临床研究病例报告表内部编号:(YUUT-TBBY-MMUT-URRUY-UOOY-DBUYI-0128)
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。
入组筛选表
1.受试者应为: 年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) 性别不限 预计生存期2个月以上的住院患者 疼痛强度为中到重度,评分≥4 并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX 剂量,疼痛强度可缓解到≤2 非放疗期或疼痛部位为非照射部位 间歇期的化疗者,应由主管医生确认化疗后无止痛作用 该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: 本研究开始前4周内曾参加过其他临床试验 正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) 24小时内用过XX类镇痛药,或5日内用过XXX 癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药 物治疗 呼吸抑制、(肺)气道阻塞或组织缺氧 胆道疾病 心脏疾患(即Ⅱ级和Ⅱ级以上心功能) 血压高于正常值 血液系统疾病 肝、肾功能明显异常(即指标高于正常值一倍以上) 脑部疾病,判定能力异常 XX药耐受、过敏,或曾在使用时因不良反应停药 药物及∕或酒精滥用 孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日
病例报告表格模板CRF
欢迎共阅 XXXXXX临床试验 病例报告表 (CaseReportForm) (版本号:第二版2010年8月3日) 试验组□对照组□ 是否完成研究:□是□否 承担临床试验的医疗机构:1.__□ 2.□ 受试者拼音缩写:□□□□ 试验编号:□□□ 研究者姓名: 研究开始日期:______年____月____日 研究结束日期:______年____月____日 实施者:XXXXXXXXXXXXXXXX公司 填表说明 1、筛选合格者填写正式病例报告表。 2、病例填写务必准确、清晰,病历及本表作为原始记录,不得随意涂改,错误之处更正时,在错误处划一水平线居中,仍能看到其原始内容,将更正的记录写在旁边,并写上研究者的姓名和更改日期。 举例:原记录为:8.5,修改后式样为8.5 3、填写本表一律使用黑色中性笔。 4、患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。 举例:张悦ZHYU,李新华LXHU,欧阳冰冰OYBB。 5、所有选择项目的□内用“X”标注。 6、试验期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生,请及时报告本中心临床试验负责人、伦理委员会、实施者、药监局。
(发现严重不良反应时需在24小时以内上报有关单位) 试验流程图 阶段手术前随访阶段 随访阶段第1次 访视 第1次 随访 第2次 随访 第3次 随访 第4次 随访 计划外随 访 术前术后即刻术后1周术后1个月术后2个月必要时 采集前列腺 病史 √————必要时签署知情同 意书 √————必要时确定入选排 除标准 √————必要时填写基本资 料 √————必要时生命体征检 查(血压、脉 搏、呼吸) √√√——必要时 量表结果观 察 √——√√必要时生化检查√√———必要时血常规检查√√———必要时肾功能检查√√———必要时 凝血功能检 查 √————必要时 尿动力学检查√——√√必要时 试验实施者:XXXXXXXXXXXXXXX公司移动电话:电话: 传真: 临床研究单位: 1.□ 2.□电话:传真:电话:传真: —1013
病例报告模板
附件4:病例报告书写格式 病例报告 你所遇到的实际病例教科书(文献)描述的典型病例 一般情况:(一般情况——家族史,占30分) 流行病学讨论:(好发性别、年龄、职业等)姓名:性别: 年龄:出生地: 职业:民族: 婚姻: 联系地址: 入院日期: 记录日期: 主诉:(患者就诊的主要症状(或体征)及持续临床表现及相关情况:(结合临床表现特征性症时间)状与体征特点及其发展变化情况、伴随症状以及 与鉴别诊断有关的阳性或阴性资料等) 现病史:(本次疾病的发生、演变、诊疗等方面 的详细情况,应按时间顺序书写) 既往史:(患者过去的健康与疾病情况,如疾病病因学及可能发病原因:(结合病因学及可能发史、传染病史、手术外伤史等)病因素,分析既往病史与该疾病有无关联) 个人史:(生活居住情况,出生地和曾居住地,流行病学特点:
文化程度,有无烟、酒等嗜好) 家族史:(父母、兄弟、姐妹及子女健康情况。病因学方面的遗传性、家族聚集性等特点: 家族成员中有无遗传病、与遗传有关的疾病及传 染病) 体格检查:(包括全身检查、腹部检查及专科检体格检查:(结合疾病发生部位、类型、大小、 查情况)(体格检查——辅助检查,占20分) 良恶性和并发症) 辅助检查:(具重要意义的阳性、阴性结果)辅助检查:(实验室检查、超声及影像学检查、 相关标志物检查等;结合文献,目前尚可采取的 检测手段及可能结果的分析)
初步诊断:(初步诊断——鉴别诊断,占30分)初步诊断和鉴别诊断:(结合临床表现、体格检 查及辅助检查,进行诊断、鉴别诊断及诊断依据)鉴别诊断: 诊疗计划:(1.常规检查评价;2.为明确诊断进 诊疗:(根据该疾病目前治疗的方法种类,结合一步需检查的项目;3.初步的治疗方案,包括拟 该患者疾病类型、分期进行个体化治疗。并对预进行的手术)(占10分) 后作出判断) 体会:(对该疾病的认识、临床思维的要点及今 后工作的启示等)(体会——思考,占10分) 社会、伦理、道德、法律、经济等相关问题思考:
病例报告表记录标准操作规程
病例报告表记录标准操作规程 1.目的:为加强对药物研究的监督管理,保证药物临床病历报告表 记录真实、规范、完整,提高药物临床试验的质量,根据《中华人民共和国药品管理法》、《国家档案法》以及药物申报和审批中的有关要求,制订本规程。 2.凡在我机构进行的药物临床试验,其病例报告表记录均应遵循本 操作规程。 3.药物临床试验病例报告表是指按试验方案所规定设计的一种文 件,用以记录每一名受试者在试验过程中的数据。每位受试者在试验中的有关资料均应记录于病例报告表中。 4.病例报告表记录的基本要求:真实、及时、准确、完整、规范, 防止漏记和随意涂改。不得伪造、编造数据。为确保达到以上要求,记录时需注意以下事项: 4.1 病例报告表中的数据来自原始文件并与原始文件一致,试验中 的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中,不得随意更改,确因填写错误,作任何更正时应保持原始记录清晰可辨,由更正者签署姓名和时间; 4.2 临床试验中各种实验室数据均应记录或将原始报告复印件粘贴 在病例报告表上,在正常范围内的数据也应具体记录。对显著偏离或在临床可接受范围外的数据须加以核实。检测项目必须注明所采用的计量单位; 4.3 病例报告表必须使用本研究机构统一专用的带有页码编号的病 例报告表。病例报告表的幅面,根据需要设定。 4.4 病例报告表中记录的内容要有必要的依据。计算机、自动记录 仪器打印的图表和数据资料,临床研究中的检验报告书、体检表、知情同意书、试验图片、照片等应按顺序粘贴在病例报告表的相应位置上,并在相应处注明试验日期和时间;底片装在统一制作的底片袋内,编号后另行保存。用热敏纸打印的试验记录,须保留其复印件。不宜粘贴的,可另行整理装订成册并加以编号,同时在病例报告表相应处注明,以便查对。 4.5 病例报告表应保持完整,不得缺页或挖补;如有缺页、漏页, 应详细说明原因。 4.6 病例报告表的记录不得使用容易擦改的记录工具如铅笔等,宜
(完整)医疗器械临床试验病例报告表
(完整)医疗器械临床试验病例报告表 编辑整理: 尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)医疗器械临床试验病例报告表)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)医疗器械临床试验病例报告表的全部内容。
编号:□□□□ 患者姓名拼音缩写:□□□□ 产品名称*****(商品名:***) 的安全性和有效性研究 病例报告表 (Case Report Form,CRF) 患者姓名拼音缩写:□□□□ 试验编号:□□□□ 医院名称: 研究者签名: 申办单位:上海******有限公司
病例报告表填写要求 1、所有记入本手册的数据需对照原始资料进行核查 2、用签字笔填写,中文字应清晰可辨,英文字母需大写 3、每格填写一个字,不适用的空格,请填“/" 4、选择项请打“√" 5、填写错误修改时,用单线划掉,切毋涂抹,原字迹需清晰可辨,并签名和注明修改时间 6、患者的姓名不得出现在本病例报告表中,患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字二字母,四字姓名填写每一个字的首子母。举例:张红ZHHO,张红旗ZHQI 欧阳予黄 OYYH. 7、日期填写为:□□□□年□□月□□日。
一、入选标准: 1、年龄18~65岁,性别不限;□是□否 2、创面面积小于体表面积的50%;□是□否 3、签署知情同意书; □是□否 如以上任何答案为“否”,则该病人不能入选 二、排除标准: 1、年龄小于18岁或大于65岁;□是□否 2、有严重心、脑、肝、肾功能不全的患者;□是□否 3、严重营养不良的患者;□是□否 4、创面面积大于体表面积50%的患者;□是□否 5、有精神疾病的患者以及无自知力、不能确切表达者。□是□否 如以上任何答案为“是",则该病人不能入选 观察医师签名: 日期年月日
临床研究病例报告表三篇
临床研究病例报告表三篇 篇一:临床研究病例报告表 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留
以上记录副本。 知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 试验观察流程图
入组筛选表
1.受试者应为: ?年龄:18-70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于 40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX 是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □
病例报告表
*************期临床试验 病例报告表 (Case Report Form) 试验单位:中山大学肿瘤防治中心 申办单位:*************** 入组序号:□□□ 患者姓名拼音首字:□□□□ 研究开始日期: 研究结束日期: 填表医师:____________________________ 研究者:____________________________ 病例报告表填写说明 (开始研究前请仔细阅读!) 1、病例报告表第一联申办者保存,第二联工作联,第三联由研究者保存。 2、病例报告表填写应用黑色签字笔用力填写(请用垫板垫于将要填写的CRF页下,以防无碳复写印到下页),数据及用语务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。举例:99.6 LZH00.11.10(勿用橡皮擦、修正液遮盖或划许多道线)。 3、患者姓名拼音缩写四格必须填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。举例:张红ZHHO 张红旗ZHQI 欧阳校风OYXF 5、所有选择项目的□内用×标注。所有应填写数字的□填写阿拉伯数字。缺省方框用0填写。例:20应在三格框中书写0 2 0。 6、所有检验项目因故“未查或漏查”,请填写ND,并注明原因;“不知道”则填入“UK”;“不能提供”或“不适用”则填入“NA”。 7、临床研究期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。如有严重不良事件发生,请及时报告本研究单位临床研究负责人。 筛选期 入选标准
临床试验—病例表
甘露聚糖肽注射液辅助治疗恶性肿瘤的安全性和有效性的随机、双盲、与安慰剂平行对照、多中心临床再评价试验 病例报告表 (Case Report Form) 受试者缩写□□□□ 药物编号:□□□ 试验中心编号:□□ 试验开始日期年月日
填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写容务必准确,不得随便涂改,如发现填写容有误,应在原记录上划单横线,在旁边写明正确容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。
试验观察流程图 -6 17 -1
入组筛选表 1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周曾参加过其他临床试验 ?正在服用或本试验开始前2周曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时用过XX类镇痛药,或5日用过XXX ?癌痛骨转移患者,近4周接受同位素放疗或/和双磷酸盐类药物治疗 ?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况
临床研究病例报告表
临床研究病例报告表 Prepared on 22 November 2020
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 试验观察流程图
入组筛选表
1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况 检查日期:年月日
病例报告表(CRF)记录标准操作规程
病例报告表(CRF)记录标准操作规程 1.目的:为加强对药物研究的监督管理,保证药物临床病历报告表记录真实、规范、完整,提高药物临床试验的质量,根据《中华人民共和国药品管理法》、《国家档案法》以及药物申报和审批中的有关要求,制订本规程。 2.凡在我机构进行的药物临床试验,其病例报告表记录均应遵循本操作规程。 3.药物临床试验病例报告表是指按试验方案所规定设计的一种文件,用以记录每一名受试者在试验过程中的数据。每位受试者在试验中的有关资料均应记录于病例报告表中。 4.病例报告表记录的基本要求:真实、及时、准确、完整、规范,防止漏记和随意涂改。不得伪造、编造数据。为确保达到以上要求,记录时需注意以下事项: 4.1病例报告表中的数据来自原始文件并与原始文件一致,试验中的任何观察、检查结果均应及时、准确、完整、规范、真实地记录于病历和正确地填写至病例报告表中,不得随意更改,确因填写错误,作任何更正时应保持原始记录清晰可辨,由更正者签署姓名和时间; 4.2临床试验中各种实验室数据均应记录或将原始报告复印件粘贴在病例报告表上,在正常范围内的数据也应具体记录。对显著偏离或在临床可接受范围外的数据须加以核实。检测项目必须注明所采用的计量单位; 4.3病例报告表必须使用本研究机构统一专用的带有页码编号的病例报告表。病例报告表的幅面,根据需要设定。 4.4病例报告表中记录的内容要有必要的依据。计算机、自动记录仪器打印的图表和数据资料,临床研究中的检验报告书、体检表、知情同意书、试验图片、照片等应按顺序粘贴在病例报告表的相应位臵上,并在相应处注明试验日期和时间;底片装在统一制作的底片袋内,编号后另行保存。用热敏纸打印的试验记录,须保留其复印件。不宜粘贴的,可另行整理装订成册并加以编号,同时在病例报告表相应处注明,以便查对。 4.5病例报告表应保持完整,不得缺页或挖补;如有缺页、漏页,应详细说明原因。 4.6病例报告表的记录不得使用容易擦改的记录工具如铅笔等,宜用钢笔或圆珠笔写。先用铅笔填写,最后根据需要再擦去后用钢笔填写的做法是不可取的。原始资料记录应用字规范,字迹工整。 4.7常用的外文缩写(包括试验试剂的外文缩写)应符合规范。首次出现时须用中文加以注释。病例报告表中属译文的应注明其外文名称。 4.8病例报告表记录应使用规范的专业术语,计量单位应采用国际标准计量单位,有效数字的取舍应符合试验要求。 4.9临床试验过程中所出现的严重不良事件应详细描述和评价。 4.10入选的未按研究方案完成疗程的病例作为脱落病例处理,需说明脱落原因并记录在案,用于分析研究的质量。脱落病例的数目一般不宜超过10%~15%,比例高时表明随机性很差,意味着试验不够成功。 5.为保护受试者隐私,病例报告表上不应出现受试者姓名。研究者应按受试者的代码确认其身份并记录。 6.监查员可在试验的前、中、后期查访试验点和研究者,确认病例报告表中
病例报告表格模板CRF
欢迎共阅 XXXXX)临床试验 病例报告表 (CaseReportForm) (版本号:第二版2010年8月3 日)试验组□对照组口 是否完成研究:□是□否 承担临床试验的医疗机构:1._口 2. 口 受试者拼音缩写:口□□口 试验编号:□□口 研究者姓名:研究开始日期:____ 年 ____ 月日 I 气X. \ X # A 研究结束日期:_________ 年_____ 月 ____ 日 —、、I, 实施者:xxxxxxxxxxxxxXX司 填表说明 1、筛选合格者填写正式病例报告表。 2、病例填写务必准确、清晰,病历及本表作为原始记录,不得随意涂改,错误之处更正时,在错误处划一水平线居中,仍能看到其原始内容,将更正的记录写在旁边,并写上研究者的姓名和更改日期。 举例:原记录为:8.5,修改后式样为8.5 3、填写本表一律使用黑色中性笔。 4、患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母,三字姓名填写三字首字母及第三字第二字母,四字姓名填写每一个字的首字母。 举例:张悦ZHYU李新华LXHU欧阳冰冰OYBB 5、所有选择项目的□内用“ X”标注。 6、试验期间应如实填写不良事件记录表。记录不良事件的发生时间、严重程度、持续时间、 采取的措施和转归。如有严重不良事件发生,请及时报告本中心临床试验负责人、伦理委员会、实施者、药监局。
(发现严重不良反应时需在小时以内上报有关单位)
患者检查/诊断信息患者主要症状描述:检查/诊断结果: 研究医师签名日期20 年月日
标准
研究医师签名日期20 年月日 义判定:1 =正常;2=异常但无临床意义;3 =异常但有临床意义;4 =未查。 研究医师签名日期20—年月日 术前评分
病例报告表样板
病例报告表样板 Standardization of sany group #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
碳水化合物交换份法在糖尿病饮食干预中的应用研究多中心随机对照临床试验 病例报告表 (Case Report Form,CRF) □ 01 医院 □ 02 医院 □ 03 医院 □04 医院 受试者姓名(拼音缩写):□□□□ 研究者签名: 申办者:浙江医院
注意事项 1.本试验主要研究者必须经过GCP培训,必须事先充分了解试验方案及有关资料,严格按方案执行,病例筛选合格者按数字随机表分组,不得随意更改分配。 2.筛选合格者填写正式病例报告表,病例报告表填写务必准确、清晰,不得随意涂改,错误之处纠正时需用双横线居中划出,并签署修改者姓名缩写及修改时间。3.每页页眉均应填写,其中中心代码填 1,2,3,4等;入组顺序号由各医院按受试 者就诊时间顺序填写(入组顺序号的次序应与就诊先后时间及住院号顺序相符合); 随机对应号请按试验设计要求填写;受试者姓名拼音缩写四格应填满,两字姓名按每个字前两个字母填写;三字姓名按每个字的首个字母和第三个字的第二个字母填写;四字姓名按每个字的首个字母填写。举例:张红 ZHHO 李书名 LSMI 欧阳小惠 OYXH 4.血糖因故未查或漏查,应填写ND。 5.填写数字时应将□都填满,位数不够的靠右侧填写,左侧空出填“0”。如□0□4。
入组选择表 请回答以下问题 纳入标准是否无关 1. 2014年6月-2016年6月收治内分泌科被诊断为2型 □□□糖尿病患者; 2. 年龄在18~80岁之间;□□□ 3. 确诊2型糖尿病1年以上□□□ 4. 受试者自愿参加研究并己签署知情同意书□□□ 5. 神志清,可自行进行饮食控制;□□□ 上述问题任一回答是“否”时,该病例不能纳入研究 排除标准是否无关 1. 预计住院时间不满3天□□□ 2.近期接受过大手术或任何一项超过2小时的手术□□□ 3.正在接受糖皮质激素治疗者□□□ 4. 正在接受肠内或肠外营养□□□ 5. 肝、肾功能障碍及其他禁忌症□□□ 6. 糖尿病酮症酸中毒□□□ 7. 妊娠期女性□□□ 8. 不愿意接受饮食管理或无法签署知情同意书者□□□ 上述问题任一回答是“是”时,该病例不能纳入研究 研究者签名日期□□□□年□□月□□日 知情同意书 疾病情况及血糖记录 疾病情况
完整版病例报告表
XXXX临床研究 病例报告表 受试者姓名拼音缩写:|__|__|__|__| 受试者编号:|__|__|__|__|__|研究者签名:________________ 主要研究者:XX 教授 申办单位: XX医院
正式填表前,请认真阅读以下说明 填表说明 1.参加本研究的人员均需经过GCP培训,并充分阅读了解本试验方案及相关资料,严格按方案执行,并如实填写。 2.已入选的受试者,不论是否剔除或淘汰,都需要填写病例报告表。 3.填写务必认真.准确.清晰.如实,不能随意涂改,如填写确有错误,修改时不能涂黑或使用涂改液,应将填写错误的数据用横线居中划出,在旁边写上正确的数据,并由临床试验负责医师在修改处签名.注明日期。例如:10 20 刘明请在各选择项□内划“×”,在|_|填写相应的数字,所有栏目内应填写,在____填写文字。选用钢笔或签字笔用力填写表格,以便第三份亦能看清。为防止复写至一下页,请在填写时用垫板衬在下一页前。 5.患者姓名拼音缩写需填满四格,两字姓名分填两字前两个字母,三字姓名填前两字首字母与第三字 青山 6.所有检查项目因故未查或漏查请填写ND,具体用药剂量和时间不明请填写NK。 7.严格观察和如实填写不良事件记录表。记录不良事件的发生时间.严重程度.持续时间.采取的措施和转归。临床研究过程中发生的任何严重不良事件,必须立即报告协办单位.临床研究负责单位主要研究者和伦理委员会。 严重不良事件报告单位 报告单位联系人联系电话XX医院伦理委员会XXXX 国家食品药品监督管理局注册司-0/32/42/20
筛选期签署知情同意书? 知情同意书签署日期:20|__|__|年|__|__|月|__|__|日访视日期:20|__|__|年|__|__|月|__|__|日 人口学资料 肿瘤诊断 肿瘤手术史 是否有肿瘤手术史?□是□否
病例报告表填写指
病例报告表填写指南 内容包括病例报告表的定义、填写和更正病例报告表的责任、病例报告表和试验方案的关系、病例报告表与原始文件的关系,填写病例报告表中常见的错误以及如何避免这些错误,申办者的审核过程,数据澄清表以及文件保存的要求。 ICH 将病例报告表(CRF )定义为一种印刷的、可视的或者是电子版的文件,用于记录每个受试者的所有试验方案要求的信息,向申办者报告。在这里我要指出的是电子版这个词,你们中的许多人可能还没有机会接触电子版的病例报告表,但制药业界的趋势是逐渐转向电子版CRF 。 我们从ICH 指南中摘录了一些有关完成病例报告表的条例。首先,研究者应保证在病例报告表和所有其他报告中,其数据准确、完整、可读和及时。前三点,准确性、完整性和可读性大家在完成病例报告表时都比较注意,假设已经做到了这三点,那么第四点及时性常常是容易被忽略的但又是同样重要的。如果你已经在准确性、完整性和可读性上花了很多努力,但却拖了几个月才写下来的,那么这会削弱准确性、完整性和可读性。 第二个条例是关于病例报告表中来源于原始资料的数据。这些数据应该与原始文件一致,如有任何不同,应做出解释。当监查员来到你的中心,他或她会将原始文件和病例报告表中填入的内容进行比较。几乎在所有的情况下,二者均应相符,如不相符,你要知道其原因。最后一个是,“病例报告表中的任何修改必须标明日期、姓名缩写以及相应的解释,并且不能使原有的记录不能辨认。研究者应保存更改和更正的记录。” 也就是说,在填写病例报告表出现错误时,只要在错误的地方划上一条线,然后标明日期和你的姓名缩写。如果是一组数据出现了错误,如药物发放记录,你可以在整个错误处划线,然后签名以及日期,而不需要分别划许多线和改许多错。 签名单: 签名单记录了所有授权填写和改正病例报告表人员的姓名和他们的首字母缩写,也记录了他们的真实签名。这是一份非常重要的文件,应该保存在中心的文件夹中。 病例报告表的用途:病例报告表的目的是为了保证根据试验方案的要求有效、完整地收集数据。这有利于分析和清晰地报告数据,其结果将对评价该药的疗效和安全性起决定性的作用。如果考虑一下申办者设计试验的理由,显然是为了收集疗效和安全性的信息。由于病例报告表是收集数据的主要载体,因此它是整个研究过程中非常关键和重要的一部分。 试验方案和病例报告表的关系: 试验方案决定了病例报告表需要记录什么数据。所有在试验方案中特指的数据都应该记录在病例报告表中。这意味着研究者不要将未在试验方案中设定的信息写入病例报告表,否则会带来一些困难。在病例报告表上的任何“自由文字(free text) ”都应该只是为了澄清数据。例如,我们常常在病例报告表的边缘部分见到填写的数据,那不是你该记录数据的地方。唯一可以允许自由文字的情况是,你在看了填入的数据后发现,假如不做一简短说明,你将会收到数据澄清表(Data Clarification Form, DCF )而被要求进一步说明。如果这样,是可以的,但如是收集数据,应避免这样填写。 ?? 原始文件: 病例报告表中填入的内容以原始资料为依据。象我们前面看到的,原始文件是收集原始数据的地方,这些数据需要输入病例报告表中。所有的信息以及临床发现、观察或试验中其他活动的原始记录都是重建和评价临床试验所必须的。基本上这就是原始数据的来源。原始资料的一些例子如住院病历,门诊病历,实验室检查报告单(包括当地和中心实验室的报告),病人日记或者自评表。药物的发放记录,录音/ 录像数据以及自动仪器也是原始资料的来源。其他的例子有X 光片,包括报告和片子,心电图记录(同样,包括心电图的报告以及微型胶卷)。
临床研究病例报告表
临床研究病例报告表 Document number:PBGCG-0857-BTDO-0089-PTT1998
XXXXXXXXXXXXXXX XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×”;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。 4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 试验观察流程图
入组筛选表
1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组是 □ □ □ □ □ □ □ □ 是 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ 否 □ □ □ □ □ □ □ □ □ □ □ □ □ □ □ 医生签名:______日期____年___月___日 病历简况 检查日期:年月日
临床研究病例报告表之欧阳家百创编
XXXXXXXXXXXXXXX 欧阳家百(2021.03.07)XXXXXXXXXXXXXXXX XXXXXXXXXXXXX 临床研究病例报告表 (X日用药) 受试者姓名缩写□□□□ 药物编号:□□□ 试验中心编号:□ 试验开始日期年月日 填表说明 1.请用签字笔填写,字迹应清晰,易于辨认。 2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。 3.在所有选择项目中,请在相应的方框中划“×” ;疼痛强度(PI)和疼痛缓解度等数字表示项目请在选择的相应数字上画圈“○”。4.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名修改者及日期。不要用任何方式(橡皮、涂改液等)涂抹原记录。 5.不要改变病例报告表的格式,如发现表中没有位置填写记录者希望记录的资料时,请将有关信息记录于后面的空白附页中,并保留以上记录副本。 6.知情同意书一般为患者签名。如患者有特殊情况,可由患者法定代理人签名。 -6 17 -1
入组筛选表
1.受试者应为: ?年龄:18 -70岁癌症患者(一般情况尚好,可适当放宽) ?性别不限 ?预计生存期2个月以上的住院患者 ?疼痛强度为中到重度,评分≥4 ?并符合一下条件之一(请在符合的项目上画圈) 1)入选前1周内曾使用XX,日剂量为40-60mg,疼痛强度可缓解到≤2; 2)入选前1周内曾使用其它镇痛药,其全日剂量相当于40-60mgXX剂量,疼痛强度可缓解到≤2 ?非放疗期或疼痛部位为非照射部位 ?间歇期的化疗者,应由主管医生确认化疗后无止痛作用 ?该患者是否同意参加本试验,并已签署知情同意书 如以上任何一个答案为“否”,此受试者不能参加 2.受试者排除标准: ?本研究开始前4周内曾参加过其他临床试验 ?正在服用或本试验开始前2周内曾服用MAO抑制剂者(如优降宁、苯乙肼等) ?24小时内用过XX类镇痛药,或5日内用过XXX ?癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗 ?呼吸抑制、(肺)气道阻塞或组织缺氧 ?胆道疾病 ?心脏疾患(即Ⅱ级和Ⅱ级以上心功能) ?血压高于正常值 ?血液系统疾病 ?肝、肾功能明显异常(即指标高于正常值一倍以上) ?脑部疾病,判定能力异常 ?XX药耐受、过敏,或曾在使用时因不良反应停药 ?药物及∕或酒精滥用 ?孕妇或哺乳期妇女 如以上任何一个答案为“是”,此受试者不能参加 结论:该患者是否符合上述要求,同意入组 是 □□□ □□ □ □ □ 是 □□ □□ □□ □□ □□ □□ □□ □ 否 □□□□ □ □ □ □ 否 □□□ □□□ □□□ □□□ □□ □ 医生签名:______日期____年___月___日 病历简况
