红外吸收光谱

第十章红外吸收光谱
Infrared Spectrometry
基本要点:
1. 红外光谱分析基本原理;
2. 红外光谱与有机化合物结构;
3. 各类化合物的特征基团频率;
4. 红外光谱的应用;
5. 红外光谱仪.
红外吸收光谱是物质的分子吸收了红外辐射后,引起分子的振动-转动能级的跃迁而形成的光谱,因为出现在红外区,所以称之为红外光谱。利用红外光谱进行定性定量分析的方法称之为红外吸收光谱法。
红外辐射是在 1800年由英国的威廉.赫谢(Willian Hersher) 尔发现的。一直到了1903年,才有人研究了纯物质的红外吸收光谱。二次世界大战期间,由于对合成橡胶的迫切需求,红外光谱才引起了化学家的重视和研究,并因此而迅速发展。随着计算机的发展,以及红外光谱仪与其它大型仪器的联用,使得红外光谱在结构分析、化学反应机理研究以及生产实践中发挥着极其重要的作用,是“四大波谱”中应用最多、理论最为成熟的一种方法。
红外光谱法的特点:
1?气态、液态和固态样品均可进行红外光谱测定;
2?每种化合物均有红外吸收,并显示了丰富的结构信息;
3?常规红外光谱仪价格低廉,易于购置;
4?样品用量少:可减少到微克级;
5. 针对特殊样品的测试要求,发展了多种测量新技术,如:光声光谱( PAS)、衰减反射光谱(ATR),漫反射,红外显微镜等。
§10-1 红外光谱分析基本原理
Principle of Infrared Spectrometry
一. 红外吸收与振动 - 转动光谱
1. 光谱的产生:
分子中基团的振动和转动能级跃迁产生振-转光谱,称红外光谱。
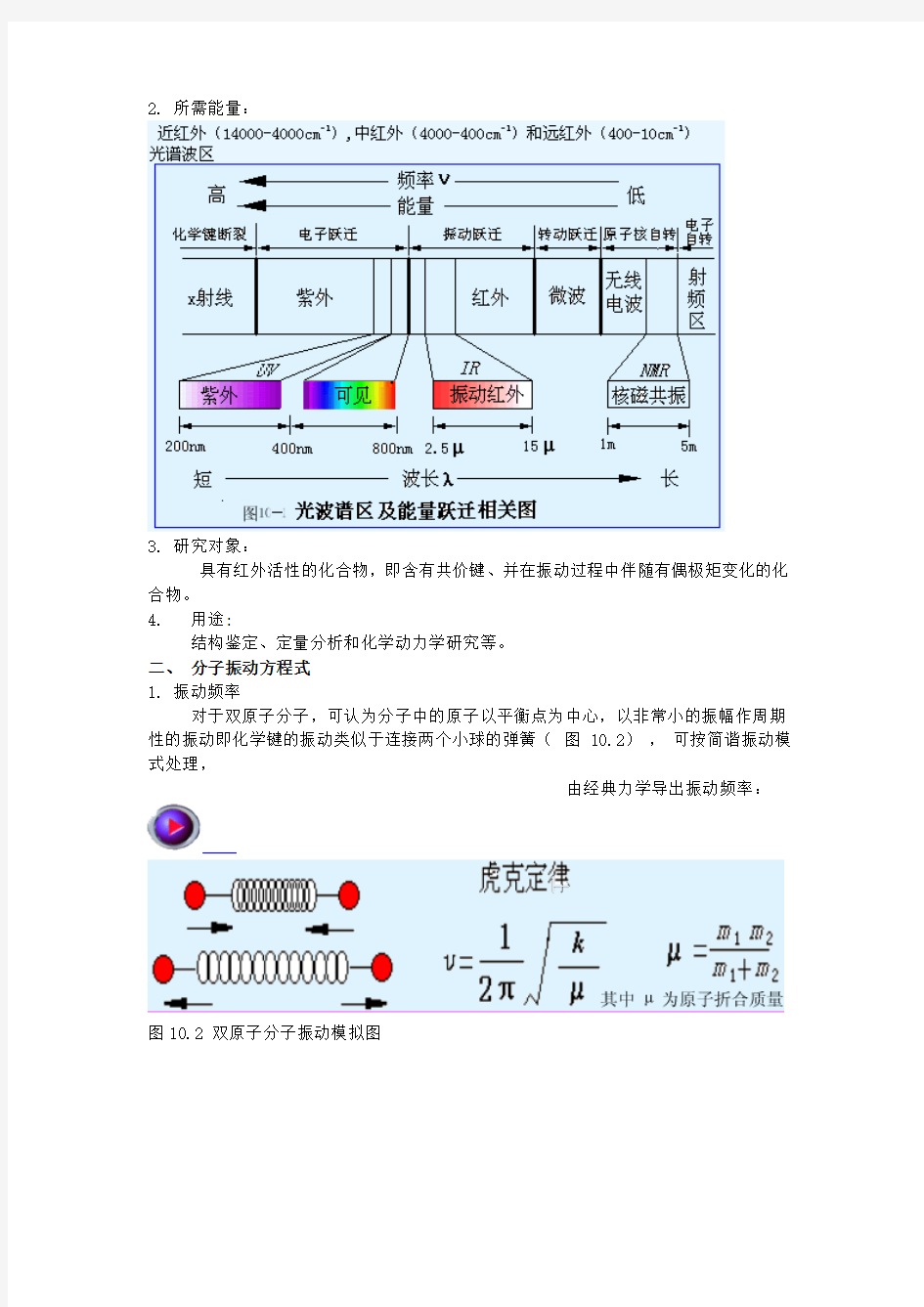
2. 所需能量:
3. 研究对象:
具有红外活性的化合物,即含有共价键、并在振动过程中伴随有偶极矩变化的化合物。
4. 用途:
结构鉴定、定量分析和化学动力学研究等。
二、分子振动方程式
1. 振动频率
对于双原子分子,可认为分子中的原子以平衡点为中心,以非常小的振幅作周期性的振动即化学键的振动类似于连接两个小球的弹簧(图 10.2),可按简谐振动模式处理,
由经典力学导出振动频率:
图10.2 双原子分子振动模拟图
图 10.3 双原子分子的势能曲线
2.振动能级(量子化):
按量子力学的观点,当分子吸收红外光谱发生跃迁时,要满足一定的要求,即振动能级是量子化的,可能存在的能级满足下式:
E 振 =( V+ 1/2 )h n
n :化学键的振动频率;V :振动量子数。
任意两个相邻的能级间的能量差为:
(用波数表示)
其中:K 为化学键的力常数,与键能和键长有关;m 为双原子的折合质量。
发生振动能级跃迁需要能量的大小取决于键两端原子的折合质量和键的力常数,即取决于分子的结构特征。
化学键键强越强(即键的力常数K 越大)原子折合质量越小,化学键的振动频率越大,吸收峰将出现在高波数区。如:
三、分子的振动形式
两类基本振动形式:变形振动和伸缩振动以甲烷为例:变形振动
四. 红外光谱产生的条件
满足两个条件:
1. 红外光的频率与分子中某基团振动频率一致;
2. 分子振动引起瞬间偶极矩变化
完全对称分子,没有偶极矩变化,辐射不能引起共振,无红外活性,如: N2 、 O2 、Cl2 等;非对称分子有偶极矩,属红外活性,如 HCl 。偶极子在交变电场中的作用可用图 10.6 表示。
图 10.6 偶极子在交变电场中的作用示意图
五. 红外光谱峰的位置、峰数与强度
1.位置:由振动频率决定,化学键的力常数K 越大,原子折合质量m 越小,键的振动频率越大,吸收峰将出现在高波数区(短波长区);反之,出现在低波数区(高波长区);
2.峰数:分子的基本振动理论峰数,可由振动自由度来计算,对于由 n 个原子组成的分子,其自由度为3 n
3n= 平动自由度+振动自由度+转动自由度
分子的平动自由度为3,转动自由度为:非线性分子3,线性分子2
振动自由度=3 n- 平动自由度-转动自由度
非线性分子:
振动自由度=3 n-6
线性分子:
振动自由度=3 n-5
绝大多数化合物红外吸收峰数远小于理论计算振动自由度(原因:无偶极矩变化的振动不产生红外吸收;吸收简并;吸收落在仪器检测范围以外;仪器分辨率低,谱峰重叠等。)如水分子和二氧化碳分子(图10.7,图 10.8)。
3.强度: 红外吸收的强度与跃迁几率的大小和振动偶极矩变化的大小有关,跃迁几率越大、振动偶极矩越大,则吸收强度越大。
4 .红外光谱图:纵坐标为吸收强度,横坐标为波长λ,(μm ),和波数 1/ λ,单位: cm -1 ,可以用峰数,峰位,峰形,峰强来描述,如仲丁醇的红外光谱(图 10.9 )。
六 . 常用的红外光谱术语
1. 频峰:由基态跃迁到第一激发态,产生的强吸收峰,称为基频峰(强度大);
2. 倍频峰:由基态直接跃迁到第二、第三等激发态,产生弱的吸收峰,称为倍频峰;
3. 合频峰:两个基频峰频率相加的峰;
4.Fermi 共振 :
某一个振动的基频与另外一个振动的倍频或合频接近时,由于相互作用而在该基频峰附近出现两个吸收带,这叫做 Fermi 共振,例如苯甲酰氯只有一个羰基,却有两个羰基伸缩振动吸收带,即1731 cm-1 和1736 cm-1, 这是由于羰基的基频(1720 cm-1) 与苯基和羰基的变角振动(880—860 cm-1) 的倍频峰之间发生 Fermi 共振而产生的. Fermi 共振的产生使红外吸收峰数增多,峰强加大.
5. 振动偶合:
两个化学键的振动频率相等或接近时,常使这两个化学键的基频吸收峰裂分为两个频率相差较大的吸收峰,这种现象叫做振动偶合.
例如:瑚珀酸(丁二酸)的两个羰基吸收频率相等.而实际红外谱却出现1700cm-1和1780cm -1 两个吸收带,就是振动偶合的确结果;再如酸酐()在羰基吸收区出现两个吸收峰,且这两个吸收峰相隔离60cm s ,也是由于振动偶合产生的,振动偶合的结果也是使红外线吸收峰数增多。
产生红外吸收光谱必备的条件
1 产生红外吸收光谱必备的条件? 答:1 辐射后具有能满足物质产生振动跃迁所需的能量2分子振动有瞬间偶极距变化。 2 过度过冷现象对溶液的影响?避免过度过冷现象的方法? 溶液中析出固相的纯溶剂之后,剩余的溶液浓度增加,而在计算机中使用的却是原始浓度,从而引入误差,所以要避免过度的过冷现象。避免过度过冷现象的方法:①加入少量的晶种作为晶核。②增加搅拌速度。 4简答:红外区可分为哪几个区?答:①近红外区,②中红外区或基频红外区, ③远红外区。 5 简述红外光谱,紫外光谱,核磁共振谱以及质谱各自的原理. 答:1.当分子振动引起分子偶极矩变化时,就能形成稳定的交变电场,其频率与分子振动频率相同,可以和相同频率的红外辐射发生相互作用,使分子吸收红外辐射的能量跃迁到高能态,从而产生红外吸收光谱. 2.紫外光谱是分子中电子吸收的变化而产生的,当样品分子或原子吸收电子后外层电子由基态跃迁到激发态.不同结构的样品分子其跃迁方式不同,而且吸收光的波长范围不同,吸光的频率也不同,可根据波长范围吸光度鉴别不同物质结构方面的差异. 3.当原子核吸收的辐射能量与核能级相等时,就发生能级跃迁,从而产生核磁共振信号. 4.质谱分析法是通过对样品离子的质量和强度的测定来进行成分和结构分析的一种方法. 6简述几种主要因素影响差热分析仪所测结果答案:1.样品量:样品量少,样品分辨率高,但灵敏度下降,一般根据样品热效应大小调节样品量,一般为3~5mg。 2.升温速度,一般升温速度范围在每分钟5~20度。 3.气氛:一般使用惰性气体,
如N2、Ar、He等,气流速度恒定,控制在10ml/min,否则会引起基线波动。7.简述判断分子离子峰的方法. 第一,看质谱中质量最大的峰,多数情况下质谱中高质量端的峰就是分子离子峰;第二,最高质量的峰与临近碎片离子峰之间的质量差是否合理;第三,根据氮规则判断第四,如果分子离子峰太弱,或经过判断后认为分子离子峰没有出现,可通过改进实验技术测定相对分子质量。 8简要说明质谱分析的原理、特点?答案:质谱分析方法是通过样品离子的质量个强度的测定来进行成分和结构分析的一种方法。特点:1应用范围广:可以进行同位素分析,又可做有机结构分析,可以是气、固、液样品2灵敏度高,样品用量少,灵敏度高达50pg50*10-12,用微克量级的样品,即可得到分析结果。 3分析速度快,可实现多组分同时检测。4但仪器结构复杂,价格昂贵。 9拉曼光谱与红外光谱的不同之处有哪些? 答:拉曼光谱红外光谱 光谱范围40~400,光谱范围400~4000 水不能作为溶剂,水能作为溶剂 样品可盛放于玻璃容器,不能玻璃容器盛放样品 样品表面可直接测定;测定时须研磨成KBr压片 10氢谱谱峰发生分裂,产生自旋—自旋裂分现象的原因? 答:这是由于在分子内部相邻碳原子上氢核自旋会相互干扰,通过成键电子之间的传递,形成相邻质子之间的自旋—自旋耦合,而导致自旋—自旋裂分。 11熔体破裂现象---不稳定流动 答案:高聚物熔体在挤出时,如果剪切速率超过某个极限值时,从口模处理的挤
仪器分析_紫外-可见分光光度和红外光谱法习题及参考答案.docx
第三章紫外可见吸收光谱法 1人眼能感觉到的可见光的波长范围是( )。 A 、400nm ?760nm B 、200nm ?400nm C 、200nm ?600nm D 、360nm ?800nm 2、 在分光光度法中,透射光强度 (I )与入射光强度(∣0)之比l∕∣0称为( )。 A 、吸光度 B 、吸光系数 C 、透光度 D 、百分透光度 3、 符合朗伯-比尔定律的有色溶液在被适当稀释时,其最大吸收峰的波长位置 ( )。 A 、向长波方向移动 B 、向短波方向移动 C 、不移动 D 、移动方向不确定 4、 对于符合朗伯-比尔定律的有色溶液,其浓度为 C 0时的透光度为 T 0;如果其浓度增大 1 倍,则此溶液透光度的对数为 ( )。 A 、T 0∕2 B 、2T 0 C 、2lgT 0 D 、0.5lgT 0 5、 在光度分析中,某有色物质在某浓度下测得其透光度为 T ;若浓度增大1倍,则透光度 为 ()。 2 1/2 A 、T B 、T/2 C 、2T D 、T 6、 某物质的摩尔吸光系数很大,则表明 ( )。 A 、该物质溶液的浓度很大 B 、光通过该物质溶液的光程长 C 、 该物质对某波长的光的吸收能力很强 D 、 用紫外-可见光分光光度法测定该物质时其检出下限很低 7、在用分光光度法测定某有色物质的浓度时,下列操作中错误的是 ( )。 B 、待测溶液注到比色皿的 2/3高度处 D 、将比色皿透光面置于光路中 B 、吸光度与浓度成正比 D 、玻璃棱镜适用于紫外光区 9、在分光光度分析中,常出现工作曲线不过原点的情况。与这一现象无关的情况有 ( )。 A 、试液和参比溶液所用吸收池不匹配 B 、参比溶液选择不当 C 、显色反应的灵敏度太低 D 、被测物质摩尔吸光系数太大 10、 质量相等的A 、B 两物质,其摩尔质量 M A > M B O 经相同方式发色后,在某一波长下测 得其吸光度相等,则在该波长下它们的摩尔吸光系数的关系是 ( )O A A 、 B Pel A, B ZB A B^ — A 、 B 选择题 A 、比色皿外壁有水珠 C 、光度计没有调零 8、下列说法正确的是( )。 A 、透光率与浓度成正比
仪器分析红外吸收光谱法习题及答案
红外吸收光谱法 一.填空题 1.一般将多原子分子的振动类型分为伸缩振动和变形振动,前者又可分为对称伸缩振动和反对称伸缩振动,后者可分为面内剪式振动(δ)、面内摇摆振动(ρ) 和面外摇摆振动(ω)、面外扭曲振动(τ) 。2.红外光区在可见光区和微波光区之间,习惯上又将其分为三个区: 远红外区,中红外区和近红外区 ,其中中红外区的应用最广。 3.红外光谱法主要研究振动中有偶极矩变化的化合物,因此,除了单原子和同核分子等外,几乎所有的化合物在红外光区均有吸收。 4.在红外光谱中,将基团在振动过程中有偶极矩变化的称为红外活性 ,相反则 称为红外非活性的。一般来说,前者在红外光谱图上出现吸收峰。5.红外分光光度计的光源主要有能斯特灯和硅碳棒。 6.基团一OH、一NH;==CH的一CH的伸缩振动频率范围分别出现在 3750—3000 cm-1, 3300—3000 cm-1, 3000—2700 cm-1。 7.基团一C≡C、一C≡N ;—C==O;一C=N,一C=C—的伸缩振动频率范围分别出现在 2400—2100 cm-1, 1900—1650 cm-1, 1650—1500 cm-1。 8.4000—1300 cm-1 区域的峰是由伸缩振动产生的,基团的特征吸收一般位于此范围,它是鉴最有价值的区域,称为官能团区;1300—600 cm-1 区域中,当分子结构稍有不同时,该区的吸收就有细微的不同,犹如人的指纹一样,故称为指纹区。 二、选择题 1.二氧化碳分子的平动、转动和振动自由度的数目分别(A) A. 3,2,4 B. 2,3,4 C. 3,4,2 D. 4,2,3 2.乙炔分子的平动、转动和振动自由度的数目分别为(C) A. 2,3,3 B. 3,2,8 C. 3,2,7 D. 2,3,7 4.下列数据中,哪一组数据所涉及的红外光谱区能够包括CH 3CH 2 COH的吸收 带?(D) A. 3000—2700cm-1,1675—1500cm-1,1475—1300cm一1。 B. 3300—3010cm-1,1675—1500cm-1, 1475—1300cm-1。 C. 3300—3010cm-1, 1900—1650cm-l,1000——650cm-1。 D. 3000—2700cm-1, 1900—1650cm-1, 1475——1300cm-1。 1900—1650cm-1为 C==O伸缩振动,3000—2700cm-1为饱和碳氢C—H伸缩振动(不饱和的其频率高于3000 cm-1),1475——1300cm-1为C—H变形振动(如—CH 3 约在1380—1460cm-1)。
红外光谱法习题[1]
第九章红外光谱法 基本要求:了解红外吸收光谱和吸收峰特征的表达, 掌握红外吸收光谱产生的条件,影响吸收峰位置、峰数和强度的因素, 掌握主要的IR谱区域以及在这些区域里引起吸收的键振动的类型, 掌握常见基团的特征吸收频率,利用IR谱鉴别构造异构体并能够解析简单化合物的结构,了解红外 吸收光谱的实验技术,了解拉曼光谱的原理及应用。 重点:IR光谱产生的条件,影响吸收峰位置,峰数和强度的因素,常见基团的特征吸收频率。 难点:键振动的类型,IR谱解析,FT-IR的原理和特点。 部分习题解答 1.产生红外吸收的条件是什么?是否所有的分子振动都会产生红外吸收光谱?为什么? 条件:(1)分子的振动或转动必须伴随偶极矩的变化;(2)红外辐射应具有能满足分子产生振动跃迁所需的能量(红外辐射频率等于振动量子数差值和振动频率的乘积) 不是所有的分子振动都会产生红外吸收光谱。只有满足上述两个条件的分子振动才会产生红外吸收光谱。例如,同核双原子分子(O2、N2、Cl2)等的振动没有红外活性。 5. 计算CO2和H2O的分子振动自由度,它们分别有几种振动形式,在红外吸收光谱中能看到几个吸收普带?数目是否相符?为什么? CO2:线性分子振动自由度3N-5=3*3-5=4 四种振动形式两个吸收带数目不符对称伸缩振动无偶极矩变化,无红外活性,无吸收峰;面内弯曲和面外弯曲振动简并,只显示一个吸收峰。 H2O:非线性分子振动自由度3N-6=3*3-6=3 三种振动形式三个吸收带数目相符 6.判断正误。 (1)对(2)错(3)错(4)对(5)错(6)错 7、下列同分异构体将出现哪些不同的特征吸收带? (1)CH3 CO2H CO2CH3 (2)C2H3COCH3CH3CH2CH2CHO (3) 解:(1)CH3——COH 在3300~2500cm-1处有v O—H, 其v C=O位于1746~1700cm-1 COCH3无v OH吸收,其v C=O位于1750~1735cm-1(2)C2H5CCH3其v C=O位于1720~1715cm-1 CH3CH2CH2CH 其2820cm-1及2720cm-1有醛基费米共振双峰。 O O O
红外反射光谱原理实验技术及应用
高级物理化学实验讲义 实验项目名称:红外反射光谱原理、实验技术及应用 编写人:苏文悦编写日期:2011-7-7 一、实验目的(宋体四号字) 1、了解并掌握FTIR-ATR、FTIR-DRS和FTIR-RAS等红外光谱表面分析技术的原理、实验技术及应用 2、比较分析FTIR-ATR、FTIR-DRS和FTIR-RAS等红外光谱技术各自适用的样品、同一样品不同红外光谱的谱带位置及形状。 二、实验原理 衰减全反射(ATR)、漫反射(DRS)和反射吸收(RAS)都是傅里叶变换红外反射光谱,是FTIR常用的表面分析技术。 图1 入射角(θ)及折射率(n1,n2)对光在界面上行为的影响 θc为临界角,sinθc=n2/n1 1全反射光谱原理、实验技术及应用 全反射:光由光密(即光在此介质中的折射率大的)媒质射到光疏(即光在此介质中折射率小的)媒质的界面时,全部被反射回原媒质内的现象。很多材料如交联聚合物、纤维、纺织品和涂层等,用一般透射法测量其红外光谱往往很困难,但使用FTIR及ATR技术却可以很方便地测绘其红外光谱。 (1)入射角与临界角 在通常情况下,光透射样品时是从光疏介质的空气射向光密介质样品的,当垂直入射(入射角θ为0°)时,则全部透过界面;当θ≠0°时,如果两者的折射率相差不大,则光是以原方向透射的,但如折射率差别较大,则会产生折射现象。 当n2与n1有足够的差值(0.5以上),且入射光从光密介质(n1)射向光疏介
质(n 2 ),入射角θ 大于一定数值时,光线会产生全反射现象。这个“一定数值”的角度称为临界角,也即当折射角φ 等于90°时的入射角θ称为临界角θc ,如图1,其中临界角θc 和折射率n 1和n 2有如下关系: sin θ=n 2/n 1 显然,临界角的数值取决于样品折射率与全反射晶体的折射率之比,对同一种全反射晶体,不同材质的样品会有不同的临界角值,表1所列数值可看出这一关系。 表1 在ATR 和MIR 方法中必须选用远大于临界角的入射角,即sin θ>n 2/n 1,以确保全反射的产生和所获光谱的质量,本实验运用单次衰减全反射ATR 附件,反射晶体是锗,入射角固定为45°,远大于临界角。 (2)衰减全反射 衰减全反射(Attenuated Total Reflectance)缩写为ATR 。当入射角大于临界角时,入射光在透入光疏介质(样品)一定深度后,会折回射入全反射晶体中。进入样品的光,在样品有吸收的频率范围内光线会被样品吸收而强度衰减,在样品无吸收的频率范围内光线被全部反射。因此对整个频率范围而言,由于样品的选择性吸收,使ATR 中的入射光能被部分衰减,除穿透深度dp 外,其衰减的程度与样品的吸收系数有关,还与多次内反射中的光接触样品的次数有关。这种衰减程度在全反射光谱上就是它的吸收强度。 全反射光谱的强度及分布 ATR 光谱的强度取决于穿透深度dp 、反射次数和样品与棱镜的紧密贴合情况以及样品本身吸收的大小。 内反射次数则是设计装置时的一个参数,入射角?越小,对同样尺寸的全反射晶体,全反射的次数就越多,谱峰越增强。 在全反射过程中光线穿透入样品的深度dp 的表示公式如下: 其中,dp :是光透入样品的垂直深度,称穿透深度 λl :是光在内反射晶体材料中的波长,与入射光波长λ成正比λ1=λ/n 1 ?:为入射角, n 21=n 2/n 1 :是样品与全反射晶体的折射率之比 21221 21)(sin 2n dp -=θπλ
红外吸附光谱法
红外吸附光谱法的学习 吸附研究方法多种多样,经典的方法有吸热法,比表面积,吸附等温线等。近代研究方法增加了红外光谱法,表面电压法,紫外光电子能谱等多个新研究方法技术。我主要对红外吸附光谱法进行了学习。 红外吸附法可提供吸附质及吸附剂—固体键的资料。通过吸附质在吸附前后红外吸收光谱地位移,考察表面吸附情况。不同的振动频率代表了吸附分子中不同的原子和表面成键。该方法有助于区别物理吸附和化学吸附。物理吸附靠范德华力,一般只能观察到谱带位移,不产生新谱带;而化学吸附形成新的化学键,能出现新谱带。该方法还能确定化学吸附分子的构型,如采用红外光谱测定CO在Pd上的吸附构型,表明覆盖率增加直线式结构增强。下面将具体介绍利用红外光谱仪测定CO在Pd/ Al 2O3 催化剂及载体上的吸附性能。 实验用催化剂系将一定浓度的含活性组分的混合溶液,浸渍于载体,然后经干燥、还原和活化而成。在红外测定前,将样品充分还原后,研磨成小颗粒,置于可用于吸附态测定的漫反射池中。采用 NaCl 做吸收池窗片。首先在高纯氮气吹扫下以 2 ℃ / mi n 的升温速率升至 180 ℃脱气,跟踪记录样品表面脱附情况 , 直至观测到的红外光谱图基本不变化。降至室温后切换为 CO 吸附气,并开始跟踪记录红外光谱图的变化。为防止催化剂表面吸附的物质对下次实验造成影响,每次实验均更换为新鲜催化剂。 首先是CO在载体Al2O3上吸附的红外光谱。众所周知 ,载体的作用不仅是稀释、支撑、分散金属活性组分 ,而且也具有明显的吸附剂特征。图 1 为 120 ℃时 CO 在载体Al2O3上吸附的红外-光谱图。从图 1 中可以看出 , CO 在Al2O3表面上有 HCOO-的形成 ( 1600 cm-1、 1383 cm-1) ,这是由于在Al2O3表面上存在不同的表面OH-可与-吸附在载体上的 CO 生成羧基等表面吸附态 , 即CO + O H-→ HCOO-。另外 , 在Al2O3上不可避免地会吸附少量的水 , 也可促进 HCOO-的生成。从图1还可发现 , 在Al2O3上有少量吸附态HCO3-的生成( 1465 cm-1,1254 cm-1)。 比较不同温度下 CO 在Al2O3上吸附的红外光谱 , 如图 2 所示 , 在室温时 , 可以发现少量的HCO3-吸收峰 ( 1656 cm-1、 1465 cm-1和1254cm-1 ,随着温度升高 , HCO3-吸收峰强度逐-渐减弱。温度至 100 ℃时 ,在 1600 cm-1处出现了一个新峰 , 且随温度的升高而逐渐增强。同时 ,1383 cm-1峰附近的 1349 cm-1处峰也随温度升-高逐渐增大 , 到100 ℃时强度已明显超出 1383cm-1处峰。 1600 cm-1和 1383 cm-1峰分别对应于HCOO-的不对称和对称伸缩振动 , 这说明HCO3-在升温过程中转变为 HCOO-, 至 120 ℃-时催化剂表面只有少量的HCO3-吸附态。 其次是CO 在催化剂Pd表面上吸附的红外光谱研究。图 3 为反应温度 120 ℃时 CO 在 Pd/ Al2O3催-化剂表面上吸附的红外光谱图。图 3 中的 2176cm-1、 2116 cm-1-处峰为
红外吸收光谱法试题和答案解析
红外吸收光谱法 一、选择题 1. CH 3—CH 3的哪种振动形式是非红外活性的(1) (1)υC-C (2)υC-H (3)δasCH (4)δsCH 2. 化合物中只有一个羰基.却在1773cm -1和1736 cm -1 处出现两个吸收峰.这是因 为(3) (1)诱导效应 (2)共轭效应 (3)费米共振 (4)空间位阻 3. 一种能作为色散型红外光谱仪的色散元件材料为(4) (1)玻璃 (2)石英 (3)红宝石 (4)卤化物晶体 4. 预测H 2S 分子的基频峰数为(2) (1)4 (2)3 (3)2 (4)1 5. 下列官能团在红外光谱中吸收峰频率最高的是(4) (1) (2)—C ≡C — (3) (4)—O —H 二、解答及解析题 1. 把质量相同的球相连接到两个不同的弹簧上。弹簧B 的力常数是弹簧A 的力常数的两倍.每个球从静止位置伸长1cm.哪一个体系有较大的势能。 答:M h hv E k 2π= = ;所以B 体系有较大的势能。 2. 红外吸收光谱分析的基本原理、仪器.同紫外可见分光光度法有哪些相似和不同之处 答: 红外 紫外 基本原理 当物质分子吸收一定波长的光能.能引起分子振动和转动的能及跃迁.产生的吸收光谱一般在中红外区.称为红外光谱 当物质分子吸收一定波长的光能.分子外层电子或分子轨道电子由基态跃迁到激发态.产生的吸收光谱一般在紫外-可见光区。 仪器 傅立叶变换红外光谱仪 紫外可见光分光光度计 相同:红外光谱和紫外光谱都是分子吸收光谱。 不同:紫外光谱是由外层电子跃迁引起的。电子能级间隔一般约为1~20eV; 而红外光谱是分子的振动能级跃迁引起的.同时伴随转动能级跃迁.一般振动能级间隔约为~1eV 。
红外吸收光谱分析实验
红外吸收光谱分析实验 概述 红外吸收光谱法是以一定波长的红外光照射物质时,若该红外光的频率,能满足物质分子中某些基团振动能级的跃迁频率条件,则该分子就吸收这一波长红外光的辐射能量,引起偶极距变化,而由基态振动能级跃迁到较高能级的激发态振动能级。检测物质分子对不同波长红外光的吸收强度,就可以得到该物质的红外吸收光谱。 各种化合物分子结构不同,分子振动能级吸收的频率不同,其红外吸收光谱也不同,利用这一特性,可进行有机化合物的结构剖析、定性鉴定和定量分析。 绝大多数有机化合物的基团振动频率分布在中红外区(波长400-4000cm-1),研究和应用最多的也是中红外区的红外吸收光谱法,该法具有灵敏度高、分析速度快、试样用量少,而且分析不受试样物态限制,可用于物质的气态、液态和固态的分析,所以应用范围非常广泛。红外吸收光谱法是现代结构化学、有机化学和分析化学等领域中最强有力的测试手段之一。 实验部分聚乙烯和聚苯乙烯膜的红外吸收光谱的测绘—薄膜法制样 目的要求 (1)学习聚乙烯和聚苯乙烯膜的红外吸收光谱的测绘方法; (2)学习对该图谱的解释,掌握红外吸收光谱分析基本原理; (3)学习红外分光光度计的工作原理及其使用方法。 基本原理 在由乙烯聚合成聚乙烯的过程中,乙烯的双键被打开,聚合生成—(CH2-CH2)n长链,因而聚乙烯分子中原子基团是饱和的亚甲基(CH2-CH2),其红外吸收光谱如图所示。由图可知聚乙烯的基本振动形式有: A.νC-H(-CH2-)2926cm-1、2853cm-1; B.δC-H(-CH2-)1468cm-1 C.δC-H(-CH2-)n,n>4时720cm-1, 由于δC-H1306cm-1和δC-H1250cm-1为弱吸收峰,在红外吸收光谱上未出现,因此只能观察到四个吸收峰。 在聚苯乙烯 2 的结构中,除了亚甲基(-CH2-)和次甲基CH 外,还有苯环上不饱和碳氢基团(=CH-)和碳碳骨架(-C=C-),它们构成了聚苯乙烯分子中基团的基本振动形式。图2为聚苯乙烯的红外吸收光谱,由图可知,聚苯乙烯的基本振动形式有: A.ν=C-H(Ar上)3010cm-1;3030cm-1;3060cm-1;3080 cm-1 B.νC-H(-CH2-)2926cm-1;2853cm-1;和νC-H(CH)2955cm-1 C.δC-H1468 cm-1;1360 cm-1;1306 cm-1; D.νC=C(Ar上)1605cm-1;1550cm-1;1450cm-1; E.δC-H(Ar上单取代倍频峰)1944cm-1;1871cm-1;1800cm-1;
仪器分析实验有机化合物的红外光谱分析解读
仪器分析实验有机化合物的红外光谱分析 2015年4月21日 有机化合物的红外光谱分析 开课实验室:环境资源楼312 【实验目的】 1、初步掌握两种基本样品制备技术及傅里叶变换光谱仪器的简单操作; 2、通过谱图解析及网上标准谱图的检索,了解由红外光谱鉴定未知物的一般过程; 3、掌握有机化合物红外光谱测定的制样方法,回顾基础有机化学光谱的相关知识。 【基本原理】 ? 原理概述:物质分子中的各种不同基团,在有选择地吸收不同频率的红外辐射后,发生振动能级之间的跃迁,形成各自独特的红外吸收光谱。据此,可对物质进行定性和定量分析。特别是对化合物结构的鉴定,应用更为广泛。 ? 红外吸收法: 类型:吸收光谱法; 原理:电子的跃迁:电子由于受到光、热、电等的激发,从一个能级转移到另一个能级的现象。这是因为分 子中的电子总是处在某一种运动状态中,每一种状态都具有一定的能量,属于一定的能级。当这些电子有选择地吸收了不同频率的红外辐射的能量,发生振动能级之间的跃迁,形成各自独特的红外吸收光谱。据此,可对化合物进行定性和定量分析; 条件:分子具有偶极矩。 【仪器与试剂】 1、仪器: 傅里叶变换红外光谱仪(德国Bruker公司,TENSOR 27型; 美国Thermo Fisher 公司, Nicolet 6700型);压片机; 玛瑙研钵; 红外灯。 2、试剂:NaCl窗片、KBr晶体,待分析试样液体及固体。 【实验步骤】 1、样品制备 (1)固体样品:KBr压片法 在玛瑙研钵将KBr晶体充分研磨后加入其量5%左右的待测固体样品,混合研磨直至均匀。在一个具有抛光面的金属模具上放一个圆形纸环,用刮勺将研磨好的
实验3 红外吸收光谱
实验三红外吸收光谱 一、实验原理 1. 了解红外吸收光谱和相关的一起操作 2. 学会分析红外吸收光谱 二、实验原理 1. 红外光区的应用 红外光区位于0.8 ~1000 μm 波长范围间 近红外区:0.8~2.5μm中红外区:2.5~50μm 远红外区:50~1000μm 2. 基本原理 将一束不同波长的红外射线照射到物质的分子上,某些特定波长的红外射线被吸收,形成这一分子的红外吸收光谱。每种分子都有由其组成和结构决定的独有的红外吸收光谱,据此可以对分子进行结构分析和鉴定。 红外吸收光谱是由分子不停地作振动和转动运动而产生的,分子振动是指分子中各原子在平衡位置附近作相对运动,多原子分子可组成多种振动图形。当分子中各原子以同一频率、同一相位在平衡位置附近作简谐振动时,这种振动方式称简正振动(例如伸缩振动和变角振动)。分子振动的能量与红外射线的光量子能量正好对应,因此当分子的振动状态改变时,就可以发射红外光谱,也可以因红外辐射激发分子而振动而产生红外吸收光谱。分子的振动和转动的能量不是连续而是量子化的。但由于在分子的振动跃迁过程中也常常伴随转动跃迁,使振动光谱呈带状。所以分子的红外光谱属带状光谱。分子越大,红外谱带也越多。如下图:
3. 产生红外的基本条件 必须满足两个条件: (1)红外辐射光子的能量与分子振动能级跃迁所需能量相同。 (2)辐射与物质间有相互耦合作用(偶极距有变化) 4. 分子振动形式 对于双原子分子,其化学键的振动类似于连接两个小球的弹簧,其振动类似于简谐振动; 对于多原子分子,振动较为复杂(原子多、化学键多、空间结构复杂),但可将其分解为多个简正振动来研究:伸缩振动ν和变形振动δ 5. 官能团和指纹区 红外谱图中有两个非常重要的区域,分别是4000~1300nm-1的高波数段官能团去和1300nm-1以下的低波数短的指纹区。 ?X-H伸缩振动区:4000~2500nm-1 ?叁键及双键积累区,2500~1900nm-1
仪器分析之红外吸收光谱法试题及答案
红外吸收光谱法习题 一、填空题 1. 在分子的红外光谱实验中,并非每一种振动都能产生一种红外吸收带,常常是实际吸收带比预期的要少得多。其原因是(1)_______; (2)________; (3)_______; (4)______。 2.乳化剂OP-10的化学名称为:烷基酚聚氧乙烯醚, 化学式: IR谱图中标记峰的归属:a_____, b____, c______, d____。 3.化合物的红外光谱图的主要振动吸收带应为: (1)3500~3100 cm-1处,有 ___________________振动吸收峰 (2)3000~2700 cm-1处,有 ___________________振动吸收峰 (3)1900~1650 cm-1处,有 ___________________振动吸收峰 (4)1475~1300 cm-1处,有 ___________________振动吸收峰 4.在苯的红外吸收光谱图中 (1) 3300~3000cm-1处,由________________________振动引起的吸收峰 (2) 1675~1400cm-1处,由________________________振动引起的吸收峰 (3) 1000~650cm-1处,由________________________振动引起的吸收峰 二、选择题 分子在红外光谱图上基频吸收峰的数目为 ( ) 1. Cl 2 (1) 0 (2) 1 (3) 2 (4) 3 2.下列关于分子振动的红外活性的叙述中正确的是 ( ) (1)凡极性分子的各种振动都是红外活性的,非极性分子的各种振动都不是红外活性的 (2)极性键的伸缩和变形振动都是红外活性的 (3)分子的偶极矩在振动时周期地变化,即为红外活性振动 (4)分子的偶极矩的大小在振动时周期地变化,必为红外活性振动,反之则不是 4.用红外吸收光谱法测定有机物结构时,试样应该是 ( ) (1)单质 (2)纯物质 (3)混合物 (4)任何
《仪器分析》教案7 - 红外吸收光谱法
第十章红外吸收光谱法 10.1教学建议 一、从应用实例入手,介绍红外吸收光谱法的基本原理和红外光谱仪结构特征。 二、依据红外谱图确定有机化合物结构,推断未知物的结构为目的,介绍红外光谱分析方法在定性及定量分析的方面的应用。 10.2主要概念 一、教学要求: (一)、掌握红外吸收光谱法的基本原理; (二)、掌握依据红外谱图确定有机化合物结构,推断未知物的结构方法; (三)、了解红外光谱仪的结构组成与应用。 二、内容要点精讲 (一)基本概念 红外吸收光谱——当用红外光照射物质时,物质分子的偶极矩发生变化而吸收红外光光能,有振动能级基态跃迁到激发态(同时伴随着转动能级跃迁),产生的透射率随着波长而变化的曲线。 红外吸收光谱法——利用红外分光光度计测量物质对红外光的吸收及所产生的红外光谱对物质的组成和结构进行分析测定的方法,称为红外吸收光谱法。 振动跃迁——分子中原子的位置发生相对运动的现象叫做分子振动。不对称分子振动会引起分子偶极矩的变化,形成量子化的振动能级。分子吸收红外光从振动能级基态到激发态的变化叫做振动跃迁。 转动跃迁——不对称的极性分子围绕其质量中心转动时,引起周期性的偶极矩变化,形成量子化的转动能级。分子吸收辐射能(远红外光)从转动能级基态到激发态的变化叫做转动跃迁。 伸缩振动——原子沿化学键的轴线方向的伸展和收缩的振动。 弯曲振动——原子沿化学键轴线的垂直方向的振动,又称变形振动,这是键长不变,键角发生变化的振动。 红外活性振动——凡能产生红外吸收的振动,称为红外活性振动,不能产生红外吸收的振动则称为红外非活性振动。 诱导效应——当基团旁边连有电负性不同的原子或基团时,通过静电诱导作用会引起分子中电子云密度变化,从而引起键的力常熟的变化,使基团频率产生位移的现象。 共轭效应——分子中形成大 键使共轭体系中的电子云密度平均化,双键力常数减小,使基团的吸收频率向低波数方向移动的现象。 氢键效应——氢键使参与形成氢键的原化学键力常数降低,吸收频率将向低波数方向移动的现象。 溶剂效应——由于溶剂(极性)影响,使得吸收频率产生位移现象。 基团频率——通常将基团由振动基态跃迁到第一振动激发态所产生的红外吸收频率称为基团频率,光谱上出现的相应的吸收峰称为基频吸收峰,简称基频峰。 振动偶合——两个相邻基团的振动之间的相互作用称为振动偶合。 基团频率区——红外吸收光谱中能反映和表征官能团(基团)存在的区域。 指纹区——红外吸收光谱中能反映和表征化合物精细结构的区域。
红外光谱原理
第二节 红外吸收光谱的基本原理 一、分子的振动与红外吸收 任何物质的分子都是由原子通过化学键联结起来而组成的。分子中的原子与化学键都处于不断的运动中。它们的运动,除了原子外层价电子跃迁以外,还有分子中原子的振动和分子本身的转动。这些运动形式都可能吸收外界能量而引起能级的跃迁,每一个振动能级常包含有很多转动分能级,因此在分子发生振动能级跃迁时,不可避免的发生转动能级的跃迁,因此无法测得纯振动光谱,故通常所测得的光谱实际上是振动-转动光谱,简称振转光谱。 1、双原子分子的振动 分子的振动运动可近似地看成一些用弹簧连接着的小球的运动。以双原子分子为例,若把两原子间的化学键看成质量可以忽略不计的弹簧,长度为r (键长),两个原子分子量为m 1、m 2。如果把两个原子看成两个小球,则它们之间的伸缩振动可以近似的看成沿轴线方向的简谐振动,如图3—2。因此可以把双原子分子称为谐振子。这个体系的振动频率υ(以波数表示),由经典力学(虎克定律)可导出: C ——光速(3×108 m/s ) υ= K ——化学键的力常数(N/m ) μ——折合质量(kg ) μ= 如果力常数以N/m 为单位,折合质量μ以原子质量为单位,则上式可简化为 υ=130.2 双原子分子的振动频率取决于化学键的力常数和原子的质量,化学键越强,相对原子质量越小,振动频率越高。 H-Cl 2892.4 cm -1 C=C 1683 cm -1 C-H 2911.4 cm -1 C-C 1190 cm -1 同类原子组成的化学键(折合质量相同),力常数大的,基本振动频率就大。由于氢的原子质量最小,故含氢原子单键的基本振动频率都出现在中红外的高频率区。 2、多原子分子的振动 1|D|ì2c K m 1m 2m 1m2+ K μ
红外光谱特征吸收峰
物质的红外光谱是其分子结构的反映,谱图中的吸收峰与分子中各基团的振动形式相对应。多原子分子的红外光谱与其结构的关系,一般是通过实验手段得到。这就是通过比较大量已知化合物的红外光谱,从中总结出各种基团的吸收规律。实验表明,组成分子的各种基团,如O-H、N-H、C-H、C=C、C=OH和C C 等,都有自己的特定的红外吸收区域,分子的其它部分对其吸收位置影响较小。通常把这种能代表及存在、并有较高强度的吸收谱带称为基团频率,其所在的位置一般又称为特征吸收峰。 一、基团频率区和指纹区 (一)基团频率区 中红外光谱区可分成4000 cm-1 ~1300 cm-1和1800cm-1 (1300 cm-1 )~ 600 cm-1两个区域。最有分析价值的基团频率在4000 cm-1 ~ 1300 cm-1 之 间,这一区域称为基团频率区、官能团区或特征区。区内的峰是由伸缩振动产生的吸收带,比较稀疏,容易辨认,常用于鉴定官能团。在1800 cm-1 (1300 cm-1 )~600 cm-1 区域内,除单键的伸缩振动外,还有因变形振动产生的谱带。这种振动与整个分子的结构有关。当分子结构稍有不同时,该区的吸收就有细微的差异,并显示出分子特征。这种情况就像人的指纹一样,因此称为指纹区。指纹区对于指认结构类似的化合物很有帮助,而且可以作为化合物存在某种基团的旁证。基团频率区可分为三个区域: (1)4000 ~2500 cm-1 X-H伸缩振动区,X可以是O、H、C或S等原子。 O-H基的伸缩振动出现在3650 ~3200 cm-1 范围内,它可以作为判断有无醇类、酚类和有机酸类的重要依据。当醇和酚溶于非极性溶剂(如CCl4),浓度于0.01mol. dm-3时,在3650 ~3580 cm-1处出现游离O-H基的伸缩振动吸收,峰形尖锐,且没有其它吸收峰干扰,易于识别。当试样浓度增加时,羟基化合物产生缔合现象,O-H基的伸缩振动吸收峰向低波数方向位移,在3400 ~3200 cm-1 出现一个宽而强的吸收峰。胺和酰胺的N-H伸缩振动也出现在3500~3100 cm-1 因此,可能会对O-H伸缩振动有干扰C-H的伸缩振动可分为饱和和不饱和的两种。饱和的C-H伸缩振动出现在3000 cm-1以下,约3000~2800 cm-1 ,取代基对它们影响很小。如-CH3 基的伸缩吸收出现在2960 cm-1和2876 cm-1附近;-
仪器分析红外光谱法
第8章红外光谱分析法 教学时数:6学时 教学要求: 1、理解产生红外吸收的条件。 2、了解分子的振动类型,红外光谱中吸收峰增减的原因。 3、理解影响吸收峰的位置、峰数、峰强的主要因素。 4、掌握基团频率和特征吸收峰,主要有机化合物的红外吸收光谱特征。 5、理解影响基团频率位移的因素 6、掌握红外吸收光谱法的定性、定量方法。 7、了解红外光谱的构造与红外制样技术。 教学重点与难点: 重点:红外吸收的条件,影响吸收峰强度的因素,基团频率和特征吸收峰,典型有机化合物的红外光谱主要特征,定性分析。 难点:分子的振动,影响基团频率的因素,结构推断。 §8-1 概述 一、分子光谱与红外光区的划分 E分子= E电子+E振动+ E转动 其中E电子属于紫外,可见研究的范围,分子的振动,转动光谱属于红
外光谱研究的范围。其波长范围约为0.75—1000nm 根据仪器技术及应用不同,习惯上把红外光谱分成三个区: 1、近红外区(λ=0.75—2.5μm ) 主要低能电子跃迁,含氢原子团的倍频吸收,用于研究稀土及其它过渡金属化合物,含氢(-OH 、N-N 、C-H )原子团的吸收 2、中红外区(λ=2.5 —25μm ) 大多有机化合物及无机离子的基频吸收带出现在该光区,主要由分子的振动和转动跃迁引起的,最适用于定性定量分析,且仪器及分析测试技术最成熟。 3、远红外区(λ= 25—1000μm ) 主要是分子的纯转动能级跃迁以及晶体振动很少应用。红外光谱中一般以波数表示谱带的位置,而不是用波长 σ(cm 1-)=) (1cm λ 二、 红外光谱研究的对象及特点 1、研究对象: 红外光谱是振动—转动光谱,但它只能研究震动中伴有偶极矩变化的化合物。 极性分子 有偶极矩变化—红外 μ≠0
红外光谱法习题参考答案
第十二章 红外吸收光谱法 思考题和习题 8.如何利用红外吸收光谱区别烷烃、烯烃及炔烃? 烷烃主要特征峰为2 3 3 ,,,CH s CH as CH H C δδδν-,其中νC-H 峰位一般接近3000cm -1又低于3000cm -1 。 烯烃主要特征峰为H C C C H C -==-=γνν,,,其中ν=C-H 峰位一般接近3000cm -1又高于3000cm -1 。νC=C 峰位约在1650 cm -1。H C -=γ是烯烃最具特征的峰,其位置约为1000-650 cm -1。 炔烃主要特征峰为H C C C H C -≡≡-≡γνν,,,其中H C -≡ν峰位在3333-3267cm -1 。C C ≡ν峰位在 2260-2100cm -1,是炔烃的高度特征峰。 9.如何在谱图上区别异丙基及叔丁基? 当两个或三个甲基连接在同一个C 上时,则吸收峰s CH 3 δ分裂为双峰。如果是异丙基,双峰分别 位于1385 cm -1和1375 cm -1左右,其峰强基本相等。如果是叔丁基,双峰分别位于1365 cm -1 和1395 cm -1左右,且1365 cm -1峰的强度约为1395 cm -1的两倍。 10.如何利用红外吸收光谱确定芳香烃类化合物? 利用芳香烃类化合物的主要特征峰来确定: 芳氢伸缩振动( =C-H ),3100~3000cm -1 (通常有几个峰) 泛频峰2000~1667cm -1 苯环骨架振动( c=c ),1650-1430 cm -1,~1600cm -1及~1500cm -1 芳氢面内弯曲振动(β=C-H ),1250~1000 cm -1 芳氢面外弯曲振动( =C-H ),910~665cm -1 14.试用红外吸收光谱区别羧酸、酯、酸酐。 羧酸的特征吸收峰为v OH 、v C=O 及OH 峰。v OH (单体)~3550 cm -1 (尖锐),v OH (二聚体)3400~2500(宽而散),v C=O (单体)1760 cm -1 (S),v as C=O (二聚体)1710~1700 cm -1 (S)。羧酸的 OH 峰位在955~915 cm -1 范围内为一宽谱带,其形状较独特。 酯的特征吸收峰为v C=O 、v c-o-c 峰,具体峰位值是:v C=O ~1735cm -1 (S);v c-o-c 1300~1000cm -1 (S)。v as c-o-c
红外吸收光谱分析
第三章红外吸收光谱分析 3.1概述 3.1.1红外吸收光谱的基本原理 红外吸收光谱法又称为分子振动转动光谱,属于分子光谱的范畴,是有机物结构分析的重要方法之一。当一定频率的红外光照射分子时,若分子中某个基团的振动频率和红外辐射的频率一致,两者产生共振,光的能量通过分子偶极矩的变化传递给分子,该基团就吸收了这个频率的红外光,产生振动能级跃迁;如果红外辐射的频率和分子中各基团的振动能级不一致,该频率的红外光将不被吸收。如果用频率连续变化的红外光照射某试样,分子将吸收某些频率的辐射,引起对应区域辐射强度的减弱,用仪器以吸收曲线的形式记录下来,就得到该试样的红外吸收光谱,稀溶液谱带的吸光度遵守Lambert-Beer定律。 图3-1为正辛烷的红外吸收光谱。红外谱图中的纵坐标为吸收强度,通常用透过率或吸光度表示,横坐标以波数或波长表示,两者互为倒数。图中的各个吸收谱带表示相应基团的振动频率。各种化合物分子结构不同,分子中各个基团的振动频率不同。其红外吸收光谱也不同,利用这一特性,可进行有机化合物的结构分析、定性鉴定和定量分析。 图3-1 正辛烷的红外光谱图 几乎所有的有机和无机化合物在红外光谱区均有吸收。除光学异构体,某些高分子量的高聚物以及一些同系物外,结构不同的两个化合物,它们的红外光谱一定不会相同。吸收谱带出现的频率位置是由分子振动能级决定,可以用经典力学(牛顿力学)的简正振动理论来说明。吸收谱带的强度则主要取决于振动过程中偶极矩的变化和能级跃迁的概率。也就是说,红外光谱中,吸收谱带的位置、形状和强度反映了分子结构的特点,而吸收谱带的吸收强度和分子组成或官能团的含量有关。
红外光谱习题答案解析
红外光谱习题 一. 选择题 1.红外光谱是(AE ) A :分子光谱 B :原子光谱 C :吸光光谱 D :电子光谱 E :振动光谱 2.当用红外光激发分子振动能级跃迁时,化学键越强,则(ACE ) A :吸收光子的能量越大 B :吸收光子的波长越长 C :吸收光子的频率越大 D :吸收光子的数目越多 E :吸收光子的波数越大 3.在下面各种振动模式中,不产生红外吸收的是(AC ) A :乙炔分子中对称伸缩振动 B :乙醚分子中不对称伸缩振动 C :CO 2分子中对称伸缩振动 D :H 2O 分子中对称伸缩振动 E :HCl 分子中H -Cl 键伸缩振动 4.下面五种气体,不吸收红外光的是(D ) A:O H 2 B:2CO C:HCl D:2N 5 分子不具有红外活性的,必须是(D ) A:分子的偶极矩为零 B:分子没有振动 C:非极性分子 D:分子振动时没有偶极矩变化 E:双原子分子 6.预测以下各个键的振动频率所落的区域,正确的是(ACD ) A:O-H伸缩振动数在4000~25001 -cm B:C-O 伸缩振动波数在2500~15001 -cm C:N-H 弯曲振动波数在4000~25001 -cm D:C-N 伸缩振动波数在1500~10001 -cm E:C ≡N 伸缩振动在1500~10001 -cm 7.下面给出五个化学键的力常数,如按简单双原子分子计算,则在红外光谱中波数最大者是(B ) A:乙烷中C-H 键,=k 510?达因1 -?cm B: 乙炔中C-H 键, =k 510?达因1 -?cm
C: 乙烷中C-C 键, =k 510?达因1 -?cm D: CH 3C ≡N 中C ≡N 键, =k 510?达因1 -?cm E:蚁醛中C=O 键, =k 510?达因1 -?cm 8.基化合物中,当C=O 的一端接上电负性基团则(ACE ) A:羰基的双键性增强 B:羰基的双键性减小 C:羰基的共价键成分增加 D:羰基的极性键成分减小 E:使羰基的振动频率增大 9.以下五个化合物,羰基伸缩振动的红外吸收波数最大者是(E ) A: B: C: D: E: 10.共轭效应使双键性质按下面哪一种形式改变(ABCD ) A:使双键电子密度下降 B:双键略有伸长 C:使双键的力常数变小 D.使振动频率减小 E:使吸收光电子的波数增加 11.下五个化合物羰基伸缩振动的红外吸收波数最小的是(E ) A: B: C: D: E: 12.下面四个化合物中的C=C 伸缩振动频率最小的是(D ) A: B: C: D: 13.两 个化合物(1) ,(2) 如用红外光谱鉴别,主要依 据的谱带是(C )
红外光谱特征峰解析常识
红外光谱特征峰解析常识 编写李炎平 红外特征光谱峰存在一定特征规律,正确的记录了化学结构和特征,识记特征波谱峰有助于我们解析红外光谱。下面我将一些特征波谱峰简要罗列如下,如有疏漏之处还望批评指出。 , 羟基:特征峰范围(3650~3200)cmˉ1,一般在 3600cmˉ1处有较强峰。 , 羧基:特征峰范围(3500~2500)cmˉ1,一般峰波 数小于羟基。 , 饱和烷烃—C—H :特征峰小于3000cmˉ1,一般在 (2950~2850)cm处,如有峰在(1390~1360)cmˉ1 处,则说明有—CH,如有峰在1450cmˉ1处,则说3 明有——, CH2 , 不抱和烷烃:特征峰大于3000cmˉ1,对于烯烃 _C,C,H在3050 cmˉ1处和(1600~1330)cmˉ1 ,C,C,H处有峰,对于炔烃在(3360~3250)cmˉ1 处有峰,在(700~600)cmˉ1处有枪宽峰。 C,C, 对于:在(1700~1645)cmˉ1处有特征峰,不 过不太明显,只具有指示作用。 ,CHO,,COC,,,COOC,, 对于在(1900~1600)cm处有强峰。 ,C,O,,,C,O,C,,,C,N,,,C,O,C,, 指纹区:等,在 (1330~900)cmˉ1处有中强峰, , 对于:在(900~400)cmˉ1处有中强或弱峰。 (CH)2n
, 对于醛类:特征范围为羰基峰+(2900~2700)cmˉ1。 , 对于:在(1300~900)cmˉ1处有两强峰(可,C,O,C, 能有一个弱峰)。 , 特征区范围(4400~1330)cmˉ1,指纹区范围(1330~400)cmˉ1。 , 通常将中红外光谱区域划分为四个部 分。 1)4000~2500cm-1,为含氢基团的伸 缩振动区,通常称为“氢键区”。 2)2500~2000cm-1叁键和累积双键区。 3)2000~1500cm-1,双键区。 4)小于1500cm-1,单键区。
