分子的立体构型(1)

新课标人教版选修三物质结构与性质
第二章分子结构与性质第二节分子的立体结构
第一课时
一、形形色色的分子
【投影展示】CO2、H2O 、NH3、CH2O 、CH4分子的球辊模型(或比例模型);
1、三原子分子
化学式结构式分子的立体结构模型分子的空间构型键角
直线形180°
V形105°2、四原子分子
化学式结构式分子的立体结构模型
平面三角形120°
三角锥形107°3、五原子分子
正四面体形109°28’4、其他分子
5、资料卡片CH3COOH C8H8
CH3OH C6H6
CH3CH2OH
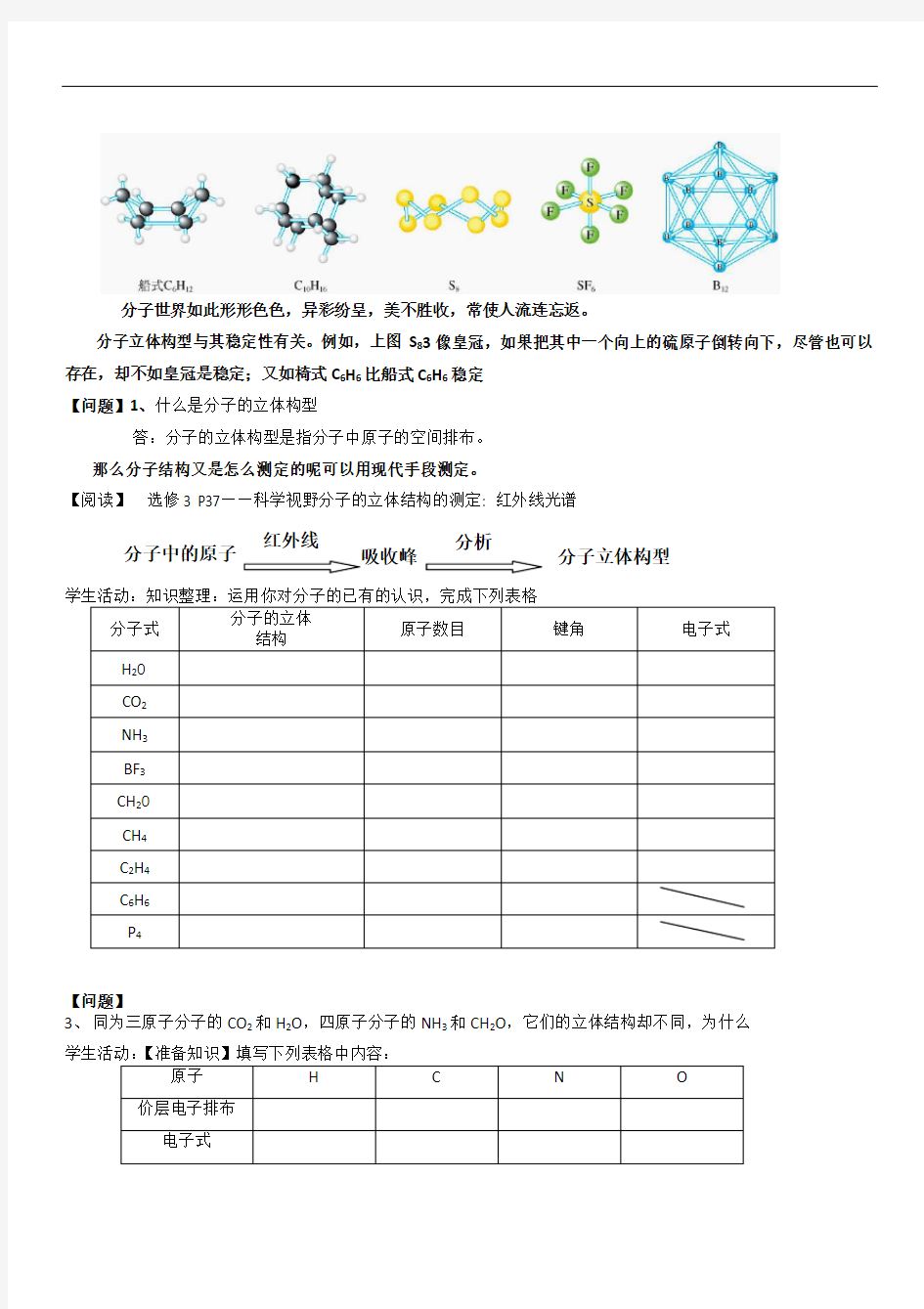
分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
分子立体构型与其稳定性有关。例如,上图S 83像皇冠,如果把其中一个向上的硫原子倒转向下,尽管也可以存在,却不如皇冠是稳定;又如椅式C 6H 6比船式C 6H 6稳定 【问题】1、什么是分子的立体构型
答:分子的立体构型是指分子中原子的空间排布。
那么分子结构又是怎么测定的呢可以用现代手段测定。
【阅读】 选修3 P37——科学视野分子的立体结构的测定: 红外线光谱
分子式 分子的立体
结构
原子数目 键角
电子式 H 2O CO 2 NH 3 BF 3 CH 2O CH 4 C 2H 4 C 6H 6 P 4
【问题】
3、 同为三原子分子的CO 2和H 2O ,四原子分子的NH 3和CH 2O ,它们的立体结构却不同,为什么 原子 H
C N O 价层电子排布
电子式
分子中的原子
分子立体构型
红外线
分析
二、价层电子对互斥模型(VSEPR 模型) 1、价层电子对互斥模型:
1940年美国的Sidgwick NV 等人相继提出了价层电子对互斥理论,简称VSEPR 法,该法适用于主族元素间形成的ABn 型分子或离子。
该理论认为:一个共价分子或离子中,中心原子A 周围所配置的原子B (配位原子)的几何构型,主要决定于中
心原子的价电子层中各电子对间的相互排斥作用。
a:中心原子的价电子数(最外层电子数)
① 对于阳离子价电子数=最外层电子数-电荷数 ② 对于阴离子价电子数=最外层电子数+电荷数
x :与中心原子相结合的原子数
b :与中心原子相结合的原子能得到的电子数
例如:CO 2: CO 2 孤电子对=1/2(4-2×2) =0
H 2O : O 上孤电子对数=1/2(6 -2×1) =2 CO 32-: C 上孤电子对数=1/2(4 +2 -3×2) =0
学生活动:填写下表内容
分子真实 构型 中心原子上孤电子对=1/2(a -x b)
分子或离子中的价层电子对在空间的分布(即含孤电子对的VSEPR模型)
2 3 4 5 6
直线形平面三角形四面体形三角双锥体形八面体形
2、分子或离子的立体构型与VSEPR模型关系
由于中心原子的孤对电子占有一定的空间,对其他成键电子对存在排斥力,影响其分子的空间结构。【例1】下列分子或离子的中心原子,带有一对孤对电子的是…………………………()
A、CCl4
B、BeCl2
C、CH4
D、PCl3
分子式电子式
中心
原子
中心原子价层
电子对数
中心原子价层孤
电子对数
中心原子结合原
子数
H2O
CO2
NH3
CH4
CH2O
分子或
离子
中心原子上孤
电子对数
分子或离子的价
层电子对数
VSEPR
模型
分子或离子的立
体构型
BF3
03
规律:若中心原子孤电子对数为0,则VSEPR模型与分子立体构型一致,
若孤电子对数不为0,则二者不一致
①中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数来预测
②中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排。
如H2O和NH3中心原子上分别有、对孤对电子也要占据中心原子周围的空间,并参与互相排斥。因而H2O分子呈型,NH3分子呈型。
【例2】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是()
A、SO2为直线形
B、NH4+为正四面体形
C、HCN为平面三角形
D、BF3为三角锥形
【例
化学式
中心
原子
中心原子孤
对电子对数
中心原子结
合的原子数
空间构型化学式
中心
原子
中心原子孤对
电子对数
中心原子结
合的原子数
空间构型NH4+
04
SO32-
14
AB n立体结构范例
n=2
n=3
n=4
n=5
n=6
【例4】用价层电子对互斥模型推测下列分子或离子的空间构型。
SCl 2 SO 32- SF 6 Cl 2O 【练习】课时训练3—4页 1、VSEPR 模型
结合CH 4 、CH 2O 的立体结构的球棍模型理解VSEPR 模型(重点是从键角的角度理解价层电子对的相互排斥) 2、分类
第一类:中心原子的价层电子对全部为成键电子对。如:CH 4
排斥力:价层电子对相同,排斥力相同; 价层电子对不同,叁键>双键>单键 判断方法: AB
n 分子的立体结构
n = 2 n =3 n = 4
第二类:中心原子的价层电子对中除了成键电子对,还有孤对电子对,如:H 2O
排斥力:孤对电子对与孤对电子对>孤对电子对与成键电子对>成键电子对与成键电子对 判断方法:根据中心原子的孤对电子对的数目及中心原子结合的原子的数目确定。
应用反馈:
1
