2018高考化学大一轮学考复习考点突破第八章水溶液中的离子平衡第26讲弱电解质的电离平衡检测新人教版

第八章水溶液中的离子平衡第26讲弱电解质的电离平衡
考纲要求 1.了解电解质的概念,了解强电解质和弱电解质的概念。2.理解电解质在水中的电离以及电解质溶液的导电性。3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算
考点一弱电解质的电离平衡
1.弱电解质
(1)概念
(2)与化合物类型的关系
强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。2.弱电解质的电离平衡
(1)电离平衡的建立
在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的特征
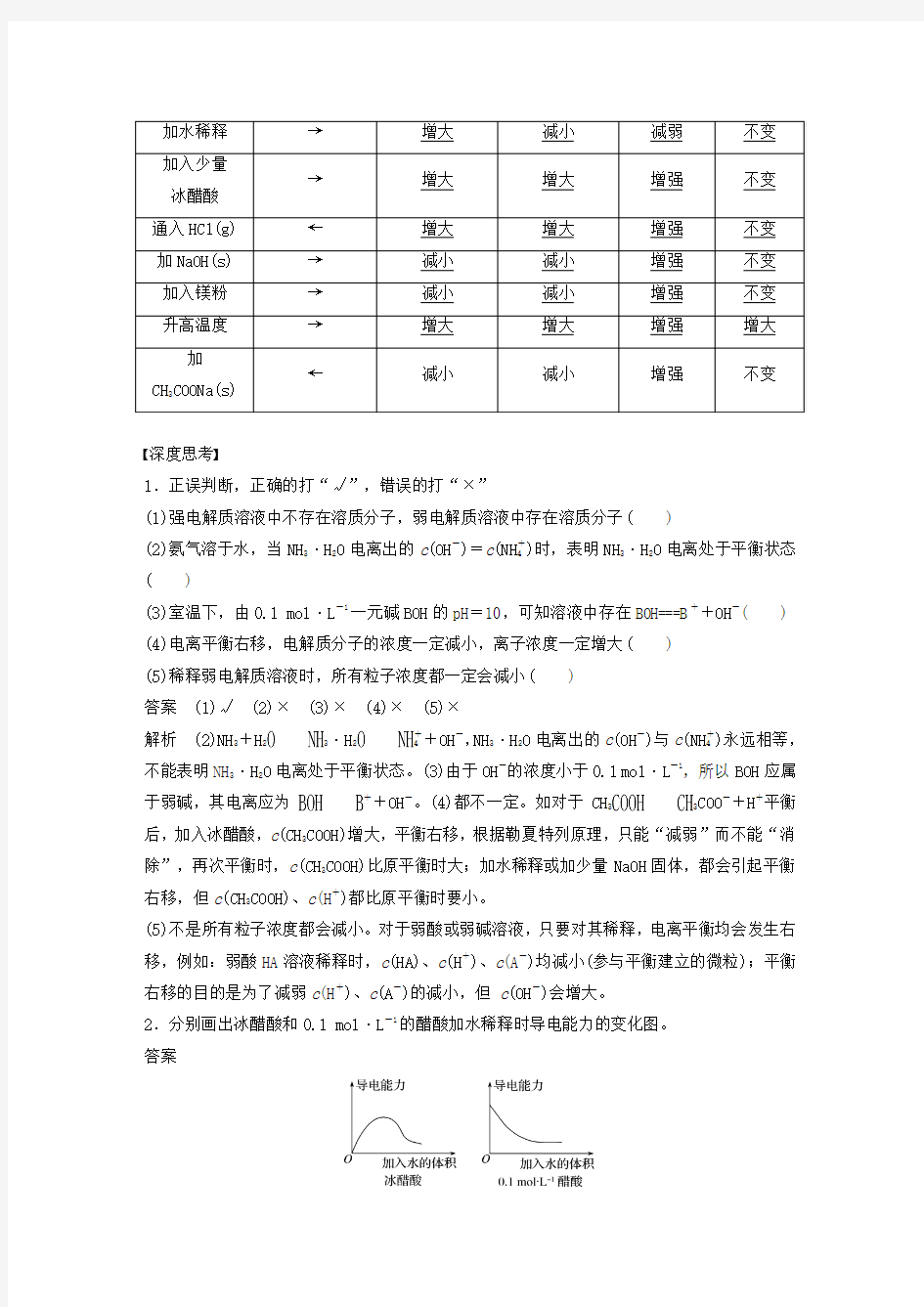
(3)外界条件对电离平衡的影响
内因:由弱电解质本身的结构或性质决定,电解质越弱,其电离程度越小。
3.以0.1 mol·L-1 CH3COOH溶液为例,填写外界条件对CH33COO-+H+ΔH>0的影响。
CH3++CH3COO-ΔH>0
深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)强电解质溶液中不存在溶质分子,弱电解质溶液中存在溶质分子( )
(2)氨气溶于水,当NH3·H2O电离出的c(OH-)=c(NH+4)时,表明NH3·H2O电离处于平衡状态( )
(3)室温下,由0.1 mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH===B++OH-( )
(4)电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大( )
(5)稀释弱电解质溶液时,所有粒子浓度都一定会减小( )
答案(1)√(2)×(3)×(4)×(5)×
解析(2)NH3+H23·H2+4+OH-,NH3·H2O电离出的c(OH-)与c(NH+4)永远相等,不能表明NH3·H2O电离处于平衡状态。(3)由于OH-的浓度小于0.1 mol·L-1,所以BOH应属于弱碱,其电离应为++OH-。(4)都不一定。如对于CH33COO-+H+平衡后,加入冰醋酸,c(CH3COOH)增大,平衡右移,根据勒夏特列原理,只能“减弱”而不能“消除”,再次平衡时,c(CH3COOH)比原平衡时大;加水稀释或加少量NaOH固体,都会引起平衡右移,但c(CH3COOH)、c(H+)都比原平衡时要小。
(5)不是所有粒子浓度都会减小。对于弱酸或弱碱溶液,只要对其稀释,电离平衡均会发生右移,例如:弱酸HA溶液稀释时,c(HA)、c(H+)、c(A-)均减小(参与平衡建立的微粒);平衡右移的目的是为了减弱c(H+)、c(A-)的减小,但c(OH-)会增大。
2.分别画出冰醋酸和0.1 mol·L-1的醋酸加水稀释时导电能力的变化图。
答案
题组一 改变条件,平衡移动,判结果变化
1.将浓度为0.1 mol·L -1
HF 溶液加水不断稀释,下列各量始终保持增大的是( ) A .c (H +
)
B .K a (HF)
C.c F -c +
D.c +
c
答案 D
解析 HF 为弱酸,存在电离平衡:
+
+F -
。根据勒夏特列原理:当改变影响平衡的一
个条件,平衡会向着能够减弱这种改变的方向移动,但平衡的移动不能完全消除这种改变,故加水稀释,平衡正向移动,但c (H +
)减小,A 错误;电离平衡常数只受温度的影响,温度不变,电离平衡常数K a 不变,B 错误;当溶液无限稀释时,c (F -
)不断减小,但c (H +
)接近10
-7
mol·L -1
,所以
c
-c
+
减小,C 错误;
c
+
c
=n +
n
,由于加水稀释,平衡正向移动,
所以溶液中n (H +
)增大,n (HF)减小,所以
c
+
c
增大,D 正确。
2.H 2S 水溶液中存在电离平衡H 2
+
+HS -
和HS -
+
+S 2-
。若向H 2S 溶液中 ( )
A .加水,平衡向右移动,溶液中氢离子浓度增大
B .通入过量SO 2气体,平衡向左移动,溶液pH 值增大
C .滴加新制氯水,平衡向左移动,溶液pH 值减小
D .加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 答案 C
解析 加水促进电离,但氢离子浓度减小,A 错误;B 项发生反应2H 2S +SO 2===3S↓+2H 2O ,当SO 2过量时溶液显酸性,而且酸性比H 2S 强,pH 值减小,错误;滴加新制氯水,发生反应Cl 2+H 2S===2HCl +S↓,平衡向左移动,溶液pH 值减小,C 项正确;加入少量硫酸铜固体,发生反应H 2S +Cu 2+
===CuS↓+2H +
, H +
浓度增大,D 项错误。 题组二 平衡移动,结果变化,判采取措施 3.稀氨水中存在着下列平衡:NH 3·H 2
+4
+OH -
,若要使平衡向逆反应方向移动,同时
使c (OH -
)增大,应加入的物质或采取的措施是( ) ①NH 4Cl 固体 ②硫酸 ③NaOH 固体 ④水 ⑤加热 ⑥加入少量MgSO 4固体 A .①②③⑤ B .③⑥ C .③ D .③⑤
答案 C
解析 若在氨水中加入NH 4Cl 固体,c (NH +
4)增大,平衡向逆反应方向移动,c (OH -
)减小,①不合题意;硫酸中的H +
与OH -
反应,使c (OH -)减小,平衡向正反应方向移动,②不合题意;
当在氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,③符合题意;若在氨水中加入水,稀释溶液,平衡向正反应方向移动,但c(OH-)减小,④不合题意;电离属吸热过程,加热平衡向正反应方向移动,c(OH-)增大,⑤不合题意;加入少量MgSO4固体发生反应Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小,⑥不合题意。
4.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH33COO-+H+,要使溶液中c(H +)/c(CH
3COOH)的值增大,可以采取的措施是( )
①加少量烧碱溶液②升高温度③加少量冰醋酸
④加水
A.①② B.①③ C.②④ D.③④
答案 C
解析本题中提供的四种措施都会使醋酸的电离平衡正向移动,但①③会使c(H+)/c(CH3COOH)的值减小。
题组三导电性变化曲线分析
5.(2016·北京理综,11)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
答案 C
解析试题所涉及的化学方程式为向Ba(OH)2溶液中滴入H2SO4溶液:Ba(OH)2+H2SO4===BaSO4↓+2H2O(反应ⅰ);向Ba(OH)2溶液中滴入NaHSO4溶液:Ba(OH)2+NaHSO4===BaSO4↓+NaOH+H2O(反应ⅱ),NaOH+NaHSO4===Na2SO4+H2O(反应ⅲ)。 A项,由题图可知曲线①在a点溶液导电能力最低,说明此时溶液中离子浓度最小,当Ba(OH)2和H2SO4完全反应时生成BaSO4沉淀,此时溶液导电能力最低,故反应ⅰ符合,正确;B项,曲线②中b点进行的反应是反应ⅱ,溶液中含有Ba(OH)2与NaHSO4反应生成的NaOH,正确;C项,c点曲线①表示Ba(OH)2已经完全反应,并剩余H2SO4,溶液显酸性,c点曲线②表示NaOH与NaHSO4反应,且NaOH还有剩余,故溶液中含有反应ⅲ生成的Na2SO4和剩余的NaOH,溶液显碱性,所以c点两溶液中含有OH-的量不相同,错误;D项,a点为Ba(OH)2和 H2SO4完全反应时生成BaSO4沉淀,溶液呈中性,d点溶液中溶质只有Na2SO4,溶液也呈中性,正确。
6.电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图
中,能正确表示用NH 3·H 2O 溶液滴定HCl 和CH 3COOH 混合溶液的滴定曲线的是( )
答案 D
解析 HCl 为强电解质,CH 3COOH 为弱电解质,滴加NH 3·H 2O ,先与HCl 反应,生成同样为强电解质的NH 4Cl ,但溶液体积不断增大,溶液稀释,所以电导率下降。当HCl 被中和完后,继续与CH 3COOH 弱电解质反应,生成CH 3COONH 4,为强电解质,所以电导率增大。HCl 与CH 3COOH 均反应完后,继续滴加弱电解质NH 3·H 2O ,电导率变化不大,因为溶液被稀释,有下降趋势。
考点二 电离平衡常数
1.表达式
(1)一元弱酸HA 的电离常数:根据+
+A -
,可表示为K a =
c -
c
+
c
。
(2)一元弱碱BOH 的电离常数:根据+
+OH -
,可表示为K b =c
+
c -
c
。
2.意义
相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。 3.特点
电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K 增大。多元弱酸是分步电离的,各级电离常数的大小关系是K 1?K 2……,所以其酸性主要决定于第一步电离。 4.影响因素
5.有关电离平衡常数的计算(以弱酸HX 为例) (1)已知c (HX)和c (H +
),求电离平衡常数。
HX
H +
+ X -
起始: c (HX) 0 0 平衡: c (HX)-c (H +
) c (H +
) c (X -
)
则:K =
c
+
c -c
-c
+
=
c 2
+
c
-c
+
由于弱酸只有极少一部分电离,c (H +
)的数值很小,可做近似处理:c (HX)-c (H +
)≈c (HX),
则K =
c 2
+
c
,代入数值求解即可。
(2)已知c (HX)和电离平衡常数,求c (H +
)。
HX
H +
+ X -
起始: c (HX) 0 0 平衡: c (HX)-c (H +
) c (H +
) c (X -
)
则:K =
c
+
c -c
-c
+
=
c 2
+
c
-c
+
由于c (H +
)的数值很小,可做近似处理:c (HX)-c (H +
)≈c (HX),则c (H +
)=K ·c ,
代入数值求解即可。 深度思考
1.正误判断,正确的打“√”,错误的打“×”
(1)弱电解质的电离平衡右移,电离平衡常数一定增大( )
(2)电离常数大的酸溶液中的c (H +
)一定比电离常数小的酸溶液中的c (H +
)大( ) (3)对于0.1 mol·L -1
的氨水,加水稀释后,溶液中c (NH +
4)·c (OH -
)变小( ) (4)向CH 3COOH 溶液中滴加相同浓度的氨水,
c
+4
c 3
·H 2
先增大再减小( )
(5)室温下,向10 mL pH =3的醋酸溶液中加水稀释后,溶液中c
3
COO
-
c 3
c
-
不变
( )
答案 (1)× (2)× (3)√ (4)× (5)√ 2.H 2CO 3的电离平衡常数K a1=4.3×10-7
,K a2=5.6×10
-11
,它的K a1、K a2差别很大的原因
(从电离平衡的角度解释)。 答案 第一步电离产生的H +
对第二步的电离起抑制作用
按要求书写离子方程式:
(1)将少量Na 2CO 3溶液滴加到HCOOH 溶液中 2HCOOH
+CO 2-
3===2HCOO -
+H 2O +CO 2↑。 (2)将少量CO 2气体通入NaClO 溶液中 ClO -
+CO 2+H 2O===HClO +HCO -
3。 (3)将少量CO 2气体通入到Na 2S 溶液中 CO 2+H 2O +S 2-
===HS -
+HCO -
3。
题组一 有关电离常数的定性分析
1.25 ℃时,部分物质的电离平衡常数如表所示:
(1)CH 3COOH 、H 2CO 3、HClO 的酸性由强到弱的顺序为 。 (2)同浓度的CH 3COO -
、HCO -
3、CO 2-
3、ClO -
结合H +
的能力由强到弱的顺序为 。 (3)体积为10 mL pH =2的醋酸溶液与一元酸HX 分别加水稀释至1 000 mL ,稀释过程中pH 变化如图所示,则HX 的电离平衡常数
(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是
。 答案 (1)CH 3COOH>H 2CO 3>HClO (2)CO 2-
3>ClO -
>HCO -
3>CH 3COO -
(3)大于 稀释相同倍数,HX 的pH 变化比CH 3COOH 的pH 变化大,酸性强,电离平衡常数大 解析 电离平衡常数越大,酸性越强,电离平衡常数越小,其对应酸根离子结合H +
能力越强。(3)根据图像分析知,起始时两种溶液中c (H +
)相同,故c (较弱酸)>c (较强酸),稀释过程中较弱酸的电离程度增大的多,故在整个稀释过程中较弱酸的c (H +
)一直大于较强酸的c (H
+
),稀释相同倍数,HX 的pH 变化比CH 3COOH 的大,故HX 酸性强,电离平衡常数大。
题组二 有关电离常数的定量计算
2.0.1 mol·L -1
醋酸溶液中,存在电离平衡CH 3
+
+CH 3COO -
。经测定溶液中c (CH 3COO
-
)为1.4×10-3
mol·L -1
,此温度下醋酸的电离常数K a = 。
答案 1.96×10-5
解析
CH
3 CH 3COO -+H +
起始-1
0 0 平衡
-1
1-1.4×10-3
1.4×10-3
1.4×10-3
K =
c
3
COO
-
c
+c
3
=
-320.1-1.4×10
-3
≈
-32
0.1
=1.96×10-5
。
3.碳氢化合物完全燃烧生成CO 2和H 2O 。常温常压下,空气中的CO 2溶于水,达到平衡时,溶液的pH =5.60,c (H 2CO 3)=1.5×10-5
mol·L -1
。若忽略水的电离及H 2CO 3的第二级电离,则H 2CO 3
-3
+H +的平衡常数K 1= 。(已知:10
-5.60
=2.5×10-6
)
答案 4.2×10-7
解析 H 2CO 3
+
+HCO -
3
K 1=
c
+
c
-3
c 2
CO
3
=10-5.60×10-5.60
1.5×10
-5
≈4.2×10-7。 考点三 强酸(碱)与弱酸(碱)的比较
一元强酸与一元弱酸的比较
深度思考
改变下列条件,请在横线上写出下列曲线代表哪种酸的变化曲线。
(1)相同体积、相同浓度的盐酸和醋酸
①加入足量的Zn,V(H2)与时间的变化曲线
答案(从上到下)盐酸醋酸
②加水稀释,pH变化的曲线
答案(从上到下)醋酸盐酸
(2)相同体积相同pH的盐酸和醋酸
①加入足量的Zn,V(H2)与时间的变化曲线
答案(从上到下)醋酸盐酸
②加水稀释,pH变化的曲线
答案(从上到下)盐酸醋酸
题组一强酸与弱酸的多角度比较
1.在一定温度下,有a.盐酸b.硫酸c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 (用字母表示,
下同)。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是。
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为,反应所需时间的长短关系是。
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。(7)将c(H+)相同体积相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH 溶液的体积大小关系为。
答案(1)b>a>c (2)b>a=c (3)c>a>b (4)c>a=b (5)a=b=c a=b>c (6)c>a=b (7)c>a=b
解析解答本题要注意以下三点:①HCl、H2SO4都是强酸,但H2SO4是二元酸;②CH3COOH是弱酸,在水溶液中不能完全电离;③醋酸溶液中存在CH33COO-+H+的电离平衡。2.现有室温下四种溶液,有关叙述不正确的是( )
B.②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.分别加水稀释10倍,四种溶液的pH ①>②>④>③
D.V1L ④与V2L ①混合,若混合后溶液pH=7,则V1<V2
答案 D
解析醋酸钠溶液显碱性,所以A正确,也可以从平衡移动角度分析,CH3COONa电离出的CH3COO-:a.与盐酸中的H+结合生成CH3COOH;b.使醋酸中平衡CH33COO-+H+左移,两溶液中H+浓度均减小,所以pH均增大;假设均是强酸强碱,且物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,c(H+)>c(OH-),B正确;分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,但稀释氨水使平衡NH3·H2+4+OH-右移,使①pH>10,同理醋酸稀释后pH<4,所以C正确;假设均是强酸强碱,混合后溶液呈中性,V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要的①氨水少,即V1>V2,D错误。
假设法进行有关量的大小比较
在做有关强酸、弱酸、强碱、弱碱的题目时,可以先假设所给物质全部是强电解质,再在此基础上结合电离平衡移动原理进行分析。如第2题中的C选项,分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,然后再根据平衡移动原理进行分析;再如D选项,假设均是强酸强碱,则V1=V2,然后再根据弱碱的电离平衡及浓度进行分析。
题组二一强一弱比较的图像分析
3.相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
答案 C
解析强酸完全电离,中强酸部分电离,随着反应的进行,中强酸会继续电离出H+,所以溶液②产生氢气的体积多,在相同时间内,②的反应速率比①快。
4.pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为V x、V y,则( )
A.x为弱酸,V x<V y B.x为强酸,V x>V y
C.y为弱酸,V x<V y D.y为强酸,V x>V y
答案 C
解析由图知:将一元酸x和y分别稀释10倍,pH的变化量ΔpH x=1,ΔpH y<1,所以x 为强酸,y为弱酸。pH=2时弱酸y的浓度大,滴加NaOH溶液至pH=7时消耗NaOH溶液的体积y比x大。
题组三弱电解质的判断方法
5.为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 mol·L -1醋酸溶液、0.1 mol·L-1盐酸、pH=3的盐酸、pH=3的醋酸、CH
3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。
(1)甲取出10 mL 0.1 mol·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是,理由是
。
(2)乙分别取pH=3的醋酸和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别
测定两溶液的pH ,则可认定醋酸是弱电解质,判断的依据是 。 (3)丙分别取pH =3的盐酸和醋酸各10 mL ,然后加入质量相同的锌粒,醋酸放出H 2的速率快,
则认定醋酸是弱电解质,你认为这一方法正确吗? ,请说明理由: 。 (4)丁用CH 3COONa 晶体、NaCl 晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该
同学的实验操作和现象是 。 答案 (1)a >1 因醋酸是弱酸,不能完全电离 (2)盐酸的pH =5,醋酸的pH <5 (3)正确 由于醋酸是弱酸,随着反应的进行,醋酸不断电离,c (H +
)变化小,产生H 2的速率醋酸比盐酸快 (4)将CH 3COONa 晶体、NaCl 晶体分别溶于适量水配成溶液,再分别滴入酚酞溶液,CH 3COONa 溶液变浅红色,NaCl 溶液不变色
判断弱电解质的三个思维角度
角度一:弱电解质的定义,即弱电解质不能完全电离,如测0.1 mol·L -1
的CH 3COOH 溶液的pH>1。
角度二:弱电解质溶液中存在电离平衡,条件改变,平衡移动,如pH =1的CH 3COOH 加水稀释10倍后,1<pH <2。
角度三:弱电解质形成的盐类能水解,如判断CH 3COOH 为弱酸可用下面两个现象: (1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞溶液。现象:溶液变为浅红色。 (2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH 试纸上,测其pH 。现象:pH>7。
1.正误判断,正确的打“√”,错误的打“×” (1)向0.1 mol·L -1
CH 3COOH 溶液中加入少量水,溶液中
c
+
c
3
减小 ( ) (2016·全国卷Ⅲ,13A)
(2)向盐酸中加入氨水至中性,溶液中
c +4c
-
>1 ( )
(2016·全国卷Ⅲ,13C)
(3)稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
( )
(2015·重庆理综,3A)
(4)25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液的pH =7 ( )
(2015·重庆理综,3B)
(5)25 ℃时,0.1 mol·L -1
的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
( )
(2015·重庆理综,3C)
答案 (1)× (2)× (3)× (4)× (5)√
2.(2015·全国卷Ⅰ,13)浓度均为0.10 mol·L -1
、体积均为V 0的MOH 和ROH 溶液,分别加水稀释至体积V ,pH 随lg V V 0
的变化如图所示。下列叙述错误的是( )
A .MOH 的碱性强于ROH 的碱性
B .ROH 的电离程度:b 点大于a 点
C .若两溶液无限稀释,则它们的c (OH -
)相等
D .当lg V V 0=2时,若两溶液同时升高温度,则
c
+c
+
增大
答案 D
解析 A 项,0.10 mol·L -1
的MOH 和ROH ,前者pH =13,后者pH 小于13,说明前者是强碱,后者是弱碱,正确;B 项,ROH 是弱碱,加水稀释,促进电离,b 点电离程度大于a 点,正确;C 项,两碱溶液无限稀释,溶液近似呈中性,c (OH -
)相等,正确;D 项,由MOH 是强碱,在溶液中完全电离,所以c (M +
)不变,ROH 是弱碱,升高温度,促进电离平衡
+
+OH
-
向右进行,c (R +
)增大,所以
c
+c
+
减小,错误。
3.(2015·海南,11)下列曲线中,可以描述乙酸(甲,K a =1.8×10-5
)和一氯乙酸(乙,K a =1.4×10-3
)在水中的电离度与浓度关系的是( )
答案 B
解析根据甲、乙的电离平衡常数得,这两种物质都是弱电解质,在温度不变、浓度相等时,电离程度CH3COOH<CH2ClCOOH,可以排除A、C;当浓度增大时,弱电解质的电离程度减小,排除D选项,故B项正确。
4.[2014·新课标全国卷Ⅰ,27(1)(2)③](1)H3PO2是一元中强酸,写出其电离方程式:
。
(2)③NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”、“中性”或“弱碱性”)。
答案(1)H3PO2H++H2PO-2
(2)正盐弱碱性
解析(1)因为H3PO2是一元中强酸,只有部分发生电离,电离方程式为H3PO2H++H2PO-2。
(2)③根据H3PO2是一元中强酸,可以判断NaH2PO2是正盐,属于弱酸强碱盐,因H2PO-2水解而使溶液呈弱碱性。
5.[2015·海南,16(1)]氨是合成硝酸、铵盐和氮肥的基本原料。回答下列问题:
氨的水溶液显弱碱性,其原因为
(用离子方程式表示);
0.1 mol·L-1的氨水中加入少量NH4Cl固体,溶液的pH (填“升高”或“降低”);若加入少量明矾,溶液中NH+4的浓度 (填“增大”或“减小”)。
答案NH3·H2+4+OH-降低增大
1.下列关于电解质的叙述正确的是( )
A.电解质溶液的浓度越大,其导电性能一定越强
B.强酸和强碱一定是强电解质,不管其水溶液浓度的大小,都能完全电离
C.强极性共价化合物不一定都是强电解质
D.多元酸、多元碱的导电性一定比一元酸、一元碱的导电性强
答案 C
解析A、D项,导电性取决于离子浓度及所带电荷数的多少,错误;C项,HF是强极性共价化合物,但是弱电解质。
2.0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大②c(NH3·H2O)增大③NH+4数目增多④c(OH-)增大⑤导电性增强
⑥
c+4
c3·H2
增大
A.①②③ B.①③⑤
C.①③⑥ D.②④⑥
答案 C
解析NH3·H2O是弱电解质,加水稀释电离程度增大,c(NH3·H2O)减小,NH+4和OH-的数目增多,但c(OH-)、c(NH+4)减小;导致溶液的导电性减弱;由于加水稀释,电离平衡向右移动,
故
c+4
c3·H2
增大。
3.(2016·邢台期末)常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH33COO-+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减少
D.加入少量pH=5的硫酸,溶液中c(H+)增大
答案 C
解析加入水稀释,使醋酸的电离平衡向右移动,但CH3COOH电离常数不变,A项错误;加入少量CH3COONa固体,c(CH3COO-)增大,使醋酸的电离平衡向左移动,B项错误;加入的少量NaOH固体与H+中和,c(H+)减小,使醋酸的电离平衡向右移动,C项正确;加入少量pH =5的硫酸,溶液中c(H+)不变,D项错误。
4.对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,有关叙述正确的是( )
A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小
B.使温度升高20 ℃,两溶液的氢离子浓度不变
C.加水稀释2倍,两溶液的氢离子浓度增大
D.加足量的Zn充分反应后,两溶液中产生的氢气一样多
答案 A
解析醋酸和盐酸c(H+)相同,CH3COOH溶液中存在着电离平衡:CH33COO-+H+,加入少量CH3COONa晶体,平衡向逆反应方向移动,溶液中c(H+)减小,而盐酸则和CH3COONa 反应生成弱电解质CH3COOH,c(H+)减小;升温,促进CH3COOH电离,c(H+)增大,盐酸挥发,溶质减少,c(H+)减小;加水稀释,CH3COOH的电离平衡向正反应方向移动,稀释相同倍数后两溶液的c(H+)不相同,醋酸中的c(H+)大于盐酸中的c(H+),但c(H+)均减小;由于醋酸和盐酸的c(H+)相同,而醋酸为弱酸,所以c(CH3COOH)大于c(HCl),加入足量的锌,由于CH3COOH
浓度大,随着反应的进行,CH 3COOH 继续电离产生H +
,因此产生的氢气多。
5.25 ℃时,向盛有50 mL pH =2的HA 溶液的绝热容器中加入pH =13的NaOH 溶液,加入NaOH 溶液的体积(V )与所得混合溶液的温度(T )的关系如图所示。下列叙述正确的是( )
A .HA 溶液的物质的量浓度为0.01 mol·L -1
B .b→c 的过程中,温度降低的主要原因是溶液中发生了吸热反应
C .a→b 的过程中,混合溶液中可能存在:c (A -
)=c (Na +
) D .25 ℃ 时,HA 的电离平衡常数K 约为1.43×10-2
答案 C
解析 恰好中和时混合溶液温度最高,即b 点,此时消耗氢氧化钠0.004 mol ,得出HA 的浓度为0.08 mol·L -1
,故A 错误;b→c 的过程中,温度降低的主要原因是溶液中反应已完全,继续滴加温度较低的氢氧化钠溶液,使混合液温度降低,故B 错误;NaA 呈碱性,HA 呈酸性,a→b 的过程中,混合溶液中可能呈中性,存在:c (A -
)=c (Na +
),故C 正确;电离平衡常数
K =
c
+
c
-
c
=0.01×0.01÷(0.08-0.01)=1.43×10-3
,故D 错误
6.电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L -1
NH 3·H 2O 滴定10 mL 浓度均为0.100 mol·L -1
HCl 和CH 3COOH 的混合液,电导率曲线如图所示。下列说法正确的是( )
A .①溶液中c (H +
)为0.200 mol·L -1
B .溶液温度高低为①>③>②
C .③点溶液中有c (Cl -
)>c (CH 3COO -
) D .③点后因离子数目减少使电导率略降低 答案 C
解析 醋酸为弱电解质,①点溶液c (H +
)<0.2 mol·L -1
,故A 错误;酸碱中和反应放热,①点溶液的温度一定比②点的低,故B 错误;③恰好完全反应生成氯化铵和醋酸铵。其中NH +
4
和CH 3COO -
发生微弱水解,则③点溶液中,c (NH +
4)>c (Cl -
)>c (CH 3COO -
),故C 正确;③点后,
溶液中离子浓度减小导致电导率降低,故D错误。
7.(2016·大连双基测试)下列有关电解质溶液的说法正确的是( )
A.0.1 mol·L-1的醋酸加水稀释后,溶液中所有离子的浓度均减小
B.分别向同体积、同pH的醋酸和盐酸中加入足量锌粉,两者产生H2的体积一样多
C.向水中加入少量NaHSO4固体,c(H+)=c(SO2-4)+c(OH-)
D.将V1 L pH=11的NaOH溶液与V2 L pH=3的HA溶液混合,溶液显中性,则V1≤V2
答案 C
解析稀醋酸加水稀释,c(H+)减小,则c(OH-)增大,A项错误;pH相同,c(H+)相同,但c(CH3COOH)>c(HCl),加入足量锌,醋酸产生的H2多,B项错误;NaHSO4溶液,由电荷守恒有c(Na+)+c(H+)=2c(SO2-4)+c(OH-),由物料守恒有c(Na+)=c(SO2-4),得c(H+)=c(SO2-4)+c(OH-),C项正确;若HA为强酸,则V1=V2,若HA为弱酸,两者等体积混合,由于酸过量,溶液呈酸性,现在溶液呈中性,说明V2≤V1,D项错误。
8.25 ℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。下列说法正确的是( )
A.同浓度的NaA与NaB溶液中,c(A-) 小于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA的酸性强于HB
答案 D
解析pH相同的酸,稀释相同倍数时,酸性强的pH变化大,酸性较弱的pH变化小,据此得出酸性:HA>HB,故D项正确;A项,根据“越弱越水解”的规律,可知A-的水解程度小于B-的水解程度,故同浓度的NaA与NaB溶液中,c(A-) 大于c(B-),错误; B项,在这两种酸溶液中,c(H+)≈c(A-),c(H+)≈c(B-),而a点的c(H+)小于b点的c(H+),故a点的c(A -)小于b点的c(B-),即a点的离子浓度小于b点的离子浓度,故a点的导电能力小于b点的导电能力,错误; C项,在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度:c(HA)<c(HB),故将溶液稀释相同倍数时,酸的浓度仍有:c(HA)<c(HB),错误。
9.现有体积相等且等pH或等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁粉,产生H2的体积(同温同压下测定)随时间的变化示意图如下:
其中正确的是( )
A.①③ B.②④ C.①②③④ D.都不对
答案 D
解析随着反应的进行,V(H2)只可能增大而不可能减小,①③错误;当两溶液等pH时,醋酸的物质的量浓度要比盐酸大得多,与足量的镁粉反应时,不仅产生的氢气体积更大,反应速率更快,而且反应的时间更长,②错误;等物质的量浓度时,醋酸中c(H+)在反应完全之前都比盐酸中的小,因此醋酸中的反应速率应该比盐酸中的反应速率小,完全反应时产生相同体积的氢气,盐酸所用时间比醋酸短,④错误。
10.常温下,pH相差1的两种一元碱A溶液和B溶液,分别加水稀释,溶液的pH变化如图所示。下列说法正确的是( )
A.稀释前两溶液中H+浓度的大小关系:A=10B
B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol·L-1
C.取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗硫酸溶液的体积相等
D.用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7
答案 D
11.某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。根据图像判断错误的是( )
A.a值一定大于9
B.Ⅱ为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀H2SO4的体积V(NaOH)<V(氨水) 答案 C
解析根据题给图像可知,开始二者pH相同,在稀释过程中促进氨水的电离,则氨水的pH 变化较小,即Ⅱ为氨水稀释时溶液的pH变化曲线,pH=11的氢氧化钠溶液稀释100倍时,pH变为9。所以,pH=11的氨水溶液稀释100倍时,pH减小不到9,即a一定大于9,A、B 都正确;C项,碱溶液中分析水的电离即判断溶液中氢离子浓度大小,稀释后氨水的pH大于NaOH溶液的pH,氨水中水的电离程度比NaOH溶液中水的电离程度小,错误;D项,根据题给图像可知,开始二者pH相同,一水合氨为弱电解质,氢氧化钠为强电解质,pH相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大于氢氧化钠溶液的物质量浓度,加水稀释相同的倍数,氨水的物质的量浓度仍较大,完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水),正确。
12.根据下表提供的数据,判断下列离子方程式或化学方程式正确的是( )
A.向Na2CO33222
B.向NaHCO3溶液中滴加少量氯水:2HCO-3+Cl2===Cl-+ClO-+2CO2↑+H2O
C.向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
D.向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
答案 C
解析HClO的电离常数小于H2CO3的第一步电离,向Na2CO3溶液中滴加少量氯水,不能生成二氧化碳,应该生成碳酸氢根。
13.一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问题:
(1)O点导电能力为零的原因是
。
(2)a、b、c三点中,CH3COOH的电离度最大的是;CH3COOH的电离平衡常数表达式K a=。
(3)若使c点溶液中c(CH3COO-)增大,则下列措施中,可选择 (填字母)。
A.加热B.加入很稀的NaOH溶液
C.加入固体KOH D.加水
E.加入固体CH3COONa F.加入锌粒
答案(1)无水醋酸不能电离出离子(2)c点
c 3COO-c+
(3)ACEF
c3
解析(1)O点时冰醋酸中没有水,CH3COOH没有电离,所以此时导电能力为零。(2)在一定温度下,溶液越稀,CH3COOH的电离度越大,因此,c点CH3COOH的电离度最大。(3)溶液中存在电离平衡:CH33COO-+H+,电离过程吸收热量,加热以及加入固体KOH、加入锌粒均可使平衡正向移动,c(CH3COO-)增大。加入很稀的NaOH溶液、加水虽然也使平衡正向移动,但因为溶液的体积增大,所以c(CH3COO-)减小。加入固体CH3COONa,平衡逆向移动,但因加入了CH3COO-,故c(CH3COO-)增大。
14.Ⅰ.室温下,现有pH=2的醋酸甲和pH=2的盐酸乙:
(1)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为pH(甲) (填“大于”、“小于”或“等于”)pH(乙)。若将甲、乙两溶液等体积混合,溶液的pH=。
(2)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH 溶液的体积大小关系为V(甲) (填“大于”、“小于”或“等于”)V(乙)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为c(Na+) (填“大于”、“小于”或“等于”)c(CH3COO-)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
2018高考化学一轮复习氧化还原反应
课时6 氧化还原反应 【课前自测】 1. (2015·海南卷)化学与生活密切相关。下列应用中利用了物质氧化性的是() A. 明矾净化水 B. 纯碱去油污 C. 食醋除水垢 D. 漂白粉漂白织物【答案】D 2. (2015·上海卷改编)下列反应中的氨与反应4NH3+5O24NO+6H2O中的氨作用相同的是() A. 2Na+2NH32NaNH2+H2 B. 2NH3+3CuO3Cu+N2+3H2O C. NH3+HCl NH4Cl D. 3SiH4+4NH3Si3N4+12H2 【答案】B 3. (2016·河北百校联考)汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3K2O+5Na2O+16N2↑,则下列说法正确的是() A. KNO3是还原剂,其中N元素被氧化 B. 生成物中的N2是氧化产物,K2O是还原产物 C. 若有65 g NaN3参加反应,则被氧化的N的物质的量为3.2 mol D. 每转移1 mol e-,可生成标准状况下N2的体积为35.84 L 【答案】D 4. 在肉制品加工中,使用的护色剂—亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。已知: 2NaNO2+4HI2NO↑+2H2O+2NaI+I2。 (1)标出电子转移的方向和数目: 2NaNO2+4HI2NO↑+2H2O+2NaI+I2 (2)该反应中的氧化剂是。 (3)若有1 mol电子转移,则氧化产物的物质的量是mol。 (4)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法正确的是(填字母)。 A. 亚硝酸钠是还原剂 B. 维生素C是氧化剂 C. 维生素C能把铁离子还原成为亚铁离子 D. 亚硝酸钠被还原 【答案】(1)(2)NaNO2(3)0.5(4)CD
2018年高考化学总复习:1-3章 含解析
课时1 物质的量 气体摩尔体积 [2018备考·最新考纲] 1.了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。 考点一 物质的量 摩尔质量 (考点层次A →自学、识记、辨析) 1.物质的量、摩尔、阿伏加德罗常数 (1)基本概念间的关系 说明:可以和其它物理量及单位对比讲解。 (2)物质的量的表示方法 x mol H 2SO 4 ↓ ↓ ↓ 数值 单位 指定化学式或微粒名称 例如:0.2 mol H 2,3 mol H 2O 等。 提醒:①摩尔后面应为确切的微粒名称;如1 mol 氢(不确切)和1 mol 大米(宏观物质)皆为错误说法。 ②6.02×1023是个纯数值没有任何物理意义,而阿伏加德罗常数(N A )是指1 mol 任何微粒所含的粒子数,它与0.012 kg 12C 所含的碳原子数相同,数值约为6.02×1023。
(3)物质的量与微粒个数、阿伏加德罗常数之间的关系 应用:已知物理量――→计算物质的量――→依据组成 计算微粒数目 2.摩尔质量 提醒:(1)相对原子(或分子)质量与摩尔质量不是同一个物理量,单位不同,只是在数值上相等。 (2)摩尔质量也等于N A m 0(m 0为单个粒子的质量)。 (3)注意掌握气体摩尔质量的求算:①标况密度法:M =22.4 L ·mol -1×ρ g ·L -1 。 ②相对密度法:例如M r =ρ(对空气)×29。 教材 VS 高考 1.(RJ 必修1·P 17)在0.5 mol Na 2SO 4中含有离子和氧原子的物质的量分别是 ( ) A .1.5 mol 0.5 mol B .1.5 mol 2 mol C .0.5 mol 4 mol D .1 mol 2 mol 解析 在0.5 mol Na 2SO 4中含有Na +的物质的量是1 mol 、SO 2-4的物质的量是 0.5 mol ,离子的总物质的量为1.5 mol ,氧原子的物质的量为0.5 mol ×4=2 mol 。 答案 B 2.(LK 必修1·P 21迁移应用改编)填空
2018版高考英语(人教通用)大一轮复习-满分必背+
必修一Unit 1Friendship Ⅰ.常考单词必背 1.upset adj.心烦意乱的;不安的;不适的vt.(upset,upset) 使不安;使心烦;打翻,碰倒;打乱 She was upset about losing her job. 她正为失去工作而心烦意乱。 Losing the ring upset her very much. 遗失戒指使她很心烦意乱。 [快速闪记] be upset about/over/at sth 为某事心烦 upset oneself about sth 为某事而烦恼 2.ignore vt.不理睬;忽视 Either she didn't see me wave or she ignored me on purpose.要么她没看见我招手,要么就是故意不理我。 [快速闪记] ignorant adj.不了解的,无知的 ignorance n.不了解,无知 3.concern vt.(使)担忧;涉及;关系到n.担心;关注;(利害)关系 The accident was concerned with the bus driver. 这次事故与公交车司机有关。 There is some cause for concern but no need for alarm. 是有点令人忧虑,但不必惊慌。 [快速闪记] concerned adj.担心的;关注的 be concerned about/for关心;担忧;挂念
be concerned with牵涉到……,与……有关 as/so far as...be concerned关于;至于;就……而言 4.power n.能力;力量;权力 The power was cut off and the street was entirely in darkness.断电后街道完全陷入了黑暗。 She was the one who had the power to hire or fire people.有权雇用或解雇人的是她。[快速闪记] (1)come to power上台,当权,表示动作,不能和一段时间连用。 (2)be in power当权,执政,表示状态,可以和一段时间连用。 (3)have the power to do sth 具有做某事的能力、权力 beyond/out of one's power某人力所不能及 5.settle vi.安家;定居;停留vt.使定居;安排;解决 They calmed down and settled their problem soon. 他们镇静下来并很快把问题解决了。 Mr.Wang settled down in America soon after he got there.王先生到美国后不久就定居下来了。 [快速闪记] (1)settle down舒适地坐下;安静下来;定居下来 settle down to sth/doing sth开始认真对待某事;定下心来做某事 (2)settlement n.解决;协议 6.suffer vt.& vi.遭受;忍受;经历 We'll suffer hunger one day if we don't care about the farmland.如果我们不关注农田,将来我们会挨饿的。 [快速闪记] suffering n.痛苦;苦难sufferer n.患病者;受难者 7.pack vi.& vt.捆扎;包装;打行李n.小包;包裹 As soon as I graduated,I packed my bags and moved to the west of China.一毕业我就收拾行李去了中国西部。 A pack of reporters were waiting outside for the latest news.一群记者在外面等待最
2018年全国卷高考化学总复习《有机化学》专题突破
2018年全国卷高考化学总复习《有机化学》专题突破 【考纲要求】 1.理解甲烷、乙烯和苯的基本结构和性质 2.了解同分异构现象和同分异构体 3.了解乙醇、乙酸的物理性质、结构,掌握其化学性质 4.了解油脂、糖类、蛋白质的组成、结构、重要性质 重点:官能团的概念、有机物化学性质 难点:从结构角度初步认识有机物的化学性质 【知识网络】 几种重要的有机物之间的转化关系 必修有机化学容较为简单,包括主要容为:最简单的有机化合物——甲烷、来自石油和煤的两种基本化工原料、生活中两种常见的有机物、基本营养物质,其知识网络如下: 【考点梳理】 有机物分子结构特点主要化学性质 甲烷 CH4 碳原子间以单键相连,剩余 价键被氢原子“饱和”,链状 (1)氧化反应:燃烧 (2)取代反应:卤代 乙烯 CH2=CH2 分子中含有碳碳双键,链状 (1)氧化反应:燃烧,使酸性KMnO4溶液褪色 (2)加成反应:使溴水褪色,与H2O加成为乙醇苯 分子中含有苯环,苯环中碳 碳之间有介于单键和双键 之间的独特的键,环状 (1)取代反应:卤代、硝化 (2)加成反应:与H2加成生成环己烷乙醇CH3CH2OH 分子中含有羟基;羟基与链 烃基直接相连 (1)取代反应:与活泼金属Na、K等制取H2 (2)氧化反应:催化氧化时生成乙醛;完全燃烧 生成CO2和H2O 乙酸CH3COOH 分子中含有羧基,受C=O 双键影响,O—H键能够断 裂,产生H+ (1)酸性:具有酸的通性,可使紫色石蕊试液变 红 (2)酯化反应:与乙醇等醇类物质反应生成酯物质的类别分子结构特征重要化学性质用途 糖 类 单 糖 葡萄糖 C6H12O6 多羟基醛,与果糖是同 分异构体 具有醛和多元醇的性质,能与 银氨溶液或新制氢氧化铜反 应,也能与乙酸等反应生成酯 1.医用:静脉注射,为体 弱和血糖过低的患者补 充营养 2.用于制镜工业、糖果工 业的等 二 糖 蔗糖 C12H22O11 无醛基不具有醛的性质,1mol蔗糖 水解生成1mol葡萄糖和1mol 果糖 作甜味食品,用于糖果 工业
2017高考化学一轮复习(蔺东斌主讲)
江西省南昌市2015-2016学年度第一学期期末试卷 (江西师大附中使用)高三理科数学分析 一、整体解读 试卷紧扣教材和考试说明,从考生熟悉的基础知识入手,多角度、多层次地考查了学生的数学理性思维能力及对数学本质的理解能力,立足基础,先易后难,难易适中,强调应用,不偏不怪,达到了“考基础、考能力、考素质”的目标。试卷所涉及的知识内容都在考试大纲的范围内,几乎覆盖了高中所学知识的全部重要内容,体现了“重点知识重点考查”的原则。 1.回归教材,注重基础 试卷遵循了考查基础知识为主体的原则,尤其是考试说明中的大部分知识点均有涉及,其中应用题与抗战胜利70周年为背景,把爱国主义教育渗透到试题当中,使学生感受到了数学的育才价值,所有这些题目的设计都回归教材和中学教学实际,操作性强。 2.适当设置题目难度与区分度 选择题第12题和填空题第16题以及解答题的第21题,都是综合性问题,难度较大,学生不仅要有较强的分析问题和解决问题的能力,以及扎实深厚的数学基本功,而且还要掌握必须的数学思想与方法,否则在有限的时间内,很难完成。 3.布局合理,考查全面,着重数学方法和数学思想的考察 在选择题,填空题,解答题和三选一问题中,试卷均对高中数学中的重点内容进行了反复考查。包括函数,三角函数,数列、立体几何、概率统计、解析几何、导数等几大版块问题。这些问题都是以知识为载体,立意于能力,让数学思想方法和数学思维方式贯穿于整个试题的解答过程之中。 二、亮点试题分析 1.【试卷原题】11.已知,,A B C 是单位圆上互不相同的三点,且满足AB AC → → =,则A BA C →→ ?的最小值为( ) A .1 4- B .12- C .34- D .1-
2018年高考化学总复习非选择题系列练题(13)
非选择题系列练题(13) 1.直接乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。 (1)三种乙醇燃料电池中正极反应物均为_____________。 (2)碱性乙醇燃料电池中,电极a上发生的电极反应式为______________________________,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_____________________________。 (3)酸性乙醇燃料电池中,电极b上发生的电极反应式为__________________________________。 (4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极______(填“a” 或“b”)移动,电极b上发生的电极反应式为____________________________________。【答案】氧气(1分) C2H5OH+16OH--12e-=2CO32-+11H2O 空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH O2+4H++4e-=2H2O a O2+2CO2+4e-=2CO32- (3)酸性乙醇燃料电池中,电极b为正极,其上发生的电极反应式为O2+4H++4e-=2H2O。(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向阳极(也是负极)电极a移动,电极b上发生还原反应,电极反应式为O2+2CO2+4e-=2CO32-。 2.一定温度下,冰醋酸在加水稀释过程中溶液导电能力的变化曲线如图所示,请回答下列问
题: (1)O点导电能力为零的原因是_______________________________。 (2)a、b、c三点中,CH3COOH的电离度最大的是________;a、b、c三点的pH由小到大的顺序是___________CH3COOH的电离平衡常数表达式K a=________。 (3)若使c点溶液中c(CH3COO-)增大,则下列措施中,可选择________(填字母序号)。 A.加热 B.加入很稀的NaOH溶液 C.加入固体KOH D.加水 E.加入固体CH3COONa F.加入锌粒 (4)在CH3COOH溶液的稀释过程中,始终保持增大趋势的是________(填字母序号)。 A.c(H+) B.H+的个数 C.CH3COOH的分子数 D.c(H+)/c(CH3COOH) (5)下列有关CH3COOH溶液的说法正确的是________(填字母序号)。 A.CH3COOH溶液中各离子浓度的关系为c(H+)=c(OH-)+c(CH3COO-) B.向0.10 mol/L的CH3COOH溶液中加水,c(H+)增大 C.CH3COOH溶液中各离子浓度的关系为c(CH3COO-)>c(H+)>c(OH-) D.常温下,c(H+)=0.01 mol/L的CH3COOH溶液与c(OH-)=0.01 mol/L的NaOH溶液等体积混合后,溶液呈碱性 【答案】无水醋酸不能电离成离子 c b 第1讲 化学实验基础1(仪器、装置、操作、实验安全) 1. 了解化学实验室常用仪器的主要用途和使用方法。 5. 能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。 知识网络 问题1:实验室热源、加热仪器、加热方式有哪些? 问题2:如何根据实验需要来选择实验仪器? 1. (2016·新课标Ⅱ卷)下列实验操作能达到实验目的的是 ( ) A B C D 除去SO 3. (2017·河南天一大联考)下图为实验室中的蒸馏装置,下列有关说法正确的是 ( ) A.仪器甲是锥形瓶,可直接用酒精灯加热 B.温度计水银球应该置于蒸馏烧瓶支管口处 C.直形冷凝管可用球形冷凝管代替 D.石油蒸馏时加沸石,制蒸馏水时不用加沸石 4.(2016·浙江卷)下列叙述不正确的是() A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏大 C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 考点1常用的实验仪器及装置 基础梳理 2.常见的实验装置 (1)物质的分离、提纯与装置 ①基本概念 ②常见实验装置 装置 萃取和分液 (2)气体制备的有关装置 ①发生装置 反应装置图 或液、液加热型 固、液不加热型 SO ②净化装置 液体干燥剂固体干燥剂 除杂试剂(Cu、CuO、 ③收集装置 中成分不反应中成分不反应 H、O、NO、CH、C H Cl、HCl、CO、NO、H S、 ④测量气体体积装置 ⑤尾气处理装置 常见有毒气体的尾气处理方法 NaOH溶液吸收CuSO4溶液或NaOH溶液吸收水吸收水或浓硫酸吸收点燃常考归纳几种常考的物质制备实验装置 2018年高考化学一轮复习加练半小时第1练-第19练 1.(2015·湖南十三校第二次联考)设N A为阿伏加德罗常数的值。下列说法正确的是() A.标准状况下,22.4 L HF中含HF分子数目为N A B.用惰性电极电解CuSO4溶液后,如果加入0.1 mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2N A C.71 g Na2SO4固体中含钠离子数目为N A D.25 g质量分数68%的H2O2水溶液中含氧原子数目为N A 2.(2015·赣中南部五校上学期二联)用N A表示阿伏加德罗常数的值。下列叙述正确的是() A.在H2O2+Cl2===2HCl+O2反应中,每生成32 g氧气,则转移4N A个电子 B.17.4 g某硫化磷(如图)中含P—S键数目为0.6N A C.每个分子中含8个碳原子的某烃,1 mol烃中含碳碳单键的个数最多为7N A D.标准状况下,22.4 L SO2与O2的混合气体,含有2N A个氧原子 3.(2015·遂宁二诊)N A为阿伏加德罗常数,下列叙述正确的是() A.标况下,2.8 L丙烷中含有的极性共价键数为N A B.在反应KIO3+6HI===KI+3I2+3H2O 中,每生成3 mol I2转移的电子数为6N A C.已知CH3COONH4溶液的pH=7,则1 L 0.1 mol·L-1的CH3COONH4溶液中,CH3COO-数目为0.1N A D.39 g Na2O2和Al(OH)3的混合物中阴、阳离子的总数为2N A 4.(2015·大连20中上学期期末)设N A为阿伏加德罗常数的值,下列叙述正确的是() A.pH=1的稀硫酸中含有的H+数目为0.1N A B.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3N A C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46N A D.80 g NH4NO3晶体中含有NH小于N A个 5.设N A表示阿伏加德罗常数的值,下列叙述正确的是() A.标准状况下,22.4 L一氯甲烷和二氯甲烷的混合物中所含的氯原子数介于N A~2N A之间B.0.1 mol Cu与足量热的浓硫酸反应生成SO2的体积约为2.24 L C.0.2 mol·L-1 Na2S溶液中含有的S2-数目小于0.2N A D.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子数大于2N A 6.设N A为阿伏加德罗常数的值,下列说法正确的是() A.常温常压下,17 g羟基中含有的电子数目为10N A B.常温常压下,28 g由C2H4和C3H6组成的混合气体中含有的碳原子数目为2N A C.0.05 mol熔融的NaHSO4中含有的离子数目为0.15N A D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1N A 7.(2015·深圳二模)设N A为阿伏加德罗常数,下列说法错误的是() 2018年全国卷高考化学总复习《等效平衡》专题训练 选择题(每题有1-2个选项符合题意) 1.在1L密闭容器中加入2molA和1molB,在一定温度下发生下列反应:2A(g)+B(g) 3C(g) +D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是() A.3molC和1molD B.2molA、1molB和3molC C.4molC和1molD D.1.9molA、0.95molB、0.15molC和0.05molD 2.在一个容积固定的密闭容器中充入,建立如下平衡:H 2 (g)+I2 (g) 2HI(g),测得HI的转化率为a%。其他条件不变,在上述平衡体系中再充入1mol HI,待平衡建立时HI的转化率为b%,则a与b的关系为() A.a>b B.a<b C.a=b D.无法确定 3.在恒温时,一固定容积的容器内发生如下反应: 2NO 2(g)N2O4(g),达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数() A.不变B.增大C.减小D.无法判断4.恒温恒压条件下,可逆反应2SO 2+O22SO3在密闭容器中进行,起始时充入1mol SO3,达到平衡时,SO2的百分含量为ω%,若再充入1mol SO3,再次达到新的平衡时,SO2的的百分含量为() A.大于ω% B.小于ω% C.等于ω% D.无法确定 5.在一恒温恒容密闭容器中,A、B气体可建立如下平衡:2A(g)+2B(g) C(g)+3D(g) 现分别从两条途径建立平衡:I. A、B的起始量均为2mol;II. C、D的起始量分别为2mol 和6mol。下列叙述不正确的是() A.I、II两途径最终达到平衡时,体系内混合气体的体积分数相同 B.I、II两途径最终达到平衡时,体系内混合气体的体积分数不同 C.达到平衡时,途径I的和途径II体系内混合气体平均相对分子质量相同 D.达到平衡时,途径I的气体密度为途径II密度的1/2 6.一定温度下,将a mol PCl 5通往一容积不变的密闭容器中达如下平衡:PCl5(g)PCl3(g)+Cl2(g),此时平衡混合气体的压强为P1,再向容器中通入a mol PCl5,恒温下再度达到平衡后压强变为P2,则P1与P2的关系是() A.2P1=P2B.2P1>P2C.2P1<P2D.P1=2P2 7.在温度、容积相同的3个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反 ―1 高考真题题组训练(五) Ⅰ.语法填空(2016全国Ⅱ) 阅读下面材料,在空白处填入适当的内容(1个单词)或括号内单词的正确形式。 If you feel stressed by responsibilities at work,you should take a step back and identify(识别) those of 1. (great) and less importance.Then,handle the most important tasks first so you’ll feel a real sense of 2. (achieve). Leaving the less important things until tomorrow 3. (be) often acceptable. Most of us are more focused 4. our tasks in the morning than we are later in the day.So,get an early start and try to be as productive 5. possible before lunch.This will give you the confidence you need to get you through the afternoon and go home feeling accomplished. Recent 6. (study) show that we are far more productive at work if we take short breaks 7. (regular).Give your body and brain a rest by stepping outside for 8. while,exercising,or doing something you enjoy. If you find something you love doing outside of the office,you’ll be less likely 9. (bring) your work home.It could be anything-gardening,cooking,music,sports-but whatever it is,10. (make) sure it’s a relief from daily stress rather than another thing to worry about. 语篇解读:这是一篇说明文。该文告诉我们当工作压力大时,应如何缓解压力。 答案及剖析: 1.greater 与less是并列关系,应用比较级。 2.achievement 其前面有介词of,应用名词形式作介词的宾语。 3.is v.-ing 形式作主语,谓语动词应用第三人称单数。全文说明的是一种生活常识,应用一般现在时。 4.on 短语be focused on集中于……大多数人早晨对任务的注意力要比晚些时候的注意力更集中。 5.as 考查固定搭配。短语as...as possible尽可能…… 6.studies 本句的谓语动词是show,说明主语应为复数形式。 第3讲 铁及其化合物 [考纲要求] 1.了解铁及其重要化合物的主要性质及其应用。2.以Fe 2+ 、Fe 3+ 的相互转化为例, 理解变价金属元素的氧化还原反应。3.能鉴别溶液中的Fe 2+ 、Fe 3+ 。 考点一 用物质分类思想认识铁及其重要化合物 1. 铁的存在 2. 铁的性质 (1)物理性质 纯铁具有金属的共性,如具有银白色金属光泽和良好的延展性,是电和热的良导体,具有能被磁铁吸引的特性,纯铁有很强的抗腐蚀能力。 (2)化学性质:铁是较活泼的金属,发生化学反应时可生成+2、+3两种价态的化合物。 用化学方程式或离子方程式表示下列变化 Fe +H 2O(g)――→④ 3Fe +4H 2O(g)=====高温 Fe 3O 4+4H 2 3. 铁的氧化物和氢氧化物 (1)铁的氧化物 4. (1)亚铁盐: 含有Fe 2+ 的溶液呈浅绿色,Fe 2+ 既有________性,又有________性,Fe 2+ 与Zn 、Cl 2反 应的离子方程式分别为_______________________________________________________ __________________,___________________________________________________。 (2)铁盐: ①氧化性:含有Fe 3+ 的溶液呈______色,Fe 3+ 具有氧化性,Fe 3+ 与Fe 、Cu 反应的离子方 程式分别为______________________________,______________________________。 ②特性:含有Fe 3+ 的盐溶液遇到________时变成血红色。 ③易水解:FeCl 3滴入沸水中的离子方程式:________________________________。 答案 (1)氧化 还原 Zn +Fe 2+ ===Zn 2+ +Fe 2Fe 2+ +Cl 2===2Fe 3+ +2Cl - (2)①棕黄色 2Fe 3+ +Fe===3Fe 2+ 2Fe 3+ +Cu===2Fe 2+ +Cu 2+ ②KSCN ③Fe 3+ + 3H 2O=====△ Fe(OH)3(胶体)+3H + 深度思考 1. 铁有很强的抗腐蚀能力,为什么日常生活中的铁制品容易生锈? 答案 主要因为铁不纯,往往含有碳等杂质,当这些铁制品在潮湿的空气中或接触到电 非选择题系列练题(2) 1.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。 (1)请写出金属钒与浓硝酸反应的离子方程式:__________________________________, (2)灼烧NH4VO3时可生成钒的氧化物V2O5,请写出该反应的化学方程式:___________。 (3)V2O5是较强的氧化剂。它能与沸腾的浓盐酸作用产生氯气,其中钒元素被还原为蓝色的VO2+, 请写出该反应的离子方程式:______________________________________。 (4)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+) 的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:______、______。(5)工业上用接触法制硫酸时要用到V2O5。在氧化SO2的过程中,450℃时发生V2O5与VO2之间的 转化:V2O5+SO2=2VO2+SO3、4VO2+O2=2V2O5,说明V2O5在接触法制硫酸过程中所起的作用是_________。 【答案】 V+6H++5NO3-= VO2++5NO2↑+3H2O(2分) 2NH4VO3V2O5+2NH3↑+H2O( V2O5+6H++2Cl-2VO2++Cl2↑+3H2O Na3VO4 (VO2)2SO4催化剂或催化作用 【解析】本题主要考查陌生方程式的书写。(1) 钒室温下能溶解于浓硫酸中生成VO2+,故金属钒与浓硝酸: 与强碱反应生成Na3VO4,V 2O5与强酸生成(VO2)2SO4;(5)由方程式V2O5+SO2=2VO2+SO3、 4VO2+O2=2V2O5可知,说明V2O5在接触法制硫酸过程中起到催化作用。 点睛:有元素化合价变化的反应是氧化还原反应,元素化合价升高,失去电子,该物质作还原剂,变为氧化产物;元素化合价降低,获得电子,该物质作氧化剂,变为还原产物,元素化合价升降总数等于反应过程中电子转移的数目;可利用最小公倍数法配平氧化还原反应方程式,对于离子反应,同时还要符合电荷守恒及原子守恒。 2.氮和磷为周期表中的第VA族元素,它们的元素及其化合物在性质上既有相似性又有不同性。 回答下列问题: 时间:45分钟满分:100分 一、选择题(每题6分,共72分) 1.[2016·四川资阳模拟]标准状况下有以下四种气体:①6.72 L CH4;②3.01×1023个HCl分子;③13.6 g H2S;④0.2 mol NH3。下列关系不正确的是( ) A.体积:④<①<③<② B.质量:④<①<③<② C.物质的量:①<②<③<④ D.氢原子数:②<④<③<① 答案 C 解析①6.72 L CH4的物质的量为 6.72 L 22.4 L·mol-1 =0.3 mol, ②3.01×1023个HCl分子的物质的量为 3.01×1023 6.02×1023 mol-1 =0.5 mol, ③13.6 g H2S的物质的量为13.6 g 34 g·mol-1 =0.4 mol,④0.2 mol NH3。标准状况下体积之比等于其物质的量之比,体积:④<①<③<②,A 项正确;CH4的质量为0.3 mol×16 g·mol-1=4.8 g,HCl的质量为0.5 mol×36.5 g·mol-1=18.25 g,NH3的质量为0.2 mol×17 g·mol -1=3.4 g,质量:④<①<③<②,B项正确;物质的量大小顺序为④<①<③<②,C项错误;CH4中n(H)=0.3 mol×4=1.2 mol,HCl 中n(H)=0.5 mol,H2S中n(H)=0.4 mol×2=0.8 mol,NH3中n(H)=0.2 mol×3=0.6 mol,氢原子数:②<④<③<①,D项正确。 2.[2016·潍坊质检]下列说法正确的是( ) A.1 mol任何气体的气体摩尔体积都约为22.4 L·mol-1 B.20 ℃、1.0×105 Pa时,同体积的O2与CO2含有相同的分子数 C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准 2018年全国卷高考化学复习专题突破《四大平衡常数》 一、水的离子积常数 1.水的离子积常数的含义 H 2O ?H ++OH - 表达式:25 ℃时,K w =c (H +)·c (OH -)=1.0×10-14. 2.对K w 的理解 (1)K w 适用于纯水、稀的电解质(酸、碱、盐)水溶液. (2)恒温时,K w 不变;升温时,电离程度增大(因为电离一般吸热),K w 增大. 二、电离平衡常数(K a 、K b ) 1.电离平衡常数的含义 如对于HA ?H ++A - ,K a =)A (H )A ()(H c c c -+?;BOH ?B ++OH -,K b =(BOH))(OH )(B c c c -+?. 2.K 值大小的意义 相同温度下,K 值越小表明电离程度越小,对应酸的酸性或碱的碱性越弱. 3.影响K 值大小的外因 同一电解质,K 值只与温度有关,一般情况下,温度越高,K 值越大;此外对于多元弱酸来说,其K a 1?K a 2?K a 3. 三、水解平衡常数(K h ) 1.水解平衡常数的含义 A -+H 2O ?HA +OH -,达到平衡时有K h =) (A (HA))(OH -c c c ?-=K w K a .同理,强酸弱碱盐水解平衡常数与弱碱电离平衡常数K b 的关系为K h =K w K b . 2.影响K h 的因素 K h 值的大小是由发生水解的离子的性质与温度共同决定的;温度一定时,离子水解能力越强,K h 值越大;温度升高时,K h 值增大;对于多元弱酸阴离子或多元弱碱阳离子来说,其K h 1?K h 2?K h 3. 四、溶度积常数(K sp ) 1.溶度积常数K sp 的表达式 对于组成为A m B n 的电解质,饱和溶液中存在平衡A m B n (s)?m A n +(aq)+n B m -(aq),K sp =c m (A n +)·c n (B m -). 2.影响K sp 大小的因素 对于确定的物质来说,K sp 只与温度有关;一般情况下,升高温度,K sp 增大. 3.溶度积规则 当Q c >K sp 时,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡;当Q c =K sp 时,溶液饱和,沉淀与溶解处于平衡状态;当Q c 高中化学总复习 高考化学第一轮复习 实质:有电子转移(得失与偏移) 特征:反应前后元素的化合价有变化 还原性 化合价升高 弱氧化性 ↑ 还原剂 氧化反应 氧化产物 氧化剂 还原反应 还原产物 ↓ ↓ 氧化性 化合价降低 弱还原性 氧化还原反应:有元素化合价升降的化学反应是氧化还原反应。 有电子转移(得失或偏移)的反应都是氧化还原反应。 概念: 氧化剂:反应中得到电子(或电子对偏向)的物质(反应中所含元素化合价降低物) 还原剂:反应中失去电子(或电子对偏离)的物质(反应中所含元素化合价升高物) 氧化产物:还原剂被氧化所得生成物; 还原产物:氧化剂被还原所得生成物。 失电子,化合价升高,被氧化 双线桥: 氧化剂 + 还原剂 = 还原产物 + 氧化产物 得电子,化合价降低,被还原 电子转移表示方法 单线桥: 电子 还原剂 + 氧化剂 = 还原产物 + 氧化产物 二者的主 表示意义、箭号起止 要区别: 电子数目等 依据原则:氧化剂化合价降低总数=还原剂化合价升高总数 找出价态变化,看两剂分子式,确定升降总数; 方法步骤:求最小公倍数,得出两剂系数,观察配平其它。 有关计算:关键是依据氧化剂得电子数与还原剂失电子数相等,列出守恒关系式求解。 变化 变化 反应物→ 概 念 及 转 化 关 系 配平 氧化还原 反 应 →产物 ①、由元素的金属性或非金属性比较;(金属活动性顺序表,元素周期律) ②、由反应条件的难易比较; ③、由氧化还原反应方向比较;(氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物) ④、根据(氧化剂、还原剂)元素的价态与氧化还原性关系比较。 元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。 ①、活泼的非金属,如Cl 2、Br 2、O 2 等; ②、元素(如Mn 等)处于高化合价的氧化物,如MnO 2、KMnO 4等 氧化剂: ③、元素(如S 、N 等)处于高化合价时的含氧酸,如浓H 2SO 4、HNO 3 等 ④、元素(如Mn 、Cl 、Fe 等)处于高化合价时的盐,如KMnO 4、KClO 3、FeCl 3、K 2Cr 2O 7 ⑤、过氧化物,如Na 2O 2、H 2O 2等。 ①、活泼的金属,如Na 、Al 、Zn 、Fe 等; ②、元素(如C 、S 等)处于低化合价的氧化物,如CO 、SO 2等 还原剂: ③、元素(如Cl 、S 等)处于低化合价时的酸,如浓HCl 、H 2S 等 ④、元素(如S 、Fe 等)处于低化合价时的盐,如Na 2SO 3、FeSO 4等 ⑤、某些非金属单质,如H 2 、C 、Si 等。 概念:在溶液中(或熔化状态下)有离子参加或生成的反应。 离子互换反应 离子非氧化还原反应 碱性氧化物与酸的反应 类型: 酸性氧化物与碱的反应 离子型氧化还原反应 一般离子氧化还原反应 化学方程式:用参加反应的有关物质的化学式表示化学反应的式子。 用实际参加反应的离子符号表示化学反应的式子。 表示方法 写:写出反应的化学方程式; 离子反应: 拆:把易溶于水、易电离的物质拆写成离子形式; 离子方程式: 书写方法:删:将不参加反应的离子从方程式两端删去; 查:检查方程式两端各元素原子种类、个数、电荷数是否 相等。 意义:不仅表示一定物质间的某个反应;还能表示同一类型的反应。 本质:反应物的某些离子浓度的减小。 金属、非金属、氧化物(Al 2O 3、SiO 2) 中学常见的难溶物 碱:Mg(OH)2、Al(OH)3、Cu(OH)2、Fe(OH)3 生成难溶的物质:Cu 2++OH -=Cu(OH)2↓ 盐:AgCl 、AgBr 、AgI 、CaCO 3、BaCO 3 生成微溶物的离子反应:2Ag ++SO 42-=Ag 2SO 4↓ 发生条件 由微溶物生成难溶物:Ca(OH)2+CO 32-=CaCO 3↓+2OH - 生成难电离的物质:常见的难电离的物质有H 2O 、CH 3COOH 、H 2CO 3、NH 3·H 2O 生成挥发性的物质:常见易挥发性物质有CO 2、SO 2、NH 3等 发生氧化还原反应:遵循氧化还原反应发生的条件。 强 弱 比 较 氧化剂 、 还 原 剂 必修5Unit 1Getting along with others Ⅰ.单项填空 1.The shy girl felt _______and uncomfortable when she could not answer her teacher's questions. A.amazed B.awkward C.curious D.amused 答案B[考查形容词词义辨析。选项应该和uncomfortable相对应,根据句意,当无法回答老师的问题时,那个害羞的女孩感到“别扭,不自然”;只有awkward意为“别扭的,不自然的”,符合句意。故选B。] 2.At first the institute refused to purchase the experiment instrument,but this decision was _____changed. A.occasionally B.consequently C.backwards D.afterwards 答案D[考查副词词义辨析。句意:这家研究所一开始拒绝购买这种实验设备,但是随后这个决定就改变了。afterwards然后,后来。] 3.You will never________your tomorrow’s exam if you don’t fix your attention on it. A.get on with B.get back C.get through D.get in 答案C[考查get短语。句意:如果你不把注意力集中在你的考试上的话,你永远也不会通过明天的考试的。get on with相处,进展;get back回来,恢复,取回;get through 接通(电话),完成,通过;get in收割,收获。根据句意选C。] 4.Mr Harris apologized ________the children ________the lady ________what they had done. A.for;to;to B.to;to;for C.for;to;for D.to;for;for 答案C[考查apologize的用法。apologize to sb for sth为某事向某人道歉。句意:哈利斯先生替这些孩子们为他们所做的事向那位女士道歉。] 5.Without enough evidence,the jury couldn’t find him________of the crime,so he was set free. A.skeptical B.ashamed C.innocent D.guilty 答案D[考查形容词辨析。句意:因为没有足够的证据,陪审团就不能认定他有罪,所以他被释放了。skeptical怀疑的;ashamed惭愧的;innocent无辜的;guilty有罪的。] 6.Whenever he meets difficulties,he always takes a positive________towards them. A.mind B.attitude C.opinion D.state2018版高考化学总复习:一轮导学案全集(含答案解析)
2018年高考化学一轮复习加练半小时第1练—第19练
2018年全国卷高考化学总复习《等效平衡》专题训练(含解析)
2018高考英语大一轮复习高考真题题组训练五外研版
2018届高考化学一轮复习 铁及其化合物
2018年高考化学总复习非选择题系列练题2
2018届高考化学一轮复习:考情分析检测(含解析)
2018年高考化学专题复习突破《四大平衡常数》知识点总结
2018高考化学知识点总结大全
2018版高考英语译林版 江苏省专用大一轮复习讲义题库
