成都市2020-2021年高一上学期化学期末考试试卷(I)卷

成都市2020-2021年高一上学期化学期末考试试卷(I)卷
姓名:________ 班级:________ 成绩:________
一、单选题 (共20题;共40分)
1. (2分)(2018·衡阳模拟) 化学与能源开发、环境保护、生产生活等密切相关。下列有关说法正确的是()
A . 二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性
B . 钢铁发生电化学腐蚀时,负极的电极反应式是Fe- 3e- =Fe3+
C . 聚酯纤维光导纤维都属于有机高分子材料
D . 静电除尘、血液透析均与胶体的性质有关
2. (2分) (2019高一下·江苏期末) 不久前,央视8套播出的“我们恨化学”广告引起了轩然大波。由此,北京大学化学与分子生物工程学院教授周公度先生欲将央视8套告上法庭。广告中常含有科学性不符合题意。下列广告用语中,不含科学性错误的是()
A . “霸王”牌厕所清洁剂,能清除所有污秽
B . “雪山牌”矿泉水,真正的纯水
C . “大自然牌茶叶”真正的绿色饮品,天然种植不含任何化学元素
D . 吸烟有害健康
3. (2分) (2018高三上·黑龙江期中) 化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是()
①过量的锌与18m ol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应;⑦过量氯气与碘化钾溶液反应
A . ②③④⑥
B . ②③⑤⑦
C . ①③⑤
D . ①②③④⑥
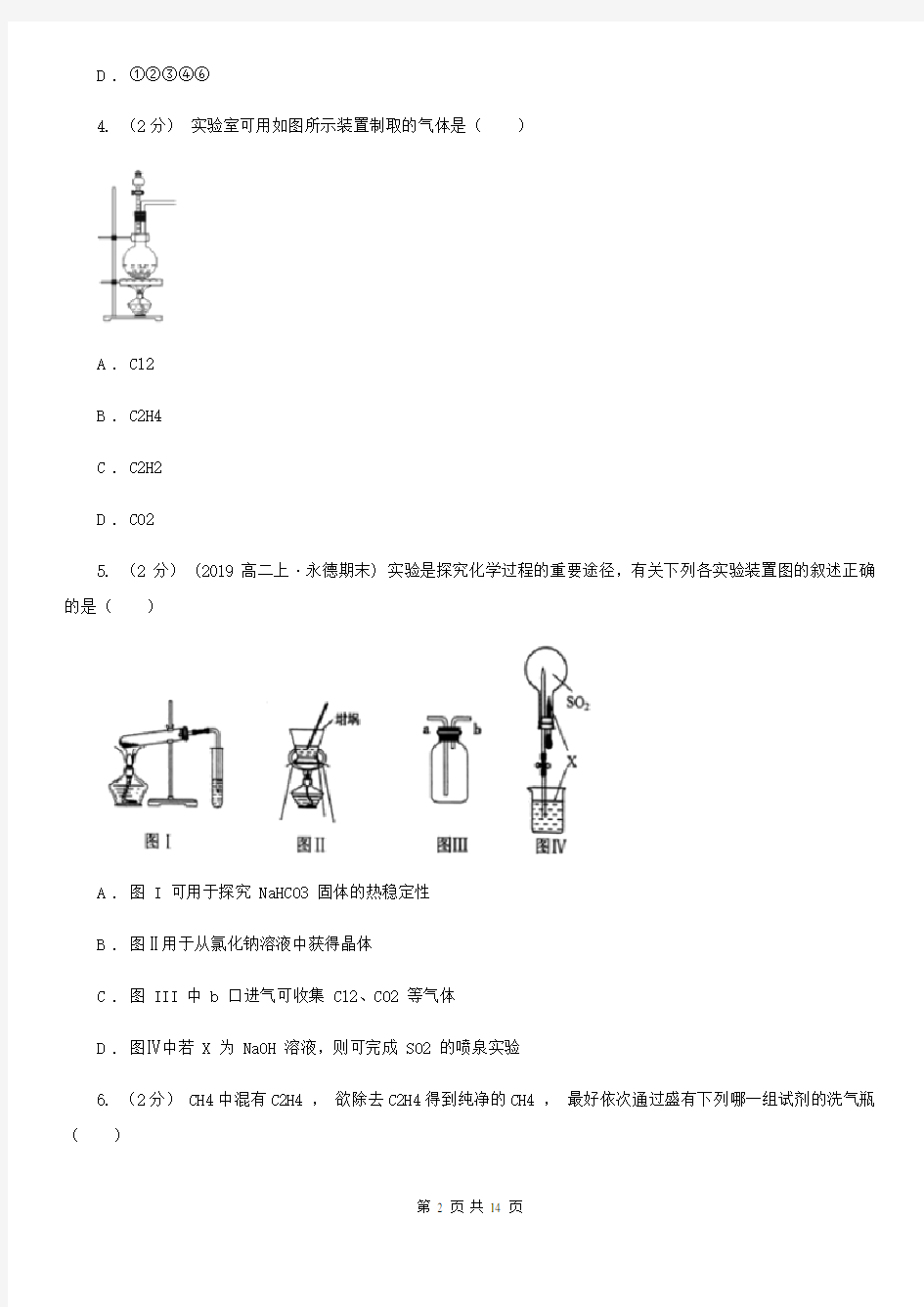
4. (2分)实验室可用如图所示装置制取的气体是()
A . Cl2
B . C2H4
C . C2H2
D . CO2
5. (2分) (2019高二上·永德期末) 实验是探究化学过程的重要途径,有关下列各实验装置图的叙述正确的是()
A . 图 I 可用于探究 NaHCO3 固体的热稳定性
B . 图Ⅱ用于从氯化钠溶液中获得晶体
C . 图 III 中 b 口进气可收集 Cl2、CO2 等气体
D . 图Ⅳ中若 X 为 NaOH 溶液,则可完成 SO2 的喷泉实验
6. (2分) CH4中混有C2H4 ,欲除去C2H4得到纯净的CH4 ,最好依次通过盛有下列哪一组试剂的洗气瓶()
A . 澄清石灰水,浓H2SO4
B . 酸性KMnO4溶液,浓H2SO4
C . Br2水,浓H2SO4
D . 浓H2SO4 ,酸性KMnO4溶液
7. (2分) (2018高三上·赣州期中) 下列说法正确的是()
A . 用澄清石灰水可区别Na2CO3和NaHCO3粉末
B . 只能用加试剂的方法区别(NH4)2SO4和Fe2(SO4)3溶液
C . 用氯化钡溶液可区别SO42-和CO32-离子
D . 用丁达尔效应可区别Fe(OH)3胶体和FeCl3溶液
8. (2分) (2018高二上·江苏期中) 下列反应的离子方程式书写正确的是()
A . 锌与CH3COOH溶液反应:Zn + 2H+ = Zn2++ H2↑
B . 氢氧化铝与稀硝酸反应:H+ + OH- = H2O
C . CuCl2溶液与铁粉反应:3Cu2+ + 2Fe =3Cu + 2Fe3+
D . MgCl2溶液与氨水反应:Mg2+ + 2NH3·H2O = Mg(OH)2↓+2NH
9. (2分) (2016高一下·金台期中) 若NA为阿伏伽德罗常数,已知某元素的阴离子Rn﹣的原子核中,中子数为A﹣x+n,其中A为原子的质量数,则m g Rn﹣中电子总数为()
A .
B .
C .
D .
10. (2分)实验室中,现有下列物质:①氯水②盐酸③浓硝酸④氢氧化钠⑤硝酸银,其中必须保存在棕色试剂瓶中的是()
A . ①③⑤
B . ①②④
C . ①②
D . 全部
11. (2分) (2018高一上·扬州月考) 对下列物质:①纯碱②食盐水③浓硫酸④烧碱⑤液态氧⑥氯酸钾,分类全部正确的是()
A . 碱——①④
B . 混合物——②③
C . 电解质——③④⑤
D . 盐——②⑥
12. (2分) (2019高一上·太原期末) 将NaOH溶液逐滴滴入Y的溶液中,生成沉淀的物质的量与NaOH溶液体积的关系如图所示,则Y是()
A . AgNO3
B . NaAlO2
C . AlCl3
D . Fe2(SO4)3
13. (2分) (2018高一上·慈溪期中) 下列说法不正确的是()
A . AgI可用于人工降雨
B . 碘酸钾可用作加碘食盐的添加剂
C . 碳酸钠是发酵粉的主要成分
D . 次氯酸钙是漂白粉的有效成分
14. (2分) (2019高一上·嘉兴期中) 下列说法正确的是()
A . 做焰色反应前铂丝要先在硫酸中洗涤,再在酒精灯上灼烧至无色
B . AgBr是一种重要的感光材料,可用于制作照相底片
C . 新制的氯水应保存在无色广口瓶中,并放在阴凉处
D . 碘是人体必需的微量元素,所以人每天要要适当补充含I2的食盐
15. (2分)下列离子检验的方法正确的是()
A . 某溶液中加入NaOH溶液,生成蓝色沉淀,说明原溶液中含有Cu2+
B . 某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42﹣
C . 某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl﹣
D . 某溶液中加入稀硫酸,产生无色气体,将气体通入澄清石灰水中生成白色沉淀,说明原溶液中含有CO32﹣
16. (2分)在探究氯水成分的实验中,下列根据实验现象得出的结论错误的是()
A . A
B . B
C . C
D . D
17. (2分)下列说法正确的是()
A . 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性
B . 一般情况下,一元弱酸HA的Ka 越大,表明该酸的酸性越弱
C . 水的离子积只与温度有关,向水中加入酸、碱或盐一定会影响水的电离平衡
D . 硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应,不和任何其它物质反应
18. (2分)取两份物质的量相同的小苏打(NaHCO3)和苏打(Na2CO3),同时与相同浓度的盐酸反应。下列有关说法正确的是()
A . 将反应过程中产生的气体完全收集,前者产生的气体体积多(相同状况)
B . 前者消耗盐酸的体积多
C . 后者消耗盐酸的体积多
D . 将反应过程中产生的气体完全收集,后者产生的气体体积多(相同状况)
19. (2分) (2018高一上·深圳期末) 下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是()
① ② ③ ④ ⑤MgO⑤Fe(OH) 3 ⑥CuSO4
A . 全部
B . ②③④⑤
C . ①②③④
D . ①②③④⑥
20. (2分)下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入足量CO2
A . ①③④⑤
B . 只有①②⑤
C . 只有②③⑤
D . 只有②③④⑤
二、实验题 (共2题;共13分)
21. (5分) (2017高一上·武汉期末) 根据要求回答问题:
(1).据报道,某地化工厂的贮氯罐意外发生泄漏,为了厂区和周围地区群众的安全,有关方面采取了相关措施:
①依据厂区实际情况,处理钢瓶的方法正确的是________
A.钢瓶推到坡下的小河里
B.把钢瓶丢到深坑里,用石灰填埋
C.把钢瓶扔到农田
②钢瓶处理后,工人应立即________
A.转移到坡下 B.转移到坡上
③同时,迅速赶到的消防员向贮氯罐周围空中喷洒稀NaOH溶液,写出相关的离子方程式________
(2).将下列硅酸盐改写成氧化物的形式
①高岭石Al2(Si2O5)(OH)4:________
②正长石KAlSi3O8:________.
22. (8分) (2017高一上·仙桃期末) 盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
(1)除铁锈(主要成分为Fe2O3),写出反应原理的离子方程式________;
(2)制备硅胶,工业上可利用水玻璃和盐酸反应制备硅酸后,进一步处理可得到硅胶,写出水玻璃和盐酸反应的化学方程式________;
(3)制氯气,实验室可以利用浓盐酸和高锰酸钾常温下反应来制取氯气,
反应同时还生成了MnCl2、KCl和H2O,写出该反应的化学方程式________,在此反应中盐酸表现出了________性.
(4)工业上可以利用如图所示装置制备盐酸,首先向________(填A或B)管中通入氢气并点燃,然后再向________(填A或B)管中通入氯气进行反应,此时火焰的颜色为________,这样操作的理由是________.
三、综合题 (共1题;共5分)
23. (5分) (2018高一下·六安开学考) 用离子方程式表示下列变化过程
(1)除去铁粉中混有铝粉________。
(2)除去二氧化碳中的氯化氢气体________。
(3)二氧化硅固体中含有碳酸钙________。
(4)盛放氢氧化钠溶液的试剂瓶不用玻璃塞原因________。
(5)用稀盐酸清洗铜器皿表面上的铜绿________。
四、推断题 (共1题;共18分)
24. (18分) (2018高一上·苏州期末) 实验室用下列装置制取二氧化硫,并进行实验。根据实验回答问题。
(1) A中反应的化学方程式是________,该反应中浓H2SO4表现的性质是________。
A.只有氧化性
B.只有酸性
C.氧化性和酸性
(2)实验时,B、C、D中的溶液都褪色,期中SO2表现漂白性的________(用B、C、D填空),另两个反应中SO2表现________性。
(3) C中反应的离子方程式如下。请用双线桥标出电子转移情况并填空。
________
若C中溶液的体积是50mL,当反应中转移0.05mol单子是,溶液紫红色刚好完全褪去,则溶液的物质的量浓度是________ 。
(4)实验时,D中反应的离子方程式是________。
(5)实验时,E中反应的离子方程式是________, ________。
(6)实验时,F中观察到的显现是________。
(7)实验时,G中观察到有淡黄色沉淀生成,反应的化学方程式是________。
(8)若让你从以下试剂中推荐替代H中的,你最不推荐的是________,请阐述你不推荐的原因________。
A. 溶液
B.澄清石灰水
C.浓溴水
(9)若用50mL 4.0 溶液吸收气体,将吸收后的溶液进行真空低温蒸发并干燥至恒重(防止分解、氧化),得到白色固体。
①这些最多可以吸收标准状况下的的体积是多少(不计水溶解的 )?
②若白色固体是纯净物,则其质量可能是多少?
③若称得白色固体的质量是16.7g,请通过计算确认白色固体的成分及质量。
(以上①、②、③个问题请写出计算过程)
五、计算题 (共1题;共5分)
25. (5分) (2017高二上·巢湖开学考) 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是:________.不采用铜跟浓硫酸反应来制取硫酸铜的原因是________.
(2)在一定体积的10mol?L﹣1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积________(填“大于”、“等于”或“小于”)180mL.
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________.(4)将8g Fe2O3投入到150mL某浓度的稀硫酸中,再投入7g铁粉,充分反应后,收集到1.68L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4mol?L﹣1的NaOH 溶液150mL.则原硫酸的物质的量浓度为________.
参考答案一、单选题 (共20题;共40分)
1-1、
2-1、
3-1、
4-1、
5-1、
6-1、
7-1、
8-1、
9-1、
10-1、
11-1、
12-1、
13-1、
14-1、
15-1、
16-1、
17-1、
18-1、
19-1、
20-1、
二、实验题 (共2题;共13分) 21-1、
21-2、
22-1、
22-2、
22-3、
22-4、
三、综合题 (共1题;共5分) 23-1、
23-2、
23-3、
23-4、
23-5、
四、推断题 (共1题;共18分)
24-1、
24-2、
24-3、
24-4、
24-5、
24-6、
24-7、
24-8、
24-9、
五、计算题 (共1题;共5分) 25-1、
25-2、
25-3、
25-4、
