高三下学期第一次月考理综化学试题(答案解析)
河南省临颍县南街高级中学【精品】高三下学期第一次月考
理综化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.化学与社会、生活密切相关。对下列现象或事实的解释错误的是
A.A B.B C.C D.D
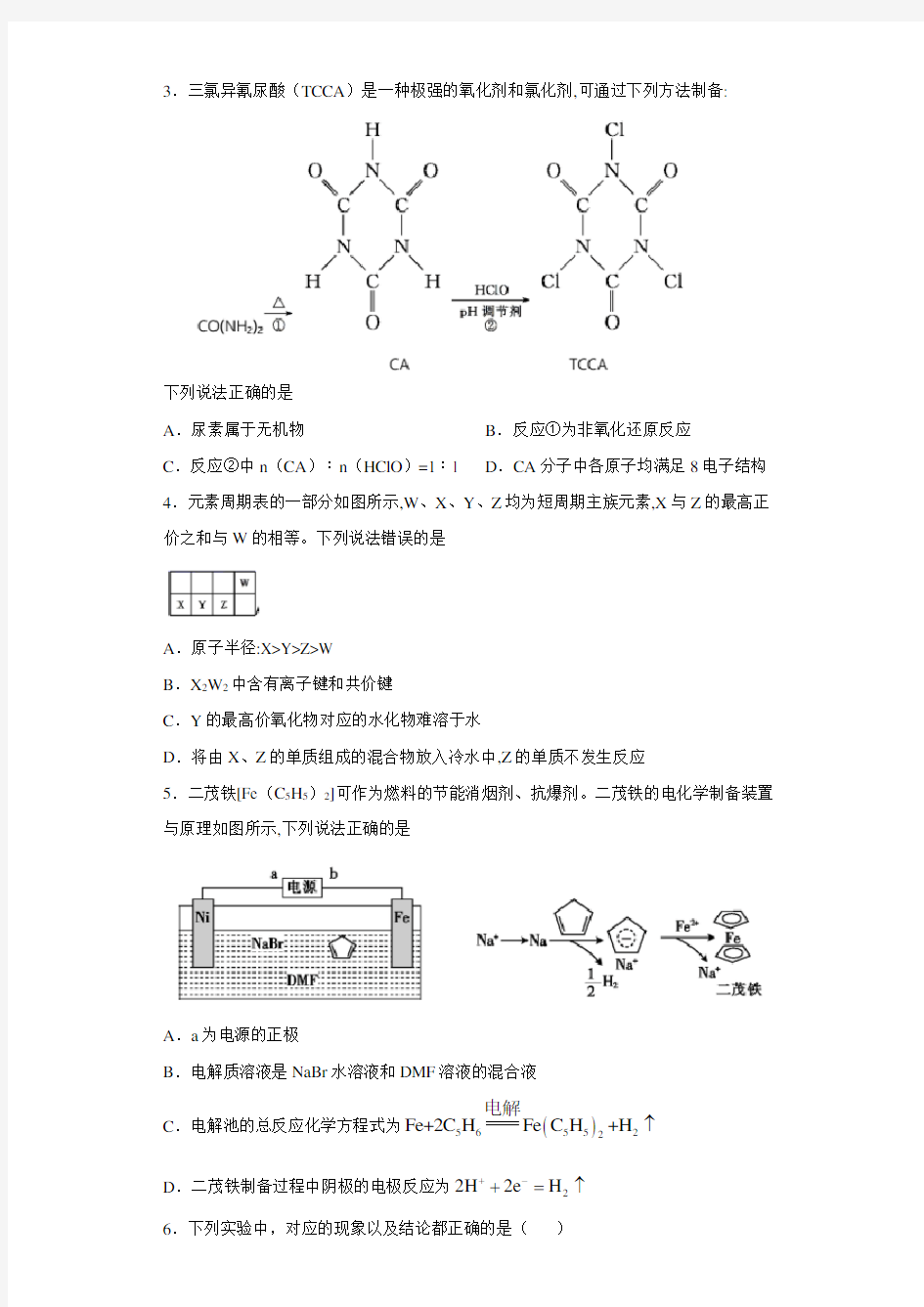
2.用图示装置及药品制备有关气体,其中能达到实验目的的是
A.制H2S B.制氨气
C.制NO2 D.制氯气
3.三氯异氰尿酸(TCCA )是一种极强的氧化剂和氯化剂,可通过下列方法制备:
下列说法正确的是
A .尿素属于无机物
B .反应①为非氧化还原反应
C .反应②中n (CA )∶n (HClO )=1∶1
D .CA 分子中各原子均满足8电子结构 4.元素周期表的一部分如图所示,W 、X 、Y 、Z 均为短周期主族元素,X 与Z 的最高正价之和与W 的相等。下列说法错误的是
A .原子半径:X>Y>Z>W
B .X 2W 2中含有离子键和共价键
C .Y 的最高价氧化物对应的水化物难溶于水
D .将由X 、Z 的单质组成的混合物放入冷水中,Z 的单质不发生反应
5.二茂铁[Fe (C 5H 5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
A .a 为电源的正极
B .电解质溶液是NaBr 水溶液和DMF 溶液的混合液
C .电解池的总反应化学方程式为()565522Fe+2C H Fe C H +H 电解↑
D .二茂铁制备过程中阴极的电极反应为22H 2e H +-+=↑
6.下列实验中,对应的现象以及结论都正确的是( )
A.A B.B C.C D.D
7.25℃时,用0.1 mol·L-1 NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物
种分布分数δ[δ(X)=-2-
2
n(X)
n(H A)+n(HA)+n(A)
]如图所示:
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1 NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.0.1 mol·L-1 Na2A溶液中:c(Na+) D.H2A的K2=1×10-7 二、原理综合题 8.金属钛在航天、潜海和医疗方面应用广泛。以钛铁矿[主要成分为钛酸亚铁(FeTiO 3),含少量Fe 2O 3]为原料制备钛的工艺流程如图所示。 (1)步骤②、③、④中,均需进行的操作是_____________(填操作名称)。 (2)滤液1中钛元素以TiO 2+形式存在,步骤①中生成TiO 2+的化学方程式为__________,硫酸质量分数对钛、铁浸出率的影响如图所示.据此判断,酸浸时所加硫酸的质量分数应为______(填范围)。. (3)请结合离子方程式解释步骤④中加热水的原因:__________。 (4)电解法制备Ti 的装置是以石墨为阳极,TiO 2为阴极,熔融CaO 为电解质。Ti 在 _______(填“阳极”或“阴极”)生成,____(填“能”或“不能”)将熔融CaO 换成石灰乳。 (5)以绿矾为原料,可以制备重要工业原料氧化铁,基本流程如下: ①绿矾溶液中离子浓度由大到小的顺序为__________。 ②F eCO 3达到沉淀溶解平衡时,室温下测得溶液的pH 为8,c(Fe 2+ )=1.0×10-5 mol ·L -1。所得FeCO 3中_____(填“含”或“不含”)有Fe(OH)2。已知: {Ksp[Fe(OH)2]= 4.9×10-17} 9.雾霾由多种污染物形成,包含颗粒物(PM2.5)、氮氧化物(NOx )、CO 、SO 2等。化学在解决雾霾污染中有着重要的作用。 (1)已知:①222CO(g)+O (g)=2CO (g)ΔH 1=-566.0 kJ· mol -1②222NO(g)+O (g)=2NO (g) ΔH 2=-116.5 kJ·mol -1③22N (g)+O (g)=2NO(g) ΔH 3=+180.5 kJ·mol -1,废气中NO 2 与CO 转化成无污染气体的热化学方程式为____。 (2)研究发现利用NH 3可除去硝酸工业尾气中的NO 。 NH 3与NO 的物质的量之比分别为1∶2、1∶1.5、3∶1时,NO 脱除率随温度变化的曲线如图所示。 ①曲线a 中,NO 的起始浓度为6× 10-4mg·m -3,从X 点到Y 点经过10 s,则该时间段内NO 的脱除速率为___________mg· m -3·s -1。 ②曲线c 对应的NH 3与NO 的物质的量之比是___,其理由是___。 (3)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO 2。活化过程的能量变化模拟计算结果如图所示。 无水情况下,一个氧分子的活化能为__ ,容易活化氧分子的条件是___(填“有水”或“无水”)。 (4)利用反应23226NO 8NH 7N H O 12+=+构成的电池既能有效消除氮氧化物的排放,减轻雾霾污染,又能充分利用化学能,装置如图所示。 ①B 极的电极反应式为___。 ②若反应转移1.2 mol 电子,A 极生成N 2的体积为___L (标准状况)。 三、工业流程题 10.实验室用酸性蚀刻废液(含+2+2--4Cu ,H ,CuCl ,Cl 等)和碱性蚀刻废液[NH 4+、Cu (NH 3)42+ 、NH 3· H 2O 等]制备CuI (白色固体)的实验流程如下: (1)步骤Ⅰ中发生了多个反应,其中()2+ 34Cu NH 与盐酸反应生成Cu (OH )Cl 的离子 方程式为____。 (2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。 (3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。 (4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。 ①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。 ②装置c中反应完成的现象是_____。 ③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。 四、有机推断题 11.(NH4)3[Fe(SCN)6]、[Fe(TCNE)(NCCH3)2][FeCl4] 、K4[Fe(CN)6]·3H2O 等铁的配合物用途非常广泛。回答下列问题: (1)基态Fe原子价层电子的电子排布图(轨道表达式)为______。 (2)Fe与Ca位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是____。 (3)配合物(NH4)3[Fe(SCN)6]中的H、S、N的电负性从大到小的顺序是_____。(4)[Fe(TCNE)(NCCH3)2][FeCl4]中,配体为CH3CN和TCNE()。 ①CH3CN中碳原子的杂化方式是____和_____。 ②TCNE中第一电离能较大的是___(填元素符号),分子中所有原子____(填“在”或“不在”)同一平面,分子中σ 键与π键的数目之比是___。 (5)K4[Fe(CN)6]·3H2O是食盐的抗结剂,强热分解有Fe3C生成, Fe3C 的晶胞结构如 图所示: Fe 3C 的密度为 ___(列出计算式)g·cm -3。 12.花椒毒素(H )有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A 为原料合成H 的一种合成路线如下: 已知: +ClCH 2CH 2Cl 3POCl ???→+HCl 回答下列问题: (1)A 的化学名称是 _____(用系统命名法)。 (2)G 中所含官能团的名称是 ____。 (3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。 E 中___ (填“有”或“没有”)手性碳。 (4)反应⑥的反应类型是 ____ 。 (5)D 的结构简式为 _____。 (6)F 与足量NaOH 溶液反应的化学方程式为 ____。 (7)芳香族化合物W 是D 的同分异构体,能发生银镜反应和水解反应,遇FeCl 3溶液发生显色反应;W 的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W 有____种。 (8)有机物M ()是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯 (ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用) 参考答案 1.A 【详解】 A.在通常情况下,铝表面有一层致密的氧化物薄膜,对铝有保护作用。当有食盐存在时,食盐能在潮湿的空气中电离出Na+和Cl-,而Cl-很容易在氧化膜的表面发生反应,形成吸附化合物AlCl3,AlCl3易溶于水,不能形成致密的保护膜,因而铝制容器跟食盐接触会被腐蚀。故A错误; B. 常温下铁在浓硝酸中钝化,则可用铁罐贮存浓硝酸,故B正确; C. S2O82-具有强氧化性,氧化性比Cu2+的强,能与铜制线路板中的铜反应,将铜氧化为Cu2+,故C正确; D.漂白粉的有效成分是次氯酸钙,次氯酸钙能与空气中的二氧化碳和水反应生成次氯酸,次氯酸遇光分解,导致漂白粉在空气中久置变质,故D正确; 故选A。 【点睛】 在通常情况下,铝表面有一层致密的氧化物薄膜,对铝有保护作用。当有食盐存在时,食盐能在潮湿的空气中电离出Na+和Cl-,而Cl-很容易在氧化膜的表面发生反应,形成吸附化合物AlCl3,AlCl3易溶于水,不能形成致密的保护膜是解答关键和易错点。 2.C 【详解】 A.浓硝酸具有强氧化性,能将硫化亚铁氧化,无法制备硫化氢气体,故A错误; B.实验室用氯化铵与消石灰共热制备氨气,加热氯化铵无法制备氨气,故B错误; C.常温下,铜与浓硝酸反应生成硝酸铜、二氧化氮和水,故C正确; D.稀盐酸与二氧化锰共热不反应,无法制得氯气,故D错误; 故选C。 【点睛】 浓盐酸与二氧化锰共热制得氯气,稀盐酸与二氧化锰共热不反应是解答关键。 3.B 【详解】 A. 尿素是由碳、氮、氧、氢组成的一种有机物,故A错误; B. 反应①为三分子尿素发生取代反应生成氰尿酸和氨气,该反应属于非氧化还原反应,故 B正确; C. 反应②中氰尿酸与次氯酸在一定pH下发生取代反应可制备三氯异氰尿酸,反应方程式为: +3HOCl→+3H2O,所以氰尿酸和次氯酸的物质的量之比应为1:3, 故C错误; D. 氰尿酸分子中氢原子最外层为2个电子,故D错误; 故选B。 4.D 【分析】 设X的最外层电子数为x,则Z和W的最外层电子数为(x+2)、(x+3),由X与Z的最高 正价之和与W的相等可得,x+(x+2)=x+3,解得x=1,由此可知X为Na元素、Y 为Mg 元素、Z为Al元素、W为C元素。 【详解】 A.同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半径依次增大,则原子半径:X>Y>Z>W,故A正确; B. X2W2为Na2C2,Na2C2中含有离子键和共价键,故B正确; C. Y 为Mg元素,氢氧化镁为难溶于水的氢氧化物,故C正确; D. 将由Na、Al的单质组成的混合物放入冷水中,钠首先和水反应生成氢氧化钠和氢气,反应生成的氢氧化钠和铝单质反应生成偏铝酸钠和氢气,故D错误; 故选D。 【点睛】 将由Na、Al的单质组成的混合物放入冷水中,钠首先和水反应生成氢氧化钠和氢气,反应生成的氢氧化钠和铝单质反应生成偏铝酸钠和氢气是解答关键,也是易错点。 5.C 【分析】 由二茂铁的电化学制备装置与原理可知,与电源正极b相连的铁为电解池的阳极,铁失电子发生氧化反应生成亚铁离子,与电源负极a相连的镍为电解池的阴极,钠离子在阴极上得电子发生还原反应生成钠,钠与发生置换反应生成和氢气,与亚铁离子反应生 成二茂铁和钠离子,制备二茂铁的总反应方程式为Fe+2+H2↑。 【详解】 A.由分析可知,a为电源的负极,b为电源的正极,故A错误; B. 与电源负极a相连的镍为电解池的阴极,钠离子在阴极上得电子发生还原反应生成钠,钠能与水反应,则电解质溶液不可能为NaBr水溶液,故B错误; C. 由分析可知,制备二茂铁的总反应方程式为Fe+2+H2↑,故C正确; D. 二茂铁制备过程中阴极上钠离子得电子发生还原反应生成钠,电极反应式为Na++e-=Na,故D错误; 故选C。 【点睛】 由二茂铁的电化学制备装置与原理可知,与电源正极b相连的铁为电解池的阳极,与电源负极a相连的镍为电解池的阴极是解答关键,钠离子在阴极上得电子发生还原反应生成钠是解答难点。 6.B 【详解】 A.气体含氨气、二氧化硫,可与氯化钡溶液反应生成亚硫酸钡,可观察到白色沉淀生成,故A错误; B.浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化硫,二氧化硫可使品红褪色,则浓硫酸具有强氧化性,故B正确; C.铁离子与碘离子可发生氧化还原反应生成碘,淀粉遇碘变蓝,则溶液变蓝,故C错误;D.漂白粉中加入浓硫酸,氯离子、次氯酸根离子发生氧化还原反应生成氯气,且生成硫酸钙沉淀,不能比较氯气与硫酸的氧化性,故D错误; 故答案选B。 7.C 【分析】 由图可知,实线为0.1mol?L-1 NaOH溶液滴定二元弱酸H2A的滴定曲线,虚线为 0.1mol?L-1 NaOH溶液滴定二元弱酸H2A的物种分布分数曲线。当n(NaOH): n(H2A)=1时,反应生成NaHA,NaHA溶液显酸性,当n(NaOH): n(H2A)=2时,反应生成Na2A,Na2A溶液显碱性,以此解答该题。 【详解】 A. 强碱滴定弱酸时,滴定终点,溶液呈碱性,应选用酚酞做指示剂,则用NaOH溶液滴定 0.1mol?L?1 NaHA溶液应用酚酞作指示剂,故A正确,但不符合题意; B. 由图可知,当n(NaOH): n(H2A)=1时,反应生成NaHA,NaHA溶液显酸性,说明HA?的电离程度大于水解程度,则溶液中c(Na+)>c(HA-)>c(A2-)>c(H2A),故B正确,但不符合题意; C. 0.1 mol·L-1 Na2A溶液中存在电荷守恒关系c(Na+)+c(H+)=c(HA?)+2c(A2?)+c(OH?),因Na2A 溶液显碱性,c(OH?)>c(H+),则:c(Na+) >c(HA-)+2c(A2-),故错误,但符合题意; D. 由图可知,当δ(X)为50%时,溶液中c(HA?)=c(A2?),pH=7,由 K2=(H+)c(A2?)/c(HA?)=c(H+)=1×10?7,故D正确,但不符合题意; 故选:C。 8.过滤FeTiO 3+2H2SO4? FeSO4+TiOSO4+2H2O 80%~85% TiO2++ 2H2O H2TiO3+2H+,水解反应是吸热反应,用热水促进反应向正反应方向进行阴极不能c(SO42-)>c(Fe2+)>c(H+)>c(OH-) 不含 【分析】 钛铁矿加酸溶解过滤得到含有TiO2+和Fe3+的滤液,向滤液中加铁粉还原Fe3+,过滤除去滤渣,对滤液冷却结晶,过滤得到FeSO4?7H2O和含有TiO2+的溶液,加入热水促进TiO2+水解生成H2TiO3,煅烧H2TiO3生成TiO2,电解可生成Ti,以此解答该题。 【详解】 (1)根据分析可知步骤②、③、④中,均需进行的操作是过滤; (2)反应物为钛铁矿,结合元素守恒可知方程式为FeTiO3+2H2SO4? FeSO4+TiOSO4+2H2O; 根据图像可知硫酸质量分数在80%~85%之间时浸出率最大; (3)TiO2+在水溶液中发生水解TiO2++ 2H 2O H2TiO3+2H+,水解反应是吸热反应,用热水促进反应向正反应方向进行,生成H2TiO3; (4)由TiO2生成Ti,Ti元素化合价降低发生还原反应,电解池中阴极得电子发生还原反应;若换成石灰乳,石灰乳中有水,阴极将产生氢气,无法得到金属钛,所以不能将熔融CaO 换成石灰乳; (5)①绿矾溶液中亚铁离子会发生水解使溶液显酸性,所以溶液中离子浓度由大到小为 c (SO 42-)>c (Fe 2+)>c (H +)>c (OH -); ②根据题意,pH 为8,则c (OH -)=1× 10-6mol/L ,因为c (Fe 2+)?c 2(OH -)=1.0×10-5×(1×10-6)2 =1.0×10-17<K sp [Fe(OH)2],故无Fe(OH)2生成。 9.2NO 2(g )+4CO (g )=N 2(g )+4CO 2(g ) △H=—1196.0kJ·mol -1 1.2×10—5 1:2 NH 3与NO 的物质的量的比值越大,NO 脱除率越大 0.75eV 有水 2NH 3-6e -+6OH -=N 2+6H 2O 3.36 【详解】 (1)由盖斯定律可知,①×2—②—③可得废气中NO 2与CO 转化成无污染气体的热化学方程式为2NO 2(g )+4CO (g )=N 2(g )+4CO 2(g ),则△H=△H 1×2—△H 2—△H 3=(-566.0 kJ·mol -1)—(-116.5 kJ·mol -1)—(+180.5 kJ· mol -1)=—1196.0kJ·mol -1,故答案为:2NO 2(g )+4CO (g )=N 2(g )+4CO 2(g ) △H=—1196.0kJ·mol -1; (2)①曲线a 中,NO 的起始浓度为6×10-4mg/m 3,A 点的脱除率为0.55,B 点的脱除率为 0.75,从A 点到B 点经过10s ,该时间段内NO 的脱除速率=436(10.75-0.550/) 10s mg m -??=1.2×10—5 mg· m -3·s -1,故答案为:1.2×10—5; ②NH 3与NO 的物质的量的比值越大,NH 3的物质的量越大,NO 脱除率越大,物质的量之比分别为1:2、1:1.5、3:1所对应的曲线分别为c 、b 、a ,故曲线c 对应NH 3与NO 的物质的量之比是1:2,故答案为:1:2;NH 3与NO 的物质的量的比值越大,NO 脱除率越大; (3)根据能量图分析,整个反应的活化能为活化能较大者,则没有水加入的反应活化能为E=0.75eV ;有水加入的反应的活化能为E=0.57eV ,所以水可使氧分子活化反应的活化能降低0.75eV-0.57eV=0.18eV ,故答案为:0.75eV ;有水; (4)①根据装置图可知,电极B 通入氨气,在KOH 溶液中氨气被氧化为氮气,电极反应式为2NH 3-6e -+6OH -=N 2+6H 2O ,故答案为:2NH 3-6e -+6OH -=N 2+6H 2O ; ②由化学方程式可知,A 极消耗5mol 二氧化氮,生成3mol 氮气,反应转移24mol 电子,则 反应转移1.2 mol 电子,A 极生成0.15mol 氮气,标准状况选体积为0.15mol ×22.4L/mol=3.36L , 故答案为:3.36。 【点睛】 根据能量图分析,整个反应的活化能为活化能较大者,则没有水加入的反应活化能为E=0.75eV ;有水加入的反应的活化能为E=0.57eV ,所以水可使氧分子活化反应的活化能降低是解答关键和难点。 10.Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+热水浴冷却结晶过滤(洗涤)分液漏斗Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O 三颈烧瓶中无紫色固体,只有白色固体可防止CuI被空气中的O2氧化使固体快速干燥并溶解表面可能混有的I2 【分析】 由流程图可知,酸性蚀刻废液和碱性蚀刻废液混合反应得到Cu(OH)Cl悬浊液,过滤,将Cu(OH)Cl加水、过浆后,与浓硫酸水浴加热反应生成硫酸铜,硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,硫酸铜晶体与碘、二氧化硫和水反应生成碘化亚铜白色固体。 【详解】 (1)步骤Ⅰ中Cu(NH3)42+与盐酸反应生成Cu(OH)Cl沉淀和氯化铵,反应的离子方程式 Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+,故答案为: Cu(NH3)42++3H++Cl-+H2O=Cu(OH)Cl↓+4NH4+; (2)步骤Ⅳ为Cu(OH)Cl加水、过浆后,与浓硫酸在控制pH为1~2,80 ℃下水浴加热反应反应生成硫酸铜,故答案为:热水浴; (3)步骤Ⅴ为硫酸铜粗溶液经蒸发浓缩、冷却结晶、过滤、干燥、洗涤得到硫酸铜晶体,故答案为:冷却结晶;过滤;洗涤; (4)①装置a中盛装浓硫酸的仪器为分液漏斗;圆底烧瓶中铜与浓硫酸共热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,故答案为:分液漏斗;Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O; ②当硫酸铜晶体与碘、二氧化硫和水反应完全生成碘化亚铜白色固体时,三颈烧瓶中无紫色固体,只有白色固体,故答案为:三颈烧瓶中无紫色固体,只有白色固体; ③装置d中的溶液为二氧化硫的饱和水溶液,碘化亚铜具有还原性,易被空气中的氧气氧化,用二氧化硫水的饱和水溶液洗涤碘化亚铜,可以防止碘化亚铜被空气中的氧气氧化;再用无水乙醇洗涤可以溶解除去碘化亚铜表面可能混有的单质碘,并能使固体快速干燥,故答案为:可防止CuI被空气中的O2氧化;使固体快速干燥并溶解表面可能混有的I2。 11.Fe的原子半径比Ca小,价电子数更多,金属键更强N >S>H sp3sp N 在1:1 7200 ??? 6.02 4.515 5.077 6.726 【分析】 (1)Fe元素的原子序数为26,由电子排布规律书写价层电子的电子排布图; (2)金属单质中金属原子的原子半径越大,价电子越少,金属键越弱,熔沸点越低;(3)元素的非金属性越强,电负性越大; (4)①—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp 杂化; ②TCNE分子是由4个氰基和1个碳碳双键构成,同一周期元素的第一电离能随着原子序数的增大而增大;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在 同一平面;分子中含有9个σ 键和9个π键; (5)由均摊法计算可得。 【详解】 (1)Fe元素的原子序数为26,基态Fe原子价层电子的电子排布图(轨道表达式)为 ,故答案为:; (2)Fe的价电子排布式为3d64s2,Ca的价电子排布式为4s2,Fe与Ca位于同一周期,Ca 的原子半径较大,且价电子较少,金属键较弱,则金属Ca的熔点、沸点等都比金属Fe低,故答案为:Fe的原子半径比Ca小,价电子数更多,金属键更强; (3)元素的非金属性越强,电负性越大,非金属性N>S>H,则电负性N>S>H,故答案为:N>S>H; (4)①CH3CN分子中含有—CH3和—C≡N,—CH3中饱和碳原子的杂化方式是sp3杂化,—C≡N中饱和碳原子的杂化方式是sp杂化,故答案为:sp3;sp ②TCNE分子是由4个氰基和1个碳碳双键构成,C、N属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,则第一电离能大小顺序是N >C;氰基中碳原子和氮原子在同一直线上,碳碳双键上的碳原子和连接的原子在同一平面, 则TCNE分子中所有原子在同一平面;分子中含有9个σ 键和9个π键,σ 键 与π键的数目之比为1:1,故答案为:N;在;1:1; (5)由晶胞结构可知,每个碳原子周围有6个铁原子,构成正八面体,正八面体的化学式 为Fe3C,体内碳原子形成1个正八面体、面心碳原子形成1 2 个正八面体、顶点和棱上碳原子 形成1 6个正八面体,则1个晶胞结构中含有4个Fe3C,由质量公式可得23 4180 6.0210 ? ? = (4.515×10—8×5.077×10—8)×6.726×10—8d,解得密度d=7200 6.02 4.515 5.077 6.726 ??? g·cm-3,故答 案为:7200 6.02 4.515 5.077 6.726 ??? 。 【点睛】 由晶胞结构可知,每个碳原子周围有6个铁原子,构成正八面体,正八面体的化学式为Fe3C, 体内碳原子形成1个正八面体、面心碳原子形成1 2个正八面体、顶点和棱上碳原子形成1 6 个 正八面体是解答关键。 12.1,2,3—苯三酚酯基、醚键和碳碳双键有消去反应 +3NaOH→+2H2O 1 【分析】 由有机物的转化关系和C的结构简式可知,在PCl3做催化剂作用下,与ClCH2COCl发生取代反应生成,则A为,B为; 一定条件下发生取代反应生成,在雷尼镍作用下,和氢气发生加成反应生成,则D为;与发生一系列反应生成,与(CH3)2SO4发生取代反应生成,一定条件下发生消去反应生成。 【详解】 (1)A的结构简式为,名称是1,2,3—苯三酚,故答案为:1,2,3—苯三酚;(2)G的结构简式为,含有的官能团为酯基、醚键和碳碳双键,故答案为:酯基、醚键和碳碳双键; (3)E的结构简式为,2号碳原子(带☆)连有4个不同的原子或基团,为手性碳,故答案为:有; (4)反应⑥为一定条件下发生消去反应生成,故答案为:消去反应; (5)D的结构简式为,故答案为:; (6)F的结构简式为,分子中含有的酯基和酚羟基能与氢氧化钠反应,与足量NaOH溶液反应生成和水,反应的化学方程式为 +3NaOH→+2H2O,故答案为:+3NaOH→ +2H2O; (7)D的结构简式为,其同分异构体W能发生银镜反应和水解反应说明含有—OOCH,遇FeCl3溶液发生显色反应说明含有酚羟基,核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1的结构只有符合,故答案为:1; (8)由M的结构简式和题给信息,利用逆推法可知,在PCl3做催化剂作用下,与ClCH2COCl发生取代反应生成,一定条件下发生取代反应,在雷尼镍作用下,和氢气发生加成反应生成,合成路线如下:,故答案 为:。 【点睛】 分子中含有的酯基和酚羟基,酯基和酚羟基能与氢氧化钠反应,注意1mol 酚酯能消耗2mol氢氧化钠是解答关键,也是易错点。
