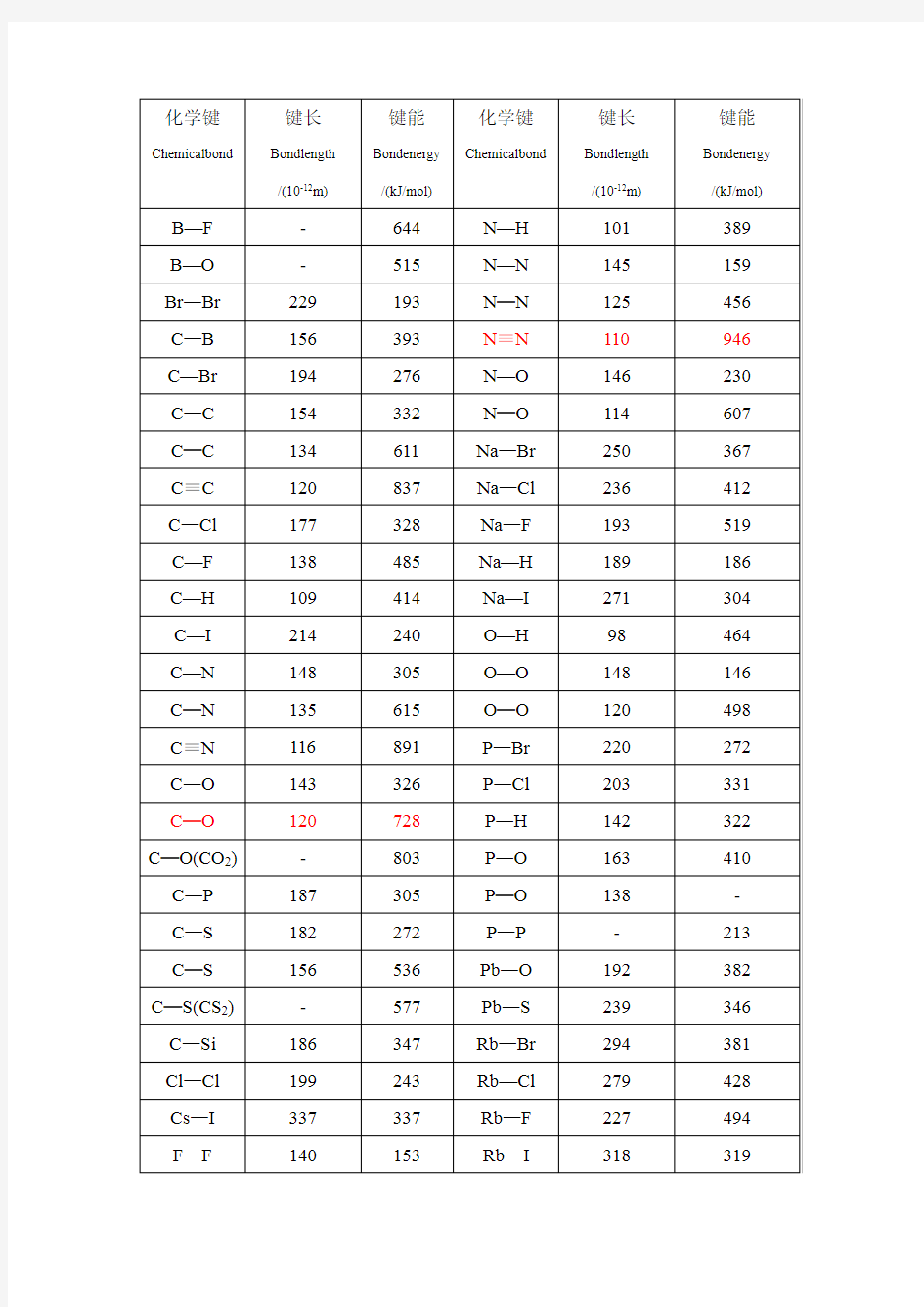
化学键能表

2019年高考真题专题汇编——元素周期表与周期律、化学键
2019年高考真题专题汇编——元素周期表与周期律1.(2019浙江)2019年是门捷列夫提出元素周期表150周年。根据元素周期律和元素周期 表,下列推断不合理 ...的是() A.第35号元素的单质在常温常压下是液体 B.位于第四周期第ⅤA族的元素为非金属元素 C.第84号元素的最高化合价是+7 D.第七周期0族元素的原子序数为118 【答案】C 【解析】 【详解】 A.35号元素是溴元素,单质Br2在常温常压下是红棕色的液体,A项合理; B.位于第四周期第ⅤA族的元素是砷元素(As),为非金属元素,B项合理; C.第84号元素位于第六周期ⅥA族,为钋元素(Po),由于最高正价等于主族序数,所以该元素最高化合价是+6,C项不合理; D.第七周期0族元素是第七周期最后一个元素,原子序数为118,D项合理。 故答案选C。 2.(2019北京)2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是() A.In是第五周期第ⅢA族元素 B.11549In的中子数与电子数的差值为17 C.原子半径:In>Al
D.碱性:In(OH)3>RbOH 【答案】D 【解析】 【分析】 A.根据原子核外电子排布规则,该原子结构示意图为,据此判断该元素 在周期表中的位置; B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,原子的质子数=电子数; C.同主族元素的原子,从上到下,电子层数逐渐增多,半径逐渐增大; D.同周期元素,核电荷数越大,金属性越越弱,最高价氧化物对应水化物的碱性越弱;【详解】 A.根据原子核外电子排布规则,该原子结构示意图为,因此In位于元素周 期表第五周期第IIIA族,故A不符合题意; B.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数,因此该原子的质子数=电子数=49,中子数为115-49=66,所以中子数与电子数之差为66-49=17,故B不符合题意; C.Al位于元素周期表的三周期IIIA族,In位于元素周期表第五周期IIIA族,同主族元素的
元素周期表周期物质结构化学键
元素周期表周期物质结构化学键
————————————————————————————————作者:————————————————————————————————日期:
元素周期表周期律物质结构化学键 西城 14.X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W 的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图。下列说法正确的是 A.五种元素中,原子半径最大的是W B.Y的简单阴离子比W的简单阴离子还原性强 C.Y与Z形成的化合物都可以和盐酸反应 D.Z与Q形成的化合物水溶液一定显酸性 东城 5.下列顺序不正确 ...的是 A.热稳定性:HF > HCl > HBr > HI B.微粒的半径:Cl-> Na+ > Mg2+ > Al3+ C.电离程度(同温度同浓度溶液中):HCl > CH3COOH > NaHCO3 D.分散质粒子的直径:Fe(OH)3悬浊液> Fe(OH)3胶体> FeCl3溶液 6.下列说法正确的是 A.含有离子键和共价键的化合物一定是离子化合物 B.元素原子的最外层电子数等于该元素的最高化合价 C.目前人们已发现的元素种类数目与原子种类数目相同 D.多电子原子中,在离核较近的区域内运动的电子能量较高 17.(10分) 短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:(1)Y在元素周期表中的位置是;X氢化物的电子式是。 答案17.(10分) (1)第3周期ⅢA族 丰台 8.短周期元素X、Y、Z在周期表中所处的位置如右图所示,三种元素的原子质子数之和为32,下列说法正确的是 Y A.三种元素中,Z元素的最高价氧化物对应的水化物的酸性最 强 B.X、Z两种元素的气态氢化物相互反应的产物是共价化合物 C.三种元素对应的气态氢化物中,Z元素形成的氢化物最稳定 D.Y元素的气态氢化物与Y的最高价氧化物对应的水化物不可能发生反应
元素周期表及化学键
元素周期表及化学键 一、高考中出现的考法 考查原子结构和性质,原子核外电子排布,并且通过核外电子排布进行元素的推断,化学键的分类及判别 二、知识讲解 考点/易错点1 元素周期表 1元素金属性强弱判断依据: 1.根据金属单质与水或者与酸反应置换出氢的难易程度。置换出氢越容易,则金属性越强。 2.根据金属元素最高价氧化物对应化水物碱性强弱。碱性越强,则原金属元素的金属性越强。 3.可以根据对应阳离子氧化性强弱判断。金属阳离子氧化性越弱,则元素金属性越强。 设计意图:通过从碱金属原子的结构可推知其化学性质,让学生初步理解物质的性质主要取决于原子的最外层电子数。培养学生观察思维能力。 2非金属性强弱的判断依据: ⑴.与氢气反应生成气态氢化物难易; ⑵.单质的氧化性(或离子的还原性); ⑶.最高价氧化物的水化物(HnROm)的酸性强弱; ⑷.非金属单质间的置换反应。
设计意图:教学过程是实现师生共同创造、共同成长的过程;本环节教学在经过前几个环节的探究学习后,将学生创新品质的培养列为重点,充分体现了现代教学以人为本,以学生为主体的思想。 3、原子结构 原子由原子核和核外电子构成,原子核在原子的中心,由带正电的质子与不带电的中子构成,带负电的电子绕核作高速运动。也就是说,质子、中子和电子是构成原子的三种微粒。在原子中,原子核带正电荷,其正电荷数由所含质子数决定。 (1)原子的电性关系:核电荷数 = 质子数 = 核外电子数 (2)质量数:将原子核内所有的质子和中子的相对质量取近似整数值加起来所得的数值,叫质量数。 质量数(A )= 质子数(Z )+ 中子数(N ) (3)离子指的是带电的原子或原子团。带正电荷的粒子叫阳离子,带负电荷的粒子叫阴离子。 当质子数(核电荷数)>核外电子数时,该粒子是阳离子,带正电荷; 当质子数(核电核数<核外电子数时,该粒子是阴离子,带负电荷。 (4)原子组成的表示方法 4、核素和同位素 ——元素符号 核电荷数—— (核内质子数) 质量数—— X A Z
元素周期表--化学键
第四节化学键 教学目标: 知识目标: 1.使学生理解离子键、共价键的概念,能用电子式表示离子化合物和共价化合物的形成。 2.使学生了解化学键的概念和化学反应的本质。 能力目标: 通过离子键和共价键的教学,培养对微观粒子运动的想像力。 教学重点:离子键、共价键 教学难点:化学键的概念,化学反应的本质 (第一课时) 教学过程: [引入]元素的性质主要决定于原子最外层的电子数。但相同原子形成不同分子时,由于分子结构不同,则分子的性质也不同,今天我们学习分子结构与物质性质的初步知识。 [板书]第四节化学键 [讲解]化学变化的实质是分子分成原子,而原子又重新结合为分子的过程,在这个过程中有分子的形成和破坏,因此,研究分子结构,对于了解不知所措垢结构和性能十分重要。 人们已发现了和合成了一千多万种物质,为什么这100多种元素能形成这么多形形色色的物质?原子是怎样结合的?为什么两个氢原子结合为一个氢分子,而两个氦原子不能结合成一个氦分子呢? 实验表明:水加热分解需10000C以上,破坏O—H需463KJ/mol。加热使氢分子分成氢原子,即使20000C 以上,分解率也不到1%,破坏H—H需436KJ/mol 所以,分子中原子之间存在相互作用。此作用不仅存在于相邻的原子之间,而且也存在于分子内不直接相邻的原子之间。 [板书]一、化学键:相邻人两个或多个原子之间强烈的相互作用,叫化学键 化学键主要有离子键、共价键、金属键 我们先学习离子键。 [板书]二、离子键 [实验]取一块黄豆大已切去氧化层的金属钠,用滤纸吸净煤油,放在石棉网上,用酒精灯预热。待钠熔融成球状时,将盛氯气的集气瓶扣在钠的上方,观察现象。 1.离子键的形成
必修二元素周期表、化学键、化学反应与能量习题练习(解析版)
必修二元素周期表、化学键、化学反应与能量习题练习 1.下列关于碱金属和卤素的说法中,错误的是 A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子能力最强 C.钾与水比钠与水的反应更剧烈 D.碱金属和卤素元素单质的熔沸点,随原子序数的增大而升高 【答案】D 【解析】 【分析】 【详解】 A.同主族元素从上到下,随着电子层的增多原子半径逐渐增大,即随着核电荷数的增加,碱金属元素和卤素的原子半径逐渐增大,A项正确; B.同主族从上到下,得电子能力逐渐减弱,失电子能力逐渐增强,故碱金属元素中锂原子失去最外层电子的能力最弱,卤素中氟原子得电子能力最强,B项正确; C.同主族元素从上到下单质的活泼性逐渐增强,金属和水的反应越来越剧烈,故钾与水的反应比钠与水的反应更剧烈,C项正确; D.卤素单质具有分子间作用力,根据对应组成和结构相似的物质,相对分子质量越大,分子间作用力就越大,物质的熔沸点越高,故卤素单质的熔沸点随原子序数的增大而升高;碱金属单质的熔沸点随原子序数的增大而降低,D项错误; 答案选D。 【点睛】 判断元素金属性或非金属性的强弱时,要注意以下不能作为判断依据: (1)通常根据元素原子在化学反应中得失电子的难易判断元素金属性或非金属性的强弱,而不是根据得失电子的多少来判断; (2)通常根据元素最高价氧化物对应水化物的酸碱性的强弱判断元素的金属性或非金属性的强弱,而不是根据其它化合物酸碱性的强弱来判断。 2.A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为 A.A>B>C B.A>C>B
化学元素周期表
物质结构与元素周期律 [考点扫描] 1.构成原子的粒子间的关系。 2.原子核外电子运动的特征。 3.原子核外电子的排布规律。 4.离子键、共价键的概念及形成。 5.化学键的概念,化学反应的本质。 6.常见原子、分子、离子、基的电子式书写。 [知识指津] 1.原子的组成 的含义:代表一个质量数为A,质子数为Z的原子。 在原子中,存在如下关系式: (1)质量关系:质量数(A)=质子数(Z)+中子数(N)。 (2)电子关系: ①对中性原子:核电荷数(Z)=质子数(Z) =原子序数(Z)=核外电子数(Z) ②对阳离子:核电荷数(Z)=质子数(Z) =原子序数(Z)>核外电子数(Z) ③对阴离子:核电荷数(Z)=质子数(Z) =原子序数(Z)<核外电子数(Z) 2.核外电子的运动特征 (1)核外电子的运动特征:质量小(9.11×10-31kg),带负电荷;运动的空间范围小(直径约为10-10);运动速度快(接近光速3×108m·s-1)。 (2)核外电子的运动规律:不服从牛顿定律,只能用统计方法指出它在原子核外空间某处出现机会的多少,核外电子的运动只能用电子云来描述。 (3)氢原子的电子云(是球形对称)示意图中的小黑点只是表示氢原子核外的一个电子曾经在这里出现过的“痕迹”,绝不是无数个电子在核外的运动状态。 3.核外电子的排布 多电子原子里,核外电子分层运动,也就是分层排布。一般规律有:核外电子总是尽先排布在能量最低的电子层里;各电子层最多容纳的电子数为2n2;最外层电子数目不超过8个(K层为最外层时不超过2个);原子次外层电子数目不超过18个,倒数第三层电子数不超过32个。以上四条规律是相互联系的,不能孤立地理解。核外电子排布规律简单总结为“一低四不超”。核外电子的排布可用原子或离子结构示意图表。 4.离子键和共价键 (1) 项 目 离子键共价键 概 念 使阴、阳离子结合成化合物的静电作用原子间通过共用电子对形成的相互作用 粒 子 阴、阳离子原子 本 质 阴、阳离子间的静电作用(吸引和排斥) 共用电子对与两核间的相互作用 形成条件活泼金属与活泼非金属化合形成 非金属元素原子间及不活泼金属与非金属原子 间形成 形成物 质 离子化合物某些共价单质和某些共价化合物(2) 共价键可分为极性键和非极性键,二者区别如下:
元素周期表知识点总结
第一章元素周期表知识点总结一、原子结构 二、元素周期表和元素周期律 三、化学键
四、背诵前20号元素和七主族和稀有气体的元素符号及其化合价
专题一元素及性质的推断 1.推断元素位置的思路 根据原子结构、元素性质及相关已知条件,可推算原子序数,判断元素在元 素周期表中的位置等,基本思路如下: 2.推断元素及物质的“题眼”总结 (1)含量与物理性质 ①地壳中含量最高的非金属元素是氧(O),居于第二位的是硅(Si),含高 的金属元素是铝(Al)。 ②金属单质中,常温下呈液态的是汞(Hg)。 ③非金属单质中,常温下呈液态的是溴(Br2)。 ④天然物质中硬度最大的单质是金刚石。 ⑤溶于水后溶液显碱性的气态氢化物一般是NH3。 ⑥沸点最高的非金属元素氢化物是H2O。 ⑦形成的化合物种类最多的元素是碳(C)。 ⑧最高价氧化物对应的水化物酸性最强的是HClO4。 (2)化学性质与用途 ①单质与水反应最剧烈的非金属元素是氟(F)。 ②气态氢化物与最高价氧化物对应的水化物能起化合反应的是氮(N): NH3+HNO3===NH4NO3。 ③气态氢化物与其低价氧化物能反应生成该元素的单质的元素是硫(S): 2H2S+SO2===3S↓+2H2O。 ④气态氢化物的水溶液可雕刻玻璃的元素是氟(F)。
⑤能导电的非金属单质有石墨(C)和晶体硅(Si)。 ⑥能与强碱溶液作用的单质有Al、Cl2、Si: 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ Cl2+2NaOH===NaCl+NaClO+H2O Si+2NaOH+H2O===Na2SiO3+2H2↑ 专题二化学键类型的判断 (1)化学键与物质 ①并不是所有的物质中都存在化学键。因为稀有气体是单原子分子,故稀有 气体是没有任何化学键的物质。 ②离子化合物与化学键的关系 a.对于离子化合物而言,因为存在着阴、阳离子,所以肯定有离子键,如NaCl的构成微粒是Na+、Cl-,它们之间唯一的作用就是离子键。 b.离子化合物中存在的阴、阳离子,既可像NaCl一样只有简单的Na+、Cl -,也可能像NaOH这样含有复杂的阴、阳离子,此时,离子化合物中既 有Na+与OH-之间的离子键,又有氢原子与氧原子之间的共价键。所以, 离子化合物中肯定有离子键,可能有共价键,而且离子键只能存在于离 子化合物中。 ③共价化合物与化学键的关系 共价化合物的构成微粒是分子或原子,不存在离子,所以共价化合物中 不可能存在离子键,只有共价键。 专题二化学键类型的判断 (1)化学键与物质 ①并不是所有的物质中都存在化学键。因为稀有气体是单原子分子,故稀有 气体是没有任何化学键的物质。 ②离子化合物与化学键的关系 a.对于离子化合物而言,因为存在着阴、阳离子,所以肯定有离子键,如 NaCl的构成微粒是Na+、Cl-,它们之间唯一的作用就是离子键。 ④单质与化学键的关系 除稀有气体外,其他任何单质都存在化学键,如金属中存在金属键(不作要求),某些非金属单质(如石墨等)中存在共价键。无论是金属还是非金属单质,它 们均不可能存在离子键。 (2)化学键与元素
2021年高考化学三轮复习专题:原子结构元素周期律元素周期表和化学键
原子结构元素周期律元素周期表和化学键 1.(2020高考全国1卷真题)1934年约里奥–居里夫妇在核反应中用α粒子(即氦核4 2 He) 轰击金属原子W Z X,得到核素30Z+2Y,开创了人造放射性核素的先河:W Z X+4 2 He→30 Z+2 Y+10n。 其中元素X、Y的最外层电子数之和为8。下列叙述正确的是 A.W Z X的相对原子质量为26 B.X、Y均可形成三氯化物 C.X的原子半径小于Y的 D.Y仅有一种含氧酸 【答案】B 【解析】原子轰击实验中,满足质子和质量数守恒,因此W+4=30+1,则W=27,X与Y原子之间质子数相差2,因X元素为金属元素,Y的质子数比X大,则Y与X位于同一周期,且Y位于X右侧,且元素X、Y的最外层电子数之和为8,设X最外层电子数为a,则Y的最外 层电子为a+2,解得a=3,因此X为Al,Y为P。A.27 13 Al的质量数为27,则该原子相对原子质量为27,故A错误;B.Al元素均可形成AlCl3,P元素均可形成PCl3,故B正确;C.Al 原子与P原子位于同一周期,且Al原子序数大于P原子序数,故原子半径Al>P,故C错误;D.P的含氧酸有H3PO4、H3PO3、H3PO2等,故D错误;故答案为:B。 2.(2020高考全国2卷真题)一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是 A.该化合物中,W、X、Y之间均为共价键 B.Z的单质既能与水反应,也可与甲醇反应 C.Y的最高化合价氧化物的水化物为强酸 D.X的氟化物XF3中原子均为8电子稳定结构 【答案】D 【解析】一种由短周期主族元素形成的化合物,具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大,且总和为24,根据图示,W为1价形成共价键,W为氢,Z为+1价
元素周期表知识点总结
考纲要求: ①了解元素、核素和同位素的含义。 ②了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 ③了解原子核外电子排布规律。 ④掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 ⑤以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 ⑥以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 ⑦了解金属、非金属元素在周期表中的位置及其性质递变规律。 ⑧了解化学键的定义。了解离子键、共价键的形成。 知识点总结: 中子N同 位素(核素)
原子核 → 质量数(A=N+Z ) 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元 素 → 元素符号 原子结构 : 素的 决定原子呈电中性 电子数(Z 个): 化学性质及最高正价和族序数 核外电子 运动特征:体积小,运动速率高(近光速) 排布规律 → 电子层数 周期序数及原子半 径 表示方法 → 原子(离子)的电子式、原子结构示 意图 1.原子结构 [核电荷数、核内质子数及核外电子数的关系] X) (A Z
核电荷数=核内质子数=原子核外电子数 注意:(1) 阴离子:核外电子数=质子数+所带的电荷数 阳离子:核外电子数=质子数-所带的电荷数 (2)“核电荷数”与“电荷数”是不同的,Cl-的核电荷数为17,电荷数为1. [质量数] 用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数. 说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N. X的意义:表示元素符号为X,质量数为A,核电 (2)符号A Z Na中,Na原子的质量数为荷数(质子数)为Z的一个原子.例如,23 11 23、质子数为11、中子数为12. [原子核外电子运动的特征] (1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少. (2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现
课时5 元素周期表 化学键
课时5 元素周期表化学键 复习 目标 1. 了解物质的组成、结构和性质的关系。 2. 了解元素周期表的结构及其应用。 3. 以第3周期、ⅠA和ⅦA族为例,掌握同一周期、同一主族内元素性质 的递变规律与原子结构的关系。 4. 了解金属、非金属在元素周期表中的位置及其性质递变的规律。 5. 认识化学键的含义;了解离子键和共价键的形成;了解常见离子化合 物和共价化合物的形成过程。 6. 能识别典型的离子化合物和共价化合物;能从化学键变化的角度认识 化学反应的实质。 知识 网络 问题 思考 问题1如何用原子结构理论来解释同一周期元素(稀有气体除外)、同一主族元素性质的变化规律? 问题2离子化合物中是不是一定含有金属元素?含有共价键的化合物是不是一定是共价化合物?
【自主学习】 考点1元素周期表与元素周期律 【基础梳理】 1. 元素周期表 (1) 元素周期表的编排原则 周期:将相同的元素按递增的顺序从左到右排成横行。 族:把相同的元素(个别除外)按电子层数递增的顺序从上到下排成纵行。 (2) 元素周期表的结构 注意:镧系元素和锕系元素分别位于第6周期和第7周期,均在ⅢB族(第3列)。从ⅢB 族到ⅡB族(第3~12列,共10个纵行)的元素统称为过渡金属元素。
(3) 元素周期表与原子结构的关系周期序数= 主族序数= 2. 元素周期律 (1) 元素周期律 (2) 同周期、同主族元素性质的递变规律 内容同周期(从左到右) 同主族(自上而下) 原 子 结 构 核电荷数逐渐逐渐 电子层数依次逐渐 原子半径逐渐逐渐 元 素 性 质 主要化合价 最高正价+1→+7;最低负价- 4→-1 最高正价=主族序数(O、F除 外) 金属性逐渐逐渐 非金属性逐渐逐渐 化 合 物 性 质 最高价氧化 物对应水化 物 酸性;碱性酸性;碱性 氢化物稳定 性 例题1(2015·江苏高考)短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质广泛用作半导体材料。下列叙述正确的是()
元素周期表练习及答案
元素周期表练习---黄博伟 一、选择题 1.美国劳伦斯国家实验室曾在1999年宣布用86Rb离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文;但是科学家们相信,完整的第7周期包含的元素数目与第6周期相同。若118号元素将来被确认,则下列预测合理的是() A.它的中子数是118 B.它是第8周期元素 C.它是活泼的金属元素D.它的最外层电子数是8 2.14C具有放射性,它能自发放出某种射线,而衰变成其他元素。考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年。下列考古遗址发现的遗物中能用14C测定年代的是() A.战国曾侯乙墓的青铜编钟(距今约2400年) B.马家窑文化遗址的粟(距今约5300年) C.秦始皇兵马俑(距今约2200年) D.元谋人的门齿(距今约170万年) 3.对于第二周期从左到右的主族元素,下列说法中不正确的是() A.原子半径逐渐减小B.电子层数逐渐增多 C.最高正化合价逐渐增大D.元素的非金属性逐渐增强4.据报道,某些花岗岩会产生氡(22286Rn),这是一种放射性很强的原子,会对人体产生伤害,因此,家庭装修时应尽量避免使用天然产的花岗岩材料。已知氡是一种稀有气体元素,下列叙述正确的是() A.该原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子层结构 B.该原子最外层有8个电子 C.该原子中子数是86 D.1 mol气体氡的质量大约是444 g 5.2011年3月17日,因日本福岛第一核电站发生核辐射泄漏,放射碘可能被附近居民吸入,引发甲状腺疾病或甲状腺癌。我国香港和内地出现抢购碘盐的疯狂热潮,用于防护核辐射,医疗专家提醒:由于碘盐中碘含量相对较低,根本起不到预防放射性碘的作用,不可盲目过量吃碘盐或碘片,否则可能诱发甲状腺毒症、甲状腺技能减退、甲状腺肿等疾病。已知核辐射中放射性碘(碘-131)的核电荷数为53,则下列说法不正确的是() A.碘131I原子核所含中子数是78 B.核能的利用证实原子的可分性 C.碘127I原子和放射性碘原子131I属于同位素 D.碘127I原子和碘131I原子的质子数不同 6.短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A 与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是() A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物 C.A的氧化物熔点比B的氧化物高D.A与C可形成离子化合物 7.下列叙述正确的是() A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 B.ⅠA族元素的金属性比ⅡA族元素的金属性强 C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 D.第三周期元素的离子半径从左到右逐渐减小 8.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是() A.这几种元素在自然界中都不能以游离态存在 B.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 C.C、D、E的半径:C>D>E D.化合物AE与CE具有相同类型的化学键 9.已知1~18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同电子层结构,下列关系
(完整版)元素周期表及元素周期律练习题答案
元素周期表及元素周期律 1.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的 核外电子层结构。下列推测不正确的是()。 A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2- C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强 【点评】在周期表中,元素的原子序数差因周期表结构出现以下两种情况:(1)同主族,相邻周期元素原子序数之差的判断。①第ⅠA、ⅡA族元素,相差上一周期元素所在周期所含元素的种数。②第ⅢA~ⅦA族元素,相差下一周期元素所在周期含有的元素的种数。 (2)同周期相邻主族元素原子序数之差的判断。①ⅠA、ⅡA元素或ⅢA~ⅦA相邻元素相差1。②ⅡA、ⅢA元素:若为第二或第三周期则相差1,若为第四或第五周期相差11,若为第六或第七周期则相差25。 2.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2 -和C-,B2+和C-具有相同的电子层结构。下列说法正确的是()。A.原子序数:A
①非金属元素不可能组成离子化合物②构成分子的粒子一定含有共价键 ③共价化合物中可能含有离子键④离子化合物中可能含有共价键⑤非极性键只存在于双原子单质分子里⑥不同元素组成的多原子分子里的化学键一定都是极性键 A.①②④⑥ B.②④⑤⑥ C.①③⑤⑥ D.只有④ 5.W、X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别 为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是( ) A.原子最外层电子数:X>Y>Z B.单质沸点:X>Y>Z C.离子半径:X2->Y+>Z-D.原子序数:X>Y>Z 6.根据原子结构及元素周期律的知识,下列推断正确的是 A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 B.核外电子排布相同的微粒化学性质也相同 C.Cl ̄、S2 ̄、Ca2+、K+半径逐渐减小 D.35 17Cl与 37 17Cl得电子能力相同
元素周期表
必修2 第一章物质结构元素周期律 第一节元素周期表教学设计 一、本章在教材中所处的地位和作用 通过初三和必修I的学习,学生已经基本具备了一定的无机化学基础知识。例如初三学习的原子的构成、核外电子排布、元素周期表简介等一些基本的物质结构知识,这些为本章的学习奠定了一定的基础。在本章中,这些知识将更加细化,理论性更强,体系更加完整。通过《物质结构元素周期律》的学习,可以使学生对于所学元素化合物等知识进行综合、归纳。同时,作为理论指导,学生能更好的把无机化学知识系统化、网络化。在物质结构的基础上,将元素周期表的学习和元素周期律的学习结合起来,将学生在初中和必修I中所学习的氧化还原反应和许多元素化合物的知识连汇贯通。在第三节,通过化学键的学习,可以为今后有志深入学习化学的同学打下一定的基础。 总之,本章内容既是必修的重要理论内容,也是为选修内容的学习打下良好的基础。 二、本章内部结构关系 本章以物质结构和元素周期律为主要内容和线索,将原子结构、碱金属与卤素的性质、电子层排布、化学键、元素周期表和周期律紧密结合。 本章内容划分为三节。第一节为元素周期表:它主要介绍了元素周期表的结构,并且通过碱金属和卤素两个典型的族,引入同一族的元素的性质递变,最后基本了解元素、核素、同位素等几个基本概念;第二节是元素周期律:本节通过核外电子排布的学习,用第三周期为例,通过典型金属和典型非金属的性质递变,引入元素周期律;第三节是化学键:介绍了离子键和共价键,极性键和非极性键,电子式和结构式,本节主要是为了选修内容和化学专业的同学打基础。全章内容的设计,通过实验和同学们比较熟悉的元素化合物,利用探究模式,体现了由感性认识上升到理性认识的科学认知规律。 本章内容虽然是理论性知识,但教材结合元素化合物知识和化学史实来引入和解释,使理论知识与元素化合物知识相互融合,以利于学生理解和掌握。 本章具体的内容及相互关系如下: 三、教学目标分析
元素周期表,化学键练习及答案
元素周期表.化学键练习 一、选择题 1.19世纪中叶,门捷列夫的突出贡献是() A.提出原子学说B.发现元素周期律 C.提出分子学说D.发现氧气 2.元素周期律的发现对新元素的发现、化学理论和实验等研究工作起到了指导作用。周期律揭示的规律包括以下内容中的() ①元素的性质随相对原子质量的递增作周期性变化 ②元素的性质是元素原子序数的周期性函数 ③事物的量变可以引起质变 ④元素性质的递变只取决于其核电荷数的递变,与原子结构无关 A.①②B.①③C.①④D.①②③④ 3.在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对于延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物的分子式为RO3,则R元素的名称为()A.硫B.砷C.硒D.硅 4.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能是()A.X+2B.X+4C.X+8D.X+18 5.短周期元素M和N的离子M2+和N2-具有相同的电子层结构,则下列说法正确的是() A.M2+的离子半径比N2-小B.M的原子序数比N小 C.M和N原子的电子层数相等D.M和N原子最外层电子数相等 6.有人认为在元素周期表中,位于ⅠA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是() A.HF B.H3O+C.NaH D.H2O2 7.“1998中国十大科技成果”之一是合成一维纳米氮化镓,已知镓是ⅢA族元素,则氮化镓的化学式可能是() A.Ga3N2B.Ga2N3C.GaN D.Ga3N
8.下列说法中错误的是() A.原子及其离子的核外电子层数等于该元素所在的周期数 B.元素周期表中从IIIB族到IIB族之间的10个纵行的元素都是金属元素 C.除氦外的稀有气体原子的最外层电子数都是8 D.同一元素的各种同位素的物理性质不同、化学性质相似 9.已知下列元素的原子半径: 根据以上数据,磷原子的半径可能是() A.0.80×10-10m B.1.10×10-10m C.1.20×10-10m D.0.70×10-10m 10.张青莲是我国著名的化学家。1991年,他准确测得In的相对原子质量为 114.818,被国际原子量委员会采用为新的标准值。这是相对原子质量表中首 次采用我国测定的相对原子质量值。已知In的原子结构如图所示,则下列关 于In的说法不正确的是() A.In为长周期元素B.In为过渡元素 C.In容易导电导热D.In在反应中容易失电子 11.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有() A.1对 B.2对 C.3对 D.4对 12.下列叙述正确的是() A.同周期元素的原子半径以VII A族的为最大 B.在周期表中零族元素的单质全部是气体 C.I A、II A族元素的原子,其半径越大就越容易得电子 D.所有主族元素的原子形成单原子离子时的最高价数都和它的族序数相等
