原核表达综述

[Merck推荐]原核表达秘笈之宿主菌株选择指南
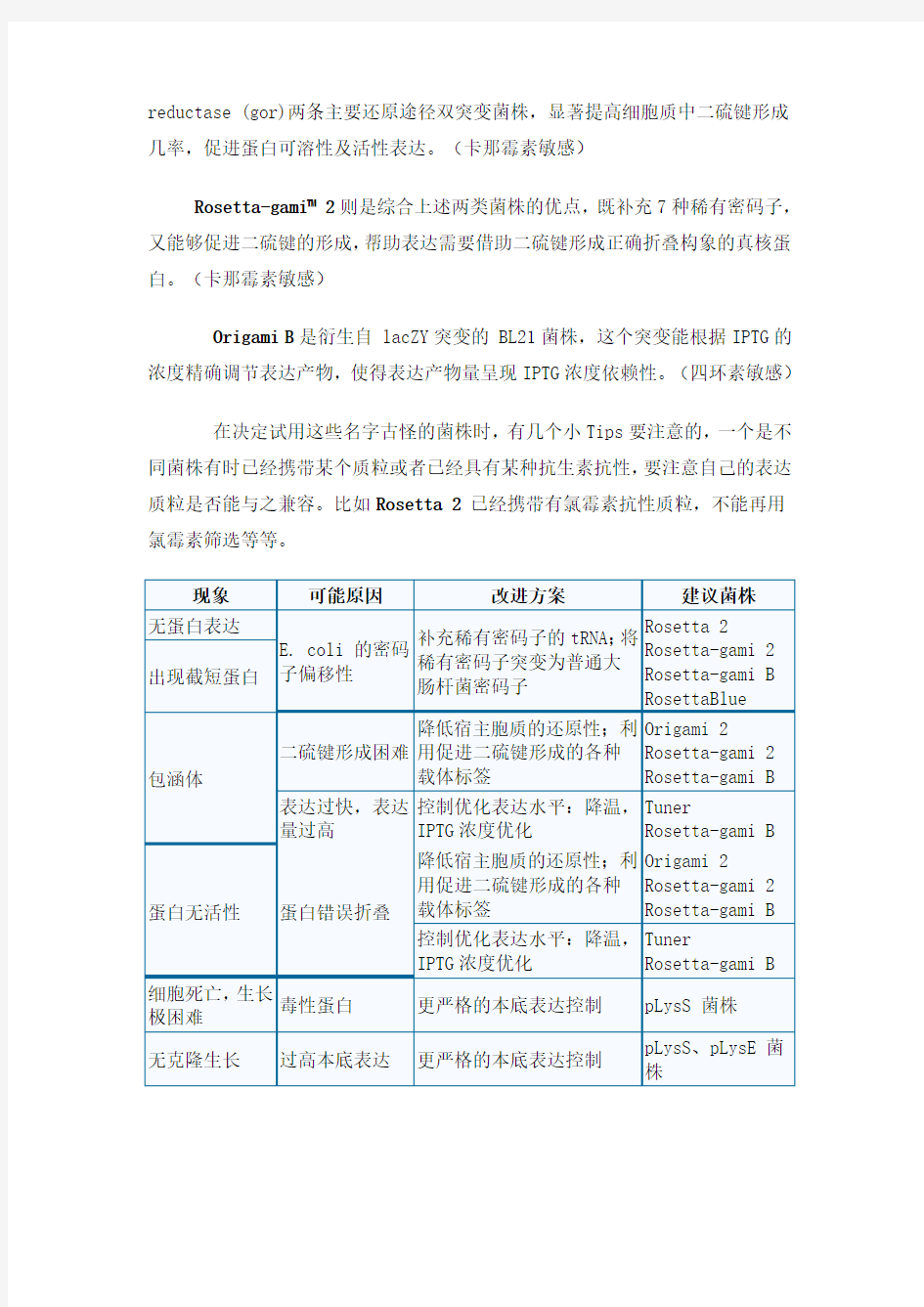
在原核蛋白表达过程中,选择构建一个合适原核表达体系需要综合考虑3大因素:表达载体、宿主菌株、表达诱导条件,以获得最满意的表达效果。
事实上,在平时的实验中,最容易被忽视的就是宿主菌的选择——多数人会直接选择自己实验室曾经用过的表达菌株,或者是载体配套的菌株,而不去追究原因——即使表达结果不佳,大多在表达条件和载体上找原因,也不会考究菌株的选择是否适合。
作为原核表达的宿主,对外源基因的表达会产生一定的影响,是勿庸置疑的。每一个宿主细胞都像一个微观的小工厂,按照细胞固有的程序完成“你给它们安排的生产任务”——因为很难亲眼观察微观世界中表达是如何进行的,当出现问题时,我们需要经验判断问题所在。宿主细胞对原核表达可能会产生哪些影响呢?
知其然还要知其所以然。比如,菌株内源的蛋白酶过多,可能会造成外源表达产物的不稳定,所以一些蛋白酶缺陷型菌株往往成为理想的起始表达菌株。堪称经典的BL21系列就是lon和ompT蛋白酶缺陷型,也是我们非常熟悉的表达菌株。大名鼎鼎的BL21(DE3)融源菌则是添加T7聚合酶基因,为T7表达系统而设计。
真核细胞偏爱的密码子和原核系统有不同,因此,在用原核系统表达真核基因的时候,真核基因中的一些密码子对于原核细胞来说可能是稀有密码子,从而导致表达效率和表达水平很低。改造基因是比较麻烦的做法,Rosetta 2系列就是更好的选择——这种携带pRARE2质粒的BL21衍生菌,补充大肠杆菌缺乏的七种(AUA, AGG, AGA, CUA, CCC, GGA 及CGG)稀有密码子对应的 tRNA,提高外源基因、尤其是真核基因在原核系统中的表达水平。(已经携带有氯霉素抗性质粒)
当要表达的蛋白质需要形成二硫键以形成正确的折叠时,可以选择K–12
衍生菌Origami 2系列,thioredoxin reductase (trxB) 和glutathione
reductase (gor)两条主要还原途径双突变菌株,显著提高细胞质中二硫键形成几率,促进蛋白可溶性及活性表达。(卡那霉素敏感)
Rosetta-gami? 2则是综合上述两类菌株的优点,既补充7种稀有密码子,又能够促进二硫键的形成,帮助表达需要借助二硫键形成正确折叠构象的真核蛋白。(卡那霉素敏感)
Origami B是衍生自 lacZY突变的 BL21菌株,这个突变能根据IPTG的浓度精确调节表达产物,使得表达产物量呈现IPTG浓度依赖性。(四环素敏感)
在决定试用这些名字古怪的菌株时,有几个小Tips要注意的,一个是不同菌株有时已经携带某个质粒或者已经具有某种抗生素抗性,要注意自己的表达质粒是否能与之兼容。比如Rosetta 2已经携带有氯霉素抗性质粒,不能再用氯霉素筛选等等。
原核表达个人秘笈:表达前的分析比什么都重要
表达不同于其它一些实验,比如:提取质粒、PCR、电镜切片,这些人为控制的因素比较多,出问题相对来说也比较好分析。表达呢,你把质粒克隆好啦,交给细胞,然后有些事情就不全是你要怎样就怎样了。原核表达在表达当中来说还是比较简单,细菌培养条件简单、生长速度快,需要的仪器和培养基都比较便宜。当然,它也存在一些缺乏高级修饰、细胞内部还原性过高等缺点。
原核表达从一开始的设计就非常重要,所谓好的开始是成功的一半。做足准备功夫,可是省去很多将来后悔的事情。首先,我们要根据是否要求可溶将载体分成两大类,如果希望可以同时尝试多种表达系统,也有许多商业化的系统供选择。
前面已经介绍过许多公司的商业化载体、菌株和多系统表达体系,现在我想先从自己的蛋白分析讲起。同样的载体、同样的系统,很可能表达这个蛋白表达量奇高,但是另外一个就是做不出来,所以没有万能的载体,只有永恒的分析。当然如果你的蛋白曾经在原核系统中成功表达出来那是最好的,选择同样的载体表达成功率会高很多。如果没有也最好尝试找一些曾经表达过和你的蛋白拥有相类似结构的文献。比如大部分含有哺乳动物src同源的SH2蛋白相互作用域的蛋白都是用pGEX系列载体表达出来的。根据经验而言,含有较少半胱氨酸和脯氨酸的、平均大小为60kD的单体蛋白较容易表达。
在下面将列出几个影响表达的因素,大家可以在表达前根据这几个因素自己分析一下:
1.翻译起始位点
现在大部分的表达载体都提供起始位点,所以它已经把起始密码子与
核糖体结合位点的距离进行优化了,一般情况下不需要自己再加,不过还是要留意载体图谱上是否注明有起始密码子和终止密码子
2.GC含量
表达序列中的GC含量超过70%的时候可能会降低蛋白在大肠杆菌中的表达水平。GC含量可以利用DNA STAR、Vector NTI Suite等软件进行预测。
3.二级结构
在起始密码子附近的mRNA二级结构可能会抑制翻译的起始或者造成翻译暂停从而产生不完全的蛋白。如果利用软件分析DNA或RNA结构上有柄(stem)结构,并且结合长度超过8个碱基,这种结构会因为位点专一突变等因素而变得不稳定。
4.基因或者蛋白的大小
一般说来小于5kD或者大于100kD的蛋白都是难以表达的。蛋白越小,越容易被降解。在这种情况下可以采取串联表达,在每个表达单位(即单体蛋白)间设计蛋白水解或者是化学断裂位点。如果蛋白较小,那么加入融合标签GST、Trx、MBP或者其它较大的促进融合的蛋白标签就较有可能使蛋白正确折叠,并以融合形式表达。
对于另一个极端,大于60kD的蛋白建议使用较小的标签,如6×组氨酸标签。对于结构研究较清楚的蛋白可以采取截取表达。当然表达时要根据目的进行截取,如果是要进行抗体制备而截取,那么一定要保证截取的部位抗原性较强。对于抗原性也可以利用软件分析,比如Vector NIT Suite或者一些在线软件,不过在分析之余也要认识到这是一种数据统计的结论,如果蛋白和免疫动物亲缘关系较远的话还是不妨一试的。
5.亲疏水性
这也是一种经验之谈,相信经常做表达的人都发现表达亲水区域时表达量会比较高,如果你要表达一个膜蛋白,那么劝你做好长期抗战的准备吧。有许多软件可以对氨基酸的亲疏水性进行分析,比如Vector NIT
Suite,除此之外还可以利用在线跨膜区预测软件
http://www.cbs.dtu.dk/services/TMHMM/ 对跨膜区进行预测。
对于自己表达的蛋白有所了解后就可以开始对载体进行选择了,目前商业化的载体基本上包含以下几个元件:
除了上面标出的元件外还需要有复制起点,它对于控制质粒的拷贝数非常重要;另外就是筛选标记了,比如蓝白斑筛选的lacZ,各种抗生素标记。在以上几个元件中,我们需要注意的是负责调节与启动的元件,也就是调控子和启动子。其中启动子对于蛋白表达的速度起着举足轻重的作用,它与最终蛋白的表达量、是否可融密不可分。这里,对于世面上广泛销售的几种原核表达载体使用的启动子进行总结。
启动子来源调控手段(浓度)强度LacUV5 乳糖操纵元lacI/IPTG (0.1-1mM) 强Trp 色氨酸操纵元trpR 3-β-吲哚丙烯酸强Tac 结合了色氨酸启动子的-35lacI/IPTG (0.1-1mM) 强
序列和乳糖启动子的-10
序列
P
L
λ噬菌体λcI阻遏物/温度强噬菌体T5 T5噬菌体lacI/IPTG (0.1-1mM) 强
pBAD 阿拉伯糖操纵元AraBAD/阿拉伯糖(1μ
m-10mM)
严谨
T7 T7 RNA聚合酶lacI/IPTG (0.1-1mM) 非常强
乳糖操纵子是应用最广泛的调控模式,除了IPTG这种化学诱导方式之外还有利用吲哚丙烯酸和阿拉伯糖的化学诱导。如果你害怕这些化学物质会损害细菌的生长,那么你可以尝试利用温度诱导的载体,如:pDH2。它利用PL启动子,在温度上升到42℃后进行诱导表达。
可以看到在所有启动子里属T7启动子最强,它可以将大肠杆菌的资源最大程度地调用过来表达外源蛋白。这样一些难表达的蛋白都可以在pET系统里面表达出来,但是是不是越强就越好呢?如果你需要表达蛋白是可溶的,那么T7启动子就不那么适合了。较弱的启动子转录速度较慢,这样对于表达可溶、稳定、完整的蛋白比较有利。
Novagen可以说是的pET系统是最王牌的T7启动子表达系统,可是当T7启动子的强启动效应不受欢迎的时候怎么办呢?在这里给读者留个小小的疑问,看看大家有没有仔细看笔者写的Novagen篇。提示一下,虽然它转录速度快,但是可以控制它的拷贝数,又或者是……利用这些原理Novagen载体也可以毒性高的外源蛋白。
载体上除了启动子这个需要注意之外,另外一个就是标签了。很多标签是为了增加蛋白的可溶性,也有一些是为了方便鉴定表达产物,所以在表达时可以选择加标签。是否加标签要看个人需要,笔者认为如果是表达一个人家没表达过的蛋白最好还是加标签,这样方便将来鉴定。如果从经济角度考虑最好加入6×组
氨酸标签,笔者曾经以为加什么标签都无所谓(前提是不需要融合表达),结果加了个Novagen的T7·Tag,等到鉴定的时候发现单抗那么贵。而且还不好买的,一些较少人用的标签会让你很伤脑筋。这也是表达前要准备的功课之一哦。
好了,如果你选好了载体,那么下一步就是设计引物的。相信大多数人都是利用PCR把目的基因调出来的吧。设计引物可以使用一下两个软件,Primer Premier或者Oligo。如果要表达全长,其实也就没那么多要考虑,从一头一尾找至少8个匹配序列在加上与载体匹配的序列就可以了。
不过,我还是有以下几点提醒一下各位:
1.这一点其实很容易理解,但是有时也容易被遗忘。那就是先查查表达外源
片段中含有什么内切酶位点,不要设计重了,否则酶切时发现怎么老是有预期外的小片段出现。
2.根据载体上的酶切位点设计引物,现在许多类似T载原理的克隆方法也可
以应用到原核表达中了,如果T载克隆方法要定向很多时候要多加4个碱基,设计引物时候可别忘了加。在设计酶切位点的5’端不要忘了加保护
碱基,不同内切酶所需的保护碱基不同,SalⅠ不需要保护碱基,EcoRⅤ
需要1个,NotⅠ需要2个,HindⅢ最好有3个。一般情况下,都设计2
个。
3.注意启始密码子和终止密码子的读码框。如果载体上有ATG可以不另外加
了,但是通常ATG后不是紧跟外源片段的,如果中间含有载体序列,务必确定中间这段序列不会造成你外源序列的移码。按情况需要,可以加1
到2个碱基在引物中使读码框正确。有始有终,同样正常的终止密码子才
能保证蛋白的产出。大部分载体也有终止密码子,如果你对载体的不放心,也可以在引物中设计上终止密码子,这样万无一失。
4.还有就是设计一对引物需要注意的地方:一对引物之间Tm值相差不宜过
大,能一样最好;一对引物不宜形成发夹结构、互相配对,若配对时最好不要是G-C的结合(可以用软件分析);3'端以G、C结尾为宜等等。如
果要详细研究可以看一下PCR技术的相关书籍,很厚。还有就是记得把上游引物设计成有义链,下游设计成反义链,否则就没有片段出现了。虽然这是很小的地方,可是经常会被忽略。
5.如果你是进行截取表达,那么除了之前提到的要注意截取亲水区,还有一
点就是对密码子的使用频率进行分析。如果在大肠杆菌中使用较少的密码子在外源片段中连续出现,还是避开它为上策。
因为纯化爱上你:原核表达GE(原安玛西亚)篇
讲起通用电气医疗集团(GE Healthcare)也许生物方面的研究人员会比较陌生,这个从爱迪生的灯泡讲起,拥有百年历史的大集团包括许许多多的行业(当然也不要盲目崇拜把通用汽车也归到旗下,GM会生气的),可是讲起蛋白纯化等领域首屈一指的安玛西亚,特别是ECL系列和当年的法玛西亚的Sepharose、Sephadex等大名鼎鼎的纯化填料,那么许多做蛋白的人都很熟悉。美国通用电气公司2003年10月以总计高达95亿美金获得安玛西亚公司100%的控股权,这就是轰动一时的仪器行业内最大的收购案之一。
选择GE的表达载体原因很简单,爱屋及乌,使用他们的载体可以方便下一步的纯化。虽然在这几篇的介绍中没有强调纯化这个步骤,但是这不是因为纯化不重要,而是因为它太重要了。涉及的内容太多,根本可以作为一门学科来了解,所以就不把“战线”拖那么长了。但是在选择表达系统的时候,表达后的纯化方法是必需考虑的非常重要的问题。
之前我们提到的经常用于标记的蛋白包括有硫氧还蛋白、6×组氨酸、谷胱甘肽S转移酶(GST)等,6×组氨酸可以说是被应用的最为广泛的了,次之就是GE医疗有专门设计的一系列载体的GST了。
GST本身是一个在解毒过程中起到重要作用的转移酶,它的天然大小为
26KD。将它应用在原核表达的原因大致有两个,一个是因为它是一个高度可溶的蛋白,希望可以利用它增加外源蛋白的可溶性;另一个是它可以在大肠杆菌中大量表达,起到一种促进表达量提高的作用。6xHis tag因为分子量很小且通常认为不会显著影目标蛋白的活性,在不太严谨的实验中经常不需要切割就可以继续分析目标蛋白(严格的实验还是必需切割下来的)。但是GST相比6xHis tag 分子量要大得多,必需要用蛋白酶将融合蛋白中的GST切下来。对于表达分子量小的目标蛋白来说选择GST就比6xHis tag 更有优势——融合蛋白分子量较大的比较不容易被降解,另外有时天然蛋白里可能存在5个连续的组氨酸(或者非常靠近的6个His)因而也会被6xHis纯化填料吸附而“混入”纯化队伍中,而GST 纯化填料的专一性则非常高。顺带提一句,GST融合表达得到的包含体经过纯化后在复性的过程中添加适量的谷胱甘肽明显有助于提高融合蛋白的复性比率(在还原剂不影响二硫键的条件下)。选择GST载体的同志不可不知。
GST系列可是说是GE医疗在原核表达这块的王牌产品,总共有13个载体。这13个载体中有9个的多克隆位点是扩展过的,有6个限制性酶切位点。扩展后的多克隆位点方便我们从λ噬菌体载体构建的文库中将所需的基因克隆出来并定向插入到表达载体中。所有载体上都带有可以将GST切割下来的蛋白酶识别位点,不同载体携带的蛋白酶不同,可以分成T系列、X系列和P系列,分别代表采用凝血酶Thrombin、Xa因子蛋白酶以及GE医疗产的PreScission?蛋白酶作为蛋白酶切割位点。前面两个都是非常经典的融合表达载体的蛋白酶切割位点,但是由于这两种蛋白酶切割需时较长而且要求在室温条件下切割GST,容易
导致目标蛋白降解,另外蛋白酶的去除也是比较烦人的问题,所以GE公司就推出了新的系列:PreScission。
P系列载体是用PreScission?酶进行切割,它的消化温度只要5°C,可以最大程度减小对目的蛋白的降解作用。因为这个蛋白酶本身通过基因操作也加上了一个GST标记,所以它可以和被切下来的GST残余部分一起通过谷光甘肽凝胶柱(Glutathione Sepharose?)纯化去除。这样就可以极大程度上简化了纯化的步骤,从这里可以再次看出GE医疗产品在设计上很多时候总是考虑到下一步的纯化步骤的。pGEX-6P有三种载体,以方便你从不同的酶切位点插入都不会造成移码突变。
另外值得一提的是pGEX-2TK是专门为了体外标记融合产物以检测表达情况而设计的。它含有来自心肌的cAMP依赖性蛋白激酶催化亚单位的识别位点,这
个位点位于GST和多克隆位点之间。表达的蛋白可以直接用蛋白激酶和
[g-32P]ATP进行标记,产物可以用放射自显影技术稳定地检测。它的GST可以用凝血酶切除。
总的说来,pGEX所有载体都提供了三种不同的翻译读码框选择;都是利用乳糖操纵子调控模式,启动子都是Ptac。Ptac是由trp启动子的-35序列和lacUV5的Pribnow序列拼接而成,调控和lac一样,但是mRNA转录水平更高,表达也更高,也都利用IPTG进行诱导表达。IPTG本身有毒而似乎不适合表达医药用途的蛋白。这系列载体都是利用氨苄青霉素进行筛选。其中pGEX-1lT,pGEX-6P-1,pGEX-4T-1和pGEX-5X-1都可以接受来自l gt11文库的cDNA片断并进行表达。
在表达后的检测和纯化方面,GE医疗的产品堪称经典。无论是Western Blot 检测表达,还是五花八门的纯化亲和层析柱,还有分离凝血酶等丝氨酸蛋白酶的苯甲脒凝胶柱,即使GE医疗没有6×组氨酸标记的载体,但是6×组氨酸亲和纯化相关产品却绝对出色。极速浓缩、1分钟洗脱,不同规格的柱子10月期间一直在特价,详细情况可参考生物通首页头条广告。这里就不详细一一介绍了。
大家做原核表达的目的是各式各样的,有用来做抗原;也有需要表达量大,并且需要活性的产物。纯化是表达后绝对不可小视的一步。所以,回到开场白“因为纯化爱上你”,就是选择pGEX的最好理由吧!
优化基因表达的关键因素之:基因的重新设计和合成
在基因表达研究中,研究者比较注意选择合适的表达载体和宿主系统,而往往忽视基因本身是否与载体和宿主系统为最佳匹配这样一个实质性问题。基因的最佳化表达可以通过对基因的重新设计和合成来实
现,如消除稀有密码子而利用最佳化密码子,二级结构最小化,调整GC含量等。以下就密码子最佳化、翻译终止效率和真核细胞中异源蛋白表达的问题加以说明。
密码子最佳化(codon optimization)
遗传密码有64种,但是绝大多数生物倾向于利用这些密码子中的一部分。那些被最频繁利用的称为最佳密码子(optimal codons),那些不被经常利用的称为稀有或利用率低的密码子(rare or low-usage codons)。实际上用做蛋白表达或生产的每种生物(包括大肠杆菌,酵母,哺乳动物细胞,Pichia,植物细胞和昆虫细胞)都表现出某种程度的密码子利用的差异或偏爱。大肠杆菌、酵母、果蝇、灵长类等每种生物都有独特的8个密码子极少被利用[1]。有趣的是,灵长类和酵母有6个同样的利用率低的密码子。大肠杆菌、酵母和果蝇中编码丰度高的蛋白质的基因明显避免低利用率的密码子。因此,重组蛋白的表达可能受密码子利用的影响(尤其在异源表达系统中)的事实并不很奇怪。你的基因利用的密码子可能不是你正在利用的蛋白生产系统进行高水平表达所偏爱的密码子,这种情况是可能的。利用偏爱密码子(preferred codons)并避免利用率低的或稀有的密码子可以合成基因,基因的这种重新设计叫密码子最佳化。
在同源表达系统中,同较低水平表达的基因相比,较高表达的基因可能有很不同的密码子偏爱。通过对密码子利用的归类分析,人们可以真正预测任何基因在酵母中的表达水平[2]。在诸如Zea mays的其他生物中,大量高表达基因强烈
偏爱以G或C结尾的密码子[3]。而且,在Dictyostelium中,同低水平表达的基因比较,高表达基因有较大数目的偏爱密码子[4]。
在大肠杆菌中表达哺乳动物基因是不可预测和具有挑战的。例如直到最近才实现了人血红蛋白的过表达[5]。为了达到血红蛋白的好的表达水平,Alpha-球蛋白cDNA不得不用大肠杆菌偏爱的密码子进行重新合成。在异源宿主中实现象血红蛋白这样复杂的蛋白质的过表达可能需要最佳化密码子,这些研究者为此提供了令人信服的资料。成簇的低利用率的密码子抑制了核糖体的运动,这是基因不能以合适水平表达的一个明显机制。核糖体翻译由九个密码子组成的信使(含几个低利用率密码子或全部为低利用率密码子)时的运动速度要比翻译不含低利用率密码子的同样长的信使的速度慢。即使低利用率密码子簇位于3’端,信使最后也会被核糖体”拥挤”而损害,核糖体又回到5’端。3’端低利用率密码子簇的抑制效应可以和全部信使都由低利用率密码子组成的抑制效应一样大。如果低利用率密码子簇位于5’端,其效应是起始核糖体数目的全面减少,导致蛋白合成中信使的低效率。散在分布的稀有密码子对翻译的效应还未很好地研究,但是有证据表明这种情况的确对翻译效率有负面效应[6]。
其他因素也可以影响蛋白表达,包括使mRNA去稳定的序列。重新设计合成基因可以去除或改变这些序列,导致高水平表达。消除稀有密码子、去除任何去稳定序列和利用最佳密码子的基因的重新设计都可能增加蛋白产量,使的蛋白生产更有效和经济。
翻译终止效率
蛋白表达水平受许多不同因素和过程影响。蛋白稳定性、mRNA稳定性和翻
译效率在蛋白生产和积累中起主要作用。翻译过程分为起始、延伸和终止三个期。对于翻译的起始,原核mRNA需要5’端非翻译前导序列中有一段叫
Shine-Dalgarno序列的特异核糖体结合序列。在真核细胞,有效的起始依赖于围绕在起始密码子ATG上下游的一段叫Kozak序列的序列。密码子利用或偏爱对延伸有深刻的影响。例如,如果mRNA有很多成簇的稀有密码子,这可能对核糖体的运动速度造成负面影响,大大减低了蛋白表达水平。翻译终止是蛋白生产必须的一步,但其对蛋白表达水平的影响还没有被研究清楚。但是最近的科学研究表明终止对蛋白表达水平有很大的影响。总的来说,更有效的翻译终止导致更好的蛋白表达。
绝大多数生物都有偏爱的围绕终止密码子的序列框架[7]。酵母和哺乳动物偏爱的终止密码子分别是UAA和UGA。单子叶植物最常利用UGA,而昆虫和大肠杆菌倾向于用UAA。翻译终止效率可能受紧接着终止密码子的下游碱基和紧靠终止密码子的上游序列影响。在酵母中通过改变围绕终止密码子的局部序列框架,翻译终止效率可能被减低几个100倍[8]。对于UGA和UAA,紧接着终止密码子的下游碱基对有效终止的影响力大小次序为G>U,A>C;对于UAG是U、A>C>G。
对于大肠杆菌,翻译终止效率可因终止密码子及临近的下游碱基的不同而显著不同,从80%(UAAU)到7%(UGAC)[9]。对于UAAN和UAGN系列,终止密码子下游碱基对翻译的有效终止的影响力大小次序为U>G>A、C。UAG极少被大肠杆菌利用,相比UAAN和UGAN,UAG表现了有效的终止,但其后的碱基对有效终止的影响力为G>U,A>C。对于哺乳动物,偏爱的终止密码子为UGA,其后的碱基可以对in vivo翻译终止有8倍的影响(A、G>>C、U)。对于UAAN系列,in vivo 终止效率可以有70倍的差别,UGAN系列为8倍[10]。如果终止密码子附近序列没有最佳化,可能发生明显增加的翻译通读,因此减少了蛋白表达。例如,在兔
网状细胞无细胞翻译系统里,UGAC的翻译通读可以高达10%,而第四个碱基如果为A,G或C,翻译通读为<1%[11]。
总的来说,翻译起始框架、翻译终止序列框架和密码子利用应该仔细选择,以利于蛋白的最高水平表达。翻译终止序列框架能几倍地改变蛋白生产水平。
重组表达质粒的构建——原核表达载体选择
重组表达质粒的构建——原核表达载体选择质粒载体是重组蛋白表达的关键工具,其结构如下图。重组蛋白表达,我们首先要将基因插入到表达载体上,插入的位置为多克隆位点。质粒载体上有很多的功能元件,这些元件对于蛋白的表达都是至关重要的。尽管我们经过系统的分析和预测,但是仍有很多蛋白不能顺利表达、表达量很低或者表达状态不好。这个时候我们需要尝试构建不同的表达载体以期得到最好的效果,这些载体的主要区别是启动子和融合标签的差异。 蛋白表达优化主要工作也就是尝试构建不同融合表达标签,使用不同的宿主表达菌,测试不同的表达条件,筛选出最优表达体系。常用的融合标签有GST、MBP、Trx、6His、SUMO等,这些标签主要功能是促表达、促可溶、信号标记或助纯化。福因德生物可以提供以下系列载体以供科研表达研究。 1)促表达/促溶标签 2)信标标签
3)纯化标签 我们选择表达载体的时候不但要考虑蛋白怎么表达成功,更要考虑蛋白怎么纯化出来,纯化的问题主要是考虑纯化标签和酶切位点的选择,下表我们列举了常见的纯化标签和酶切位点。 4)酶切位点 以上为原核表达常用的标签和酶切位点,其性质也都作了简要的介绍,各专业网站或专业书籍已对此做详尽解释,科研工作者可根据具体实验设计方案,组合设计以上标签和酶切位点的使用。特别值得注意的是,选用和设计蛋白酶切位点的时候首要考虑的是序列内部有没有蛋白酶位点,同时要考虑酶切的效率和蛋白酶试剂成本。一般商业化载体,在标签蛋白与载体多克隆位点之间都设计有酶切位点。 标签可设计在N-端也可在C-端,设计在N-端的优势是,可通过标签高效翻译起始位点带动插入蛋白的表达,可溶性标签的高效表达更可促进蛋白的可溶性表达;同时,大部分的蛋白内切酶的切割位点在C-端,所以标签设计在N-端可将标签切割完全。 在设计标签序列与酶切位点的时候还要考虑N-端稳定性原则,也就是所谓宿主细胞的N-端规则(N-end rule),这个要避免;同时,还应该检查是否引入了可与别的蛋白相互作用的序列或者蛋白酶切位点。
浅谈原核表达
浅谈原核表达的技巧 摘要:原核表达是表达外源基因常用的方法,具有操作简单、快捷,需时较短,表达产量高,适合工业化等优点。本文作者根据自己的实践经验,总结了原核表达的一些技巧。 关键词:原核表达表达载体限制性内切酶 将植物、动物、微生物等的目的基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下优点:易于生长和控制;易于培养,实验耗费少;可选择多种大肠杆菌菌株及与之匹配的具各种特性的质粒。原核表达是近年来表达外源蛋白常用的方法,本文根据自己的实践经验,着重谈谈对原核表达中的技巧问题。 一、原核表达一般程序 表达前准备-获得目的基因-构建含目的片段的表达载体(测序验证)-转化表达宿主菌-诱导靶蛋白的表达-表达蛋白的分析。 二、原核表达中各操作步骤的关键因素及技巧 1.表达前的准备要素:原核表达注重表达前对目的片段、表达载体及表达菌株的分析、选择。正所谓“磨刀不误砍柴功”,经过细致、周全的分析、准备、设计可带来较为顺当的实验,可免去许多不必要的麻烦。 (1)对表达载体的分析 载体的选择:同样的载体,同样的系统,很可能表达这个蛋白表达量起高,但另外一个就是做不出来,所以表达载体的选择非常重要,没有万能的载体。选择载体通常我们关心质粒上的几个功能组件及所带来的问题:是否为诱导表达型载体,启动子的强弱、多克隆位点、限制性内切酶的位置、终止密码子的有无及位置,融合Tag的有无,筛选报告基因的位置等。所选载体一定要保持原来的遗传背景(有些载体经过多次交换已变异)。选择表达载体时,要根据所表达蛋白的最终应用考虑,如果为了方便纯化,可选择融合表达;如果为了获得天然蛋白,可选择非融合表达。融合表达时在选择外源DNA同载体分子连接反应时,对转录和转译过程中密码结构的阅读不能发生干扰。 翻译的起始位点:要表达目的蛋白,在该基因的5’端必须有一起始位点,现在大部分的表达载体都提供起始位点,起始密码子与核糖体结合位点的距离都已被优化,一般情况下不需要自己再加,实际操作时要留意载体图谱上是否注明有起始密码子和终止密码子,如无,还得根据自己的实际情况加上。 在起始密码子附近的mRNA二级结构:外源基因其始转录后,保持mRNA的有效延伸、终止及稳定存在是外源基因有效表达的关键,尤其是在起始密码子附近的mRNA二级结构可能会抑制翻译的起始或者造成翻译暂停从而产生不完全的蛋白。如果利用Primer Premier软件分析DNA或RNA结构上有柄(stem)结构,并且结合长度超过8个碱基,这种结构会因为位点专一突变等因素而变得不稳定,影响正常的翻译。 (2)对目的片段的分析 基因(或蛋白)的大小:原核表达的成功与否与所要表达的蛋白(或基因)大小有关,一般说来小于5kD或者大于100kD的蛋白都是难以表达的。蛋白越小,越容易被内源蛋白水解酶所降解。在这种情况下可以采取串联表达,在每个表达单位(即单体蛋白)间设计蛋白水解或者是化学断裂位点。如果蛋白较小,那么加入融合标签GST、Trx、MBP或者其它较大的促进融合的蛋白标签就较有可能使蛋白正确折叠,并以融合形式表达。如果蛋白较大,大于60kD的蛋白建议使用较小的标签(如6×组氨酸标签)。对于结构研究较清楚的蛋白可以采取截取表达。当然表达时要根据目的进行截取,如果是要进行抗体制备而截取,那么一定要保证截取的部位抗原性较强。对于抗原性也可以利用软件分析,比如Vector NIT Suite或者一些在线软件,不过在分析之余也要认识到这是一种资料统计的结论,
原核表达遇到瓶颈怎么办(终审稿)
原核表达遇到瓶颈怎么 办 TPMK standardization office【 TPMK5AB- TPMK08- TPMK2C- TPMK18】
我想表达遇到的第一个瓶颈估计就是为什么我的外源片段插到载体里面,PCR鉴定没问题,双酶切也OK,可是就是不见表达。一般我们是如何判断没有表达呢?大多都是首先进行SDS-PAGE。在跑胶的时候一定要设对照,比较严谨的电泳对照,应该是:Marker,标准品阳性对照(如果有,且打算做Western的话),以及空白载体(诱导)和重组载体(不诱导)2个阴性对照,再加上诱导不同时间的表达结果。Marker用于判断条带大小,标准品用于判断Western体系包括抗体显色剂和操作的可靠性,以及精确判断大小;空白载体(诱导)负对照有助于判断在非诱导条件下的本底表达;而重组载体(不诱导)负对照则有助于判断诱导的效果以及排除诱导剂对宿主菌潜在的干扰,或者是区分细菌内源和外源表达产物——偷懒可不是好习惯,会影响结果判断。注意,接种表达和接种做感受态都类似,一定要用挑单克隆、加足量抗生素、过夜培养的新鲜菌液转种最好,在筛选压力下生长旺盛的种子液远比经过4℃保存的菌液要好得多,也许是因为保存时间长会导致抗生素失效部分细菌丢失质粒或者其他变化。反正就是一种经验做法。 跑SDS-PAGE的话可以用考马斯亮兰染,它灵敏度在100ng左右;但是不能跟着做Western了。银染的灵敏度在0.1~1 ng;有钱还可以用Sypro Red,灵敏度高还可以继续做Western。WesternBlot是蛋白质定性和半定量的最通用的技术,具体细节可参考生物通WesternBlot技术专题,我们有详细介绍的。 在做过Western Blot仍没有检测到表达带,那么就要开始进行下一步的分析了。首先,看看载体的多克隆位点和片断插入的序列,是否有因为酶切连接而意外引入了转录终止信号。有时载体几经多个实验人员的周转,反复插入片断,或者是粘端
表达载体的构建方法及步骤
表达载体的构建方法及步骤 令狐采学 一、载体的选择及如何阅读质粒图谱 目前,载体主要有病毒和非病毒两大类,其中质粒DNA 是一种新的非病毒转基因载体。 一个合格质粒的组成要素: (1)复制起始位点Ori 即控制复制起始的位点。原核生物DNA 分子中只有一个复制起始点。而 真核生物DNA 分子有多个复制起始位点。 (2)抗生素抗性基因可以便于加以检测,如Amp+ ,Kan+ (3)多克隆位点MCS 克隆携带外源基因片段 (4)P/E 启动子/增强子 (5)Terms 终止信号 (6)加poly(A)信号可以起到稳定mRNA 作用 选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制酶切位点。如果构建的目 的是要表达一个特定的基因,则要选择合适的表达载体。 载体选择主要考虑下述3点: 【1】构建DNA 重组体的目的,克隆扩增/基因表达,选择合适的克隆载体/表达载体。 【2】.载体的类型:
(1)克隆载体的克隆能力-据克隆片段大小(大选大,小选小)。如<10kb 选质粒。 (2)表达载体据受体细胞类型-原核/真核/穿梭,E.coli/哺乳类细胞表达载体。 (3)对原核表达载体应该注意:选择合适的启动子及相应的受体菌,用于表达真核蛋白质时注意克服4个困难和阅读框错位;表达天然蛋白质或融合蛋白作为相应载体的参考。 【3】载体MCS 中的酶切位点数与组成方向因载体不同而异,适应目的基因与载体易于链接,不能产生阅读框架错位。 综上所述,选用质粒(最常用)做载体的5点要求: (1)选分子量小的质粒,即小载体(1-1.5kb)→不易损坏,在细菌里面拷贝数也多(也有大载 体); (2)一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上的拷贝,而严谨型质粒<10个。 (3)必需具备一个以上的酶切位点,有选择的余地; (4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位Ampr(试一试)。 (5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、G418)等等。 无论选用哪种载体,首先都要获得载体分子,然后采用适当的限制酶将载体DNA 进行切割,获得线性载体分子,以便于与
原核表达步骤
原核表达步骤
Chi l 原核表达基本试验步骤 将克隆化基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下特点:易于生长和控制;用于细菌培养的材料不及哺乳动物细胞系统的材料昂贵;有各种各样的大肠杆菌菌株及与之匹配的具各种特性的质粒可供选择。但是,在大肠杆菌中表达的蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。 表达载体在基因工程中具有十分重要的作用,原核表达载体通常为质粒,典型的表达载体应具有以下几种元件: (1)选择标志的编码序列; (2)可控转录的启动子; (3)转录调控序列(转录终止子,核糖体结合位点); (4)一个多限制酶切位点接头; (5)宿主体内自主复制的序列。 原核表达一般程序如下:获得目的基因-准备表达载体-将目的基因插入表达载体中(测序验证)-转化表达宿主菌-诱导靶蛋白的表达-表达蛋白的分析-扩增、纯化、进一步检测,其中包括: 一、试剂准备 (1)LB培养基。 (2)1M IPTG(异丙基硫代-β-D-半乳糖苷):2.38g IPTG溶于10ml ddH2O
中,0.22μm滤膜抽滤,-20℃保存。 CCY的IPTG是1M的,用时进行1000倍稀释。 二、操作步骤 (一)获得目的基因 1、通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。 2、通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA 为模板,逆转录形成cDNA第一链,以逆转录产物为模板进行PCR循环获得产物。 (二)构建重组表达载体 1、载体酶切:将表达质粒用限制性内切酶(同引物的酶切位点)进行双酶切,酶切产物行琼脂糖电泳后,用胶回收Kit或冻融法回收载体大片段。 2、PCR产物双酶切后回收,在T4DNA连接酶作用下连接入载体。我们用Soultion I连接。 (三)获得含重组表达质粒的表达菌种 1、将连接产物转化大肠杆菌BL21,根据重组载体的标志(抗Amp或蓝白斑)作筛选,挑取单斑,碱裂解法小量抽提质粒,双酶切初步鉴定。 2、测序验证目的基因的插入方向及阅读框架均正确,进入下步操作。否则应筛选更多克隆,重复亚克隆或亚克隆至不同酶切位点。 3、以此重组质粒DNA转化表达宿主菌的感受态细胞。
如何做原核表达——面面俱到Novagen产品
之所以首先介绍Novagen公司的产品是因为用过它的pET系列载体,感觉很好用。Novagen的母公司是德国默克(Merck)公司,它是国际著名的化学及制药公司总部位于德国的Darmstadt,已有300多年的历史。已在全世界55个主要国家设立了分公司,其中在28个国家建有62个生产基地。 Novagen公司出品的pET系列载体是目前应用最为广泛的原核表达系统,已经成功地在大肠杆菌中表达了各种各样的异源蛋白。pET系列载体是利用大肠杆菌T7噬菌体转录系统进行表达的载体,其表达原理见下图。 T7噬菌体具有一套专一性非常强的转录体系,利用这一体系中的元件为基础构建的表达系统称为T7表达系统。T7噬菌体基因编码的T7 RNA聚合酶选择性的激活T7噬菌体启动子的转录。它是一种高活性的RNA聚合酶,其合成mRNA的速度比大肠杆菌RNA聚合酶快5倍左右。并可以转录某些不能被大肠杆菌RNA聚合酶有效转录的序列。在细胞中存在T7 RNA聚合酶和T7噬菌体启动子的情形下,大肠杆菌宿主本身基因的转录竞争不过T7噬菌体转录体系,最终受T7噬菌体启动子控制的基因的转录能达到很高的水平。 T7噬菌体启动子的转录完全依赖于T7 RNA聚合酶,因此T7 RNA聚合酶的转录调控模式就决定了表达系统的调控方式。噬菌体DE3是λ噬菌体的衍生株,一段含
有lacⅠ,lacUV5启动子和T7 RNA聚合酶基因的DNA片段倍插入其int基因中,用噬菌体DE3的溶源菌,如BL21(DE3)、HMS174(DE3)等作为表达载体的宿主菌,调控方式为化学信号诱导型,类似于Lac表达系统。 从开始涉及表达的时候可以根据是否要用基因本身的起始密码子进行选择,Novagen公司仅提供三个载体:pET-21(+),pET-24(+)和pET-23(+)。如果你打算利用载体的起始密码子,那么就有许多选择。 根据是否要可溶性表达,选择加有不同标记的载体。一般说来在大肠杆菌中不加标记外源蛋白都会以不溶的包涵体形式表达。为了让外源蛋白融合表达一般说来有三个策略: 1.与一个高度可溶的多肽联合一起表达,比如:谷胱甘肽S转移酶(glutathione S transferase, GST)、硫氧还蛋白(thioredoxin, Trx)和N利用质A(N utilization substance A, NusA)。 2.转入一个酶催化二硫键的形成,如:硫氧还蛋白,DsbA,DsbC。 3.插入一个定位到周质空间的信号序列。 不同载体提供不同的标记,有的可以同时带有多个标记。如果你不希望在蛋白的N末端加入任何的多肽,你也可以选择用NdeⅠ直接从起始密码子后插入外源片断,或者在得到表达产物后利用蛋白氨基酸的酶切位点把多余的多肽切除。 以下是Novagen载体带有标记及抗性的列表:
pET 表达系统
pET 原核表达 pET 载体中,目标基因克隆到T7 噬菌体强转录和翻译信号控制之下,并通过在宿主细胞提供T7 RNA 聚合酶来诱导表达。Novagen 的pET 系统不断扩大,提供了用于表达的新技术和选择,目前共包括36 种载体类型、15 种不同宿主菌和设计用于有效检测和纯化目标蛋白的许多其它相关产品。 优点 ·是原核蛋白表达引用最多的系统 ·在任何大肠杆菌表达系统中,基础表达水平最低 ·真正的调节表达水平的“变阻器”控制 ·提供各种不同融合标签和表达系统配置 ·可溶性蛋白生产、二硫键形成、蛋白外运和多肽生产等专用载体和宿主菌 ·许多载体以LIC 载体试剂盒提供,用于迅速定向克隆PCR 产物 ·许多宿主菌株以感受态细胞形式提供,可立即用于转化 阳性pFORCE TM 克隆系统具有高效克隆PCR 产物、阳性选择重组体和高水平表达目标蛋白等特点。 pET 系统概述 pET 系统是在大肠杆菌中克隆和表达重组蛋白的最强大系统。根据最初由Studier 等开发的T7 启动子驱动系统,Novagen 的pET 系统已用于表达成千上万种不同蛋白。 控制基础表达水平 pET 系统提供6 种载体- 宿主菌组合,能够调节基础表达水平以优化目标基因的表达。没有单一策略或条件适用于所有目标蛋白,所以进行优化选择是必要的。 宿主菌株 质粒在非表达宿主菌中构建完成后,通常转化到一个带有T7 RNA 聚合酶基因的宿主菌(λDE3 溶原菌)中表达目标蛋白。在λDE3 溶原菌中,T7 RNA 聚合酶基因由lacUV5 启动子控制。未诱导时便有一定程度转录,因此适合于表达其产物对宿主细胞生长无毒害作用的一些基因。而宿主菌带有pLysS 和pLyE 时调控会更严紧。pLys 质粒编码T7 溶菌酶,它是T7 RNA 聚合酶的天然抑制物,因此可降低其在未诱导细胞中转录目标基因的能力。pLysS 宿主菌产生低量T7 溶菌酶,而pLysE 宿主菌产生更多酶,因此是最严紧控制的λDE3 溶原菌。 有11 种不同DE3 溶原化宿主菌。使用最广泛的为BL21 及其衍生菌株,它的优点在于缺失lon 和ompT 蛋白酶。B834 菌株为甲硫氨酸营养缺陷型,因此可用35 S- 甲硫氨酸和硒代甲硫氨酸对目标蛋白进行高特异活性标记。BLR 为recA - 衍生菌株,改善了质粒单体产量,有助于稳定含有重复序列的目标质粒。两个硫氧还蛋白还原酶( trxB ) 突变菌株(AD494,BL21 trxB ) ,有利于大肠杆菌胞浆中二硫键形成。Origami TM 和OrigamiB 菌株为trxB/gor 双突变,这两个酶是主要还原途径的关键酶。Origami 和OrigamiB 宿主菌的主要优点是能形成正确折迭的含有二硫键的蛋白。新的Rosetta TM 菌株补充了四种大肠杆菌稀有密码子的tRNA ,改善了由于密码子使用频率不同而引起的一些真核蛋白低表达。其它菌株背景包括K-12 菌株HMS174 和NovaBlue ,象BLR 一样为recA - 。这些菌株可稳定表达其产物可能导致DE3 噬菌体丢失的某些目标基因。由于存在F 附加体编码
原核&真核表达载体构建
原核、真核表达载体构建 真核表达载体和原核表达载体的区别:主要是因为原核和真核表达系统所需的表达元件不同。 比如说启动子,终止子在两种表达系统中是不一样的。 带有真核表达元件的是真核载体,能在真核生物内表达; 带有原核表达元件的是原核载体,能在原核生物内表达。两者都具有的为穿梭载体。 ㈠原核表达载体指:能携带插入的外源核酸序列进入原核细胞中进行复制的载体。 原核表达载体调控原件 1.启动子 启动子是DNA链上一段能与RNA聚合酶结合并起始RNA合成的序列,它是基因表达不可缺少的重要调控序列。没有启动子,基因就不能转录。由于细菌RNA聚合酶不能识别真核基因的启动子,因此原核表达载体所用的启动子必须是原核启动子。原核启动子是由两段彼此分开且又高度保守的核苷酸序列组成,对mRNA的合成极为重要。在转录起始点上游5~10 bp处,有一段由6~8个碱基组成,富含A和T的区域,称为Pribnow 盒,又名TATA 盒或-10区。来源不同的启动子,Pribnow 盒的碱基顺序稍有变化。在距转录起始位点上游35 bp 处,有一段由10 bp组成的区域,称为-35区。转录时大肠杆菌RNA聚合酶识别并结合启动子。-35区与RNA聚合酶s亚基结合,-10区与RNA聚合酶的核心酶结合,在转录起始位点附近DNA被解旋形成单链,RNA聚合酶使第一和第二核苷酸形成磷酸二酯键,以后在RNA聚合酶作用下向前推进,形成新生的RNA 链。原核表达系统中通常使用的可调控的启动子有Lac(乳糖启动子)、Trp(色氨酸启动子)、Tac(乳糖和色氨酸的杂合启动子) 、lPL (l噬菌体的左向启动子)、T7噬菌体启动子等。 2. SD序列 1974年Shine和Dalgarno首先发现,在mRNA上有核糖体的结合位点,它们是起始密码子AUG和一段位于AUG上游3~10 bp处的由3~9 bp组成的序列。这段序列富含嘌呤核苷酸,刚好与16S rRNA 3¢末端的富含嘧啶的序列互补,是核糖体RNA的识别与结合位点。以后将此序列命名为Shine-Dalgarno序列,简称SD序列。它与起始密码子AUG之间的距离是影响mRNA转录、翻译成蛋白的重要因素之一,某些蛋白质与SD序列结合也会影响mRNA与核糖体的结合,从而影响蛋白质的翻译。另外,真核基因的第二个密码子必须紧接在ATG 之后,才能产生一个完整的蛋白质。 3.终止子 在一个基因的3¢末端或是一个操纵子的3'末端往往有特定的核苷酸序列,且具有终止转录功能,这一序列称之为转录终止子,简称终止子(terminator)。转录终止过程包括:RNA聚合酶停在DNA模板上不再前进,RNA的延伸也停止在终止信号上,完成转录的RNA从RNA聚合酶上释放出来。对RNA聚合酶起
原核表达
原核表达 一、原理 1、E . coli 表达系统 E . coli 是重要的原核表达体系。在重组基因转化入E . coli 菌株以后,通过温度的控制,诱导其在宿主菌内表达目的蛋白质,将表达样品进行SDS-PAGE 以检测表达蛋白质。 2、外源基因的诱导表达 提高外源基因表达水平的基本手段之一,就是将宿主菌的生长与外源基因的表达分成两个阶段,以减轻宿主菌的负荷。常用的有温度诱导和药物诱导。本实验采用异丙基硫代-β-D-半乳糖昔(IPTG)诱导外源基因表达。 不同的表达质粒表达方法并不完全相同,因启动子不同,诱导表达要根据具体情况而定。 二、材料 1、诱导表达材料 ( 1 ) LB (Luria—Bertani))培养基 酵母膏(Yeast extract) 5g 蛋白胨(Peptone) 10g NaCl 10g 琼脂(Agar) 1-2% 蒸馏水(Distilled water) 1000ml pH 7.0 适用范围:大肠杆菌 ( 2 ) IPTG 贮备液:2 g IPTG溶于10 mL 蒸馏水中,0 . 22 μm 滤膜过滤除菌,分装成1 mL /份,-20 ℃保存。 ( 3 ) l×凝胶电泳加样缓冲液: 50 mmol / L Tris -CI ( pH 6 . 8 ) 50 mmol / L DTT 2 % SDS (电泳级) 0.1 %溴酚蓝 10 %甘油 2、大肠杆菌包涵体的分离与蛋白纯化材料 1 )酶溶法 (1)裂解缓冲液: 50 mmol / L Tris-CI ( pH 8 . 0 ) 1 mmol / L EDTA 100 mmol / LNaCI (2)50 mmol / L 苯甲基磺酰氟(PMSF )。 (3)10 mg / mL 溶菌酶。 (4)脱氧胆酸。 (5)1 mg / mL DNase I。 2 )超声破碎法 ( 1 ) TE 缓冲液。 ( 2 ) 2×SDS -PAGE 凝胶电泳加样缓冲液: 100 mmol / L Tris-HCI ( pH 8 . 0 ) 100 mmol / L DTT 4 %SDS 0.2 %溴酚蓝 20 %甘油
植物基因在大肠杆菌中的原核表达
植物基因在大肠杆菌中的原核表达 通过大肠杆菌表达目的基因大量获得重组蛋白是一个方便快捷的方法。植物中克隆的目的基因被克隆到特异设计的质粒载体上,受噬菌体T7强启动子控制;表达由宿主细胞提供的T7 RNA聚合酶诱导。 当需要表达蛋白时,在细菌培养基中加入IPTG来启动表达。不同载体在邻近克隆位点处具有编码不同的多肽“标签”的序列,在定位、检测或纯化目的蛋白时提供方便。 以pET-32a(+)为例,介绍将目的基因克隆进载体并进行表达获得重组蛋白的过程,从而熟悉根据自己的要求采用不同的载体进行原核表达的全过程。 1.准备工作(试剂配置和器材准备) 1)操作流程示意图 主要步骤操作 ①制备pET-32a(+)载体用限制性酶消化,去磷酸化后胶纯化回收 ②制备插入DNA PCR装入质粒后进行限制性消化,再回收 ③插入片段克隆到pET-32a(+)载体插入片段与pET连接,转化 ④转化表达宿主菌BL21 转化带有T7RNA聚合酶基因的菌株 ⑤诱导表达目的蛋白 SDS-PAGE,Western 印迹、定量分析确定目的蛋白 ⑥放大试验纯化目的蛋白放大试验,制备粗提物,亲和纯化,切除融合标签 2)配制生长培养基如LB,和100mM IPTG,50μg/ml 卡那霉素存储液。 3)宿主菌的保存。长期存放菌株和pET重组子应保存于甘油中。 4)感受态细胞的制备,参照其它试验手册。 2.操作步骤 [1] 制备载体 1)载体消化和胶纯化 3μg pET载体 3μl 10×限制性内切酶buffer 10-20U 两种酶(是否共用buffer; 酶体积不要超过反应体系的10%) 3μl 1mg/ml乙酰BSA(根据需要 补足水到30μl
原核表达步骤
1.将已经成功转有重组表达载体pET-28a-CYP83A1的表达菌 E. coli.BL21(DE3)在LB固体培养基(50μg/mL Kan)上划线接种培 2.挑取单菌落,接种于5mL的LB液体培养基(50μg/mL Kan)中,37℃,180r/min振荡培养过夜。 3.取500μL过夜培养的菌液转接入100mL新的LB液体培养基(50μg/mL Kan)中,37℃,190r/min振荡培养到菌液OD600 =0.6~0.8。 4.分组培养:实验组加入终浓度为1mmol/L的IPTG,对照组不加IPTG,37℃,190r/min诱导培养6h。 5.8000r/min离心2min,收集细菌,用1×PBS(0.01mol/L)缓冲液悬浮。 6.冰上超声波破碎,功率30w,工作5s,间歇5s,总时间2min。 7.4℃、12000r/min离心10min,分离上清与沉淀,取100μL上清与等体积的2×上样缓冲液混合;用200μL1×上样缓冲液悬浮沉淀,沸水浴5min后,对上清和沉淀进行SDS-PAGE检测。
重组质粒在大肠杆菌中的诱导表达及SDS-PAGE分析 挑测序正确的单克隆接种到3mLLB(50μg·mL-1Kan)培养基中,振荡培养12h后,将菌液按1﹕100的比例加入到300mL LB(50μg·mL-1Kan)培养基中200r/min37℃振荡培养至OD600为0.5—0.6时,加入IPTG(使终浓度为1mmol·L-1)进行诱导表达,分别在37℃诱导4h,4℃保存备用。未加IPTG诱导的pET-28a-CsFOMT收集作为阴性对照。诱导全部完成后,各取50mL 菌液离心收集细菌,加入SDS上样缓冲液,悬浮混匀,100℃3min,12000r/min离心1min,取上清4℃保存备用。另取50mL菌液离心收集菌体后用1×PBS(PH7.4)将沉菌悬起,经过超声波细胞破碎(20mm的变幅杆,400W,超声2s,间隔5s,重复60次),10000r/min离心10min分离上清和沉淀,上清和沉淀样品中分别加入SDS上样缓冲液,混匀,沸水浴,取上清和沉淀分别进行SDS-PAGE(5%浓缩胶,12%分离胶),然后分析蛋白表达结果
Pichia酵母表达系统使用心得
Pichia酵母表达系统使用心得 摘要:Pichia酵母表达系统广泛应用于外源基因表达。 生物通编者按:甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。 + 表示优胜于;- 表示不如;= 表示差不多 EasySelect Pichia Expression System
产品性能: 优点——使用简单,表达量高,His-tag便于纯化 缺点——酵母表达蛋白有时会出现蛋白切割问题 全面产品报告及心得体会: 巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。 毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。 第一步构建载体 Xiang Yang:pPICZ系列有许多克隆位点可供选择,同时也有三种读码框以便不用的用户需要。 红叶山庄:有关是选择pPIC9K还是pPICZ系列?pPIC9K属于穿梭质粒,也可以在原核表达,而pPICZ系列比较容易操作,大肠和毕赤酵母均用抗Zeocin筛选(PIC9K操作麻烦一点,大肠用amp抗性,而毕赤酵母先用His缺陷筛选阳性克隆,在利用G418筛选多拷贝),而且对于大小合适(30—50KD)的蛋白在产量上是pPIC9K 无法比拟的。 leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微镜中观测。大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的时间了。 基本熟悉了毕赤酵母,了解了她生长的喜好(多糖偏酸环境),生长的周期等等情况后,当然更多的精力还是应该花在表达的目的蛋白上,我的表达蛋白有些恐怖,有100KD,本来当然应该放在大肠杆菌中表达,但是为了分泌表达(其实后来发现大肠杆菌pET系列分泌表达系列也不错)和糖基化修饰(主要是这个方面,因
原核表达步骤
Chi l 原核表达基本试验步骤 将克隆化基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下特点:易于生长和控制;用于细菌培养的材料不及哺乳动物细胞系统的材料昂贵;有各种各样的大肠杆菌菌株及与之匹配的具各种特性的质粒可供选择。但是,在大肠杆菌中表达的蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。 表达载体在基因工程中具有十分重要的作用,原核表达载体通常为质粒,典型的表达载体应具有以下几种元件: (1)选择标志的编码序列; (2)可控转录的启动子; (3)转录调控序列(转录终止子,核糖体结合位点); (4)一个多限制酶切位点接头; (5)宿主体内自主复制的序列。 原核表达一般程序如下:获得目的基因-准备表达载体-将目的基因插入表达载体中(测序验证)-转化表达宿主菌-诱导靶蛋白的表达-表达蛋白的分析-扩增、纯化、进一步检测,其中包括: 一、试剂准备 (1)LB培养基。 (2)1M IPTG(异丙基硫代-β-D-半乳糖苷):2.38g IPTG溶于10ml ddH2O
中,0.22μm滤膜抽滤,-20℃保存。 CCY的IPTG是1M的,用时进行1000倍稀释。 二、操作步骤 (一)获得目的基因 1、通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。 2、通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA 为模板,逆转录形成cDNA第一链,以逆转录产物为模板进行PCR循环获得产物。 (二)构建重组表达载体 1、载体酶切:将表达质粒用限制性内切酶(同引物的酶切位点)进行双酶切,酶切产物行琼脂糖电泳后,用胶回收Kit或冻融法回收载体大片段。 2、PCR产物双酶切后回收,在T4DNA连接酶作用下连接入载体。我们用Soultion I连接。 (三)获得含重组表达质粒的表达菌种 1、将连接产物转化大肠杆菌BL21,根据重组载体的标志(抗Amp或蓝白斑)作筛选,挑取单斑,碱裂解法小量抽提质粒,双酶切初步鉴定。 2、测序验证目的基因的插入方向及阅读框架均正确,进入下步操作。否则应筛选更多克隆,重复亚克隆或亚克隆至不同酶切位点。 3、以此重组质粒DNA转化表达宿主菌的感受态细胞。
表达载体的构建方法及步骤
表达载体的构建方法及步骤 一、载体的选择及如何阅读质粒图谱 目前,载体主要有病毒和非病毒两大类,其中质粒DNA 是一种新的非病毒转基因载体。一个合格质粒的组成要素: (1)复制起始位点Ori 即控制复制起始的位点。原核生物DNA 分子中只有一个复制起始点。而 真核生物DNA 分子有多个复制起始位点。 (2)抗生素抗性基因可以便于加以检测,如Amp+ ,Kan+ (3)多克隆位点MCS 克隆携带外源基因片段 (4)P/E 启动子/增强子 (5)Terms 终止信号 (6)加poly(A)信号可以起到稳定mRNA 作用 选择载体主要依据构建的目的,同时要考虑载体中应有合适的限制酶切位点。如果构建的目 的是要表达一个特定的基因,则要选择合适的表达载体。 载体选择主要考虑下述3点: 【1】构建DNA 重组体的目的,克隆扩增/基因表达,选择合适的克隆载体/表达载体。【2】.载体的类型: (1)克隆载体的克隆能力-据克隆片段大小(大选大,小选小)。如<10kb 选质粒。(2)表达载体据受体细胞类型-原核/真核/穿梭,E.coli/哺乳类细胞表达载体。
(3)对原核表达载体应该注意:选择合适的启动子及相应的受体菌,用于表达真核蛋白质时注意克服4个困难和阅读框错位;表达天然蛋白质或融合蛋白作为相应载体的参考。【3】载体MCS 中的酶切位点数与组成方向因载体不同而异,适应目的基因与载体易于链接,不能产生阅读框架错位。 综上所述,选用质粒(最常用)做载体的5点要求: (1)选分子量小的质粒,即小载体(1-1.5kb)→不易损坏,在细菌里面拷贝数也多(也有大载 体); (2)一般使用松弛型质粒在细菌里扩增不受约束,一般10个以上的拷贝,而严谨型质粒<10个。 (3)必需具备一个以上的酶切位点,有选择的余地; (4)必需有易检测的标记,多是抗生素的抗性基因,不特指多位Ampr(试一试)。(5)满足自己的实验需求,是否需要包装病毒,是否需要加入荧光标记,是否需要加入标签蛋白,是否需要真核抗性(如Puro、G418)等等。 无论选用哪种载体,首先都要获得载体分子,然后采用适当的限制酶将载体DNA 进行切割,获得线性载体分子,以便于与目的基因片段进行连接。 如何阅读质粒图谱 第一步:首先看Ori 的位置,了解质粒的类型(原核/真核/穿梭质粒) 第二步:再看筛选标记,如抗性,决定使用什么筛选标记。 (1)Ampr 水解β-内酰胺环,解除氨苄的毒性。 (2)tetr 可以阻止四环素进入细胞。 (3)camr 生成氯霉素羟乙酰基衍生物,使之失去毒性。 (4)neor(kanr)氨基糖苷磷酸转移酶使G418(长那霉素衍生物)失活
原核表达操作步骤及注意事项
原核表达操作步骤及注意事项 时间:2010-03-03 14:05:01 来源:作者:点击:1046次 将克隆化基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下特点: 易于生长和控制;用于细菌培养的材料不及哺乳动物细胞系统的材料昂贵;有各种各样的大肠杆菌菌株及与之匹配的具各种特性的质粒可供选择。但是,在大肠杆菌中表达的蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。 表达载体在基因工程中具有十分重要的作用,原核表达载体通常为质粒,典型的表达载体应具有以下几种元件: (1)选择标志的编码序列; (2)可控转录的启动子; (3)转录调控序列(转录终止子,核糖体结合位点); (4)一个多限制酶切位点接头; (5)宿主体自主复制的序列。 原核表达一般程序如下: 获得目的基因-准备表达载体-将目的基因插入表达载体中(测序验证)-转化表达宿主菌-诱导靶蛋白的表达-表达蛋白的分析-扩增、纯化、进一步检测 一、试剂准备 1、LB培养基。 2、100mM IPTG(异丙基硫代-β-D-半乳糖苷):2.38g IPTG溶于100ml ddH2O中,0.22μm滤膜抽滤,-20℃保存。 二、操作步骤 (一)获得目的基因 1、通过PCR方法:以含目的基因的克隆质粒为模板,按基因序列设计一对引物(在上游和下游引物分别引入不同的酶切位点),PCR循环获得所需基因片段。 2、通过RT-PCR方法:用TRIzol法从细胞或组织中提取总RNA,以mRNA为模板,逆转录形成cDNA 第一链,以逆转录产物为模板进行PCR循环获得产物。 (二)构建重组表达载体 1、载体酶切:将表达质粒用限制性切酶(同引物的酶切位点)进行双酶切,酶切产物行琼脂糖电泳后,用胶回收Kit或冻融法回收载体大片段。 2、PCR产物双酶切后回收,在T4DNA连接酶作用下连接入载体。
原核表达步骤总结
原核表达步骤 原核表达先要将基因克隆到原核表达载体上,然后通过转化到 JM109或BL21等菌株中,诱导表达蛋白,然后进行蛋白纯化。本实验方案的前提是,目的基因已克隆到载体,并已转进入JM109菌株中。 1.鉴定目的蛋白是否在大肠杆菌JM109或BL21中大量表达 (1)制样 1 . 挑取经过双酶切鉴定的单克隆菌落于700ul LB培养基,加入0.7ul Amp(100mg/mL),37o C200r/min摇床培养,过夜活化。 2. 以1:50比例(200ul),将活化的过夜培养物加入10mL LB液体培养基中,加入10uLAmp(100mg/ml),37o C200r/min摇床扩大培养2h-3h,期间取样监控菌液的OD值,控制菌液OD600在0.6-1.0之间,以使大肠杆菌处于最适合表达外源蛋白的生长状态。(一般3h时,菌液浓度及达到标准,但是不同的基因对菌的影响不同,所以第一次实验时需要确定这个最佳时间) 3. 从10ml扩大培养物中取3ml菌液作为不加IPTG的空白对照(CK),其余7ml菌液加入7ul IPTG(储存浓度为0.5mol/l),使IPTG 终浓度达到0.5mmol/l。以200r/min的转速,37o C摇床培养3h。 4. 以5000r/min离心2min收集菌体,倾倒上清,每个离心管收集3ml培养物。 5. 加入1ml dH2O,将管底沉淀用振荡器打散以充分洗涤,8000r/min 离心2min,倾倒上清。 6. 重复步骤5。将离心管中的水倒干净。 (二)菌落SDS-PAGE 1. 在收集的菌体中加入200ul 1×SDS PAGE loading buffer(可根据沉淀的量增加或减少loading buffer的量,一般200ul比较合适)。用漩涡器剧烈震荡,确保将管底沉淀震散。 2. 将样品于100℃恒温加热器上开盖加热10min(Marker也要加热)。样品凉后,12000r/min离心3min,取每管的上清点样。上样量一般30ul—40ul,marker 20ul。 (3)SDS-PAGE分析 1. 根据目的片段的大小,制作不同浓度的分离胶 蛋白分子量 (kDa)凝胶浓度 (%) 4-4020
原核生物及其多样性1
原核生物及其多样性 【摘要】:原核生物是由原核细胞构成的生物【1】,其多样性在维持生物圈生态平衡和为人类提供广泛的、大量的未开发资源方面起着重要的作用。原核生物生活在各种生境中,包括在其他生物无法生存的条件下,其仍能进行多种形式的物质循环,并以我们初步了解的方式同其他生命形式相互作用。原核微生物的多样性在形式和分化上表现并不突出,而主要表现在物种和基因水平上。因此,研究原核微生物及其重要性具有主要的意义。 【关键字】:原核生物多样性 【正文】: 1.原核生物 原核生物最早是由Chatton提出的,原核生物是指一类无真正细胞核的单细胞生物或类似于细胞的简单组合结构的微生物【2】。20世纪70年代,Woese和Fox根据不同生物类群细胞中的ssuRNA的序列同源性提出了生物的三域学说,即地球上所有的细胞生物由细菌域、古菌域和真核生物组成,细菌和古菌都是原核生物。原核生物是由原核细胞构成的生物,原核细胞中无膜围的核和其他细胞器。 原核生物是没有成形的细胞核或线粒体的一类单细胞生物。原核生物对人类生活的影响,有利也有弊。植物病原原核生物是仅次于真菌和病毒的第3大类病原生物,浸染植物可引起许多重要的病害,造成农作物的严重减产,例如国内外普遍发生的茄科植物的青枯病、水稻白叶枯病、白菜软腐病;有国外危害严重,国内尚未发生的检疫性病害梨火疫病和玉米枯萎病,还有在国内较普遍的泡桐丛枝病和枣疯病等【3】。但是原核生物也有着许多对人类有益的地方,比如,中国的泡菜制作,就需要利用乳酸菌来发酵。现在,已经发现越来越多的原核生物的有利之处。例如,近年来的研究表明,致突变、致畸和致癌这三者之间具有较强的相关性,即多数的致癌物就是细菌诱变剂,而且通常的致畸剂量就可引起致突变,加之各种环境因子对原核生物的致突变作用与它对哺乳动物的潜在致癌作用有关【4】,原核生物rRNA在分子生物学研究中也得到了越来越广泛的应用【5】,对冰河消退时土壤微生物碳含苗的研究表明,微生物生物量与冰河峰面消退程度和植被盖度均呈正相关【6】。总的说来,原核生物对人类的利大于弊。 目前全球已描述的已描述的原核微生物种数约7000种,许多原核生物所生存的环境,一般生物都无法生存。位于中国西南边陲的腾冲的大滚锅(DGG)和龙陵的大沸泉(DFQ)相距约70km,两泉泉水出口温度均在96℃左右,据研究又如细菌和古茵在腾冲的大滚锅(DGG)和龙陵的大沸泉(DFQ)2个高温热泉中均有一定数量的存在【7】。 2.原核微生物的多样性 不同人对原核生物多样性的定义不一。根据世界自然保护联盟(1UCN)提出的定义,原核微生物的生物多样性包括所有原核微生物的生命形式、生态系统和生态过程以及有关在遗传、分类和生态系统水平上的知识概念【8】。而 Watve等则认为,微生物多样性可细致划分为生活环境多样性、生长繁殖速度多样性、营养和代谢类型多样性、生活方式多样性、基因多样性和微生物资源开发利用多样性等【9】。微生物多样性的分析主要集中在土壤、海洋和地表水【10】,本文主要探讨原核生物的生态多样性、代谢多样性和遗传多样性。
